JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Photoactivatable 태그 갇힌된 분자 접착제를 사용 하 여 살아있는 세포에서 핵 전 좌 spatiotemporally 제어
요약
이 프로토콜에 갇힌된 분자 접착제 태그를 사용 하 여 살아있는 세포에서 핵 전 좌를 빛 트리거 설명 합니다. 이 방법은 사이트 선택적 핵 타겟팅 약물 전달에 대 한 약속입니다.
초록
세포 핵 하나 가장 중요 한 세포의 subcellular 마약 배달 대상으로 유전자 복제의 이후 이며 식 다양 한 질병 치료에 효과적입니다. 여기, 우리를 사용 하 여 고객님의 핵 전 좌 빛 트리거 갇힌 분자 접착제 (갇힌접착제-R) 태그, 그 여러 guanidinium 이온 (+번) 펜 던 트 (낙 산 염 대신 음이온 photocleavable 그룹에 의해 보호 됩니다 설명 nitroveratryloxycarbonyl; 바 NVOC)입니다. 우리에 갇힌접착제-R 태그로 손님을 생활 고려 통해 endocytosis 세포 및 endosomes. 그러나, photoirradiation, 시 우리에 갇힌접착제-R uncaged 분자 접착제 (Uncaged접착제-R) 여러 번+ 펜 던 트를 들고 endosomal 탈출 및 손님 들의 후속 핵 전 좌 용이로 변환 됩니다. 이 방법은 사이트 선택적 핵 타겟팅 약물 전달에 대 한 약속 때문에 태그 손님 세포질 세포 핵 다음으로 마이그레이션할 수 있습니다 경우에만 photoirradiated. 갇힌 접착제-R 태그는 작은 분자 손님 뿐만 아니라 고분자 손님 양자 점 (QDs) 등을 제공할 수 있습니다. 갇힌 접착제-R 태그는 자외선 뿐만 아니라 조직에 깊이 침투 수 2 광자 근처-적외선 (NIR) 빛으로 갇힌 수입니다.
서문
유전 정보를 전달, 세포 핵 하나 가장 중요 한 세포의 subcellular 마약 배달 대상으로 유전자 복제의 이후 이며 식 암 등 다양 한 질병 치료에 효과적 이며 유전 장애1,2,3. 약물의 핵 전달, 펩 티 드의 활용 태그 같은 핵 지 방화 신호 (NLS)4,,56 광범위 하 게 조사 되었습니다. 그러나, 원치 않는 부작용을 줄이기 위해 핵 전 좌의 spatiotemporal 제어 필요 하다.
이전, 빛-트리거 전 좌 단백질의 세포 핵에 갇힌된 NLS7,,89를 사용 하 여 달성 되었습니다. NLS 세포질 수송 단백질6에 바인딩하여 세포 핵으로 마이그레이션합니다. 보고 방법에 갇힌된 NLS 베어링 이용 단백질 직접 microinjection8 세포질에 통합 또는 유전자 코드 확장 기법9를 사용 하 여 대상 셀에 표현. 따라서, 세포질 통풍 관 및 사진 유도 핵 전 좌를 얻을 수 있는 방법을 실용적인 응용 프로그램에 대 한 유리 하다.
여기, 우리 수지상 갇힌된 분자 접착제 (우리에 갇힌접착제-R, 그림 1) 태그를 사용 하 여 살아있는 세포에서 핵 전 좌 빛 트리거 설명 합니다. 수용 성 분자 접착제10,11,12,13,14,15,16,,1718 , 19 , 20 , 21 , 22 , 23 여러 번+ 펜 던 트 베어링 이전 개발 되었습니다는 단단히 단백질11,12,13,,1415, 준수 16,17, 핵 산18,,1920, 인지질 막21및 찰 흙 nanosheets22,23 통해는 그들의 구+ 펜 던 트 및 대상에 oxyanionic 그룹 사이의 여러 염 다리의 형성. 우리에 갇힌접착제-R의 구+ 펜 던 트 음이온 photocleavable 그룹, 낙 산 염 대체 nitroveratryloxycarbonyl (BANVOC)에 의해 보호 됩니다. 우리에 갇힌접착제-R 태그로 손님을 생활 고려 통해 endocytosis 및 endosomes (그림 2)에서 세포. Photoirradiation에 바NVOC 그룹의 우리에 갇힌접착제-R는 uncaged 분자 접착제 (Uncaged접착제-R) 여러 번+ 펜 던 트를 들고 다음 태그 이용의 마이그레이션을 용이 하 게 하를 떨어뜨려합니다 에 세포질 세포 핵 (그림 2)에 의해 따라. 우리에 갇힌접착제-R 태그는 UV 또는 심각한 phototoxicity 없이 2 광자 근처-적외선 (NIR) 빛에 노출에 의해 갇힌 수입니다. 양자 점 (QDs) 및 형광 염료 (nitrobenzoxadiazole;를 사용 하 여 우리에 갇힌접착제-R 태그, 작은 분자의 손님 뿐만 아니라 고분자 손님 spatiotemporally 제어 핵 전달 설명 NBD), 예제로 각각.
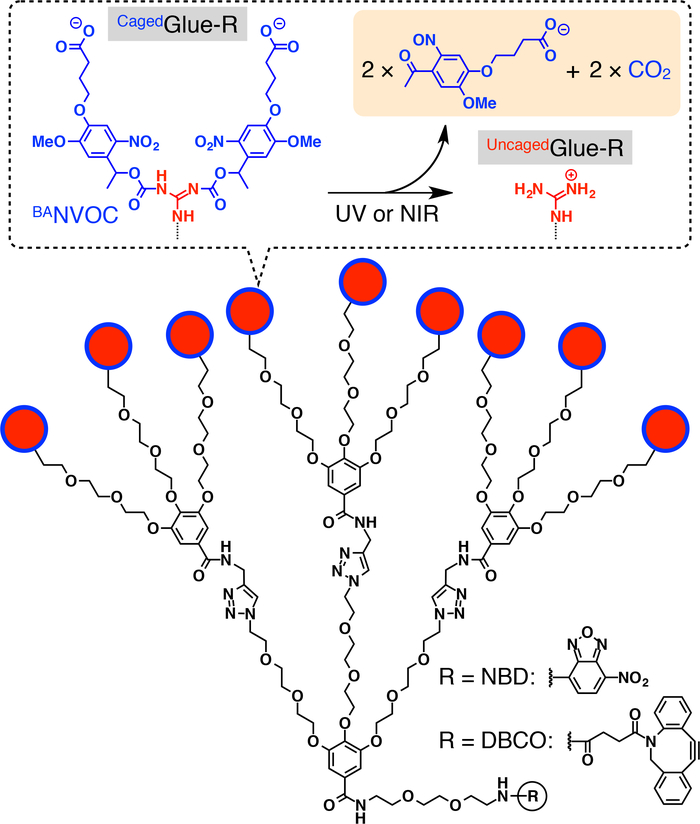
우리에 갇힌접착제-R.의 도식 구조를 그림 1: 9 guanidinium 이온 (+번) 펜 던 트 우리에 갇힌접착제-R의 낙 산 염 대체 nitroveratryloxycarbonyl (BANVOC) 그룹에 의해 보호 됩니다. BANVOC 그룹은 UV 또는 2 광자 NIR 빛 조사에 의해 죽 습. 우리에 갇힌접착제-R의 초점 핵심은 공업화 nitrobenzoxadiazole (NBD) 또는 dibenzocylooctyne (DBCO). 참조20허가 매 판. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
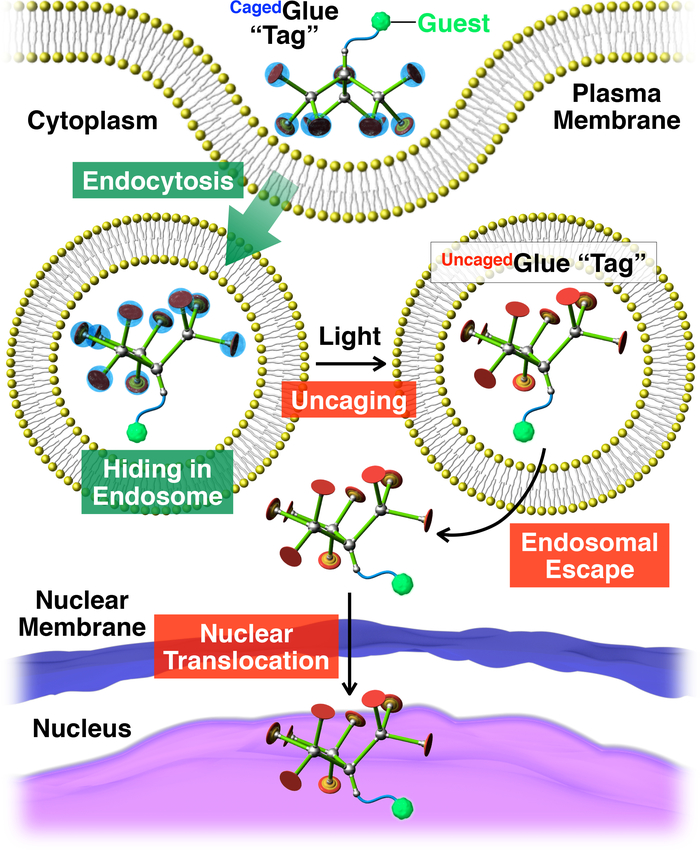
그림 2: 고객님의 핵 전 좌 빛 발생의 개요 그림 우리에 갇힌접착제-R 태그 활용. 손님이우리에 갇힌접착제-R 공액 생활으로 채택 / 셀 통해 endocytosis. Photoirradiation에 우리에 갇힌접착제-R 태그는 태그의 endosomal 탈출을 용이 하 게 수 한 Uncaged접착제-R 태그를 감 금. 그 후, 태그 이용 세포 핵으로 마이그레이션합니다. 참조20허가 매 판. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
프로토콜
1. 준비 갇힌접착제-R와 함께 고객님의 태그
- 우리에 갇힌접착제 NBD 솔루션을 준비 합니다.
- 우리에 갇힌접착제-NBD (그림 1) 다음 절차를 앞에서 설명한20음성 합성.
- 우리에 갇힌접착제-NBD (10mm) 건조 디 메 틸 sulfoxide (DMSO)에서 재고 솔루션을 준비 합니다.
참고: 어둠 속에서 재고 솔루션을 저장 합니다. 솔루션은 수성 버퍼 또는 셀 문화 미디어 사용 시 희석 수 있습니다.
- 우리에 갇힌접착제-qd는 솔루션을 준비 합니다.
- 우리에 갇힌접착제-dibenzocylooctyne (우리에 갇힌접착제-DBCO)를 합성 (그림 1)20을 설명한 이전 절차에 따라.
- 우리에 갇힌접착제-DBCO (10 mM) 건조 DMSO에의 재고 솔루션을 준비 합니다.
- 우리에 갇힌접착제-QD의 준비를 위해 먼저 아 지 드 기능성된 QDs (아 지 드-QD; 준비 그림 3)입니다. DMF의 400 µ L를 100 µ L 아 지 드-PEG4-NHS 에스테 르 (그림 3)의 디 메 틸 formamide (DMF, 125 µ M) 솔루션의 추가 (500 nM) 아민 기능성된 페그 (아민-QD; 코팅 양자 점 (QDs)의 솔루션 그림 3)입니다. 실 온에서 1 h에 대 한 혼합물을 저 어.
- 재생된 셀 룰 로스 막 3500 분자량 컷오프 (MWCO)와 함께 사용 하 여 DMF의 800 mL에 대 한 24 시간에 대 한 결과 솔루션 dialyze
- 우리에 갇힌접착제-DBCO 50 µ m와 DMF의 재고 솔루션을 희석. 포스트 투 석 해결책 (그림 3)에 솔루션의 200 µ L을 추가 하 고 실 온에서 3 h에 대 한 혼합물을 저 어.
- 재생된 셀 룰 로스 멤브레인 (25000 MWCO)를 사용 하 여 DMF의 800 mL에 대 한 24 시간에 대 한 결과 솔루션 dialyze
- 200 결과 솔루션을 희석 DMF nM.
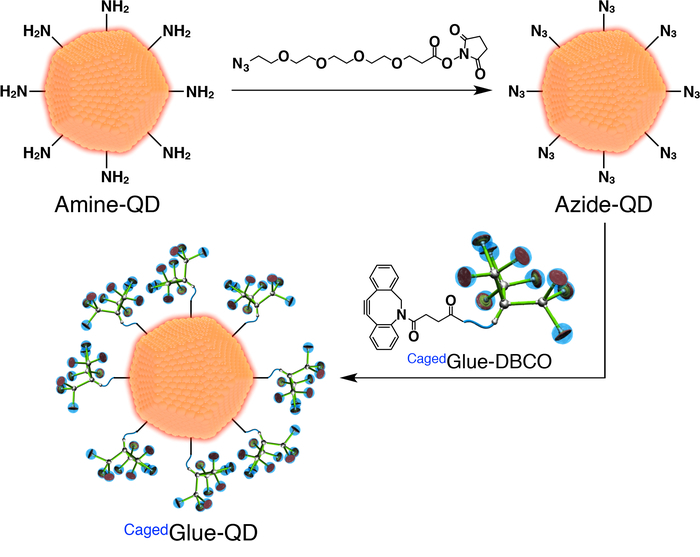
그림 3: 우리에 갇힌접착제-QD의 준비의 회로도 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
2. 현미경 관찰 Hep3B 세포 샘플의 준비
- 이 글의 최소한의 필수 매체 (EMEM) 포함 하는 10% 태아 둔감 한 혈 청 (FBS) 37 ° C에서 5% 미만에서 인간의 간세포 암 Hep3B 세포 유지 CO2.
- 씨 셀 실험 전날입니다. EMEM에 8 연 발 유리 기판의 당 씨 5.0 × 103 Hep3B 세포 (10 %FBS, 200 µ L), 37 ° C에서 5%에서 셀 샘플을 품 어 고 24 h에 대 한 CO2 .
- 문화 매체를 제거 하 고 Dulbecco의 인산 염 버퍼 식 염 수 (D-PBS)의 100 µ L로 셀 샘플을 두 번 씻어.
3. 자외선에 의해 발생 하는 작은 분자 손님의 핵 전 좌의 관찰
- 포함 하는 우리에 갇힌접착제 NBD FBS 무료 EMEM의 200 µ L로 셀 샘플 (2.3에서 준비 단계)를 공급 (10 µ M) 고 37 ° C에서 5%에서 결과 셀 샘플을 품 어 3 h의 CO2 .
참고: 셀 샘플 FBS 무료 EMEM 4 h 이상에서 부 화는 심각한 세포 손상이 발생합니다. - 문화 매체를 제거 하 고 D-PBS의 100 µ L로 셀 샘플을 두 번 씻어.
- endosomes의 시각화에 대 한 EMEM의 200 µ L로 셀 샘플을 공급 (10 %FBS) 빨간색 형광 염료를 포함 (예를 들어, LysoTracker 빨강, 100 nM), 고 37 ° C에서 결과 셀 샘플을 품 어 미만 5% CO2 20 분에 대 한 제거는 문화 매체, 그리고 린스 100 µ L D-PBS의 두 번으로 셀 샘플. EMEM의 200 µ L로 셀 샘플을 공급 (10 %FBS).
- 우리에 갇힌접착제 NBD의 핵 전 좌, UV 2 분 통해 365 nm 대역 통과 필터를 갖춘 100 W 크 세 논 광원을 사용 하 여 광섬유에 빛을 셀 샘플을 표시 합니다. UV 노출 없이 참조 셀 샘플을 어둠 속에서 셀 샘플을 계속.
참고: 유리 기판의 뚜껑 수 수 이륙 효율적인 자외선 노출에 대 한. 자외선에 장기간 노출은 세포에 세포 독성을 일으킬 수 있습니다. - 핵의 시각화에 대 한 문화 매체에 Hoechst 33342 (1 mg/mL)의 1 µ L을 추가 하 고 37 ° C에서 5%에서 결과 셀 샘플을 품 어 10 분 CO2 .
- Confocal 레이저 스캐닝 현미경 검사 법을 셀 샘플을 주제 및 488에서 여기에 현미경을 기록 nm (λobs = 500-530 nm), 543 nm (λobs = 565-620 nm), 및 710 nm (2-광자; Λ obs = 390-465 nm) NBD, 레드-형광 염료, Hoechst 33342, 각각.
4. 2 광자 NIR 빛에 의해 발생 하는 작은 분자 손님의 핵 전 좌의 관찰
- 포함 하는 우리에 갇힌접착제 NBD FBS 무료 EMEM의 200 µ L로 셀 샘플 (2.3에서 준비 단계)를 공급 (10 µ M) 고 37 ° C에서 5%에서 결과 셀 샘플을 품 어 3 h의 CO2 .
- 문화 매체를 제거 하 고 D-PBS의 100 µ L로 셀 샘플을 두 번 씻어. EMEM의 200 µ L로 셀 샘플을 공급 (10 %FBS).
- Confocal 레이저 스캐닝 현미경 검사 법을 셀 샘플을 주제로 하 고 기록 488에서 여기에 현미경 nm (λobs = 500-530 nm).
- 우리에 갇힌접착제 NBD의 핵 전 좌를 위해 비추는 2 광자 여기 레이저의 셀을 포함 하는 지역 (710 nm), 2 분 (30 s × 4) 현미경에서 광원으로 설치. 4.3 단계에서 설명한 대로 전 좌를 관찰 합니다.
5. 자외선에 의해 발생 하는 고분자 손님의 핵 전 좌의 관찰
- FBS-무료 EMEM 포함 하는 우리에 갇힌접착제-QD의 200 µ L로 셀 샘플 (2.3에서 준비 단계)를 공급 (10 nM), 고 37 ° C에서 5%에서 결과 셀 샘플을 품 어 3 h의 CO2 .
- 문화 매체를 제거 하 고 D-PBS의 100 µ L로 셀 샘플을 두 번 씻어. EMEM의 200 µ L로 셀 샘플을 공급 (10 %FBS).
- 우리에 갇힌접착제-QD의 핵 전 좌, UV 2 분 통해 365 nm 대역 통과 필터를 갖춘 100 W 크 세 논 광원을 사용 하 여 광섬유에 빛을 셀 샘플을 표시 합니다. UV 노출 없이 참조 셀 샘플을 어둠 속에서 셀 샘플을 계속.
- 핵의 시각화에 대 한 문화 매체에 Hoechst 33342 (1 mg/mL)의 1 µ L을 추가 하 고 37 ° C에서 5%에서 결과 셀 샘플을 품 어 10 분 CO2 .
- Confocal 레이저 스캐닝 현미경 검사 법을 셀 샘플을 주제로 하 고 405에서 여기에 현미경을 기록 nm (λobs = 430-520 nm) 및 488 nm (λobs = 625-680 nm) Hoechst 33342 및 QDs, 각각.
6. 세포 생존 능력 분석 실험
- EMEM에 있는 인간 간세포 암 Hep3B 세포 유지 (10 %FBS) 37 ° c 미만 5% CO2.
- 씨 셀 실험 전날입니다. EMEM에서 96 잘 문화 접시의 당 씨 5.0 × 103 Hep3B 세포 (10 %FBS, 200 µ L), 37 ° C에서 5%에서 셀 샘플을 품 어 고 24 h에 대 한 공동2 .
- 문화 매체를 제거 하 고 D-PBS의 100 µ L로 셀 샘플을 두 번 씻어.
- 우리에 갇힌접착제 NBD를 포함 하는 FBS 무료 EMEM의 200 µ L로 셀 샘플을 공급 (0.1-100 µ M)와 37 ° C에서 5%에서 결과 셀 샘플을 품 어 3 h의 CO2 .
- 노출 셀 샘플을 통해 2 분에 대 한 자외선 365 nm 대역 통과 필터를 갖춘 100 W 크 세 논 광원을 사용 하 여 광섬유. UV 노출 없이 유사한 셀 샘플, 어둠 속에서 셀 샘플을 계속.
- 문화 매체에 셀 계산 키트-8 시 (10 µ L)의 10 µ L을 추가 하 고 37 ° C에서 5%에서 결과 셀 샘플을 품 어 2 h의 CO2 .
- 흡수 분광학을 세포 샘플 제목 (λ = 450 nm) microplate 리더를 사용 하 여.
결과
Photoirradiation, 전에 우리에 갇힌접착제 NBD와 incubated Hep3B 세포 전시 그들의 내부에서 punctate 형광 방출 (λext = 488 nm; 그림 4A 고 4 C, 녹색). 유사한 현미경 사진 543에서 여기에 얻은 우리에 갇힌접착제 NBD는 endosomes에 지역화 나타내는 빨간색 형광 염료 (그림 4B , 4c, 빨간색)에 대 한 ...
토론
빛-트리거 전 좌 단백질의 세포 핵으로의 이전 조사 갇힌된 NLS7,,89를 사용 하 여 달성 되었습니다. 앞에서 설명 했 듯이, 이러한 방법을 세포질에 NLS 태그 단백질 통합을 추가 기술 해야 합니다. 반면, 우리의 우리에 갇힌접착제-R 태그 사진 유도 핵 전 좌 뿐만 아니라 손님 들의 세포질 통풍 관을 수 있습니다. 이 우?...
공개
저자는 공개 없다.
감사의 말
우리는 NanoBio 통합, 도쿄의 대학에 대 한 중심을 인정합니다. 이 작품은 특정 여 대 한 젊은 과학자 (B) (26810046)를 ko로 부분적으로에서 및 지원 특정 특별히 승진 연구 (25000005)에 대 한 T.A. R.M. 덕분에 일본 사회 연구 장학 과학 (JSP의 승진에 대 한 ) 젊은 과학자와 최고의 대학원 (GPLLI) 프로그램에 대 한.
자료
| Name | Company | Catalog Number | Comments |
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
참고문헌
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유