Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Spatiotemporally контролируемых ядерных транслокации гостей в живых клеток с помощью клетке молекулярный клей как Photoactivatable Теги
В этой статье
Резюме
Этот протокол описывает свет срабатывает ядерной транслокации гостей в живых клеток с помощью тегов клетке молекулярный клей. Этот метод является перспективным для сайта селективные таргетинг доставки лекарств.
Аннотация
Клеточное ядро является одним из наиболее важных органеллы как цель субцеллюлярные доставки лекарств, после модуляции гена репликации и выражение является эффективным для лечения различных заболеваний. Здесь мы демонстрируем, что свет срабатывает ядерной транслокации гостей с помощью клетке Теги молекулярный клей (Cagedклей-R), анионные photocleavable группой (бутират замещенных защищены которого несколько подвески Ион (ГУ+) Гуанидиновые nitroveratryloxycarbonyl; Ба NVOC). Гости, отмеченных Cagedклей-R учитываются живых клеток через эндоцитоза и остаются в endosomes. Однако после хлорином, Cagedклей-R преобразуется в отключенную молекулярный клей (Uncagedклей-R) проведение нескольких ГУ+ подвески, которая облегчает побег от англ и последующих ядерных транслокации гостей. Этот метод является перспективным для доставки лекарств сайт селективные таргетинг, поскольку тегами гости могут мигрировать в цитоплазме, следуют клеточного ядра только при photoirradiated. В клетке Клей-R Теги могут доставить макромолекулярных гостей, таких как квантовых точек (QDs) а также мелкомолекулярных гостей. В клетке Клей-R Теги могут быть отключенную с не только УФ-излучения, но и двух Фотон ближней ИК-области спектра (NIR) света, который может глубоко проникают в ткани.
Введение
Клеточное ядро, которое несет генетическую информацию, является одним из наиболее важных органеллы как цель субцеллюлярные доставки лекарств, с модуляции гена репликации и выражение является эффективным для лечения различных заболеваний, включая рак и генетических расстройства,1,2,3. Для доставки ядерного оружия, наркотиков спряжение пептида теги, такие, как широко исследована ядерной локализации сигналов (NLS)4,5,6 . Однако для того чтобы уменьшить нежелательные побочные эффекты, пространственно-временных контроль ядерных транслокации является необходимым.
Ранее был достигнут свет срабатывает транслокации белка в ядре клетки, с помощью NLS клетке7,8,9. NLS мигрирует в ядре клетки путем связывания белков цитоплазматического транспорта6. В сообщаемых методов гость белки, принимая клетке NLS непосредственно включены в цитоплазме микроинъекции8 или выраженные в целевой ячейки, используя метод расширения генетического кода9. Таким образом метод, который можно достичь клеточного поглощения и фото индуцированной ядерной транслокации выгодно для практического применения.
Здесь мы описываем свет срабатывает ядерной транслокации гостей в живых клеток с помощью тегов дендритных клетках молекулярный клей (Cagedклей-R, рис. 1). Водорастворимые клеи молекулярной10,11,12,13,14,,1516,17,18 , 19 , 20 , 21 , 22 , 23 , принимая несколько ГУ+ подвески ранее разработаны, который жестко придерживаться белков11,12,13,14,15, 16,17, нуклеиновые кислоты18,19,20, фосфолипидов мембран21и глины nanosheets22,23 через формирование нескольких соли мостов между их подвески ГУ+ и oxyanionic группами на цели. ГУ+ подвески Cagedклей-R защищены анионные photocleavable группой, бутират замещенных nitroveratryloxycarbonyl (BANVOC). Гости, отмеченных Cagedклей-R учитываются живых клеток через эндоцитоза и пребывания в endosomes (рис. 2). После хлорином БаNVOC групп Cagedклей-R отсоединены приносить отключенную молекулярный клей (Uncagedклей-R) перевозящих несколько ГУ+ подвески, которая затем способствует миграции тегами гостя в цитоплазме, следуют клеточного ядра (рис. 2). Cagedклей-R тег может быть отключенную под воздействием УФ или два Фотон ближней ИК-области спектра (NIR) света без серьезных Фототоксичность. Мы демонстрируем spatiotemporally контролируемых ядерных поставок макромолекулярных гостей, а также мелкомолекулярных гостей с Cagedклей-R теги, использование квантовых точек (QDs) и флуоресцентные краски (nitrobenzoxadiazole; NBD), соответственно, в качестве примеров.
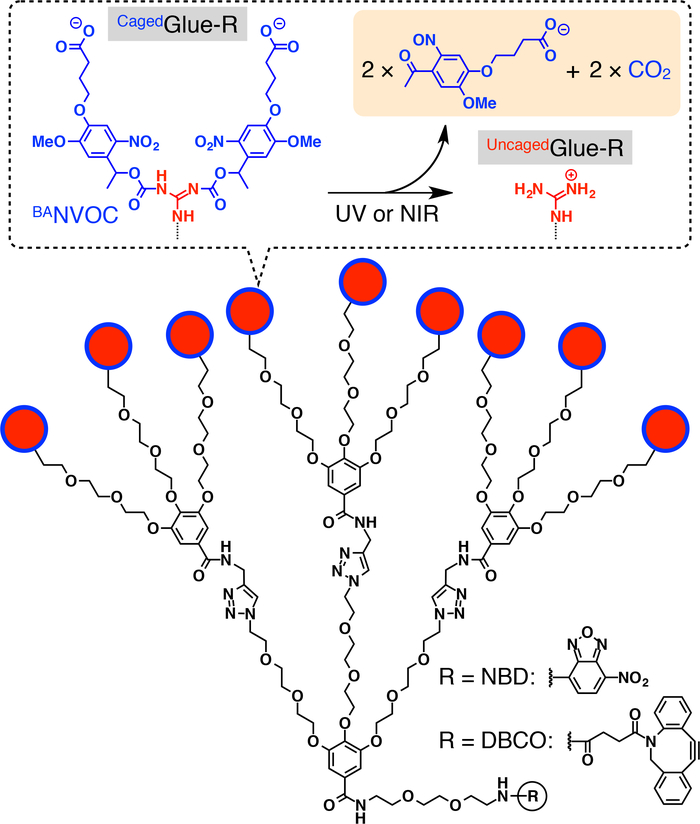
Рисунок 1: Схема структуры Cagedклей-р. 9 Гуанидиновые Ион (ГУ+) подвески Cagedклей-r защищены группой бутират замещенных nitroveratryloxycarbonyl (BANVOC). Группы NVOC Барасщепляется при облучении УФ или два Фотон NIR света. Суть фокуса Cagedклей-R функционализированных с nitrobenzoxadiazole (NBD) или dibenzocylooctyne (DBCO). Перепечатано с разрешения ссылки20. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
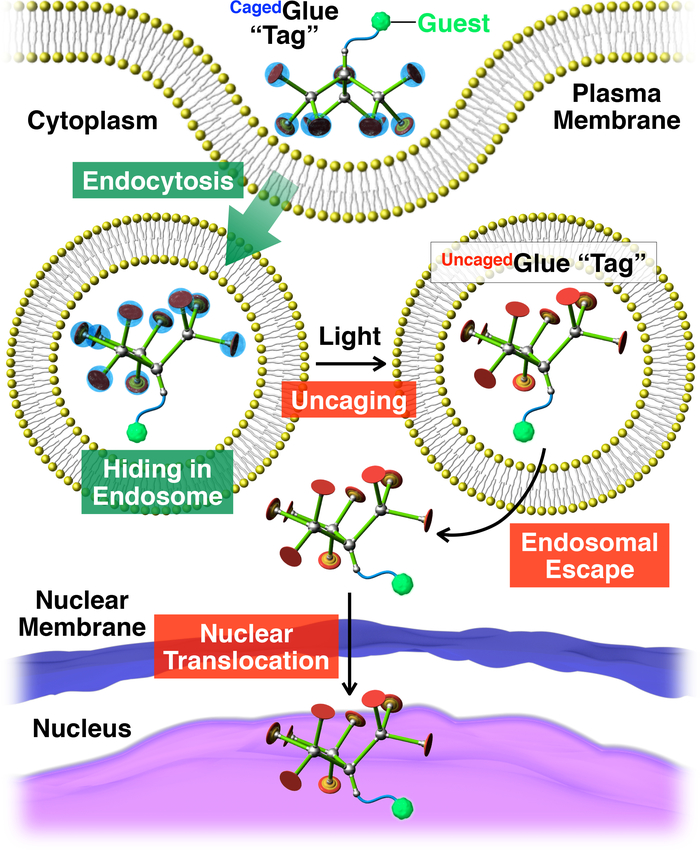
Рисунок 2: Схематическое изображение света срабатывает ядерной транслокации гостей конъюгированных с тегом клей-R Caged. Гость /Cagedклей-R конъюгата учитывается живых клеток через эндоцитоз. После хлорином клей-R тег Cagedотключенную приносить тег клей-R Uncaged, который может облегчить побег от англ тегами гостя. Впоследствии помеченный гость мигрирует в ядре клетки. Перепечатано с разрешения ссылки20. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
1. Подготовка гостей с клеткеклей R Теги
- Готовят раствор клея-NBD Caged.
- Синтезировать Cagedклей-NBD (рис. 1) после ранее описанные процедуры20.
- Подготовьте Стоковый раствор Cagedклей-NBD (10 мм) в сухом диметилсульфоксида (ДМСО).
Примечание: Стоковый раствор Храните в темноте. Решение может быть разбавлен с водной буферов или носителей культуры клеток после использования.
- Готовят раствор клея-QD Caged.
- Синтезировать Cagedклей dibenzocylooctyne (Cagedклей-DBCO) (рис. 1) после процедур ранее описанных20.
- Подготовьте Стоковый раствор Cagedклей-DBCO (10 мм) в сухом ДМСО.
- Для подготовки Cagedклей-QD сначала Подготовьте азид функционализированных QDs (азид-QD; Рисунок 3). Добавить 100 мкл раствора формамид (DMF, 125 мкм) диметилового эфира азид PEG4-NHS (рис. 3) 400 мкл DMF (500 Нм) раствор квантовых точек (QDs) покрытием с Амин функционализированных ПЭГ (Амин-QD; Рисунок 3). Перемешайте смесь за 1 ч при комнатной температуре.
- Dialyze полученный раствор для 24 h против 800 мл ДМФ с помощью мембраны регенерированной целлюлозы с 3500 молекулярный вес производства (MWCO).
- Разбавьте Стоковый раствор Cagedклей-DBCO до 50 мкм с ДМФ. Добавить 200 мкл раствора в решение после диализа (рис. 3) и перемешать смесь для 3 ч при комнатной температуре.
- Dialyze полученный раствор для 24 h против 800 мл ДМФ с помощью мембраны регенерированной целлюлозы (25000 MWCO).
- Разбавить полученный раствор до 200 нанометр с ДМФ.
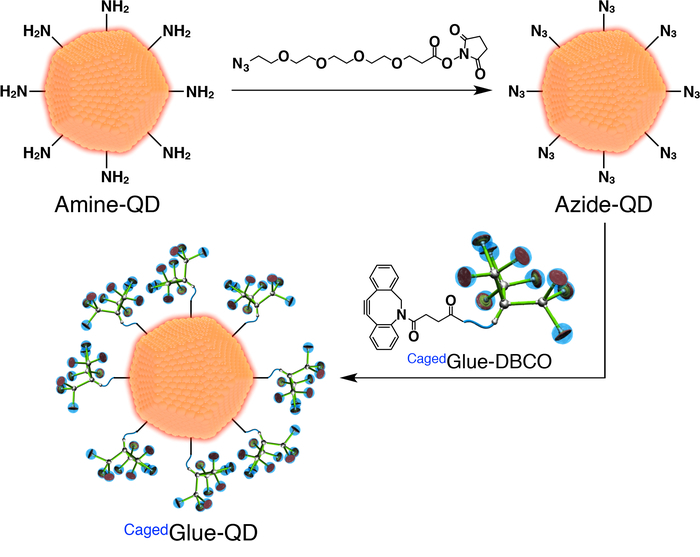
Рисунок 3: схематическая иллюстрация подготовки Cagedклей-QD. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
2. Подготовка Hep3B ячейки выборки микроскопические наблюдения
- Поддерживать человека гепатоцеллюлярной карциномы Hep3B клетки в минимальные основные средне орла (EMEM) содержащий 10% плода бычьим сывороточным (ФБС) при 37 ° C под 5% CO2.
- Семя клетки за день до эксперимента. Семя 5.0 × 103 Hep3B клеток на хорошо 8-камерная стекла субстрата в EMEM (10% FBS, 200 мкл) и инкубировать образец клеток при 37 ° C под 5% CO2 на 24 часа.
- Удалите средство культуры и промойте образец клеток с 100 мкл Дульбекко фосфатный буфер (D-PBS) дважды.
3. наблюдение за ядерной транслокации мелкомолекулярных гостей, вызванные УФ света
- Поставка образец клеток (подготовленные в шаге 2.3) с 200 мкл FBS бесплатно ЕМЕМ, содержащие Cagedклей-NBD (10 мкм) и инкубировать полученный образец клеток при 37 ° C под 5% CO2 на 3 ч.
Примечание: Инкубационный ячейки выборки в FBS бесплатно EMEM более 4 ч вызывает серьезные повреждения. - Удалите средство культуры и промойте образец клеток с 100 мкл D-PBS дважды.
- Для визуализации endosomes, предоставить образец клеток с 200 мкл EMEM (10% FBS) содержащий красный флуоресцентные краски (например, красный LysoTracker, 100 Нм), и инкубировать полученный образец клеток при 37 ° C и под 5% CO2 на 20 мин удалить культуры Средний и промыть образец клеток с 100 мкл D-PBS дважды. Поставка образец клеток с 200 мкл EMEM (10% FBS).
- Для ядерной транслокации Cagedклей-НБД предоставлять образец клеток УФ света для 2 мин через оптическое волокно с помощью источника света ксенон 100-W, оснащены 365 Нм полосовой фильтр. Для эталонного образца клеток без УФ-облучения Держите образец клеток в темноте.
Примечание: Крышки стеклянные подложки может быть снята для эффективного воздействия УФ. Долгое время воздействие ультрафиолета может вызвать цитотоксичность клеток. - Для визуализации ядер, 1 мкл Hoechst 33342 (1 мг/мл) в среде культуры и инкубировать полученный образец клеток при 37 ° C под 5% CO2 за 10 мин.
- При условии образец клеток Конфокальная лазерная сканирующая микроскопия и записывать микроскопии после возбуждения на 488 нм (λobs = 500-530 Нм), 543 Нм (λobs = 565-620 Нм) и 710 Нм (два Фотон; Λ OBS = 390-465 Нм) для НБД, красный флуоресцентные краски и Hoechst 33342, соответственно.
4. наблюдение за ядерной транслокации мелкомолекулярных гостей, вызванных NIR двух Фотон света
- Поставка образец клеток (подготовленные в шаге 2.3) с 200 мкл FBS бесплатно ЕМЕМ, содержащие Cagedклей-NBD (10 мкм) и инкубировать полученный образец клеток при 37 ° C под 5% CO2 на 3 ч.
- Удалите средство культуры и промойте образец клеток с 100 мкл D-PBS дважды. Поставка образец клеток с 200 мкл EMEM (10% FBS).
- При условии образец клеток Конфокальная лазерная сканирующая микроскопия и записывать микроскопии после возбуждения на 488 нм (obs λ= 500-530 Нм).
- Для ядерной транслокации Cagedклей-НБД, облучать региона, включая клетки интерес с двух Фотон возбуждения лазер (710 Нм), установлен в качестве источника света в Микроскоп, 2 мин (30 s × 4). Наблюдать за транслокации, как описано в шаге 4.3.
5. наблюдение за ядерной транслокации макромолекулярных гостей, вызванные УФ света
- Поставка (подготовленные в шаге 2.3) образец клеток с 200 мкл FBS бесплатно ЕМЕМ, содержащие Cagedклей-QD (10 Нм) и инкубировать полученный образец клеток при 37 ° C под 5% CO2 на 3 ч.
- Удалите средство культуры и промойте образец клеток с 100 мкл D-PBS дважды. Поставка образец клеток с 200 мкл EMEM (10% FBS).
- Для ядерной транслокации Cagedклей-QD предоставлять образец клеток УФ света для 2 мин через оптическое волокно с помощью источника света ксенон 100-W, оснащены 365 Нм полосовой фильтр. Для эталонного образца клеток без УФ-облучения Держите образец клеток в темноте.
- Для визуализации ядер, 1 мкл Hoechst 33342 (1 мг/мл) в среде культуры и инкубировать полученный образец клеток при 37 ° C под 5% CO2 за 10 мин.
- При условии образец клеток Конфокальная лазерная сканирующая микроскопия и записывать микроскопии после возбуждения в 405 нм (λobs = 430-520 Нм) и 488 нм (λobs = 625-680 нм) для Hoechst 33342 и QDs, соответственно.
6. ячейки жизнеспособности Assay
- Поддерживать человека гепатоцеллюлярной карциномы Hep3B клетки в EMEM (10% FBS) при 37 ° C под 5% CO2.
- Семя клетки за день до эксперимента. Семя 5.0 × 103 Hep3B клеток на хорошо 96-луночных культуры плиты в EMEM (10% FBS, 200 мкл) и инкубировать образец клеток при 37 ° C под 5% CO2 на 24 часа.
- Удалите средство культуры и промойте образец клеток с 100 мкл D-PBS дважды.
- Поставка образец клеток с 200 мкл FBS бесплатно ЕМЕМ, содержащие Cagedклей-NBD (0,1-100 мкм) и инкубировать полученный образец клеток при 37 ° C под 5% CO2 на 3 ч.
- Предоставлять образец клеток УФ света для 2 мин через оптическое волокно с помощью источника света ксенон 100-W, оснащены 365 Нм полосовой фильтр. Для аналогичных ячейки выборки без УФ-облучения Держите образец клеток в темноте.
- Добавить 10 мкл реагента (10 мкл) клеток подсчета Kit-8 питательной среды и инкубировать полученный образец клеток при 37 ° C под 5% CO2 на 2 ч.
- При условии образец клеток абсорбционной спектроскопии (λ = 450 Нм) с использованием Считыватель микропланшетов.
Результаты
Перед хлорином, Hep3B клетки инкубировали с Cagedклей-NBD выставлены пунктата флуоресценции выбросов от их интерьер (λext = 488 нм; 4A цифры и 4 C, зеленый). Аналогичных Микрофотография был получен после возбуждения в 543 Нм для красно Люминесцентн?...
Обсуждение
Предыдущие исследования-срабатывает транслокации белка в ядре клетки были достигнуты с помощью NLS клетке7,8,9. Как упоминалось ранее, эти методы требуют дополнительных методов включения NLS-тегами белков в цитоплазме. В противоположност?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы признаем центр для NanoBio интеграции, Университет Токио. Эта работа была поддерживается за счет целевых субсидий для молодых ученых (B) (26810046) К.О и частично поддерживается субсидий специально поощрять исследований (25000005) т.а. R.M. Спасибо исследовательские стипендии Японии общества для поощрения науки (JSP ) для молодых ученых и программы для ведущих выпускник школ (GPLLI).
Материалы
| Name | Company | Catalog Number | Comments |
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
Ссылки
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены