A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Spatiotemporally מבוקר גרעיני טרנסלוקציה של האורחים בתאים חיים באמצעות דבקים מולקולרית בכלובים כמו Photoactivatable תגיות
In This Article
Summary
פרוטוקול זה מתאר מבוססות אור רוברטסונית הגרעין של האורחים בתאים חיים באמצעות תגי דבק מולקולרית בכלובים. שיטה זו היא מבטיחה עבור משלוח סמים פילוח גרעיני האתר סלקטיבית.
Abstract
גרעין התא הוא אחד organelles החשובים ביותר כמטרה סמים subcellular-מסירה, מאז אפנון של שכפול גנטי, הביטוי הוא יעיל לטיפול במחלות שונות. . הנה, נדגים מבוססות אור רוברטסונית הגרעין של האורחים שימוש בכלוב תגיות דבק מולקולרית (בכלובדבק-R), תליונים יון (ג. א.+) מרובות של מי guanidinium מוגנים על-ידי קבוצת anionic photocleavable (butyrate-שהוחלפו nitroveratryloxycarbonyl; BA NVOC). האורחים המתויגת כלואהדבק-R נלקחים לתוך החיים תאים באמצעות אנדוציטוזה וישארו endosomes. עם זאת, בעת photoirradiation, כלואהדבק-R מומר שברחה מכלוב מולקולרית דבק (Uncagedדבק-R) תליונים גו+ מרובים, נושאת המאפשרת את הבריחה endosomal ואת רוברטסונית גרעיני עוקבות של האורחים. בשיטה זו הוא מבטיח למסירה אתר סלקטיבית הגרעיני פילוח סמים, מאז מתויג האורחים יכולים להעביר לתוך הציטופלסמה ואחריו גרעין התא רק כאשר photoirradiated. בכלוב דבק-R תגיות יכול לספק לאורחים macromolecular כגון נקודות קוונטיות (QDs) כמו גם האורחים מולקולה קטנה. בכלוב תגיות דבק-R ניתן שברחה מכלוב עם לא רק אור UV, אלא גם שני הפוטונים-סגול (ניר) אור, אשר יכול לחדור עמוק לתוך רקמות.
Introduction
גרעין התא, אשר נושאת מידע גנטי, הוא אחד organelles החשובים ביותר כמטרה סמים subcellular-מסירה, מאז אפנון של שכפול גנטי, הביטוי הוא יעיל לטיפול במחלות שונות, כולל סרטן ותעשיה והפרעות1,2,3. למסירה הגרעין של סמים, ההטיה של פפטיד תיוג כגון גרעיני לוקליזציה אותות (שקל)4,5,6 נחקר באופן נרחב. אולם, על מנת להפחית תופעות לוואי לא רצויות, ייתכן השליטה רוברטסונית גרעיני הוא הכרחי.
בעבר, מבוססות אור טרנסלוקציה של חלבונים לתוך גרעין התא הושגה באמצעות בכלובים NLS7,8,9. NLS נודד אל תוך גרעין התא על-ידי איגוד התחבורה cytoplasmic חלבונים6. בשיטות שדווחה, חלבונים חוות הנושאת NLS בכלובים ישירות שולבו הציטופלסמה מאת microinjection8 או לידי ביטוי תאי היעד באמצעות טכניקה הרחבה9הקוד הגנטי. לכן, שיטה להשגת ספיגת הסלולר והן צילום-induced רוברטסונית גרעינית היא יתרון עבור יישומים מעשיים.
במסמך זה, אנו מתארים מבוססות אור רוברטסונית הגרעין של האורחים בתאים חיים באמצעות תגי דנדריטים דבק מולקולרית בכלובים (כלואהדבק-R, איור 1). דבקים מולקולרית מסיסים במים10,11,12,13,14,15,16,17,18 , 19 , 20 , 21 , 22 , 23 הנושאת תליונים גו+ מרובים בעבר פותחו, אשר באופן הדוק לדבוק חלבונים11,12,13,14,15, 16,17, חומצות גרעין18,19,20, פוספוליפיד ממברנות21, ו קליי nanosheets22,23 דרך היווצרות גשרים מלח מרובים בין תליונים גו+ oxyanionic קבוצות על המטרות. ג. א.+ תליונים של כלואהדבק-R מוגנים על-ידי קבוצת anionic photocleavable, nitroveratryloxycarbonyl butyrate שהוחלפו (BANVOC). האורחים המתויגת כלואהדבק-R נלקחים לתוך החיים תאים באמצעות אנדוציטוזה והישאר ב- endosomes (איור 2). על photoirradiation, קבוצות NVOC BA כלואהדבק-R מנותקים להניב תשואה של שברחה מכלוב מולקולרית דבק (Uncagedדבק-R) תליונים גו+ מרובים, נושאת המאפשרת ואז ההעברה של האורח מתויג לתוך הציטופלסמה ואחריו גרעין התא (איור 2). התג דבק-R כלואהניתן שברחה מכלוב על ידי חשיפה UV או שני הפוטונים-סגול (ניר) אור בלי phototoxicity רצינית. נדגים את המשלוח גרעיני מבוקר spatiotemporally של האורחים macromolecular, כמו גם מולקולה קטנה לאורחים תגים דבק-R כלואה, באמצעות נקודות קוונטיות (QDs) של הפלורסנט (nitrobenzoxadiazole; להארכה), בהתאמה, כדוגמאות.
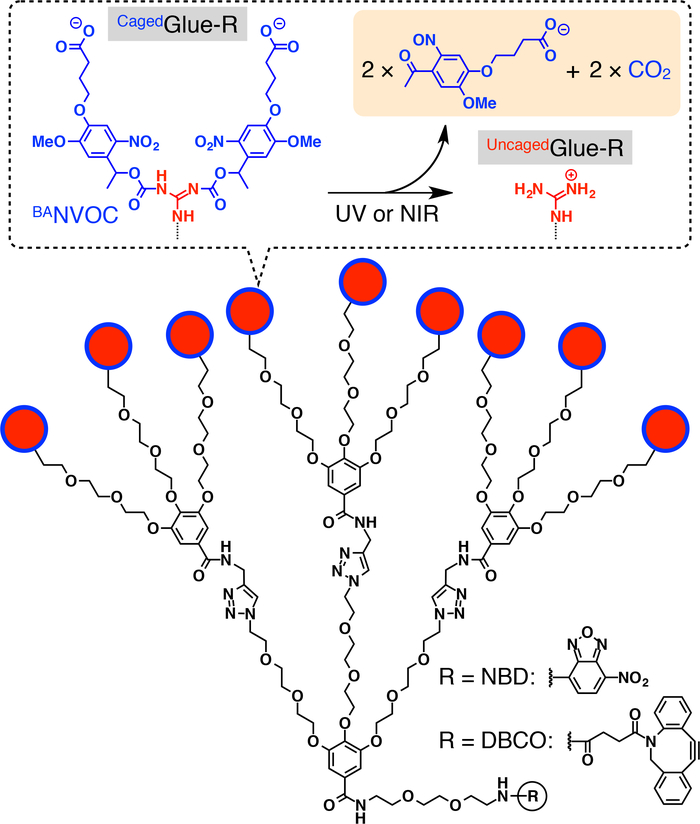
איור 1: מבנה סכמטי של כלואהדבק-R. תליונים יון (ג. א.+) guanidinium 9 של כלואהדבק-R מוגן על ידי קבוצת nitroveratryloxycarbonyl butyrate שהוחלפו (BANVOC). הקבוצות NVOC BAהם ביקע על ידי הקרנה UV או אור ניר שני הפוטונים. ליבת מוקד כלואהדבק-R הוא functionalized עם nitrobenzoxadiazole (להארכה) או dibenzocylooctyne (DBCO). הודפס מחדש באישור הפניה20. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
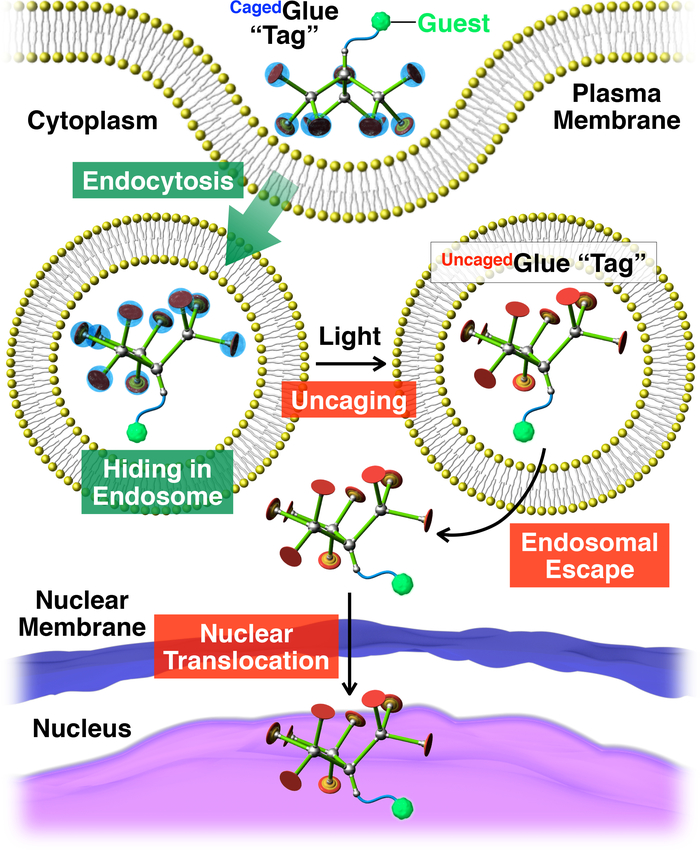
איור 2: איור סכמטי של מבוססות אור רוברטסונית הגרעין של האורחים מצומדת עם תג דבק-R כלואה. האורח /כלואהדבק-R המספר המשלים הוא נלקח לתוך החיים תאים באמצעות אנדוציטוזה. בעת photoirradiation, התג דבק-R כלואההינם שברחה מכלוב להניב תג דבק-R Uncaged, דבר היכול להקל על הבריחה endosomal של האורח מתויגות. לאחר מכן, האורח מתויג נודד אל תוך גרעין התא. הודפס מחדש באישור הפניה20. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Protocol
1. הכנת לאורחים עם דבק-R בכלובתגי
- להכין פתרון דבק-להארכה כלואה.
- לסנתז כלואהדבק-להארכה (איור 1) בעקבות הליכים שתואר לעיל20.
- להכין פתרון מניות של כלואהדבק-להארכה (10 מ מ) ביבש דימתיל סולפוקסיד (דימתיל סולפוקסיד).
הערה: אחסן את הפתרון מניות בחושך. הפתרון יכול להיות מדולל עם מאגרי מימית או תא תרבות המדיה בעת השימוש.
- להכין פתרון דבק-QD כלואה.
- לסנתז כלואהדבק-dibenzocylooctyne (כלואהדבק-DBCO) (איור 1) ביצוע הפרוצדורות בעבר תיאר20.
- להכין פתרון מניות של כלואהדבק-DBCO (10 מ מ) ב דימתיל סולפוקסיד יבש.
- עבור הכנת דבק כלואה-QD, להכין תחילה QDs אזיד-functionalized (אזיד-QD; איור 3). להוסיף 100 µL של דימתיל formamide (DMF, 125 µM) פתרון של אזיד-PEG4-NHS אסתר (איור 3) µL 400 של DMF (500 ננומטר) פתרון של נקודות קוונטיות (QDs) מצופה פג functionalized-אמין (Amine-QD; איור 3). מערבבים את התערובת לשעה בטמפרטורת החדר.
- Dialyze הפתרון שיתקבל עבור 24 שעות מול 800 מיליליטר DMF באמצעות קרום תאית מחדש עם משקל מולקולרי 3,500 ניתוק (MWCO).
- לדלל את הפתרון מניות של כלואהדבק-DBCO 50 מיקרומטר עם DMF. להוסיף 200 µL של הפתרון הפתרון שלאחר דיאליזה (איור 3) ומערבבים את התערובת במשך 3 שעות בטמפרטורת החדר.
- Dialyze הפתרון שיתקבל עבור 24 שעות מול 800 מיליליטר DMF באמצעות קרום regenerated תאית (25,000 MWCO).
- לדלל הפתרון שיתקבל ל-200 nM עם DMF.
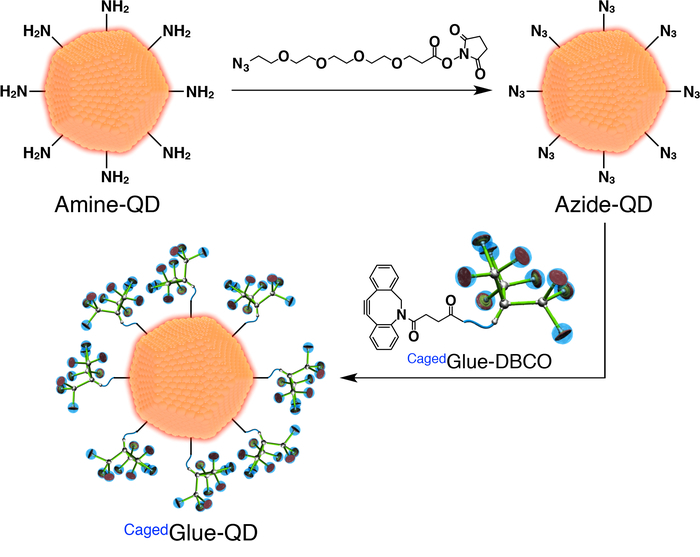
איור 3: איור סכמטי של הכנת דבק כלואה-QD. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
2. הכנה של דגימות התאים Hep3B תצפיות מיקרוסקופיות
- לשמור על hepatocellular האנושי תאי קרצינומה Hep3B של הנשר מינימלית חיונית בינוני (EMEM) המכיל 10% סרום שור עוברית (FBS) ב 37 מעלות צלזיוס מתחת 5% CO2.
- הזרע התאים יום לפני הניסוי. תאי זרע 5.0 × 103 Hep3B טוב של המצע זכוכית תאיים 8 ב- EMEM (10% FBS, 200 µL), דגירה המדגם תא ב 37 מעלות צלזיוס מתחת 5% CO2 עבור 24 שעות.
- להסיר את המדיום תרבות ולשטוף את דגימת תאים עם 100 µL של Dulbecco של המאגר פוספט תמיסת מלח (D-PBS) פעמיים.
3. תצפית של טרנסלוקציה הגרעין של מולקולה קטנה האורחים מופעלות על ידי אור UV
- לספק את הדגימה תא (שלב מוכן ב- 2.3) עם 200 µL של EMEM נטולת FBS המכיל כלואהדבק-להארכה (10 מיקרומטר) דגירה המדגם התא שנוצר ב 37 מעלות צלזיוס מתחת 5% CO2 ב-3 שעות.
הערה: דגירה של המדגם תא ב EMEM FBS ללא יותר מ 4 שעות גורמת נזק רציני. - להסיר את המדיום תרבות ולשטוף את דגימת תאים עם 100 µL של D-PBS פעמיים.
- עבור ויזואליזציה של endosomes, לספק את דגימת תאים עם 200 µL של EMEM (10% FBS) המכיל צבע אדום-פלורסנט (למשל, LysoTracker אדום, 100 ננומטר), דגירה המדגם התא שנוצר ב 37 מעלות צלזיוס מתחת 5% CO2 עבור 20 דקות להסיר את התרבות בינוני, ולאחר מכן לשטוף דגימת תאים עם 100 µL של D-PBS פעמיים. לספק את דגימת תאים עם 200 µL של EMEM (10% FBS).
- עבור רוברטסונית הגרעין של כלואהדבק-להארכה, לחשוף את דגימת תאים לאור אולטרא סגול במשך 2 דקות דרך סיב אופטי באמצעות מקור אור 100-W קסנון מצויד במסנן bandpass nm 365. עבור מדגם תא הפניה ללא חשיפה UV, לשמור את דגימת תאים בחושך.
הערה: המכסה של סובסטרטים זכוכית ניתן לקחת חשיפה UV יעיל. ותיק חשיפה לאור UV עלולים לגרום cytotoxicity על התאים. - ויזואליזציה של הגרעינים, להוסיף 1 µL של Hoechst 33342 (1 מ"ג/מ"ל) למדיום תרבות, דגירה המדגם התא שנוצר ב 37 מעלות צלזיוס מתחת 5% CO2 למשך 10 דקות.
- נושא את דגימת תאים סריקת מיקרוסקופ לייזר קונפוקלי ולהקליט את micrographs על עירור-488 ננומטר (λobs = 500-530 ננומטר), 543 nm (λobs = 565-620 nm), ו- 710 nm (שני הפוטונים; Λ obs = 390-465 nm) עבור להארכה, צבע אדום-פלורסנט Hoechst 33342, בהתאמה.
4. התבוננות רוברטסונית הגרעין של מולקולה קטנה האורחים המופעלות על-ידי שני הפוטונים ניר אור
- לספק את הדגימה תא (שלב מוכן ב- 2.3) עם 200 µL של EMEM נטולת FBS המכיל כלואהדבק-להארכה (10 מיקרומטר) דגירה המדגם התא שנוצר ב 37 מעלות צלזיוס מתחת 5% CO2 ב-3 שעות.
- להסיר את המדיום תרבות ולשטוף את דגימת תאים עם 100 µL של D-PBS פעמיים. לספק את דגימת תאים עם 200 µL של EMEM (10% FBS).
- נושא לדוגמה תא סריקת מיקרוסקופ לייזר קונפוקלי ולהקליט את micrographs על עירור-488 ננומטר (λobs = 500-530 ננומטר).
- עבור רוברטסונית הגרעין של כלואהדבק-להארכה, להאיר את האזור כולל את התא של עניין עם לייזר שני הפוטונים עירור (710 nm), שהותקנו כמקור אור במיקרוסקופ, למשך 2 דקות (30 s × 4). להתבונן רוברטסונית כפי שמתואר בשלב 4.3.
5. תצפיות של טרנסלוקציה הגרעין של האורחים Macromolecular מופעלות על ידי אור UV
- לספק את הדגימה תא (שלב מוכן ב- 2.3) עם 200 µL של EMEM נטולת FBS המכיל כלואהדבק-QD (10 ננומטר), דגירה המדגם התא שנוצר ב 37 מעלות צלזיוס מתחת 5% CO2 ב-3 שעות.
- להסיר את המדיום תרבות ולשטוף את דגימת תאים עם 100 µL של D-PBS פעמיים. לספק את דגימת תאים עם 200 µL של EMEM (10% FBS).
- עבור רוברטסונית הגרעין של כלואהדבק-QD, לחשוף את דגימת תאים לאור אולטרא סגול במשך 2 דקות דרך סיב אופטי באמצעות מקור אור 100-W קסנון מצויד במסנן bandpass nm 365. עבור מדגם תא הפניה ללא חשיפה UV, לשמור את דגימת תאים בחושך.
- ויזואליזציה של הגרעינים, להוסיף 1 µL של Hoechst 33342 (1 מ"ג/מ"ל) למדיום תרבות, דגירה המדגם התא שנוצר ב 37 מעלות צלזיוס מתחת 5% CO2 למשך 10 דקות.
- נושא את דגימת תאים סריקת מיקרוסקופ לייזר קונפוקלי ולהקליט את micrographs על עירור-405 ננומטר (λobs = 430-520 nm), 488 ננומטר (λobs = nm 625-680) ועבור Hoechst 33342 QDs, בהתאמה.
6. תא הכדאיות Assay
- לשמור על hepatocellular האנושי קרצינומה Hep3B תאים EMEM (10% FBS) ב 37 מעלות צלזיוס מתחת 5% CO2.
- הזרע התאים יום לפני הניסוי. תאי זרע 5.0 × 103 Hep3B טוב של צלחת 96-ובכן התרבות ב- EMEM (10% FBS, 200 µL), דגירה המדגם תא ב 37 מעלות צלזיוס מתחת 5% CO2 עבור 24 שעות.
- להסיר את המדיום תרבות ולשטוף את דגימת תאים עם 100 µL של D-PBS פעמיים.
- לספק את דגימת תאים עם 200 µL של EMEM נטולת FBS המכיל כלואהדבק-להארכה (0.1-100 מיקרומטר) דגירה המדגם התא שנוצר ב 37 מעלות צלזיוס מתחת 5% CO2 ב-3 שעות.
- לחשוף את הדגימה תא לאור UV במשך 2 דקות דרך סיב אופטי באמצעות מקור אור 100-W קסנון מצויד במסנן bandpass nm 365. לקבלת דוגמה מקבילה לתא ללא חשיפה UV, השאר את דגימת תאים בחושך.
- להוסיף 10 µL של ריאגנט תא סופר קיט-8 (10 µL) המדיום תרבות, דגירה המדגם התא שנוצר ב 37 מעלות צלזיוס מתחת 5% CO2 כבר שעתיים.
- נושא לדוגמה תא בליעה (λ = 450 ננומטר) באמצעות קורא microplate.
תוצאות
לפני photoirradiation, תאים Hep3B מודגרות עם דבק כלואה-להארכה הציג פליטת קרינה פלואורסצנטית punctate מן הפנים שלהם (λext = 488 ננומטר; דמויות 4A ו- 4 Cירוק). Micrograph מקביל הושג על עירור-543 nm לצבע אדום-פלורסנט (דמויות 4B ו- 4 C, אדום), המצי...
Discussion
חקירות קודמות מבוססות אור טרנסלוקציה של חלבונים לתוך גרעין התא הושגו באמצעות בכלובים NLS7,8,9. כאמור, שיטות אלה דורשים שיטות נוספות כדי לשלב את החלבונים מתויג NLS בתוך הציטופלסמה. לעומת זאת, התגים דבק-R שלנו כלואהמאפשרת לא רק תמונה-induced ר?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו להכיר את המרכז לשילוב NanoBio, באוניברסיטת טוקיו. עבודה זו היה נתמך על ידי מענק הסיוע עבור צעירים מדענים (B) (26810046) כדי לעלף ו חלקית נתמך על ידי מענק הסיוע למחקר מיוחד קידום (25000005) חומרי גלם עוזר ההוראה תודה מלגות של יפן אגודת המחקר עבור קידום המדע (JSPS ) עבור מדענים צעירים ואת התוכנית עבור המובילים בוגרת בתי ספר (GPLLI).
Materials
| Name | Company | Catalog Number | Comments |
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
References
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved