Method Article
使用CRISPR/ CasRx在 黑腹果蝇 中无处不在和组织特异性RNA靶向
摘要
本文概述了在果蝇中使用RNA靶向Cas13D酶(RfxCas13D)的详细方案。
摘要
CasRx是RNA靶向Cas13家族的成员,是CRISPR / Cas技术在高效基因转录本还原方面的新成员,在细胞和生物体水平上都具有有吸引力的脱靶谱。最近有报道称,CRISPR/ CasRx系统可用于实现 黑腹果蝇中无处不在和组织特异性的基因转录减少。本文详细介绍了最近工作的方法,包括三部分:1)使用双组分CasRx系统进行无处不在的体内内源性RNA靶向;2)使用三组分CasRx系统在体内无处不在的外源RNA靶向;和3)使用三组分CasRx系统靶向组织特异性体内RNA。观察到的RNA靶向的影响包括靶向基因特异性表型变化,靶向RNA转录本减少以及与CasRx蛋白和侧支活性的高表达相关的偶尔致死表型。总体而言,这些结果表明,CasRx系统能够以可编程和有效的方式在生物体水平上靶向RNA转录本还原,证明体内转录组靶向和工程是可行的,并为未来体内基于CRISPR的RNA靶向技术奠定了基础。
引言
自簇状规则间隔短回文重复序列(CRISPR)技术问世以来,该领域的大部分重点一直放在DNA编辑上,这为医学和生物技术提供了变革性的应用1。然而,由于伦理考虑,DNA序列的永久性改变并不总是可取的。有鉴于此,最近的研究开始开发基于CRISPR的靶向RNA的工具,并证明CRISPR技术确实可用于各种生物系统中的RNA靶向2,3,4,5,6,7。在许多测试的这些系统中,目前广泛使用的靶向RNA和转录本还原的方法是RNA干扰(RNAi),它远非完美,当在体内使用时,通常表现出不同的功效和高脱靶活性8,9,10,11,12,13,14,15,16,17.因此,鉴于这些技术的地位,值得进一步探索基于CRISPR的RNA靶向工具的潜力。
最近一项值得注意的研究报告称,核糖核酸酶CasRx是Cas13d类的成员,可以有效地降低人类细胞培养物中的基因转录水平,并具有有吸引力的脱靶谱4。这一发现引发了一个问题,即这种新的核糖核酸酶是否可以在生物体水平上保持其RNA靶向的功效和低脱靶率。最近的一项研究解决了这个问题,表明CasRx系统可用于实现黑 腹果蝇中无处不在和组织特异性的基因转录减少5。
为了简化这种最近发表的方法的可用性,该协议详细介绍了最近工作的方法,该方法由三个主要部分组成:1)使用双组分CasRx系统进行无处不在的体内RNA靶向;2)使用三组分CasRx系统在体内无处不在的外源RNA靶向;和3)使用三组分CasRx系统靶向组织特异性体内RNA。
设计了在无处不在的启动子控制下靶向不同靶基因的向导RNA(gRNA),并生成表达这些含gRNA构建体的飞系。在无处不在的启动子或可由GAL4转录因子激活的条件上游激活序列(UASt)启动子的控制下,CasRx构建体也被设计出来,并飞行含有这些CasRx构建体的飞行系。催化非活性CasRx结构dCasRx被设计并用作阴性对照。通过与无处不在的 CasRx 表达蝇系交叉,可以实现苍蝇中无处不在的 RNA 靶向。表达靶向特定基因转录本的gRNA构建体和CasRx蛋白的后代具有靶向基因转录本的普遍减少。通过首先将表达gRNA的苍蝇与表达UASt-CasRx的苍蝇杂交,获得携带gRNA和UASt-CasRx构建体的转杂合子蝇,可以达到果蝇中的组织特异性RNA靶向。这些苍蝇反过来与组织特异性表达GAL4的苍蝇杂交,导致在苍蝇中产生组织特异性CasRx表达和RNA靶向。
CasRx系统的可编程特性提供了定制和优化的可能性,有助于实现体内RNA靶向的高功效和低脱靶活性。基于CRISPR的RNA靶向的潜在应用很多,包括在实验室中取代RNAi,并为野外昆虫媒介控制做出贡献。在后者中,全球未满足的需求之一是开发有效的工具来对抗通过蚊子传播的RNA病毒感染。许多RNA病毒,如登革热、寨卡病毒和基孔肯雅病毒,通过蚊子传播,影响人类健康,并导致死亡。已经提出了许多关于具有抗病毒性的工程蚊子种群以预防疾病的建议;然而,目前没有技术能够使蚊子同时对所有重要的RNA病毒产生抗药性18,19,20,21,22,23。RNA靶向Cas系统可以通过启用一个可编程平台来靶向所有蚊子传播的RNA病毒,从而为这种技术提供一个起点。
研究方案
1. 使用双组分CasRx系统的无处不在的体内RNA靶向
- 生成 Ubiq-CasRx 和 Ubiq-dCasRx 表达载体
- 使用聚合酶链反应 (PCR) 和引物 1050E 扩增 CasRx 序列。C3 和 1050E。C4和原始的CasRx构建pNLS-RfxCas13d-NLS-HA(pCasRx);并使用带有引物1050E的PCR扩增dCasRx序列。C3 和 1050E。C4 和原始的 dCasRx 构建 pNLS-dRfxCas13d-NLS-HA (pdCasRx)4 (表 1)。之后使用凝胶纯化试剂盒对扩增的 CasRx 和 dCasRx 片段进行凝胶纯化。
- 消化碱基载体(Addgene质粒#112686)与限制性内切酶SwaI和PacI24。在所得产品中,使用试剂盒对较大的片段进行凝胶纯化,称为碱基载体骨架。
- 使用Gibson组装方法将Ubiq-CasRx向量与基本向量骨干和CasRx片段组装;使用 Gibson 组装方法将 Ubiq-dCasRx 向量与基本向量主干和 dCasRx 片段组装在一起25。
注意:Ubiq-CasRx 载体 (OA-1050E) 的 Addgene ID 为 #132416,Ubiq-dCasRx 载体 (OA-1050R) 的 Addgene ID 为 #132417。
- 生成 gRNA 表达载体
- 根据以下标准设计每个gRNA片段:靶序列长度为30个核苷酸;聚U拉伸在目标序列中的最大长度为4个碱基对;目标序列GC含量在30%-70%范围内;靶序列预测不会形成强RNA发夹结构;和含有最少预测的RNA二级或三级结构的靶序列5。
注意:本研究将每个gRNA设计为4个串联序列,每个序列长30个核苷酸,间隔36个核苷酸长直接重复,两端都有一个7-胸腺嘧啶终止子5。对于外源性靶基因GFP,遵循与上述相同的标准,添加OpIE2-GFP片段5。 - 使用引物1043.C1和1043.C23以及Addgene质粒#112688的PCR扩增U6:3启动子序列(表1)26。使用凝胶纯化试剂盒对扩增的U6:3片段进行凝胶纯化。
- 消化添加基因质粒#112688与限制性内切酶AscI和XbaI24。在所得产品中,使用试剂盒对较大的片段进行凝胶纯化,这称为预碱基载体骨架。
- 使用 Gibson 汇编方法25 将基向量与前基向量主干和 U6:3 片段组装基向量。以下基本载体被命名为OA-1043。
注意:质粒OA-1043的添加基因ID为#164586。 - 使用外部基因合成服务合成靶基因的gRNA片段。
- 用限制性内切酶PstI和NotI24消化碱基载体OA-1043。保留整个消化产物,称为消化OA-1043。
- 使用Gibson组装方法将gRNA表达载体与消化的OA-1043和靶基因gRNA片段组装在一起25。
注意:研究了四个靶基因:三个是内源性(白色, 缺口, 黄色),一个是外源性(GFP)。他们的Addgene ID是:#132420(gRNAw),#132421(gRNAN),#132425(gRNAy)和#133304(gRNAGFP)。
- 根据以下标准设计每个gRNA片段:靶序列长度为30个核苷酸;聚U拉伸在目标序列中的最大长度为4个碱基对;目标序列GC含量在30%-70%范围内;靶序列预测不会形成强RNA发夹结构;和含有最少预测的RNA二级或三级结构的靶序列5。
- 产生转基因苍蝇
- 使用外部苍蝇胚胎注射服务将表达载体注射到苍蝇胚胎中,并将含有ØC31整合位点的苍蝇胚胎注射到苍蝇胚胎中。将注射的胚胎置于26°C。
注意:attp40w(第2 染色体上有整合位点)用于生成CasRx系,8622(第 3染色体上有整合位点)用于生成各种gRNA系。 - 将苍蝇保留为纯合线或平衡杂合线。
注意:Ubiq-CasRx和Ubiq-dCasRx苍蝇被保留为杂合平衡线,以CyO作为平衡器。此外,Ubiq-CasRx 和 Ubiq-dCasRx 向量都包含一个 dsRed 标记。因此,Ubiq-CasRx和Ubiq-dCasRx苍蝇具有以下三种表型:dsRed阳性,卷曲的翅膀和白色的眼睛。表达gRNA的苍蝇被保留为纯合线。它们的Bloomington Drosophila Stock Center(BDSC)苍蝇库存号为:#84118(Ubiq-CasRx),#84119(Ubiq-dCasRx),#84124(gRNAw),#84122(gRNAN),#84123(gRNAy),#84986(gRNAGFP)。
- 使用外部苍蝇胚胎注射服务将表达载体注射到苍蝇胚胎中,并将含有ØC31整合位点的苍蝇胚胎注射到苍蝇胚胎中。将注射的胚胎置于26°C。
- 苍蝇遗传学(图1A)
- 从纯合gRNA系中收集10只处女成年雌性苍蝇,并从平衡杂合Ubiq-CasRx / CyO系收集5只成年雄蝇。将收集的雌果和雄蝇(称为亲本苍蝇)放入补充有干酵母粉的小瓶中(图1A)。
- 重复上一步 3 次以生成 3 次重复。对于对照组,使用Ubiq-dCasRx / CyO系列,同时保持其他所有内容相同。
注意:对于普通的玻璃小瓶食品,0.1克干酵母粉就足够了。使用BDSC的苍蝇食物配方。 - 将含有亲本苍蝇的小瓶在26°C下放置48小时。然后从每个小瓶中取出所有亲本苍蝇。然后将小瓶在26°C下保持至少20天。
- 每天观察小瓶,看看是否有任何新的成年后代从F1代的蛹中出现。如果是这样,通过插入连接到飞瓶内二氧化碳罐的管子,然后打开流量开关10秒钟,用二氧化碳麻醉它们。
- 一旦苍蝇变得不动,将它们从小瓶中清空到飞垫上,该飞垫也连接到二氧化碳罐,二氧化碳不断通过苍蝇垫流出。
- 对麻醉的苍蝇的表型进行评分,并使用连接到荧光立体显微镜的彩色相机对它们进行成像。计算具有不同表型的后代的数量。使用图像处理软件进行图像后处理和编译(图2A - 2D)。
注:根据孟德尔遗传学,每个杂交的后代中预计有两种类型的苍蝇(图1A)。
- 核糖核酸酶 (图2E – 2G)
- 样品采集
注意:从以下3个示例中选择适当的样品收集方法;每种不同的样品类型需要 3 次重复。- 成虫蝇头样本采集
- 从纯合子gRNA系中收集10只处女成年雌性苍蝇。从平衡杂合Ubiq-CasRx/ CyO系收集5只成年雄蝇。将收集的雌果和雄蝇(即亲本苍蝇)放入补充了干酵母粉的小瓶中。
- 重复上一步 3 次,共重复 3 次。对于对照组,使用Ubiq-dCasRx / CyO系列,同时保持其他所有内容相同。
- 将含有亲本苍蝇的小瓶在26°C下放置48小时。然后从每个小瓶中取出所有亲本苍蝇。然后将小瓶保持在26°C,直到后代从蛹中出来。
- 收集10只具有正确表型的1天龄成年苍蝇。用二氧化碳麻醉苍蝇,然后切掉苍蝇头,将苍蝇头放在1.5毫升的干冰离心管中。将离心管储存在-80°C。 对 3 次重复重复重复此步骤 3 次。
- 17 – 20小时大的胚胎样本采集
- 从纯合gRNA系中收集8-10只处女成年雌性苍蝇。从平衡杂合Ubiq-CasRx/ CyO系中收集4-5只成年雄蝇。将收集的雌果和雄蝇(即亲本苍蝇)放入补充了干酵母粉的小瓶中。
- 重复上一步 3 次,共重复 3 次。对于对照组,使用Ubiq-dCasRx / CyO系列,同时保持其他所有内容相同。
- 将含有亲本苍蝇的小瓶在26°C下放置48小时。
- 按照此食谱为每个重复准备一个葡萄汁胚胎收集室:376毫升水,126毫升葡萄汁,15克琼脂和6克蔗糖。将培养基放入1升烧杯中,用微波炉高微波加热5-6分钟,同时密切关注烧杯中的培养基,以检查是否出现气泡/泡沫。如果是这样,请停止微波炉,让气泡/泡沫沉淀。继续以这种方式微波加热,直到气泡变清晰。在所有气泡都清除之前,不要旋转。最后,加入10毫升100%酒精和5毫升乙酸。混合均匀,然后用25 mL血清学移液管将培养基移入35 mm培养皿中。当培养基在培养皿中凝固时,即可使用。
- 在48小时孵育结束时,将亲本苍蝇转移到葡萄汁胚胎收集室中,并在26°C下孵育3小时。然后除去成年苍蝇,同时将新鲜产下的胚胎在26°C下在葡萄汁板上再保持17小时。
- 孵育后,从葡萄汁板中收集50-100个胚胎,通过将胚胎表面浸没在去离子水中来清洁胚胎表面,然后将它们转移到冰上的1.5mL离心管中。将它们储存在-80°C。 对 3 次重复重复重复此步骤 3 次。
- 首次幼虫样本采集
- 从纯合gRNA系中收集8-10只处女成年雌性苍蝇。从平衡杂合Ubiq-CasRx/ CyO系中收集4-5只成年雄蝇。将收集的雌果和雄蝇(即亲本苍蝇)放入补充了干酵母粉的小瓶中。对 3 次重复重复重复此步骤 3 次。对于对照组,使用Ubiq-dCasRx / CyO系列,同时保持其他所有内容相同。
- 将含有亲本苍蝇的小瓶在26°C下放置48小时。然后将成年苍蝇转移到另一个新的常规食物瓶中,在26°C下孵育过夜(16小时)。 然后,去除成年苍蝇。
- 将含胚胎的小瓶在26°C下保持24小时,然后在显微镜下使用基于不同标记物对经杂合子的首龄幼虫进行评分。收集15-30个具有正确表型的幼虫,并将它们放入1.5mL离心管中,并将其储存在-80°C。 对 3 次重复重复重复此步骤 3 次。
- 成虫蝇头样本采集
- 测 序
- RNA提取:使用市售的RNA提取试剂盒,并按照试剂盒的说明处理所有样品。然后,用市售脱氧核糖核酸酶孵育提取的RNA样品,并按照其说明从样品中除去任何污染的DNA。
- 使用市售的紫外可见分光光度计测量RNA浓度。使用市售的RNA完整性测定装置测量样品中的RNA完整性。
- 使用市售的RNA文库制备试剂盒构建RNA-seq文库。
- 使用外部测序服务进行文库测序,具有以下设置:单读模式;读取长度:50nt,深度:每个库2000万次读取。使用 RTA 1.18.64 执行基本调用,然后使用 bcl2fastq 1.8.4 将数据转换为 FASTQ。
注:原始测序数据可以在国家生物技术信息测序阅读档案中找到(提交ID:SUB6818910 [BioProject: PRJNA600654])。
- 生物信息学
- 使用STAR aligner28的默认参数设置,使用STAR aligner28的默认参数设置,从测序数据中读取释放6个果蝇黑色素ogaster基因组(GenBank加入号:GCA_000001215.4)和外源CasRx和GFP序列,并添加"-outFilterType BySJout"过滤器选项和"-sjdbGTFfile Drosophila_melanogaster。BDGP6.22.97.gtf"来自ENSEMBL的基因转移格式文件。
- 使用"-t 外显子 -g gene_id -M -O --分数"选项,使用 Counts35 功能确定每个带注释的转录本的原始转录本计数。然后,使用"addTpmFpkmToFeatureCounts.pl"Perl 脚本使用总成绩单计数规范化原始成绩单计数。
- 使用最大后验方法和DESeq2管道中的原始收缩估计器来估计每个基因的转录本的对数折叠变化(LFC)。
- 样品采集
2. 使用三组分CasRx系统的无处不在的体内外源RNA靶向
- 生成外源性靶标无处不在的表达载体
- PCR使用引物1052B扩增Ubiq启动子片段。C1 和 1052B。C2和Addgene质粒#112686 26。然后,PCR用引物908A.1和908A.2扩增从Addgene质粒#112686扩增的T2A-eGFP片段(表1)26。然后,PCR使用Addgene质粒#112686和引物908A.3和908A.4扩增Ubiq启动子片段作为反向序列(表1)26。使用凝胶纯化试剂盒对 Ubiq 启动子片段、T2A-eGFP 片段和反向 Ubiq 启动子片段进行凝胶纯化。
- 订购自定义萤火虫荧光素酶编码序列和包含p10 3'UTR片段的自定义片段,反向肾路绿素酶,然后是SV40 3'UTR片段。
- 消化添加基因质粒#112688与限制性内切酶AscI和XbaI24。在所得产品中,使用凝胶纯化试剂盒(称为碱基载体骨架)对较大的片段进行凝胶纯化。
- 使用Gibson组装方法将碱基载体与碱基载体骨架和以下片段组装:Ubiq启动子片段,T2A-eGFP片段,反向Ubiq启动子片段,萤火虫荧光素酶编码序列和反向肾小路萤光素酶,然后是SV40 3'UTR片段25。
注意:所得双荧光素酶表达载体(OA-1052B)的Addgene ID为#132426。
- 生成 gRNA 表达载体
- PCR使用引物1043.C1和1043.C23以及Addgene质粒#112688扩增U6:3启动子序列(表1)26。使用凝胶纯化试剂盒对扩增的U6:3片段进行凝胶纯化。
- 消化添加基因质粒#112688与限制性内切酶AscI和XbaI24。在所得产品中,使用凝胶纯化试剂盒对较大的片段进行凝胶纯化,称为预碱基载体骨架。
- 使用 Gibson 汇编方法将基向量与前基向量主干和 U6:3 片段组装在一起25。以下基本载体被命名为OA-1043。
- 使用外部基因合成服务合成靶基因的gRNA片段。
- 用限制性内切酶PstI和NotI24消化碱基载体OA-1043。保留整个消化产物,称为消化的OA-1043。
- 使用Gibson组装方法将gRNA表达载体与消化的OA-1043和靶基因gRNA片段组装在一起25。
注:所得质粒(OA-1052K)的添加基因ID为#132422。
- 产生转基因苍蝇
- 通过外部苍蝇胚胎注射服务,使用来自第三条染色体上含有ØC31整合位点(BDSC苍蝇库存号9744)的苍蝇胚胎将OA-1052B载体注射到苍蝇胚胎中。同样,使用来自第3条染色体(BDSC苍蝇库存号8622)上含有ØC31整合位点的苍蝇的胚胎将OA-1052K载体注射到苍蝇胚胎中。将注射的胚胎置于26°C。
- 保持双荧光素酶表达的苍蝇和gRNA苍蝇作为纯合线;通过将第1节中生成的单平衡杂合Ubiq-CasRx系与携带TM6平衡染色体的具有残茬(Stb)标记的平衡线交叉,并保持Ubiq-CasRx系为双平衡杂合系,并仅保留具有白眼,卷曲翅膀和dsRed荧光表型的双平衡后代。
注意:BDSC苍蝇库存号为:#84127(Ubiq-Fluc-Rluc),#84125(gRNAFluc)。
- 苍蝇遗传学(图1B 和 图3A)
- 从双荧光素酶表达线收集8-10只处女成年雌性苍蝇。从平衡杂合Ubiq-CasRx/CyO中收集4-5只成年雄蝇;+/TM6,Stb线,同时显示白眼,卷曲的翅膀和dsRed荧光。将收集的母蝇和雄蝇(即亲本苍蝇)放入补充有干酵母粉的小瓶中(以下称为步骤1交叉)。
- 重复上一步 3 次,共重复 3 次。对于对照组,使用Ubiq-dCasRx / CyO;+/TM6,Stb 线,同时保持其他一切相同。
- 将含有亲本苍蝇的步骤1交叉小瓶在26°C下放置48小时。然后从每个小瓶中取出所有亲本苍蝇。然后将小瓶在26°C下保持至少14天。在此期间,从纯合萤火虫荧光素酶靶向gRNA系中收集8-10个雌性处女。对 3 次重复重复重复此步骤 3 次。
- 每天观察步骤1交叉小瓶,看看是否有任何新的成年苍蝇从蛹中出现。如果是这样,用二氧化碳麻醉它们,从后代中收集5只表达Ubiq-CasRx(或Ubiq-dCasRx)和双荧光素酶报告者的雄性苍蝇,并将它们与来自萤火虫荧光素酶靶向gRNA线的10只处女雌性一起放入一个新的小瓶中(以下称为Step 2 Cross)。对 3 次重复重复重复此步骤 3 次。
- 从步骤1交叉小瓶中收集另一个5个表达Ubiq-CasRx(或Ubiq-dCasRx)和双荧光素酶报告基因的1日龄雄性,并在26°C下孵育2-4天。 然后,将它们转移到1.5mL离心管中并储存在-80°C。 重复此步骤 3 次,共进行 3 次复制。
- 将含有亲本苍蝇的步骤2交叉小瓶在26°C下放置48小时。然后从每个小瓶中取出所有亲本苍蝇。然后将小瓶在26°C下保持至少20天。
- 每天观察步骤2交叉小瓶,看看是否有新的成年后代从蛹中出现。如果是这样,用二氧化碳麻醉它们,对麻醉的苍蝇的表型进行评分,并使用配备荧光立体显微镜的彩色相机对它们进行成像。计算具有不同表型的后代的数量。使用图像处理软件进行图像后处理和编译(图3B – 3C)。
注:孟德尔遗传学表明,如果苍蝇都是可行的,那么在步骤2杂交的后代中,预计有4种类型的苍蝇,每种苍蝇占种群的25%(图1B 和 图3A)。
- 荧光素酶测定(图3D)
- 通过重复步骤2.4.1-2.4.5生成三重跨杂合蝇以及控制蝇。在出生时收集雄蝇,并将它们老化至3天大。
- 将3天大的苍蝇转移到1.5mL离心管中,并使用杵和市售荧光素酶测定试剂盒的荧光素酶裂解缓冲液裂解它们。
- 使用来自每个样品的5μL裂解组织,使用市售的萤光素酶测定试剂盒和荧光计测量萤火虫和小脑藻荧光素酶活性。
3. 使用三组分CasRx系统靶向组织特异性体内RNA
- 生成 UASt-CasRx 和 UASt-dCasRx 表达载体
- 使用质粒pJFRC81和引物1041.C9和1041.C11扩增UASt启动子序列;然后,使用质粒OA-1050E(添加基因ID #132416)和引物1050L扩增CasRx片段。C1 和 1050E。C4;然后使用质粒OA-1050R(添加基因ID #132417)和引物1050L扩增dCasRx片段。C1 和 1050E。C4(表1)26.使用凝胶纯化试剂盒对扩增的UASt启动子序列、CasRx和dCasRx片段进行凝胶纯化。
- 消化碱基载体(添加基因质粒#112686)与限制性内切酶NotI和PacI24。在所得产品中,使用凝胶纯化试剂盒对较大的片段(称为碱基载体骨架)进行凝胶纯化。
- 使用Gibson组装将UASt-CasRx向量与碱基向量骨架,UASt启动子序列和CasRx片段组装;然后使用 Gibson 组装方法将 UASt-dCasRx 向量与碱基向量主链、UASt 启动子序列和 dCasRx 片段组装在一起25。
注意:UASt-CasRx 载体是 Addgene 质粒 #132418,UASt-dCasRx 载体是 Addgene 质粒 #132419
- 产生转基因苍蝇
- 使用苍蝇胚胎注射服务将UASt-CasRx载体注射到苍蝇胚胎中,并将来自苍蝇ØC31整合位点8621的胚胎注入其第2 条染色体;然后使用苍蝇胚胎注射服务将UASt-dCasRx载体注射到苍蝇胚胎中,并将来自苍蝇ØC31整合位点8621的胚胎注入其第2 条染色体上。将注射的胚胎置于26°C。
- 将苍蝇保持为具有CyO和Sb标记的双平衡杂合线。注意:BDSC 中飞行线的 ID 是 84121 (UASt-CasRx) 和 84120 (UASt-dCasRx)。
- 苍蝇遗传学(图1C)
- 从BDSC订购所需的GAL4线路;从步骤3.2.2(或从BDSC)获得相关的gRNA谱系。
注意:使用了以下2只来自BDSC的GAL4苍蝇:GAL4-GMR(BDSC ID:#29967),GAL4-y(BDSC ID:#44373)。使用第一部分中产生的相同的3个gRNA谱系:gRNAw (BDSC ID:#84124),gRNAN (BDSC ID #84122),gRNAy(BDSC ID:#84123)。 - 从gRNA系中收集5-10只处女成年雌性苍蝇。从双平衡杂合UASt-CasRx/CyO中采集2-4只成年雄蝇;+/TM6,Sb线,同时显示白眼,卷曲的翅膀和dsRed荧光。将收集的雌果和雄蝇(即亲本苍蝇)放入常规食物瓶中(以下称为步骤1十字架)。对 3 次重复重复重复此步骤 3 次。对于对照组,使用UASt-dCasRx / CyO;+/TM6,Sb 线,同时保持其他所有内容相同。
- 将含有亲本苍蝇的步骤1交叉小瓶在26°C下放置48小时。然后从每个小瓶中取出所有亲本苍蝇。然后将小瓶在26°C下保持至少14天。在此期间,从GAL4系列中收集5-10个女性处女。对 3 次重复重复重复此步骤 3 次。
- 每天观察步骤1交叉小瓶,看看是否有任何新的成年苍蝇从蛹中出现。如果是这样,用二氧化碳麻醉它们,收集2-4只雄性苍蝇,表达UASt-CasRx(或UASt-dCasRx)和来自同时具有dsRed荧光和残茬表型的后代的gRNA载体。将从步骤1十字架中收集的雄性与来自GAL4线(以下称为步骤2十字架)的5-10个收集的处女雌性一起放入新小瓶中。对 3 次重复重复重复此步骤 3 次。
- 将含有亲本苍蝇的步骤2交叉小瓶在26°C下放置48小时。然后从每个小瓶中取出所有亲本苍蝇。然后将小瓶在26°C下保持至少20天。
- 每天观察步骤2交叉小瓶,看看是否有新的成年苍蝇从蛹中出现。如果是这样,用二氧化碳麻醉它们,对麻醉的苍蝇的表型进行评分,并使用配备荧光立体显微镜的彩色相机对它们进行成像。计算具有不同表型的后代的数量。使用图像处理软件进行图像后处理和编译(图4)。
注:孟德尔遗传学表明,如果苍蝇都是可行的,那么在步骤2 Cross的后代中,预计有4种类型的苍蝇,每种苍蝇占种群的25%(图1C)。
- 从BDSC订购所需的GAL4线路;从步骤3.2.2(或从BDSC)获得相关的gRNA谱系。
结果
使用双组分 CasRx 系统的无处不在的体内 RNA 靶向
与表达Ubiq-dCasRx和gRNA构建体的对照蝇相比,表达Ubiq-CasRx和gRNA(靶向内源性和外源性基因)构建体的F1转杂合蝇显示出显着的表型(图2和图4)。具体而言,与经杂合dCasRx苍蝇相比,经杂合CasRx苍蝇的存活率显着降低,这表明Ubiq-CasRx系统的毒性(图2A和图4A)。值得注意的是,经杂合子CasRx和dCasRx苍蝇的遗传率都低于50%,这是基于孟德尔遗传学的预期比率。在三个靶基因中,Ubiq-CasRx/+;U6-gRNAN/+ 苍蝇和Ubiq-CasRx/+;U6-gRNAy/ +苍蝇是不可存活的(0%遗传),并且没有超过第二龄幼虫阶段(图2A-2B)。幸存的Ubiq-CasRx/+;U6-gRNAw/+苍蝇的遗传率为12.9%,显示出明显的完全渗透性白眼表型(图2B)。除了与CasRx相关的可观察性状外,我们还能够确认3个靶基因的靶基因转录本显着减少:Notch,黄色和GFP(图2E-2G)。与对照Ubiq-dCasRx/+,U6-gRNAw/+苍蝇相比,在Ubiq-CasRx/+,U6-gRNAw/+苍蝇中观察到白色基因转录本的减少,尽管这种减少没有统计学意义(图2E - 2F)。在比较来自表达CasRx的苍蝇的样品和来自表达dCasRx的苍蝇的样品之间的差异表达转录本时,发现了CasRx诱导的脱靶活性的证据(图2E,2G)。非靶标转录本明显差异表达的数量如下:白色,253(占总转录本的1.4%);缺口, 300 (1.7%);黄色, 41 (0.23%);GFP,5,880(33%)(图2G)在总共17,779个不同的转录本中,6个非靶标转录本在所有4组样本中均有显着差异表达。确定的6个转录本之一是Gadd45,这是一种参与果蝇细胞凋亡和细胞停滞的基因,提高了CasRx的酶促作用可能直接触发细胞凋亡或间接触发其他基因的错误表达的可能性,这反过来又导致细胞凋亡。最后,值得注意的是,Ubiq-CasRx和Ubiq-dCasRx苍蝇没有被确定为纯合子种群,可能是由于高无处不在的表达所赋予的毒性。结果,杂合Ubiq-CasRx / CyO和Ubiq-dCasRx / CyO苍蝇用于与纯合gRNA苍蝇系杂交。总之,双组分Ubiq-CasRx系统能够实现内源性和外源性靶标的普遍RNA靶向,从而产生可观察到的表型和转录本减少。这些结果还表明,CasRx介导的RNA靶向可能会在体内引入毒性。
使用三组分 CasRx 系统的无处不在的体内外源性 RNA 靶向
两步交叉的结果表明,尽管靶基因(即Fluc)具有外源性,但在F2三重转杂合子(Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)中表达所有三个转基因,与涉及Ubiq-dCasRx的对照杂交相比,表达所有三个转基因(Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)(图3B-C)中未观察到致死性。).更具体地说,只有所有三个转基因(Ubiq-CasRx/+;gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)的组合才产生100%的致死率(图3B和D),而(Ubiq-CasRx/+;gRNAFluc/TM6)和(Ubiq-CasRx/+;Ubiq-Fluc-Ubiq-Rluc/TM6)基因型是可行的,并且缺乏表型,其遗传率与预期的孟德尔传播率相匹配,这表明靶序列(即萤火虫荧光素酶)与Ubiq-CasRx/+和gRNAFluc组合的可用性是导致观察到的致死性表型的原因,可能源于Cas13酶的附带活性2,8.此外,没有可区分的表型或对F1转杂合子(Ubiq-CasRx/+; gRNAFluc/+或Ubiq-CasRx/+;与Ubiq-dCasRx对照(Ubiq-dCasRx/+; gRNAFluc/+或Ubiq-dCasRx/+;Ubiq-Fluc-Ubiq-Rluc/+)(图3B),表明催化活性酶对于获得观察到的致死性表型至关重要。此外,与双荧光素酶报告基因对照相比,所有可行基因型的果蝇中的Fluc和Rluc表达水平在Ubiq-dCasRx三重转杂合子(Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)中未显示Fluc表达显着降低。这表明dCasRx靶向没有降低Fluc蛋白表达水平(图3D)。综上所述,两种不同的CasRx介导的无处不在的RNA靶向实验中的共同致死表型表明,当普遍用于组织时,CasRx介导的RNA靶向可能对生物体有毒。
使用三组分 CasRx 系统靶向组织特异性体内 RNA
在无处不在的RNA靶向实验中观察到的高水平毒性促使我们使用方法部分详述的三组分CasRx系统设计来探索组织特异性RNA靶向。事实上,与Ubiq启动子相比,当使用UASt启动子降低整体CasRx表达时,观察到的毒性水平降低,这在三个方面得到了例证:1)UASt-CasRx和UASt-dCasRx系保持为纯合系,尽管基于两步交叉方案,使用双平衡UASt-CasRx和UASt-dCasRx系进行交叉, 2)所有F2代dCasRx三重转杂合子遗传率均与预期的25%孟德尔遗传率相匹配,3)F2代CasRx三重转杂合子致死表型适度降低。在白色靶向实验中,在F2三重转杂合子中预期的25%孟德尔遗传率中,仅观察到0.57%的活成年蝇(UASt-CasRx / +; gRNAw / GMR-Gal4),所有这些都显示出严重的眼部特异性色素沉着和形态表型(图4A和4B)。对于白色靶向交叉,表达CasRx的三重经杂合子F2遗传率显着低于表达dCasRx的三重经杂合子对照组(27.6%)(图4A)。在Notch靶向实验中,表达CasRx的三重透杂合子携带所有三个转基因是100%致命的,而dCasRx对照遗传率为29.3%(图4A)。在黄色靶向实验中,F2三重转杂合子CasRx表达,gRNAy和y-GAL4显示胸部和腹部黄色角质层小块的几丁质素色素减少,遗传率为2.67%,远低于dCasRx对照组(25.2%)(图4A).所有dCasRx对照的三重转杂合子蝇都没有像表达CasRx的苍蝇那样呈现明显的表型,这表明CasRx的催化活性有助于观察到的表型。CasRx三重转杂合子组的低遗传率表明,CasRx RNA靶向中存在两个毒性来源:一个与CasRx的高表达相关,其毒性因限制性CasRx表达而降低,另一个与附带活性相关。综上所述,这些结果表明,CasRx系统可以通过利用经典的Gal4 / UASt系统实现组织特异性体内RNA靶向,同时降低毒性。然而,与无处不在的方法相比,毒性和偶尔致死表型的严重程度仍然较低,这表明侧支裂解活性与毒性相关。
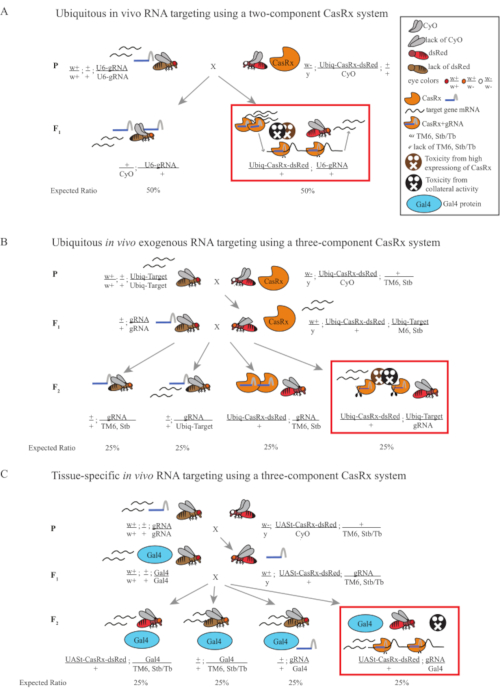
图1:使用Cas13D系统靶向RNA的一般概述。 (A)使用双组分CasRx系统在无处不在的体内RNA靶向中一步遗传杂交的示意图。(B)使用三组分CasRx系统在无处不在的体内外源RNA靶向中两步遗传杂交的示意图。(C)使用三组分CasRx系统在组织特异性体内RNA靶向中的两步遗传杂交的示意图。 请点击此处查看此图的放大版本。
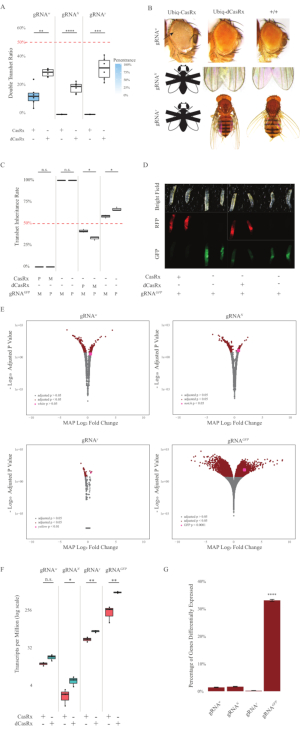
图2:使用双组分CasRx系统(重印5)的无处不在的体内RNA靶向。(A)遗传Ubiq-CasRx(或Ubiq-dCasRx)和gRNA的转杂合蝇的总遗传百分比。框图中的蓝色阴影表示表型外显率。(B)经杂合子蝇的表型。箭头表示眼睛组织坏死。标有"X"的黑白苍蝇代表杀伤力。(C)Ubiq-CasRx(或Ubiq-dCasRx)和gRNAGFP-OpIE2-GFP苍蝇之间双向交叉的经杂合子苍蝇的总遗传百分比。M,CasRx的母体遗传;P,CasRx的父系遗传。(D)F1幼虫后代在父系杂交。(E) 成绩单对数折数变化的最大后验估计数。使用了 DESeq2 管道。(F) 以 CasRx 或 dCasRx 为目标的每百万 (TPM) 成绩单。(G) CasRx-depentent差异表达转录本的转录本百分比。请点击此处查看此图的放大版本。
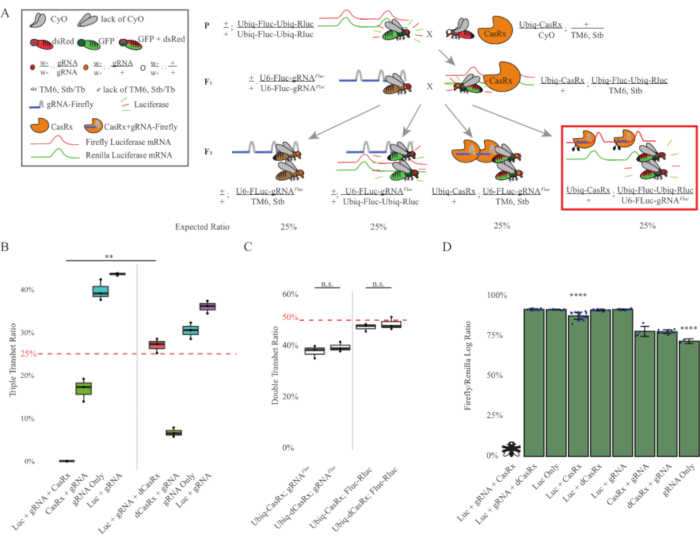
图3:使用三组分CasRx系统的无处不在的体内外源RNA靶向。(B)F2世代中出现的所有基因型的总遗传百分比。在F2后代中遗传所有三个转基因(Ubiq-CasRx,Ubiq-Fluc-Ubiq-Rluc和gRNAFLuc)导致100%的致死率,并且与Ubiq-dCasRx三重转杂合子对照组(p = 0.001,t-test)相比显着降低。(C)单独携带Ubiq-CasRx/gRNAFluc或单独携带Ubiq-CasRx和Ubiq-Fluc-Ubiq-Rluc不会导致严重的致死性,Ubiq-CasRx和Ubiq-dCasRx转杂合子之间的遗传率没有显着差异(分别p = 0.41和p = 0.51,t检验)。(D)荧光素酶比率将Fluc读数归一化为Rluc读数。表达Ubiq-CasRx,Ubiq-Fluc-Ubiq-Rluc,gRNAFLuc的三重转杂合蝇是胚胎致命的,其由带有"X"的苍蝇表示,因此没有测量荧光素酶表达。Ubiq-CasRx/+、Ubiq-Fluc-Ubiq-Rluc/TM6、Stb transheterozygotes的Fluc/Rluc比值显著低于其他Ubiq-Fluc-Ubiq-Rluc表达组(p = 1.2e-06或更低,t检验)。仅gRNAFLuc组的结果显着低于所有其他组(p = 1.2e-06或更低,t检验)。请点击此处查看此图的放大版本。
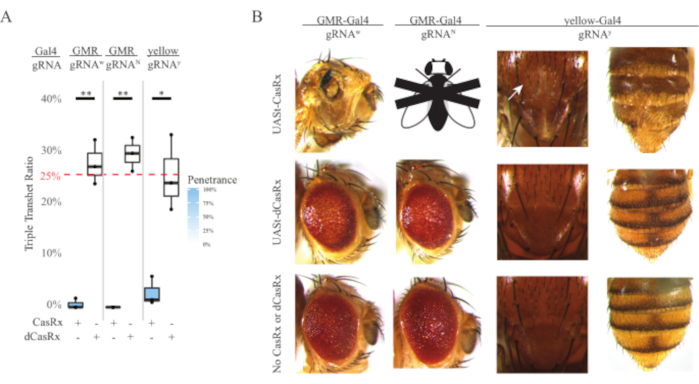
图 4:使用三组分 CasRx 系统靶向组织特异性体内 RNA(重印5)。 (A) 携带三个转基因(UASt-CasRx 或 UASt-dCasRx、gRNA 和 Gal4-driver)的三重转杂合蝇的总遗传百分比。(B)三重经杂合子蝇的表型。白色箭头表示胸部甲壳素色素减少。标有"X"的黑白苍蝇代表杀伤力。 请点击此处查看此图的放大版本。
| 构建 | 描述 | 底漆 | 引物序列(5' 至 3') | 聚合酶链反应模板 |
| OA-1050E | 卡斯瑞克 | 1050E.C3型 | TACTAATTTTCCAC ATCTATTTTGAC CCGCAGATTAATTA ATGAGCCCCAAGA 阿加 | pNLS-RfxCas13d-NLS-HA (pCasRx) |
| 1050E.C4型 | CAATTGATTTGTTA TTTTAAAAACGATT 卡特塔格塔克塔克特 TAAGCGTAATCTGG 阿卡 | |||
| OA-1050R | dCasRx | 1050E.C3型 | TACTAATTTTCCAC ATCTATTTTGAC CCGCAGATTAATTA ATGAGCCCCAAGA 阿加 | pNLS-dRfxCas13d-NLS-HA (pdCasRx) |
| 1050E.C4型 | CAATTGATTTGTTA TTTTAAAAACGATT 卡特塔格塔克塔克特 TAAGCGTAATCTG 嘎嘎嘎 | |||
| OA-1050L | 无人机推广者 | 1041.C9 | GCGGGTTCTCGA 中控科技 GCATGTCGACGC GGCCGCAACCAA 卡卡塔格 | pJFRC81 |
| 1041.C11 | CTGGCCTCCACC 断续器 TGGGGCTCATGT TTAAACCCAATT CCCTATTCAGA | |||
| 卡斯瑞克 | 1050L.C1 | 阿塔卡加加加 GAACTGAATA GGGAATTGGGT TTAAACATGAGC 中华嘉嘉 | pCasRx | |
| 1050E.C4型 | CAATTGATTTGT 塔塔阿阿克 关贸总协定 GCTAGCTTAAG CGTAATCTGGA 断续器 | |||
| OA-1050S | 无人机推广者 | 1041.C9 | GCGGGTTCTC 嘎嘎嘎 GCGGGCATGT 中海会 格恰卡卡阿 CACTAGTAG | pJFRC81 |
| 1041.C11 | 断续器 断续器 断续器 CATGTTTAAAC 中华互信会 断续器 | |||
| dCasRx | 1050L.C1 | 阿塔卡加格 AGAACTCTGAAT AGGGAATTGGG TTTAAACATGAG CCCCAAGAAGAA | pdCasRx | |
| 1050E.C4型 | CAATTGATTTGT 塔塔阿阿克 GATTCATTCTAG CTAGCTTAAGCG TAATCTGGAACA | |||
| OA-1043 | U6:3 启动子 | 1043 C1 | GGGAATTGGGA ATTGGGGCAATAT TTAAATGGCGGC 全球气候委员会 断续器 | 添加基因质粒 #164586 |
| 1043.C23 | 阿卡塔格特加特 断续器 中华民盟 CAAAAAAGTTGT AATAGCCCCTCA AAACTGGACCTT CCACAACTGCAG CCGACGTTAAAT 断续器 | |||
| OA-1052B | Ubiq promoter | 1052B.C1 | GGGAATTGGGCA ATATTTAAATGGC GGCTGCAGCGCGC GCAGATCGCCGAT | 添加基因质粒 #112686 |
| 1052B.二、低温 | TTTCTTTATGTTT TTGGCGTCTTCC ATCCTAGGTCTG CGGGTCAAAATA 嘎嘎嘎 | |||
| T2A-eGFP | 908A1 | 阿塔阿格卡格 AAGGGCGGAAA GATCGCCGTGG AGGGCAGAGGA AGTCTTCTAACAT 气相色谱 | 添加基因质粒 #112686 | |
| 908A1 | TTGTTATTTTAAAA ACGATTCATTCTA GGCGATCGCTTA CTTGTACAGCTC GTCCATGCC | |||
| 反向 Ubiq 启动子 | 908A3 | ACCGTGACCTAC ATCGTCGACACTA GTGGATCTCTAGA CGCGCAGATCGC 断续器 | 添加基因质粒 #112686 | |
| 908A3 | GGATCATAAACTT TCGAAGTCATGC GGCCGCTCTGCG 格特恰阿塔加格 断续器 |
表1:本研究中使用的分子构建体和引物列表。 此列表包括所有构造(ID 和描述)以及每个构造的相关引物(ID 和序列(5' 到 3'))和使用的模板。
讨论
通过CasRx系统的三种不同应用设计,这项工作证明了在果蝇体内可编程的RNA靶向。不同的策略迎合了不同的项目需求,例如内源性与外源性基因靶向以及无处不在与组织特异性RNA靶向。RNA靶向的影响包括靶基因特异性表型变化,靶RNA转录本减少以及与CasRx蛋白和侧支活性高表达相关的偶尔致死表型。总体而言,这些结果表明,CasRx系统能够以可编程和有效的方式在生物体水平上靶向RNA转录本还原。
成功定制CasRx系统的关键因素之一是gRNA的设计。具体而言,应注意以下建议:靶序列长度约为30个核苷酸,靶序列中聚U拉伸的长度为4个碱基对或更少,靶序列GC含量在30%-70%的范围内,目标序列不预测形成强RNA发夹结构,并且靶序列包含最小的预测RNA二级或三级结构5。
除了gRNA设计之外,每个方案中的苍蝇遗传学步骤对于成功实施也至关重要。是否存在从后代中亲本传下来的已定义表型对于识别和量化由转杂合子后代中的CasRx系统诱导的表型非常重要。此外,使用dCasRx苍蝇并行设置对照杂交也有助于排除经杂合子后代中的非特异性表型。
值得注意的是,这些结果揭示了在苍蝇中普遍表达CasRx和dCasRx蛋白所引入的毒性问题,这是CasRx系统的局限性。仅在Ubiq启动子下,CasRx或dCasRx的普遍表达,没有gRNA,带来了非平凡的适应性成本,因为Ubiq-CasRx和Ubiq-dCasRx苍蝇都不能被确定为纯合子系。相反,UASt-CasRx和UASt-dCasRx苍蝇可以被确定为健康的纯合子种群,尽管由于交叉方案的设计,它们被保留为双平衡种群,这一事实支持了无处不在的CasRx蛋白表达诱导的毒性的存在。另一个支持性的证据是,在涉及催化无活性的dCasRx的对照实验中,携带dCasRx和gRNA构建体的苍蝇在F1 一代苍蝇总数中的百分比始终低于50%,如果没有dCasRx相关毒性,则基于孟德尔遗传学的预期比率。这表明无处不在地表达dCasRx以及gRNA会诱导苍蝇的毒性,导致遗传率低于预期。经杂合子UASt-dCasRx,gRNA,GAL4苍蝇的遗传率遵循孟德尔遗传学,这再次表明CasRx和dCasRx蛋白的普遍表达特异性诱导的毒性。CRISPR/Cas体系中的毒性并不新鲜。大量的Cas9蛋白已被证明在几种生物体中是有毒的,包括苍蝇29,30,31,32。最近的一项研究开发了一种定制的GAL4 / UAS系统,该系统可以通过在UAS-Cas9构造中的UAS序列和Cas9序列之间添加不同长度的开放阅读框架来调整苍蝇中表达的Cas9蛋白的量33。因此,值得探索通过调整CasRx蛋白表达水平来降低CasRx诱导的毒性的方法。
除了CasRx和dCasRx蛋白无处不在的表达所诱导的毒性外,结果还显示出与CasRx系统的非特异性附带脱靶效应相关的致死性,这是许多CRISPR系统的特征1,2,7,34。例如,在一些表达 CasRx 和非必需基因 gRNA 的双或三经杂合子蝇中,例如在靶向 Notch 时,与转 dCasRx 蝇相比,经杂合子 CasRx 蝇的存活率显着降低。在这些CasRx和表达gRNA的转杂合蝇的RNA-seq分析中,观察到靶基因转录本水平的降低和非靶基因转录本的减少。这些附带效应是CasRx依赖性和靶标依赖性的,因为它们仅在表达CasRx蛋白和gRNA的跨杂合子蝇中观察到。值得指出的是,当CasRx靶向白色基因时,其中一个靶基因白色仅显示出有限的,无统计学意义的转录本减少,这与明显的色素减少表型相反。据推测,这可能是由于以下事实:1)RNA-seq样品收集的时间与早期发育期间白色基因达到其表达峰值的时间不完全一致,2)眼睛中白色基因的局部表达使得在早期发育阶段收集相关组织具有挑战性,当时只有全身样本收集是可行的。为了减少CasRx系统中的附带活性,需要进行未来的研究,以充分了解生物体水平上脱靶现象系统背后的机制。
有趣的是,最近一项研究35 描述了果蝇中RNA靶向Cas13工具,似乎改善了与CasRx表达相关的一般毒性,原因有几个可能。首先,作者重新编码了Cas13转基因以优化 果蝇 中的表达,并且与本研究中使用的泛素启动子相比,使用了表达更弱的启动子(肌动蛋白5C),可能导致Cas13表达水平降低,因此毒性更低。事实上,这得到了UASt驱动的CasRx和dCasRx表达本身没有毒性的观察结果的支持,因为这项研究(以及 35位作者)没有观察到UASt-CasRx苍蝇有任何明显的致死性。此外,与本研究相比,这些作者对gRNA的编码方式不同,这可能影响了它们的表达并降低了系统在经杂合Cas13 / gRNA苍蝇中的毒性。例如,在他们的研究中,使用U6:3启动子表达两个gRNA,两侧是tRNA,以便在不需要CasRx35的情况下在tRNA成熟时进行gRNA处理。相反,在这项研究中,gRNA被编码为靶向每个基因最多4个位置的阵列,并模仿细菌中发现的内源性Cas13阵列结构,这需要Cas13酶来处理每个gRNA。这些不同的方法可能导致gRNA表达水平的差异和其他因素,这些因素可能对整个系统的毒性产生固有的影响。最后,Huynh等人靶向的基因与本研究中靶向的基因不同,这导致靶-Cas/gRNA相互作用和附带活性的差异,并可能对观察到的致死水平产生影响。观察到的毒性的这些差异需要进一步调查,以确定可以改进整个系统的方法。
总体而言,这项研究首次证明了 D. melanogaster中功能性遗传编码的可编程RNA靶向Cas系统,尽管需要进一步优化CasRx系统(符合报道的35),以进一步降低脱靶相关致死性并提高CasRx靶向切割的功效。使用Cas酶靶向RNA是一个快速发展的领域,具有许多潜在的应用,从昆虫载体控制到治疗用途1,2,3,4,5,6,7,该协议为有兴趣设计其第一个苍蝇CasRx系统的人提供了一个入门包,同时与系统的定制和进一步优化兼容。这里提供的示例演示了在体内实施该系统期间可能遇到的一系列结果,并且可以作为其他用户评估CasRx系统在其应用中的性能的基准。
披露声明
O.S.A.是Agragene, Inc.的创始人,拥有股权,并在公司的科学顾问委员会任职。加州大学圣地亚哥分校根据其利益冲突政策审查并批准了这一安排的条款。所有其他作者均未声明任何竞争利益。
致谢
这项工作部分得到了DARPA安全基因计划赠款(HR0011-17-2-0047)和NIH授予O.S.A.的奖项(R21RAI149161A,DP2AI152071)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 100% Grape Juice | Welch Foods Inc. | N/A | |
| Active Dry Yeast (908g) | Red Star Yeast Company, LLC | N/A | |
| DMC4500 color camera | Leica Microsystems | DMC4500 | |
| Dual-Luciferase Reporter Assay System | Promega | E1910 | |
| GAL4-GMR flies | Bloomington Drosophila Stock Center | 29967 | |
| GAL4-y flies | Bloomington Drosophila Stock Center | 44373 | |
| Glomax 20/20 Luminometer | Promega | E5331 | |
| Illumina HiSeq2500 Sequencer | Illumina, Inc. | HiSeq2500 | |
| M165FC fluorescent stereomicroscope | Leica Microsystems | M165FC | |
| Nanodrop OneC UV-vis spectrophotometer | ThermoFisher | NDONEC-W | |
| NEBNext Ultra II RNA Library Prep Kit | New England Biolabs, Inc. | E7770 | |
| plasmid # 112686 | Addgene | 112686 | |
| plasmid # 112688 | Addgene | 112688 | |
| plasmid # 132416 | Addgene | 132416 | |
| plasmid # 132417 | Addgene | 132417 | |
| plasmid # 132419 | Addgene | 132419 | |
| plasmid # 132420 | Addgene | 132420 | |
| plasmid # 132421 | Addgene | 132421 | |
| plasmid # 132422 | Addgene | 132422 | |
| plasmid # 132425 | Addgene | 132425 | |
| plasmid # 132426 | Addgene | 132426 | |
| plasmid # 133304 | Addgene | 133304 | |
| plasmid # 164586 | Addgene | 164586 | |
| plasmid #132418 | Addgene | 132418 | |
| plasmid pJFRC81 | Addgene | 36432 | |
| Qiagen RNeasy Mini Kit | Qiagen | 74104 | |
| Restriction endonucleases AscI | New England Biolabs Inc. | R0558L | |
| Restriction endonucleases NotI | New England Biolabs Inc. | R0189L | |
| Restriction endonucleases PacI | New England Biolabs Inc. | R0547L | |
| Restriction endonucleases PstI | New England Biolabs Inc. | R0140L | |
| Restriction endonucleases SwaI | New England Biolabs Inc. | R0604L | |
| Restriction endonucleases XbaI | New England Biolabs Inc. | R0145L | |
| RNA 6000 Pico Kit for Bioanalyzer | Agilent Technologies | 5067-1513 | |
| Turbo DNase | Invitrogen | AM2238 | |
| U6-3:4-gRNA-Fluc flies | Bloomington Drosophila Stock Center | 84125 | |
| U6-3:4-gRNA-GFP; OpIE2-GFP flies | Bloomington Drosophila Stock Center | 84986 | |
| U6-3:4-gRNA-N flies | Bloomington Drosophila Stock Center | 84122 | |
| U6-3:4-gRNA-w flies | Bloomington Drosophila Stock Center | 84124 | |
| U6-3:4-gRNA-y flies | Bloomington Drosophila Stock Center | 84123 | |
| UASt-CasRx flies | Bloomington Drosophila Stock Center | 84121 | |
| UASt-dCasRx flies | Bloomington Drosophila Stock Center | 84120 | |
| Ubiq-CasRx flies | Bloomington Drosophila Stock Center | 84118 | |
| Ubiq-dCasRx flies | Bloomington Drosophila Stock Center | 84119 | |
| Ubiq-Firefly-T2A-eGFP-Ubiq-Renilla flies | Bloomington Drosophila Stock Center | 84127 | |
| Zymoclean Gel DNA Recovery Kits | Zymo Research Corporation | D4007 |
参考文献
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nat Communications. 9, 1911 (2018).
- Abudayyeh, O., et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. 353 (6299), 5573 (2016).
- East-Seletsky, A., O'Connell, M., Burstein, D., Knott, G., Doudna, J. RNA Targeting by Functionally Orthogonal Type VI-A CRISPR-Cas Enzymes. Molecular Cell. 66 (3), 373-383 (2017).
- Konermann, S., Lotfy, P., Brideau, N., Oki, J., Shokhirev, M., Hsu, P. Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors. Cell. 173 (3), 665-676 (2018).
- Buchman, A., Brogan, D., Sun, R., Yang, T., Hsu, P., Akbari, O. Programmable RNA Targeting Using CasRx in Flies. The CRISPR Journal. 3 (3), 164-176 (2020).
- Kushawah, G., et al. CRISPR-Cas13d Induces Efficient mRNA Knockdown in Animal Embryos. Developmental Cell. 54 (6), 805-817 (2020).
- Abudayyeh, O., et al. RNA targeting with CRISPR-Cas13. Nature. 550, 280-284 (2017).
- Perrimon, N., Ni, J., Perkins, L. In vivo RNAi: today and tomorrow. Cold Spring Harbor Perspectives in Biology. 2, 003640 (2010).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448, 151-156 (2007).
- Ni, J., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Ni, J., et al. A genome-scale shRNA resource for transgenic RNAi in Drosophila. Nature Methods. 8, 405-407 (2011).
- Ni, J., et al. Vector and parameters for targeted transgenic RNA interference in Drosophila melanogaster. Nature Methods. 5, 49-51 (2008).
- Heigwer, F., Port, F., Boutros, M. RNA Interference (RNAi) Screening in Drosophila. Genetics. 208 (3), 853-874 (2018).
- Kulkarni, M., et al. Evidence of off-target effects associated with long dsRNAs in Drosophila melanogaster cell-based assays. Nature Methods. 3, 833-838 (2006).
- Ma, Y., Creanga, A., Lum, L., Beachy, P. Prevalence of off-target effects in Drosophila RNA interference screens. Nature. 443, 359-363 (2006).
- Perrimon, N., Mathey-Prevot, B. Matter arising: off-targets and genome-scale RNAi screens in Drosophila. Fly. 1 (1), 1-5 (2007).
- Markstein, M., Pitsouli, C., Villalta, C., Celniker, S., Perrimon, N. Exploiting position effects and the gypsy retrovirus insulator to engineer precisely expressed transgenes. Nature Genetics. 40, 476-483 (2008).
- Champer, J., Buchman, A., Akbari, O. Cheating evolution: engineering gene drives to manipulate the fate of wild populations. Nature Review Genetics. 17 (3), 146-159 (2016).
- Buchman, A., et al. Broad dengue neutralization in mosquitoes expressing an engineered antibody. PLoS Pathogens. 16 (4), 1008103 (2020).
- Mathur, G., Sanchez-Vargas, I., Alvarez, D., Olson, K., Marinotti, O., James, A. Transgene-mediated suppression of dengue viruses in the salivary glands of the yellow fever mosquito, Aedes aegypti. Insect Molecular Biology. 19 (6), 753-763 (2011).
- Franz, A., et al. Engineering RNA interference-based resistance to dengue virus type 2 in genetically modified Aedes aegypti. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4198-4203 (2006).
- Yen, P., James, A., Li, J., Chen, C., Failloux, A. Synthetic miRNAs induce dual arboviral-resistance phenotypes in the vector mosquito Aedes aegypti. Communications Biology. 1, 11 (2018).
- Buchman, A., et al. Engineered resistance to Zika virus in transgenic Aedes aegypti expressing a polycistronic cluster of synthetic small RNAs. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3656-3661 (2019).
- . Addgene Available from: https://www.addgene.org/protocols/restriction-digest/ (2020)
- Gibson, D., Young, L., Chuang, R., Venter, J., Hutchison, C., Smith, H. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- . Addgene Available from: https://www.addgene.org/protocols/pcr/ (2020)
- . Indiana University Bloomington Available from: https://bdsc.indiana.edu/information/recipes/bloomfood.htmL (2020)
- Dobin, A., et al. STAR:ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Jiang, W., Brueggeman, A., Horken, K., Plucinak, T., Weeks, D. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryotic Cell. 13 (11), 1465-1469 (2014).
- Poe, A., et al. Robust CRISPR/Cas9-Mediated Tissue-Specific mutagenesis reveals gene redundancy and perdurance in Drosophila. Genetics. 211 (2), 459-472 (2019).
- Port, F., Chen, H., Lee, T., Bullock, S. Optimized CRISPR/Cas tools for efficient ger mLine and somatic genome engineering in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (29), 2967-2976 (2014).
- Yang, S., Li, S., Li, X. Shortening the Half-Life of Cas9 maintains its gene editing ability and reduces neuronal toxicity. Cell Reports. 25 (10), 2653-2659 (2018).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. eLife. 9, 53865 (2020).
- Zhang, X., Tee, L., Wang, X., Huang, Q., Yang, S. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy - Nucleic Acids. 4 (17), 264 (2015).
- Huynh, N., Depner, N., Larson, R., King-Jones, K. A versatile toolkit for CRISPR-Cas13-based RNA manipulation in Drosophila. Genome Biology. 21, 279 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。