Method Article
Orientación de ARN ubicuo y específico del tejido en Drosophila Melanogaster utilizando CRISPR / CasRx
En este artículo
Resumen
Este artículo describe un protocolo detallado para el uso de la enzima Cas13D dirigida al ARN (RfxCas13D) en moscas.
Resumen
CasRx, un miembro de la familia Cas13 dirigida al ARN, es una nueva adición prometedora de las tecnologías CRISPR / Cas en la reducción eficiente de la transcripción de genes con un atractivo perfil fuera del objetivo tanto a nivel celular como de organismo. Recientemente se ha informado de que el sistema CRISPR/CasRx se puede utilizar para lograr una reducción ubicua y específica de la transcripción de genes en Drosophila melanogaster. Este artículo detalla los métodos del trabajo reciente, que consta de tres partes: 1) orientación ubicua de ARN endógeno in vivo utilizando un sistema CasRx de dos componentes; 2) orientación ubicua de ARN exógeno in vivo utilizando un sistema CasRx de tres componentes; y 3) la orientación de ARN in vivo específica del tejido utilizando un sistema CasRx de tres componentes. Los efectos de la orientación del ARN observados incluyen cambios fenotípicos específicos de genes dirigidos, reducción dirigida de la transcripción del ARN y fenotipos de letalidad ocasionales asociados con una alta expresión de la proteína CasRx y la actividad colateral. En general, estos resultados mostraron que el sistema CasRx es capaz de apuntar a la reducción de la transcripción de ARN a nivel del organismo de una manera programable y eficiente, lo que demuestra que la orientación y la ingeniería del transcriptoma in vivo son factibles y sientan las bases para futuras tecnologías de orientación de ARN basadas en CRISPR in vivo.
Introducción
Desde el advenimiento de las tecnologías Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR), gran parte del enfoque en este campo se ha centrado en la edición de ADN, que ofrece aplicaciones transformadoras en medicina y biotecnología1. La alteración permanente de las secuencias de ADN, sin embargo, no siempre se desea debido a consideraciones éticas. A la luz de esto, estudios recientes comenzaron a desarrollar herramientas basadas en CRISPR para dirigirse al ARN y demostraron que las tecnologías CRISPR pueden usarse para la orientación del ARN en una variedad de sistemas biológicos2,3,4,5,6,7. En muchos de estos sistemas probados, el enfoque actual ampliamente utilizado para dirigirse a la reducción de ARN y transcripción es la interferencia de ARN (ARNi), que está lejos de ser perfecta, a menudo exhibe una eficacia variada y una alta actividad fuera del objetivo cuando se usa in vivo8,9,10,11,12,13,14,15,16,17 . Por lo tanto, dado el estado de estas tecnologías, vale la pena explorar más a fondo los potenciales de las herramientas basadas en CRISPR para la orientación de ARN.
Un estudio reciente notable informó que la ribonucleasa CasRx, un miembro de la clase Cas13d, puede reducir eficientemente los niveles de transcripción de genes en cultivos celulares humanos y posee un atractivo perfil fuera del objetivo4. Este hallazgo llevó a la pregunta de si esta nueva ribonucleasa puede mantener su eficacia y una baja tasa fuera del objetivo para el ARN dirigido a nivel del organismo. Un estudio reciente abordó esta pregunta al mostrar que el sistema CasRx se puede utilizar para lograr una reducción de la transcripción de genes ubicua y específica del tejido en Drosophila melanogaster5.
Para agilizar la usabilidad de este enfoque recientemente publicado, este protocolo detalla los métodos de este trabajo reciente, que consta de tres partes principales: 1) orientación de ARN in vivo ubicua utilizando un sistema CasRx de dos componentes; 2) orientación ubicua de ARN exógeno in vivo utilizando un sistema CasRx de tres componentes; y 3) la orientación de ARN in vivo específica del tejido utilizando un sistema CasRx de tres componentes.
Se diseñaron ARN guía (ARNg) dirigidos a diferentes genes diana bajo el control de un promotor ubicuo y se generaron líneas de mosca que expresan estas construcciones que contienen ARNg. También se diseñaron construcciones casRx bajo el control de un promotor ubicuo o un promotor de secuencia de activación ascendente condicional (UASt) activable por el factor de transcripción GAL4 y se generaron líneas de vuelo que albergan estas construcciones que contienen CasRx. Los constructos CasRx catalíticamente inactivos, dCasRx, fueron diseñados y utilizados como controles negativos. La orientación ubicua de ARN en moscas se logra cruzando líneas de mosca que expresan gRNA con líneas de mosca que expresan CasRx de forma ubicua. La progenie que expresa tanto la construcción de ARNg dirigida a una transcripción genética específica como la proteína CasRx tiene una reducción ubicua de las transcripciones de genes dirigidos. La focalización de ARN específico de tejido en moscas se logra cruzando primero moscas que expresan ARNg con moscas que expresan UASt-CasRx, obteniendo moscas transheterocigotas que transportan construcciones de gRNA y UASt-CasRx. Tales moscas a su vez se cruzan con moscas que expresan GAL4 específicas del tejido, lo que resulta en la generación de la expresión de CasRx específica del tejido y la orientación de ARN en las moscas.
La naturaleza programable del sistema CasRx ofrece la posibilidad de personalización y optimización para ayudar a lograr una alta eficacia y una baja actividad fuera del objetivo para la orientación de ARN in vivo. Las aplicaciones potenciales de la orientación de ARN basada en CRISPR son numerosas, incluida la sustitución de ARNi en el laboratorio y la contribución al control de insectos vectores en la naturaleza. De estos últimos, una de las necesidades globales insatisfechas es el desarrollo de herramientas eficientes para combatir las infecciones de virus de ARN transmitidas a través de mosquitos. Muchos virus de ARN, como el dengue, el Zika y el virus chikungunya, se transmiten a través de mosquitos, lo que afecta la salud humana y contribuye a la mortalidad. Se han hecho muchas propuestas para diseñar poblaciones de mosquitos con resistencia al virus para la prevención de enfermedades; sin embargo, ninguna tecnología actual es capaz de hacer que los mosquitos sean simultáneamente resistentes a todos los virus de ARN significativos18,19,20,21,22,23. Los sistemas Cas dirigidos al ARN pueden proporcionar un punto de partida para dicha tecnología al permitir una plataforma programable para atacar todos los virus de ARN transmitidos por mosquitos.
Protocolo
1. Orientación de ARN in vivo omnipresente utilizando un sistema CasRx de dos componentes
- Generación del vector de expresión Ubiq-CasRx y Ubiq-dCasRx
- Amplifique la secuencia CasRx mediante una reacción en cadena de la polimerasa (PCR) con imprimación 1050E. C3 y 1050E. C4 y el casRx original construyen pNLS-RfxCas13d-NLS-HA (pCasRx); y amplificar la secuencia dCasRx mediante PCR con imprimación 1050E. C3 y 1050E. C4 y el original dCasRx construyen pNLS-dRfxCas13d-NLS-HA (pdCasRx)4 (Tabla 1). Purificar en gel los fragmentos amplificados de CasRx y dCasRx después utilizando un kit de purificación de gel.
- Vector base de digestión (plásmido Addgene #112686) con enzimas de restricción SwaI y PacI24. En los productos resultantes, use un kit para purificar en gel el fragmento más grande, que se llama columna vertebral del vector base.
- Ensamblar el vector Ubiq-CasRx con la columna vertebral del vector base y el fragmento CasRx utilizando el método de ensamblaje gibson; ensamblar el vector Ubiq-dCasRx con la columna vertebral del vector base y el fragmento dCasRx utilizando el método de ensamblaje de Gibson25.
NOTA: El ID de Addgene del vector Ubiq-CasRx (OA-1050E) es #132416, y el ID de Addgene del vector Ubiq-dCasRx (OA-1050R) es #132417.
- Generación del vector de expresión de ARNb
- Diseñar cada fragmento de ARNg en base a los siguientes criterios: secuencia objetivo de 30 nucleótidos de longitud; la longitud máxima de los estiramientos poli-U en la secuencia objetivo es de 4 pares de bases; el contenido de GC de la secuencia objetivo está en el rango de 30% - 70%; la secuencia objetivo predijo que no formaría estructuras de horquilla de ARN fuertes; y la secuencia diana que contiene una estructura secundaria o terciaria mínima de ARN predicha5.
NOTA: Este estudio diseñó cada ARNg como 4 secuencias en tándem cada 30 nucleótidos de largo, espaciadas por 36 repeticiones directas largas de nucleótidos, y con un terminador de 7 timinas en ambos extremos5. Para el gen diana exógeno, GFP, se siguieron los mismos criterios anteriores con la adición de un fragmento opIE2-GFP5. - Amplificar la secuencia promotora U6:3 mediante PCR con cebadores 1043.C1 y 1043.C23 y el plásmido Addgene #112688 (Tabla 1)26. Purificar en gel los fragmentos amplificados de U6:3 utilizando el kit de purificación de gel.
- Digest Addgene plasmid #112688 con la enzima de restricción AscI y XbaI24. En los productos resultantes, use un kit para purificar en gel los fragmentos más grandes, lo que se denomina columna vertebral del vector pre-base.
- Ensamble el vector base con la columna vertebral vectorial prebase y el fragmento U6:3 utilizando el método de ensamblaje de Gibson25. El vector base a continuación se denomina OA-1043.
NOTA: El ID de Addgene del plásmido OA-1043 es #164586. - Sintetizar el fragmento de ARNg del gen objetivo utilizando el servicio externo de síntesis de genes.
- Digerir el vector base OA-1043 con la enzima de restricción PstI y NotI24. Mantenga todo el producto de digestión, que se llama OA-1043 digerido.
- Ensamblar el vector de expresión de ARNg con el OA-1043 digerido y el fragmento de ARNg del gen objetivo utilizando el método de ensamblaje de Gibson25.
NOTA: Se estudiaron cuatro genes diana: tres eran endógenos (blanco, Notch, amarillo), uno era exógeno (GFP). Sus ID de Addgene son: #132420 (gRNAw), #132421 (gRNAN), #132425 (gRNAy) y #133304 (gRNAGFP).
- Diseñar cada fragmento de ARNg en base a los siguientes criterios: secuencia objetivo de 30 nucleótidos de longitud; la longitud máxima de los estiramientos poli-U en la secuencia objetivo es de 4 pares de bases; el contenido de GC de la secuencia objetivo está en el rango de 30% - 70%; la secuencia objetivo predijo que no formaría estructuras de horquilla de ARN fuertes; y la secuencia diana que contiene una estructura secundaria o terciaria mínima de ARN predicha5.
- Generación de moscas transgénicas
- Inyectar vectores de expresión en embriones de mosca utilizando el servicio externo de inyección de embriones de mosca y embriones de moscas que contienen sitios de integración ØC31. Trasera los embriones inyectados a 26 °C.
NOTA: La línea attp40w (con sitios de integración en el cromosoma 2) se utilizó para generar líneas CasRx y la línea 8622 (con sitios de integración en el cromosoma 3) se utilizó para generar varias líneas de ARNg. - Mantenga las moscas como líneas homocigotas o como líneas heterocigotas equilibradas.
NOTA: Las moscas Ubiq-CasRx y Ubiq-dCasRx se mantuvieron como líneas equilibradas heterocigotas con el CyO como equilibrador. Además, los vectores Ubiq-CasRx y Ubiq-dCasRx contienen un marcador dsRed. Como resultado, las moscas Ubiq-CasRx y Ubiq-dCasRx tienen los siguientes tres fenotipos: dsRed-positivo, alas rizadas y ojos blancos. Las moscas que expresan ARNg se mantuvieron como líneas homocigotas. Sus números de stock de mosca bloomington Drosophila Stock Center (BDSC) son: #84118 (Ubiq-CasRx), #84119 (Ubiq-dCasRx), #84124 (gRNAw), #84122 (gRNAN), #84123 (gRNAy), #84986 (gRNAGFP).
- Inyectar vectores de expresión en embriones de mosca utilizando el servicio externo de inyección de embriones de mosca y embriones de moscas que contienen sitios de integración ØC31. Trasera los embriones inyectados a 26 °C.
- Genética de moscas (Figura 1A)
- Recolecte 10 moscas hembras adultas vírgenes de la línea de ARNg homocigota y recoja 5 moscas macho adultas de la línea heterocigota equilibrada Ubiq-CasRx / CyO. Coloque las moscas hembra y macho recolectadas, que se llaman moscas parentales, en un vial suplementado con polvo de levadura seca (Figura 1A).
- Repita el paso anterior 3 veces para generar 3 réplicas. Para el grupo de control, use la línea Ubiq-dCasRx/CyO mientras mantiene todo lo demás igual.
NOTA: Para un vial de vidrio regular de alimentos, 0,1 g de polvo de levadura seca es suficiente. Se utiliza la receta de comida para moscas del BDSC. - Coloque los viales que contienen las moscas parentales a 26 °C durante 48 horas. Luego retire todas las moscas parentales de cada vial. A continuación, mantenga los viales a 26 °C durante al menos 20 días.
- Observe los viales todos los días para ver si surgieron nuevas progenies adultas de pupas de la generación F1. Si es así, anestéselos con dióxido de carbono insertando un tubo conectado a un tanque de dióxido de carbono dentro de los viales de mosca, luego encienda el interruptor de flujo durante 10 segundos.
- Una vez que las moscas se vuelven inmóviles, vacíelas del vial en una almohadilla de mosca, que también está conectada al tanque de dióxido de carbono y el dióxido de carbono fluye continuamente a través de la almohadilla de mosca.
- Puntúa el fenotipo de las moscas anestesiadas e imagina que están usando una cámara a color conectada a un estereomicroscopio fluorescente. Cuente el número de progenies con diferentes fenotipos. Utilice software de procesamiento de imágenes para el postprocesamiento y compilación de imágenes (Figura 2A - 2D).
NOTA: Según la genética mendeliana, se esperan dos tipos de moscas entre las progenies para cada cruce (Figura 1A).
- RNA-Seq (Figura 2E – 2G)
- Recogida de muestras
NOTA: Elija un método de recolección de muestras apropiado de los 3 ejemplos a continuación; Se requieren 3 réplicas para cada tipo de muestra distinto.- Recolección de muestras de cabeza de mosca adulta
- Recolecta 10 moscas hembras adultas vírgenes de la línea de ARNg homocigota. Recolecte 5 moscas macho adultas de la línea heterocigota equilibrada Ubiq-CasRx/CyO. Coloque las moscas hembra y macho recolectadas, que son las moscas parentales, en un vial suplementado con polvo de levadura seca.
- Repita el paso anterior 3 veces para 3 réplicas. Para el grupo de control, use la línea Ubiq-dCasRx/CyO mientras mantiene todo lo demás igual.
- Coloque los viales que contienen las moscas parentales a 26 °C durante 48 horas. Luego retire todas las moscas parentales de cada vial. Luego mantenga los viales a 26 ° C hasta que las progenies emerjan de las pupas.
- Recolecte 10 moscas adultas de 1 día de edad con el fenotipo correcto. Anestesiar las moscas con dióxido de carbono, luego cortar la cabeza de la mosca y colocar las cabezas en un tubo de centrífuga de 1,5 ml sobre hielo seco. Guarde el tubo de la centrífuga a -80 °C. Repita este paso 3 veces para 3 réplicas.
- 17 – 20 horas de recolección de muestras de embriones de 20 horas de edad
- Recolecte de 8 a 10 moscas hembras adultas vírgenes de la línea de ARNg homocigota. Recolecte 4-5 moscas macho adultas de la línea heterocigota equilibrada Ubiq-CasRx / CyO. Coloque las moscas hembra y macho recolectadas, que son las moscas parentales, en un vial suplementado con polvo de levadura seca.
- Repita el paso anterior 3 veces para 3 réplicas. Para el grupo de control, use la línea Ubiq-dCasRx/CyO mientras mantiene todo lo demás igual.
- Coloque los viales que contienen las moscas parentales a 26 °C durante 48 horas.
- Prepare una cámara de recolección de embriones de jugo de uva para cada réplica siguiendo esta receta: 376 ml de agua, 126 ml de jugo de uva, 15 g de agar y 6 g de sacarosa. Coloque el medio en un vaso de precipitados de 1 L y póngalo en el microondas en alto durante 5-6 minutos mientras vigila de cerca los medios en el vaso de precipitados para verificar si aparecen burbujas / espuma. Si es así, detenga el microondas y deje que la burbuja / espuma se asiente. Continúe con el microondas de esta manera hasta que la burbuja se aclare. No se arremolina hasta que todas las burbujas estén claras. Por último, añadir 10 mL de alcohol al 100% y 5 mL de ácido acético. Mezclar bien, luego pipetear el medio en placas de Petri de 35 mm con una pipeta serológica de 25 ml. Cuando el medio se solidifica en la placa de Petri, está listo para su uso.
- Al final de la incubación de 48 horas, transfiera las moscas parentales a las cámaras de recolección de embriones de jugo de uva y las incubó a 26 ° C durante 3 h. Luego retire las moscas adultas mientras mantiene los embriones recién colocados en las placas de jugo de uva durante otras 17 h a 26 ° C.
- Después de la incubación, recoja los 50 a 100 embriones de las placas de jugo de uva, limpie la superficie del embrión sumergiéndolos en agua desionizada, luego transfiéralos a un tubo de centrífuga de 1.5 ml en hielo. Guárdelos a -80 °C. Repita este paso 3 veces para 3 réplicas.
- Primera recogida de muestras de larvas instar
- Recolecte de 8 a 10 moscas hembras adultas vírgenes de la línea de ARNg homocigota. Recolecte 4-5 moscas macho adultas de la línea heterocigota equilibrada Ubiq-CasRx / CyO. Coloque las moscas hembra y macho recolectadas, que son las moscas parentales, en un vial suplementado con polvo de levadura seca. Repita este paso 3 veces para 3 réplicas. Para el grupo de control, use la línea Ubiq-dCasRx/CyO mientras mantiene todo lo demás igual.
- Coloque los viales que contienen las moscas parentales a 26 °C durante 48 horas. Luego transfiera las moscas adultas a otro nuevo vial de alimento regular para la incubación nocturna (16 h) a 26 ° C. Luego, retire las moscas adultas.
- Mantenga el vial que contiene el embrión a 26 °C durante 24 h, luego puntúe las primeras larvas transheterocigotas bajo el microscopio utilizando marcadores distintos basados. Recoger 15-30 larvas con fenotipos correctos y ponerlas en un tubo centrífugo de 1,5 ml y almacenarlas a -80 °C. Repita este paso 3 veces para 3 réplicas.
- Recolección de muestras de cabeza de mosca adulta
- Secuenciación
- Extracción de ARN: utilice un kit de extracción de ARN disponible comercialmente y siga las instrucciones del kit para procesar todas las muestras. Luego, incube las muestras de ARN extraídas con desoxirribonucleasa disponibles comercialmente y siga sus instrucciones para eliminar cualquier ADN contaminante de las muestras.
- Mida la concentración de ARN utilizando el espectrofotómetro UV-vis disponible en el mercado. Mida la integridad del ARN en las muestras utilizando la configuración del ensayo de integridad del ARN disponible en el mercado.
- Construya las bibliotecas de ARN-seq utilizando el kit de preparación de la biblioteca de ARN disponible comercialmente.
- Utilice el servicio de secuenciación externa para la secuenciación de bibliotecas con la siguiente configuración: modo de lectura única; longitud de lectura: 50nt, profundidad: 20 millones de lecturas por biblioteca. Realice llamadas base con RTA 1.18.64 y luego convierta los datos a FASTQ usando bcl2fastq 1.8.4.
NOTA: Los datos de secuenciación en bruto se pueden encontrar en el Archivo leído de secuenciación de información del Centro Nacional de Información Biotecnológica (ID de presentación: SUB6818910 [BioProyecto: PRJNA600654]).
- Bioinformática
- El mapa lee los datos de secuenciación de la versión 6 del genoma de Drosophila melanogaster del Proyecto del Genoma de Berkeley Drosophila (número de acceso de GenBank: GCA_000001215.4) y las secuencias exógenas CasRx y GFP utilizando la configuración de parámetros predeterminada del alineador STAR28 con la adición de la opción de filtro "-outFilterType BySJout" y el Drosophila_melanogaster "-sjdbGTFfile". BDGP6.22.97.gtf" archivo de formato de transferencia de genes de ENSEMBL.
- Determine los recuentos de transcripciones sin procesar para cada transcripción anotada con la función Counts35 utilizando las opciones "-t exon -g gene_id -M -O --fraction". Luego, normalice los recuentos de transcripciones sin procesar utilizando los recuentos totales de transcripciones utilizando el script Perl "addTpmFpkmToFeatureCounts.pl".
- Utilice el método de máximo a posteriori con el estimador de contracción original en la tubería DESeq2 para estimar el cambio de pliegue logarítmico (LFC) de las transcripciones de cada gen.
- Recogida de muestras
2. Orientación ubicua de ARN exógeno in vivo utilizando un sistema CasRx de tres componentes
- Generación de vector de expresión ubicua objetivo exógeno
- La PCR amplifica el fragmento promotor de Ubiq utilizando cebadores 1052B. C1 y 1052B. C2 y el plásmido Addgene #112686 26. A continuación, la PCR amplifica el fragmento T2A-eGFP amplificado a partir del plásmido Addgene #112686 con cebadores 908A.1 y 908A.2 (Tabla 1)26. Luego, la PCR amplifica el fragmento promotor de Ubiq como secuencia invertida utilizando el plásmido Addgene #112686 con cebadores 908A.3 y 908A.4 (Tabla 1)26. Purificar en gel el fragmento promotor de Ubiq, el fragmento de T2A-eGFP y el fragmento de promotor de Ubiq invertido utilizando un kit de purificación de gel.
- Solicite una secuencia de codificación de luciferasa de luciérnaga personalizada y un fragmento personalizado que contenga un fragmento p10 3'UTR, renilla luciferasa invertida seguida de un fragmento SV40 3'UTR.
- Digest Addgene plasmid #112688 con la enzima de restricción AscI y XbaI24. En los productos resultantes, purificar en gel los fragmentos más grandes utilizando el kit de purificación de gel, que se denomina columna vertebral del vector base.
- Utilice el método de ensamblaje de Gibson para ensamblar el vector base con la columna vertebral del vector base y los siguientes fragmentos: fragmento promotor de Ubiq, el fragmento T2A-eGFP, el fragmento promotor de Ubiq invertido, la secuencia codificante luciferasa de luciérnaga y la renilla luciferasa invertida seguida de un fragmento SV40 3'UTR25.
NOTA: El ID de Addgene del vector de expresión de doble luciferasa resultante (OA-1052B) es #132426.
- Generación del vector de expresión de ARNb
- La PCR amplifica la secuencia promotora U6:3 utilizando cebadores 1043.C1 y 1043.C23 y el plásmido Addgene #112688 (Tabla 1)26. Purificar en gel los fragmentos amplificados de U6:3 utilizando el kit de purificación de gel.
- Digest Addgene plasmid #112688 con enzima de restricción AscI y XbaI24. En los productos resultantes, purificar en gel los fragmentos más grandes, lo que se denomina columna vertebral del vector pre-base, utilizando el kit de purificación de gel.
- Ensamblar el vector base con la columna vertebral vectorial prebase y el fragmento U6:3 utilizando el método de ensamblaje gibson25. El vector base a continuación se denomina OA-1043.
- Sintetizar el fragmento de ARNg del gen objetivo utilizando el servicio externo de síntesis de genes.
- Digerir el vector base OA-1043 con la enzima de restricción PstI y NotI24. Mantenga todo el producto de digestión, que se llama digestión OA-1043.
- Ensamblar el vector de expresión de ARNg con el OA-1043 digerido y el fragmento de ARNg del gen objetivo utilizando el método de ensamblaje de Gibson25.
NOTA: El ID de Addgene del plásmido resultante (OA-1052K) es #132422.
- Generación de moscas transgénicas
- Inyecte el vector OA-1052B en embriones de mosca utilizando embriones de moscas que contienen el sitio de integración ØC31 en el 3er cromosoma, número de stock de mosca BDSC 9744, a través del servicio externo de inyección de embriones de mosca. Del mismo modo, inyecte el vector OA-1052K en embriones de mosca utilizando embriones de moscas que contienen el sitio de integración ØC31 en el 3er cromosoma, número de mosca BDSC 8622. Trasera los embriones inyectados a 26 °C.
- Mantenga las moscas que expresan la luciferasa dual y las moscas del ARNg como líneas homocigotas; mantener las líneas Ubiq-CasRx como líneas heterocigotas de doble equilibrio cruzando la línea heterocigota Ubiq-CasRx de un solo equilibrio generada en la sección 1 para equilibrar las líneas que llevan el cromosoma equilibrador TM6 con marcador de rastrojo (Stb) y retener solo las progenies de doble equilibrio con alas rizadas de ojos blancos y fenotipos fluorescentes dsRed simultáneamente.
NOTA: Los números de stock de moscas BDSC son: #84127 (Ubiq-Fluc-Rluc), #84125 (gRNAFluc).
- Genética de moscas (Figura 1B y Figura 3A)
- Recolecte de 8 a 10 moscas hembras adultas vírgenes de la línea que expresa la luciferasa dual. Recolectar 4-5 moscas macho adultas del heterocigoto equilibrado Ubiq-CasRx/CyO; +/TM6, línea Stb que muestra alas rizadas de ojos blancos y fluorescencia dsRed simultáneamente. Coloque las moscas hembra y macho recolectadas, que son las moscas parentales, en un vial suplementado con polvo de levadura seca (en adelante llamado Paso 1 Cruz).
- Repita el paso anterior 3 veces para 3 réplicas. Para el grupo de control, utilice ubiq-dCasRx/CyO; +/TM6, línea Stb manteniendo todo lo demás igual.
- Coloque en la parte trasera los viales cruzados del Paso 1 que contienen las moscas parentales a 26 °C durante 48 horas. Luego retire todas las moscas parentales de cada vial. A continuación, mantenga los viales a 26 °C durante al menos 14 días. Durante este tiempo, recolecte de 8 a 10 vírgenes hembras de la línea de ARNg homocigota dirigida a la luciferasa. Repita este paso 3 veces para 3 réplicas.
- Observe los viales de Step 1 Cross todos los días para ver si surge alguna nueva mosca adulta de las pupas. Si es así, anestesiarlos con dióxido de carbono, recolectar 5 moscas macho que expresen tanto el Ubiq-CasRx (o Ubiq-dCasRx) como el reportero de luciferasa dual de las progenies y ponerlos en un nuevo vial junto con 10 hembras vírgenes de la línea de ARNg dirigida a la luciferasa luciérnaga (en adelante llamada Paso 2 Cruz). Repita este paso 3 veces para 3 réplicas.
- Recoja a otro macho de 5 años de edad que exprese tanto el Ubiq-CasRx (o Ubiq-dCasRx) como el reportero de luciferasa dual de los viales de Step 1 Cross e incube durante 2 a 4 días a 26 ° C. Luego, transfiéralos a un tubo centrífugo de 1,5 ml y guárdelos a -80 °C. Repita este paso 3 veces para tres réplicas.
- Coloque los viales de Step 2 Cross que contienen las moscas parentales a 26 °C durante 48 horas. Luego retire todas las moscas parentales de cada vial. A continuación, mantenga los viales a 26 °C durante al menos 20 días.
- Observe los viales de Step 2 Cross todos los días para ver si surgieron nuevas progenies adultas de las pupas. Si es así, anestesiarlos con dióxido de carbono, calificar los fenotipos de las moscas anestesiadas e imaginarlos usando una cámara a color equipada con un estereomicroscopio fluorescente. Cuente el número de progenies con diferentes fenotipos. Utilice software de procesamiento de imágenes para el posprocesamiento y la compilación de imágenes (Figura 3B – 3C).
NOTA: La genética mendeliana sugiere que, si todas las moscas son viables, se esperan 4 tipos de moscas entre las progenies del Paso 2 Cruz, cada una de las cuales representa el 25% de la población (Figura 1B y Figura 3A).
- Ensayo de luciferasa (Figura 3D)
- Genere las moscas transheterocigotas triples, así como las moscas de control repitiendo los pasos 2.4.1-2.4.5. Recoge moscas macho al nacer y envejezca hasta los 3 días de edad.
- Transfiera las moscas de 3 días a tubos centrífugos de 1,5 ml y lisarlos usando un mortero y el tampón de lisis luciferasa del kit de ensayo de luciferasa disponible comercialmente.
- Utilice 5 μL de tejido lisado de cada muestra para medir la actividad de la luciérnaga y la renilla luciferasa utilizando el kit de ensayo de luciferasa disponible comercialmente y el luminómetro.
3. Orientación de ARN in vivo específica del tejido mediante un sistema CasRx de tres componentes
- Generación del vector de expresión UASt-CasRx y UASt-dCasRx
- La PCR amplifica la secuencia promotora de UASt utilizando el plásmido pJFRC81 y los cebadores 1041.C9 y 1041.C11; luego, la PCR amplifica el fragmento de CasRx utilizando el plásmido OA-1050E (Addgene ID #132416) y cebadores 1050L. C1 y 1050E. C4; y luego pcrificar fragmentos de dCasRx usando plásmido OA-1050R (Addgene ID #132417) y cebadores 1050L. C1 y 1050E. C4 (Cuadro 1)26. Purificar en gel la secuencia amplificada del promotor UASt, CasRx y los fragmentos dCasRx utilizando el kit de purificación de gel.
- Vector base de digestión (plásmido Addgene #112686) con enzimas de restricción NotI y PacI24. En los productos resultantes, purificar en gel el fragmento más grande, que se llama columna vertebral del vector base, utilizando el kit de purificación de gel.
- Ensamblar el vector UASt-CasRx con la columna vertebral del vector base, la secuencia promotora UASt y el fragmento CasRx utilizando el ensamblaje Gibson; a continuación, ensamble el vector UASt-dCasRx con la columna vertebral del vector base, la secuencia promotora UASt y el fragmento dCasRx utilizando el método de ensamblaje Gibson25.
NOTA: El vector UASt-CasRx es el plásmido Addgene #132418, y el vector UASt-dCasRx es el plásmido Addgene #132419
- Generación de moscas transgénicas
- Inyectar el vector UASt-CasRx en embriones de mosca utilizando el servicio de inyección de embriones de mosca y embriones de moscas ØC31 sitio de integración 8621 en sus 2º cromosomas; luego inyectar el vector UASt-dCasRx en embriones de mosca utilizando el servicio de inyección de embriones de mosca y embriones de moscas ØC31 sitio de integración 8621 en sus 2º cromosomas. Trasera los embriones inyectados a 26 °C.
- Mantenga las moscas como líneas heterocigotas doblemente equilibradas con marcadores CyO y Sb. NOTA: Los ID de las líneas de vuelo en BDSC son 84121 (UASt-CasRx) y 84120 (UASt-dCasRx).
- Genética de moscas (Figura 1C)
- Ordene las líneas GAL4 deseadas de BDSC; Obtenga líneas de ARNg relevantes del paso 3.2.2 (o de BDSC).
NOTA: Se utilizaron las siguientes 2 moscas GAL4 de BDSC: GAL4-GMR (BDSC ID: #29967), GAL4-y (BDSC ID: #44373). Se utilizaron las mismas 3 líneas de gRNA generadas en la primera sección: gRNAw (BDSC ID: #84124), gRNAN (BDSC ID #84122), gRNAy(BDSC ID: #84123). - Recolecte de 5 a 10 moscas hembras adultas vírgenes de la línea de ARNg. Recolectar 2-4 moscas macho adultas del heterocigoto doble equilibrado UASt-CasRx/CyO; +/TM6, línea Sb que muestra alas rizadas de ojos blancos y fluorescencia dsRed simultáneamente. Coloque las moscas hembra y macho recolectadas, que son las moscas parentales, en un vial de alimento regular (en adelante llamado Paso 1 Cruz). Repita este paso 3 veces para 3 réplicas. Para el grupo de control, utilice el UASt-dCasRx/CyO; +/TM6, línea Sb manteniendo todo lo demás igual.
- Coloque en la parte trasera los viales cruzados del Paso 1 que contienen las moscas parentales a 26 °C durante 48 horas. Luego retire todas las moscas parentales de cada vial. A continuación, mantenga los viales a 26 °C durante al menos 14 días. Durante este tiempo, recoja de 5 a 10 mujeres vírgenes de la línea GAL4. Repita este paso 3 veces para 3 réplicas.
- Observe los viales de Step 1 Cross todos los días para ver si surge alguna nueva mosca adulta de las pupas. Si es así, anestesiarlos con dióxido de carbono, recolectar 2-4 moscas macho que expresan tanto el UASt-CasRx (o UASt-dCasRx) como el vector gRNA de las progenies que simultáneamente tienen fenotipos dsRed-fluorescente y rastrojo. Coloque los machos recolectados del Paso 1 Cross en un nuevo vial junto con 5-10 hembras vírgenes recolectadas de la línea GAL4 (en adelante llamada Step 2 Cross). Repita este paso 3 veces para 3 réplicas.
- Coloque los viales de Step 2 Cross que contienen las moscas parentales a 26 °C durante 48 horas. Luego retire todas las moscas parentales de cada vial. A continuación, mantenga los viales a 26 °C durante al menos 20 días.
- Observe los viales de Step 2 Cross todos los días para ver si surge alguna nueva mosca adulta de las pupas. Si es así, anestesiarlos con dióxido de carbono, calificar los fenotipos de las moscas anestesiadas e imaginarlos usando una cámara a color equipada con un estereomicroscopio fluorescente. Cuente el número de progenies con diferentes fenotipos. Utilice software de procesamiento de imágenes para el posprocesamiento y la compilación de imágenes (Figura 4).
NOTA: La genética mendeliana sugiere que, si todas las moscas son viables, se esperan 4 tipos de moscas entre las progenies del Paso 2 Cruz, cada una de las cuales representa el 25% de la población (Figura 1C).
- Ordene las líneas GAL4 deseadas de BDSC; Obtenga líneas de ARNg relevantes del paso 3.2.2 (o de BDSC).
Resultados
Orientación ubicua de ARN in vivo mediante un sistema CasRx de dos componentes
Las moscas transheterocigotas F1 que expresan las construcciones Ubiq-CasRx y gRNA (dirigidas a genes endógenos y exógenos) mostraron fenotipos marcados en comparación con las moscas de control que expresan las construcciones Ubiq-dCasRx y gRNA (Figura 2 y Figura 4). Específicamente, las moscas transheterocigotas CasRx tienen niveles significativamente más bajos de tasa de supervivencia en comparación con las moscas transheterozgyous dCasRx, lo que indica toxicidad del sistema Ubiq-CasRx (Figura 2A y Figura 4A). Vale la pena señalar que tanto las moscas transheterocigotas CasRx como dCasRx tienen una tasa de herencia inferior al 50%, que es la proporción esperada basada en la genética mendeliana. De los tres genes diana, el Ubiq-CasRx/+; U6-gRNAN/+ moscas y Ubiq-CasRx/+; Las moscas U6-gRNAy/+ no son viables (0% de herencia) y no crecieron más allá de la segunda etapa de larvas instar (Figura 2A-2B). El Ubiq-CasRx/+sobreviviente; Las moscas U6-gRNAw/+, cuya herencia fue del 12,9%, mostraron un fenotipo distintivo de ojos blancos totalmente penetrante (Figura 2B). Además de los rasgos observables asociados con CasRx, pudimos confirmar una reducción significativa de las transcripciones de genes diana para 3 genes diana: Notch, amarillo y GFP (Figura 2E-2G). Se observó una reducción de las transcripciones de genes blancos en las moscas Ubiq-CasRx/+, U6-gRNAw/+, en comparación con las moscas de control Ubiq-dCasRx/+, U6-gRNAw/+, aunque la reducción no fue estadísticamente significativa (Figura 2E - 2F). Se encontró evidencia de actividad fuera del objetivo inducida por CasRx al comparar las transcripciones expresadas diferencialmente entre muestras de moscas que expresan CasRx y muestras de moscas que expresan dCasRx (Figura 2E, 2G). El número de transcripciones no objetivo expresadas significativamente de manera diferencial son las siguientes: blanco, 253 (1,4% del total de transcripciones); Notch, 300 (1,7%); amarillo, 41 (0,23%); GFP, 5.880 (33%) (Figura 2G).. Del total de 17.779 transcripciones diferentes, 6 transcripciones no objetivo se expresaron significativamente de manera diferencial en los 4 grupos de muestras. Una de las 6 transcripciones identificadas fue Gadd45, un gen involucrado en la apoptosis y la detención celular en moscas, lo que plantea la posibilidad de que la acción enzimática de CasRx pueda desencadenar directamente la apoptosis celular o desencadenar indirectamente la mala expresión de otros genes, lo que a su vez conduce a la apoptosis. Finalmente, vale la pena señalar que las moscas Ubiq-CasRx y Ubiq-dCasRx no se establecieron como poblaciones homocigotas, presumiblemente debido a la toxicidad conferida por la alta expresión ubicua. Como resultado, se utilizaron moscas heterocigotas Ubiq-CasRx/CyO y Ubiq-dCasRx/CyO para cruzar con líneas de moscas homocigotas de ARNg. En resumen, el sistema Ubiq-CasRx de dos componentes es capaz de lograr una orientación ubicua de ARN para objetivos endógenos y exógenos, lo que resulta en fenotipos observables y reducción de la transcripción. Estos resultados también mostraron que la orientación de ARN mediado por CasRx puede introducir toxicidad in vivo.
Orientación ubicua de ARN exógeno in vivo utilizando un sistema CasRx de tres componentes
Los resultados de la cruz de dos pasos mostraron que a pesar de la naturaleza exógena del gen diana (es decir, Fluc), la expresión de los tres transgenes en los transheterocigotos triples F2 (Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) dio como resultado una letalidad del 100% en comparación con los cruces de control que involucran Ubiq-dCasRx, donde no se observó letalidad en los transheterocigotos triples F2 (Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) (Figura 3B-C ). Más específicamente, solo la combinación de los tres transgenes (Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) resultó en una letalidad del 100% (Figura 3B y D), mientras que (Ubiq-CasRx/+; gRNAFluc/TM6) y (Ubiq-CasRx/+; Los genotipos Ubiq-Fluc-Ubiq-Rluc/TM6) eran viables y carecían de fenotipos con sus tasas de herencia que coincidían con las tasas de transmisión mendelianas esperadas, lo que sugiere que la disponibilidad de la secuencia objetivo (es decir, luciferasa luciérnaga) en combinación con Ubiq-CasRx/+ y gRNAFluc es lo que resultó en los fenotipos de letalidad observados, presumiblemente derivados de la actividad colateral de las enzimas Cas132,8 . Además, no hay fenotipos distinguibles ni influencia dramática sobre la herencia en transheterocigotos F1 (Ubiq-CasRx/+; gRNAFluc/+ o Ubiq-CasRx/+; Se observaron ubiq-fluc-ubiq-Rluc/+) en comparación con los controles Ubiq-dCasRx (Ubiq-dCasRx/+; gRNAFluc/+ o Ubiq-dCasRx/+; Ubiq-Fluc-Ubiq-Rluc/+) (Figura 3B), indicando que una enzima catalíticamente activa es esencial para obtener los fenotipos de letalidad observados. Además, los niveles de expresión de Fluc y Rluc en moscas de todos los genotipos viables no mostraron una reducción significativa en la expresión de Fluc en los transheterocigotos triples ubiq-dCasRx (Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) en comparación con los controles reporteros de luciferasa dual. Esto sugiere que los niveles de expresión de la proteína Fluc no se redujeron mediante la orientación de dCasRx (Figura 3D). Tomados en conjunto, el fenotipo de letalidad común en los dos diferentes experimentos de orientación de ARN ubicuo mediados por CasRx indica que cuando se usa en tejidos de manera ubicua, la orientación de ARN mediado por CasRx puede ser tóxica para el organismo.
Segmentación de ARN in vivo específica del tejido mediante un sistema CasRx de tres componentes
El alto nivel de toxicidad observado en los experimentos de orientación de ARN ubicuo nos llevó a explorar la orientación de ARN específica del tejido utilizando un diseño de sistema CasRx de tres componentes detallado en la sección de métodos. De hecho, el nivel de toxicidad observado se redujo cuando la expresión general de CasRx se redujo utilizando el promotor UASt en comparación con el del promotor Ubiq, esto se ejemplifica en tres aspectos: 1) las líneas UASt-CasRx y UASt-dCasRx se mantuvieron como líneas homocigotas, aunque en base al esquema cruzado de dos pasos se utilizaron líneas uast-CasRx y UASt-dCasRx doblemente equilibradas para realizar los cruces, 2) todas las tasas de herencia transheterocigota triple dCasRx de la generación F2 coincidieron con la tasa de herencia mendeliana esperada del 25%, y 3) el fenotipo de letalidad transheterocigota triple CasRx de la generación F2 se redujo moderadamente. En el experimento de focalización blanca, de las tasas de herencia mendelianas del 25% esperadas en los transheterocigotos triples F2, solo se observaron un 0,57% de moscas adultas viables (UASt-CasRx/+; gRNAw/GMR-Gal4), todas las cuales mostraron fenotipos severos de pigmentación y morfología específica del ojo (Figura 4A y 4B). Para el cruce de blancos, la tasa de herencia F2 transheterocigota triple que expresa CasRx fue significativamente menor que la del grupo de control de triple transheterocigoto que expresa dCasRx (27,6%) (Figura 4A). En el experimento de focalización Notch, los tranheterocigotos triples que expresan CasRx que transportan los tres transgenes fueron 100% letales, mientras que la tasa de herencia de control de dCasRx fue del 29,3% (Figura 4A). En el experimento de focalización amarilla, F2 triple transheterocigoto que expresa CasRx, gRNAy e y-GAL4 mostró una reducción marginal del pigmento de quitina como pequeños parches de cutícula amarilla en el tórax y el abdomen con una tasa de herencia del 2,67%, mucho menor que la del grupo de control dCasRx (25,2%) (Figura 4A ). Todas las moscas transheterocigotas triples de control dCasRx no presentaron fenotipos obvios como las moscas que expresan CasRx, lo que indica que la actividad catalítica de CasRx contribuyó a los fenotipos observados. La baja tasa de herencia en el grupo transheterocigoto triple de CasRx sugirió que existen dos fuentes de toxicidad en la orientación de ARN de CasRx: una está asociada con una alta expresión de CasRx, cuya toxicidad se redujo por la expresión restrictiva de CasRx, la otra está asociada con la actividad colateral. Tomados en conjunto, estos resultados mostraron que el sistema CasRx puede lograr la orientación de ARN in vivo específica del tejido al aprovechar el sistema clásico Gal4 / UASt y, mientras tanto, reducir la toxicidad. Sin embargo, los fenotipos de toxicidad y letalidad ocasional todavía se observaron en un nivel de gravedad más bajo en comparación con el de los enfoques ubicuos, lo que indica que la actividad de escisión colateral se asocia con toxicidad.
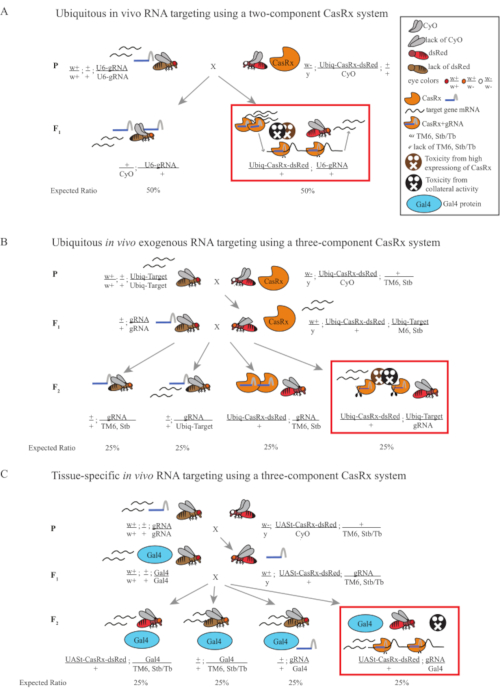
Figura 1: Descripción general de la orientación de ARN utilizando un sistema Cas13D. (A) Esquemas del cruce genético de un solo paso en la orientación ubicua de ARN in vivo utilizando un sistema CasRx de dos componentes. (B) Esquemas de un cruce genético de dos pasos en la omnipresente orientación de ARN exógeno in vivo utilizando el sistema CasRx de tres componentes. (C) Esquemas de un cruce genético de dos pasos en la orientación de ARN in vivo específico del tejido utilizando un sistema CasRx de tres componentes. Haga clic aquí para ver una versión más grande de esta figura.
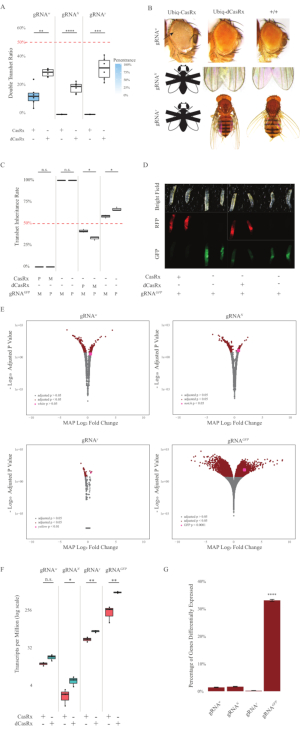
Figura 2: Orientación ubicua de ARN in vivo utilizando un sistema CasRx de dos componentes (reimpreso5). (A) Porcentajes de herencia total de moscas transheterocigotas que heredan Ubiq-CasRx (o Ubiq-dCasRx) y gRNAs. El sombreado azul en el diagrama de caja indica la penetrancia del fenotipo. (B) Fenotipos de moscas transheterocigotas. Las flechas indican necrosis tisular en el ojo. La mosca blanca y negra marcada con ''X'' representa la letalidad. (C) Porcentajes de herencia total de moscas transheterocigotas de cruces bidireccionales entre ubiq-CasRx (o Ubiq-dCasRx) y moscas gRNAGFP-OpIE2-GFP. M, herencia materna de CasRx; P, herencia paterna de CasRx. (D) Larvas F1 progenies en la cruz paterna. (E) Estimaciones máximas a posteriori de las transcripciones para el cambio del pliegue logarítmico. Se utilizó la tubería DESeq2. (F) Transcripciones por millón (TPM) dirigidas con CasRx o dCasRx. (G) Porcentaje de transcripciones expresadas diferencialmente por CasRx-depentent de transcripciones. Haga clic aquí para ver una versión más grande de esta figura.
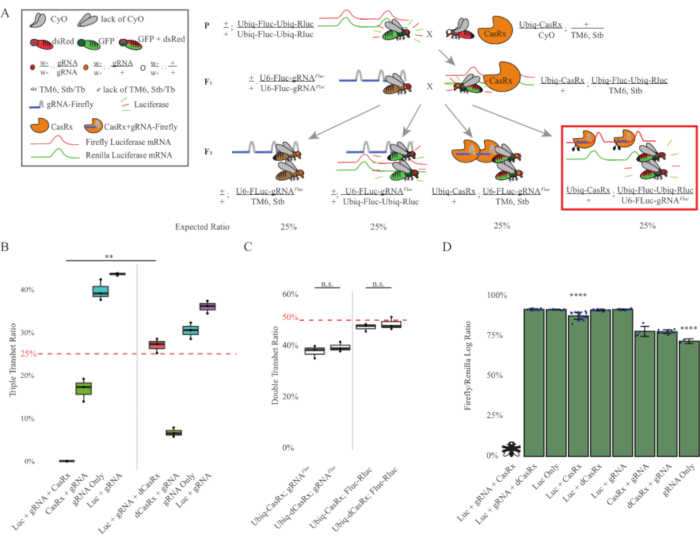
Figura 3: Orientación ubicua de ARN exógeno in vivo utilizando un sistema CasRx de tres componentes. (A) Esquemas del cruce genético de dos pasos. (B) Porcentajes de herencia total para todos los genotipos emergentes en la generación F2 . La herencia de los tres transgenes (Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc y gRNAFLuc) en la progenie F2 resultó en una letalidad del 100% y fue significativamente menor en comparación con el grupo de control de transheterocigotos triples ubiq-dCasRx (p = 0,001, prueba t). (C) Llevar Ubiq-CasRx/gRNAFluc solo o Ubiq-CasRx y Ubiq-Fluc-Ubiq-Rluc solo no condujo a una letalidad grave, y las relaciones de herencia entre los transheterocigotos Ubiq-CasRx y Ubiq-dCasRx no fueron significativamente diferentes (p = 0,41 y p = 0,51, respectivamente, prueba t). (D) Proporciones de luciferasa normalizando las lecturas de Fluc a las lecturas de Rluc. Las moscas transheterocigotas triples que expresaban Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc, gRNAFLuc eran letales embrionarias, que estaban representadas por una mosca con una "X", y como resultado no se midió la expresión de luciferasa. La relación Fluc/Rluc de Ubiq-CasRx/+, Ubiq-Fluc-Ubiq-Rluc/TM6, Stb transheterocigotos fue significativamente menor que la de los otros grupos que expresan Ubiq-Fluc-Ubiq-Rluc (p = 1.2e-06 o inferior, prueba t). Los resultados del grupo de solo gRNAFLuc fueron significativamente más bajos que los de todos los demás grupos (p = 1.2e-06 o menos, prueba t). Haga clic aquí para ver una versión más grande de esta figura.
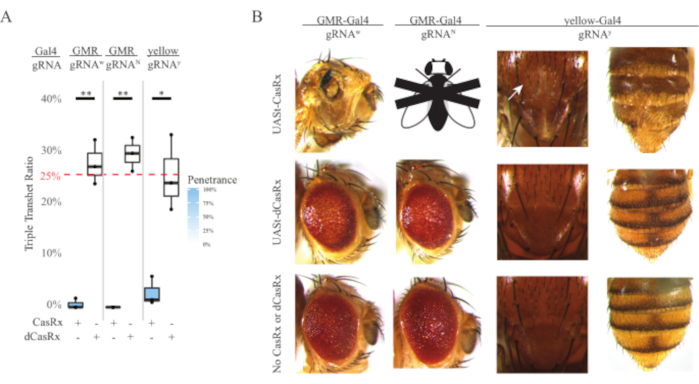
Figura 4: Orientación de ARN in vivo específico de tejido utilizando un sistema CasRx de tres componentes (reimpreso5). (A) Porcentaje de herencia total de moscas transheterocigotas triples portadoras de tres transgenes (UASt-CasRx o UASt-dCasRx, gRNAs y Gal4-driver. (B) Fenotipos de las moscas transheterocigotas triples. La flecha blanca indica la reducción del pigmento de quitina en el tórax. La mosca blanca y negra marcada con ''X'' representa la letalidad. Haga clic aquí para ver una versión más grande de esta figura.
| Construir | Descripción | Cebador | Secuencia de imprimación (5' a 3') | Plantilla PCR |
| OA-1050E | CasRx | 1050E. C3 | TACTAATTTTCCAC ATCTCTATTTTGAC CCGCAGATTAATTA ATGAGCCCCAAGA AGAA | pNLS-RfxCas13d-NLS-HA (pCasRx) |
| 1050E. C4 | CAATTGATTTGTTA TTTTAAAAACGATT CATTCTAGCTAGCT TAAGCGTAATCTGG AACA | |||
| OA-1050R | dCasRx | 1050E. C3 | TACTAATTTTCCAC ATCTCTATTTTGAC CCGCAGATTAATTA ATGAGCCCCAAGA AGAA | pNLS-dRfxCas13d-NLS-HA (pdCasRx) |
| 1050E. C4 | CAATTGATTTGTTA TTTTAAAAACGATT CATTCTAGCTAGCT TAAGCGTAATCTG GAACA | |||
| OA-1050L | Promotor UASt | 1041.C9 | GCGGGTTCTCGA CGGTCACGGCGG GCATGTCGACGC GGCCGCAACCAA CAACACTAGTAG | pJFRC81 |
| 1041.C11 | CTGGCCTCCACC TTTCTCTTCTTCT TGGGGCTCATGT TTAAACCCAATT CCCTATTCAGA | |||
| CasRx | 1050L. C1 | AATACAAGAAGA GAACTCTGAATA GGGAATTGGGT TTAAACATGAGC CCCAAGAAGAA | pCasRx | |
| 1050E. C4 | CAATTGATTTGT TATTTTAAAAAC GATTCATTCTA GCTAGCTTAAG CGTAATCTGGA ACA | |||
| OA-1050S | Promotor UASt | 1041.C9 | GCGGGTTCTC GACGGTCACG GCGGGCATGT CGACGCGGCC GCAACCAACAA CACTAGTAG | pJFRC81 |
| 1041.C11 | CTGGCCTCCA CCTTTCTCTTC TTCTTGGGGCT CATGTTTAAAC CCAATTCCCTA TTCAGA | |||
| dCasRx | 1050L. C1 | AATACAAGAAG AGAACTCTGAAT AGGGAATTGGG TTTAAACATGAG CCCCAAGAAGAA | pdCasRx | |
| 1050E. C4 | CAATTGATTTGT TATTTTAAAAAC GATTCATTCTAG CTAGCTTAAGCG TAATCTGGAACA | |||
| OA-1043 | Promotor U6:3 | 1043.C1 | GGGAATTGGGA ATTGGGCAATAT TTAAATGGCGGC GCGCCGAATTCT TTTTTGCTCACCT | Plásmido Addgene #164586 |
| 1043.C23 | ACACTAGTGGAT CTCTAGAGGTAC CGTTGCGGCCG CAAAAAAGTTGT AATAGCCCCTCA AAACTGGACCTT CCACAACTGCAG CCGACGTTAAAT TGAAA | |||
| OA-1052B | Promotor Ubiq | Artículo 1052B. C1 | GGGAATTGGGCA ATATTTAAATGGC GGCTGCAGCGC GCAGATCGCCGAT | Plásmido Addgene #112686 |
| Artículo 1052B. C2 | TTTCTTTATGTTT TTGGCGTCTTCC ATCCTAGGTCTG CGGGTCAAAATA GAGATG | |||
| T2A-eGFP | 908A1 | ATAAAGGCCAAG AAGGGCGGAAA GATCGCCGTGG AGGGCAGAGGA AGTCTTCTAACAT GC | Plásmido Addgene #112686 | |
| 908A2 | TTGTTATTTTAAAA ACGATTCATTCTA GGCGATCGCTTA CTTGTACAGCTC GTCCATGCC | |||
| Promotor ubiq invertido | 908A3 | ACCGTGACCTAC ATCGTCGACACTA GTGGATCTCTAGA CGCGCAGATCGC CGATG | Plásmido Addgene #112686 | |
| 908A4 | GGATCATAAACTT TCGAAGTCATGC GGCCGCTCTGCG GGTCAAAATAGAG ATGT |
Tabla 1: Lista de constructos moleculares y cebadores utilizados en este estudio. Esta lista incluye todas las construcciones (tanto el ID como la descripción) y los cebadores asociados de cada constructo (tanto el ID como las secuencias (5' a 3')) y las plantillas utilizadas.
Discusión
Con tres diseños de aplicación diferentes del sistema CasRx, este trabajo demostró in vivo la orientación de ARN programable en moscas. Las diferentes estrategias satisfacen las diferentes necesidades del proyecto, como la orientación génica endógena versus exógena y la orientación ubicua versus específica del TEJIDO. Los efectos de la orientación del ARN incluyeron cambios fenotípicos específicos del gen objetivo, reducción de la transcripción del ARN objetivo y fenotipos de letalidad ocasionales asociados con la alta expresión de la proteína CasRx y la actividad colateral. En general, estos resultados mostraron que el sistema CasRx es capaz de apuntar a la reducción de la transcripción de ARN a nivel del organismo de una manera programable y eficiente.
Uno de los factores clave en la personalización exitosa del sistema CasRx es el diseño de gRNAs. Específicamente, se prestarán atención a los siguientes consejos: la secuencia objetivo tiene una longitud de alrededor de 30 nucleótidos, la longitud de los estiramientos poli-U en la secuencia objetivo es de 4 pares de bases o menos, el contenido de GC de la secuencia objetivo está en el rango del 30% al 70%, no se predice que la secuencia objetivo forme estructuras de horquilla de ARN fuertes y la secuencia objetivo contiene una estructura secundaria o terciaria mínima de ARN predicha5.
Además de los diseños de ARNg, el paso de genética de moscas en cada protocolo también es crítico en una implementación exitosa. La presencia o falta de los fenotipos definidos transmitidos por los padres en las progenies son importantes para identificar y cuantificar los fenotipos inducidos por el sistema CasRx en las progenies transheterocigotas. Además, la configuración de cruces de control utilizando las moscas dCasRx en paralelo también es útil para descartar fenotipos no específicos en las progenies transheterocigotas.
Vale la pena señalar que estos resultados revelaron el problema de toxicidad introducido por la expresión ubicua de casRx y la proteína dCasRx en la mosca, una limitación del sistema CasRx. La expresión ubicua de CasRx o dCasRx bajo el promotor Ubiq solo, sin gRNAs, vino con costos de aptitud no triviales, ya que ni ubiq-CasRx ni ubiq-dCasRx volaron como líneas homocigotas. Por el contrario, las moscas UASt-CasRx y UASt-dCasRx pueden establecerse como poblaciones homocigotas sanas, aunque debido al diseño del esquema cruzado se mantuvieron como poblaciones de doble equilibrio, un hecho que respalda la existencia de toxicidad inducida por la expresión ubicua de la proteína CasRx. Otra evidencia de apoyo es que en experimentos de control que involucran dCasRx, que es catalíticamente inactivo, los porcentajes de moscas que llevan construcciones de dCasRx y gRNA del número total de moscas en la generación F1 fueron consistentemente inferiores al 50%, la proporción esperada basada en la genética mendeliana si no había toxicidad asociada a dCasRx. Esto indicó que la expresión ubicua de dCasRx, junto con los gRNAs, induce toxicidad en la mosca, lo que resulta en una relación de herencia inferior a la esperada. Las relaciones de herencia de las moscas transheterocigotas UASt-dCasRx, gRNA, GAL4 siguieron la genética mendeliana, lo que nuevamente sugiere la toxicidad inducida específicamente por la expresión ubicua de las proteínas CasRx y dCasRx. La toxicidad en el sistema CRISPR/Cas no es nueva. Se ha demostrado que altas cantidades de proteína Cas9 son tóxicas en varios organismos, incluidas las moscas29,30,31,32. Un estudio reciente ha desarrollado un sistema GAL4/UAS personalizado que puede ajustar la cantidad de proteína Cas9 expresada en moscas mediante la adición de un marco de lectura abierta de longitud variable entre la secuencia UAS y la secuencia Cas9 en la construcción UAS-Cas933. Por lo tanto, vale la pena explorar formas de reducir la toxicidad inducida por CasRx ajustando el nivel de expresión de la proteína CasRx.
Aparte de la toxicidad inducida por la expresión ubicua de las proteínas CasRx y dCasRx, los resultados también mostraron una letalidad vinculada a los efectos colaterales no específicos fuera del objetivo del sistema CasRx, una característica de muchos sistemas CRISPR1,2,7,34. En algunas de las moscas transheterocigotas dobles o triples que expresan gRNA de CasRx y genes no esenciales, por ejemplo, cuando se dirigen a Notch, las moscas transheterocigotas CasRx tienen niveles significativamente más bajos de tasa de supervivencia en comparación con las moscas transheterozgyous dCasRx. En el análisis de ARN-seq de estas moscas transheterocigotas casRx y que expresan ARNg, se observó tanto la reducción de los niveles de transcripción de genes diana como la reducción de transcripciones de genes no objetivo. Estos efectos colaterales fueron dependientes de CasRx y dependientes del objetivo, ya que solo se observaron en moscas transheterocigotas que expresan tanto la proteína CasRx como el ARNg. Vale la pena señalar que uno de los genes objetivo, el blanco, mostró solo una reducción limitada y no estadísticamente significativa en las transcripciones cuando el gen blanco fue atacado por CasRx, lo que contrastaba con el fenotipo de reducción de pigmento claro. Se plantea la hipótesis de que esto puede deberse al hecho de que 1) el momento de la recolección de muestras de ARN-seq no estaba bien alineado con el momento en que el gen blanco alcanza su máxima expresión durante el desarrollo temprano, y 2) la expresión localizada del gen blanco en los ojos hace que sea difícil recolectar los tejidos relevantes durante la fase de desarrollo temprano cuando solo es factible la recolección de muestras de todo el cuerpo. Para reducir la actividad colateral en el sistema CasRx, se requieren estudios futuros para comprender completamente los mecanismos subyacentes al sistema de fenómenos fuera del objetivo a nivel del organismo.
Curiosamente, un estudio reciente35 que describe las herramientas Cas13 dirigidas al ARN en moscas pareció mejorar la toxicidad general asociada con la expresión de CasRx, por varias razones posibles. En primer lugar, los autores recodificaron los transgenes Cas13 para optimizar la expresión en Drosophila y utilizaron un promotor de expresión más débil (actina 5C) en comparación con el promotor de ubiquitina utilizado en el presente estudio, lo que probablemente conduce a niveles más bajos de expresión de Cas13 y, por lo tanto, a una menor toxicidad. De hecho, esto está respaldado por las observaciones de que la expresión de CasRx y dCasRx impulsada por UASt no era, por sí misma, tóxica, ya que este estudio (y los autores en 35) no observaron ninguna letalidad obvia en las moscas UASt-CasRx. Además, estos autores codificaron sus ARNs de manera diferente en comparación con este estudio, lo que puede haber afectado su expresión y reducido la toxicidad del sistema en moscas transheterocigotas Cas13/gRNA. Por ejemplo, en su estudio se expresaron dos ARNg utilizando el promotor U6:3 y flanqueados por ARNt para permitir el procesamiento de ARNg en la maduración del ARNt sin requerir CasRx35. Por el contrario, en este estudio, los gRNAs se codificaron como matrices dirigidas a hasta 4 ubicaciones por gen e imitando la estructura endógena de la matriz Cas13 que se encuentra en las bacterias, que requiere que la enzima Cas13 procese cada gRNA. Estos diferentes enfoques pueden haber llevado a diferencias en los niveles de expresión de ARNg y otros factores que pueden tener efectos inherentes sobre la toxicidad de todo el sistema. Finalmente, Huynh et al. se dirigieron a genes diferentes a los dirigidos en el presente estudio, lo que resulta en diferencias en la interacción objetivo-Cas/gRNA y la actividad colateral y puede tener efectos sobre los niveles observados de letalidad. Estas diferencias en la toxicidad observada justifican una mayor investigación para identificar formas en que se pueden mejorar los sistemas generales.
En general, este estudio es la primera demostración de un sistema Cas funcional codificable programable dirigido a ARN codificado genéticamente en D. melanogaster, aunque se requerirá una mayor optimización del sistema CasRx (en línea con lo que se informa35) para reducir aún más la letalidad asociada fuera del objetivo y aumentar la eficacia de la escisión CasRx en el objetivo. La orientación de ARN con enzimas Cas es un campo en rápida evolución con muchas aplicaciones potenciales que van desde el control de insectos vectores hasta usos terapéuticos1,2,3,4,5,6,7, y este protocolo ofrece un paquete de inicio para cualquier persona interesada en diseñar su primer sistema CasRx en moscas, al tiempo que es compatible con la personalización y la optimización adicional del sistema. Los ejemplos presentados aquí demuestran una gama de resultados que uno puede encontrar durante la implementación de este sistema in vivo y pueden servir como puntos de referencia para otros usuarios en la evaluación del rendimiento del sistema CasRx en sus aplicaciones.
Divulgaciones
O.S.A es fundador de Agragene, Inc., tiene una participación accionaria y forma parte del Consejo Asesor Científico de la compañía. Los términos de este acuerdo han sido revisados y aprobados por la Universidad de California, San Diego de acuerdo con sus políticas de conflicto de intereses. Todos los demás autores no declaran intereses contrapuestos.
Agradecimientos
Este trabajo fue apoyado en parte por la financiación de una subvención del Programa de Genes Seguros de DARPA (HR0011-17-2-0047) y los premios de los NIH (R21RAI149161A, DP2AI152071) otorgados a O.S.A.
Materiales
| Name | Company | Catalog Number | Comments |
| 100% Grape Juice | Welch Foods Inc. | N/A | |
| Active Dry Yeast (908g) | Red Star Yeast Company, LLC | N/A | |
| DMC4500 color camera | Leica Microsystems | DMC4500 | |
| Dual-Luciferase Reporter Assay System | Promega | E1910 | |
| GAL4-GMR flies | Bloomington Drosophila Stock Center | 29967 | |
| GAL4-y flies | Bloomington Drosophila Stock Center | 44373 | |
| Glomax 20/20 Luminometer | Promega | E5331 | |
| Illumina HiSeq2500 Sequencer | Illumina, Inc. | HiSeq2500 | |
| M165FC fluorescent stereomicroscope | Leica Microsystems | M165FC | |
| Nanodrop OneC UV-vis spectrophotometer | ThermoFisher | NDONEC-W | |
| NEBNext Ultra II RNA Library Prep Kit | New England Biolabs, Inc. | E7770 | |
| plasmid # 112686 | Addgene | 112686 | |
| plasmid # 112688 | Addgene | 112688 | |
| plasmid # 132416 | Addgene | 132416 | |
| plasmid # 132417 | Addgene | 132417 | |
| plasmid # 132419 | Addgene | 132419 | |
| plasmid # 132420 | Addgene | 132420 | |
| plasmid # 132421 | Addgene | 132421 | |
| plasmid # 132422 | Addgene | 132422 | |
| plasmid # 132425 | Addgene | 132425 | |
| plasmid # 132426 | Addgene | 132426 | |
| plasmid # 133304 | Addgene | 133304 | |
| plasmid # 164586 | Addgene | 164586 | |
| plasmid #132418 | Addgene | 132418 | |
| plasmid pJFRC81 | Addgene | 36432 | |
| Qiagen RNeasy Mini Kit | Qiagen | 74104 | |
| Restriction endonucleases AscI | New England Biolabs Inc. | R0558L | |
| Restriction endonucleases NotI | New England Biolabs Inc. | R0189L | |
| Restriction endonucleases PacI | New England Biolabs Inc. | R0547L | |
| Restriction endonucleases PstI | New England Biolabs Inc. | R0140L | |
| Restriction endonucleases SwaI | New England Biolabs Inc. | R0604L | |
| Restriction endonucleases XbaI | New England Biolabs Inc. | R0145L | |
| RNA 6000 Pico Kit for Bioanalyzer | Agilent Technologies | 5067-1513 | |
| Turbo DNase | Invitrogen | AM2238 | |
| U6-3:4-gRNA-Fluc flies | Bloomington Drosophila Stock Center | 84125 | |
| U6-3:4-gRNA-GFP; OpIE2-GFP flies | Bloomington Drosophila Stock Center | 84986 | |
| U6-3:4-gRNA-N flies | Bloomington Drosophila Stock Center | 84122 | |
| U6-3:4-gRNA-w flies | Bloomington Drosophila Stock Center | 84124 | |
| U6-3:4-gRNA-y flies | Bloomington Drosophila Stock Center | 84123 | |
| UASt-CasRx flies | Bloomington Drosophila Stock Center | 84121 | |
| UASt-dCasRx flies | Bloomington Drosophila Stock Center | 84120 | |
| Ubiq-CasRx flies | Bloomington Drosophila Stock Center | 84118 | |
| Ubiq-dCasRx flies | Bloomington Drosophila Stock Center | 84119 | |
| Ubiq-Firefly-T2A-eGFP-Ubiq-Renilla flies | Bloomington Drosophila Stock Center | 84127 | |
| Zymoclean Gel DNA Recovery Kits | Zymo Research Corporation | D4007 |
Referencias
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nat Communications. 9, 1911 (2018).
- Abudayyeh, O., et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. 353 (6299), 5573 (2016).
- East-Seletsky, A., O'Connell, M., Burstein, D., Knott, G., Doudna, J. RNA Targeting by Functionally Orthogonal Type VI-A CRISPR-Cas Enzymes. Molecular Cell. 66 (3), 373-383 (2017).
- Konermann, S., Lotfy, P., Brideau, N., Oki, J., Shokhirev, M., Hsu, P. Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors. Cell. 173 (3), 665-676 (2018).
- Buchman, A., Brogan, D., Sun, R., Yang, T., Hsu, P., Akbari, O. Programmable RNA Targeting Using CasRx in Flies. The CRISPR Journal. 3 (3), 164-176 (2020).
- Kushawah, G., et al. CRISPR-Cas13d Induces Efficient mRNA Knockdown in Animal Embryos. Developmental Cell. 54 (6), 805-817 (2020).
- Abudayyeh, O., et al. RNA targeting with CRISPR-Cas13. Nature. 550, 280-284 (2017).
- Perrimon, N., Ni, J., Perkins, L. In vivo RNAi: today and tomorrow. Cold Spring Harbor Perspectives in Biology. 2, 003640 (2010).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448, 151-156 (2007).
- Ni, J., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Ni, J., et al. A genome-scale shRNA resource for transgenic RNAi in Drosophila. Nature Methods. 8, 405-407 (2011).
- Ni, J., et al. Vector and parameters for targeted transgenic RNA interference in Drosophila melanogaster. Nature Methods. 5, 49-51 (2008).
- Heigwer, F., Port, F., Boutros, M. RNA Interference (RNAi) Screening in Drosophila. Genetics. 208 (3), 853-874 (2018).
- Kulkarni, M., et al. Evidence of off-target effects associated with long dsRNAs in Drosophila melanogaster cell-based assays. Nature Methods. 3, 833-838 (2006).
- Ma, Y., Creanga, A., Lum, L., Beachy, P. Prevalence of off-target effects in Drosophila RNA interference screens. Nature. 443, 359-363 (2006).
- Perrimon, N., Mathey-Prevot, B. Matter arising: off-targets and genome-scale RNAi screens in Drosophila. Fly. 1 (1), 1-5 (2007).
- Markstein, M., Pitsouli, C., Villalta, C., Celniker, S., Perrimon, N. Exploiting position effects and the gypsy retrovirus insulator to engineer precisely expressed transgenes. Nature Genetics. 40, 476-483 (2008).
- Champer, J., Buchman, A., Akbari, O. Cheating evolution: engineering gene drives to manipulate the fate of wild populations. Nature Review Genetics. 17 (3), 146-159 (2016).
- Buchman, A., et al. Broad dengue neutralization in mosquitoes expressing an engineered antibody. PLoS Pathogens. 16 (4), 1008103 (2020).
- Mathur, G., Sanchez-Vargas, I., Alvarez, D., Olson, K., Marinotti, O., James, A. Transgene-mediated suppression of dengue viruses in the salivary glands of the yellow fever mosquito, Aedes aegypti. Insect Molecular Biology. 19 (6), 753-763 (2011).
- Franz, A., et al. Engineering RNA interference-based resistance to dengue virus type 2 in genetically modified Aedes aegypti. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4198-4203 (2006).
- Yen, P., James, A., Li, J., Chen, C., Failloux, A. Synthetic miRNAs induce dual arboviral-resistance phenotypes in the vector mosquito Aedes aegypti. Communications Biology. 1, 11 (2018).
- Buchman, A., et al. Engineered resistance to Zika virus in transgenic Aedes aegypti expressing a polycistronic cluster of synthetic small RNAs. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3656-3661 (2019).
- . Addgene Available from: https://www.addgene.org/protocols/restriction-digest/ (2020)
- Gibson, D., Young, L., Chuang, R., Venter, J., Hutchison, C., Smith, H. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- . Addgene Available from: https://www.addgene.org/protocols/pcr/ (2020)
- . Indiana University Bloomington Available from: https://bdsc.indiana.edu/information/recipes/bloomfood.htmL (2020)
- Dobin, A., et al. STAR:ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Jiang, W., Brueggeman, A., Horken, K., Plucinak, T., Weeks, D. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryotic Cell. 13 (11), 1465-1469 (2014).
- Poe, A., et al. Robust CRISPR/Cas9-Mediated Tissue-Specific mutagenesis reveals gene redundancy and perdurance in Drosophila. Genetics. 211 (2), 459-472 (2019).
- Port, F., Chen, H., Lee, T., Bullock, S. Optimized CRISPR/Cas tools for efficient ger mLine and somatic genome engineering in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (29), 2967-2976 (2014).
- Yang, S., Li, S., Li, X. Shortening the Half-Life of Cas9 maintains its gene editing ability and reduces neuronal toxicity. Cell Reports. 25 (10), 2653-2659 (2018).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. eLife. 9, 53865 (2020).
- Zhang, X., Tee, L., Wang, X., Huang, Q., Yang, S. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy - Nucleic Acids. 4 (17), 264 (2015).
- Huynh, N., Depner, N., Larson, R., King-Jones, K. A versatile toolkit for CRISPR-Cas13-based RNA manipulation in Drosophila. Genome Biology. 21, 279 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados