Method Article
Повсеместный и тканеспецифический таргетинг РНК у Drosophila Melanogaster с использованием CRISPR / CasRx
В этой статье
Резюме
В этой статье описывается подробный протокол использования фермента Cas13D, нацеленного на РНК (RfxCas13D) у мух.
Аннотация
CasRx, член семейства CAS13, нацеленных на РНК, является многообещающим новым дополнением технологий CRISPR / Cas в эффективном восстановлении транскриптов генов с привлекательным нецелевым профилем как на клеточном, так и на организменном уровнях. Недавно сообщалось, что система CRISPR/ CasRx может быть использована для достижения повсеместного и тканеспецифического снижения транскрипта гена у Drosophila melanogaster. В этой статье подробно описываются методы из недавней работы, состоящие из трех частей: 1) повсеместное in vivo эндогенное нацеливание на РНК с использованием двухкомпонентной системы CasRx; 2) повсеместное in vivo экзогенное нацеливание на РНК с использованием трехкомпонентной системы CasRx; и 3) тканеспецифическое нацеливание на РНК in vivo с использованием трехкомпонентной системы CasRx. Наблюдаемые эффекты таргетирования РНК включают целевые ген-специфические фенотипические изменения, снижение транскрипта целевой РНК и случайные фенотипы летальности, связанные с высокой экспрессией белка CasRx и коллатеральной активностью. В целом, эти результаты показали, что система CasRx способна нацеливаться на восстановление транскрипта РНК на уровне организма программируемым и эффективным образом, демонстрируя, что нацеливание на транскриптом in vivo и инженерия осуществимы и закладывают основу для будущих технологий таргетирования РНК на основе IN VIVO CRISPR.
Введение
С момента появления технологий Clustered Regular Interspaced Short Palindromic Repeats (CRISPR) основное внимание в этой области было сосредоточено на редактировании ДНК, которое предлагает преобразующие приложения в медицине и биотехнологии1. Однако постоянное изменение последовательностей ДНК не всегда желательно из-за этических соображений. В свете этого недавние исследования начали разработку инструментов на основе CRISPR для нацеливания на РНК и продемонстрировали, что технологии CRISPR действительно могут быть использованы для нацеливания на РНК в различных биологических системах2,3,4,5,6,7. Во многих из этих протестированных систем в настоящее время широко используемым подходом к нацеливанию на РНК и восстановление транскрипта является РНК-интерференция (РНКи), которая далека от совершенства, часто демонстрируя различную эффективность и высокую нецелевую активность при использовании в vivo8,9,10,11,12,13,14,15,16,17 . Поэтому, учитывая статус этих технологий, стоит дополнительно изучить потенциал инструментов на основе CRISPR для таргетинга на РНК.
В одном известном недавнем исследовании сообщалось, что рибонуклеаза CasRx, член класса Cas13d, может эффективно снижать уровни транскриптов генов в культуре клеток человека и обладает привлекательным нецелевым профилем4. Это открытие привело к вопросу о том, может ли эта новая рибонуклеаза поддерживать свою эффективность и низкую нецелевую скорость для РНК- таргетирования на уровне организма. Недавнее исследование решило этот вопрос, показав, что система CasRx может быть использована для достижения повсеместного и тканеспецифического снижения транскрипта гена у Drosophila melanogaster5.
Чтобы упростить удобство использования этого недавно опубликованного подхода, этот протокол детализирует методы из этой недавней работы, которая состоит из трех основных частей: 1) повсеместное нацеливание на РНК in vivo с использованием двухкомпонентной системы CasRx; 2) повсеместное in vivo экзогенное нацеливание на РНК с использованием трехкомпонентной системы CasRx; и 3) тканеспецифическое нацеливание на РНК vivo с использованием трехкомпонентной системы CasRx.
Были разработаны направляющие РНК (гРНК), нацеленные на различные гены-мишени под контролем вездесущего промотора, и были сгенерированы линии мух, экспрессирующие эти гРНК-содержащие конструкции. Также были спроектированы конструкции CasRx под управлением либо вездесущего промотора, либо промотора условной последовательности активации (UASt), активируемого фактором транскрипции GAL4, и были сгенерированы летающие линии, содержащие эти CasRx-содержащие конструкции. Каталитически неактивные конструкции CasRx, dCasRx, были разработаны и использованы в качестве отрицательных элементов управления. Повсеместное нацеливание РНК на мух достигается путем пересечения гРНК-экспрессирующих линий мух с вездесущими CasRx-экспрессирующими линиями мух. Потомство, экспрессирующее как конструкцию гРНК, нацеленную на конкретный транскрипт гена, так и белок CasRx, имеет повсеместное сокращение целевых транскриптов генов. Тканеспецифическое нацеливание РНК у мух достигается путем первого скрещивания гРНК-экспрессирующих мух с UASt-CasRx экспрессирующими мухами, получая трансгетерозиготных мух, несущих как гРНК, так и конструкции UASt-CasRx. Такие мухи, в свою очередь, скрещиваются с тканеспецифическими GAL4-экспрессирующими мухами, что приводит к генерации тканеспецифической экспрессии CasRx и РНК-таргетинга у мух.
Программируемый характер системы CasRx предлагает возможность настройки и оптимизации для достижения высокой эффективности и низкой внецелевой активности для таргетирования РНК in vivo. Потенциальные применения РНК-таргетинга на основе CRISPR многочисленны, включая замену РНКi в лаборатории и содействие борьбе с насекомыми-переносчиками в дикой природе. Из последних одной из глобальных неудовлетворенных потребностей является разработка эффективных средств борьбы с инфекциями РНК-вирусов, передаваемых через комаров. Многие РНК-вирусы, такие как вирус денге, Зика и чикунгунья, передаются через комаров, влияя на здоровье человека и способствуя смертности. Было внесено много предложений по созданию популяций комаров с устойчивостью к вирусам для профилактики заболеваний; однако ни одна современная технология не способна сделать комаров одновременно устойчивыми ко всем значимым РНК-вирусам18,19,20,21,22,23. Системы Cas, нацеленные на РНК, могут обеспечить отправную точку для такой технологии, обеспечив программируемую платформу для нацеливания на все РНК-вирусы, переносимые комарами.
протокол
1. Повсеместное нацеливание на РНК in vivo с использованием двухкомпонентной системы CasRx
- Генерация вектора выражений Ubiq-CasRx и Ubiq-dCasRx
- Амплификация последовательности CasRx с помощью полимеразной цепной реакции (ПЦР) с праймером 1050E. C3 и 1050E. C4 и оригинальная конструкция CasRx pNLS-RfxCas13d-NLS-HA (pCasRx); и амплировать последовательность dCasRx с помощью ПЦР с праймером 1050E. C3 и 1050E. C4 и оригинальная конструкция dCasRx pNLS-dRfxCas13d-NLS-HA (pdCasRx)4 (таблица 1). После этого очистите усиленные фрагменты CasRx и dCasRx с помощью набора для очистки геля.
- Переварить базовый вектор (addgene plasmid #112686) с рестрикционными ферментами SwaI и PacI24. В полученных продуктах используют набор для гель-очистки более крупного фрагмента, который называется базовым векторным позвоночником.
- Собрать вектор Ubiq-CasRx с базовой векторной магистралью и фрагментом CasRx с помощью метода сборки Гибсона; собрать вектор Ubiq-dCasRx с базовой векторной магистралью и фрагментом dCasRx с помощью метода сборки Гибсона25.
ПРИМЕЧАНИЕ: Идентификатор addgene вектора Ubiq-CasRx (OA-1050E) равен #132416, а addgene ID вектора Ubiq-dCasRx (OA-1050R) — #132417.
- Генерация вектора экспрессии гРНК
- Проектирование каждого фрагмента гРНК на основе следующих критериев: целевая последовательность длиной 30 нуклеотидов; максимальная длина поли-U растяжек в целевой последовательности составляет 4 пары оснований; содержание ГК целевой последовательности находится в пределах 30% - 70%; целевая последовательность, по прогнозам, не будет образовывать сильные структуры РНК шпильки; и целевая последовательность, содержащая минимальную предсказанную вторичную или третичную структуру РНК5.
ПРИМЕЧАНИЕ: Это исследование спроектировало каждую гРНК как 4 тандемные последовательности длиной 30 нуклеотидов, разнесенных 36 нуклеотидными длинными прямыми повторами и с 7-тиминовым терминатором на обоих концах5. Для экзогенного гена-мишени, GFP, те же критерии, что и выше, сопровождались добавлением фрагмента OpIE2-GFP5. - Амплифицируйте последовательность промоторов U6:3 с помощью ПЦР с праймерами 1043.C1 и 1043.C23 и плазмидой Addgene #112688 (Таблица 1)26. Гель-очистка усиленных фрагментов U6:3 с помощью набора для очистки геля.
- Переварить плазмиду addgene #112688 с ферментами рестрикции AscI и XbaI24. В полученных продуктах используют набор для гель-очистки более крупных фрагментов, который называется предосновной векторной магистралью.
- Соберите базовый вектор с предосновной векторной магистралью и фрагментом U6:3 с помощью метода сборки Гибсона25. Ниже базовый вектор называется OA-1043.
ПРИМЕЧАНИЕ: Идентификатор Addgene плазмиды OA-1043 # 164586. - Синтезируйте фрагмент гРНК гена-мишени с помощью сервиса внешнего синтеза генов.
- Переваривайте базовый вектор OA-1043 с помощью фермента рестрикции PstI и NotI24. Сохраните весь продукт пищеварения, который называется переваренным ОА-1043.
- Собрать вектор экспрессии гРНК с переваренным OA-1043 и фрагментом гРНК-гена-мишени с помощью метода сборки Гибсона25.
ПРИМЕЧАНИЕ: Были изучены четыре гена-мишени: три были эндогенными (белый, Notch, желтый), один был экзогенным (GFP). Их идентификаторы Addgene: #132420 (gRNAW), #132421 (gRNAN), #132425 (gRNAY) и #133304 (gRNAGFP).
- Проектирование каждого фрагмента гРНК на основе следующих критериев: целевая последовательность длиной 30 нуклеотидов; максимальная длина поли-U растяжек в целевой последовательности составляет 4 пары оснований; содержание ГК целевой последовательности находится в пределах 30% - 70%; целевая последовательность, по прогнозам, не будет образовывать сильные структуры РНК шпильки; и целевая последовательность, содержащая минимальную предсказанную вторичную или третичную структуру РНК5.
- Генерация трансгенных мух
- Вводите векторы экспрессии в эмбрионы мух с помощью услуги внешней инъекции эмбрионов мух и эмбрионы от мух, содержащих сайты интеграции ØC31. Вырастите введенные эмбрионы при температуре 26 °C.
ПРИМЕЧАНИЕ: Линия attp40w (с сайтами интеграции на 2-й хромосоме) использовалась для генерации линий CasRx, а линия 8622 (с сайтами интеграции на 3-й хромосоме) использовалась для генерации различных линий гРНК. - Держите мух либо в виде гомозиготных линий, либо в виде сбалансированных гетерозиготных линий.
ПРИМЕЧАНИЕ: Мухи Ubiq-CasRx и Ubiq-dCasRx были сохранены как гетерозиготные сбалансированные линии с CyO в качестве балансировщика. Кроме того, векторы Ubiq-CasRx и Ubiq-dCasRx содержат маркер dsRed. В результате мухи Ubiq-CasRx и Ubiq-dCasRx имеют следующие три фенотипа: dsRed-положительные, кудрявые крылья и белые глаза. ГРНК-экспрессирующие мухи держались в виде гомозиготных линий. Их фондовые номера Bloomington Drosophila Stock Center (BDSC): #84118 (Ubiq-CasRx), #84119 (Ubiq-dCasRx), #84124 (gRNAW), #84122 (gRNAN), #84123 (gRNAY), #84986 (gRNAGFP).
- Вводите векторы экспрессии в эмбрионы мух с помощью услуги внешней инъекции эмбрионов мух и эмбрионы от мух, содержащих сайты интеграции ØC31. Вырастите введенные эмбрионы при температуре 26 °C.
- Генетика мух (Рисунок 1А)
- Соберите 10 взрослых самок из гомозиготной линии гРНК и соберите 5 взрослых самцов из сбалансированной гетерозиготной линии Ubiq-CasRx/CyO. Поместите собранных самок и самцов мух, которых называют родительскими мухами, во флакон, дополненный сухим дрожжевым порошком (рисунок 1А).
- Повторите предыдущий шаг 3 раза, чтобы создать 3 реплики. Для контрольной группы используйте линию Ubiq-dCasRx/CyO, сохраняя при этом все остальное прежним.
ПРИМЕЧАНИЕ: Для обычного стеклянного флакона с пищей достаточно 0,1 г сухого дрожжевого порошка. Используется рецепт корма для мух BDSC. - Верните флаконы, содержащие родительских мух, при 26 °C в течение 48 часов. Затем удалите всех родительских мух из каждого флакона. Затем храните флаконы при температуре 26 °C не менее 20 дней.
- Наблюдайте за флаконами каждый день, чтобы увидеть, появились ли какие-либо новые взрослые потомки из кукол поколения F1. Если это так, обезболите их углекислым газом, вставив трубку, подключенную к резервуару для углекислого газа, внутрь флаконов мухи, а затем включите переключатель потока на 10 секунд.
- Как только мухи станут неподвижными, опорожните их из флакона на нахлыстовую площадку, которая также соединена с резервуаром с углекислым газом, и углекислый газ непрерывно вытекает через налетную площадку.
- Оцените фенотип обезболенных мух и визуализируйте их с помощью цветной камеры, подключенной к флуоресцентному стереомикроскопу. Подсчитайте количество потомств с разными фенотипами. Используйте программное обеспечение для обработки изображений для постобработки и компиляции изображений (рисунок 2A - 2D).
ПРИМЕЧАНИЕ: Основываясь на менделевской генетике, среди потомков для каждого скрещивания ожидаются два типа мух (рисунок 1A).
- РНК-Сек (Рисунок 2E – 2G)
- Сбор образцов
ПРИМЕЧАНИЕ: Выберите подходящий метод сбора образцов из 3 приведенных ниже примеров; Требуется 3 реплики для каждого отдельного типа образца.- Сбор образцов головы взрослой мухи
- Соберите 10 девственных взрослых самок мух из гомозиготной линии гРНК. Соберите 5 взрослых самцов мух из сбалансированной гетерозиготной линии Ubiq-CasRx/CyO. Поместите собранных самок и самцов мух, которые являются родительскими мухами, во флакон, дополненный сухим дрожжевым порошком.
- Повторите предыдущий шаг 3 раза для 3 реплик. Для контрольной группы используйте линию Ubiq-dCasRx/CyO, сохраняя при этом все остальное прежним.
- Верните флаконы, содержащие родительских мух, при 26 °C в течение 48 часов. Затем удалите всех родительских мух из каждого флакона. Затем держите флаконы при температуре 26 °C до тех пор, пока из куколок не выйдут потомства.
- Соберите 10 1-дневных взрослых мух с правильным фенотипом. Обезболить мух углекислым газом, затем отрезать голову мухи и поместить головки в центрифужную трубку объемом 1,5 мл на сухом льду. Храните трубку центрифуги при температуре -80 °C. Повторите этот шаг 3 раза для 3 реплик.
- 17 – 20-часовой отбор образцов эмбрионов
- Соберите 8-10 девственных взрослых самок мух из гомозиготной линии гРНК. Соберите 4-5 взрослых самцов мух из сбалансированной гетерозиготной линии Ubiq-CasRx/CyO. Поместите собранных самок и самцов мух, которые являются родительскими мухами, во флакон, дополненный сухим дрожжевым порошком.
- Повторите предыдущий шаг 3 раза для 3 реплик. Для контрольной группы используйте линию Ubiq-dCasRx/CyO, сохраняя при этом все остальное прежним.
- Верните флаконы, содержащие родительских мух, при 26 °C в течение 48 часов.
- Подготовьте одну камеру сбора эмбрионов виноградного сока для каждой реплики по этому рецепту: 376 мл воды, 126 мл виноградного сока, 15 г агара и 6 г сахарозы. Поместите носитель в стакан объемом 1 л и поставьте его в микроволновую печь в течение 5-6 минут, внимательно следя за средой в стакане, чтобы проверить, появляются ли пузырьки / пена. Если это так, остановите микроволновую печь и дайте пузырьку / пене осесть. Продолжайте микроволновку таким образом, пока пузырь не станет прозрачным. Не закручивайтесь, пока все пузырьки не очистятся. Наконец, добавьте 10 мл 100% спирта и 5 мл уксусной кислоты. Хорошо перемешайте, затем выпейте среду в 35 мм чашки Петри серологическим пипетом объемом 25 мл. Когда среда затвердевает в чашке Петри, она готова к использованию.
- В конце 48-часовой инкубации переносят родительских мух в камеры сбора эмбрионов виноградного сока и инкубируют их при 26 °C в течение 3 ч. Затем удалите взрослых мух, удерживая свежеуложенные эмбрионы на пластинах виноградного сока еще 17 ч при 26 °C.
- После инкубации соберите 50-100 эмбрионов из пластин виноградного сока, очистите поверхность эмбриона, погрузив их в деионизированную воду, затем перенесите их в центрифужную трубку объемом 1,5 мл на льду. Хранить их при -80 °C. Повторите этот шаг 3 раза для 3 реплик.
- Первый отбор проб личинок instar
- Соберите 8-10 девственных взрослых самок мух из гомозиготной линии гРНК. Соберите 4-5 взрослых самцов мух из сбалансированной гетерозиготной линии Ubiq-CasRx/CyO. Поместите собранных самок и самцов мух, которые являются родительскими мухами, во флакон, дополненный сухим дрожжевым порошком. Повторите этот шаг 3 раза для 3 реплик. Для контрольной группы используйте линию Ubiq-dCasRx/CyO, сохраняя при этом все остальное прежним.
- Верните флаконы, содержащие родительских мух, при 26 °C в течение 48 часов. Затем переведите взрослых мух в другой новый обычный флакон с пищей для ночной инкубации (16 ч) при 26 °C. Затем удалите взрослых мух.
- Держите флакон, содержащий эмбрион, при 26 °C в течение 24 часов, затем забивайте трансгетерозиготные первые личинки под микроскопом, используя различные маркеры. Соберите 15-30 личинок с правильными фенотипами и поместите их в центрифужную трубку объемом 1,5 мл и храните при -80 °C. Повторите этот шаг 3 раза для 3 реплик.
- Сбор образцов головы взрослой мухи
- Секвенирование
- Экстракция РНК: используйте коммерчески доступный набор для экстракции РНК и следуйте инструкциям набора для обработки всех образцов. Затем инкубируйте извлеченные образцы РНК с коммерчески доступной дезоксирибонуклеазой и следуйте ее инструкциям, чтобы удалить любую загрязняющую ДНК из образцов.
- Измерьте концентрацию РНК с помощью коммерчески доступного спектрофотометра UV-vis. Измерьте целостность РНК в образцах, используя коммерчески доступную установку для анализа целостности РНК.
- Создайте библиотеки RNA-seq, используя коммерчески доступный комплект подготовки библиотеки РНК.
- Используйте внешний сервис секвенирования для виртуализации библиотек со следующими настройками: режим однократного чтения; длина чтения: 50nt, глубина: 20 миллионов чтений на библиотеку. Выполните базовые вызовы с помощью RTA 1.18.64, а затем преобразуйте данные в FASTQ с помощью bcl2fastq 1.8.4.
ПРИМЕЧАНИЕ: Необработанные данные секвенирования можно найти в Архиве чтения Национального центра секвенирования информации о биотехнологии (идентификатор представления: SUB6818910 [BioProject: PRJNA600654]).
- Биоинформатика
- Карта считывает данные секвенирования до генома Drosophila melanogaster Release 6 из проекта Berkeley Drosophila Genome Project (номер присоединения GenBank: GCA_000001215.4) и экзогенных последовательностей CasRx и GFP с использованием настройки параметров по умолчанию STAR aligner28 с добавлением опции фильтра «-outFilterType BySJout» и Drosophila_melanogaster «-sjdbGTFfile». BDGP6.22.97.gtf" файл формата переноса генов из ENSEMBL.
- Определите количество необработанных транскриптов для каждой аннотированной расшифровки с помощью функции Counts35, используя параметры «-t exon -g gene_id -M -O --fraction». Затем нормализуйте количество необработанных транскриптов, используя общее количество транскриптов с помощью perl-скрипта «addTpmFpkmToFeatureCounts.pl».
- Используйте метод максимальной апостериории с исходной оценкой усадки в конвейере DESeq2 для оценки изменения логарифмической складки транскриптов каждого гена (LFC).
- Сбор образцов
2. Повсеместное in vivo экзогенное нацеливание на РНК с использованием трехкомпонентной системы CasRx
- Генерация экзогенного целевого вездесущего вектора экспрессии
- ПЦР амплифицируют фрагмент промотора Ubiq с помощью праймеров 1052B. C1 и 1052B. C2 и плазмида Addgene #112686 26. Затем ПЦР амплируют фрагмент T2A-eGFP, амплифицированный из плазмиды Addgene #112686 праймерами 908A.1 и 908A.2 (таблица 1)26. Затем ПЦР амплируют фрагмент промотора Ubiq в виде обратной последовательности с использованием плазмиды Addgene #112686 праймерами 908A.3 и 908A.4 (Таблица 1)26. Гель-очищают промоторный фрагмент Ubiq, фрагмент T2A-eGFP и обратный фрагмент промотора Ubiq с помощью набора для очистки геля.
- Закажите пользовательскую последовательность кодирования люциферазы светлячка и пользовательский фрагмент, содержащий фрагмент p10 3'UTR, обратный ренилла люцифераза, за которым следует фрагмент SV40 3'UTR.
- Переварить плазмиду addgene #112688 с ферментами рестрикции AscI и XbaI24. В полученных продуктах гель-очистка более крупных фрагментов с помощью набора для очистки геля, который называется базовым векторным позвоночником.
- Используйте метод сборки Гибсона для сборки базового вектора с базовой векторной магистралью и следующими фрагментами: фрагмент промотора Ubiq, фрагмент T2A-eGFP, обратный фрагмент промотора Ubiq, кодирующая последовательность люциферазы светлячка и обратная люцифераза ренилла, за которой следует фрагмент SV40 3'UTR25.
ПРИМЕЧАНИЕ: Идентификатор Addgene результирующего вектора экспрессии дуальной люциферазы (OA-1052B) равен #132426.
- Генерация вектора экспрессии гРНК
- ПЦР амплифицируют промоторную последовательность U6:3 с использованием праймеров 1043.C1 и 1043.C23 и плазмиды Addgene #112688 (Таблица 1)26. Гель-очистка усиленных фрагментов U6:3 с помощью набора для очистки геля.
- Переварить плазмиду адджена #112688 с ферментами рестрикции AscI и XbaI24. В полученных продуктах гель-очистка более крупных фрагментов, которая называется предосновной векторной магистралью, используя набор для очистки геля.
- Соберите базовый вектор с предбазовой векторной магистралью и фрагментом U6:3 с помощью метода сборки Гибсона25. Ниже базовый вектор называется OA-1043.
- Синтезируйте фрагмент гРНК гена-мишени с помощью сервиса внешнего синтеза генов.
- Переваривайте базовый вектор OA-1043 с помощью фермента рестрикции PstI и NotI24. Сохраните весь продукт пищеварения, который называется переваренным ОА-1043.
- Собрать вектор экспрессии гРНК с переваренным OA-1043 и фрагментом гРНК-гена-мишени с помощью метода сборки Гибсона25.
ПРИМЕЧАНИЕ: Идентификатор addgene результирующей плазмиды (OA-1052K) равен #132422.
- Генерация трансгенных мух
- Ввести вектор OA-1052B в эмбрионы мух с использованием эмбрионов мух, содержащих сайт интеграции ØC31 на 3-й хромосоме, номер 9744 мухи BDSC, через услугу внешней инъекции эмбриона мухи. Аналогичным образом, вводите вектор OA-1052K в эмбрионы мух, используя эмбрионы мух, содержащие сайт интеграции ØC31 на 3-й хромосоме, номер 8622 мухи BDSC. Вырастите введенные эмбрионы при температуре 26 °C.
- Держите мух, экспрессирующих двойную люциферазу, и гРНК мухи в виде гомозиготных линий; поддерживать линии Ubiq-CasRx как двойные сбалансированные гетерозиготные линии, пересекая однобалансированную гетерозиготную линию Ubiq-CasRx, генерируемую в секции 1, к балансирующим линиям, несущим хромосому балансира TM6 с маркером стерни (Stb), и сохранять только двойные сбалансированные потомки с белоглазыми, кудрявыми крыльями и dsRed-флуоресцентными фенотипами одновременно.
ПРИМЕЧАНИЕ: Номера запасов мух BDSC: #84127 (Ubiq-Fluc-Rluc), #84125 (gRNAFluc).
- Генетика мух (рисунок 1B и рисунок 3A)
- Соберите 8-10 девственных взрослых самок мух из линии, экспрессирующей двойную люциферазу. Соберите 4-5 взрослых самцов мух из сбалансированного гетерозиготного Ubiq-CasRx/CyO; +/TM6, линия Stb, которая показывает белоглазые, кудрявые крылья и dsRed флуоресценцию одновременно. Поместите собранных самок и самцов мух, которые являются родительскими мухами, во флакон, дополненный сухим дрожжевым порошком (далее называемый Крестом Шага 1).
- Повторите предыдущий шаг 3 раза для 3 реплик. Для контрольной группы используйте Ubiq-dCasRx/CyO; +/TM6, линия Stb, сохраняя при этом все остальное прежним.
- Верните флаконы Step 1 Cross, содержащие родительские мухи при температуре 26 °C в течение 48 часов. Затем удалите всех родительских мух из каждого флакона. Затем держите флаконы при температуре 26 °C не менее 14 дней. За это время соберите 8-10 женских девственниц из гомозиготной линии гРНК, нацеленной на люциферазу светлячка. Повторите этот шаг 3 раза для 3 реплик.
- Соблюдайте флаконы Step 1 Cross каждый день, чтобы увидеть, появляется ли из куколок новая взрослая муха. Если это так, обезболите их углекислым газом, соберите 5 самцов мух, экспрессирующих как Ubiq-CasRx (или Ubiq-dCasRx), так и репортер двойной люциферазы из потомков и поместите их в новый флакон вместе с 10 девственными самками из линии гРНК, нацеленной на люциферазу светлячка (далее именуемой Step 2 Cross). Повторите этот шаг 3 раза для 3 реплик.
- Соберите еще 5 однодневных самцов, экспрессирующих как Ubiq-CasRx (или Ubiq-dCasRx), так и двойной люциферазный репортер из флаконов Step 1 Cross и высиживайте их в течение 2-4 дней при 26 °C. Затем переложите их в центрифужную трубку объемом 1,5 мл и храните при -80 °C. Повторите этот шаг 3 раза для трех реплик.
- Верните флаконы Step 2 Cross, содержащие родительские мухи при температуре 26 °C, в течение 48 часов. Затем удалите всех родительских мух из каждого флакона. Затем храните флаконы при температуре 26 °C не менее 20 дней.
- Соблюдайте флаконы Step 2 Cross каждый день, чтобы увидеть, появились ли какие-либо новые взрослые потомки из куколок. Если это так, обезболивайте их углекислым газом, оцените фенотипы обезболенных мух и визуализируйте их с помощью цветной камеры, оснащенной флуоресцентным стереомикроскопом. Подсчитайте количество потомств с разными фенотипами. Используйте программное обеспечение для обработки изображений для постобработки и компиляции изображений (рисунок 3B – 3C).
Примечание: Менделевская генетика предполагает, что, если все мухи жизнеспособны, среди потомков из Step 2 Cross ожидается 4 типа мух, каждый из которых составляет 25% популяции (рисунок 1B и рисунок 3A).
- Анализ люциферазы (Рисунок 3D)
- Генерируйте тройные трансгетерозиготные мухи, а также контрольные мухи, повторяя шаги 2.4.1-2.4.5. Собирайте самцов мух при рождении и старите их до 3-дневного возраста.
- Переведите 3-дневных мух в центрифужные трубки объемом 1,5 мл и лизируйте их с помощью пестика и буфера лизиса люциферазы коммерчески доступного набора для анализа люциферазы.
- Используйте 5 мкл лизированной ткани из каждого образца для измерения активности светлячка и ренилла люциферазы с использованием коммерчески доступного набора для анализа люциферазы и люминометра.
3. Тканеспецифическое нацеливание на РНК in vivo с использованием трехкомпонентной системы CasRx
- Генерация вектора выражений UASt-CasRx и UASt-dCasRx
- ПЦР амплируют последовательность промоторов UASt с использованием плазмиды pJFRC81 и праймеров 1041.C9 и 1041.C11; затем ПЦР амплируют фрагмент CasRx с использованием плазмиды OA-1050E (Addgene ID #132416) и праймеров 1050L. C1 и 1050E. С4; а затем ПЦР амплируют фрагменты dCasRx с помощью плазмиды OA-1050R (Addgene ID #132417) и праймеров 1050L. C1 и 1050E. С4 (Таблица 1)26. Гелевая очистка усиленной последовательности промоторов UASt, фрагментов CasRx и dCasRx с помощью набора для очистки геля.
- Переваривает базовый вектор (addgene plasmid #112686) с рестрикционными ферментами NotI и PacI24. В полученных продуктах гель-очистка более крупного фрагмента, который называется базовым вектором позвоночника, используя набор для очистки геля.
- Собрать вектор UASt-CasRx с базовой векторной магистралью, последовательностью промотора UASt и фрагментом CasRx с помощью сборки Gibson; затем соберите вектор UASt-dCasRx с базовой векторной магистралью, последовательностью промотора UASt и фрагментом dCasRx с помощью метода сборки Gibson25.
ПРИМЕЧАНИЕ: Вектор UASt-CasRx — это плазмида Addgene #132418, а вектор UASt-dCasRx — плазмида Addgene #132419
- Генерация трансгенных мух
- Вводить вектор UASt-CasRx в эмбрионы мух с помощью услуги инъекции эмбрионов мух и эмбрионов от 8621 интеграционного сайта ØC31 мух на их 2-х хромосомах; затем вводят вектор UASt-dCasRx в эмбрионы мух с помощью услуги инъекции эмбрионов мух и эмбрионы от сайта интеграции ØC31 мух ØC31 на их 2-х хромосомах. Вырастите введенные эмбрионы при температуре 26 °C.
- Держите мух в виде двойных сбалансированных гетерозиготных линий с маркерами CyO и Sb. ПРИМЕЧАНИЕ: Идентификаторы летающих линий в BDSC: 84121 (UASt-CasRx) и 84120 (UASt-dCasRx).
- Генетика мух (Рисунок 1C)
- Закажите нужные линии GAL4 у BDSC; Получение соответствующих линий гРНК из шага 3.2.2 (или из BDSC).
ПРИМЕЧАНИЕ: Были использованы следующие 2 мухи GAL4 от BDSC: GAL4-GMR (идентификатор BDSC: #29967), GAL4-y (идентификатор BDSC: #44373). Использовались те же 3 линии гРНК, сгенерированные в первом разделе: gRNAw (BDSC ID: #84124), gRNAN (BDSC ID #84122), gRNAY (BDSC ID: #84123). - Соберите 5-10 девственных взрослых самок мух из линии гРНК. Соберите 2-4 взрослых самца мух из двойного сбалансированного гетерозиготного UASt-CasRx/CyO; +/TM6, линия Sb, которая показывает белоглазые, кудрявые крылья и dsRed флуоресценцию одновременно. Поместите собранных самок и самцов мух, которые являются родительскими мухами, в обычный пищевой флакон (далее называемый Крестом Шага 1). Повторите этот шаг 3 раза для 3 реплик. Для контрольной группы используйте UASt-dCasRx/CyO; +/TM6, линия Sb, сохраняя при этом все остальное прежним.
- Верните флаконы Step 1 Cross, содержащие родительские мухи при температуре 26 °C в течение 48 часов. Затем удалите всех родительских мух из каждого флакона. Затем держите флаконы при температуре 26 °C не менее 14 дней. За это время соберите 5-10 девственниц из линейки GAL4. Повторите этот шаг 3 раза для 3 реплик.
- Соблюдайте флаконы Step 1 Cross каждый день, чтобы увидеть, появляется ли из куколок новая взрослая муха. Если это так, обезболите их углекислым газом, соберите 2-4 самца мух, экспрессирующих как UASt-CasRx (или UASt-dCasRx), так и вектор гРНК от потомков, которые одновременно имеют dsRed-флуоресцентный и щетинковый фенотипы. Поместите собранных самцов из Креста Шага 1 в новый флакон вместе с 5-10 собранными девственными самками из линии GAL4 (далее именуемой Крестом Шага 2). Повторите этот шаг 3 раза для 3 реплик.
- Верните флаконы Step 2 Cross, содержащие родительские мухи при температуре 26 °C, в течение 48 часов. Затем удалите всех родительских мух из каждого флакона. Затем храните флаконы при температуре 26 °C не менее 20 дней.
- Соблюдайте флаконы Step 2 Cross каждый день, чтобы увидеть, появляется ли какая-либо новая взрослая муха из куколок. Если это так, обезболивайте их углекислым газом, оцените фенотипы обезболенных мух и визуализируйте их с помощью цветной камеры, оснащенной флуоресцентным стереомикроскопом. Подсчитайте количество потомств с разными фенотипами. Используйте программное обеспечение для обработки изображений для постобработки и компиляции изображений (рисунок 4).
Менделевская генетика предполагает, что, если все мухи жизнеспособны, среди потомков из Step 2 Cross ожидается 4 типа мух, каждый из которых составляет 25% популяции (рисунок 1C).
- Закажите нужные линии GAL4 у BDSC; Получение соответствующих линий гРНК из шага 3.2.2 (или из BDSC).
Результаты
Повсеместное нацеливание на РНК in vivo с использованием двухкомпонентной системы CasRx
Трансгетерозиготные мухи F1, экспрессирующие как Ubiq-CasRx, так и гРНК (нацеленные как на эндогенные, так и на экзогенные гены), показали выраженные фенотипы по сравнению с контрольными мухами, экспрессирующими конструкции Ubiq-dCasRx и гРНК (рисунок 2 и рисунок 4). В частности, трансгетерозиготные мухи CasRx имеют значительно более низкие уровни выживаемости по сравнению с трансгетерозгическими мухами dCasRx, что указывает на токсичность системы Ubiq-CasRx (рисунок 2A и рисунок 4A). Стоит отметить, что как трансгетерозиготные мухи CasRx, так и dCasRx имеют менее 50% наследования, что является ожидаемым соотношением, основанным на менделевской генетике. Из трех генов-мишеней Ubiq-CasRx/+; U6-gRNAN/+ летает и Ubiq-CasRx/+; Мухи U6-gRNAY/+ нежизнеспособны (0% наследования) и не выросли за пределы второй стадии личинок (рисунок 2A-2B). Уцелевший Ubiq-CasRx/+; Мухи U6-gRNAw/+, наследование которых составило 12,9%, показали отчетливый полностью проникающий белоглазый фенотип (рисунок 2B). В дополнение к наблюдаемым признакам, связанным с CasRx, мы смогли подтвердить значительное снижение транскриптов генов-мишеней для 3 генов-мишеней: Notch, yellow и GFP (рисунок 2E-2G). Снижение транскриптов белых генов наблюдалось у мух Ubiq-CasRx/+, U6-gRNAw/+ по сравнению с контрольными мухами Ubiq-dCasRx/+, U6-gRNAW/+, хотя снижение не было статистически значимым (рисунок 2E - 2F). Доказательства нецелевой активности, индуцированной CasRx, были обнаружены при сравнении дифференциально экспрессированных транскриптов между образцами из CasRx-экспрессирующих мух и образцами из dCasRx-экспрессирующих мух (рисунок 2E, 2G). Количество нецелевых транскриптов, значительно дифференцированно выраженных, выглядит следующим образом: белый — 253 (1,4% от общего числа транскриптов); Вырез, 300 (1,7%); желтый, 41 (0,23%); GFP, 5 880 (33%) (Рисунок 2G). Из 17 779 различных транскриптов 6 нецелевых транскриптов были значительно дифференцированно выражены во всех 4 группах образцов. Одним из 6 идентифицированных транскриптов был Gadd45, ген, участвующий в апоптозе и клеточной остановке у мух, что повышает вероятность того, что ферментативное действие CasRx может либо непосредственно вызвать клеточный апоптоз, либо косвенно вызвать неправильную экспрессию других генов, что, в свою очередь, приводит к апоптозу. Наконец, стоит отметить, что мухи Ubiq-CasRx и Ubiq-dCasRx не были установлены как гомозиготные запасы, по-видимому, из-за токсичности, придаваемой высокой повсеместной экспрессией. В результате гетерозиготные мухи Ubiq-CasRx/CyO и Ubiq-dCasRx/CyO использовались для скрещивания с гомозиготными линиями гРНК. В целом, двухкомпонентная система Ubiq-CasRx способна достичь повсеместного нацеливания РНК как на эндогенные, так и на экзогенные мишени, что приводит к наблюдаемым фенотипам и снижению транскриптов. Эти результаты также показали, что CasRx-опосредованное нацеливание РНК может привести к токсичности in vivo.
Повсеместное in vivo экзогенное нацеливание на РНК с использованием трехкомпонентной системы CasRx
Результаты двухступенчатого скрещивания показали, что, несмотря на экзогенную природу гена-мишени (т.е. Fluc), экспрессия всех трех трансгенов в тройных трансгетероготах F2 (Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) приводила к 100% летальности по сравнению с контрольными кроссами с участием Ubiq-dCasRx, где летальность не наблюдалась у тройных трансгетерозигот F2 (Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) (Рисунок 3B-C ). Более конкретно, только комбинация всех трех трансгенов (Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) привела к 100% летальности (рисунок 3B и D), в то время как (Ubiq-CasRx/+; gRNAFluc/TM6) и (Ubiq-CasRx/+; Генотипы Ubiq-Fluc-Ubiq-Rluc/TM6) были жизнеспособными и не имели фенотипов со скоростью наследования, соответствующей ожидаемым менделевским скоростям передачи, предполагая, что наличие целевой последовательности (т.е. светлячка люциферазы) в сочетании с Ubiq-CasRx/+ и gRNAFluc - это то, что привело к наблюдаемым фенотипам летальности, предположительно вытекающим из коллатеральной активности ферментов Cas132,8 . Кроме того, отсутствуют различимые фенотипы или резкое влияние на наследование у трансгетерозигот F1 (Ubiq-CasRx/+; gRNAFluc/+ или Ubiq-CasRx/+; Ubiq-Fluc-Ubiq-Rluc /+) наблюдались по сравнению с контролем Ubiq-dCasRx (Ubiq-dCasRx/+; gRNAFluc/+ или Ubiq-dCasRx/+; Ubiq-Fluc-Ubiq-Rluc /+) (Рисунок 3B), что указывает на то, что каталитически активный фермент необходим для получения наблюдаемых фенотипов летальности. Кроме того, уровни экспрессии Fluc и Rluc у мух всех жизнеспособных генотипов не показали значительного снижения экспрессии Fluc в тройных трансгетерозиготах Ubiq-dCasRx (Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) по сравнению с контролем с двойным репортером люциферазы. Это говорит о том, что уровни экспрессии белка Fluc не были снижены при нацеливании dCasRx (рисунок 3D). Взятый вместе, общий фенотип летальности в двух различных экспериментах с casRx-опосредованной вездесущей РНК-мишенью показывает, что при повсеместном использовании на тканях Опосредованное CasRx РНК-нацеливание может быть токсичным для организма.
Тканеспецифическое нацеливание на РНК in vivo с использованием трехкомпонентной системы CasRx
Высокий уровень токсичности, наблюдаемый в вездесущих экспериментах по нацеливанию на РНК, побудил нас исследовать тканеспецифическое нацеливание на РНК с использованием трехкомпонентной системы CasRx, подробно описанной в разделе методов. Действительно, наблюдаемый уровень токсичности был снижен, когда общая экспрессия CasRx была снижена с использованием промотора UASt по сравнению с промотором Ubiq, это иллюстрируется тремя аспектами: 1) линии UASt-CasRx и UASt-dCasRx поддерживались в качестве гомозиготных линий, хотя на основе двухступенчатой кросс-схемы для выполнения скрещиваний использовались двойные сбалансированные линии UASt-CasRx и UASt-dCasRx, 2) все показатели тройного трансгетерозиготного наследования DCasRx поколения F2 соответствовали ожидаемому 25% менделевскому уровню наследования, и 3) фенотип тройной трансгетерозиговой летальности CasRx поколения F2 был умеренно снижен. В эксперименте по белому таргетированию из 25% менделевских показателей наследования, ожидаемых у тройных трансгетерозигот F2, наблюдалось только 0,57% жизнеспособных взрослых мух (UASt-CasRx/+; gRNAw/GMR-Gal4), все из которых демонстрировали тяжелую специфическую пигментацию и морфологические фенотипы глаз (рисунки 4A и 4B). Для кросса белого таргетинга частота наследования Тройного трансгетерозигоза F2, экспрессирующего CasRx, была значительно ниже, чем у dCasRx-экспрессирующей тройной трансгетерозиговой контрольной группы (27,6%) (рисунок 4A). В эксперименте с таргетированием Notch CasRx-экспрессирующие тройные трансгетерозиговые, несущие все три трансгена, были на 100% смертельными, в то время как контрольный уровень наследования dCasRx составлял 29,3% (рисунок 4A). В эксперименте с желтым таргетированием F2 тройной трансгетерозиговой CasRx-экспрессирующей, gRNAY и y-GAL4 показали маргинальное снижение пигмента хитина в виде небольших пятен желтой кутикулы на грудной клетке и брюшной полости со скоростью наследования 2,67%, что намного ниже, чем у контрольной группы dCasRx (25,2%) (Рисунок 4A ). Все контрольные тройные трансгетерозиготные мухи dCasRx не представляли очевидных фенотипов, как CasRx-экспрессирующие мухи, что указывает на то, что каталитическая активность CasRx способствовала наблюдаемым фенотипам. Низкая скорость наследования в тройной трансгетерозиговой группе CasRx предполагает, что в нацеливании на РНК CasRx существуют два источника токсичности: один связан с высокой экспрессией CasRx, токсичность которого была снижена ограничительной экспрессией CasRx, другой связан с коллатеральной активностью. Взятые вместе, эти результаты показали, что система CasRx может достичь тканеспецифического нацеливания на РНК in vivo за счет использования классической системы Gal4 / UASt и в то же время снизить токсичность. Однако токсичность и случайные фенотипы летальности по-прежнему наблюдались на более низком уровне тяжести по сравнению с вездесущими подходами, что указывает на то, что активность коллатерального расщепления связана с токсичностью.
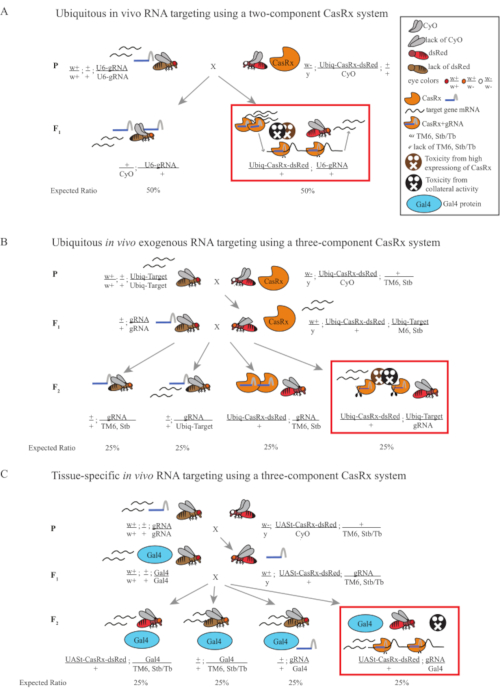
Рисунок 1: Общий обзор нацеливания на РНК с использованием системы Cas13D. (A) Схемы одноступенчатого генетического кросса в вездесущей РНК-таргетинге in vivo с использованием двухкомпонентной системы CasRx. (B) Схемы двухступенчатого генетического скрещивания в вездесущей in vivo экзогенной РНК-таргетинге с использованием трехкомпонентной системы CasRx. (C) Схемы двухступенчатого генетического скрещивания в тканеспецифической РНК in vivo с использованием трехкомпонентной системы CasRx. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
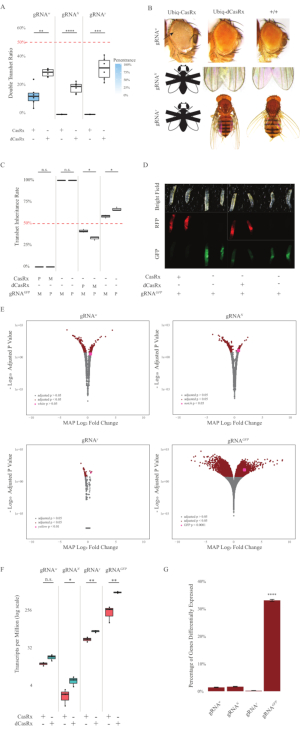
Рисунок 2: Повсеместное нацеливание на РНК in vivo с использованием двухкомпонентной системы CasRx (перепечатано5). (A) Общий процент наследования трансгетерозиготных мух, наследующих Ubiq-CasRx (или Ubiq-dCasRx) и гРНК. Синее затенение на прямоугольном графике указывает на пенетрантность фенотипа. (B) Фенотипы трансгетерозиготных мух. Стрелки указывают на некроз тканей в глазу. Черно-белая муха, помеченная буквой «X», символизирует летальность. (C) Общий процент наследования трансгетерозиготных мух двунаправленных скрещиваний между мухами Ubiq-CasRx (или Ubiq-dCasRx) и gRNAGFP-OpIE2-GFP. M, материнское наследование CasRx; P, отцовское наследование CasRx. (D) Личинки F1 потомства в отцовском кресте. (E) Максимальные апостериорные оценки транскриптов для изменения логарифмической складки. Использовался конвейер DESeq2. (F) Расшифровок на миллион (TPM), предназначенных для CasRx или dCasRx. (G) CasRx-диспендент дифференциально выраженный процент стенограмм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
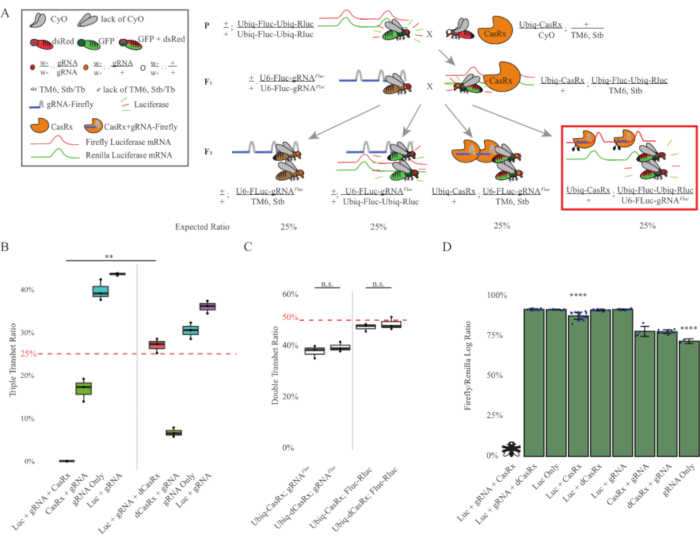
Рисунок 3: Повсеместное in vivo экзогенное нацеливание РНК с использованием трехкомпонентной системы CasRx. (A) Схемы двухступенчатого генетического кросса. (B) Общий процент наследования для всех генотипов, возникающих в поколении F2 . Наследование всех трех трансгенов (Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc и gRNAFLuc) в потомстве F2 привело к 100% летальности и было значительно ниже по сравнению с контрольной группой тройных трансгетерозигот Ubiq-dCasRx (p = 0,001, t-тест). (C) Перенос только Ubiq-CasRx/gRNAFluc или Ubiq-CasRx и Ubiq-Fluc-Ubiq-Rluc сам по себе не приводил к тяжелой летальности, а соотношения наследования между трансгетерозиготами Ubiq-CasRx и Ubiq-dCasRx существенно не отличались (p = 0,41 и p = 0,51, соответственно, t-тест). (D) Соотношение люциферазы, нормализующее показания Fluc к показаниям Rluc. Тройные трансгетерозиготные мухи, экспрессирующие Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc, gRNAFLuc , были эмбрионально летальными, которые были представлены мухой с «X», и в результате экспрессия люциферазы не измерялась. Соотношение Fluc/Rluc трансгетерозигот Ubiq-CasRx/+, Ubiq-Fluc-Ubiq-Rluc/TM6, Stb было значительно ниже, чем у других Ubiq-Fluc-Ubiq-Rluc-экспрессирующих групп (p = 1,2e-06 или ниже, t-тест). Результаты из группы, состоящей только из gRNAFLuc, были значительно ниже, чем у всех других групп (p = 1,2e-06 или ниже, t-тест). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
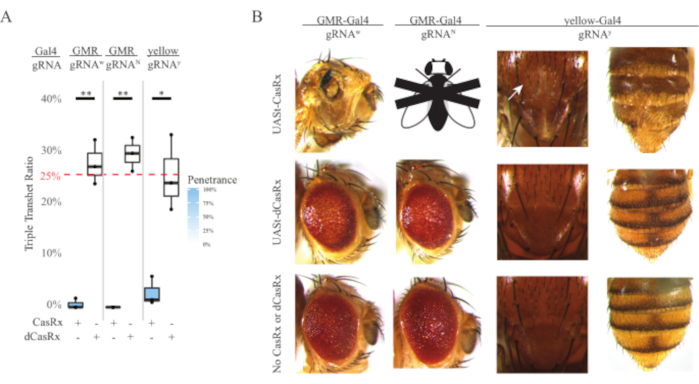
Рисунок 4: Тканеспецифическое нацеливание на РНК in vivo с использованием трехкомпонентной системы CasRx (перепечатано5). (A) Общий процент наследования тройных трансгетерозиготных мух, несущих три трансгена (UASt-CasRx или UASt-dCasRx, gRNAs и Gal4-driver. (B) Фенотипы тройных трансгетерозиготных мух. Белая стрелка указывает на уменьшение пигмента хитина в грудной клетке. Черно-белая муха, помеченная буквой «X», символизирует летальность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Строить | Описание | Букварь | Последовательность праймеров (от 5' до 3') | Шаблон ПЦР |
| ОА-1050Е | КасРх | 1050Е. С3 | ТАКТААТТТЦКАК АКТКТАТТТТГАК CCGCAGATTAATTA АТГАГККККААГА АГААА | pNLS-RfxCas13d-NLS-HA (pCasRx) |
| 1050Е. С4 | КААТТГАТТТТТА ТТТТАААААКГАТТ CATTCTAGCTAGCT TAAGCGTAATCTGG ААКА | |||
| ОА-1050Р | дКасРх | 1050Е. С3 | ТАКТААТТТЦКАК АКТКТАТТТТГАК CCGCAGATTAATTA АТГАГККККААГА АГААА | pNLS-dRfxCas13d-NLS-HA (pdCasRx) |
| 1050Е. С4 | КААТТГАТТТТТА ТТТТАААААКГАТТ CATTCTAGCTAGCT TAAGCGTAATCTG ГААКА | |||
| ОА-1050Л | Промоутер UASt | 1041,с9 | GCGGGTTCTCGA CGGTCACGGCGG GCATGTCGACGC GGCCGCAACCAA КААКТАГТАГ | pJFRC81 |
| 1041.С11 | CTGGCCTCCACC ТТТКТКТТЦТТКТТТТТКТ TGGGGCTCATGT ТТАААККААТТ CCCTATTCAGA | |||
| КасРх | 1050л. С1 | ААТАКААГАГАГА ГААККТГААТА ГГГААТТГГТТ TTAAACATGAGC ККАААГАГАА | pCasRx | |
| 1050Е. С4 | КААТТГАТТТГТ ТАТТТТААААК ГАТТКАТТКТА GCTAGCTTAAG CGTAATCTGGA АСА | |||
| ОА-1050С | Промоутер UASt | 1041,с9 | GCGGGTTCTC GACGGTCACG GCGGGCATGT CGACGCGGCC ГКААККААКАА КАКТАГТАГ | pJFRC81 |
| 1041.С11 | CTGGCCTCCA ККТТТКТТКТК ТТКТТГГГГКТ КАТГТТТАААК CCAATTCCCTA ТЦАГА | |||
| дКасРх | 1050л. С1 | ААТАКААГААГ АГААККТГААТ АГГГААТТГГ ТТТАААКАТГАГ КЦККААГААГАА | pdCasRx | |
| 1050Е. С4 | КААТТГАТТТГТ ТАТТТТААААК ГАТТКАТТКТАГ CTAGCTTAAGCG ТААТКТГГААКА | |||
| ОА-1043 | Промоутер U6:3 | 1043,С1 | ГГГААТТГГА АТТГГКААТАТ TTAAATGGCGGC GCGCCGAATTCT TTTTTGCTCACCT | Адгенная плазмида #164586 |
| 1043,с23 | ACACTAGTGGAT CTCTAGAGGTAC CGTTGCGGCCG КААААААГТТГТ ААТАГЦККТКА AAACTGGACCTT CCACAACTGCAG CCGACGTTAAAT ТГААА | |||
| ОА-1052Б | Промоутер Ubiq | 1052Б. С1 | ГГГААТТГГКА ATATTTAAATGGC GGCTGCAGC GCAGATCGCCGAT | Адгенная плазмида #112686 |
| 1052Б. С2 | ТТТЦТТТТАГТТТТТТТТ ТТГГГГТКТККЦ ATCCTAGGTCTG CGGGTCAAAATA ГАГАТГ | |||
| Т2А-эГФП | 908А1 | АТАААГГЦКААГ ААГГГГГГАААА ГАЦГКЦГТГГ АГГГКАГАГГА СЛКПТТКТААКАТ ГК | Адгенная плазмида #112686 | |
| 908А2 | ТТГТТАТТТТААААА ACGATTCATTCTA GGCGATCGCTTA CTTGTACAGCTC ГТККАТГКС | |||
| Перевернутый промоутер Ubiq | 908А3 | ACCGTGACCTAC АТЦГТКГАКАКТА GTGGATCTCTAGA CGCGCAGATCGC ЦГАТГ | Адгенная плазмида #112686 | |
| 908А4 | ГГАТКАТАААКТТ TCGAAGTCATGC GGCCGCTCTGCG ГГТКААААТАТАГАГ АТГТ |
Таблица 1: Список молекулярных конструкций и праймеров, используемых в данном исследовании. Этот список включает в себя все конструкции (как идентификатор, так и описание) и связанные с каждой конструкцией буквари (как идентификатор, так и последовательности (от 5' до 3')) и используемые шаблоны.
Обсуждение
С тремя различными конструкциями применения системы CasRx эта работа продемонстрировала в вивопрограммируемое нацеливание РНК на мух. Различные стратегии удовлетворяют различные потребности проекта, такие как эндогенное и экзогенное нацеливание на гены и повсеместное и тканеспецифическое нацеливание на РНК. Эффекты нацеливания на РНК включали специфические фенотипические изменения целевого гена, снижение транскрипта целевой РНК и случайные фенотипы летальности, связанные с высокой экспрессией белка CasRx и коллатеральной активностью. В целом, эти результаты показали, что система CasRx способна целенаправленное снижение транскрипта РНК на уровне организма программируемым и эффективным образом.
Одним из ключевых факторов успешной настройки системы CasRx является проектирование гРНК. В частности, следует учитывать следующие рекомендации: целевая последовательность составляет около 30 нуклеотидов в длину, длина поли-U растяжек в целевой последовательности составляет 4 пары оснований или менее, содержание GC целевой последовательности находится в диапазоне 30% - 70%, целевая последовательность не прогнозируется для формирования сильных структур шпильки РНК, а целевая последовательность содержит минимальную прогнозируемую вторичную или третичную структуру РНК5.
В дополнение к конструкциям гРНК, шаг генетики мух в каждом протоколе также имеет решающее значение для успешной реализации. Наличие или отсутствие определенных фенотипов, передаваемых от родителей в потомствах, важно для идентификации и количественной оценки фенотипов, индуцированных системой CasRx у трансгетерозиготных потомков. Кроме того, настройка контрольных скрещиваний с использованием мух dCasRx параллельно также полезна для исключения неспецифических фенотипов у трансгетерозиговых потомков.
Стоит отметить, что эти результаты выявили проблему токсичности, вызванную повсеместной экспрессией белка CasRx и dCasRx в мухе, что является ограничением системы CasRx. Повсеместная экспрессия CasRx или dCasRx только под промотором Ubiq, без гРНК, сопровождалась нетривиальными затратами на приспособленность, поскольку ни мухи Ubiq-CasRx, ни Ubiq-dCasRx не могли быть установлены как гомозиготные линии. Напротив, мухи UASt-CasRx и UASt-dCasRx могут быть установлены как здоровые гомозиготные запасы, хотя из-за конструкции кросс-схемы они были сохранены как двойные сбалансированные запасы, что подтверждает существование токсичности, вызванной повсеместной экспрессией белка CasRx. Еще одно подтверждающее доказательство заключается в том, что в контрольных экспериментах с участием dCasRx, который каталитически неактивен, процент мух, несущих как dCasRx, так и гРНК-конструкции из общего числа мух в поколении F1, был последовательно ниже 50%, соотношение, ожидаемое на основе менделевской генетики, если не было токсичности, связанной с dCasRx. Это указывало на то, что повсеместно экспрессирующая dCasRx вместе с гРНК вызывает токсичность у мухи, что приводит к меньшему, чем ожидалось, соотношению наследования. Коэффициенты наследования трансгетерозиготных мух UASt-dCasRx, gRNA, GAL4 следовали менделевской генетике, что еще раз указывает на токсичность, вызванную именно повсеместной экспрессией белков CasRx и dCasRx. Токсичность в системе CRISPR/Cas не нова. Было показано, что большое количество белка Cas9 токсично в нескольких организмах, включая мух29,30,31,32. Недавнее исследование разработало индивидуальную систему GAL4 / UAS, которая может настраивать количество белка Cas9, экспрессируемого в мухах, добавляя открытый кадр считывания различной длины между последовательностью UAS и последовательностью Cas9 в конструкции UAS-Cas933. Поэтому стоит изучить способы снижения токсичности, вызванной CasRx, путем настройки уровня экспрессии белка CasRx.
Помимо токсичности, вызванной повсеместной экспрессией белков CasRx и dCasRx, результаты также показали летальность, связанную с неспецифическими побочными эффектами системы CasRx вне цели, что характерно для многих систем CRISPR1,2,7,34. У некоторых CasRx и несущественных генов гРНК-экспрессирующих двойных или тройных трансгетерозиговых мух, например, при нацеливании на Notch, трансгетерозиготные мухи CasRx имеют значительно более низкие уровни выживаемости по сравнению с трансгетерозгическими мухами dCasRx. В анализе RNA-seq этих CasRx и гРНК-экспрессирующих трансгетерозиготных мух наблюдалось как снижение уровней транскриптов генов-мишеней, так и снижение транскриптов нецелевых генов. Эти побочные эффекты были CasRx-зависимыми и целевыми, поскольку они наблюдались только у трансгетерозиготных мух, экспрессирующих как белок CasRx, так и гРНК. Стоит отметить, что один из генов-мишеней, белый, показал лишь ограниченное, нестатистически значимое снижение транскриптов, когда белый ген был нацелен casRx, что контрастировало с четким фенотипом восстановления пигмента. Предполагается, что это может быть связано с тем, что 1) сроки сбора образцов РНК-seq не были хорошо согласованы со сроками, когда белый ген достигает своей пиковой экспрессии во время раннего развития, и 2) локализованная экспрессия белого гена в глазах затрудняет сбор соответствующих тканей на ранней стадии развития, когда возможен только сбор образцов всего тела. Чтобы снизить коллатеральную активность в системе CasRx, необходимы будущие исследования, чтобы полностью понять механизмы, лежащие в основе системы нецелевых явлений на уровне организма.
Интересно, что недавнее исследование35 , описывающее инструменты Cas13, нацеленные на РНК у мух, по-видимому, улучшает общую токсичность, связанную с экспрессией CasRx, по нескольким возможным причинам. Во-первых, авторы перекодировали трансгены Cas13 для оптимизации экспрессии у дрозофилы и использовали более слабо экспрессирующий промотор (актин 5C) по сравнению с промотором убиквитина, используемым в настоящем исследовании, что, вероятно, привело к снижению уровня экспрессии Cas13 и, следовательно, меньшей токсичности. Действительно, это подтверждается наблюдениями о том, что экспрессия CasRx и dCasRx, управляемая UASt, сама по себе не была токсичной, поскольку это исследование (и авторы в 35) не наблюдали какой-либо очевидной летальности у мух UASt-CasRx. Кроме того, эти авторы кодировали свои гРНК по-разному по сравнению с этим исследованием, что, возможно, повлияло на их экспрессию и снизило токсичность системы у трансгетерозиготных мух Cas13 / gRNA. Например, в их исследовании две гРНК были экспрессированы с использованием промотора U6: 3 и окружены тРНК, чтобы обеспечить обработку гРНК при созревании тРНК без необходимости CasRx35. И наоборот, в этом исследовании гРНК были закодированы как массивы, нацеленные на до 4 мест на ген и имитирующие эндогенную структуру массива Cas13, обнаруженную у бактерий, которая требует фермента Cas13 для обработки каждой гРНК. Эти различные подходы, возможно, привели к различиям в уровнях экспрессии гРНК и других факторах, которые могут оказывать неотъемлемое влияние на токсичность всей системы. Наконец, Huynh et al. нацелились на гены, отличные от тех, которые были нацелены в настоящем исследовании, что приводит к различиям во взаимодействии мишени Cas / gRNA и коллатеральной активности и может оказывать влияние на наблюдаемые уровни летальности. Эти различия в наблюдаемой токсичности требуют дальнейшего изучения для выявления способов улучшения общих систем.
В целом, это исследование является первой демонстрацией функциональной генетически закодированной программируемой системы Cas, нацеленной на РНК, в D. melanogaster, хотя дальнейшая оптимизация системы CasRx (в соответствии с тем, что сообщается35) потребуется для дальнейшего снижения летальности вне цели и повышения эффективности расщепления CasRx на цели. РНК-таргетинг с ферментами Cas является быстро развивающейся областью со многими потенциальными приложениями, начиная от борьбы с насекомыми-переносчиками до терапевтического использования1,2,3,4,5,6,7, и этот протокол предлагает стартовый пакет для всех, кто заинтересован в разработке своей первой системы CasRx на мухах, будучи совместимым с настройкой и дальнейшей оптимизацией системы. Примеры, представленные здесь, демонстрируют ряд результатов, с которыми можно столкнуться при внедрении этой системы in vivo, и могут служить ориентирами для других пользователей при оценке производительности системы CasRx в их приложениях.
Раскрытие информации
O.S.A является основателем Agragene, Inc., имеет долю в акционерном капитале и входит в состав Научно-консультативного совета компании. Условия этого соглашения были рассмотрены и одобрены Калифорнийским университетом в Сан-Диего в соответствии с его политикой конфликта интересов. Все остальные авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа была частично поддержана финансированием гранта DARPA Safe Genes Program Grant (HR0011-17-2-0047) и наград NIH (R21RAI149161A, DP2AI152071), присужденных O.S.A.
Материалы
| Name | Company | Catalog Number | Comments |
| 100% Grape Juice | Welch Foods Inc. | N/A | |
| Active Dry Yeast (908g) | Red Star Yeast Company, LLC | N/A | |
| DMC4500 color camera | Leica Microsystems | DMC4500 | |
| Dual-Luciferase Reporter Assay System | Promega | E1910 | |
| GAL4-GMR flies | Bloomington Drosophila Stock Center | 29967 | |
| GAL4-y flies | Bloomington Drosophila Stock Center | 44373 | |
| Glomax 20/20 Luminometer | Promega | E5331 | |
| Illumina HiSeq2500 Sequencer | Illumina, Inc. | HiSeq2500 | |
| M165FC fluorescent stereomicroscope | Leica Microsystems | M165FC | |
| Nanodrop OneC UV-vis spectrophotometer | ThermoFisher | NDONEC-W | |
| NEBNext Ultra II RNA Library Prep Kit | New England Biolabs, Inc. | E7770 | |
| plasmid # 112686 | Addgene | 112686 | |
| plasmid # 112688 | Addgene | 112688 | |
| plasmid # 132416 | Addgene | 132416 | |
| plasmid # 132417 | Addgene | 132417 | |
| plasmid # 132419 | Addgene | 132419 | |
| plasmid # 132420 | Addgene | 132420 | |
| plasmid # 132421 | Addgene | 132421 | |
| plasmid # 132422 | Addgene | 132422 | |
| plasmid # 132425 | Addgene | 132425 | |
| plasmid # 132426 | Addgene | 132426 | |
| plasmid # 133304 | Addgene | 133304 | |
| plasmid # 164586 | Addgene | 164586 | |
| plasmid #132418 | Addgene | 132418 | |
| plasmid pJFRC81 | Addgene | 36432 | |
| Qiagen RNeasy Mini Kit | Qiagen | 74104 | |
| Restriction endonucleases AscI | New England Biolabs Inc. | R0558L | |
| Restriction endonucleases NotI | New England Biolabs Inc. | R0189L | |
| Restriction endonucleases PacI | New England Biolabs Inc. | R0547L | |
| Restriction endonucleases PstI | New England Biolabs Inc. | R0140L | |
| Restriction endonucleases SwaI | New England Biolabs Inc. | R0604L | |
| Restriction endonucleases XbaI | New England Biolabs Inc. | R0145L | |
| RNA 6000 Pico Kit for Bioanalyzer | Agilent Technologies | 5067-1513 | |
| Turbo DNase | Invitrogen | AM2238 | |
| U6-3:4-gRNA-Fluc flies | Bloomington Drosophila Stock Center | 84125 | |
| U6-3:4-gRNA-GFP; OpIE2-GFP flies | Bloomington Drosophila Stock Center | 84986 | |
| U6-3:4-gRNA-N flies | Bloomington Drosophila Stock Center | 84122 | |
| U6-3:4-gRNA-w flies | Bloomington Drosophila Stock Center | 84124 | |
| U6-3:4-gRNA-y flies | Bloomington Drosophila Stock Center | 84123 | |
| UASt-CasRx flies | Bloomington Drosophila Stock Center | 84121 | |
| UASt-dCasRx flies | Bloomington Drosophila Stock Center | 84120 | |
| Ubiq-CasRx flies | Bloomington Drosophila Stock Center | 84118 | |
| Ubiq-dCasRx flies | Bloomington Drosophila Stock Center | 84119 | |
| Ubiq-Firefly-T2A-eGFP-Ubiq-Renilla flies | Bloomington Drosophila Stock Center | 84127 | |
| Zymoclean Gel DNA Recovery Kits | Zymo Research Corporation | D4007 |
Ссылки
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nat Communications. 9, 1911 (2018).
- Abudayyeh, O., et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. 353 (6299), 5573 (2016).
- East-Seletsky, A., O'Connell, M., Burstein, D., Knott, G., Doudna, J. RNA Targeting by Functionally Orthogonal Type VI-A CRISPR-Cas Enzymes. Molecular Cell. 66 (3), 373-383 (2017).
- Konermann, S., Lotfy, P., Brideau, N., Oki, J., Shokhirev, M., Hsu, P. Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors. Cell. 173 (3), 665-676 (2018).
- Buchman, A., Brogan, D., Sun, R., Yang, T., Hsu, P., Akbari, O. Programmable RNA Targeting Using CasRx in Flies. The CRISPR Journal. 3 (3), 164-176 (2020).
- Kushawah, G., et al. CRISPR-Cas13d Induces Efficient mRNA Knockdown in Animal Embryos. Developmental Cell. 54 (6), 805-817 (2020).
- Abudayyeh, O., et al. RNA targeting with CRISPR-Cas13. Nature. 550, 280-284 (2017).
- Perrimon, N., Ni, J., Perkins, L. In vivo RNAi: today and tomorrow. Cold Spring Harbor Perspectives in Biology. 2, 003640 (2010).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448, 151-156 (2007).
- Ni, J., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Ni, J., et al. A genome-scale shRNA resource for transgenic RNAi in Drosophila. Nature Methods. 8, 405-407 (2011).
- Ni, J., et al. Vector and parameters for targeted transgenic RNA interference in Drosophila melanogaster. Nature Methods. 5, 49-51 (2008).
- Heigwer, F., Port, F., Boutros, M. RNA Interference (RNAi) Screening in Drosophila. Genetics. 208 (3), 853-874 (2018).
- Kulkarni, M., et al. Evidence of off-target effects associated with long dsRNAs in Drosophila melanogaster cell-based assays. Nature Methods. 3, 833-838 (2006).
- Ma, Y., Creanga, A., Lum, L., Beachy, P. Prevalence of off-target effects in Drosophila RNA interference screens. Nature. 443, 359-363 (2006).
- Perrimon, N., Mathey-Prevot, B. Matter arising: off-targets and genome-scale RNAi screens in Drosophila. Fly. 1 (1), 1-5 (2007).
- Markstein, M., Pitsouli, C., Villalta, C., Celniker, S., Perrimon, N. Exploiting position effects and the gypsy retrovirus insulator to engineer precisely expressed transgenes. Nature Genetics. 40, 476-483 (2008).
- Champer, J., Buchman, A., Akbari, O. Cheating evolution: engineering gene drives to manipulate the fate of wild populations. Nature Review Genetics. 17 (3), 146-159 (2016).
- Buchman, A., et al. Broad dengue neutralization in mosquitoes expressing an engineered antibody. PLoS Pathogens. 16 (4), 1008103 (2020).
- Mathur, G., Sanchez-Vargas, I., Alvarez, D., Olson, K., Marinotti, O., James, A. Transgene-mediated suppression of dengue viruses in the salivary glands of the yellow fever mosquito, Aedes aegypti. Insect Molecular Biology. 19 (6), 753-763 (2011).
- Franz, A., et al. Engineering RNA interference-based resistance to dengue virus type 2 in genetically modified Aedes aegypti. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4198-4203 (2006).
- Yen, P., James, A., Li, J., Chen, C., Failloux, A. Synthetic miRNAs induce dual arboviral-resistance phenotypes in the vector mosquito Aedes aegypti. Communications Biology. 1, 11 (2018).
- Buchman, A., et al. Engineered resistance to Zika virus in transgenic Aedes aegypti expressing a polycistronic cluster of synthetic small RNAs. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3656-3661 (2019).
- . Addgene Available from: https://www.addgene.org/protocols/restriction-digest/ (2020)
- Gibson, D., Young, L., Chuang, R., Venter, J., Hutchison, C., Smith, H. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- . Addgene Available from: https://www.addgene.org/protocols/pcr/ (2020)
- . Indiana University Bloomington Available from: https://bdsc.indiana.edu/information/recipes/bloomfood.htmL (2020)
- Dobin, A., et al. STAR:ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Jiang, W., Brueggeman, A., Horken, K., Plucinak, T., Weeks, D. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryotic Cell. 13 (11), 1465-1469 (2014).
- Poe, A., et al. Robust CRISPR/Cas9-Mediated Tissue-Specific mutagenesis reveals gene redundancy and perdurance in Drosophila. Genetics. 211 (2), 459-472 (2019).
- Port, F., Chen, H., Lee, T., Bullock, S. Optimized CRISPR/Cas tools for efficient ger mLine and somatic genome engineering in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (29), 2967-2976 (2014).
- Yang, S., Li, S., Li, X. Shortening the Half-Life of Cas9 maintains its gene editing ability and reduces neuronal toxicity. Cell Reports. 25 (10), 2653-2659 (2018).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. eLife. 9, 53865 (2020).
- Zhang, X., Tee, L., Wang, X., Huang, Q., Yang, S. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy - Nucleic Acids. 4 (17), 264 (2015).
- Huynh, N., Depner, N., Larson, R., King-Jones, K. A versatile toolkit for CRISPR-Cas13-based RNA manipulation in Drosophila. Genome Biology. 21, 279 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены