Method Article
CRISPR/CasRxを用いた ショウジョウバエメラノガスター におけるユビキタスおよび組織特異的RNAターゲティング
要約
この記事では、ハエでRNA標的Cas13D酵素(RfxCas13D)を使用するための詳細なプロトコルを概説します。
要約
CasRxは、RNA標的Cas13ファミリーの一員であり、細胞レベルと生物体レベルの両方で魅力的なオフターゲットプロファイルを有する効率的な遺伝子転写低減におけるCRISPR/Cas技術の有望な新たな追加である。最近、CRISPR/CasRxシステムは、ショ ウジョウバエメラノガスターのユビキタスおよび組織特異的遺伝子転写低減を達成するために使用できることが報告されています。この論文は、3つの部分からなる最近の研究の方法を詳述する:1)2成分CasRxシステムを用いたインビボ内在RNA標的化。2)3成分CasRxシステムを用いた標的化インビボ外生RNAのユビキタス;3)3成分CasRxシステムを用いたインビボRNAターゲティングの組織特異的。観察されたRNA標的化の効果には、標的遺伝子特異的表現型変化、標的RNA転写低下、CasRxタンパク質および副産物活性の高発現に関連する時折の致死性表現型が含まれる。全体として、これらの結果は、CasRxシステムがプログラム可能かつ効率的な方法で生物レベルでRNA転写産物の減少を標的にすることができることを示し、生体内転写法ターゲティングが実現可能であり、エンジニアリングが実現可能であり、vivo CRISPRベースのRNA標的技術における将来の基礎を築く。
概要
クラスター化された定期的に間隔を組んだ短いパリンドローム反復(CRISPR)技術の出現以来、この分野の焦点の多くは、医学とバイオテクノロジーの変革的なアプリケーションを提供するDNA編集に焦点を当てています1。しかし、DNA配列の永久的な変化は、倫理的な配慮のために必ずしも望ましいとは限らない。これを踏まえて、最近の研究では、RNAを標的とするCRISPRベースのツールの開発が始まり、CRISPR技術が実際に様々な生物学的システムでRNA標的化に使用できることを実証しました2,3,4,5,6,7。これらのシステムの多くが試験されたRNAおよび転写物の減少を標的にするための現在広く使用されているアプローチは、RNA干渉(RNAi)であり、これは完璧とは程遠く、生体内で使用すると様々な有効性と高いオフターゲット活性を示すことが多い8,9,10,11,12,13,14,15,16,17 .したがって、これらの技術の状況を考えると、RNAターゲティングのためのCRISPRベースのツールの可能性をさらに探求する価値があります。
最近の注目すべき研究では、Cas13dクラスのメンバーであるリボヌクレアーゼCasRxは、ヒト細胞培養における遺伝子転写レベルを効率的に低下させ、魅力的なオフターゲットプロファイル4を有することが報告された。この発見は、この新しいリボヌクレアーゼが生物レベルで標的とするRNAの有効性と低いオフターゲット率を維持できるかどうかという問題につながった。最近の研究では、CasRxシステムがショウジョウバエメラノガスター5のユビキタスおよび組織特異的遺伝子転写を達成するために使用できることを示すことによって、この質問に対処しました。
最近公開されたこのアプローチの使いやすさを合理化するために、このプロトコルは、3つの主要な部分で構成されるこの最近の研究の方法を詳述しています: 1) 2成分CasRxシステムを使用して標的化インビボRNAでユビキタス;2)3成分CasRxシステムを用いた標的化インビボ外生RNAのユビキタス;3)組織特異的な生体内RNAターゲティングは、3成分CasRxシステムを用いた。
ガイドRNA(gRNA)は、ユビキタスプロモーターの制御下で異なる標的遺伝子を標的とし、これらのgRNA含有構築物を発現するフライラインを設計し、生成した。CasRxは、ユビキタスプロモーター、またはGAL4転写因子によって活性化可能な条件付き上流活性化シーケンス(UASt)プロモーターの制御下にある構築物も、生成されたこれらのCasRx含有構成体を収容するフライラインと設計された。触媒的に非アクティブなCasRxコンストラクト、dCasRxは、設計され、否定的なコントロールとして使用されました。ハエを標的とするユビキタスRNAは、ユビキタスCasRx発現フライラインとgRNA発現フライラインを横断することによって達成される。特定の遺伝子転写産物を標的とするgRNA構築物とCasRxタンパク質の両方を発現する子孫は、標的遺伝子転写産物のユビキタスな還元を有する。ハエを標的とする組織特異的RNAは、最初にハエを発現するUASt-CasRxを用いてgRNA発現ハエを交播し、gRNAおよびUASt-CasRxコンストラクトの両方を運ぶ経ヘテロ接合ハエを得ることによって達成される。このようなハエは、組織特異的なGAL4発現ハエと交配し、その結果、ハエにおける組織特異的CasRx発現およびRNA標的化の生成をもたらす。
CasRxシステムのプログラム可能な性質は、生体内RNAターゲティングのための高い有効性と低いオフターゲット活性を達成するのに役立つカスタマイズと最適化の可能性を提供しています。CRISPRベースのRNA標的化の潜在的な用途は、実験室でRNAiを置き換え、野生の昆虫ベクター制御に寄与するなど、数多くあります。後者の1つは、世界的なアンメットニーズの1つは、蚊を介して伝染するRNAウイルスの感染に対抗するための効率的なツールの開発です。デング熱、ジカ、チクングニアウイルスなどの多くのRNAウイルスは蚊を介して伝染し、人間の健康に影響を与え、死亡率に寄与する。病気予防のためのウイルス抵抗性を有する蚊集団のエンジニアリングのための多くの提案がなされている。しかし、現在の技術では、蚊がすべての重要なRNAウイルスに同時に耐性を持つ18,19,20,21,22,23に耐性を持つものではありません。RNA標的Casシステムは、すべての蚊媒介性RNAウイルスを標的とするプログラム可能なプラットフォームを可能にすることによって、このような技術の出発点を提供するかもしれない。
プロトコル
1. 2成分CasRxシステムを用いたインビボRNA標的化
- Ubiq-CasRx および Ubiq-dCasRx 発現ベクターの生成
- プライマー1050Eでポリメラーゼ連鎖反応(PCR)を用いてCasRx配列を増幅する。C3および1050E。C4 と元の CasRx は pNLS-RfxCas13d-NLS-HA (pCasRx) を構築します。プライマー 1050E を用いた PCR を使用して dCasRx 配列を増幅する。C3および1050E。C4 と元の dCasRx は、pNLS-dRfxCas13d-NLS-HA (pdCasRx)4 を構築します (表 1)。その後、ゲル精製キットを使用して増幅されたCasRxおよびdCasRxフラグメントをゲル精製します。
- 消化塩基ベクター(アプゲンプラスミド #112686)と制限酵素 SwaI および PacI24.得られた製品では、キットを使用して、ベースベクターバックボーンと呼ばれるより大きな断片をゲル化します。
- ギブソンアセンブリメソッドを使用して、ベースベクトルバックボーンとCasRxフラグメントを使用してUbiq-CasRxベクトルを組み立てます。ベース ベクター バックボーンと dCasRx フラグメントを使用して、ギブソン アセンブリメソッド25を使用して Ubiq-dCasRx ベクターを組み立てます。
注: Ubiq-CasRx ベクター (OA-1050E) の Addgene ID は #132416、Ubiq-dCasRx ベクター (OA-1050R) の追加遺伝子 ID は #132417です。
- gRNA発現ベクターの生成
- 以下の基準に基づいて各gRNA断片を設計する:30ヌクレオチド長の標的配列;ターゲットシーケンスのポリUストレッチの最大長は4塩基対です。ターゲット配列GC含有量は30%~70%の範囲内にある。標的配列は、強力なRNAヘアピン構造を形成しないと予測した。そして、最小予測RNA二次または三次構造を含む標的配列5。
注:この研究は、各gRNAを4タンデム配列として設計し、30ヌクレオチドの長さ、36ヌクレオチドの長い直接繰り返し、および両端に7-チアミンターミターを使用して間隔をあけた5。外因性標的遺伝子については、GFP、上記と同様の基準に従い、OpIE2-GFPフラグメント5を添加した。 - プライマー 1043.C1 および 1043.C23 およびアプジーン プラスミド #112688 (表 1)26 を使用して、U6:3 プロモーター配列を増幅します。ゲル精製キットを使用して増幅されたU6:3フラグメントをゲル精製します。
- 制限酵素AscIとXbaI24とダイジェストアジーンプラスミド#112688。得られた製品では、キットを使用して、プレベースベクターバックボーンと呼ばれるより大きな断片をゲル化します。
- Gibson アセンブリメソッド25を使用して、ベースベクターの前骨格とU6:3フラグメントを使用してベースベクトルを組み立てます。以下の基底ベクトルはOA-1043と名付けられます。
注: プラスミド OA-1043 の Addgene ID は #164586です。 - 外部遺伝子合成サービスを用いて標的遺伝子のgRNA断片を合成する。
- 制限酵素PstIとNotI24でベースベクターOA-1043を消化します。消化されたOA-1043と呼ばれる全体の消化産物を、保ちます。
- ギブソン集合法25を用いて、消化されたOA-1043および標的遺伝子gRNA断片を用いてgRNA発現ベクターを組み立てる。
注:4つの標的遺伝子が研究された:3つは内因性(白、 ノッチ、 黄色)、1つは外因性(GFP)であった。彼らのAddgene IDは、#132420(gRNAw)、#132421(gRNAN)、#132425(gRNAy)、#133304(gRNAGFP)です。
- 以下の基準に基づいて各gRNA断片を設計する:30ヌクレオチド長の標的配列;ターゲットシーケンスのポリUストレッチの最大長は4塩基対です。ターゲット配列GC含有量は30%~70%の範囲内にある。標的配列は、強力なRNAヘアピン構造を形成しないと予測した。そして、最小予測RNA二次または三次構造を含む標的配列5。
- トランスジェニックハエの生成
- 外部フライ胚注射サービスを使用してフライ胚に発現ベクターを注入し、ØC31統合部位を含むハエからの胚を注入する。注入した胚を26°Cで後部とする。
注:attp40w(第2 染色体の統合サイト)ラインはCasRxラインを生成するために使用され、8622(第3 染色体の統合サイト)ラインは、様々なgRNAラインを生成するために使用されました。 - ハエはホモ接合線またはバランスの取れたヘテロ接合線として保管してください。
注:Ubiq-CasRxとUbiq-dCasRxハエは、バランサとしてCyOとのバランスラインをヘテロ接合として維持されました。さらに、Ubiq-CasRx と Ubiq-dCasRx の両方のベクターには、dsRed マーカーが含まれています。その結果、Ubiq-CasRxとUbiq-dCasRxハエは、DsRed陽性、巻き翼、白い目の3つの表現型を持っています。gRNA発現ハエはホモ接線として保たれた。ブルーミントン・ショウジョウバエストックセンター(BDSC)フライストック番号は、#84118(Ubiq-CasRx)、#84119(Ubiq-dCasRx)、#84124(gRNAw)、#84122(gRNAN)、#84123(gRNAY)、#84986(gRNAGFP)です。
- 外部フライ胚注射サービスを使用してフライ胚に発現ベクターを注入し、ØC31統合部位を含むハエからの胚を注入する。注入した胚を26°Cで後部とする。
- フライ遺伝学(図1A)
- ホモ接合gRNAラインから10人の処女成人の雌のハエを収集し、バランスのとれたヘテロ接合Ubiq-CasRx / CyOラインから5人の成人男性ハエを収集します。採取した雌と雄のハエは、親のハエと呼ばれ、乾燥酵母粉末を補ったバイアルに入れます(図1A)。
- 3 つの反復を生成する前の手順を 3 回繰り返します。コントロールグループの場合は、他のすべてを同じに保ちながら、Ubiq-dCasRx/CyOラインを使用します。
注:食品の通常のガラスバイアルの場合、乾燥酵母粉末の0.1 gで十分です。BDSCのフライフードのレシピが使用されます。 - ペアレンタルハエを含むバイアルを26°Cで48時間後回しにします。その後、すべてのバイアルからすべての親のハエを削除します。その後、バイアルを26°Cで少なくとも20日間保管してください。
- 毎日バイアルを観察して、F1世代の子犬から新しい成人の子孫が出現したかどうかを確認してください。その場合は、フライバイアルの中に二酸化炭素タンクに接続されたチューブを挿入し、フロースイッチを10秒間オンにして二酸化炭素で麻酔します。
- ハエが動かなくなると、バイアルからフライパッドに空にし、二酸化炭素タンクにも接続され、二酸化炭素はフライパッドを通って連続的に流出します。
- 麻酔付きハエの表現型をスコアリングし、蛍光体顕微鏡に接続されたカラーカメラを使用してそれらを画像化します。異なる原型を持つ子孫の数を数えます。イメージ後処理およびコンパイルには、画像処理ソフトウェアを使用します(図2A -2D)。
注:メンデリア遺伝学に基づいて、各十字架の前立性の間で2種類のハエが期待されます(図1A)。
- RNA-セク(図 2E – 2G)
- サンプルコレクション
注: 以下の 3 つの例から適切なサンプル収集方法を選択してください。各特殊サンプル・タイプごとに 3 つの反復が必要です。- 大人のフライヘッドサンプルコレクション
- ホモ接合gRNAラインから10人の処女成人雌のハエを収集します。バランスのとれたヘテロ接合Ubiq-CasRx / CyOラインから5大人の男性のハエを収集します。採取した雌とオスのハエは、親のハエで、乾燥酵母粉末を補ったバイアルに入れます。
- 3 回の反復で、前の手順を 3 回繰り返します。コントロールグループの場合は、他のすべてを同じに保ちながら、Ubiq-dCasRx/CyOラインを使用します。
- ペアレンタルハエを含むバイアルを26°Cで48時間後回しにします。その後、すべてのバイアルからすべての親のハエを削除します。その後、前生が子犬から出てくるまでバイアルを26°Cに保ちます。
- 正しい表現型で10の1日の大人のハエを収集します。二酸化炭素でハエを麻酔し、フライヘッドを切断し、ドライアイスの上に1.5 mL遠心チューブに頭を入れます。遠心管は-80°Cで保管してください。 3 回のレプリケートに対してこの手順を 3 回繰り返します。
- 17 – 20時間齢の胚サンプルコレクション
- ホモ接合gRNAラインから8-10処女成虫の女性のハエを収集します。4-5大人の雄ハエをバランスのとれたヘテロ接合Ubiq-CasRx /CyOラインから収集します。採取した雌とオスのハエは、親のハエで、乾燥酵母粉末を補ったバイアルに入れます。
- 3 回の反復で、前の手順を 3 回繰り返します。コントロールグループの場合は、他のすべてを同じに保ちながら、Ubiq-dCasRx/CyOラインを使用します。
- ペアレンタルハエを含むバイアルを26°Cで48時間後回しにします。
- このレシピに続いて複製ごとに1つのブドウ果汁胚採取室を準備する:376 mLの水、126 mLのブドウジュース、15gの寒天、6gのスクロース。1 Lビーカーにメディアを入れ、泡/泡が表示されるかどうかを確認するためにビーカーのメディアを注意深く見ながら、それを5〜6分間高く電子レンジします。もしそうなら、電子レンジを停止し、泡/泡が落ち着くようにしましょう。泡がはっきりするまで、この方法でマイクロウェーブを続けます。すべての気泡がクリアされるまで旋回しないでください。最後に、100%アルコール10mLと酢酸5mLを加えます。よく混ぜてから、メディアを35mmのペトリ皿に25 mLの血清学的ピペットでパイプします。メディアがペトリ皿で固まるとき、それは使用する準備ができている。
- 48時間のインキュベーションの終わりに、親のハエをブドウジュース胚採取室に移し、26°Cで3時間培養した。その後、26°Cでさらに17時間ブドウジュースプレートに焼きたての胚を保ちながら、成体ハエを取り除きます。
- インキュベーション後、ブドウ果汁プレートから50~100個の胚を回収し、脱イオン水に沈めて胚表面をきれいにし、氷上の1.5mL遠心チューブに移します。-80°Cで保管してください。 3 回のレプリケートに対してこの手順を 3 回繰り返します。
- 最初のインスター幼虫サンプルコレクション
- ホモ接合gRNAラインから8-10処女成虫の女性のハエを収集します。4-5大人の雄ハエをバランスのとれたヘテロ接合Ubiq-CasRx /CyOラインから収集します。採取した雌とオスのハエは、親のハエで、乾燥酵母粉末を補ったバイアルに入れます。3 回のレプリケートに対してこの手順を 3 回繰り返します。コントロールグループの場合は、他のすべてを同じに保ちながら、Ubiq-dCasRx/CyOラインを使用します。
- ペアレンタルハエを含むバイアルを26°Cで48時間後回しにします。その後、26°Cで一晩インキュベーション(16時間)のために別の新しい通常の食品バイアルに大人のハエを移します。 その後、大人のハエを取り除く。
- 胚含有バイアルを24時間26°Cに保ち、次に、基づいた別個のマーカーを使用して顕微鏡下で最初に半月形のインスター幼虫を採点する。正しいフェノタイプで15-30の幼虫を収集し、1.5 mL遠心分離チューブに入れ、-80°Cで保管してください。 3 回のレプリケートに対してこの手順を 3 回繰り返します。
- 大人のフライヘッドサンプルコレクション
- シークエンシング
- RNA抽出: 市販の RNA 抽出キットを使用し、キットの指示に従ってすべてのサンプルを処理します。次に、抽出したRNAサンプルを市販のデオキシリボヌクレアーゼとインキュベートし、その指示に従って、サンプルから汚染DNAを除去する。
- 市販のUV-vis分光光度計を用いてRNA濃度を測定する。市販のRNA完全性アッセイ設定を使用してサンプル中のRNA完全性を測定します。
- 市販のRNAライブラリ調製キットを使用してRNA-seqライブラリを構築します。
- ライブラリシーケンスには、次の設定で外部シーケンス サービスを使用します。読み取り長:50nt、深さ:ライブラリあたり2000万読み取り。RTA 1.18.64 でベース コールを実行し、bcl2fastq 1.8.4 を使用してデータを FASTQ に変換します。
注:生のシーケンシングデータは、国立バイオテクノロジー情報シーケンシング読み取りアーカイブセンター(提出ID:SUB6818910[BioProject:PRJNA600654])にあります。
- バイオインフォマティクス
- マップは、バークレー・ショウジョウバエゲノムプロジェクト(GenBank加盟番号:GCA_000001215.4)から6つのショウジョウバエメラノガスターゲノムをリリースするシーケンシングデータと、STAR aligner28のデフォルトパラメータ設定を使用して外因性CasRxおよびGFPシーケンスに読み取り、"outFilterType BySJout"オプションと「sgtjdbF」オプションを追加Drosophila_melanogaster。BDGP6.22.97.gtf"遺伝子導入形式ファイルをENSEMBLから。
- 「-t exon -g gene_id -M -O -fraction」オプションを使用して、各コメント付きトランスクリプトの各コメント付きトランスクリプトの数を計算します。次に、「addTpmFpkmToFeatureCounts.pl」Perl スクリプトを使用して、総トランスクリプト数を使用して生のトランスクリプトカウントを正規化します。
- DESeq2パイプラインの元の収縮推定器で最大の後処理法を使用して、各遺伝子の対数折り変化(LFC)を推定します。
- サンプルコレクション
2. ユビキタス in 生体外発性RNA標的化 3成分 CasRx システム
- 外因性標的ユビキタス発現ベクトルの生成
- PCRはプライマー1052Bを用いてUbiqプロモーター断片を増幅する。C1および1052B。C2とアプジーンプラスミド #112686 26.次いで、PCRは、アプジーンプラスミド#112686から増幅したT2A-eGFPフラグメントをプライマー908A.1および908A.2で増幅する(表1)26。次いで、PCRは、インプレッマー908A.3および908A.4を用いたアデンジーンプラスミド#112686を用いて、Ubiqプロモーター断片を逆転配列として増幅する(表1)26。ゲル精製は、Ubiqプロモーターフラグメント、T2A-eGFPフラグメント、およびゲル精製キットを用いて逆Ubiqプロモーターフラグメントを精製する。
- カスタムホタルルシメラーゼコード配列とp10 3'UTRフラグメントを含むカスタムフラグメントを注文し、逆レニラルシファーゼの後にSV40 3'UTRフラグメントを続けます。
- 制限酵素AscIとXbaI24とダイジェストアジーンプラスミド#112688。得られた製品では、基幹ベクターバックボーンと呼ばれるゲル精製キットを用いて、より大きな断片をゲル精製する。
- ベースベクター骨格と次のフラグメントを使用してベースベクターを組み立てるには、ギブソンアセンブリ法を使用します:Ubiqプロモーターフラグメント、T2A-eGFPフラグメント、逆Ubiqプロモーターフラグメント、ホタルルシファーゼコーディング配列、および逆レニラルシメラーゼに続くSV40 3'UTRフラグメント25。
注: 得られたデュアルルシフェラーゼ発現ベクター(OA-1052B)のAddgene IDは#132426です。
- gRNA発現ベクターの生成
- PCRは、プライマー1043.C1および1043.C23およびアプジーンプラスミド#112688を用いてU6:3プロモーター配列を増幅する(表1)26。ゲル精製キットを使用して増幅されたU6:3フラグメントをゲル精製します。
- ダイジェストアプジーンプラスミド #112688 制限酵素AscIとXbaI24.得られた製品では、ゲル精製キットを用いて、プレベースベクターバックボーンと呼ばれるより大きな断片をゲル精製する。
- ギブソンアセンブリメソッド25を使用して、ベースベクターのバックボーンとU6:3フラグメントを使用してベースベクトルを組み立てます。以下の基底ベクトルはOA-1043と名付けられます。
- 外部遺伝子合成サービスを用いて標的遺伝子のgRNA断片を合成する。
- 制限酵素PstIとNotI24でベースベクターOA-1043を消化します。消化されたOA-1043と呼ばれる全体の消化産物を保管してください。
- ギブソン集合法25を用いて、消化されたOA-1043および標的遺伝子gRNA断片を用いてgRNA発現ベクターを組み立てる。
注: 結果として得られるプラスミド (OA-1052K) の Addgene ID は #132422 です。
- トランスジェニックハエの生成
- 第3染色体、BDSCフライストック番号9744、外部フライ胚注入サービスを介してØC31統合部位を含むハエからの胚を使用して、フライ胚にOA-1052Bベクターを注入する。同様に、第3染色体、BDSCフライストック番号8622にØC31統合部位を含むハエからの胚を使用して、フライ胚にOA-1052Kベクターを注入する。注入した胚を26°Cで後部とする。
- 二重ルシファーサ発現ハエを保ち、gRNAはホモ接合線として飛ぶ。セクション1で生成された単一バランスのヘテロ接合Ubiq-CasRxラインをTM6バランサー染色体を無精ひげ(Stb)マーカーで運ぶバランサラインに切り離し、白目、巻き翼、dsRed-蛍光フェータイプを持つ二重バランスのプロゲニーのみを保持することで、Ubiq-CasRxラインをダブルバランスヘテロ接合ラインとして保持します。
注:BDSCフライストック番号は、#84127(Ubiq-Fluc-Rluc)、#84125(gRNAFluc)です。
- フライ遺伝学(図1B および 図3A)
- デュアルルシファーゼ表現ラインから8-10処女成虫の女性のハエを収集します。4-5大人の男性ハエをバランスのとれたヘテロ接合Ubiq-CasRx /CyOから収集します。+/TM6、白目、巻き翼、およびdsRed蛍光を同時に示すStbライン。収集した雌と雄のハエを、親のハエである、乾燥酵母粉末(以下ステップ1クロスと呼ばれる)を補充したバイアルに入れます。
- 3 回の反復で、前の手順を 3 回繰り返します。コントロール グループの場合は、Ubiq-dCasRx/CyO を使用します。+/TM6、他のすべてを同じに保ちながらStbライン。
- 26°Cでペアレンタルハエを含むステップ1クロスバイアルを48時間後回しにします。その後、すべてのバイアルからすべての親のハエを削除します。その後、バイアルを少なくとも14日間26°Cに保ちます。この間、ホモ接ホタルルシファーゼターターゲットgRNAラインから8〜10人の女性の処女を集める。3 回のレプリケートに対してこの手順を 3 回繰り返します。
- 毎日ステップ1クロスバイアルを観察して、新しい大人のハエが子犬から出てくるかどうかを確認してください。もしそうなら、二酸化炭素でそれらを麻酔し、Ubiq-CasRx(またはUbiq-dCasRx)と子孫からのデュアルルシファーゼレポーターの両方を表現する5つの雄のハエを収集し、ホタルルシフェラーゼターターゲットgRNAラインから10人の処女女性と一緒に新しいバイアルに入れます(以下、ステップ2クロスと呼ばれます)。3 回のレプリケートに対してこの手順を 3 回繰り返します。
- ステップ1クロスバイアルからUbiq-CasRx(またはUbiq-dCasRx)とデュアルルシファーゼレシンの両方を表現する別の5 1日の男性を収集し、26°Cで2〜4日間インキュベートします。 その後、1.5 mL遠心分離チューブに移し、-80°Cで保管してください。 3 回の反復に対してこの手順を 3 回繰り返します。
- 26°Cでペアレンタルハエを含むステップ2クロスバイアルを48時間後回しにします。その後、すべてのバイアルからすべての親のハエを削除します。その後、バイアルを26°Cで少なくとも20日間保管してください。
- 毎日ステップ2クロスバイアルを観察して、新しい成人の子孫が子犬から出てきたかどうかを確認してください。その場合は、二酸化炭素で麻酔をし、麻酔付きハエの表型を採点し、蛍光顕微鏡を装備したカラーカメラを使用して画像化します。異なる原型を持つ子孫の数を数えます。イメージの後処理およびコンパイルには、画像処理ソフトウェアを使用します(図 3B – 3C)。
注:メンデリア遺伝学は、ハエがすべて実行可能であれば、ステップ2クロスの子孫の間で4種類のハエが予想され、それぞれが人口の25%を占めていることを示唆しています(図1B および 図3A)。
- ルシファーゼアッセイ(図3D)
- ステップ2.4.1-2.4.5を繰り返して、三重のトランスヘテロ接星飛行とコントロールハエを生成します。オスのハエは生後3日まで集めて、年齢を重くする。
- 3日間のハエを1.5mL遠心分離チューブに移し、市販のルシファーゼアッセイキットの害虫およびルシファーゼライシスバッファーを使用してそれらをライスします。
- 各サンプルから5μLのリズした組織を使用して、市販のルシファーゼアッセイキットとルミノメーターを使用してホタルとレニラルシメラーゼ活性を測定します。
3. 生体内での組織特異的なRNA標的化
- 生成する UASt-CasRx と UASt-dCasRx 式のベクター
- PCR はプラスミド pJFRC81 およびプライマー 1041.C9 および 1041.C11 を使用して UASt プロモーター配列を増幅します。次いで、PCRは、プラスミドOA-1050E(addgene ID #132416)およびプライマー1050Lを用いてCasRxフラグメントを増幅する。C1および1050E。C4;PCR は、プラスミド OA-1050R (addgene ID #132417) およびプライマー 1050L を使用して dCasRx フラグメントを増幅します。C1および1050E。C4(表1)26。ゲル精製キットを使用して、増幅された UASt プロモーター配列、CasRx、および dCasRx フラグメントをゲル精製します。
- 消化酵素 NotI および PacI24 を含むダイジェストベースベクター (アプゲンプラスミド #112686)得られた製品では、ゲル精製キットを用いて、基ベクトル骨格と呼ばれる大きな断片をゲル精製する。
- ベース ベクターバックボーン、UASt プロモーター シーケンス、およびギブソン アセンブリを使用して CasRx フラグメントを使用して UASt-CasRx ベクターを組み立てます。次に、ベース ベクターバックボーン、UASt プロモーター シーケンス、およびギブソン アセンブリ メソッド 25 を使用して dCasRx フラグメントを使用して UASt-dCasRx ベクターを組み立てます。
注: UASt-CasRx ベクターは、アプジェネ プラスミド #132418、UASt-dCasRx ベクターは、アドイン遺伝子プラスミド #132419
- トランスジェニックハエの生成
- フライ胚注射サービスを使用してUASt-CasRxベクターをフライ胚に注入し、2番目 の染色体上のハエØC31統合サイト8621からの胚を注入する。次に、フライ胚注射サービスを使用してUASt-dCasRxベクターをフライ胚に注入し、2番目 の染色体のハエØC31統合部位8621からの胚を注入する。注入した胚を26°Cで後部とする。
- CyOとSbマーカーを持つ二重バランスヘテロ接合線としてハエを保ちます。注: BDSC のフライ ラインの ID は 84121 (UASt-CasRx) および 84120 (UASt-dCasRx) です。
- フライ遺伝学(図1C)
- BDSC から希望の GAL4 行を注文します。ステップ3.2.2(またはBDSCから)から関連するgRNAラインを得る。
注: BDSC から次の 2 つの GAL4 ハエが使用されました: GAL4-GMR (BDSC ID: #29967),GAL4-y (BDSC ID: #44373).第1のセクションで生成された同じ3gRNAラインが使用された:gRNAw (BDSC ID:#84124)、gRNAN (BDSC ID#84122)、gRNAY(BDSC ID:#84123)。 - gRNAラインから5-10処女成虫の女性のハエを収集します。ダブルバランスヘテロ接合UASt-CasRx /CyOから2-4大人の男性のハエを収集します。+/TM6、白目、巻き翼、およびdsRed蛍光を同時に示すSbライン。収集した雌と雄のハエ(親のハエ)を通常の食べ物バイアルに入れます(以下、ステップ1クロスと呼びます)。3 回のレプリケートに対してこの手順を 3 回繰り返します。コントロール グループの場合は、UASt-dCasRx/CyO を使用します。+/TM6、他のすべてを同じに保ちながらSbライン。
- 26°Cでペアレンタルハエを含むステップ1クロスバイアルを48時間後回しにします。その後、すべてのバイアルからすべての親のハエを削除します。その後、バイアルを少なくとも14日間26°Cに保ちます。この間、GAL4 ラインから 5-10 女性の処女を収集します。3 回のレプリケートに対してこの手順を 3 回繰り返します。
- 毎日ステップ1クロスバイアルを観察して、新しい大人のハエが子犬から出てくるかどうかを確認してください。もしそうなら、二酸化炭素でそれらを麻酔し、UASt-CasRx(またはUASt-dCasRx)と同時にdsRed蛍光と無精ひげ表現型を有する子孫からgRNAベクターの両方を発現する2〜4個の雄のハエを収集する。GAL4ラインから5-10収集処女女性と一緒に新しいバイアルにステップ1クロスから収集した男性を入れて(以下、ステップ2クロスと呼ばれます)。3 回のレプリケートに対してこの手順を 3 回繰り返します。
- 26°Cでペアレンタルハエを含むステップ2クロスバイアルを48時間後回しにします。その後、すべてのバイアルからすべての親のハエを削除します。その後、バイアルを26°Cで少なくとも20日間保管してください。
- 毎日ステップ2クロスバイアルを観察して、新しい大人のハエが子犬から出てくるかどうかを確認してください。その場合は、二酸化炭素で麻酔をし、麻酔付きハエの表型を採点し、蛍光顕微鏡を装備したカラーカメラを使用して画像化します。異なる原型を持つ子孫の数を数えます。イメージの後処理およびコンパイルには、画像処理ソフトウェアを使用します(図4)。
注:メンデリア遺伝学は、ハエがすべて実行可能であれば、ステップ2クロスの子孫の間で4種類のハエが期待され、それぞれが人口の25%を占めていることを示唆しています(図1C)。
- BDSC から希望の GAL4 行を注文します。ステップ3.2.2(またはBDSCから)から関連するgRNAラインを得る。
結果
2成分CasRxシステムを用いたユビキタスインビボRNAターゲティング
Ubiq-CasRxとgRNA(内因性および外因性遺伝子の両方を標的とする)の両方を発現するF1経ヘテロ接合ハエは、Ubiq-dCasRxおよびgRNA構築物を発現する対照ハエと比較して顕著な表現型を示した(図2および図4)。具体的には、Transheterozygous CasRxハエは、トランスヘテロオズギョスdCasRxハエと比較して生存率の有意に低いレベルを有し、Ubiq-CasRxシステムの毒性を示す(図2Aおよび図4A)。トランスヘテロ接合CasRxとdCasRxの両方のハエは、メンデリア遺伝学に基づく予想比率である50%未満の相続率を有することは注目に値する。3つの標的遺伝子のうち、Ubiq-CasRx/+;U6-gRNAN/+ハエとウビクキャスRx/+;U6-gRNAy/+ハエは生存不可能(0%相続)であり、第2のインスター幼虫段階を超えて成長しなかった(図2A-2B)。生き残ったUbiq-CasRx/+;U6-gRNAw/+ハエは12.9%であったが、完全に浸透した白目表現型を示した(図2B)。CasRxに関連する観察可能な形質に加えて、ノッチ、イエロー、GFPの3つの標的遺伝子に対する標的遺伝子転写物の有意な減少を確認することができた(図2E-2G)。白い遺伝子転写物の減少は、Ubiq-CasRx/+、U6-gRNAw/+ハエで観察されたが、U6-gRNAw/+ハエの対照と比較して、減少は統計的に有意ではなかった(図2E - 2F)。CasRxによって誘発されたオフターゲット活性の証拠は、CasRx発現ハエからのサンプルとdCasRx発現ハエからのサンプルとの差で発現したトランスクリプトを比較したときに発見された(図2E、2G)。有意に差異的に発現する非対象の転写物の数は、白、253(全写物の1.4%)です。ノッチ、300(1.7%);黄色, 41 (0.23%);GFP、5,880(図2G)。合計17,779種類の転写物のうち、6つの非標的転写物が4つのサンプル群すべてで有意に差的に発現した。同定された6つのトランスクリプトのうちの1つは、ハエにおけるアポトーシスおよび細胞逮捕に関与する遺伝子であるGadd45であり、CasRxの酵素作用が細胞アポトーシスを直接引き起こすか、間接的に他の遺伝子の誤発現を引き起こす可能性を高め、アポトーシスにつながる。最後に、Ubiq-CasRxとUbiq-dCasRxハエは、おそらく高いユビキタス表現によって与えられた毒性のために、ホモ接合株として確立されなかったことは注目に値します。その結果、ヘテロザイグースUbiq-CasRx/CyOおよびUbiq-dCasRx/CyOハエは、ホモ接合gRNAフライラインとの交差に使用されました。要するに、2成分のUbiq-CasRxシステムは、観察可能な型および転写物の減少をもたらす内因性および外因性の標的の両方に対して、ユビキタスRNA標的を達成することができる。これらの結果はまた、CasRx媒介RNA標的が生体内で毒性を導入する可能性があることを示した。
3成分CasRxシステムを用いたユビキタスインビボ外因性RNA標的化
2段階の十字架からの結果は、標的遺伝子(すなわち、Fluc)の外因性にもかかわらず、F2トリプルトランスヘテロ接合(Ubiq-CasRx/++)における3つの遺伝子全てを発現することを示した。 gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)は、F2トリプルトランスヘテロジゴテ(Ubiq-dCasRx/+;gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)で致死性が観察されなかったUbiq-dCasRxを含む対照十字架と比較して100%致死性をもたらした(図3B-C)).具体的には、3つの遺伝子(Ubiq-CasRx/+;gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)の組み合わせのみが100%致死率(図3BとD)をもたらし、(Ubiq-CasRx/+;gRNAFluc/TM6)および(Ubiq-CasRx/+;Ubiq-Fluc-Ubiq-Rluc/TM6)遺伝子型は実行可能であり、予想されるメンデリア感染率と一致する相続率を持つ形質型を欠いていた。 Ubiq-CasRx/+とgRNAFlucと組み合わせた標的配列(すなわちホタルルシメラーゼ)の可用性が、観察された致死性の型式をもたらしたことを示唆し、おそらくCas13酵素2,8の副次活性に起因する.さらに、F1トランスヘテロザイゴテ(Ubiq-CasRx/+;gRNAFluc/+またはUbiq-CasRx/+)の継承に対する顕著な型または劇的な影響はありません。Ubiq-Fluc-Ubiq-Rluc/+)は、Ubiq-dCasRxコントロール(Ubiq-dCasRx/+;gRNAFluc/+またはUbiq-dCasRx/+)と比較して観察されました。Ubiq-Fluc-Ubiq-Rluc/+)(図3B)は、観察された致死性のフェノタイプを得るために触媒活性酵素が不可欠であることを示す。さらに、すべての生存可能な遺伝子型のハエにおけるFlucおよびRluc発現レベルは、デュアルルシファーゼレポーター制御と比較して、Ubiq-dCasRxトリプルトランスヘテロ接合体(Ubiq-dCasRx/+;gRNAFluc-Fluc-Ubiq-Rluc)におけるFluc発現の有意な減少を示さなかった。これは、DCasRxターゲティングによってFlucタンパク質発現レベルが低下していないことを示唆している(図3D)。まとめると、2つの異なるCasRx媒介性ユビキタスRNA標的化実験における共通の致死性表現型は、組織上でユビキタスに使用すると、CasRx媒介RNA標的化が生物に有毒であり得ることを示している。
3成分CasRxシステムを用いた生体内RNA標的化の組織特異的
ユビキタスRNA標的化実験で観察された高レベルの毒性は、方法セクションで詳述されている3成分CasRxシステム設計を使用して組織特異的RNA標的を探求するよう促しました。実際、Ubiqプロモーターと比較してUAStプロモーターを使用して全体的なCasRx発現が低下したときに観察された毒性のレベルは低下し、これは3つの側面で例示される:1)UASt-CasRxとUASt-dCasRxラインはホモ接合線として維持されたが、2ステップの交差スキームに基づいてUASt-CasRxとUSt-d-crossを行った。 2)すべてのF2世代dCasRxトリプルトランスヘテロ接合相続率は、予想される25%メンデリア継承率と一致し、3)F2世代CasRxトリプルトランスヘテロ接合致死性表現型は適度に減少した。白色標的化実験では、F2トリプルトランスヘテロ接合法で予想される25%のメンデリア相続率のうち、生存可能な成体ハエ(UASt-CasRx/+;gRNAw/GMR-Gal4)のみが観察され、いずれも重度の眼特異的色素沈着および形態異型(図4Aおよび4B)を示した。白色ターゲティングクロスの場合、CasRx発現トリプルトランスヘテロ接合F2相続率は、dCasRx発現トリプルトランスヘテロ接合対照群(図4A)の相続率よりも有意に低かった(図4A)。ノッチターゲティング実験では、3つの遺伝子すべてを運ぶCasRx発現トリプルトランヘテロ接合は100%致死的であり、dCasRxコントロール継承率は29.3%であった(図4A)。黄色の標的化実験では、F2トリプル・トランスヘテロ接合CasRx発現、gRNAy、およびy-GAL4は、相続率が2.67%の胸郭と腹部に黄色のキューティクルの小さなパッチとして限界キチン色素減少を示し、dRx対照群(25.2%)よりもはるかに低い(図4A)).すべてのdCasRxコントロールトリプルトランスヘテロ接合ハエは、CasRx発現ハエとして明白な表現型を提示せず、CasRxの触媒活性が観察された表現型に寄与したことを示す。CasRxトリプルトランスヘテロ接合グループの低い相続率は、CasRx RNA標的に2つの毒性源が存在することを示唆した:1つはCasRxの高発現に関連し、その毒性は制限CasRx発現によって減少し、他方は担保活性に関連している。これらの結果をまとめると、CasRxシステムは古典的なGal4/UAStシステムを活用して生体内RNAターゲティングで組織特異的なインビボRNAを達成し、その間に毒性を低減できることを示した。しかし、毒性および偶発的な致死性の型は、依然として、ユビキタスアプローチと比較して低いレベルの重症度で観察され、担保切断活性が毒性に関連していることを示している。
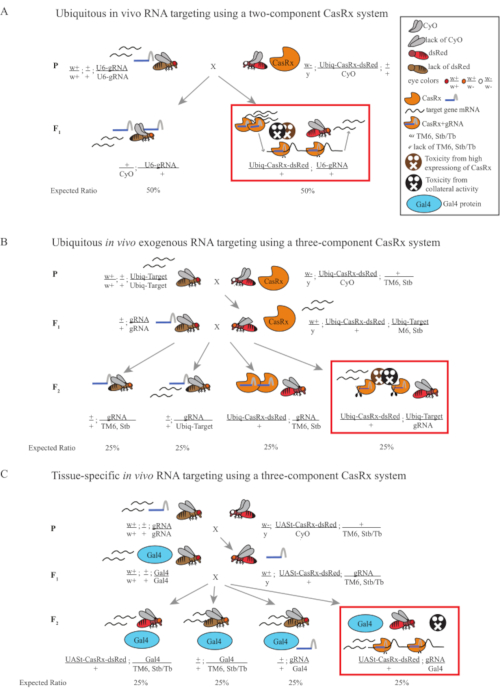
図1:Cas13Dシステムを用いたRNA標的化の一般的な概要. (A)2成分CasRxシステムを用いたユビキタスインビボRNA標的化における1ステップ遺伝十字架の概略図。(B)3成分CasRxシステムを用いたユビキタスインビボ外生RNA標的化における2段階の遺伝的十字架の概略。(C)3成分CasRxシステムを用いた組織特異的インビボRNA標的における2段階の遺伝的十字架の概略図。 この図の大きなバージョンを表示するには、ここをクリックしてください。
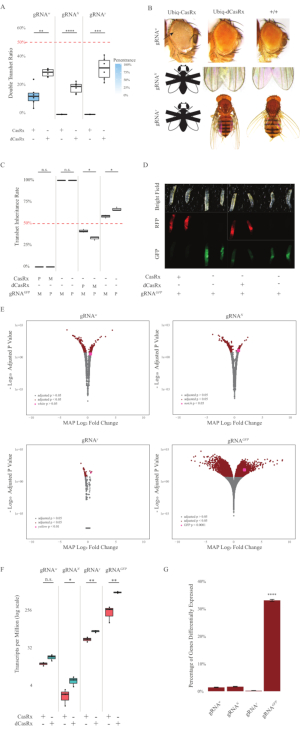
図2:2成分CasRxシステム(re5)を用いたユビキタスin vivo RNAターゲティング(A)Ubiq-CasRx(またはUbiq-dCasRx)およびgRNAを継承する半ヘテロ接合ハエの総相続割合。ボックスプロットの青い網掛けは、表現型の浸透を示しています。(B)トランスヘテロ接合のフェノタイプが飛ぶ。矢印は、眼の組織壊死を示す。「X」でマークされた黒と白のフライは致死性を表します。(C)Ubiq-CasRx(またはUbiq-dCasRx)とgRNAGFP-OpIE2-GFPフライ間の双方向交配の半ヘテロ接合ハエの総遺伝率。M、CasRxの母体継承;P、CasRxの父方継承。(D) 父方十字のF1幼虫前生。(E)トランスクリプトの対数フォールド変化に対する後方推定値の最大値。DESeq2 パイプラインが使用されました。(F) CasRx または dCasRx を対象とした 100 万分の 1 あたりのトランスクリプト (TPM)。(G) CasRx-depententは、転写物の転写物の割合を差し分化した。この図の大きなバージョンを表示するには、ここをクリックしてください。
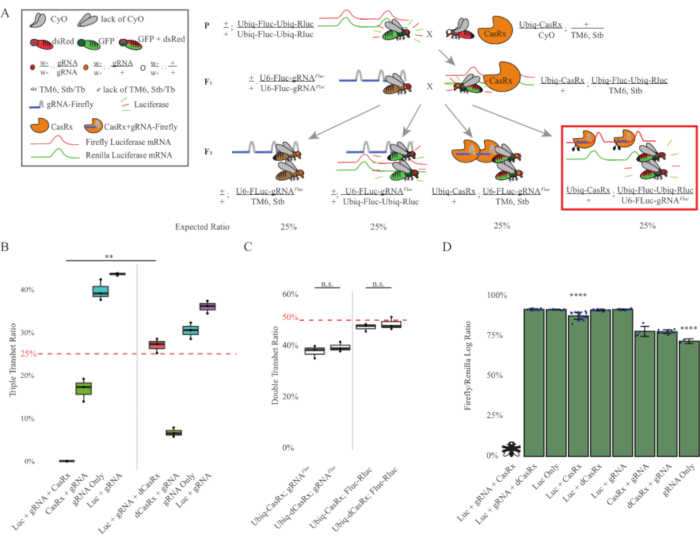
図3:3段階のCasRxシステムを用いたユビキタスインインビボ外生RNA標的化(A)2段階の遺伝的十字の概略。(B) F2 世代で出現するすべての遺伝子型の合計継承率。F2子孫の3つの遺伝子(Ubiq-CasRx、Ubiq-Fluc-Ubiq-Rluc、およびgRNAFLuc)すべてを受け継ぐことは、100%致死性をもたらし、Ubiq-dCasRxトリプルトランスヘテロジゴテス対照群(p = 0.001、t-test)と比較して有意に低かった。(C) Ubiq-CasRx/gRNAFluc単独またはUbiq-CasRxとUbiq-Fluc-Ubiq-Rluc単独で重度の致死性をもたさなかったし、Ubiq-CasRxとUbiq-dCasRxの相続率は有意に異なっていなかった(p = 0.41およびp = 0.51、(D)ルク測定値に対するFluc測定値を正規化するルシファーゼ比。Ubiq-CasRx、Ubiq-Fluc-Ubiq-Rluc、gRNAFLucを発現する三重経ヘテロ接合ハエは、胚性致死性であり、これは「X」を有するハエによって表され、その結果、ルシファーゼーゼ発現は測定されなかった。Ubiq-CasRx/+、Ubiq-Fluc-Ubiq-Rluc/TM6、StbトランスヘロザイゴトのFluc-Rluc比は、他のUbiq-Fluc-Ubiq-Rluc発現群よりも有意に低かった(p = 1.2e-06以下のt検定)。gRNAFLuc-のみのグループからの結果は、他のすべての群の結果よりも有意に低かった(p = 1.2e-06以下、t検定)。この図の大きなバージョンを表示するには、ここをクリックしてください。
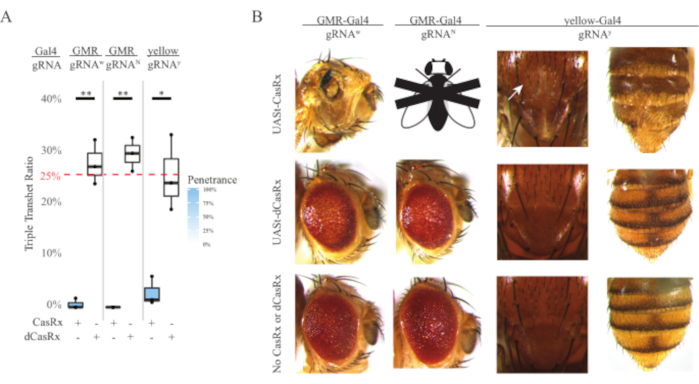
図4:3成分CasRxシステムを用いた組織特異的なインビボRNA標的化(re)(A)3つの遺伝子(UASt-CasRxまたはUASt-dCasRx、gRNA、およびGal4-driver)を担う三重半ヘテロ接合体ハエの総相続率。(B)三重経重尾大の奇形の変性が飛ぶ。白い矢印は胸郭におけるキチン色素の減少を示す。「X」でマークされた黒と白のフライは致死性を表します。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 建てる | 形容 | 入門 | プライマーシーケンス(5~3') | PCR テンプレート |
| OA-1050E | カスRx | 1050E。C3 | タクトアトトカッカ アクトットガック CCGCガガッタッタ アトガグカシアガ アガア | を使用します。 |
| 1050E。C4 | カアットガットッタ トッタアアカクアット キャットタグタグ ターアグトゥタートクッグ AACA | |||
| OA-1050R | デカスRx | 1050E。C3 | タクトアトトカッカ アクトットガック CCGCガガッタッタ アトガグカシアガ アガア | 13d-NLS-HA (pdCasRx) |
| 1050E。C4 | カアットガットッタ トッタアアカクアット キャットタグタグ ターアグググ・グタートク ガアカ | |||
| OA-1050L | UASt プロモーター | 1041.C9 | GCGGGTTCTCGA CGGTCACGGGG GCATGTCGGC グッチョカアカア カアカッタグタグ | pJFRC81 |
| 1041.C11 | CTGGCCCCACC TTCtCTCTCtCtCTCTCT TGGCTCATGT アアアッケート CCCTATCAGA | |||
| カスRx | 1050L。C1 | アタカーアガガ ガアククトガータ グガートッググ ターアカトガグ CCCAAGAGAA | をクリックします。 | |
| 1050E。C4 | カアットガットGT タットタアック ガットカトクタ GCTAGCTTAAG Cグタートクトゴーガ ACA | |||
| OA-1050S | UASt プロモーター | 1041.C9 | GCGGGTCtC ガググトカック GCGGGCATGT CGACGCGGCC GCAACCACAA カッタグタグ | pJFRC81 |
| 1041.C11 | CTGGCCCA CCTTCTCTTC TTCTTGGGGCT カッグッタアック CCAATTCCCTA TTCAGA | |||
| デカスRx | 1050L。C1 | アタカーガーグ アガクトクガートガート アグガトッグ トッタアカトガグ CCCCAAGAAA | をクリックします。 | |
| 1050E。C4 | カアットガットGT タットタアック ガットキャットキャッタッグ チャッグッタアグCG タートクトガアカ | |||
| OA-1043 | U6:3 プロモーター | 1043.C1 | ガガートッガ アトッグGCAATタット サトアトググク GCGCCGAATCT TTTTGCCACCT | アッドジーン プラスミド #164586 |
| 1043.C23 | アカッタグッガート CTCTAGAGGTAC CGTTGCGGG カアアアGTGT アタグマッククカ アアクロッガクト カカアクGCAG CCGACGTTAAAT トガアア | |||
| OA-1052B | ウビクプロモーター | 1052B.C1 | グガートグッガ アタッタアアット グックGCGC GCAGATCGGCAT | アッドジーン プラスミド #112686 |
| 1052B.C2 | TTTCTTTATTTTT TTGGCGTクトクッチ アクトタグクトグ CGGGTCAAATA ガガット | |||
| T2A-エグFP | 908A1 | アターアアッカグ アグッGCGGAAA ガトCGクッチグッグ アグリカガガ アクトクトクトクタキャット GC | アッドジーン プラスミド #112686 | |
| 908A2 | TTGTTATTAAAAA アカクトカクタ グッカガッタ CTTGTACAGCTC GTCCATGCC | |||
| 逆Ubiqプロモーター | 908A3 | アクトガクタック アックグカカタ グガッタグクタガ CGCAATCGC CGATG | アッドジーン プラスミド #112686 | |
| 908A4 | ガッカタアクト TCGAGTCATGC グッチョクトクチグ GGTCAAATAGAG ATGT |
表1:本研究で用いた分子構造およびプライマーのリスト このリストには、すべての構成体(IDと説明の両方)、および各コンストラクトの関連プライマー(IDとシーケンス(5'~3')の両方)と使用されるテンプレートが含まれています。
ディスカッション
CasRxシステムの3つの異なるアプリケーション設計により、この研究はハエを標的とする生体内でのRNAを実証した。異なる戦略は、内因性と外因性遺伝子の標的化、ユビキタス対組織特異的RNAターゲティングなど、さまざまなプロジェクトニーズに対応します。RNAターゲティングの効果には、標的遺伝子特異的表現型変化、標的RNA転写産物低下、CasRxタンパク質および副産物活性の高発現に関連する時折の致死性表現型が含まれていた。全体として、これらの結果は、CasRxシステムがプログラム可能かつ効率的な方法で生物レベルでRNA転写低下を標的にすることができることを示した。
CasRx システムのカスタマイズを成功させる重要な要素の 1 つは、gRNA の設計です。具体的には、次のアドバイスは、標的配列が約30ヌクレオチド長、ポリU伸縮の長さが4塩基対以下、標的配列GC含量が30%~70%の範囲にあり、標的配列が強いRNAヘアピン構造を形成すると予測されておらず、標的配列は、最小限の予測RNA二次または三次構造を含む。
gRNAの設計に加えて、各プロトコルのフライ遺伝学ステップは、成功した実装においても重要です。子孫の両親から受け継がれる定義された型の存在または欠如は、経ヘテロ接合のCasRxシステムによって誘導される形質型を同定し、定量化するために重要である。また、dCasRxハエを並列に使用して制御クロスを設定することは、経ヘテロ接合前性における非特異的なフェノタイプを排除するのにも有用である。
これらの結果は、CasRxシステムの制限であるハエでCasRxおよびdCasRxタンパク質をユビキタスに発現させることによって導入された毒性問題を明らかにしていることは注目に値する。Ubiq-CasRxハエもUbiq-dCasRxハエもホモ接線として確立できなかったため、Ubiqプロモートの下でCasRxまたはdCasRxのユビキタス発現は、gRNAなしで、些細なフィットネスコストが付属しました。それどころか、UASt-CasRxとUASt-dCasRxハエは健康なホモ接合株として確立することができますが、クロススキームの設計により、ユビキタスCasRxタンパク質発現によって引き起こされる毒性の存在を支持する事実であるダブルバランスストックとして保持されていました。もう一つの裏付けとなる証拠は、触媒的に不活性であるdCasRxを含む対照実験において、F1世代のハエの総数のうちdCasRxとgRNAの両方を運ぶハエの割合が一貫して50%未満であったということである。これは、gRNAと共にdCasRxを遍在的に発現させることが、その場で毒性を誘発し、期待される相続率よりも低いことを示した。経ヘテロ接合UASt-dCasRx、gRNA、GAL4ハエの相続率はメンデリア遺伝学に続き、CasRxおよびdCasRxタンパク質のユビキタス発現によって特異的に誘発される毒性を再び示唆している。CRISPR/Casシステムの毒性は新しいものではありません。Cas9タンパク質の大量は、ハエ29,30,31,32を含むいくつかの生物で有毒であることが示されています。最近の研究では、UAS-Cas9 construct33のUAS配列とCas9配列の間に様々な長さのオープンリーディングフレームを追加することで、ハエで発現するCas9タンパク質の量を調整できるカスタマイズされたGAL4/UASシステムを開発しました。したがって、CasRxタンパク質発現レベルを調整することによってCasRx誘発毒性を低減する方法を模索する価値があります。
CasRxおよびdCasRxタンパク質のユビキタス発現によって誘発される毒性以外にも、結果はCasRxシステムの非特異的な副次的なオフターゲット効果に関連する致死性も示した。CasRxおよび非本質的な遺伝子gRNA発現二重または三重の経ヘテロ接合ハエの一部では、例えばノッチを標的とする場合、Transheterozygous CasRxハエは、トランスヘテロ化双生児dCasRxハエと比較して生存率が有意に低い。これらのCasRxおよびgRNA発現性トランスヘテロ接合ハエのRNA-seq分析では、標的遺伝子転写レベルの低下および非標的遺伝子転写の減少の両方が観察された。これらの副次的な効果はCasRx依存性および標的依存性であり、CasRxタンパク質およびgRNAの両方を発現する経ヘテロ接合ハエでのみ観察された。標的遺伝子の1つである白色は、透明な色素還元表現型とは対照的に、CasRxによって白色遺伝子を標的とした場合、限られた非統計的に有意な低下のみを示したことを指摘する価値がある。これは、1)RNA-seqサンプル採取のタイミングが初期の発達中に白い遺伝子がピーク発現に達するタイミングと十分に一致していなかったこと、および2)目の白色遺伝子の局所的発現が、全身サンプル採取のみが可能な初期の発達段階で関連組織を採取することが困難であるという事実に起因する可能性があると仮定される。CasRxシステムにおける副次的な活動を減らすために、将来の研究は、生物レベルでオフターゲット現象システムの基礎となるメカニズムを完全に理解するために求められます。
興味深いことに、ハエにおけるRNA標的Cas13ツールを記述する最近の研究35 は、いくつかの考えられる理由から、CasRx発現に関連する一般的な毒性を改善するように見えた。まず、研究チームは、ショ ウジョウバエ の発現を最適化するためにCas13トランス遺伝子を再コード化し、本研究で使用されたユビキチンプロモーターと比較して、より弱く発現するプロモーター(actin 5C)を利用し、Cas13発現のレベルを低下させ、毒性を低下させる可能性が高い。確かに、これは、この研究(および 35の著者)がUASt-CasRxハエで明らかな致死性を観察しならなかったので、UASt駆動のCasRxおよびdCasRx発現自体が毒性ではなかったという観測によって支えられている。さらに、これらの著者は、この研究と比較してgRNAを異なる方法でコードし、その発現に影響を与え、Transheterygous Cas13/gRNAハエにおけるシステムの毒性を低下させた可能性がある。例えば、彼らの研究では、2つのgRNAをU6:3プロモーターを使用して発現させ、CasRx35を必要とせずにtRNA成熟時にgRNA処理を可能にするためにtRNAによって横たわった。逆に、この研究では、gRNAは、遺伝子あたり最大4カ所を標的とするアレイとしてコード化され、細菌に見られる内因性Cas13アレイ構造を模倣し、Cas13酵素が各gRNAを処理する必要があります。これらの異なるアプローチは、gRNA発現レベルおよびシステム全体の毒性に固有の影響を及ぼす可能性のある他の因子の違いをもたらす可能性があります。最後に、Huynhらは、本研究で標的としたものとは異なる遺伝子を標的とし、標的-Cas/gRNA相互作用および副次活性の差をもたらし、観察された致死性レベルに影響を及ぼす可能性がある。これらの観察された毒性の違いは、システム全体を改善する方法を特定するために、さらなる調査を保証します。
全体として、この研究は、D.メラノガスターにおける機能的に遺伝的にコード化されたプログラマブルRNA標的Casシステムの最初のデモンストレーションであり、CasRxシステムのさらなる最適化(報告されたものに沿って35)は、標的に関連する致死性をさらに低下させ、CasRxオンターゲット切断の有効性を高めるために必要となる。Cas酵素によるRNAターゲティングは、昆虫ベクター制御から治療用途まで多くの潜在的な用途を持つ急速に進化する分野であり、このプロトコルは、システムのカスタマイズおよびさらなる最適化と互換性を持ちながら、ハエでの最初のCasRxシステムの設計に興味がある人にスターターパッケージを提供します。ここで示す例は、このシステムをインビボで実装する際に遭遇する可能性のある結果の範囲を示し、アプリケーションにおけるCasRxシステムのパフォーマンスを評価する際に他のユーザーのベンチマークとして役立つ可能性があります。
開示事項
O.S.Aはアグラジーン社の創設者であり、株式権を持ち、同社のサイエンティフィック・アドバイザリー・ボードを務めています。この取り決めの条件は、利益相反政策に従って、カリフォルニア大学サンディエゴ校によって見直され、承認されています。他のすべての著者は、競合する利益を宣言しません。
謝辞
この研究は、DARPAセーフジーンプログラムグラント(HR0011-17-2-0047)とNIH賞(R21RAI149161A、DP2AI152071)からの資金提供によって部分的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 100% Grape Juice | Welch Foods Inc. | N/A | |
| Active Dry Yeast (908g) | Red Star Yeast Company, LLC | N/A | |
| DMC4500 color camera | Leica Microsystems | DMC4500 | |
| Dual-Luciferase Reporter Assay System | Promega | E1910 | |
| GAL4-GMR flies | Bloomington Drosophila Stock Center | 29967 | |
| GAL4-y flies | Bloomington Drosophila Stock Center | 44373 | |
| Glomax 20/20 Luminometer | Promega | E5331 | |
| Illumina HiSeq2500 Sequencer | Illumina, Inc. | HiSeq2500 | |
| M165FC fluorescent stereomicroscope | Leica Microsystems | M165FC | |
| Nanodrop OneC UV-vis spectrophotometer | ThermoFisher | NDONEC-W | |
| NEBNext Ultra II RNA Library Prep Kit | New England Biolabs, Inc. | E7770 | |
| plasmid # 112686 | Addgene | 112686 | |
| plasmid # 112688 | Addgene | 112688 | |
| plasmid # 132416 | Addgene | 132416 | |
| plasmid # 132417 | Addgene | 132417 | |
| plasmid # 132419 | Addgene | 132419 | |
| plasmid # 132420 | Addgene | 132420 | |
| plasmid # 132421 | Addgene | 132421 | |
| plasmid # 132422 | Addgene | 132422 | |
| plasmid # 132425 | Addgene | 132425 | |
| plasmid # 132426 | Addgene | 132426 | |
| plasmid # 133304 | Addgene | 133304 | |
| plasmid # 164586 | Addgene | 164586 | |
| plasmid #132418 | Addgene | 132418 | |
| plasmid pJFRC81 | Addgene | 36432 | |
| Qiagen RNeasy Mini Kit | Qiagen | 74104 | |
| Restriction endonucleases AscI | New England Biolabs Inc. | R0558L | |
| Restriction endonucleases NotI | New England Biolabs Inc. | R0189L | |
| Restriction endonucleases PacI | New England Biolabs Inc. | R0547L | |
| Restriction endonucleases PstI | New England Biolabs Inc. | R0140L | |
| Restriction endonucleases SwaI | New England Biolabs Inc. | R0604L | |
| Restriction endonucleases XbaI | New England Biolabs Inc. | R0145L | |
| RNA 6000 Pico Kit for Bioanalyzer | Agilent Technologies | 5067-1513 | |
| Turbo DNase | Invitrogen | AM2238 | |
| U6-3:4-gRNA-Fluc flies | Bloomington Drosophila Stock Center | 84125 | |
| U6-3:4-gRNA-GFP; OpIE2-GFP flies | Bloomington Drosophila Stock Center | 84986 | |
| U6-3:4-gRNA-N flies | Bloomington Drosophila Stock Center | 84122 | |
| U6-3:4-gRNA-w flies | Bloomington Drosophila Stock Center | 84124 | |
| U6-3:4-gRNA-y flies | Bloomington Drosophila Stock Center | 84123 | |
| UASt-CasRx flies | Bloomington Drosophila Stock Center | 84121 | |
| UASt-dCasRx flies | Bloomington Drosophila Stock Center | 84120 | |
| Ubiq-CasRx flies | Bloomington Drosophila Stock Center | 84118 | |
| Ubiq-dCasRx flies | Bloomington Drosophila Stock Center | 84119 | |
| Ubiq-Firefly-T2A-eGFP-Ubiq-Renilla flies | Bloomington Drosophila Stock Center | 84127 | |
| Zymoclean Gel DNA Recovery Kits | Zymo Research Corporation | D4007 |
参考文献
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nat Communications. 9, 1911 (2018).
- Abudayyeh, O., et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. 353 (6299), 5573 (2016).
- East-Seletsky, A., O'Connell, M., Burstein, D., Knott, G., Doudna, J. RNA Targeting by Functionally Orthogonal Type VI-A CRISPR-Cas Enzymes. Molecular Cell. 66 (3), 373-383 (2017).
- Konermann, S., Lotfy, P., Brideau, N., Oki, J., Shokhirev, M., Hsu, P. Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors. Cell. 173 (3), 665-676 (2018).
- Buchman, A., Brogan, D., Sun, R., Yang, T., Hsu, P., Akbari, O. Programmable RNA Targeting Using CasRx in Flies. The CRISPR Journal. 3 (3), 164-176 (2020).
- Kushawah, G., et al. CRISPR-Cas13d Induces Efficient mRNA Knockdown in Animal Embryos. Developmental Cell. 54 (6), 805-817 (2020).
- Abudayyeh, O., et al. RNA targeting with CRISPR-Cas13. Nature. 550, 280-284 (2017).
- Perrimon, N., Ni, J., Perkins, L. In vivo RNAi: today and tomorrow. Cold Spring Harbor Perspectives in Biology. 2, 003640 (2010).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448, 151-156 (2007).
- Ni, J., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Ni, J., et al. A genome-scale shRNA resource for transgenic RNAi in Drosophila. Nature Methods. 8, 405-407 (2011).
- Ni, J., et al. Vector and parameters for targeted transgenic RNA interference in Drosophila melanogaster. Nature Methods. 5, 49-51 (2008).
- Heigwer, F., Port, F., Boutros, M. RNA Interference (RNAi) Screening in Drosophila. Genetics. 208 (3), 853-874 (2018).
- Kulkarni, M., et al. Evidence of off-target effects associated with long dsRNAs in Drosophila melanogaster cell-based assays. Nature Methods. 3, 833-838 (2006).
- Ma, Y., Creanga, A., Lum, L., Beachy, P. Prevalence of off-target effects in Drosophila RNA interference screens. Nature. 443, 359-363 (2006).
- Perrimon, N., Mathey-Prevot, B. Matter arising: off-targets and genome-scale RNAi screens in Drosophila. Fly. 1 (1), 1-5 (2007).
- Markstein, M., Pitsouli, C., Villalta, C., Celniker, S., Perrimon, N. Exploiting position effects and the gypsy retrovirus insulator to engineer precisely expressed transgenes. Nature Genetics. 40, 476-483 (2008).
- Champer, J., Buchman, A., Akbari, O. Cheating evolution: engineering gene drives to manipulate the fate of wild populations. Nature Review Genetics. 17 (3), 146-159 (2016).
- Buchman, A., et al. Broad dengue neutralization in mosquitoes expressing an engineered antibody. PLoS Pathogens. 16 (4), 1008103 (2020).
- Mathur, G., Sanchez-Vargas, I., Alvarez, D., Olson, K., Marinotti, O., James, A. Transgene-mediated suppression of dengue viruses in the salivary glands of the yellow fever mosquito, Aedes aegypti. Insect Molecular Biology. 19 (6), 753-763 (2011).
- Franz, A., et al. Engineering RNA interference-based resistance to dengue virus type 2 in genetically modified Aedes aegypti. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4198-4203 (2006).
- Yen, P., James, A., Li, J., Chen, C., Failloux, A. Synthetic miRNAs induce dual arboviral-resistance phenotypes in the vector mosquito Aedes aegypti. Communications Biology. 1, 11 (2018).
- Buchman, A., et al. Engineered resistance to Zika virus in transgenic Aedes aegypti expressing a polycistronic cluster of synthetic small RNAs. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3656-3661 (2019).
- . Addgene Available from: https://www.addgene.org/protocols/restriction-digest/ (2020)
- Gibson, D., Young, L., Chuang, R., Venter, J., Hutchison, C., Smith, H. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- . Addgene Available from: https://www.addgene.org/protocols/pcr/ (2020)
- . Indiana University Bloomington Available from: https://bdsc.indiana.edu/information/recipes/bloomfood.htmL (2020)
- Dobin, A., et al. STAR:ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Jiang, W., Brueggeman, A., Horken, K., Plucinak, T., Weeks, D. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryotic Cell. 13 (11), 1465-1469 (2014).
- Poe, A., et al. Robust CRISPR/Cas9-Mediated Tissue-Specific mutagenesis reveals gene redundancy and perdurance in Drosophila. Genetics. 211 (2), 459-472 (2019).
- Port, F., Chen, H., Lee, T., Bullock, S. Optimized CRISPR/Cas tools for efficient ger mLine and somatic genome engineering in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (29), 2967-2976 (2014).
- Yang, S., Li, S., Li, X. Shortening the Half-Life of Cas9 maintains its gene editing ability and reduces neuronal toxicity. Cell Reports. 25 (10), 2653-2659 (2018).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. eLife. 9, 53865 (2020).
- Zhang, X., Tee, L., Wang, X., Huang, Q., Yang, S. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy - Nucleic Acids. 4 (17), 264 (2015).
- Huynh, N., Depner, N., Larson, R., King-Jones, K. A versatile toolkit for CRISPR-Cas13-based RNA manipulation in Drosophila. Genome Biology. 21, 279 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved