Method Article
CRISPR/CasRx를 사용하여 드로소필라 멜라노가스터 에서 유비쿼터스 및 조직 별 RNA 표적화
요약
이 문서에서는 RNA 표적 Cas13D 효소(RfxCas13D)를 파리에서 사용하기 위한 상세한 프로토콜을 간략하게 설명합니다.
초록
CASRx, RNA 표적 Cas13 가족의 일원은, 세포와 유기체 수준 둘 다에 매력적인 오프 표적 단면도를 가진 효율적인 유전자 전사량 감소에 있는 CRISPR/Cas 기술의 유망한 새로운 추가입니다. 그것은 최근 CRISPR/CasRx 시스템은 Drosophila 멜라노가스터에 있는 유비쿼터스 및 조직 특정 유전자 성적증명서 감소를 달성하기 위하여 이용될 수 있다는 것을 보고됩니다. 본 논문은 2성분 CasRx 시스템을 이용하여 생체 내생 RNA 표적화의 3개 부분으로 구성된 최근 작업에서 의 방법을 자세히 설명한다. 2) 3성분 CasRx 시스템을 이용한 생체 외인성 RNA 표적화에서 유비쿼터스; 및 3) 3성분 CasRx 시스템을 이용한 생체 내 RNA 표적질내 조직별. 관찰된 RNA 표적화의 효력은 CasRx 단백질 및 부수적 활동의 높은 발현과 관련되었던 표적 유전자 특정 표현표 변경, 표적으로 한 RNA 전사량 감소 및 간헐적인 치사성 표현형을 포함합니다. 전반적으로, 이러한 결과는 CasRx 시스템이 프로그래밍 가능하고 효율적인 방식으로 유기체 수준에서 표적 RNA 전사 감소를 할 수 있음을 보여주었으며, 생체 내 전사 타겟팅, 엔지니어링이 실현 가능하고 생체 내 CRISPR 기반 RNA 표적화 기술의 미래를 위한 토대를 마련한다는 것을 입증했다.
서문
클러스터드 의 출현 이후 정기적으로 간격 짧은 Palindromic 반복 (CRISPR) 기술, 이 분야에서 초점의 대부분은 DNA 편집에있었다, 이는 의학 및 생명 공학에 변형 응용 프로그램을 제공합니다1. 그러나 DNA 서열의 영구적인 변경은 윤리적 고려 사항으로 인해 항상 바람직하지는 않습니다. 이에 비추어, 최근 연구는 RNA를 표적으로 하는 CRISPR 기지를 둔 공구를 개발하기 시작하고 CRISPR 기술이 실제로 다양한 생물학 체계2,3,4,5,6,7에서 RNA 표적에 실제로 사용될 수 있다는 것을 보여주었습니다. 테스트된 많은 시스템에서, RNA 및 전사감소를 표적으로 하는 현재 널리 사용되는 접근법은 RNA 간섭(RNAi)이며, 이는 완벽하지 않으며, 생체 내에서 사용될 때 다양한 효능과 높은 오프타겟 활성을 종종 나타내고 있습니다.8,9,10,12,13,15,16,17 . 따라서 이러한 기술의 상태를 감안할 때 RNA 표적화를 위한 CRISPR 기반 도구의 잠재력을 더 탐구할 가치가 있습니다.
한 주목할만한 최근 연구는 Ribonuclease CasRx, Cas13d 클래스의 일원, 효율적으로 인간의 세포 배양에 있는 유전자 성적증명서 수준을 감소시킬 수 있고 매력적인 오프 표적 profile4를 소유한다는 것을 보고했습니다. 이 사실 인정은 이 새로운 ribonuclease가 유기체 수준에서 표적으로 하는 RNA를 위한 그것의 효험 그리고 낮은 오프 표적 비율을 유지할 수 있는지의 질문으로 이끌어 냈습니다. 최근 연구는 CasRx 시스템이 Drosophila melanogaster5에 있는 유비쿼터스 및 조직 특정 유전자 성적증명서 감소를 달성하기 위하여 이용될 수 있다는 것을 보여줌으로써 이 질문을 해결했습니다.
이 최근에 발표된 접근 방식의 유용성을 간소화하기 위해 이 프로토콜은 3가지 주요 부분으로 구성된 이 최근 작업의 방법을 자세히 설명합니다: 1) 2성분 CasRx 시스템을 사용하여 생체 RNA 표적화에서 유비쿼터스; 2) 3성분 CasRx 시스템을 이용한 생체 외인성 RNA 표적화에서 유비쿼터스; 및 3) 3성분 CasRx 시스템을 이용한 조직 특이적 생체내 RNA 표적.
유비쿼터스 프로모터의 통제 하에 상이한 표적 유전자를 표적으로 하는 가이드 RNA(gRNA)가 이러한 gRNA 함유 구조를 발현하는 플라이 라인을 설계하고 플라이 라인이 생성되었다. CasRx는 유비쿼터스 프로모터 또는 GAL4 전사 인자에 의해 활성화 가능한 조건부 업스트림 활성화 서열(UASt) 프로모터의 제어하에, 또한 이러한 CasRx 함유 구조물을 수용하는 라인을 설계및 플라이 라인으로 설계하였다. 촉매비활성 CasRx 구문인 dCasRx는 음의 컨트롤로 설계및 사용되었습니다. 파리에서 유비쿼터스 RNA 타겟팅은 유비쿼터스 캐스락스 표현 플라이 라인으로 gRNA 표현 플라이 라인을 교차하여 달성됩니다. 특정 유전자 전사체와 CasRx 단백질을 대상으로 하는 gRNA 구조를 모두 발현하는 자손은 표적 유전자 전사체의 유비쿼터스 감소를 갖는다. 파리에서 조직별 RNA 표적화는 UASt-CasRx가 파리를 발현하는 gRNA 발현 파리를 처음 건널때 달성되어 gRNA와 UASt-CasRx 구조를 모두 운반하는 트랜스헤터로즈구우스 파리를 얻습니다. 이러한 파리는 차례로 조직 별 GAL4 표현 파리와 교차하여 파리에서 조직별 CasRx 발현 및 RNA 표적화의 생성을 초래합니다.
CasRx 시스템의 프로그래밍 가능한 특성은 생체 내 RNA 표적화에 대한 높은 효능과 낮은 오프 타겟 활동을 달성하는 데 도움이 되는 사용자 정의 및 최적화가능성을 제공합니다. CRISPR 기반 RNA 표적팅의 잠재적인 응용 은 실험실에서 RNAi를 대체하고 야생에서 곤충 벡터 제어에 기여하는 것을 포함하여 수많은 것입니다. 후자의, 글로벌 충족 되지 않은 요구 중 하나는 모기를 통해 전송 하는 RNA 바이러스의 감염을 방지 하기 위해 효율적인 도구의 개발. 뎅기열, Zika 및 chikungunya 바이러스와 같은 많은 RNA 바이러스는 모기를 통해 전달되고, 인간의 건강에 영향을 미치고, 사망을 기여합니다. 질병 예방을 위한 바이러스 저항을 가진 공학 모기 인구를 위한 많은 제안이 만들어졌습니다; 그러나, 현재 기술은 모기가 모든 중요한 RNA 바이러스18,19,20,21,22,23에 동시에 저항하는 것을 만들 수 없습니다. RNA 표적화 Cas 시스템은 모든 모기 매개 RNA 바이러스를 표적으로 하는 프로그래밍 가능한 플랫폼을 가능하게 함으로써 이러한 기술에 대한 출발점을 제공할 수 있다.
프로토콜
1. 2성분 CasRx 시스템을 이용한 생체 내 RNA 표적화
- Ubiq-CasRx 및 Ubiq-dCasRx 발현 벡터 생성
- 프라이머 1050E를 사용하여 폴리머라제 연쇄 반응(PCR)을 사용하여 CasRx 서열을 증폭시한다. C3 및 1050E. C4 및 원래 CasRx 는 pNLS-RfxCas13d-NLS-HA (pCasRx)를 생성합니다. 프라이머 1050E를 사용하여 pcR을 사용하여 dCasRx 서열을 증폭시. C3 및 1050E. C4 및 원래 dCasRx 구조 pNLS-dRfxCas13d-NLS-HA (pdCasRx)4 (표 1). 젤 정제 키트를 사용하여 증폭된 CasRx 및 dCasRx 조각을 겔 정화합니다.
- 다이제스트 베이스 벡터 (Addgene plasmid #112686) 제한 효소 SwaI 및 PacI24. 결과 제품에서 키트를 사용하여 기본 벡터 백본이라고 하는 더 큰 조각을 젤 정화합니다.
- 깁슨 어셈블리 방법을 사용하여 베이스 벡터 백본 및 CasRx 단편을 사용하여 Ubiq-CasRx 벡터를 조립하는 행위; 깁슨 어셈블리 방법을 사용하여 베이스 벡터 백본 및 dCasRx 단편을 사용하여 Ubiq-dCasRx 벡터를 조립한다.
참고: Ubiq-CasRx 벡터(OA-1050E)의 애드진 ID는 #132416, Ubiq-dCasRx 벡터(OA-1050R)의 아제진 ID는 #132417.
- gRNA 발현 벡터 생성
- 다음 기준에 기초하여 각 gRNA 단편을 설계: 표적 서열은 길이 30 뉴클레오티드인; 폴리-U의 최대 길이는 4개의 베이스 쌍인 대상 서열에서 뻗어 있다; 대상 시퀀스 GC 콘텐츠는 30% - 70%의 범위에 있는; 표적 서열은 강한 RNA 헤어핀 구조를 형성하지 않을 것으로 예측; 및 최소한의 예측 RNA 이차 또는 고등 구조를 포함하는 표적 서열5.
참고: 이 연구는 각 gRNA를 4개의 탠덤 서열로 설계하여 각각 30개의 뉴클레오티드 를 길고, 36개의 뉴클레오티드 장기 직접 반복으로 간격을 두었으며, 양 끝에 7-티민 종결기로 5. 외인성 표적 유전자의 경우, GFP는, 상기와 동일한 기준이 OpIE2-GFP 단편5를 첨가하여 뒤따랐다. - 프라이머 1043.C1 및 1043.C23 및 Addgene plasmid #112688 (표 1)26을 사용하여 PCR을 사용하여 U6:3 프로모터 서열을 증폭시합니다. 젤 정화 키트를 사용하여 증폭된 U6:3 조각을 겔 정화합니다.
- 다이제스트 Addgene plasmid #112688 제한 효소 AscI 및 XbaI24. 결과 제품에서 키트를 사용하여 사전 베이스 벡터 백본이라고 하는 더 큰 조각을 젤 정화합니다.
- 깁슨 어셈블리 방법을 사용하여 사전 베이스 벡터 백본 및 U6:3 단편으로 베이스 벡터를 조립한다25. 본 명세서에 기본 벡터는 OA-1043이라고 명명된다.
참고: 플라스미드 OA-1043의 Addgene ID는 #164586. - 외부 유전자 합성 서비스를 사용하여 표적 유전자의 gRNA 단편을 합성합니다.
- 염기 벡터 OA-1043을 제한 효소 PstI 및 NotI24로 소화한다. 소화된 OA-1043이라고 불리는 전체 소화 제품을 보관하십시오.
- 소화된 OA-1043 및 대상 유전자 gRNA 단편을 사용하여 gRNA 발현 벡터를 조립하여 깁슨 어셈블리 방법을 이용한 25.
참고: 4개의 표적 유전자가 연구되었습니다: 3개는 내인성 (백색, 노치, 노크, 황색), 1개는 외인성 (GFP)이었습니다. 그들의 Addgene ID는 다음과 같습니다 :#132420 (gRNAw), #132421 (gRNAN), #132425 (gRNAy), #133304 (gRNAGFP).
- 다음 기준에 기초하여 각 gRNA 단편을 설계: 표적 서열은 길이 30 뉴클레오티드인; 폴리-U의 최대 길이는 4개의 베이스 쌍인 대상 서열에서 뻗어 있다; 대상 시퀀스 GC 콘텐츠는 30% - 70%의 범위에 있는; 표적 서열은 강한 RNA 헤어핀 구조를 형성하지 않을 것으로 예측; 및 최소한의 예측 RNA 이차 또는 고등 구조를 포함하는 표적 서열5.
- 형질 전환기 파리 생성
- ØC31 통합 부위를 함유한 파리의 외부 플라이 배아 주입 서비스 및 배아를 사용하여 발현 벡터를 플라이 배아에 주입한다. 26°C에서 주입된 배아를 후방으로 합니다.
참고: attp40w(제2 염색체의 통합 사이트) 라인은 CasRx 라인을 생성하는 데 사용되었고 8622(제3 염색체의 통합 사이트) 라인은 다양한 gRNA 라인을 생성하는 데 사용되었습니다. - 파리를 동질성 선이나 균형 잡힌 이종수선으로 유지하십시오.
참고: Ubiq-CasRx와 Ubiq-dCasRx 파리는 균형 선수로 CyO와 이종화구스 균형 라인으로 유지되었습니다. 또한 Ubiq-CasRx 및 Ubiq-dCasRx 벡터에는 dsRed 마커가 포함되어 있습니다. 그 결과, Ubiq-CasRx와 Ubiq-dCasRx 파리는 다음과 같은 세 가지 표현형을 가지고 있습니다: dsRed 양성, 곱슬 날개 및 흰색 눈. gRNA 표현 파리는 동질성 선으로 유지되었다. 그들의 블루밍턴 드로소필라 주식 센터 (BDSC) 플라이 주식 번호는 다음과 같습니다 : #84118 (Ubiq-CasRx), #84119 (Ubiq-dCasRx), #84124 (gRNAW), #84122 (gRNAN), #84123 (gRNAY), #84986 (gRNAY), #849866 (gRNA)
- ØC31 통합 부위를 함유한 파리의 외부 플라이 배아 주입 서비스 및 배아를 사용하여 발현 벡터를 플라이 배아에 주입한다. 26°C에서 주입된 배아를 후방으로 합니다.
- 비행 유전학 (그림 1A)
- 동형 gRNA 라인에서 10 처녀 성인 여성 파리를 수집하고 균형 잡힌 이테로즈구우스 Ubiq-CasRx / CyO 라인에서 5 성인 남성 파리를 수집합니다. 모의 파리라고 불리는 수집된 암컷과 수컷 파리를 마른 효모 분말로 보충한 바이알에 넣습니다(그림 1A).
- 이전 단계를 3회 반복하여 3개의 복제를 생성합니다. 대조군의 경우 Ubiq-dCasRx/CyO 라인을 사용하여 다른 모든 것을 동일하게 유지합니다.
참고: 일반 유리 병의 경우, 건조 효모 분말 0.1 g로 충분합니다. BDSC의 플라이 푸드 레시피가 사용됩니다. - 부모가 함유한 바이알을 48시간 동안 26°C에서 날아다닙습니다. 그런 다음 모든 유리병에서 모든 부모 파리를 제거합니다. 그런 다음 바이알을 26°C에서 20일 이상 보관하십시오.
- F1 세대의 강아지에서 새로운 성인 자손이 나타났는지 확인하기 위해 매일 바이알을 관찰하십시오. 그렇다면, 플라이 바이알 내부에 이산화탄소 탱크에 연결된 튜브를 삽입하여 이산화탄소로 마취한 다음 유동 스위치를 10초 동안 켭돌립니다.
- 파리가 움직이지 않게 되면 유리병에서 플라이 패드에 비우고 이산화탄소탱크와 연결되어 있으며 이산화탄소는 플라이 패드를 통해 지속적으로 유입됩니다.
- 마취 된 파리의 표현형을 점수매기고 형광 성 입체 현미경에 연결된 컬러 카메라를 사용하여 이미지를 이미지합니다. 다른 표현형을 가진 자손의 수를 계산합니다. 이미지 후처리 및 컴파일에 이미지 프로세싱 소프트웨어를 사용합니다(그림 2A - 2D).
참고: Mendelian 유전학에 근거하여, 파리의 2개의 모형은 각 십자가에 대한 자손 중 예상됩니다 (그림 1A).
- RNA-세크 (그림 2E – 2G)
- 샘플 수집
참고: 아래 3가지 예제에서 적절한 샘플 수집 방법을 선택합니다. 각 고유한 샘플 유형에 대해 3개의 복제가 필요합니다.- 성인 플라이 헤드 샘플 컬렉션
- 동종 구균 gRNA 라인에서 10 처녀 성인 여성 파리를 수집합니다. 균형 잡힌 이종수우 우빅-카스락스/CyO 라인에서 성인 수컷 파리 5마리를 모으실 수 있습니다. 모의 파리를 모은 파리를 마른 효모 파우더로 보충한 바이알에 넣습니다.
- 이전 단계를 3 복제에 대해 3번 반복합니다. 대조군의 경우 Ubiq-dCasRx/CyO 라인을 사용하여 다른 모든 것을 동일하게 유지합니다.
- 부모가 함유한 바이알을 48시간 동안 26°C에서 날아다닙습니다. 그런 다음 모든 유리병에서 모든 부모 파리를 제거합니다. 그런 다음 자손이 pupae에서 나올 때까지 바이알을 26 °C로 유지하십시오.
- 올바른 표현형으로 1일 된 성인 파리 10마리를 모으실 수 있습니다. 이산화탄소로 파리를 마취한 다음, 플라이 헤드를 잘라 내고 마른 얼음 위에 1.5mL 원심분리기 튜브에 머리를 넣습니다. 원심분리기 튜브를 -80°C에 저장합니다. 이 단계를 3복제에 대해 3회 반복합니다.
- 17 – 20시간 된 배아 샘플 수집
- 동종 구균 gRNA 라인에서 8-10 처녀 성인 여성 파리를 수집합니다. 균형 잡힌 이종구우스 Ubiq-CasRx/CyO 라인에서 4-5 성인 남성 파리를 수집합니다. 모의 파리를 모은 파리를 마른 효모 파우더로 보충한 바이알에 넣습니다.
- 이전 단계를 3 복제에 대해 3번 반복합니다. 대조군의 경우 Ubiq-dCasRx/CyO 라인을 사용하여 다른 모든 것을 동일하게 유지합니다.
- 부모가 함유한 바이알을 48시간 동안 26°C에서 날아다닙습니다.
- 이 레시피에 따라 각 복제물에 대해 포도 주스 배아 수집 챔버 1개를 준비합니다: 물 376mL, 포도 주스 126mL, 한천 15g, 자당 6 g. 1 L 비커에 미디어를 넣고 거품 / 거품이 나타나는지 확인하기 위해 비커의 미디어를 주시하면서 5-6 분 동안 높은 전자 레인지에 전자 레인지. 그렇다면 전자 레인지를 멈추고 거품 / 거품이 정착하도록하십시오. 거품이 명확해질 때까지 이 방법을 마이크로웨이브계속 합니다. 모든 거품이 명확해질 때까지 소용돌이하지 마십시오. 마지막으로, 100% 알코올의 10mL와 아세트산 5mL를 추가합니다. 잘 섞은 다음 미디어를 35mm 페트리 접시에 25mL 세로지 피펫으로 파이프로 넣습니다. 페트리 접시에 미디어가 고화되면 사용할 준비가 되어 있습니다.
- 48시간 배양의 끝에서, 부모가 포도 주스 배아 수집실로 이송하여 26°C에서 3시간 동안 배양하였다. 그런 다음 26°C에서 17시간 동안 포도 주스 접시에 갓 놓인 배아를 유지하면서 성인 파리를 제거합니다.
- 인큐베이션 후 포도 주스 플레이트에서 50 - 100 개의 배아를 수집하고 탈이온 된 물에 잠근 배아 표면을 청소한 다음 얼음 위에 1.5 mL 원심 분리 튜브로 옮긴다. -80 °C에 저장합니다. 이 단계를 3복제에 대해 3회 반복합니다.
- 첫 번째 인스타 애벌레 샘플 수집
- 동종 구균 gRNA 라인에서 8-10 처녀 성인 여성 파리를 수집합니다. 균형 잡힌 이종구우스 Ubiq-CasRx/CyO 라인에서 4-5 성인 남성 파리를 수집합니다. 모의 파리를 모은 파리를 마른 효모 파우더로 보충한 바이알에 넣습니다. 이 단계를 3복제에 대해 3회 반복합니다. 대조군의 경우 Ubiq-dCasRx/CyO 라인을 사용하여 다른 모든 것을 동일하게 유지합니다.
- 부모가 함유한 바이알을 48시간 동안 26°C에서 날아다닙습니다. 그런 다음 성인파리를 26°C에서 하룻밤 잠복(16h)에 대한 또 다른 새로운 일반 음식 병으로 이송한다. 그런 다음 성인 파리를 제거합니다.
- 24시간 동안 26°C에서 배아 함유 바이알을 유지한 다음, 기초의 뚜렷한 마커를 사용하여 현미경하에서 최초로 인스타 애벌레를 채점한다. 올바른 표현형으로 15-30 개의 애벌레를 수집하고 1.5 mL 원심 분리 튜브에 넣고 -80 ° C에 보관하십시오. 이 단계를 3복제에 대해 3회 반복합니다.
- 성인 플라이 헤드 샘플 컬렉션
- 시퀀싱
- RNA 추출: 시판되는 RNA 추출 키트를 사용하고 키트의 지시를 따라 모든 샘플을 처리합니다. 그런 다음, 추출된 RNA 샘플을 시판 가능한 데옥시리보누크로 배양하고 샘플에서 오염되는 DNA를 제거하기 위해 그 지시를 따릅니다.
- 시판 가능한 UV-vis 분광광계를 사용하여 RNA 농도를 측정합니다. 시판되는 RNA 무결성 분석 설정을 사용하여 샘플에서 RNA 무결성을 측정합니다.
- 상용 RNA 라이브러리 준비 키트를 사용하여 RNA-seq 라이브러리를 구성합니다.
- 단일 읽기 모드: 다음 설정으로 라이브러리 시퀀싱을 위해 외부 시퀀싱 서비스를 사용합니다. 읽기 길이: 50nt, 깊이: 라이브러리당 2천만 개의 읽기. RTA 1.18.64로 기본 통화를 수행한 다음 bcl2fastq 1.8.4를 사용하여 데이터를 FASTQ로 변환합니다.
참고: 원시 시퀀싱 데이터는 국립 생명공학 정보 시퀀싱 아카이브 센터에서 찾을 수 있습니다(제출 ID: SUB6818910 [바이오프로젝트: PRJNA600654]).
- 생물 정보학
- 지도는 버클리 드로소필라 게놈 프로젝트(GenBank 가입 번호: GCA_000001215.4)와 "아웃 필터Type BySJout" 필터 및 옵션 "sjff)의 추가와 함께 STAR aligner28의 기본 매개 변수 설정을 사용하여 외인성 CasRx 및 GFP 시퀀스에서 6 드로소필라 멜라노가스터 게놈을 출시하기 위해 시퀀싱 데이터에서 읽 Drosophila_melanogaster습니다. ENSEMBL에서 BDGP6.22.97.gtf" 유전자 전송 형식 파일.
- "-t 엑슨 -g gene_id -M-O -분수" 옵션을 사용하여 기능 Counts35와 각 주석 이주석 성적증명서에 대한 원시 성적증명서 수를 결정합니다. 그런 다음 "addTpmFpkmToFeatureCounts.pl" Perl 스크립트를 사용하여 전체 성적증명서 수를 사용하여 원시 성적증명서 수를 정규화합니다.
- DESeq2 파이프라인의 원래 수축 추정기와 함께 최대 후방 방법을 사용하여 각 유전자의 로그리지스맥 변경(LFC)을 추정합니다.
- 샘플 수집
2. 3 성분 CasRx 시스템을 사용하여 생체 외인성 RNA 표적화에서 유비쿼터스
- 외인성 표적 유비쿼터스 발현 벡터 생성
- PCR은 프라이머 1052B를 사용하여 Ubiq 프로모터 조각을 증폭시합니다. C1 및 1052B. C2 및 Addgene 플라스미드 #112686 26. 그런 다음 PCR은 프라이머 908A.1 및 908A.2 (표 1)26을 통해 addgene plasmid #112686증폭된 T2A-eGFP 단편을 증폭시한다. 그런 다음, PCR은 프라이머 908A.3 및 908A.4 (표 1)26을 가진 Addgene plasmid #112686 사용하여 Ubiq 프로모터 단편을 반전 서열로 증폭시합니다. 겔 정화 키트를 사용하여 Ubiq 프로모터 단편, T2A-eGFP 단편 및 반전된 Ubiq 프로모터 조각을 정제합니다.
- 사용자 정의 반딧불 루시파래이 코딩 시퀀스와 p10 3'UTR 조각을 포함하는 사용자 정의 조각을 주문하고, SV40 3'UTR 조각 다음에 역렌야 루시파아제를 반전.
- 다이제스트 Addgene plasmid #112688 제한 효소 AscI 및 XbaI24. 결과 제품에서, 젤 정제 키트를 사용하여 더 큰 조각을 정화, 이는 기본 벡터 백본이라고합니다.
- 깁슨 어셈블리 방법을 사용하여 베이스 벡터 백본 및 다음 조각으로 베이스 벡터를 조립합니다: Ubiq 프로모터 단편, T2A-eGFP 단편, 반전된 Ubiq 프로모터 단편, 반딧불 루시파래아코딩 시퀀스, 그리고 SV40 3'UTR fragment25의 뒤따르는 역진 루시파아제.
참고: 생성된 이중 루시파아제 발현 벡터(OA-1052B)의 Addgene ID는 #132426.
- gRNA 발현 벡터 생성
- PCR은 프라이머 1043.C1 및 1043.C23 및 Addgene plasmid #112688 (표 1)26을 사용하여 U6:3 프로모터 서열을 증폭시합니다. 젤 정화 키트를 사용하여 증폭된 U6:3 조각을 겔 정화합니다.
- 다이제스트 Addgene plasmid #112688 제한 효소 AscI 및 XbaI24. 결과 제품에서 겔 정화 키트를 사용하여 사전 염기 벡터 백본이라고 불리는 더 큰 조각을 겔 정화합니다.
- 깁슨 어셈블리 방법을 사용하여 사전 베이스 벡터 백본 및 U6:3 단편을 사용하여 베이스 벡터를 어셈블합니다25. 본 명세서에 기본 벡터는 OA-1043이라고 명명된다.
- 외부 유전자 합성 서비스를 사용하여 표적 유전자의 gRNA 단편을 합성합니다.
- 염기 벡터 OA-1043을 제한 효소 PstI 및 NotI24로 소화한다. 소화된 OA-1043이라고 불리는 전체 소화 제품을 보관하십시오.
- 소화된 OA-1043 및 대상 유전자 gRNA 단편을 사용하여 gRNA 발현 벡터를 조립하여 깁슨 어셈블리 방법을 이용한 25.
참고: 결과 플라스미드(OA-1052K)의 애드진 ID는 #132422.
- 형질 전환기 파리 생성
- 외부 플라이 배아 주입 서비스를 통해 3차 염색체, BDSC 플라이 스톡 번호 9744에 ØC31 통합 부위를 포함하는 파리의 배아를 사용하여 OA-1052B 벡터를 플라이 배아에 주입한다. 유사하게, OA-1052K 벡터를 플라이 배아에 주입하여 제3 염색체에 ØC31 통합 부위를 함유한 파리로부터의 배아를 사용하여, BDSC 플라이 스톡 번호 8622. 26°C에서 주입된 배아를 후방으로 합니다.
- 이중 루시파아제 표현 파리를 유지하고 gRNA는 동질성 선으로 날아갑니다. Ubiq-CasRx 라인을 1항에서 생성된 단일 균형 이종자 구우스 Ubiq-CasRx 라인을 건너서 TM6 밸런저 염색체를 스텁(Stb) 마커로 운반하는 균형을 맞추고 흰색 눈, 곱슬날개, 그리고 비경색 플루어를 동시에 갖춘 이중 균형의 자손만 유지합니다.
참고: BDSC 플라이 스톡 번호는 #84127 (Ubiq-Fluc-Rluc), #84125 (gRNAFluc)입니다.
- 비행 유전학 (그림 1B 및 그림 3A)
- 이중 루시파아제 표현 라인에서 8-10 처녀 성인 여성 파리를 수집합니다. 균형 잡힌 이종구우스 Ubiq-CasRx/CyO에서 4-5 성인 남성 파리를 수집; +/TM6, 흰 눈, 곱슬날개, dsRed 형광을 동시에 보여주는 Stb 라인. 수집 된 암컷과 수컷 파리를 부모 파리인 마른 효모 분말로 보충한 바이알에 넣습니다 (이하 1 단계 십자가라고 함).
- 이전 단계를 3 복제에 대해 3번 반복합니다. 대조군의 경우 Ubiq-dCasRx/CyO를 사용하십시오. +/TM6, Stb 라인은 다른 모든 것을 동일하게 유지합니다.
- 48시간 동안 26°C에서 부모가 파리를 포함하는 1단계 십자가 바이알을 후방으로 키워보세요. 그런 다음 모든 유리병에서 모든 부모 파리를 제거합니다. 그런 다음 바이알을 26°C에서 적어도 14일 동안 보관하십시오. 이 기간 동안, 동형구스 반딧불 루시파라제-표적 gRNA 라인에서 8-10 명의 여성 처녀를 수집하십시오. 이 단계를 3복제에 대해 3회 반복합니다.
- 새로운 성인 비행이 강아지에서 나오는지 확인하기 위해 매일 1 단계 십자가 바이알을 관찰하십시오. 그렇다면, 이산화탄소로 마취, 5 수컷 파리모두 Ubiq-CasRx (또는 Ubiq-dCasRx)와 자손에서 이중 루시파라제 기자를 모두 표현하고 반딧불 루시파라제 표적 gRNA 라인에서 10 처녀 여성과 함께 새로운 바이알에 넣어 (여기 단계 2 크로스라고 함). 이 단계를 3복제에 대해 3회 반복합니다.
- Ubiq-CasRx (또는 Ubiq-dCasRx)와 단계 1 십자가 바이알에서 이중 루시파라제 기자를 모두 표현하는 또 다른 5 명의 1 일 된 남성을 수집하고 26 °C에서 2 - 4 일 동안 배양하십시오. 그런 다음 1.5mL 원심분리기 튜브로 옮기고 -80°C에 보관하십시오. 이 단계를 세 번 반복하면 세 번 반복됩니다.
- 48시간 동안 26°C에서 부모가 파리를 포함하는 2단계 십자가 바이알을 후방으로 한다. 그런 다음 모든 유리병에서 모든 부모 파리를 제거합니다. 그런 다음 바이알을 26°C에서 20일 이상 보관하십시오.
- 푸파에서 새로운 성인 자손이 나타났는지 확인하기 위해 매일 2 단계 십자가 바이알을 관찰하십시오. 그렇다면, 이산화탄소로 마취하고, 마취 된 파리의 표현형을 점수화하고 형광 성 입체 현미경이 장착 된 컬러 카메라를 사용하여 이미지를 이미지하십시오. 다른 표현형을 가진 자손의 수를 계산합니다. 이미지 후처리 및 컴파일에 이미지 프로세싱 소프트웨어를 사용합니다(그림 3B – 3C).
참고: Mendelian 유전학은 파리가 모두 실행 가능한 경우, 4 종류의 파리가 2 단계 십자가에서 자손 들 사이에서 예상되며, 각 개체수는 인구의 25 %를 차지합니다 (그림 1B 및 그림 3A).
- 루시파라제 분석 (그림 3D)
- 2.4.1-2.4.5 단계를 반복하여 삼중 트랜지터로지구스 파리와 컨트롤 플라이를 생성합니다. 출생 시 수컷 파리를 수집하고 3 일까지 나이.
- 3일 된 파리를 1.5mL 원심분리기 튜브로 옮기고 유봉과 루시파라제 분석 용 버퍼를 사용하여 리세합니다.
- 각 샘플에서 5 μL의 lysed 조직을 사용하여 시판되는 루시파라세이 키트와 발광계를 사용하여 반딧불과 레닐라 루시파라제 활성을 모두 측정합니다.
3. 3 성분 CasRx 시스템을 사용하여 생체 내 RNA 표적에 조직 특정
- UASt-CasRx 및 UASt-dCasRx 발현 벡터 생성
- PCR은 플라스미드 pJFRC81 및 프라이머 1041.C9 및 1041.C11을 사용하여 UASt 프로모터 서열을 증폭; 그런 다음 PCR은 플라스미드 OA-1050E(Addgene ID #132416) 및 프라이머 1050L을 사용하여 CasRx 단편을 증폭시합니다. C1 및 1050E. C4; 그런 다음 PCR은 플라스미드 OA-1050R(Addgene ID #132417) 및 프라이머 1050L을 사용하여 dCasRx 조각을 증폭시합니다. C1 및 1050E. C4 (표 1)26. 겔 정화 키트를 사용하여 증폭된 UASt 프로모터 서열, CasRx 및 dCasRx 조각을 겔 정화합니다.
- 다이제스트 베이스 벡터 (Addgene plasmid #112686) 제한 효소 NotI 및 PacI24. 결과 제품에서 겔 정화 키트를 사용하여 기본 벡터 백본이라고 불리는 더 큰 조각을 겔 정화합니다.
- 기저 벡터 백본, UASt 프로모터 시퀀스 및 깁슨 어셈블리를 사용하여 CasRx 단편을 사용하여 UASt-CasRx 벡터를 조립하는 행위; 그런 다음 깁슨 어셈블리 방법을 사용하여 UASt-dCasRx 벡터를 베이스 벡터 백본, UASt 프로모터 서열 및 dCasRx 단편으로 조립한다.
참고: UASt-CasRx 벡터는 애드진 플라스미드 #132418, UASt-dCasRx 벡터는 Addgene plasmid #132419
- 형질 전환기 파리 생성
- UASt-CasRx 벡터를 플라이 배아 주입 서비스 및 플라이 ØC31 통합 사이트 8621에서 플라이 배아를 사용하여 플라이 배아에 주입하여 2차 염색체에 삽입합니다. 그런 다음 UASt-dCasRx 벡터를 플라이 배아 주입 서비스 및 플라이 ØC31 통합 사이트 8621에서 2염색 체에 사용하여 배아를 플라이 배아에 주입합니다. 26°C에서 주입된 배아를 후방으로 합니다.
- CyO 및 Sb 마커로 파리를 이중 균형이 잡힌 이종구스 라인으로 유지하십시오. 참고: BDSC의 플라이 라인 의 아이디는 84121(UASt-CasRx) 및 84120(UASt-dCasRx)입니다.
- 비행 유전학 (그림 1C)
- BDSC에서 원하는 GAL4 라인을 주문; 단계 3.2.2 (또는 BDSC에서) 관련 gRNA 라인을 가져옵니다.
참고: 다음 2 GAL4 BDSC에서 비행 사용 되었다: GAL4-GMR (BDSC ID: #29967), GAL4-y (BDSC ID: #44373). 첫 번째 섹션에서 생성된 동일한 3gRNA 라인이 사용되었습니다: gRNAw (BDSC ID: #84124), gRNAN (BDSC ID #84122), gRNAy (BDSC ID: #84123). - gRNA 라인에서 5-10 처녀 성인 여성 파리를 수집합니다. 이중 균형이 잡힌 이종수우스 UASt-CasRx/CyO에서 2-4 성인 남성 파리를 수집합니다. +/TM6, 흰 눈, 곱슬날개, dsRed 형광을 동시에 보여주는 Sb 라인. 모의 암컷과 수컷 파리를 일반 음식 병병(이하 1단계 십자가)에 넣습니다. 이 단계를 3복제에 대해 3회 반복합니다. 대조군의 경우 UASt-dCasRx/CyO를 사용하십시오. +/TM6, Sb 라인은 다른 모든 것을 동일하게 유지합니다.
- 48시간 동안 26°C에서 부모가 파리를 포함하는 1단계 십자가 바이알을 후방으로 키워보세요. 그런 다음 모든 유리병에서 모든 부모 파리를 제거합니다. 그런 다음 바이알을 26°C에서 적어도 14일 동안 보관하십시오. 이 기간 동안 GAL4 라인에서 5-10 명의 여성 처녀를 수집하십시오. 이 단계를 3복제에 대해 3회 반복합니다.
- 새로운 성인 비행이 강아지에서 나오는지 확인하기 위해 매일 1 단계 십자가 바이알을 관찰하십시오. 그렇다면, 이산화탄소로 마취하고, UASt-CasRx (또는 UASt-dCasRx) 및 동시에 dsRed 형광및 수염 표현형을 가진 자손에서 gRNA 벡터를 모두 표현하는 2-4 개의 수컷 파리를 수집합니다. 1단계 십자가에서 수집된 수컷을 GAL4 라인에서 수집한 처녀 암컷(이하 2단계 십자가)과 함께 새로운 바이알에 넣습니다. 이 단계를 3복제에 대해 3회 반복합니다.
- 48시간 동안 26°C에서 부모가 파리를 포함하는 2단계 십자가 바이알을 후방으로 한다. 그런 다음 모든 유리병에서 모든 부모 파리를 제거합니다. 그런 다음 바이알을 26°C에서 20일 이상 보관하십시오.
- 2단계 십자가 바이알을 매일 관찰하여 새로운 성인이 강아지에서 날아오는지 확인하십시오. 그렇다면, 이산화탄소로 마취하고, 마취 된 파리의 표현형을 점수화하고 형광 성 입체 현미경이 장착 된 컬러 카메라를 사용하여 이미지를 이미지하십시오. 다른 표현형을 가진 자손의 수를 계산합니다. 이미지 후처리 및 컴파일에 이미지 프로세싱 소프트웨어를 사용합니다(그림 4).
참고: Mendelian 유전학은 파리가 모두 실행 가능한 경우, 4 종류의 파리가 2 단계 십자가에서 자손 들 사이에서 예상되며, 각 개체수는 인구의 25 %를 차지합니다 (그림 1C).
- BDSC에서 원하는 GAL4 라인을 주문; 단계 3.2.2 (또는 BDSC에서) 관련 gRNA 라인을 가져옵니다.
결과
2성분 CasRx 시스템을 이용한 생체 내 RNA 타겟팅
F1 트랜게테로지구우스파리는 Ubiq-CasRx와 gRNA(내인성 및 외인성 유전자 를 모두 표적으로) 구조체를 모두 발현하는 파리는 Ubiq-dCasRx 및 gRNA 구조물을 표현하는 대조군 파리에 비해 현저한 표현형을 보였다(도 2 및 도 4). 구체적으로, 트랜게테로지구우스 CasRx 파리는 아비크-카스릭스 시스템의 독성을 나타내는 트랜게테로즈기스 dCasRx 파리에 비해 생존율이 현저히 낮습니다(그림 2A 및 도 4A). 그것은 모두 transheterozygous CasRx와 dCasRx 파리는 미만 50% 상속 률, 멘델리안 유전학에 따라 예상 비율입니다 주목할 필요가있다. 세 가지 표적 유전자 중, Ubiq-CasRx/+; U6-gRNAN/+ 파리 및 Ubiq-CasRx/+; U6-gRNAy/+ 파리는 실행 불가능한(0% 상속)이며 두 번째 인스타 애벌레 단계(그림 2A-2B)를 넘어서는 성장하지 않았습니다. 살아남은 Ubiq-CasRx/+; U6-gRNAw/+ 파리, 상속은 12.9%,, 뚜렷한 완전 관통 백눈 표현형(그림 2B)을 보였다. CasRx와 관련되었던 관찰 가능한 특성 이외에, 우리는 3개의 표적 유전자를 위한 표적 유전자 전사체의 유의한 감소를 확인할 수 있었습니다: 노치, 황색 및 GFP (그림 2E-2G). 백색 유전자 전사체의 감소는 Ubiq-CasRx/+, U6-gRNAw/+ 파리에서 관찰되었으며, 대조군 Ubiq-dCasRx/+, U6-gRNAw/+ 파리에 비해 감소는 통계적으로 유의하지 는 않았지만(그림 2E - 2F). CasRx에 의해 유도된 오프 표적 활동의 증거는 dCasRx 표현 파리에서 CasRx 표현 파리및 견본에서 견본 사이 분별 전사체 를 비교할 때 찾아냈습니다 (그림 2E, 2G). 크게 차별화표현된 비표적 성적증명서의 수는 다음과 같습니다: 화이트, 253 (전체 성적증명서의 1.4%). 노치, 300 (1.7 %); 노란색, 41 (0.23 %); GFP, 5,880 (33%) (그림2G). 총 17,779개의 다른 성적증명서 중 6개의 비표적 성적증명서가 4개의 샘플 그룹에서 현저하게 분화되었다. 확인된 6개의 전사체 의 한은 Gadd45, 파리에서 세포 세포 체포에 관련되었던 유전자, CasRx의 효소 작용이 세포 세포 사멸을 직접 트리거하거나 간접적으로 그밖 유전자의 잘못된 표현을 시작할 수 있다는 가능성을 제기했습니다, 차례차례로 apoptosis로 이끌어 내는. 마지막으로, Ubiq-CasRx와 Ubiq-dCasRx 파리는 높은 유비쿼터스 표현에 의해 부여 된 독성으로 인해 동종 가우스 주식으로 설립되지 않았다는 점에 주목할 필요가있다. 그 결과, 이테로지구우스 Ubiq-CasRx/CyO 및 Ubiq-dCasRx/CyO 파리는 호모지구스 gRNA 플라이 라인으로 횡단하는 데 사용되었습니다. 요약하면, 2성분 Ubiq-CasRx 시스템은 관찰 가능한 표현형 및 성적증명서 감소를 초래하는 내인성 및 외인성 표적 모두에 대한 유비쿼터스 RNA 표적을 달성할 수 있다. 이러한 결과는 또한 CasRx 매개 RNA 표적화 생체 내에서 독성을 도입할 수 있음을 보여주었다.
3성분 CasRx 시스템을 이용한 생체 외인성 RNA 표적화유비쿼터스
2단계 십자가의 결과는 표적 유전자의 외인성 특성에도 불구하고 F2 트리플 트랜게터로지고테스(Ubiq-CasRx/+)에서 세 가지 전유전자를 모두 발현하는 것으로 나타났습니다. gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)는 F2 트리플 트랜게터로즈고테스(Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) (3B-C-Figure 3B-C-CLuc)에서 치사도가 관찰되지 않은 Ubiq-dCasRx와 관련된 제어 십자가에 비해 100% 치사율을 초래했습니다. ). 보다 구체적으로 말하자면, 세 가지 전진(Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)의 조합만 100% 치사율(그림 3B 및 D), 반면(Ubiq-CasRx/+; gRNAFluc/TM6) 및(Ubiq-CasRx/+;+;; Ubiq-Fluc-Ubiq-Rluc/TM6) 유전자형은 실행 가능하고 예상멘델리안 전송 률과 일치하는 상속률과 표현형이 부족했습니다. Ubiq-CasRx/+ gRNAFluc와 함께 표적 시퀀스(즉, 반딧불 루시파라제)의 가용성이 관찰된 치사 성 표현형을 초래한 것으로 나타났습니다(아마도 Cas13 enzymes2,8의 부수적 인 활동에서 비롯된 것). . 또한 F1 트랜게터로지고트(Ubiq-CasRx/+; gRNAFluc/+ 또는 Ubiq-CasRx/+)의 상속에 대한 구별가능한 표현형이나 극적인 영향은 없습니다. Ubiq-Fluc-Ubiq-Rluc/+)는 Ubiq-dCasRx 컨트롤(Ubiq-dCasRx/+; gRNAFluc/+ 또는 Ubiq-dCasRx/+;+; Ubiq-Fluc-Ubiq-Rluc/+)(그림 3B)는 촉매 활성 효소가 관찰된 치사 성 표현형을 얻기 위해 필수적임을 나타냅니다. 또한, 모든 실행 가능한 유전자형의 파리의 Fluc 및 Rluc 발현 수준은 이중 루시파라제 리포터 컨트롤에 비해 Ubiq-dCasRx 삼중 환막(Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc)에서 Fluc 발현이 현저한 감소를 보이지 않았습니다. 이것은 Fluc 단백질 발현 수준이 dCasRx 표적화에 의해 감소되지 않았다는 것을 건의합니다 (그림 3D). 종합하면, 두 개의 다른 CasRx 매개 유비쿼터스 RNA 표적화 실험에서 일반적인 치사 성 표현형은 조직에 유비쿼터스로 사용될 때, CasRx 매개 RNA 표적화유기체에 독성이 있을 수 있음을 나타낸다.
3성분 CasRx 시스템을 이용한 조직 특이적 생체 내 RNA 표적
유비쿼터스 RNA 표적 실험에서 관찰된 높은 수준의 독성은 방법 섹션에 상세히 기술된 3성분 CasRx 시스템 설계를 사용하여 조직별 RNA 표적화를 탐구하도록 유도하였다. 실제로, 전체 CasRx 발현이 Ubiq 프로모터의 독성에 비해 UASt 프로모터를 사용하여 낮아졌을 때 관찰된 독성 수준이 감소하였고, 이것은 세 가지 측면에서 예시: 1) UASt-CasRx및 UASt-dCasRx 라인은 동형 저선으로 유지되었지만, 2 단계 크로스 방식 이중 균형 UASt-CasRx 및 UASt-dCasRx 라인은 십자가를 수행하는 데 사용되었지만, 2) 모든 F2 세대 dCasRx 트리플 트랜게테로지구스 상속률은 예상 25% 멘델리안 상속률과 일치하며, 3) F2 세대 CasRx 트리플 트랜게터로지구스 치사성 표현형은 적당히 감소하였다. 백색 표적 실험에서, F2 트리플 transheterozygotes에서 예상되는 25% 멘델리안 상속비율의, 단지 0.57% 실행 가능한 성인 파리 (UASt-CasRx/+; gRNAw/GMR-Gal4)는 관찰되었으며, 모두 심한 눈 특이적 색소 침착 및 형태학적 표현형(그림 4A 및 4B)을 나타냈다. 백색 표적 십자가의 경우, CasRx-표현 트리플 트랜게터로즈구스 F2 상속률은 dCasRx-표현 트리플 트랜게테로지구스 대조군(27.6%)보다 현저히 낮았다(그림 4A). 노치 표적 실험에서, 3개의 전염을 모두 운반하는 CasRx 표현 삼중 트랜지터로즈구스는 100% 치명적이었고, dCasRx 제어 상속율은 29.3%였다(그림 4A). 노란색 표적 실험에서, F2 트리플 트랜게테로지구우스 CasRx 표현, gRNAy 및 y-GAL4는 2.67%의 상속률을 가진 흉부 및 복부에 황색 표기의 작은 패치로 한계 치틴 안료 감소를 보였다, dCasRx 대조군 (Figure4A4A)보다 훨씬 낮은 ). 모든 dCasRx 제어 트리플 트랜게터로지구우스 파리는 CasRx 표현 파리로 명백한 표현형을 제시하지 않았다, CasRx의 촉매 활성이 관찰 표현형에 기여했음을 나타내는. CasRx 삼중 환화구우스 그룹의 낮은 상속률은 CasRx RNA 표적화에 존재하는 독성의 2개의 근원이 있다는 것을 건의했습니다: 하나는 CasRx의 높은 발현과 연관되고, 그 독성은 제한적인 CasRx 발현에 의해 감소되고, 다른 하나는 부수적인 활동과 연관된다. 종합하면, 이러한 결과는 CasRx 시스템이 고전적인 Gal4/UASt 시스템을 활용하여 생체 내 RNA 표적화에서 조직별 RNA 표적화를 달성할 수 있으며 그 동안 독성을 감소시키는 것으로 나타났다. 그러나, 독성 및 가끔 치사 성 표현형은 여전히 유비쿼터스 접근법에 비해 심각도의 낮은 수준에서 관찰되었다, 부수적 인 분열 활동이 독성과 연관되어 있음을 나타내는.
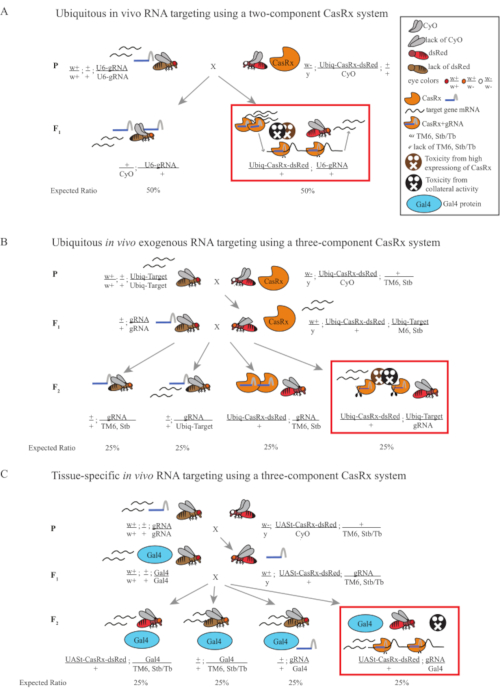
도 1: Cas13D 시스템을 이용한 RNA 표적화의 일반적인 개요. (A) 2성분 CasRx 시스템을 이용하여 생체 내 RNA 표적화에서 1단계 유전적 교차의 회로도. (B) 3성분 CasRx 시스템을 이용하여 생체외 유발 RNA 표적화에서 유비쿼터스에서 2단계 유전적 교차의 회로도. (C) 3성분 CasRx 시스템을 이용하여 생체 내 RNA 표적화에서 2단계 유전적 교차의 회로도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
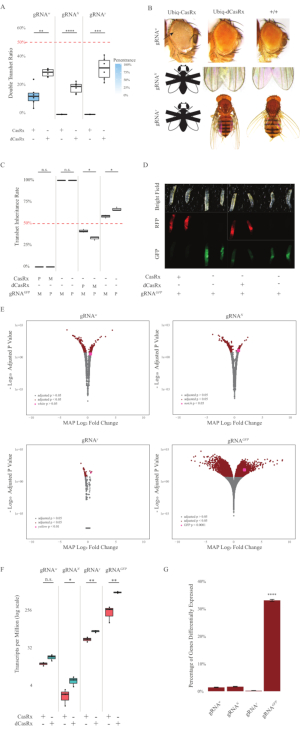
그림 2: 2성분 CasRx 시스템(reprinted5)을 사용하여 생체 내 RNA 표적화. (A) 비히크-카스릭스(또는 Ubiq-dCasRx) 및 gRNA를 상속하는 트랜게터로즈구스의 총 상속 비율. 상자 플롯의 파란색 그늘은 표현형 관통을 나타냅니다. (B) 대위원류의 표현형이 날아간다. 화살표는 눈에 조직 괴사를 나타냅니다. 'X'로 표시된 흑백 플라이는 치사성을 나타냅니다. (C) Ubiq-CasRx(또는 Ubiq-dCasRx) 및 gRNAGFP-OpIE2-GFP 파리 간 양방향 교차의 트랜게터로지구스의 총 상속 비율. M, CasRx의 모성 상속; P, CasRx의 아버지 상속. (D) 친자 십자가에서 F1 애벌레 자손. (E) 기록기의 최대 후방 은 로그산방 주름 변화에 대한 추정치입니다. DESeq2 파이프라인이 사용되었습니다. (F) CasRx 또는 dCasRx를 대상으로 백만 (TPM) 당 성적 증명서. (G) CasRx-depentent 는 전사체의 성적 증명서 비율을 다르게 표현하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
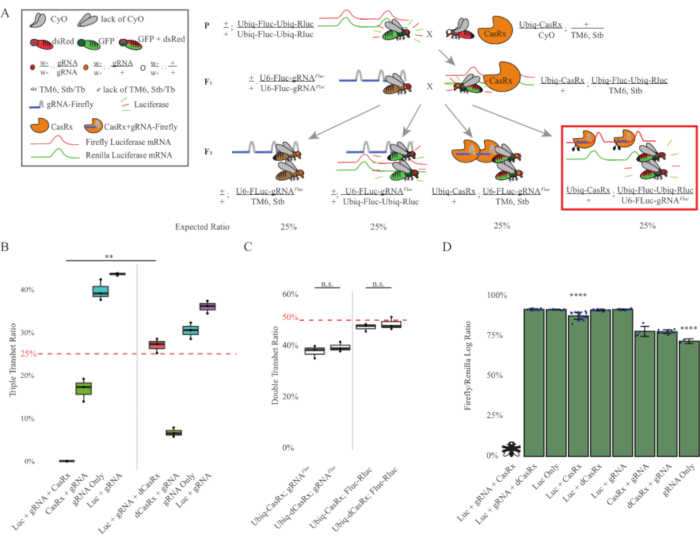
도 3: 3성분 CasRx 시스템을 이용한 생체 외인성 RNA 표적화에서 유비쿼터스(A) 2단계 유전적 교차의 회로도. (B) F2 세대에서 나타나는 모든 유전자형에 대한 총 상속 비율. F2 자손에서 세 가지 트랜스진(Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc 및 gRNAFLuc)을 모두 상속하여 100% 치사를 초래했으며 Ubiq-dCasRx 삼중 트랜스헤터로지고트 대조군(p= 0.001, t-test)에 비해 현저히 낮았습니다. (C) Ubiq-CasRx/gRNAFluc 단독으로 운반하거나 Ubiq-CasRx및 Ubiq-Fluc-Ubiq-Rluc단독으로 운반하는 것은 심각한 치사율로 이어지지 않았으며, Ubiq-CasRx와 Ubiq-dCasRx transheterozygotes 사이의 상속 비율은 크게 다르지 않았습니다(p = 0.41 및 p = 0.51, t=t). (D) 루시파라제 비율은 Rluc 판독값으로 플루크 판독값을 정상화합니다. Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc를 표현하는 트리플 트랜게테로지구우스 파리, gRNAFLuc는 "X"로 비행으로 표현된 배아 치명적인 것으로, 그 결과 루시파아제 발현을 측정하지 못했습니다. Ubiq-CasRx/+, Ubiq-Fluc-Ubiq-Rluc/TM6의 Fluc/Rluc 비율, Stb transheterozygotes는 다른 Ubiq-Fluc-Ubiq-Rluc-rluc 표현 그룹(p = 1.2e-06 이하) 보다 현저히 낮았습니다. gRNAFLuc 전용 그룹의 결과는 다른 모든 그룹(p = 1.2e-06 이하, t-test)보다 현저히 낮았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
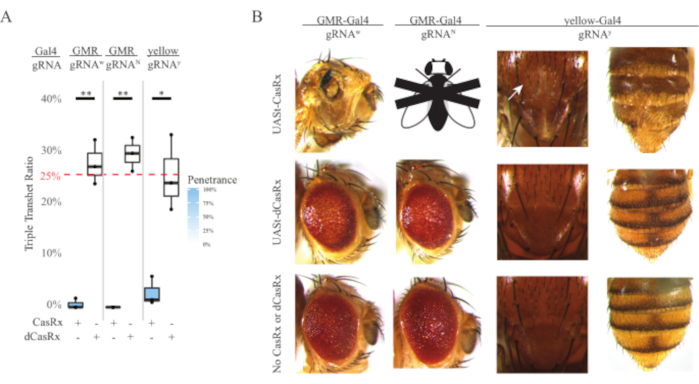
도 4: 3성분 CasRx 시스템(reprinted5)을 이용한 조직별 생체내 RNA 표적화( A) 3개의 트랜스게네스(UASt-CasRx 또는 UASt-dCasRx, gRNA 및 Gal4-driver)를 운반하는 삼중 트랜게터로즈구스의 총 상속 비율. (B) 삼중 환원류의 표현형이 날아간다. 흰색 화살표는 흉부에서 치틴 색소 감소를 나타냅니다. 'X'로 표시된 흑백 플라이는 치사성을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 건설하다 | 묘사 | 입문서 | 프라이머 시퀀스 (5'~ 3') | PCR 템플릿 |
| OA-1050E | 카스록스 | 1050E. C3 | 타타타트타트CCAC ATCTCTATTGAC CCGCAGATTAATTA ATGAGCCCCAAGA 아가아 | pNLS-RfxCas13d-NLS-HA (pCasRx) |
| 1050E. C4 | 카트가트GTTA TTTTAAAAACGATT 캐트크태그CT 타GCGTAATCTGG 아카아 | |||
| OA-1050R | dCasRx | 1050E. C3 | 타타타트타트CCAC ATCTCTATTGAC CCGCAGATTAATTA ATGAGCCCCAAGA 아가아 | pNLS-dRfxCas13d-NLS-HA (pdCasRx) |
| 1050E. C4 | 카트가트GTTA TTTTAAAAACGATT 캐트크태그CT 타GCGTAATCTG 가카와 | |||
| OA-1050L | UASt 프로모터 | 1041.C9 | GCGGGTTCTCGA CGGTCACGGGGG GCATGTCGACGC GGCCGCAACCAA 카카타태그 | pJFRC81 |
| 1041.C11 | CTGGCCTCCACC TTTCTCtCtCTCT TGGGGCTCATGT 타아카카타트 CCCTATTCAGA | |||
| 카스록스 | 1050L. C1 | 아타카아가가 개트크가아타 GGGAATTGGGT TTAAACATGAGC CCCAAGA아가아 | pCasRx | |
| 1050E. C4 | 카트가트GT 타트타아아악 개트카티크타 GCTAGCTTAAG CGTAATCTGGA ACA | |||
| OA-1050S | UASt 프로모터 | 1041.C9 | GCGGGTTCTC 가그그카그 GCGGGCATGT CGACGCGGCC GCAACCAACAA CACTAGTAG | pJFRC81 |
| 1041.C11 | CTGGCCTCCA CCTTTCTCTTC TTCTTGGGGGGCT 캣타아악 CCAATTCCCTA TTCAGA | |||
| dCasRx | 1050L. C1 | 아타카아가아그 아가액트크가트 아가트그그그 TTTAAACATGAG CCCCAA아가아가아 | pdCasRx | |
| 1050E. C4 | 카트가트GT 타트타아아악 개트캣츠택 CTAGCTTAAGCG 타트크가카 | |||
| OA-1043 | U6:3 프로모터 | 1043.C1 | GGGAATTGGGA ATTGGGCAATAT TTAAAATGGCGGC GCGCCGAATTCT TTTGCTCACCT | 애드진 플라스미드 #164586 |
| 1043.C23 | 아카타그츠가트 CTC타가그택 CGTTGCGGCCG 카아아아아에트GT 아타그CCTCA 아액트가크트 카카액트GCAG CCGACGTTAAT TGAAA | |||
| OA-1052B | 우비크 프로모터 | 1052B. C1 | GGGAATTGGGCA 아타타아타그C GGCTGCAGCGC GCAGATCGCCGAT | 애드진 플라스미드 #112686 |
| 1052B. C2 | TTTTTTTTTGTTT TTGGCGTCTTCC ATCCTAGGTCTG CGGGTCAAAATA 가가트 | |||
| T2A-eGFP | 908A1 | ATAAAGAG 아그GCGGAAAAA 가트CGCCGTGG 애그가가가가 아그넥트CTAACAT GC | 애드진 플라스미드 #112686 | |
| 908A2 | TTGTTTTAAAAAAAAAAAAAAAAA ACGATTCATTCTA GGCGCTTA CTTGTACAGCTC GTCCGCC | |||
| 반전 된 Ubiq 프로모터 | 908A3 | ACCGTGACCTAC ATCGTCGACACTA GTGGATCTCTAGA CGCGCAGATCGC CGATG | 애드진 플라스미드 #112686 | |
| 908A4 | GGATCATAAACTT TCGAAGTCATGC GGCCGCTCTGCG GGTCAAAATAGAG ATGT |
표 1: 이 연구에서 사용되는 분자 구조 및 프라이머 목록. 이 목록에는 모든 구문(ID 및 설명 모두)과 각 구문의 관련 프라이머(ID 및 시퀀스(5'~3')와 사용된 템플릿이 포함됩니다.
토론
CasRx 시스템의 세 가지 응용 프로그램 설계로,이 작품은 파리에서 생체 프로그래밍 가능한 RNA 타겟팅에서 입증되었습니다. 다른 전략은 내인성 대 외인성 유전자 표적화 및 조직 특정 RNA 표적화 대 유비쿼터스와 같은 다른 프로젝트 요구를 수용합니다. RNA 표적화의 효력은 CasRx 단백질 및 부수적 활동의 높은 발현과 관련되었던 표적 유전자 특정 표현성 변경, 표적 RNA 전사량 감소 및 간헐적인 치사성 표현형을 포함했습니다. 전반적으로, 이러한 결과는 CasRx 시스템이 프로그래밍 가능하고 효율적인 방식으로 유기체 수준에서 표적 RNA 전사감소가 가능한 것으로 나타났다.
CasRx 시스템의 성공적인 사용자 정의의 주요 요소 중 하나는 gRNA의 설계입니다. 구체적으로, 다음의 조언은 주의해야 한다: 표적 서열은 길이약 30뉴클레오티드, 표적 서열에서 폴리-U 뻗어의 길이는 4기층 이하이며, 표적 서열 GC 함량은 30% -70%의 범위에 있으며, 표적 서열은 강력한 RNA 헤어핀 구조를 형성할 것으로 예측되지 않으며, 표적 서열은 최소한의 예측 RNA 또는 대동맥 구조를 포함한다55.
gRNA 설계 외에도 각 프로토콜의 플라이 유전학 단계는 성공적인 구현에서도 중요합니다. 자손의 부모로부터 계승된 정의된 표현형의 존재 또는 부족은 트랜스페테로지구스 자손에서 CasRx 시스템에 의해 유도된 표현형을 식별하고 정량화하는 데 중요하다. 또한, dCasRx 파리를 병렬로 사용하여 제어 십자가를 설정하는 것은 또한 transheterozygous 자손에서 비 특이적 표현형을 배제하는 데 도움이됩니다.
이러한 결과 밝혀 독성 문제 유비 쿼터스 로 발현 CasRx 와 dCasRx 단백질 즉석에서, CasRx 시스템의 제한. Ubiq promotor에서 단독으로 CasRx 또는 dCasRx의 유비쿼터스 표현은 gRNAs없이, 비 사소한 피트니스 비용과 함께, Ubiq-CasRx 또는 Ubiq-dCasRx 파리는 homozygous 라인으로 설립 될 수 없습니다. 반대로, UASt-CasRx 및 UASt-dCasRx 파리는 건강한 호모자구스 주식으로 확립될 수 있지만, 크로스 계획의 설계로 인해 이중 균형 주식으로 유지되었지만 유비쿼터스 CasRx 단백질 발현에 의해 유발되는 독성의 존재를 뒷받침하는 사실이다. 또 다른 지원 증거는 dCasRx와 관련된 대조 실험에서, 이는 촉매적으로 비활성, F1 세대에 있는 파리의 총 수에서 dCasRx와 gRNA 구조물을 모두 운반하는 파리의 백분율은 일관되게 50% 보다 낮았다, dCasRx 관련 독성이 없는 경우에 Mendelian 유전학에 근거를 둔 예상비율. 이것은 gRNA와 함께 dCasRx를 유비쿼터스로 표현하는 것이 즉석에서 독성을 유도하여 예상보다 적은 상속 비율을 초래한다는 것을 나타냈습니다. transheterozygous UASt-dCasRx, gRNA, GAL4 파리의 상속 비율은 다시 CasRx와 dCasRx 단백질의 유비쿼터스 발현에 의해 특별히 유도된 독성을 건의하는 멘델리안 유전학을 따랐습니다. CRISPR/Cas 시스템의 독성은 새로운 것이 아닙니다. Cas9 단백질의 다량은 flies29,30,31,32를 포함하여 몇몇 유기체에서 유독한 것으로 나타났습니다. 최근 연구는 UAS-Cas9 construct33에서 UAS 서열과 Cas9 서열 사이의 다양한 길이의 개방 독서 프레임을 추가하여 파리에서 발현된 Cas9 단백질의 양을 조정할 수 있는 맞춤형 GAL4/UAS 시스템을 개발했습니다. 따라서 CasRx 단백질 발현 수준을 조정하여 CasRx 유도 독성을 줄이는 방법을 모색할 필요가 있습니다.
CasRx 및 dCasRx 단백질의 유비쿼터스 발현에 의해 유도된 독성 이외에, 결과는 또한 CasRx 시스템의 비특이적 부수적 인 오프 표적 효과에 연결된 치사성, 많은 CRISPR 시스템의 특징1,2,7,34를 보였다. CasRx 및 비 필수 유전자 gRNA 발현 이중 또는 삼중 환화구우스 파리, 예를 들어 노치를 대상으로 할 때, transheterozygous CasRx 파리는 transheterozgyous dCasRx 파리에 비해 생존율의 상당히 낮은 수준을 갖는다. 이들 CasRx 및 gRNA 발현 트랜게테로지구우스의 RNA-seq 분석에서 표적 유전자 전사량의 감소와 비표적 유전자 전사체의 감소가 모두 관찰되었다. 이러한 부수적 효과는 CasRx에 의존적이고 표적에 의존적이었으며, CasRx 단백질과 gRNA를 모두 표현하는 트랜스페테로지구우스 파리에서만 관찰되었습니다. 표적 유전자 중 하나인 흰색은 백색 유전자가 명확한 색소 감소 표현형과는 대조적으로 CasRx에 의해 표적으로 삼았을 때 성적증명서의 제한적, 비통계적으로 유의한 감소만을 보였다는 점을 지적할 가치가 있습니다. 이는 1) RNA-seq 샘플 수집의 타이밍이 백색 유전자가 초기 발달 시 피크 발현에 도달할 때타이밍과 잘 맞지 않았기 때문일 수 있으며, 2) 눈내 백색 유전자의 국소화된 발현은 전바디 샘플 수집만 가능할 때 초기 개발 단계에서 관련 조직을 수집하는 데 어려움을 겪고 있다. CasRx 시스템의 부수적 활동을 줄이기 위해, 미래의 연구는 유기체 수준에서 오프 타겟 현상 시스템의 근본적인 메커니즘을 완전히 이해하도록 요구됩니다.
흥미롭게도, 최근 연구35 파리에서 RNA 표적 Cas13 도구를 설명하는 것은 몇 가지 가능한 이유로 CasRx 발현과 관련된 일반적인 독성을 개량하는 것으로 나타났다. 첫째, 저자는 Drosophila 에서 표현을 최적화하기 위하여 Cas13 전염을 재코딩하고 본 연구 결과에서 사용된 유비퀴틴 프로모터에 비해 더 약한 표현 프로모터 (actin 5C)를 이용하고, 가능성이 Cas13 발현의 낮은 수준으로 이끌어 내고 따라서 더 적은 독성으로 이끌어 냅니다. 실제로, 이것은 UASt 중심의 CasRx및 dCasRx 발현이 이 연구 결과 (그리고 35의 저자)가 UASt-CasRx 파리에 있는 어떤 명백한 치사도 관찰하지 않았기 때문에, 그 자체로, 유독하지 않았다는 관측에 의해 지원됩니다. 더욱이, 이 저자는 그들의 발현에 영향을 미쳤을 지도 모르다 이 연구 결과에 비하여 그들의 gRNA를 다르게 인코딩하고 transheterozygous Cas13/gRNA 파리에 있는 시스템의 독성을 감소시켰습니다. 예를 들어, 연구에서 2gRNA는 U6:3 프로모터를 사용하여 발화되었고 TRNA에 의해 측면화되어 CasRx35를 요구하지 않고 tRNA 성숙시 gRNA 처리를 가능하게 했다. 반대로, 이 연구에서 gRNA는 유전자당 최대 4개의 위치를 대상으로 하는 어레이로 인코딩되었으며 박테리아에서 발견되는 내인성 Cas13 어레이 구조를 모방하여 각 gRNA를 처리하는 Cas13 효소를 필요로 합니다. 이러한 다른 접근은 gRNA 발현 수준 및 전체 시스템의 독성에 내재된 영향을 미칠 수 있는 그밖 요인에 있는 다름으로 이끌어 내수 수 있습니다. 마지막으로, Huynh 외. 대상-Cas/gRNA 상호 작용 및 부수적 활동에 차이 귀착되 고 치사의 관찰 된 수준에 영향을 미칠 수 있습니다 본 연구에서 대상 보다 다른 유전자를 대상으로. 관찰된 독성의 이러한 차이는 전체 시스템을 개선할 수 있는 방법을 확인하기 위해 추가 조사를 보증합니다.
전반적으로, 본 연구는 D. 멜라노가스터에서 기능적 유전적으로 인코딩된 프로그래밍 가능한 RNA 표적 Cas 시스템의 첫 번째 데모이며, CasRx 시스템의 추가 최적화(보고된 내용35에 따라)는 오프 타겟 관련 치사성을 더욱 감소시키고 표적 분열에 대한 CasRx의 효능을 증가시키는 데 필요할 것이다. Cas 효소를 가진 RNA 표적화는 곤충 벡터 제어에서 치료 사용에 이르기까지 많은 잠재적 인 응용 분야를 가진 급속하게 진화하는 분야입니다1,2,3,4,5,6,7, 이 프로토콜은 파리의 첫 번째 CasRx 시스템을 설계하는 데 관심이있는 사람을위한 스타터 패키지를 제공하며 시스템의 사용자 정의 및 추가 최적화와 호환됩니다. 여기에 제시된 예제에서는 이 시스템을 생체 내에서 구현하는 동안 발생할 수 있는 다양한 결과를 보여 주며 응용 프로그램에서 CasRx 시스템의 성능을 평가하는 다른 사용자의 벤치마크 역할을 할 수 있습니다.
공개
O.S.A.는 Agragene, Inc.의 창립자이며 지분 지분을 가지고 있으며 회사의 과학 자문위원회에서 근무하고 있습니다. 이 협정의 조건은 이해 상충 정책에 따라 캘리포니아 대학, 샌디에고에 의해 검토되고 승인되었습니다. 다른 모든 저자는 경쟁 이익을 선언하지 않습니다.
감사의 말
이 작품은 DARPA 세이프 유전자 프로그램 보조금(HR0011-17-2-0047)과 NIH 어워드(R21RAI149161A, DP2AI152071)의 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100% Grape Juice | Welch Foods Inc. | N/A | |
| Active Dry Yeast (908g) | Red Star Yeast Company, LLC | N/A | |
| DMC4500 color camera | Leica Microsystems | DMC4500 | |
| Dual-Luciferase Reporter Assay System | Promega | E1910 | |
| GAL4-GMR flies | Bloomington Drosophila Stock Center | 29967 | |
| GAL4-y flies | Bloomington Drosophila Stock Center | 44373 | |
| Glomax 20/20 Luminometer | Promega | E5331 | |
| Illumina HiSeq2500 Sequencer | Illumina, Inc. | HiSeq2500 | |
| M165FC fluorescent stereomicroscope | Leica Microsystems | M165FC | |
| Nanodrop OneC UV-vis spectrophotometer | ThermoFisher | NDONEC-W | |
| NEBNext Ultra II RNA Library Prep Kit | New England Biolabs, Inc. | E7770 | |
| plasmid # 112686 | Addgene | 112686 | |
| plasmid # 112688 | Addgene | 112688 | |
| plasmid # 132416 | Addgene | 132416 | |
| plasmid # 132417 | Addgene | 132417 | |
| plasmid # 132419 | Addgene | 132419 | |
| plasmid # 132420 | Addgene | 132420 | |
| plasmid # 132421 | Addgene | 132421 | |
| plasmid # 132422 | Addgene | 132422 | |
| plasmid # 132425 | Addgene | 132425 | |
| plasmid # 132426 | Addgene | 132426 | |
| plasmid # 133304 | Addgene | 133304 | |
| plasmid # 164586 | Addgene | 164586 | |
| plasmid #132418 | Addgene | 132418 | |
| plasmid pJFRC81 | Addgene | 36432 | |
| Qiagen RNeasy Mini Kit | Qiagen | 74104 | |
| Restriction endonucleases AscI | New England Biolabs Inc. | R0558L | |
| Restriction endonucleases NotI | New England Biolabs Inc. | R0189L | |
| Restriction endonucleases PacI | New England Biolabs Inc. | R0547L | |
| Restriction endonucleases PstI | New England Biolabs Inc. | R0140L | |
| Restriction endonucleases SwaI | New England Biolabs Inc. | R0604L | |
| Restriction endonucleases XbaI | New England Biolabs Inc. | R0145L | |
| RNA 6000 Pico Kit for Bioanalyzer | Agilent Technologies | 5067-1513 | |
| Turbo DNase | Invitrogen | AM2238 | |
| U6-3:4-gRNA-Fluc flies | Bloomington Drosophila Stock Center | 84125 | |
| U6-3:4-gRNA-GFP; OpIE2-GFP flies | Bloomington Drosophila Stock Center | 84986 | |
| U6-3:4-gRNA-N flies | Bloomington Drosophila Stock Center | 84122 | |
| U6-3:4-gRNA-w flies | Bloomington Drosophila Stock Center | 84124 | |
| U6-3:4-gRNA-y flies | Bloomington Drosophila Stock Center | 84123 | |
| UASt-CasRx flies | Bloomington Drosophila Stock Center | 84121 | |
| UASt-dCasRx flies | Bloomington Drosophila Stock Center | 84120 | |
| Ubiq-CasRx flies | Bloomington Drosophila Stock Center | 84118 | |
| Ubiq-dCasRx flies | Bloomington Drosophila Stock Center | 84119 | |
| Ubiq-Firefly-T2A-eGFP-Ubiq-Renilla flies | Bloomington Drosophila Stock Center | 84127 | |
| Zymoclean Gel DNA Recovery Kits | Zymo Research Corporation | D4007 |
참고문헌
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nat Communications. 9, 1911 (2018).
- Abudayyeh, O., et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. 353 (6299), 5573 (2016).
- East-Seletsky, A., O'Connell, M., Burstein, D., Knott, G., Doudna, J. RNA Targeting by Functionally Orthogonal Type VI-A CRISPR-Cas Enzymes. Molecular Cell. 66 (3), 373-383 (2017).
- Konermann, S., Lotfy, P., Brideau, N., Oki, J., Shokhirev, M., Hsu, P. Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors. Cell. 173 (3), 665-676 (2018).
- Buchman, A., Brogan, D., Sun, R., Yang, T., Hsu, P., Akbari, O. Programmable RNA Targeting Using CasRx in Flies. The CRISPR Journal. 3 (3), 164-176 (2020).
- Kushawah, G., et al. CRISPR-Cas13d Induces Efficient mRNA Knockdown in Animal Embryos. Developmental Cell. 54 (6), 805-817 (2020).
- Abudayyeh, O., et al. RNA targeting with CRISPR-Cas13. Nature. 550, 280-284 (2017).
- Perrimon, N., Ni, J., Perkins, L. In vivo RNAi: today and tomorrow. Cold Spring Harbor Perspectives in Biology. 2, 003640 (2010).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448, 151-156 (2007).
- Ni, J., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Ni, J., et al. A genome-scale shRNA resource for transgenic RNAi in Drosophila. Nature Methods. 8, 405-407 (2011).
- Ni, J., et al. Vector and parameters for targeted transgenic RNA interference in Drosophila melanogaster. Nature Methods. 5, 49-51 (2008).
- Heigwer, F., Port, F., Boutros, M. RNA Interference (RNAi) Screening in Drosophila. Genetics. 208 (3), 853-874 (2018).
- Kulkarni, M., et al. Evidence of off-target effects associated with long dsRNAs in Drosophila melanogaster cell-based assays. Nature Methods. 3, 833-838 (2006).
- Ma, Y., Creanga, A., Lum, L., Beachy, P. Prevalence of off-target effects in Drosophila RNA interference screens. Nature. 443, 359-363 (2006).
- Perrimon, N., Mathey-Prevot, B. Matter arising: off-targets and genome-scale RNAi screens in Drosophila. Fly. 1 (1), 1-5 (2007).
- Markstein, M., Pitsouli, C., Villalta, C., Celniker, S., Perrimon, N. Exploiting position effects and the gypsy retrovirus insulator to engineer precisely expressed transgenes. Nature Genetics. 40, 476-483 (2008).
- Champer, J., Buchman, A., Akbari, O. Cheating evolution: engineering gene drives to manipulate the fate of wild populations. Nature Review Genetics. 17 (3), 146-159 (2016).
- Buchman, A., et al. Broad dengue neutralization in mosquitoes expressing an engineered antibody. PLoS Pathogens. 16 (4), 1008103 (2020).
- Mathur, G., Sanchez-Vargas, I., Alvarez, D., Olson, K., Marinotti, O., James, A. Transgene-mediated suppression of dengue viruses in the salivary glands of the yellow fever mosquito, Aedes aegypti. Insect Molecular Biology. 19 (6), 753-763 (2011).
- Franz, A., et al. Engineering RNA interference-based resistance to dengue virus type 2 in genetically modified Aedes aegypti. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4198-4203 (2006).
- Yen, P., James, A., Li, J., Chen, C., Failloux, A. Synthetic miRNAs induce dual arboviral-resistance phenotypes in the vector mosquito Aedes aegypti. Communications Biology. 1, 11 (2018).
- Buchman, A., et al. Engineered resistance to Zika virus in transgenic Aedes aegypti expressing a polycistronic cluster of synthetic small RNAs. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3656-3661 (2019).
- . Addgene Available from: https://www.addgene.org/protocols/restriction-digest/ (2020)
- Gibson, D., Young, L., Chuang, R., Venter, J., Hutchison, C., Smith, H. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- . Addgene Available from: https://www.addgene.org/protocols/pcr/ (2020)
- . Indiana University Bloomington Available from: https://bdsc.indiana.edu/information/recipes/bloomfood.htmL (2020)
- Dobin, A., et al. STAR:ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Jiang, W., Brueggeman, A., Horken, K., Plucinak, T., Weeks, D. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryotic Cell. 13 (11), 1465-1469 (2014).
- Poe, A., et al. Robust CRISPR/Cas9-Mediated Tissue-Specific mutagenesis reveals gene redundancy and perdurance in Drosophila. Genetics. 211 (2), 459-472 (2019).
- Port, F., Chen, H., Lee, T., Bullock, S. Optimized CRISPR/Cas tools for efficient ger mLine and somatic genome engineering in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (29), 2967-2976 (2014).
- Yang, S., Li, S., Li, X. Shortening the Half-Life of Cas9 maintains its gene editing ability and reduces neuronal toxicity. Cell Reports. 25 (10), 2653-2659 (2018).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. eLife. 9, 53865 (2020).
- Zhang, X., Tee, L., Wang, X., Huang, Q., Yang, S. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy - Nucleic Acids. 4 (17), 264 (2015).
- Huynh, N., Depner, N., Larson, R., King-Jones, K. A versatile toolkit for CRISPR-Cas13-based RNA manipulation in Drosophila. Genome Biology. 21, 279 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유