Method Article
Targeting dell'RNA ubiquo e tessuto-specifico in Drosophila Melanogaster con CRISPR/CasRx
In questo articolo
Riepilogo
Questo articolo delinea un protocollo dettagliato per l'utilizzo dell'enzima Cas13D mirato all'RNA (RfxCas13D) nelle mosche.
Abstract
CasRx, un membro della famiglia Cas13 mirata all'RNA, è una nuova promettente aggiunta delle tecnologie CRISPR / Cas in un'efficiente riduzione del trascritto genico con un attraente profilo off-target sia a livello cellulare che di organismo. È stato recentemente riportato che il sistema CRISPR / CasRx può essere utilizzato per ottenere una riduzione del trascritto genico ubiquitario e specifico del tessuto in Drosophila melanogaster. Questo documento descrive in dettaglio i metodi del recente lavoro, composto da tre parti: 1) ubiquitous in vivo endogenous RNA targeting utilizzando un sistema CasRx bicomponente; 2) targeting RNA esogeno ubiquitario in vivo utilizzando un sistema CasRx a tre componenti; e 3) targeting dell'RNA in vivo specifico per tessuto utilizzando un sistema CasRx a tre componenti. Gli effetti del targeting dell'RNA osservati includono cambiamenti fenotipici specifici del gene mirato, riduzione mirata del trascritto dell'RNA e fenotipi occasionali di letalità associati all'alta espressione della proteina CasRx e all'attività collaterale. Nel complesso, questi risultati hanno mostrato che il sistema CasRx è in grado di indirizzare la riduzione del trascritto dell'RNA a livello dell'organismo in modo programmabile ed efficiente, dimostrando che il targeting del trascrittoma in vivo e l'ingegneria sono fattibili e gettano le basi per le future tecnologie di targeting dell'RNA in vivo basate su CRISPR.
Introduzione
Dall'avvento delle tecnologie CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), gran parte dell'attenzione in questo campo si è concentrata sull'editing del DNA, che offre applicazioni trasformative in medicina e biotecnologia1. L'alterazione permanente delle sequenze di DNA, tuttavia, non è sempre desiderata a causa di considerazioni etiche. Alla luce di ciò, studi recenti hanno iniziato a sviluppare strumenti basati su CRISPR per il targeting dell'RNA e hanno dimostrato che le tecnologie CRISPR possono effettivamente essere utilizzate per il targeting dell'RNA in una varietà di sistemi biologici2,3,4,5,6,7. In molti di questi sistemi testati, l'attuale approccio ampiamente utilizzato per il targeting dell'RNA e la riduzione del trascritto è l'interferenza dell'RNA (RNAi), che è tutt'altro che perfetta, spesso mostrando un'efficacia varia e un'elevata attività off-target quando usato in vivo8,9,10,11,12,13,14,15,16,17 . Pertanto, dato lo stato di queste tecnologie, vale la pena esplorare ulteriormente le potenzialità degli strumenti basati su CRISPR per il targeting dell'RNA.
Un importante studio recente ha riportato che la ribonucleasi CasRx, membro della classe Cas13d, può ridurre efficacemente i livelli di trascrizione genica nella coltura cellulare umana e possiede un attraente profilo off-target4. Questa scoperta ha portato alla domanda se questa nuova ribonucleasi possa mantenere la sua efficacia e il basso tasso off-target per il targeting dell'RNA a livello di organismo. Un recente studio ha affrontato questa domanda dimostrando che il sistema CasRx può essere utilizzato per ottenere una riduzione del trascritto genico ubiquitario e specifico del tessuto in Drosophila melanogaster5.
Per semplificare l'usabilità di questo approccio recentemente pubblicato, questo protocollo descrive in dettaglio i metodi di questo recente lavoro, che consiste di tre parti principali: 1) targeting RNA ubiquitario in vivo utilizzando un sistema CasRx a due componenti; 2) targeting RNA esogeno ubiquitario in vivo utilizzando un sistema CasRx a tre componenti; e 3) targeting dell'RNA in vivo specifico per i tessuti utilizzando un sistema CasRx a tre componenti.
Sono stati progettati RNA guida (gRNA) che prendono di mira diversi geni bersaglio sotto il controllo di un promotore ubiquitario e sono state generate linee di volo che esprimono questi costrutti contenenti gRNA. Sono stati progettati anche costrutti CasRx sotto il controllo di un promotore ubiquitario o di un promotore UASt (Conditional Upstream Activation Sequence) attivabile dal fattore di trascrizione GAL4 e sono state generate linee di volo che ospitano questi costrutti contenenti CasRx. I costrutti CasRx cataliticamente inattivi, dCasRx, sono stati progettati e utilizzati come controlli negativi. Il targeting dell'RNA onnipresente nelle mosche si ottiene incrociando le linee di mosca che esprimono gRNA con le linee di mosca che esprimono ubiquitariamente CasRx. La progenie che esprime sia il costrutto gRNA che prende di mira un trascritto genico specifico che la proteina CasRx ha una riduzione ubiquitaria dei trascritti genici mirati. Il targeting dell'RNA tessuto-specifico nelle mosche si ottiene incrociando prima le mosche che esprimono gRNA con le mosche che esprimono UASt-CasRx, ottenendo mosche transeterozigoti che trasportano sia gRNA che costrutti UASt-CasRx. Tali mosche a loro volta sono incrociate con mosche che esprimono GAL4 specifiche del tessuto, con conseguente generazione di espressione CasRx tessuto-specifica e targeting dell'RNA nelle mosche.
La natura programmabile del sistema CasRx offre la possibilità di personalizzazione e ottimizzazione per aiutare a raggiungere un'elevata efficacia e una bassa attività off-target per il targeting dell'RNA in vivo. Le potenziali applicazioni del targeting dell'RNA basato su CRISPR sono numerose, tra cui la sostituzione dell'RNAi in laboratorio e il contributo al controllo degli insetti vettori in natura. Di questi ultimi, uno dei bisogni globali insoddisfatti è lo sviluppo di strumenti efficienti per combattere le infezioni da virus a RNA trasmessi attraverso le zanzare. Molti virus a RNA, come la dengue, zika e il virus chikungunya, vengono trasmessi attraverso le zanzare, influenzando la salute umana e contribuendo alla mortalità. Sono state avanzate molte proposte per l'ingegneria delle popolazioni di zanzare con resistenza ai virus per la prevenzione delle malattie; tuttavia, nessuna tecnologia attuale è in grado di rendere le zanzare contemporaneamente resistenti a tutti i virus a RNA significativi18,19,20,21,22,23. I sistemi Cas di targeting dell'RNA possono fornire un punto di partenza per tale tecnologia abilitando una piattaforma programmabile per il targeting di tutti i virus a RNA trasmessi dalle zanzare.
Protocollo
1. Targeting dell'RNA in vivo onnipresente utilizzando un sistema CasRx a due componenti
- Generazione del vettore di espressione Ubiq-CasRx e Ubiq-dCasRx
- Amplificare la sequenza CasRx utilizzando una reazione a catena della polimerasi (PCR) con primer 1050E. C3 e 1050E. C4 e il costrutto CasRx originale pNLS-RfxCas13d-NLS-HA (pCasRx); e amplificare la sequenza dCasRx utilizzando la PCR con primer 1050E. C3 e 1050E. C4 e il costrutto dCasRx originale pNLS-dRfxCas13d-NLS-HA (pdCasRx)4 (Tabella 1). Successivamente purificare in gel i frammenti CasRx e dCasRx amplificati utilizzando un kit di purificazione del gel.
- Vettore base del digest (Addgene plasmid #112686) con enzimi di restrizione SwaI e PacI24. Nei prodotti risultanti, utilizzare un kit per purificare il frammento più grande, che è chiamato spina dorsale vettoriale di base.
- Assemblare il vettore Ubiq-CasRx con la dorsale vettoriale di base e il frammento CasRx utilizzando il metodo di assemblaggio Gibson; assemblare il vettore Ubiq-dCasRx con la spina dorsale vettoriale di base e il frammento dCasRx utilizzando il metodo di assemblaggio Gibson25.
NOTA: l'ID addgenico del vettore Ubiq-CasRx (OA-1050E) è #132416 e l'ID addgenico del vettore Ubiq-dCasRx (OA-1050R) è #132417.
- Generazione del vettore di espressione gRNA
- Progettare ogni frammento di gRNA in base ai seguenti criteri: la sequenza target è lunga 30 nucleotidi; la lunghezza massima dei poli-U si estende nella sequenza target essendo 4 coppie di basi; il contenuto GC della sequenza target è compreso tra il 30% e il 70%; la sequenza target prevista per non formare forti strutture forine di RNA; e la sequenza target contenente la struttura secondaria o terziaria minima prevista dell'RNA5.
NOTA: Questo studio ha progettato ogni gRNA come 4 sequenze tandem ciascuna lunga 30 nucleotidi, distanziate da 36 nucleotidi lunghe ripetizioni dirette e con un terminatore a 7-timina su entrambe le estremità5. Per il gene bersaglio esogeno, GFP, sono stati seguiti gli stessi criteri di cui sopra con l'aggiunta di un frammento OpIE2-GFP5. - Amplificare la sequenza del promotore U6:3 usando la PCR con i primer 1043.C1 e 1043.C23 e il plasmide dell'addgenico #112688 (Tabella 1)26. Purificare in gel i frammenti U6:3 amplificati utilizzando il kit di purificazione del gel.
- Digest Addgene plasmid #112688 con enzima di restrizione AscI e XbaI24. Nei prodotti risultanti, utilizzare un kit per purificare in gel i frammenti più grandi, che è chiamato spina dorsale vettoriale pre-base.
- Assemblate il vettore di base con la spina dorsale vettoriale pre-base e il frammento U6:3 utilizzando il metodo di assemblaggio Gibson25. Il vettore di base in seguito è chiamato OA-1043.
NOTA: l'ID addgenico del plasmide OA-1043 è #164586. - Sintetizzare il frammento di gRNA del gene bersaglio utilizzando un servizio di sintesi genica esterno.
- Digerire il vettore base OA-1043 con l'enzima di restrizione PstI e NotI24. Mantenere l'intero prodotto di digestione, che si chiama OA-1043 digerito.
- Assemblare il vettore di espressione del gRNA con l'OA-1043 digerito e il frammento di gRNA del gene bersaglio utilizzando il metodo di assemblaggio Gibson25.
NOTA: Sono stati studiati quattro geni bersaglio: tre erano endogeni (bianco, Notch, giallo), uno era esogeno (GFP). I loro ID addgenici sono: #132420 (gRNAw), #132421 (gRNAN), #132425 (gRNAy) e #133304 (gRNAGFP).
- Progettare ogni frammento di gRNA in base ai seguenti criteri: la sequenza target è lunga 30 nucleotidi; la lunghezza massima dei poli-U si estende nella sequenza target essendo 4 coppie di basi; il contenuto GC della sequenza target è compreso tra il 30% e il 70%; la sequenza target prevista per non formare forti strutture forine di RNA; e la sequenza target contenente la struttura secondaria o terziaria minima prevista dell'RNA5.
- Generazione di mosche transgeniche
- Iniettare vettori di espressione in embrioni di mosca utilizzando il servizio di iniezione di embrioni di mosca esterni ed embrioni da mosche contenenti siti di integrazione ØC31. Allevare gli embrioni iniettati a 26 °C.
NOTA: La linea attp40w (con siti di integrazione sul 2 ° cromosoma) è stata utilizzata per generare linee CasRx e la linea 8622 (con siti di integrazione sul 3 ° cromosoma) è stata utilizzata per generare varie linee di gRNA. - Mantieni le mosche come linee omozigoti o come linee eterozigoti bilanciate.
NOTA: le mosche Ubiq-CasRx e Ubiq-dCasRx sono state mantenute come linee bilanciate eterozigoti con il CyO come bilanciatore. Inoltre, entrambi i vettori Ubiq-CasRx e Ubiq-dCasRx contengono un marcatore dsRed. Di conseguenza, le mosche Ubiq-CasRx e Ubiq-dCasRx hanno i seguenti tre fenotipi: dsRed-positive, ali ricci e occhi bianchi. Le mosche che esprimono gRNA sono state mantenute come linee omozigoti. I loro numeri di stock di mosca del Bloomington Drosophila Stock Center (BDSC) sono: #84118 (Ubiq-CasRx), #84119 (Ubiq-dCasRx), #84124 (gRNAw), #84122 (gRNAN), #84123 (gRNAy), #84986 (gRNAGFP).
- Iniettare vettori di espressione in embrioni di mosca utilizzando il servizio di iniezione di embrioni di mosca esterni ed embrioni da mosche contenenti siti di integrazione ØC31. Allevare gli embrioni iniettati a 26 °C.
- Genetica delle mosche (Figura 1A)
- Raccogli 10 mosche femmine adulte vergini dalla linea gRNA omozigote e raccogli 5 mosche maschi adulte dalla linea Ubiq-CasRx/CyO eterozigote bilanciata. Metti le mosche femminili e maschili raccolte, che sono chiamate mosche parentali, in una fiala integrata con polvere di lievito secco (Figura 1A).
- Ripetere il passaggio precedente 3 volte per generare 3 repliche. Per il gruppo di controllo, utilizzare la linea Ubiq-dCasRx/CyO mantenendo tutto lo stesso.
NOTA: Per una normale fiala di vetro di cibo, sono sufficienti 0,1 g di lievito secco in polvere. Viene utilizzata la ricetta del cibo a mosca del BDSC. - Allevare i flaconcini contenenti le mosche parentali a 26 °C per 48 ore. Quindi rimuovere tutte le mosche parentali da ogni fiala. Quindi conservare i flaconcini a 26 °C per almeno 20 giorni.
- Osserva le fiale ogni giorno per vedere se sono emerse nuove progenie adulte dalle pupe della generazione F1. In tal caso, anestetizzarli con anidride carbonica inserendo un tubo collegato a un serbatoio di anidride carbonica all'interno delle fiale volanti, quindi accendendo il flussostato per 10 secondi.
- Una volta che le mosche diventano immobili, svuotale dalla fiala su un fly-pad, che è anche collegato al serbatoio di anidride carbonica e l'anidride carbonica fuoriesce continuamente attraverso il fly pad.
- Segna il fenotipo delle mosche anestetizzate e visualizzale usando una fotocamera a colori collegata a uno stereomicroscopio fluorescente. Contare il numero di progenie con fenotipi diversi. Utilizzare un software di elaborazione delle immagini per la post-elaborazione e la compilazione delle immagini (Figura 2A - 2D).
NOTA: Sulla base della genetica mendeliana, sono attesi due tipi di mosche tra le progenie per ogni croce (Figura 1A).
- RNA-Seq (Figura 2E – 2G)
- Raccolta di campioni
NOTA: scegliere un metodo di raccolta dei campioni appropriato dai 3 esempi seguenti; Sono necessarie 3 repliche per ogni tipo di campione distinto.- Raccolta di campioni di teste di mosca adulta
- Raccogli 10 mosche femmine adulte vergini dalla linea omozigote del gRNA. Raccogli 5 mosche maschio adulto dalla linea bilanciata eterozigote Ubiq-CasRx/CyO. Metti le mosche femminili e maschili raccolte, che sono le mosche parentali, in una fiala integrata con polvere di lievito secco.
- Ripetere il passaggio precedente 3 volte per 3 repliche. Per il gruppo di controllo, utilizzare la linea Ubiq-dCasRx/CyO mantenendo tutto lo stesso.
- Allevare i flaconcini contenenti le mosche parentali a 26 °C per 48 ore. Quindi rimuovere tutte le mosche parentali da ogni fiala. Quindi tenere i flaconcini a 26 °C fino a quando le progenie emergono dalle pupe.
- Raccogli 10 mosche adulte di 1 giorno con il fenotipo corretto. Anestetizzare le mosche con anidride carbonica, quindi tagliare la testa della mosca e mettere le teste in un tubo centrifugo da 1,5 ml su ghiaccio secco. Conservare il tubo della centrifuga a -80 °C. Ripetere questo passaggio 3 volte per 3 repliche.
- Raccolta di campioni di embrioni di 17 – 20 ore
- Raccogli 8-10 mosche femmine adulte vergini dalla linea omozigote del gRNA. Raccogli 4-5 mosche maschi adulte dalla linea bilanciata eterozigote Ubiq-CasRx/CyO. Metti le mosche femminili e maschili raccolte, che sono le mosche parentali, in una fiala integrata con polvere di lievito secco.
- Ripetere il passaggio precedente 3 volte per 3 repliche. Per il gruppo di controllo, utilizzare la linea Ubiq-dCasRx/CyO mantenendo tutto lo stesso.
- Allevare i flaconcini contenenti le mosche parentali a 26 °C per 48 ore.
- Preparare una camera di raccolta embrioni di succo d'uva per ogni replica seguendo questa ricetta: 376 ml di acqua, 126 ml di succo d'uva, 15 g di agar e 6 g di saccarosio. Mettere il supporto in un becher da 1 L e cuocerlo a microonde in alto per 5-6 minuti tenendo d'occhio il supporto nel becher per verificare se appaiono bolle / schiuma. In tal caso, fermare il microonde e lasciare che la bolla / schiuma si depositi. Continua a cuocere a microonde in questo modo fino a quando la bolla non diventa chiara. Non ruotare fino a quando tutte le bolle sono chiare. Infine, aggiungere 10 ml di alcol al 100% e 5 ml di acido acetico. Mescolare bene, quindi pipettare il supporto in piastre di Petri da 35 mm con un pipetto sierologico da 25 ml. Quando il supporto si solidifica nella capsula di Petri, è pronto per l'uso.
- Al termine dell'incubazione di 48 ore, trasferire le mosche parentali nelle camere di raccolta degli embrioni del succo d'uva e incubarle a 26 °C per 3 ore. Quindi rimuovere le mosche adulte mantenendo gli embrioni appena deposti sulle piastre di succo d'uva per altre 17 ore a 26 ° C.
- Dopo l'incubazione, raccogliere i 50 – 100 embrioni dalle piastre di succo d'uva, pulire la superficie dell'embrione immergendoli in acqua deionizzata, quindi trasferirli in un tubo centrifugo da 1,5 ml sul ghiaccio. Conservarli a -80 °C. Ripetere questo passaggio 3 volte per 3 repliche.
- Prima raccolta di campioni di larve instar
- Raccogli 8-10 mosche femmine adulte vergini dalla linea omozigote del gRNA. Raccogli 4-5 mosche maschi adulte dalla linea bilanciata eterozigote Ubiq-CasRx/CyO. Metti le mosche femminili e maschili raccolte, che sono le mosche parentali, in una fiala integrata con polvere di lievito secco. Ripetere questo passaggio 3 volte per 3 repliche. Per il gruppo di controllo, utilizzare la linea Ubiq-dCasRx/CyO mantenendo tutto lo stesso.
- Allevare i flaconcini contenenti le mosche parentali a 26 °C per 48 ore. Quindi trasferire le mosche adulte in un altro nuovo flaconcino di cibo normale per l'incubazione notturna (16 ore) a 26 °C. Quindi, rimuovere le mosche adulte.
- Tenere il flaconcino contenente embrioni a 26 °C per 24 ore, quindi segnare le prime larve transeterozigoti al microscopio utilizzando marcatori distinti basati. Raccogliere 15-30 larve con fenotipi corretti e metterle in un tubo centrifugo da 1,5 ml e conservarle a -80 °C. Ripetere questo passaggio 3 volte per 3 repliche.
- Raccolta di campioni di teste di mosca adulta
- Sequenziamento
- Estrazione dell'RNA: utilizzare un kit di estrazione dell'RNA disponibile in commercio e seguire le istruzioni del kit per elaborare tutti i campioni. Quindi, incubare i campioni di RNA estratti con desossiribonucleasi disponibile in commercio e seguire le sue istruzioni per rimuovere qualsiasi DNA contaminante dai campioni.
- Misurare la concentrazione di RNA utilizzando lo spettrofotometro UV-vis disponibile in commercio. Misurare l'integrità dell'RNA nei campioni utilizzando la configurazione del test di integrità dell'RNA disponibile in commercio.
- Costruisci le librerie RNA-seq utilizzando il kit di preparazione della libreria di RNA disponibile in commercio.
- Utilizzare il servizio di sequenziazione esterno per la sequenziazione della libreria con le seguenti impostazioni: modalità di lettura singola; lunghezza di lettura: 50nt, profondità: 20 milioni di letture per libreria. Eseguire chiamate di base con RTA 1.18.64 e quindi convertire i dati in FASTQ utilizzando bcl2fastq 1.8.4.
NOTA: i dati grezzi di sequenziamento sono disponibili nel National Center for Biotechnology Information Sequencing Read Archive (ID di presentazione: SUB6818910 [BioProject: PRJNA600654]).
- Bioinformatica
- La mappa legge dai dati di sequenziamento al release 6 del genoma di Drosophila melanogaster dal Berkeley Drosophila Genome Project (numero di adesione GenBank: GCA_000001215.4) e alle sequenze esogene CasRx e GFP utilizzando l'impostazione predefinita dei parametri di STAR aligner28 con l'aggiunta dell'opzione di filtro "-outFilterType BySJout" e del Drosophila_melanogaster "-sjdbGTFfile". BDGP6.22.97.gtf" file in formato di trasferimento genico da ENSEMBL.
- Determinare i conteggi delle trascrizioni non elaborate per ogni trascrizione annotata con la funzione Counts35 utilizzando le opzioni "-t eson -g gene_id -M -O --fraction". Quindi, normalizza i conteggi delle trascrizioni non elaborate utilizzando i conteggi totali delle trascrizioni utilizzando lo script Perl "addTpmFpkmToFeatureCounts.pl".
- Utilizzare il metodo a posteriori con lo stimatore di restringimento originale nella pipeline DESeq2 per stimare il cambiamento logaritmico della piega logaritmica (LFC) dei trascritti di ciascun gene.
- Raccolta di campioni
2. Targeting dell'RNA esogeno ubiquitario in vivo utilizzando un sistema CasRx a tre componenti
- Generazione di un vettore di espressione ubiquitario esogeno target
- La PCR amplifica il frammento del promotore Ubiq utilizzando i primer 1052B. C1 e 1052B. C2 e il plasmide addgenico #112686 26. Quindi, la PCR amplifica il frammento T2A-eGFP amplificato dal plasmide addgenico #112686 con primer 908A.1 e 908A.2 (Tabella 1)26. Quindi, la PCR amplifica il frammento del promotore Ubiq come sequenza invertita usando addgene plasmidico #112686 con primer 908A.3 e 908A.4 (Tabella 1)26. Purificare il gel il frammento promotore Ubiq, il frammento T2A-eGFP e il frammento promotore Ubiq invertito utilizzando il kit di purificazione del gel.
- Ordina una sequenza di codifica luciferasi lucciola personalizzata e un frammento personalizzato contenente un frammento p10 3'UTR, renilla luciferase invertita seguito da un frammento SV40 3'UTR.
- Digest Addgene plasmid #112688 con enzima di restrizione AscI e XbaI24. Nei prodotti risultanti, purificare il gel i frammenti più grandi utilizzando il kit di purificazione del gel, che è chiamato spina dorsale del vettore di base.
- Utilizzare il metodo di assemblaggio Gibson per assemblare il vettore di base con la spina dorsale del vettore di base e i seguenti frammenti: il frammento del promotore Ubiq, il frammento T2A-eGFP, il frammento del promotore Ubiq invertito, la sequenza di codifica della lucciola luciferasi e la renilla luciferasi invertita seguita da un frammento SV40 3'UTR25.
NOTA: l'ID Addgene del vettore di espressione dual-luciferasi risultante (OA-1052B) è #132426.
- Generazione del vettore di espressione gRNA
- La PCR amplifica la sequenza del promotore U6:3 usando i primer 1043.C1 e 1043.C23 e il plasmide addgenico #112688 (Tabella 1)26. Purificare in gel i frammenti U6:3 amplificati utilizzando il kit di purificazione del gel.
- Digest Addgene plasmid #112688 con enzima di restrizione AscI e XbaI24. Nei prodotti risultanti, purificare il gel i frammenti più grandi, che è chiamato spina dorsale vettoriale pre-base, utilizzando il kit di purificazione del gel.
- Assemblate il vettore di base con la spina dorsale vettoriale pre-base e il frammento U6:3 utilizzando il metodo di assemblaggio Gibson25. Il vettore di base in seguito è chiamato OA-1043.
- Sintetizzare il frammento di gRNA del gene bersaglio utilizzando un servizio di sintesi genica esterno.
- Digerire il vettore base OA-1043 con l'enzima di restrizione PstI e NotI24. Mantenere l'intero prodotto di digestione, che viene chiamato digerito OA-1043.
- Assemblare il vettore di espressione del gRNA con l'OA-1043 digerito e il frammento di gRNA del gene bersaglio utilizzando il metodo di assemblaggio Gibson25.
NOTA: l'ID addgenico del plasmide risultante (OA-1052K) è #132422.
- Generazione di mosche transgeniche
- Iniettare il vettore OA-1052B in embrioni di mosca utilizzando embrioni di mosche contenenti il sito di integrazione ØC31 sul 3 ° cromosoma, numero di stock di mosca BDSC 9744, tramite il servizio di iniezione di embrioni di mosca esterni. Allo stesso modo, iniettare il vettore OA-1052K in embrioni di mosca utilizzando embrioni di mosche contenenti il sito di integrazione ØC31 sul 3 ° cromosoma, numero di stock di mosca BDSC 8622. Allevare gli embrioni iniettati a 26 °C.
- Mantenere le mosche che esprimono la doppia luciferasi e il gRNA vola come linee omozigoti; mantenere le linee Ubiq-CasRx come linee eterozigoti a doppio equilibrio superando la linea Ubiq-CasRx eterozigote a bilanciato singolo generata nella sezione 1 alle linee di bilanciamento che trasportano il cromosoma bilanciatore TM6 con marcatore di stoppie (Stb) e mantenere solo le progenie a doppio equilibrio con fenotipi a occhio bianco, ricci e dsRed-fluorescenti contemporaneamente.
NOTA: I numeri di stock di mosca BDSC sono: #84127 (Ubiq-Fluc-Rluc), #84125 (gRNAFluc).
- Genetica delle mosche (Figura 1B e Figura 3A)
- Raccogli 8-10 mosche femmine adulte vergini dalla linea che esprime la doppia luciferasi. Raccogli 4-5 mosche maschi adulte dall'eterozigote bilanciato Ubiq-CasRx/CyO; +/TM6, linea Stb che mostra contemporaneamente ali bianche, ricci e fluorescenza dsRed. Metti le mosche femmine e maschili raccolte, che sono le mosche parentali, in una fiala integrata con polvere di lievito secco (di seguito chiamata Step 1 Cross).
- Ripetere il passaggio precedente 3 volte per 3 repliche. Per il gruppo di controllo, utilizzare Ubiq-dCasRx/CyO; +/TM6, linea Stb mantenendo tutto il resto uguale.
- Sollevare i flaconcini incrociati Step 1 contenenti le mosche parentali a 26 °C per 48 ore. Quindi rimuovere tutte le mosche parentali da ogni fiala. Quindi conservare i flaconcini a 26 °C per almeno 14 giorni. Durante questo periodo, raccogli 8-10 vergini femmine dalla linea omozigote del gRNA che mira alla lucciola luciferasi. Ripetere questo passaggio 3 volte per 3 repliche.
- Osserva le fiale della Croce Passo 1 ogni giorno per vedere se qualche nuova mosca adulta emerge dalle pupe. Se è così, anestetizzarli con anidride carbonica, raccogliere 5 mosche maschio che esprimono sia l'Ubiq-CasRx (o Ubiq-dCasRx) che il reporter della doppia luciferasi dalle progenie e metterli in una nuova fiala insieme a 10 femmine vergini dalla linea gRNA che punta alla lucciola luciferasi (di seguito chiamata Step 2 Cross). Ripetere questo passaggio 3 volte per 3 repliche.
- Raccogli altri 5 maschi di un giorno che esprimono sia l'Ubiq-CasRx (o Ubiq-dCasRx) che il reporter a doppia luciferasi dalle fiale della Croce Passo 1 e incubale per 2 – 4 giorni a 26 °C. Quindi, trasferirli in un tubo di centrifuga da 1,5 ml e conservarli a -80 °C. Ripetere questo passaggio 3 volte per tre repliche.
- Sollevare i flaconcini incrociati Step 2 contenenti le mosche parentali a 26 °C per 48 ore. Quindi rimuovere tutte le mosche parentali da ogni fiala. Quindi conservare i flaconcini a 26 °C per almeno 20 giorni.
- Osserva le fiale della Croce Passo 2 ogni giorno per vedere se dalle pupe sono emerse nuove progenie adulte. In tal caso, anestetizzarli con anidride carbonica, segnare i fenotipi delle mosche anestetizzate e visualizzarli utilizzando una fotocamera a colori dotata di uno stereomicroscopio fluorescente. Contare il numero di progenie con fenotipi diversi. Utilizzare un software di elaborazione delle immagini per la post-elaborazione e la compilazione delle immagini (Figura 3B – 3C).
NOTA: La genetica mendeliana suggerisce che, se le mosche sono tutte vitali, sono attesi 4 tipi di mosche tra le progenie della Step 2 Cross, ognuna delle quali rappresenta il 25% della popolazione (Figura 1B e Figura 3A).
- Test della luciferasi (Figura 3D)
- Generare le mosche triplo transeterozigoti e le mosche di controllo ripetendo i passaggi 2.4.1-2.4.5. Raccogli le mosche maschili alla nascita e invecchiale fino a 3 giorni.
- Trasferire le mosche di 3 giorni in tubi di centrifuga da 1,5 ml e lisarle usando un pestello e il tampone di lisi della luciferasi del kit di analisi della luciferasi disponibile in commercio.
- Utilizzare 5 μL di tessuto lisato da ciascun campione per misurare sia l'attività della lucciola che della renilla luciferasi utilizzando il kit di analisi della luciferasi e il luminometro disponibili in commercio.
3. Targeting dell'RNA in vivo specifico per tessuto utilizzando un sistema CasRx a tre componenti
- Generazione di vettori di espressione UASt-CasRx e UASt-dCasRx
- La PCR amplifica la sequenza del promotore UASt utilizzando il plasmide pJFRC81 e i primer 1041.C9 e 1041.C11; quindi, la PCR amplifica il frammento CasRx usando il plasmide OA-1050E (Addgene ID #132416) e i primer 1050L. C1 e 1050E. C4; e poi pcr amplificare i frammenti dCasRx usando il plasmide OA-1050R (Addgene ID #132417) e i primer 1050L. C1 e 1050E. C4 (tabella 1)26. Purificare in gel la sequenza di promotori UASt amplificati, i frammenti CasRx e dCasRx utilizzando il kit di purificazione del gel.
- Vettore base del digest (Addgene plasmid #112686) con enzimi di restrizione NotI e PacI24. Nei prodotti risultanti, purificare il gel il frammento più grande, che è chiamato spina dorsale vettoriale di base, utilizzando il kit di purificazione del gel.
- Assemblare il vettore UASt-CasRx con la spina dorsale del vettore di base, la sequenza del promotore UASt e il frammento CasRx usando l'assieme Gibson; quindi assemblare il vettore UASt-dCasRx con la dorsale del vettore di base, la sequenza del promotore UASt e il frammento dCasRx utilizzando il metodo di assemblaggio Gibson25.
NOTA: il vettore UASt-CasRx è Addgene plasmid #132418 e il vettore UASt-dCasRx è Addgene plasmid #132419
- Generazione di mosche transgeniche
- Iniettare il vettore UASt-CasRx in embrioni di mosca utilizzando il servizio di iniezione di embrioni di mosca ed embrioni da mosche ØC31 sito di integrazione 8621 sul loro secondo cromosoma ; quindi iniettare il vettore UASt-dCasRx in embrioni di mosca utilizzando il servizio di iniezione di embrioni di mosca ed embrioni di mosche ØC31 sito di integrazione 8621 sul loro secondo cromosoma . Allevare gli embrioni iniettati a 26 °C.
- Mantieni le mosche come linee eterozigoti a doppio equilibrio con marcatori CyO e Sb. NOTA: gli ID delle linee di volo in BDSC sono 84121 (UASt-CasRx) e 84120 (UASt-dCasRx).
- Genetica delle mosche (Figura 1C)
- Ordina le linee GAL4 desiderate da BDSC; Ottenere linee di gRNA rilevanti dal passo 3.2.2 (o da BDSC).
NOTA: Sono state utilizzate le seguenti 2 mosche GAL4 da BDSC: GAL4-GMR (ID BDSC: #29967), GAL4-y (ID BDSC: #44373). Sono state utilizzate le stesse 3 linee di gRNA generate nella prima sezione: gRNAw (BDSC ID: #84124), gRNAN (BDSC ID #84122), gRNAy (BDSC ID: #84123). - Raccogli 5-10 mosche femmine adulte vergini dalla linea gRNA. Raccogliere 2-4 mosche maschio adulte dal doppio bilanciato eterozigote UASt-CasRx/CyO; +/TM6, linea Sb che mostra contemporaneamente ali bianche, ricci e fluorescenza dsRed. Metti le mosche femminili e maschili raccolte, che sono le mosche parentali, in una normale fiala di cibo (di seguito chiamata Step 1 Cross). Ripetere questo passaggio 3 volte per 3 repliche. Per il gruppo di controllo, utilizzare UASt-dCasRx/CyO; +/TM6, linea Sb mantenendo tutto il resto uguale.
- Sollevare i flaconcini incrociati Step 1 contenenti le mosche parentali a 26 °C per 48 ore. Quindi rimuovere tutte le mosche parentali da ogni fiala. Quindi conservare i flaconcini a 26 °C per almeno 14 giorni. Durante questo periodo, raccogli 5-10 vergini femminili dalla linea GAL4. Ripetere questo passaggio 3 volte per 3 repliche.
- Osserva le fiale della Croce Passo 1 ogni giorno per vedere se qualche nuova mosca adulta emerge dalle pupe. Se è così, anestetizzarli con anidride carbonica, raccogliere 2-4 mosche maschio che esprimono sia l'UASt-CasRx (o UASt-dCasRx) che il vettore gRNA dalle progenie che hanno contemporaneamente fenotipi dsRed-fluorescenti e stoppie. Metti i maschi raccolti dalla Croce del Passo 1 in una nuova fiala insieme a 5-10 femmine vergini raccolte dalla linea GAL4 (di seguito chiamata Croce passo 2). Ripetere questo passaggio 3 volte per 3 repliche.
- Sollevare i flaconcini incrociati Step 2 contenenti le mosche parentali a 26 °C per 48 ore. Quindi rimuovere tutte le mosche parentali da ogni fiala. Quindi conservare i flaconcini a 26 °C per almeno 20 giorni.
- Osserva le fiale della Croce Passo 2 ogni giorno per vedere se qualche nuova mosca adulta emerge dalle pupe. In tal caso, anestetizzarli con anidride carbonica, segnare i fenotipi delle mosche anestetizzate e visualizzarli utilizzando una fotocamera a colori dotata di uno stereomicroscopio fluorescente. Contare il numero di progenie con fenotipi diversi. Utilizzare un software di elaborazione delle immagini per la post-elaborazione e la compilazione delle immagini (Figura 4).
NOTA: La genetica mendeliana suggerisce che, se le mosche sono tutte vitali, sono attesi 4 tipi di mosche tra le progenie della Step 2 Cross, ognuna delle quali rappresenta il 25% della popolazione (Figura 1C).
- Ordina le linee GAL4 desiderate da BDSC; Ottenere linee di gRNA rilevanti dal passo 3.2.2 (o da BDSC).
Risultati
Targeting RNA ubiquitario in vivo utilizzando un sistema CasRx a due componenti
Le mosche transeterozigoti F1 che esprimono sia i costrutti Ubiq-CasRx che gRNA (mirati sia ai geni endogeni che esogeni) hanno mostrato fenotipi marcati rispetto alle mosche di controllo che esprimono i costrutti Ubiq-dCasRx e gRNA (Figura 2 e Figura 4). In particolare, le mosche transeterozigoti CasRx hanno livelli significativamente più bassi di tasso di sopravvivenza rispetto alle mosche transeterozgye dCasRx, indicando tossicità del sistema Ubiq-CasRx (Figura 2A e Figura 4A). Vale la pena notare che entrambe le mosche transeterozigoti CasRx e dCasRx hanno un tasso di ereditarietà inferiore al 50%, che è il rapporto atteso basato sulla genetica mendeliana. Dei tre geni bersaglio, l'Ubiq-CasRx/+; U6-gRNAN/+ mosche e Ubiq-CasRx/+; Le mosche U6-gRNAy/+ non sono vitali (ereditarietà dello 0%) e non sono cresciute oltre il secondo stadio di larve instar (Figura 2A-2B). L'Ubiq-CasRx/+sopravvissuto; Le mosche U6-gRNAw/+, la cui ereditarietà era del 12,9%, hanno mostrato un fenotipo distinto dagli occhi bianchi completamente penetrante (Figura 2B). Oltre ai tratti osservabili associati a CasRx, siamo stati in grado di confermare una significativa riduzione dei trascritti genici bersaglio per 3 geni bersaglio: Notch, giallo e GFP (Figura 2E-2G). La riduzione dei trascritti del gene bianco è stata osservata nelle mosche Ubiq-CasRx/+, U6-gRNAw/+, rispetto alle mosche Ubiq-dCasRx/+, U6-gRNAw/+, di controllo, sebbene la riduzione non fosse statisticamente significativa (Figura 2E - 2F). Prove di attività off-target indotte da CasRx sono state trovate confrontando i trascritti differenzialmente espressi tra campioni di mosche che esprimono CasRx e campioni di mosche che esprimono dCasRx (Figura 2E, 2G). Il numero di trascrizioni non target significativamente espresse in modo differenziato è il seguente: bianco, 253 (1,4% delle trascrizioni totali); Notch, 300 (1,7%); giallo, 41 (0,23%); GFP, 5.880 (33%) (Figura2G). Del totale di 17.779 trascrizioni diverse, 6 trascrizioni non target sono state significativamente espresse in modo differenziato in tutti e 4 i gruppi di campioni. Uno dei 6 trascritti identificati è stato Gadd45, un gene coinvolto nell'apoptosi e nell'arresto cellulare nelle mosche, sollevando la possibilità che l'azione enzimatica di CasRx possa innescare direttamente l'apoptosi cellulare o innescare indirettamente un'errata espressione di altri geni, che a sua volta porta all'apoptosi. Infine, vale la pena notare che le mosche Ubiq-CasRx e Ubiq-dCasRx non sono state stabilite come stock omozigoti, presumibilmente a causa della tossicità conferita da un'elevata espressione ubiquitaria. Di conseguenza, le mosche eterozigoti Ubiq-CasRx/CyO e Ubiq-dCasRx/CyO sono state utilizzate per l'incrocio con linee di mosca gRNA omozigoti. In sintesi, il sistema Ubiq-CasRx a due componenti è in grado di raggiungere il targeting rna ubiquitario sia per bersagli endogeni che esogeni con conseguente fenotipi osservabili e riduzione del trascritto. Questi risultati hanno anche mostrato che il targeting dell'RNA mediato da CasRx può introdurre tossicità in vivo.
Targeting dell'RNA esogeno ubiquitario in vivo utilizzando un sistema CasRx a tre componenti
I risultati della croce in due fasi hanno mostrato che, nonostante la natura esogena del gene bersaglio (cioè Fluc), l'espressione di tutti e tre i transgeni nei tripli transeterozigoti F2 (Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) ha determinato una letalità del 100% rispetto agli incroci di controllo che coinvolgono Ubiq-dCasRx, dove non è stata osservata letalità nei tripli transeterozigoti F2 (Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) (Figura 3B-C ). Più specificamente, solo la combinazione di tutti e tre i transgeni (Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) ha determinato una letalità del 100% (Figura 3B e D), mentre (Ubiq-CasRx/+; gRNAFluc/TM6) e (Ubiq-CasRx/+; I genotipi Ubiq-Fluc-Ubiq-Rluc/TM6) erano vitali e mancavano di fenotipi con i loro tassi di ereditarietà corrispondenti ai tassi di trasmissione mendeliani attesi, suggerendo che la disponibilità della sequenza bersaglio (cioè la lucciola luciferasi) in combinazione con Ubiq-CasRx/+ e gRNAFluc è ciò che ha portato ai fenotipi di letalità osservati, presumibilmente derivanti dall'attività collaterale degli enzimi Cas132,8 . Inoltre, nessun fenotipo distinguibile o influenza drammatica sull'ereditarietà nei transeterozigoti F1 (Ubiq-CasRx/+; gRNAFluc/+ o Ubiq-CasRx/+; Ubiq-Fluc-Ubiq-Rluc/+) sono stati osservati rispetto ai controlli Ubiq-dCasRx (Ubiq-dCasRx/+; gRNAFluc/+ o Ubiq-dCasRx/+; Ubiq-Fluc-Ubiq-Rluc/+) (Figura 3B), che indica che un enzima cataliticamente attivo è essenziale per ottenere i fenotipi di letalità osservati. Inoltre, i livelli di espressione di Fluc e Rluc nelle mosche di tutti i genotipi vitali non hanno mostrato una riduzione significativa dell'espressione di Fluc nei tripli transeterozigoti Ubiq-dCasRx (Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) rispetto ai controlli reporter dual luciferase. Ciò suggerisce che i livelli di espressione della proteina Fluc non sono stati ridotti dal targeting dCasRx (Figura 3D). Nel loro insieme, il fenotipo di letalità comune nei due diversi esperimenti di targeting dell'RNA ubiquitario mediato da CasRx indica che se usato sui tessuti in modo ubiquitario, il targeting dell'RNA mediato da CasRx può essere tossico per l'organismo.
Targeting dell'RNA in vivo specifico per tessuto utilizzando un sistema CasRx a tre componenti
L'alto livello di tossicità osservato negli esperimenti di targeting dell'RNA ubiquitario ci ha spinto a esplorare il targeting dell'RNA specifico del tessuto utilizzando un progetto di sistema CasRx a tre componenti dettagliato nella sezione dei metodi. In effetti, il livello di tossicità osservato è stato ridotto quando l'espressione complessiva di CasRx è stata abbassata utilizzando il promotore UASt rispetto a quello del promotore Ubiq, questo è esemplificato in tre aspetti: 1) le linee UASt-CasRx e UASt-dCasRx sono state mantenute come linee omozigoti, anche se sulla base dello schema incrociato a due fasi sono state utilizzate linee UASt-CasRx e UASt-dCasRx a doppio bilanciamento per eseguire le croci, 2) tutti i tassi di ereditarietà tripla transeterozigote dCasRx di generazione F2 corrispondevano al tasso di ereditarietà mendeliana previsto del 25% e 3) il fenotipo di letalità transeterozigote casRx tripla generazione F2 era moderatamente ridotto. Nell'esperimento di targeting bianco, dei tassi di ereditarietà mendeliana del 25% attesi nei tripli transeterozigoti F2, sono state osservate solo lo 0,57% di mosche adulte vitali (UASt-CasRx/+; gRNAw/GMR-Gal4), che mostravano tutti gravi fenotipi di pigmentazione e morfologia specifici per gli occhi (Figura 4A e 4B). Per la croce di targeting bianco, il tasso di ereditarietà di F2 triplo transeterozigote che esprime CasRx era significativamente inferiore a quello del gruppo di controllo triplo transeterozigote che esprime dCasRx (27,6%) (Figura 4A). Nell'esperimento di targeting di Notch, il triplo tranheterozigote che esprime CasRx che trasportava tutti e tre i transgeni era letale al 100%, mentre il tasso di ereditarietà del controllo dCasRx era del 29,3% (Figura 4A). Nell'esperimento di targeting giallo, F2 tripla transeterozigote Che esprime CasRx, gRNAy e y-GAL4 hanno mostrato una riduzione marginale del pigmento di chitina come piccole macchie di cuticola gialla sul torace e sull'addome con un tasso di ereditarietà del 2,67%, molto inferiore a quello del gruppo di controllo dCasRx (25,2%) (Figura 4A). ). Tutte le mosche transeterozigoti di controllo dCasRx non presentavano fenotipi evidenti come le mosche che esprimono CasRx, indicando che l'attività catalitica di CasRx ha contribuito ai fenotipi osservati. Il basso tasso di ereditarietà nel gruppo casRx triplo transeterozigote ha suggerito che esistono due fonti di tossicità nel targeting dell'RNA CasRx: una è associata ad un'alta espressione di CasRx, la cui tossicità è stata ridotta dall'espressione restrittiva di CasRx, l'altra è associata all'attività collaterale. Nel loro insieme, questi risultati hanno dimostrato che il sistema CasRx può raggiungere il targeting dell'RNA in vivo specifico per i tessuti sfruttando il classico sistema Gal4 / UASt e nel frattempo ridurre la tossicità. Tuttavia, i fenotipi di tossicità e letalità occasionale sono stati ancora osservati a un livello di gravità inferiore rispetto a quello degli approcci ubiquitari, indicando che l'attività di scissione collaterale è associata a tossicità.
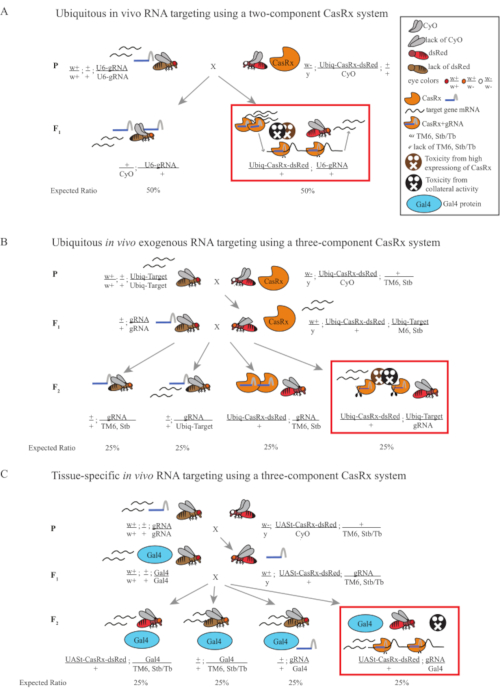
Figura 1: Panoramica generale del targeting dell'RNA utilizzando un sistema Cas13D. (A) Schemi della croce genetica in un solo passaggio nel targeting rna ubiquitario in vivo utilizzando un sistema CasRx a due componenti. (B) Schemi di una croce genetica in due fasi nel targeting rna esogeno ubiquitario in vivo utilizzando il sistema CasRx a tre componenti. (C) Schemi di una croce genetica in due fasi nel targeting dell'RNA in vivo specifico del tessuto utilizzando un sistema CasRx a tre componenti. Fare clic qui per visualizzare una versione più grande di questa figura.
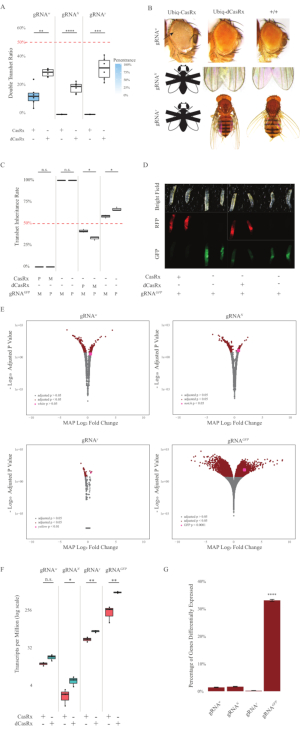
Figura 2: Targeting dell'RNA in vivo onnipresente utilizzando un sistema CasRx a due componenti (ristampato5). (A) Percentuali di ereditarietà totale di mosche transeterozigoti che ereditano Ubiq-CasRx (o Ubiq-dCasRx) e gRNA. L'ombreggiatura blu nel riquadro indica la penetranza del fenotipo. (B) Fenotipi delle mosche transeterozigoti. Le frecce indicano la necrosi tissutale nell'occhio. La mosca in bianco e nero contrassegnata con ''X'' rappresenta la letalità. (C) Percentuali di ereditarietà totale delle mosche transeterozigoti di incroci bidirezionali tra mosche Ubiq-CasRx (o Ubiq-dCasRx) e gRNAGFP-OpIE2-GFP. M, eredità materna di CasRx; P, eredità paterna di CasRx. (D) Le larve F1 progenie nella croce paterna. (E) Stime a posteriori massime delle trascrizioni per la variazione della piega logaritmica. È stata utilizzata la pipeline DESeq2. (F) Trascrizioni per milione (TPM) mirate con CasRx o dCasRx. (G) CasRx-depentent percentuale di trascrizione differenzialmente espressa delle trascrizioni. Fare clic qui per visualizzare una versione più grande di questa figura.
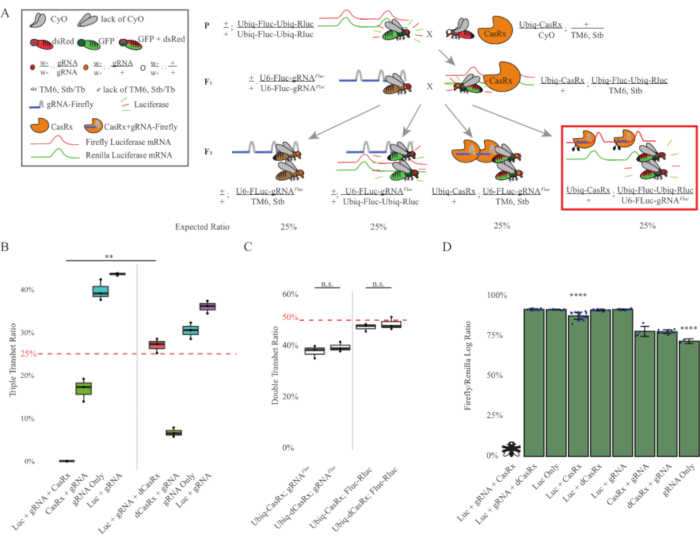
Figura 3: Targeting dell'RNA esogeno ubiquitario in vivo utilizzando un sistema CasRx a tre componenti. (A) Schemi della croce genetica in due fasi. (B) Percentuali di ereditarietà totale per tutti i genotipi emergenti nella generazione F2 . L'ereditarietà di tutti e tre i transgeni (Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc e gRNAFLuc) nella progenie F2 ha determinato una letalità del 100% ed è stata significativamente inferiore rispetto al gruppo di controllo dei tre transeterozigoti Ubiq-dCasRx (p = 0,001, t-test). (C) Il trasporto di Ubiq-CasRx/gRNAFluc da solo o Ubiq-CasRx e Ubiq-Fluc-Ubiq-Rluc da solo non ha portato a grave letalità e i rapporti di ereditarietà tra i transeterozigoti Ubiq-CasRx e Ubiq-dCasRx non erano significativamente diversi (p = 0,41 e p = 0,51, rispettivamente, t-test). (D) Rapporti di luciferasi che normalizzano le letture fluc alle letture Rluc. Le mosche triplo transeterozigoti che esprimono Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc, gRNAFLuc erano letali embrionali, che erano rappresentate da una mosca con una "X", e di conseguenza l'espressione della luciferasi non è stata misurata. Il rapporto Fluc/Rluc dei transeterozigoti Ubiq-CasRx/+, Ubiq-Fluc-Ubiq-Rluc/TM6, Stb era significativamente inferiore a quello degli altri gruppi che esprimono Ubiq-Fluc-Ubiq-Rluc (p = 1,2e-06 o inferiore, t-test). I risultati del gruppo solo gRNAFLuc erano significativamente inferiori a quelli di tutti gli altri gruppi (p = 1,2e-06 o inferiore, t-test). Fare clic qui per visualizzare una versione più grande di questa figura.
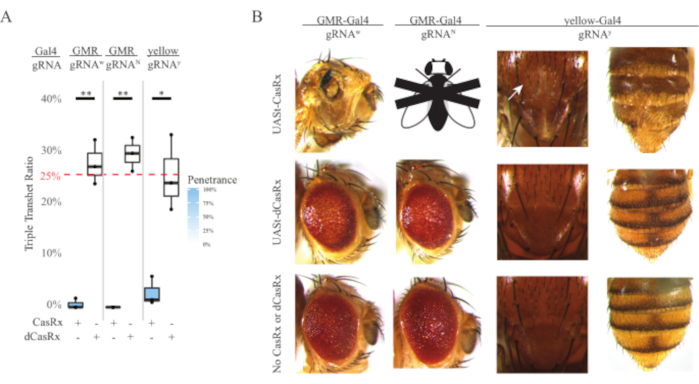
Figura 4: Targeting dell'RNA in vivo specifico per tessuto utilizzando un sistema CasRx a tre componenti (ristampato5). (A) Percentuale di ereditarietà totale di mosche triplo transeterozigote che trasportano tre transgeni (UASt-CasRx o UASt-dCasRx, gRNA e Gal4-driver. (B) Fenotipi delle mosche tripli transeterozigoti. La freccia bianca indica la riduzione del pigmento di chitina nel torace. La mosca in bianco e nero contrassegnata con ''X'' rappresenta la letalità. Fare clic qui per visualizzare una versione più grande di questa figura.
| Costruire | Descrizione | Abbecedario | Sequenza di primer (da 5' a 3') | Modello PCR |
| OA-1050E · | CasRx · | 1050E. C3 · | TACTAATTTTCCAC ATCTCTATTTTGAC CCGCAGATTAATTA ATGAGCCCCAAGA AGAA · | pNLS-RfxCas13d-NLS-HA (pCasRx) |
| 1050E. C4 · | CAATTGATTTGTTA TTTTAAAAACGATT CATTCTAGCTAGCT TAAGCGTAATCTGG AACA · | |||
| OA-1050R · | dCasRx | 1050E. C3 · | TACTAATTTTCCAC ATCTCTATTTTGAC CCGCAGATTAATTA ATGAGCCCCAAGA AGAA · | pNLS-dRfxCas13d-NLS-HA (pdCasRx) |
| 1050E. C4 · | CAATTGATTTGTTA TTTTAAAAACGATT CATTCTAGCTAGCT TAAGCGTAATCTG GAACA · | |||
| OA-1050L · | Promotore UASt | 1041,C9 | GCGGGTTCTCGA CGGTCACGGCGG GCATGTCGACGC GGCCGCAACCAA CAACACTAGTAGTAG | pJFRC81 |
| 1041,C11 | CTGGCCTCCACC TTTCTCTTCTTCT TGGGGCTCATGT TTAAACCCAATT CCCTATTCAGA | |||
| CasRx · | 1050L. C1 · | AATACAAGAAGA GAACTCTGAATA GGGAATTGGGT TTAAACATGAGC CCCAAGAAGAA | pCasRx | |
| 1050E. C4 · | CAATTGATTTGT TATTTTAAAAAC GATTCATTCTA GCTAGCTTAAG CGTAATCTGGA ACA · | |||
| OA-1050S | Promotore UASt | 1041,C9 | GCGGGTTCTC GACGGTCACG GCGGGCATGT CGACGCGGCC GCAACCAACAA CACTAGTAG | pJFRC81 |
| 1041,C11 | CTGGCCTCCA CCTTTCTCTTC TTCTTGGGGCT CATGTTTAAAC CCAATTCCCTA TTCAGA · | |||
| dCasRx | 1050L. C1 · | AATACAAGAAG AGAACTCTGAAT AGGGAATTGGG TTTAAACATGAG CCCCAAGAAGAA | pdCasRx | |
| 1050E. C4 · | CAATTGATTTGT TATTTTAAAAAC GATTCATTCTAG CTAGCTTAAGCG TAATCTGGAACA | |||
| OA-1043 · | Promotore U6:3 | 1043,C1 | GGGAATTGGGA ATTGGGCAATAT TTAAATGGCGGC GCGCCGAATTCT TTTTTGCTCACCT | Plasmide addgenico #164586 |
| 1043,C23 | ACACTAGTGGAT CTCTAGAGGTAC CGTTGCGGCCG CAAAAAAGTTGT AATAGCCCCTCA AAACTGGACCTT CCACAACTGCAG CCGACGTTAAAT TGAAA · | |||
| OA-1052B · | Promotore Ubiq | 1052B. C1 · | GGGAATTGGGCA ATATTTAAATGGC GGCTGCAGCGC GCAGATCGCCGAT | Plasmide addgenico #112686 |
| 1052B. C2 · | TTTCTTTATGTTT TTGGCGTCTTCC ATCCTAGGTCTG CGGGTCAAAATA GAGATG · | |||
| T2A-eGFP | 908A1 · | ATAAAGGCCAAG AAGGGCGGAAA GATCGCCGTGG AGGGCAGAGGA AGTCTTCTAACAT GC | Plasmide addgenico #112686 | |
| 908A2 · | TTGTTATTTTAAAA ACGATTCATTCTA GGCGATCGCTTA CTTGTACAGCTC GTCCATGCC | |||
| Promotore Ubiq invertito | 908A3 · | ACCGTGACCTAC ATCGTCGACACTA GTGGATCTCTAGA CGCGCAGATCGC CGATG · | Plasmide addgenico #112686 | |
| 908A4 · | GGATCATAAACTT TCGAAGTCATGC GGCCGCTCTGCG GGTCAAAATAGAG ATGT · |
Tabella 1: Elenco dei costrutti molecolari e dei primer utilizzati in questo studio. Questo elenco include tutti i costrutti (sia l'ID che la descrizione) e le primer associate a ciascun costrutto (sia l'ID che le sequenze (da 5' a 3')) e i modelli utilizzati.
Discussione
Con tre diversi progetti applicativi del sistema CasRx, questo lavoro ha dimostrato il targeting dell'RNA in vivo programmabile nelle mosche. Le diverse strategie soddisfano le diverse esigenze del progetto, come il targeting genico endogeno rispetto a quello esogeno e il targeting RNA ubiquitario rispetto a quello specifico del tessuto. Gli effetti del targeting dell'RNA includevano cambiamenti fenotipici specifici del gene bersaglio, riduzione del trascritto dell'RNA bersaglio e fenotipi occasionali di letalità associati all'alta espressione della proteina CasRx e all'attività collaterale. Nel complesso, questi risultati hanno mostrato che il sistema CasRx è in grado di indirizzare la riduzione del trascritto dell'RNA a livello dell'organismo in modo programmabile ed efficiente.
Uno dei fattori chiave per il successo della personalizzazione del sistema CasRx è la progettazione di gRNA. In particolare, si deve prestare attenzione ai seguenti consigli: la sequenza target è lunga circa 30 nucleotidi, la lunghezza degli allungamenti poly-U nella sequenza target è di 4 coppie di basi o meno, il contenuto gc della sequenza target è compreso tra il 30% e il 70%, la sequenza target non è prevista per formare forti strutture a forcina di RNA e la sequenza target contiene una struttura secondaria o terziaria minima prevista dell'RNA5.
Oltre ai progetti di gRNA, anche la fase di genetica delle mosche in ogni protocollo è fondamentale per un'implementazione di successo. La presenza o la mancanza dei fenotipi definiti tramandati dai genitori nelle progenie sono importanti per identificare e quantificare i fenotipi indotti dal sistema CasRx nelle progenie transeterozigoti. Inoltre, l'impostazione di incroci di controllo utilizzando le mosche dCasRx in parallelo è anche utile per escludere fenotipi non specifici nelle progenie transeterozigoti.
Vale la pena notare che questi risultati hanno rivelato un problema di tossicità introdotto dall'espressione ubiquitaria delle proteine CasRx e dCasRx nella mosca, una limitazione del sistema CasRx. L'espressione onnipresente di CasRx o dCasRx sotto il solo promotore Ubiq, senza gRNA, ha comportato costi di fitness non banali, poiché né le mosche Ubiq-CasRx né Ubiq-dCasRx potevano essere stabilite come linee omozigoti. Al contrario, le mosche UASt-CasRx e UASt-dCasRx possono essere stabilite come stock omozigoti sani, anche se a causa della progettazione dello schema incrociato sono state mantenute come scorte a doppio equilibrio, un fatto che supporta l'esistenza di tossicità indotta dall'espressione onnipresente della proteina CasRx. Un'altra prova a sostegno è che negli esperimenti di controllo che coinvolgono dCasRx, che è cataliticamente inattivo, le percentuali di mosche che trasportano sia dCasRx che costrutti gRNA sul numero totale di mosche nella generazione F1 erano costantemente inferiori al 50%, il rapporto atteso sulla base della genetica mendeliana se non era presente tossicità associata a dCasRx. Ciò ha indicato che l'espressione ubiquitaria di dCasRx, insieme ai gRNA, induce tossicità nella mosca, risultando in un rapporto di ereditarietà inferiore al previsto. I rapporti di ereditarietà delle mosche transeterozigoti UASt-dCasRx, gRNA, GAL4 hanno seguito la genetica mendeliana, che suggerisce ancora una volta la tossicità indotta specificamente dall'espressione ubiquitaria delle proteine CasRx e dCasRx. La tossicità nel sistema CRISPR/Cas non è nuova. Elevate quantità di proteina Cas9 hanno dimostrato di essere tossiche in diversi organismi, tra cui le mosche29,30,31,32. Un recente studio ha sviluppato un sistema GAL4/UAS personalizzato in grado di sintonizzare la quantità di proteina Cas9 espressa nelle mosche aggiungendo un frame di lettura aperto di lunghezza variabile tra la sequenza UAS e la sequenza Cas9 nel costrutto UAS-Cas933. Pertanto, vale la pena esplorare modi per ridurre la tossicità indotta da CasRx regolando il livello di espressione della proteina CasRx.
Oltre alla tossicità indotta dall'espressione ubiquitaria delle proteine CasRx e dCasRx, i risultati hanno anche mostrato letalità legata agli effetti collaterali non specifici fuori bersaglio del sistema CasRx, una caratteristica di molti sistemi CRISPR1,2,7,34. In alcune delle mosche transeterozigoti doppie o triple che esprimono gRNA casRx e geni non essenziali che esprimono gRNA, ad esempio quando prendono di mira Notch, le mosche CasRx transeterozigoti hanno livelli significativamente più bassi di tasso di sopravvivenza rispetto alle mosche dCasRx transeterozgine. Nell'analisi RNA-seq di queste mosche transeterozigoti che esprimono CasRx e gRNA, sono state osservate sia la riduzione dei livelli di trascrizione genica bersaglio che la riduzione dei trascritti genici non bersaglio. Questi effetti collaterali erano CasRx-dipendenti e target-dipendenti, in quanto sono stati osservati solo nelle mosche transeterozigoti che esprimono sia la proteina CasRx che il gRNA. Vale la pena sottolineare che uno dei geni bersaglio, il bianco, ha mostrato solo una riduzione limitata e non statisticamente significativa dei trascritti quando il gene bianco è stato preso di mira da CasRx, che era in contrasto con il fenotipo di riduzione del pigmento chiaro. Si ipotizza che ciò possa essere dovuto al fatto che 1) i tempi di raccolta del campione RNA-seq non erano ben allineati con i tempi in cui il gene bianco raggiunge la sua massima espressione durante lo sviluppo precoce e 2) l'espressione localizzata del gene bianco negli occhi rende difficile raccogliere i tessuti rilevanti durante la fase iniziale di sviluppo quando è possibile solo la raccolta di campioni di tutto il corpo. Per ridurre l'attività collaterale nel sistema CasRx, sono necessari studi futuri per comprendere appieno i meccanismi alla base del sistema di fenomeni off-target a livello di organismo.
È interessante notare che un recente studio35 che descrive gli strumenti Cas13 che prendono di mira l'RNA nelle mosche sembrava migliorare la tossicità generale associata all'espressione di CasRx, per diverse possibili ragioni. In primo luogo, gli autori hanno ricodificato i transgeni Cas13 per ottimizzare l'espressione in Drosophila e hanno utilizzato un promotore più debolmente espressivo (actina 5C) rispetto al promotore dell'ubiquitina utilizzato nel presente studio, probabilmente portando a livelli più bassi di espressione di Cas13 e quindi meno tossicità. In effetti, questo è supportato dalle osservazioni che l'espressione di CasRx e dCasRx guidata da UASt non era, di per sé, tossica, poiché questo studio (e gli autori in 35) non hanno osservato alcuna letalità evidente nelle mosche UASt-CasRx. Inoltre, questi autori hanno codificato i loro gRNA in modo diverso rispetto a questo studio, il che potrebbe aver influenzato la loro espressione e ridotto la tossicità del sistema nelle mosche transeterozigoti Cas13 / gRNA. Ad esempio, nel loro studio due gRNA sono stati espressi utilizzando il promotore U6: 3 e affiancati da tRNA per consentire l'elaborazione del gRNA alla maturazione del tRNA senza richiedere CasRx35. Al contrario, in questo studio, i gRNA sono stati codificati come array che prendono di mira fino a 4 posizioni per gene e imitano la struttura endogena dell'array Cas13 trovata nei batteri, che richiede l'enzima Cas13 per elaborare ciascun gRNA. Questi diversi approcci possono aver portato a differenze nei livelli di espressione del gRNA e altri fattori che possono avere effetti intrinseci sulla tossicità dell'intero sistema. Infine, Huynh et al. hanno preso di mira geni diversi da quelli presi di mira nel presente studio, che si traducono in differenze nell'interazione bersaglio-Cas / gRNA e nell'attività collaterale e possono avere effetti sui livelli osservati di letalità. Queste differenze nella tossicità osservata giustificano ulteriori indagini per identificare i modi in cui i sistemi complessivi possono essere migliorati.
Nel complesso, questo studio è la prima dimostrazione di un sistema Cas funzionale programmabile programmabile con targeting dell'RNA in D. melanogaster, anche se sarà necessaria un'ulteriore ottimizzazione del sistema CasRx (in linea con quanto riportato35) per ridurre ulteriormente la letalità associata fuori bersaglio e aumentare l'efficacia della scissione CasRx on-target. Il targeting dell'RNA con gli enzimi Cas è un campo in rapida evoluzione con molte potenziali applicazioni che vanno dal controllo degli insetti vettori agli usi terapeutici1,2,3,4,5,6,7, e questo protocollo offre un pacchetto iniziale per chiunque sia interessato a progettare il proprio primo sistema CasRx nelle mosche, pur essendo compatibile con la personalizzazione e l'ulteriore ottimizzazione del sistema. Gli esempi qui presentati dimostrano una serie di risultati che si possono incontrare durante l'implementazione di questo sistema in vivo e possono servire come parametri di riferimento per altri utenti nella valutazione delle prestazioni del sistema CasRx nelle loro applicazioni.
Divulgazioni
O.S.A è uno dei fondatori di Agragene, Inc., ha una partecipazione azionaria e fa parte del comitato consultivo scientifico della società. I termini di questo accordo sono stati rivisti e approvati dall'Università della California, San Diego in conformità con le sue politiche di conflitto di interessi. Tutti gli altri autori non dichiarano interessi concorrenti.
Riconoscimenti
Questo lavoro è stato supportato in parte dal finanziamento di una sovvenzione del programma DARPA Safe Genes (HR0011-17-2-0047) e dai premi NIH (R21RAI149161A, DP2AI152071) assegnati a O.S.A.
Materiali
| Name | Company | Catalog Number | Comments |
| 100% Grape Juice | Welch Foods Inc. | N/A | |
| Active Dry Yeast (908g) | Red Star Yeast Company, LLC | N/A | |
| DMC4500 color camera | Leica Microsystems | DMC4500 | |
| Dual-Luciferase Reporter Assay System | Promega | E1910 | |
| GAL4-GMR flies | Bloomington Drosophila Stock Center | 29967 | |
| GAL4-y flies | Bloomington Drosophila Stock Center | 44373 | |
| Glomax 20/20 Luminometer | Promega | E5331 | |
| Illumina HiSeq2500 Sequencer | Illumina, Inc. | HiSeq2500 | |
| M165FC fluorescent stereomicroscope | Leica Microsystems | M165FC | |
| Nanodrop OneC UV-vis spectrophotometer | ThermoFisher | NDONEC-W | |
| NEBNext Ultra II RNA Library Prep Kit | New England Biolabs, Inc. | E7770 | |
| plasmid # 112686 | Addgene | 112686 | |
| plasmid # 112688 | Addgene | 112688 | |
| plasmid # 132416 | Addgene | 132416 | |
| plasmid # 132417 | Addgene | 132417 | |
| plasmid # 132419 | Addgene | 132419 | |
| plasmid # 132420 | Addgene | 132420 | |
| plasmid # 132421 | Addgene | 132421 | |
| plasmid # 132422 | Addgene | 132422 | |
| plasmid # 132425 | Addgene | 132425 | |
| plasmid # 132426 | Addgene | 132426 | |
| plasmid # 133304 | Addgene | 133304 | |
| plasmid # 164586 | Addgene | 164586 | |
| plasmid #132418 | Addgene | 132418 | |
| plasmid pJFRC81 | Addgene | 36432 | |
| Qiagen RNeasy Mini Kit | Qiagen | 74104 | |
| Restriction endonucleases AscI | New England Biolabs Inc. | R0558L | |
| Restriction endonucleases NotI | New England Biolabs Inc. | R0189L | |
| Restriction endonucleases PacI | New England Biolabs Inc. | R0547L | |
| Restriction endonucleases PstI | New England Biolabs Inc. | R0140L | |
| Restriction endonucleases SwaI | New England Biolabs Inc. | R0604L | |
| Restriction endonucleases XbaI | New England Biolabs Inc. | R0145L | |
| RNA 6000 Pico Kit for Bioanalyzer | Agilent Technologies | 5067-1513 | |
| Turbo DNase | Invitrogen | AM2238 | |
| U6-3:4-gRNA-Fluc flies | Bloomington Drosophila Stock Center | 84125 | |
| U6-3:4-gRNA-GFP; OpIE2-GFP flies | Bloomington Drosophila Stock Center | 84986 | |
| U6-3:4-gRNA-N flies | Bloomington Drosophila Stock Center | 84122 | |
| U6-3:4-gRNA-w flies | Bloomington Drosophila Stock Center | 84124 | |
| U6-3:4-gRNA-y flies | Bloomington Drosophila Stock Center | 84123 | |
| UASt-CasRx flies | Bloomington Drosophila Stock Center | 84121 | |
| UASt-dCasRx flies | Bloomington Drosophila Stock Center | 84120 | |
| Ubiq-CasRx flies | Bloomington Drosophila Stock Center | 84118 | |
| Ubiq-dCasRx flies | Bloomington Drosophila Stock Center | 84119 | |
| Ubiq-Firefly-T2A-eGFP-Ubiq-Renilla flies | Bloomington Drosophila Stock Center | 84127 | |
| Zymoclean Gel DNA Recovery Kits | Zymo Research Corporation | D4007 |
Riferimenti
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nat Communications. 9, 1911 (2018).
- Abudayyeh, O., et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. 353 (6299), 5573 (2016).
- East-Seletsky, A., O'Connell, M., Burstein, D., Knott, G., Doudna, J. RNA Targeting by Functionally Orthogonal Type VI-A CRISPR-Cas Enzymes. Molecular Cell. 66 (3), 373-383 (2017).
- Konermann, S., Lotfy, P., Brideau, N., Oki, J., Shokhirev, M., Hsu, P. Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors. Cell. 173 (3), 665-676 (2018).
- Buchman, A., Brogan, D., Sun, R., Yang, T., Hsu, P., Akbari, O. Programmable RNA Targeting Using CasRx in Flies. The CRISPR Journal. 3 (3), 164-176 (2020).
- Kushawah, G., et al. CRISPR-Cas13d Induces Efficient mRNA Knockdown in Animal Embryos. Developmental Cell. 54 (6), 805-817 (2020).
- Abudayyeh, O., et al. RNA targeting with CRISPR-Cas13. Nature. 550, 280-284 (2017).
- Perrimon, N., Ni, J., Perkins, L. In vivo RNAi: today and tomorrow. Cold Spring Harbor Perspectives in Biology. 2, 003640 (2010).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448, 151-156 (2007).
- Ni, J., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Ni, J., et al. A genome-scale shRNA resource for transgenic RNAi in Drosophila. Nature Methods. 8, 405-407 (2011).
- Ni, J., et al. Vector and parameters for targeted transgenic RNA interference in Drosophila melanogaster. Nature Methods. 5, 49-51 (2008).
- Heigwer, F., Port, F., Boutros, M. RNA Interference (RNAi) Screening in Drosophila. Genetics. 208 (3), 853-874 (2018).
- Kulkarni, M., et al. Evidence of off-target effects associated with long dsRNAs in Drosophila melanogaster cell-based assays. Nature Methods. 3, 833-838 (2006).
- Ma, Y., Creanga, A., Lum, L., Beachy, P. Prevalence of off-target effects in Drosophila RNA interference screens. Nature. 443, 359-363 (2006).
- Perrimon, N., Mathey-Prevot, B. Matter arising: off-targets and genome-scale RNAi screens in Drosophila. Fly. 1 (1), 1-5 (2007).
- Markstein, M., Pitsouli, C., Villalta, C., Celniker, S., Perrimon, N. Exploiting position effects and the gypsy retrovirus insulator to engineer precisely expressed transgenes. Nature Genetics. 40, 476-483 (2008).
- Champer, J., Buchman, A., Akbari, O. Cheating evolution: engineering gene drives to manipulate the fate of wild populations. Nature Review Genetics. 17 (3), 146-159 (2016).
- Buchman, A., et al. Broad dengue neutralization in mosquitoes expressing an engineered antibody. PLoS Pathogens. 16 (4), 1008103 (2020).
- Mathur, G., Sanchez-Vargas, I., Alvarez, D., Olson, K., Marinotti, O., James, A. Transgene-mediated suppression of dengue viruses in the salivary glands of the yellow fever mosquito, Aedes aegypti. Insect Molecular Biology. 19 (6), 753-763 (2011).
- Franz, A., et al. Engineering RNA interference-based resistance to dengue virus type 2 in genetically modified Aedes aegypti. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4198-4203 (2006).
- Yen, P., James, A., Li, J., Chen, C., Failloux, A. Synthetic miRNAs induce dual arboviral-resistance phenotypes in the vector mosquito Aedes aegypti. Communications Biology. 1, 11 (2018).
- Buchman, A., et al. Engineered resistance to Zika virus in transgenic Aedes aegypti expressing a polycistronic cluster of synthetic small RNAs. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3656-3661 (2019).
- . Addgene Available from: https://www.addgene.org/protocols/restriction-digest/ (2020)
- Gibson, D., Young, L., Chuang, R., Venter, J., Hutchison, C., Smith, H. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- . Addgene Available from: https://www.addgene.org/protocols/pcr/ (2020)
- . Indiana University Bloomington Available from: https://bdsc.indiana.edu/information/recipes/bloomfood.htmL (2020)
- Dobin, A., et al. STAR:ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Jiang, W., Brueggeman, A., Horken, K., Plucinak, T., Weeks, D. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryotic Cell. 13 (11), 1465-1469 (2014).
- Poe, A., et al. Robust CRISPR/Cas9-Mediated Tissue-Specific mutagenesis reveals gene redundancy and perdurance in Drosophila. Genetics. 211 (2), 459-472 (2019).
- Port, F., Chen, H., Lee, T., Bullock, S. Optimized CRISPR/Cas tools for efficient ger mLine and somatic genome engineering in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (29), 2967-2976 (2014).
- Yang, S., Li, S., Li, X. Shortening the Half-Life of Cas9 maintains its gene editing ability and reduces neuronal toxicity. Cell Reports. 25 (10), 2653-2659 (2018).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. eLife. 9, 53865 (2020).
- Zhang, X., Tee, L., Wang, X., Huang, Q., Yang, S. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy - Nucleic Acids. 4 (17), 264 (2015).
- Huynh, N., Depner, N., Larson, R., King-Jones, K. A versatile toolkit for CRISPR-Cas13-based RNA manipulation in Drosophila. Genome Biology. 21, 279 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon