Method Article
CRISPR/CasRx kullanarak Drosophila Melanogaster'da Her Yerde ve Dokuya Özgü RNA Hedeflemesi
Bu Makalede
Özet
Bu makalede, sineklerde RNA hedefleme cas13d enzimini (RfxCas13D) kullanmak için ayrıntılı bir protokol özetlenmiştir.
Özet
RNA hedeflemeli Cas13 ailesinin bir üyesi olan CasRx, crispr/cas teknolojilerinin hem hücresel hem de organizma düzeyinde çekici bir hedef dışı profille verimli gen transkript azaltmada umut verici yeni bir ilavesi. Yakın zamanda CRISPR/CasRx sisteminin Drosophila melanogaster'da her yerde bulunan ve dokuya özgü gen transkriptinde azalma sağlamak için kullanılabileceği bildiriliyor. Bu makale, üç bölümden oluşan son çalışmadan yöntemleri detaylandırıyor: 1) iki bileşenli casrx sistemi kullanarak her yerde bulunan in vivo endojen RNA hedeflemesi; 2) üç bileşenli CasRx sistemi kullanarak her yerde bulunan in vivo eksojen RNA hedeflemesi; ve 3) üç bileşenli CasRx sistemi kullanılarak dokuya özgü in vivo RNA hedeflemesi. Gözlenen RNA hedeflemesinin etkileri arasında hedefe yönelik gen spesifik fenotipik değişiklikler, hedeflenen RNA transkript azaltma ve CasRx proteininin yüksek ekspresyumu ve kollateral aktivite ile ilişkili zaman zaman ölümcüllük fenotipleri sayıldı. Genel olarak, bu sonuçlar CasRx sisteminin organizma düzeyinde RNA transkript azaltmayı programlanabilir ve verimli bir şekilde hedefleyebildiğini, in vivo transkriptom hedeflemenin ve mühendisliğin mümkün olduğunu ve vivo CRISPR tabanlı RNA hedefleme teknolojilerinde geleceğin temelini atabileceğini göstermiştir.
Giriş
Kümelenmiş Düzenli Aralıklı Kısa Palindromiyal Tekrarlar (CRISPR) teknolojilerinin ortaya çıkmasından bu yana, bu alandaki odak noktasının çoğu tıp ve biyoteknolojide dönüştürücü uygulamalar sunan DNA düzenleme üzerine olmuştur1. Bununla birlikte, DNA dizilerinin kalıcı olarak değiştirilmesi, etik hususlar nedeniyle her zaman istenmez. Bunun ışığında, son çalışmalar RNA'yı hedeflemek için CRISPR tabanlı araçlar geliştirmeye başladı ve CRISPR teknolojilerinin çeşitli biyolojik sistemlerde RNA hedeflemesi için gerçekten kullanılabileceğini gösterdi2,3,4,5,6,7. Test edilen bu sistemlerin çoğunda, RNA ve transkript azaltmayı hedeflemek için yaygın olarak kullanılan mevcut yaklaşım, mükemmel olmaktan uzak olan, genellikle vivo8,9,10,11,12,13,14,15,16,17'de kullanıldığında çeşitli etkinlik ve yüksek hedef dışı aktivite sergileyen RNA parazitidir (RNAi) . Bu nedenle, bu teknolojilerin durumu göz önüne alındığında, RNA hedeflemesi için CRISPR tabanlı araçların potansiyellerini daha fazla araştırmaya değer.
Son zamanlarda yapılan önemli bir çalışmada, Cas13d sınıfının bir üyesi olan ribonükleaz CasRx'in insan hücre kültüründeki gen transkript seviyelerini verimli bir şekilde azaltabileceği ve çekici bir hedef dışı profile sahip olduğu bildirilmiştir4. Bu bulgu, bu yeni ribonikleazın organizma düzeyinde RNA hedeflemesi için etkinliğini ve düşük hedef dışı oranını koruyup koruyamayacağı sorusuna yol açtı. Yeni bir çalışma, CasRx sisteminin Drosophila melanogaster5'te her yerde bulunan ve dokuya özgü gen transkriptini azaltmayı sağlamak için kullanılabileceğini göstererek bu soruyu ele haline geldi.
Yakın zamanda yayınlanan bu yaklaşımın kullanılabilirliğini kolaylaştırmak için, bu protokol üç ana bölümden oluşan bu son çalışmadan yöntemleri detaylandırıyor: 1) iki bileşenli bir CasRx sistemi kullanarak her yerde bulunan in vivo RNA hedeflemesi; 2) üç bileşenli CasRx sistemi kullanarak her yerde bulunan in vivo eksojen RNA hedeflemesi; ve 3) üç bileşenli CasRx sistemi kullanılarak doku spesifikin vivo RNA hedeflemesi.
Her yerde bulunan bir organizatörün kontrolü altındaki farklı hedef genleri hedefleyen kılavuz RNA'lar (gRNA) tasarlanmış ve bu gRNA içeren yapıları ifade eden sinek hatları oluşturulmuştır. Her yerde bulunan bir promotörün veya GAL4 transkripsiyon faktörü tarafından etkinleştirilebilen koşullu bir yukarı akış aktivasyon dizisi (UASt) promotörünün kontrolü altındaki CasRx yapıları da tasarlanmış ve bu CasRx içeren yapıları barındıran uçucu hatlar oluşturulmuştır. Katalitik olarak etkin olmayan CasRx yapıları, dCasRx, negatif kontroller olarak tasarlanmış ve kullanılmıştır. Sineklerde her yerde bulunan RNA hedeflemesi, gRNA ekspresyöz sinek hatlarını her yerde bulunan CasRx ifade eden sinek hatları ile geçerek elde edilir. Hem belirli bir gen transkriptini hedefleyen gRNA yapısını hem de CasRx proteinini ifade eden soy, hedeflenen gen transkriptlerinde her yerde bir azalmaya sahiptir. Sineklerde dokuya özgü RNA hedeflemesi, gRNA eksprese eden sinekleri ilk olarak UASt-CasRx eksprese eden sineklerle geçerek, hem gRNA hem de UASt-CasRx yapılarını taşıyan transheterozygöz sinekler elde ederek elde edilir. Bu tür sinekler dokuya özgü GAL4 ekspresyon sinekleri ile geçilir, bu da dokuya özgü CasRx ekspresyonunun üretilmesine ve sineklerde RNA hedeflemesine neden edilir.
CasRx sisteminin programlanabilir doğası, in vivo RNA hedeflemesi için yüksek etkinlik ve düşük hedef dışı etkinlik elde etmeye yardımcı olmak için özelleştirme ve optimizasyon imkanı sunar. CRISPR tabanlı RNA hedeflemesinin potansiyel uygulamaları, laboratuvarda RNAi'nin değiştirilmesi ve vahşi doğada böcek vektör kontrolüne katkıda bulunmak da dahil olmak üzere çok sayıdadır. İkincisi, karşılanmamış küresel ihtiyaçlardan biri, sivrisinekler yoluyla bulaşan RNA virüslerinin enfeksiyonlarıyla mücadele etmek için etkili araçların geliştirilmesidir. Dang humması, Zika ve chikungunya virüsü gibi birçok RNA virüsü sivrisinekler yoluyla bulaşır, insan sağlığını etkiler ve mortaliteye katkıda girer. Hastalığın önlenmesi için virüs direnci olan sivrisinek popülasyonlarının mühendisliği için birçok öneride bulunulmuştır; bununla birlikte, hiçbir mevcut teknoloji sivrisinekleri aynı anda tüm önemli RNA virüslerine karşı dirençli hale getiremez18,19,20,21,22,23. RNA hedefleme Cas sistemleri, sivrisinek kaynaklı tüm RNA virüslerini hedeflemek için programlanabilir bir platform sağlayarak böyle bir teknoloji için bir başlangıç noktası sağlayabilir.
Protokol
1. İki Bileşenli CasRx Sistemi Kullanarak Her Yerde Bulunan In vivo RNA Hedeflemesi
- Ubiq-CasRx ve Ubiq-dCasRx ifade vektörü oluşturma
- CasRx dizisini astar 1050E ile bir polimeraz zincir reaksiyonu (PCR) kullanarak güçlendirin. C3 ve 1050E. C4 ve orijinal CasRx yapısı pNLS-RfxCas13d-NLS-HA (pCasRx); ve astar 1050E ile PCR kullanarak dCasRx sırasını güçlendirin. C3 ve 1050E. C4 ve özgün dCasRx yapısı pNLS-dRfxCas13d-NLS-HA (pdCasRx)4 (Tablo 1). Jel saflaştırma kiti kullanarak güçlendirilmiş CasRx ve dCasRx parçalarını daha sonra jel saflaştırın.
- SVA ve PacI24 kısıtlama enzimleri ile baz vektörü (Addgene plazmid #112686) sindirin. Elde edilen ürünlerde, temel vektör omurgası olarak adlandırılan daha büyük parçayı jel-saflaştırmak için bir kit kullanın.
- Gibson montaj yöntemini kullanarak Ubiq-CasRx vektörünü temel vektör omurgası ve CasRx parçası ile birleştirin; Gibson montaj yöntemini kullanarak Ubiq-dCasRx vektörü temel vektör omurgası ve dCasRx parçası ile birleştirin25.
NOT: Ubiq-CasRx vektörün (OA-1050E) Addgene Kimliği #132416 ve Ubiq-dCasRx vektörün (OA-1050R) Addgene Kimliği #132417' dir.
- gRNA ifade vektörü oluşturma
- Her gRNA parçasını aşağıdaki kriterlere göre tasarlayın: hedef sıra 30 nükleotid uzunluğundadır; poly-U'nun maksimal uzunluğu hedef sırayla 4 baz çifti olarak uzanır; hedef sıra GC içeriği% 30 -% 70 aralığındadır; güçlü RNA saç tokası yapıları oluşturmayacağı tahmin edilen hedef dizi; ve minimum tahmin edilen RNA ikincil veya üçüncül yapı içeren hedef sıra5.
NOT: Bu çalışma her gRNA'yı her biri 30 nükleotid uzunluğunda, 36 nükleotid uzunluğunda doğrudan tekrarlarla aralıklı ve her iki ucunda 7 timin sonlandırıcısı olan 4 tandem dizisi olarak tasarladı5. Eksojen hedef gen olan GFP için, opie2-GFP parçasının eklenmesiyle yukarıdaki kriterlerin aynısı takip edildi5. - 1043.C1 ve 1043.C23 primer'ları ve Addgene plazmid #112688 (Tablo 1)26 ile PCR kullanarak U6:3 promotör sırasını güçlendirin. Jel saflaştırma kiti kullanarak güçlendirilmiş U6:3 parçalarını jelle arındırın.
- Addgene plazmid #112688 kısıtlama enzimi AscI ve XbaI24 ile sindirin. Elde edilen ürünlerde, taban öncesi vektör omurgası olarak adlandırılan daha büyük parçaları jel arındırmak için bir kit kullanın.
- Gibson montaj yöntemini kullanarak taban vektörü, taban öncesi vektör omurgası ve U6:3 parçası ile birleştirin25. Bundan sonraki temel vektör OA-1043 olarak adlandırılır.
NOT: Plazmid OA-1043'ün Addgene Kimliği #164586. - Dış gen sentezi hizmetini kullanarak hedef genin gRNA parçasını sentezle.
- PstI ve NotI24 kısıtlama enzimi ile temel vektör OA-1043 sindirin. Sindirilmiş OA-1043 adı verilen tüm sindirim ürününü saklayın.
- GRNA ifade vektörü sindirilmiş OA-1043 ile birleştirin ve Gibson montaj yöntemini kullanarak gen gRNA parçasını hedefle25.
NOT: Dört hedef gen incelendi: üçü endojen (beyaz, Çentik, sarı), biri eksojen (GFP). Addgene kimlikleri şunlardır: #132420 (gRNAw), #132421(gRNAN), #132425 (gRNAy) ve #133304 (gRNAGFP).
- Her gRNA parçasını aşağıdaki kriterlere göre tasarlayın: hedef sıra 30 nükleotid uzunluğundadır; poly-U'nun maksimal uzunluğu hedef sırayla 4 baz çifti olarak uzanır; hedef sıra GC içeriği% 30 -% 70 aralığındadır; güçlü RNA saç tokası yapıları oluşturmayacağı tahmin edilen hedef dizi; ve minimum tahmin edilen RNA ikincil veya üçüncül yapı içeren hedef sıra5.
- Transgenik sinekler üretmek
- Dış sinek embriyo enjeksiyonu hizmetini kullanarak sinek embriyolarına ve ØC31 entegrasyon alanlarını içeren sineklerden embriyolara ekspresyon vektörleri enjekte edin. Enjekte edilen embriyoları 26 °C'de arkala.
NOT: CasRx hatları oluşturmak için attp40w (2. kromozom üzerinde entegrasyon sahaları ile) hattı, çeşitli gRNA hatları oluşturmak için ise 8622 (3. kromozom üzerinde entegrasyon sahaları ile) hattı kullanılmıştır. - Sinekleri homozigous çizgiler veya dengeli heterozipöz çizgiler olarak tutun.
NOT: Ubiq-CasRx ve Ubiq-dCasRx sinekleri, dengeleyici olarak CyO ile heterozygous dengeli hatlar olarak tutuldu. Ek olarak, hem Ubiq-CasRx hem de Ubiq-dCasRx vektörleri bir dsRed işaretleyici içerir. Sonuç olarak, Ubiq-CasRx ve Ubiq-dCasRx sinekleri aşağıdaki üç fenotipe sahiptir: dsRed-pozitif, kıvırcık kanatlar ve beyaz gözler. GRNA'yı ifade eden sinekler homozigot çizgiler olarak tutuldu. Onların Bloomington Drosophila Stok Merkezi (BDSC) sinek stok numaraları şunlardır: #84118 (Ubiq-CasRx), #84119 (Ubiq-dCasRx), #84124 (gRNAw), #84122 (gRNAN), #84123 (gRNAy), #84986 (gRNAGFP).
- Dış sinek embriyo enjeksiyonu hizmetini kullanarak sinek embriyolarına ve ØC31 entegrasyon alanlarını içeren sineklerden embriyolara ekspresyon vektörleri enjekte edin. Enjekte edilen embriyoları 26 °C'de arkala.
- Sinek genetiği (Şekil 1A)
- Homozigot gRNA hattından 10 bakire yetişkin dişi sinek toplayın ve dengeli heterozipöz Ubiq-CasRx / CyO hattından 5 yetişkin erkek sinek toplayın. Toplanan dişi ve erkek sinekleri, ebeveyn sinekleri olarak adlandırılan kuru maya tozu ile desteklenmiş bir şişeye koyun (Şekil 1A).
- 3 çoğaltma oluşturmak için önceki adımı 3 kez yineleyin. Kontrol grubu için, diğer her şeyi aynı tutarken Ubiq-dCasRx/CyO hattını kullanın.
NOT: Normal bir cam şişe yiyecek için 0,1 g kuru maya tozu yeterlidir. BDSC'nin sinek yemeği tarifi kullanılır. - Ebeveyn sineklerini içeren şişeleri 48 saat boyunca 26 °C'de arkala. Sonra her şişeden tüm ebeveyn sineklerini çıkarın. Daha sonra şişeleri en az 20 gün boyunca 26 °C'de tutun.
- F1 kuşağının pupalarından yeni yetişkin soylarının çıkıp çıkmadığını görmek için her gün şişeleri gözlemleyin. Öyleyse, sinek şişelerinin içine bir karbondioksit tankına bağlı bir tüp yerleştirerek ve ardından akış anahtarını 10 saniye açarak karbondioksit ile uyuşturun.
- Sinekler hareketsiz hale geldikten sonra, şişeden karbondioksit tankına da bağlı olan bir sineklik üzerine boşaltın ve karbondioksit sürekli olarak sineklik boyunca akar.
- Uyuşturulmış sineklerin fenotipini puanlayın ve floresan stereomikroskopa bağlı renkli kamera kullanarak görüntüleyin. Farklı fenotiplere sahip soyların sayısını sayın. Görüntü sonrası işleme ve derleme için görüntü işleme yazılımını kullanın (Şekil 2A - 2D).
NOT: Mendelian genetiğine dayanarak, her haç için soylar arasında iki tür sinek beklenir (Şekil 1A).
- RNA-Seq (Şekil 2E – 2G)
- Örnek toplama
NOT: Aşağıdaki 3 örnekten uygun bir örnek toplama yöntemi seçin; Her farklı örnek türü için 3 çoğaltma gereklidir.- Yetişkin sinek başı örnek toplama
- Homozigot gRNA hattından 10 bakire yetişkin dişi sinek toplayın. Dengeli heterozygous Ubiq-CasRx / CyO hattından 5 yetişkin erkek sinek toplayın. Toplanan dişi ve erkek sinekleri, ebeveyn sinekleri olan kuru maya tozu ile desteklenmiş bir şişeye koyun.
- Önceki adımı 3 çoğaltma için 3 kez yineleyin. Kontrol grubu için, diğer her şeyi aynı tutarken Ubiq-dCasRx/CyO hattını kullanın.
- Ebeveyn sineklerini içeren şişeleri 48 saat boyunca 26 °C'de arkala. Sonra her şişeden tüm ebeveyn sineklerini çıkarın. Daha sonra şişeleri pupalardan soylar çıkana kadar 26 °C'de tutun.
- Doğru fenotip ile 10 1 günlük yetişkin sinekleri toplayın. Sinekleri karbondioksitle uyuşturun, sonra sinek kafasını kesin ve kafaları kuru buz üzerinde 1,5 mL santrifüj tüpüne koyun. Santrifüj tüpünü -80 °C'de saklayın. Bu adımı 3 çoğaltma için 3 kez yineleyin.
- 17 – 20 saatlik embriyo örnek toplama
- Homozigot gRNA hattından 8-10 bakire yetişkin dişi sinek toplayın. Dengeli heterozygous Ubiq-CasRx / CyO hattından 4-5 yetişkin erkek sinek toplayın. Toplanan dişi ve erkek sinekleri, ebeveyn sinekleri olan kuru maya tozu ile desteklenmiş bir şişeye koyun.
- Önceki adımı 3 çoğaltma için 3 kez yineleyin. Kontrol grubu için, diğer her şeyi aynı tutarken Ubiq-dCasRx/CyO hattını kullanın.
- Ebeveyn sineklerini içeren şişeleri 48 saat boyunca 26 °C'de arkala.
- Bu tarifi takip eden her çoğaltma için bir üzüm suyu embriyo toplama odası hazırlayın: 376 mL su, 126 mL üzüm suyu, 15 g agar ve 6 g sakkaroz. Kabarcıkların / köpüğün görünip görünmediğine bakmak için beherdeki medyayı yakından takip ederken medyayı 1 L behere koyun ve 5-6 dakika boyunca mikrodalgaya koyun. Öyleyse, mikrodalgayı durdurun ve kabarcık / köpüğün yerleşmesine izin verin. Kabarcık netleşene kadar mikrowaving'e bu şekilde devam edin. Tüm kabarcıklar temizlenine kadar döndürmeyin. Son olarak, 10 mL% 100 alkol ve 5 mL asetik asit ekleyin. İyice karıştırın, ardından medyayı 25 mL serolojik pipet ile 35 mm Petri kaplarına borulayın. Petri kabında ortam katılaştığında kullanıma hazırdır.
- 48 saatlik kuluçkanın sonunda, ebeveyn sineklerini üzüm suyu embriyo toplama odalarına aktarın ve 3 saat boyunca 26 ° C'de kuluçkaya yatırın. Daha sonra taze döşenen embriyoları üzüm suyu tabaklarında 26 ° C'de 17 saat daha tutarken yetişkin sinekleri çıkarın.
- Kuluçkadan sonra, üzüm suyu plakalarından 50 - 100 embriyoyu toplayın, deiyonize suya batırarak embriyo yüzeyini temizleyin, ardından buz üzerinde 1,5 mL santrifüj tüpüne aktarın. -80 °C'de saklayın. Bu adımı 3 çoğaltma için 3 kez yineleyin.
- İlk instar larva örnek toplama
- Homozigot gRNA hattından 8-10 bakire yetişkin dişi sinek toplayın. Dengeli heterozygous Ubiq-CasRx / CyO hattından 4-5 yetişkin erkek sinek toplayın. Toplanan dişi ve erkek sinekleri, ebeveyn sinekleri olan kuru maya tozu ile desteklenmiş bir şişeye koyun. Bu adımı 3 çoğaltma için 3 kez yineleyin. Kontrol grubu için, diğer her şeyi aynı tutarken Ubiq-dCasRx/CyO hattını kullanın.
- Ebeveyn sineklerini içeren şişeleri 48 saat boyunca 26 °C'de arkala. Daha sonra yetişkin sinekleri 26 ° C'de gece kuluçkası (16 saat) için başka bir yeni normal gıda şişesine aktarın. Sonra, yetişkin sinekleri çıkarın.
- Embriyo içeren şişeyi 24 saat boyunca 26 °C'de tutun, ardından transheterozygöz ilk instar larvalarını temel alınan farklı belirteçler kullanarak mikroskop altında puanlayın. Doğru fenotiplere sahip 15-30 larva toplayın ve bunları 1,5 mL santrifüj tüpüne koyun ve -80 ° C'de saklayın. Bu adımı 3 çoğaltma için 3 kez yineleyin.
- Yetişkin sinek başı örnek toplama
- Sıralama
- RNA ekstraksiyonu: piyasada bulunan bir RNA ekstraksiyon kiti kullanın ve tüm örnekleri işlemek için kitin talimatını izleyin. Daha sonra, çıkarılan RNA örneklerini ticari olarak mevcut deoksiribonükleaz ile kuluçkaya yatırın ve numunelerden kontamine DNA'ları çıkarmak için talimatını izleyin.
- Piyasada bulunan UV-vis spektrofotometreyi kullanarak RNA konsantrasyonunu ölçün. Ticari olarak kullanılabilen RNA bütünlük tahlil kurulumunu kullanarak numunelerde RNA bütünlüğünü ölçün.
- Piyasada bulunan RNA kitaplık hazırlama kitini kullanarak RNA-seq kitaplıklarını oluşturun.
- Kitaplık sıralama için aşağıdaki ayarlarla dış sıralama hizmetini kullanın: tek okuma modu; okuma uzunluğu: 50nt, derinlik: Kütüphane başına 20 milyon okuma. RTA 1.18.64 ile temel aramalar gerçekleştirin ve bcl2fastq 1.8.4 kullanarak verileri FASTQ'ya dönüştürün.
NOT: Ham sıralama verileri Ulusal Biyoteknoloji Bilgi Sıralama Okuma Arşivi Merkezi'nde bulunabilir (gönderim kimliği: SUB6818910 [BioProject: PRJNA600654]).
- Biyoinformatik
- Harita, berkeley Drosophila Genom Projesi'nden (GenBank katılım numarası: GCA_000001215.4) 6 Drosophila melanogaster genomunu ve STAR aligner28'in varsayılan parametre ayarını kullanarak eksojen CasRx ve GFP dizilerini "-outFilterType BySJout" filtre seçeneği ve "-sjdbGTFfile Drosophila_melanogaster. BDGP6.22.97.gtf" gen transfer formatı dosyası ENSEMBL'den.
- "-t exon -g gene_id -M -O --fraction" seçeneklerini kullanarak Counts35 özelliğiyle açıklamalı her transkript için ham transkript sayılarını belirleyin. Ardından, "addTpmFpkmToFeatureCounts.pl" Perl komut dosyasını kullanarak toplam transkript sayılarını kullanarak ham transkript sayılarını normalleştirin.
- Her genin transkriptlerinin logaritmik kat değişimini (LFC) tahmin etmek için DESeq2 işlem hattındaki orijinal büzülme tahmincisi ile maksimum posteriori yöntemini kullanın.
- Örnek toplama
2. Üç Bileşenli CasRx Sistemi Kullanılarak Her Yerde Bulunan In vivo Eksojen RNA Hedeflemesi
- Eksojen hedef her yerde bulunan ifade vektörü oluşturma
- PCR, primers 1052B kullanarak Ubiq promotör parçasını güçlendirin. C1 ve 1052B. C2 ve Addgene plazmid #112686 26. Ardından PCR, Addgene plazmid #112686'dan yükseltilmiş T2A-eGFP parçasını 908A.1 ve 908A.2 (Tablo 1)26 astarlarıyla güçlendirin. Ardından PCR, Addgene plasmid #112686'ı 908A.3 ve 908A.4 (Tablo 1)26 ile kullanarak Ubiq promotör parçasını ters sıra olarak yükseltin. Jel arındırma kiti kullanarak Ubiq promotör parçasını, T2A-eGFP parçasını ve ters Ubiq promotör parçasını saflaştırın.
- Özel bir ateş böceği luciferase kodlama dizisi ve p10 3'UTR parçası, ters renilla luciferaz ve ardından bir SV40 3'UTR parçası içeren özel bir parça sipariş edin.
- Addgene plazmid #112688 kısıtlama enzimi AscI ve XbaI24 ile sindirin. Elde edilen ürünlerde, temel vektör omurgası olarak adlandırılan jel arıtma kiti kullanarak daha büyük parçaları jel-saflaştırın.
- Temel vektör omurgası ve aşağıdaki parçalarla temel vektörü birleştirmek için Gibson montaj yöntemini kullanın: Ubiq promotör parçası, T2A-eGFP parçası, ters Ubiq promotör parçası, ateş böceği luciferaz kodlama dizisi ve ters renilla luciferase ve ardından bir SV40 3'UTR parçası25.
NOT: Elde edilen çift luciferaz ifade vektörün (OA-1052B) Addgene kimliği #132426' dir.
- gRNA ifade vektörü oluşturma
- PCR, 1043.C1 ve 1043.C23 primer'ları ve Addgene plazmid #112688 (Tablo 1)26 kullanarak U6:3 promotör dizisini güçlendirin. Jel saflaştırma kiti kullanarak güçlendirilmiş U6:3 parçalarını jelle arındırın.
- Addgene plazmid #112688 kısıtlama enzimi AscI ve XbaI24 ile sindirin. Elde edilen ürünlerde, jel saflaştırma kiti kullanarak, taban öncesi vektör omurgası olarak adlandırılan daha büyük parçaları jel-saflaştırın.
- Gibson montaj yöntemini kullanarak taban vektörü, taban öncesi vektör omurgası ve U6:3 parçası ile birleştirin25. Bundan sonraki temel vektör OA-1043 olarak adlandırılır.
- Dış gen sentezi hizmetini kullanarak hedef genin gRNA parçasını sentezle.
- PstI ve NotI24 kısıtlama enzimi ile temel vektör OA-1043 sindirin. Sindirilmiş OA-1043 olarak adlandırılan tüm sindirim ürününü saklayın.
- GRNA ifade vektörü sindirilmiş OA-1043 ile birleştirin ve Gibson montaj yöntemini kullanarak gen gRNA parçasını hedefle25.
NOT: Elde edilen plazmid 'in (OA-1052K) Addgene kimliği #132422' dir.
- Transgenik sinekler üretmek
- 3. kromozom, BDSC sinek stok numarası 9744'te ØC31 entegrasyon bölgesini içeren sineklerden elde edilen embriyoları kullanarak, dış sinek embriyo enjeksiyon hizmeti yoluyla sinek embriyolarına OA-1052B vektörü enjekte edin. Benzer şekilde, 3. kromozom, BDSC sinek stok numarası 8622 olan ØC31 entegrasyon bölgesini içeren sineklerden embriyoları kullanarak sinek embriyolarına OA-1052K vektör enjekte edin. Enjekte edilen embriyoları 26 °C'de arkala.
- Çift luciferaz ifade eden sinekleri ve gRNA'yı homozygous çizgiler olarak uçurun; Bölüm 1'de oluşturulan tek dengeli heterozipöz Ubiq-CasRx hattını anız (Stb) işaretleyicili TM6 dengeleyici kromozomu taşıyan dengeleyici hatlara geçerek Ubiq-CasRx çizgilerini çift dengeli heterozipöz çizgiler olarak tutun ve sadece beyaz gözlü çift dengeli soyları koruyun, kıvırcık kanatlar ve aynı anda dsRed-floresan fenotipler.
NOT: BDSC sinek stok numaraları şunlardır: #84127 (Ubiq-Fluc-Rluc), #84125 (gRNAFluc).
- Sinek Genetiği (Şekil 1B ve Şekil 3A)
- Çift luciferaz ifade hattından 8-10 bakire yetişkin dişi sinek toplayın. Dengeli heterozygous Ubiq-CasRx / CyO'dan 4-5 yetişkin erkek sinek toplayın; +/TM6, aynı anda beyaz gözlü, kıvırcık kanatlar ve dsRed floresan gösteren Stb çizgisi. Toplanan dişi ve erkek sinekleri, ebeveyn sinekleri olan kuru maya tozu ile desteklenmiş bir şişeye koyun (bundan böyle Adım 1 Haç olarak adlandırılır).
- Önceki adımı 3 çoğaltma için 3 kez yineleyin. Denetim grubu için Ubiq-dCasRx/CyO; +/TM6, Stb hattı ve diğer her şeyi aynı tutar.
- Ebeveyn sineklerini içeren Adım 1 Çapraz şişeleri 48 saat boyunca 26 °C'de arkala. Sonra her şişeden tüm ebeveyn sineklerini çıkarın. Daha sonra şişeleri en az 14 gün boyunca 26 °C'de tutun. Bu süre zarfında, homozigot ateş böceği luciferaz hedefli gRNA hattından 8-10 dişi bakire toplayın. Bu adımı 3 çoğaltma için 3 kez yineleyin.
- Pupalardan yeni bir yetişkin sinek çıkıp çıkmadığını görmek için her gün Adım 1 Çapraz şişelerini gözlemleyin. Öyleyse, onları karbondioksitle uyuşturun, hem Ubiq-CasRx'i (veya Ubiq-dCasRx'i) hem de soylardan çift luciferaz muhabirini ifade eden 5 erkek sinek toplayın ve onları ateş böceği luciferaz hedefleyen gRNA hattından (bundan böyle Adım 2 Çapraz olarak adlandırılır) 10 bakire dişi ile birlikte yeni bir şişeye koyun. Bu adımı 3 çoğaltma için 3 kez yineleyin.
- Adım 1 Çapraz şişelerden hem Ubiq-CasRx 'i (veya Ubiq-dCasRx) hem de çift luciferaz muhabirini ifade eden 5 günlük başka bir erkek toplayın ve 26 °C'de 2 - 4 gün boyunca kuluçkaya yatırın. Ardından, bunları 1,5 mL santrifüj tüpüne aktarın ve -80 ° C'de saklayın. Üç çoğaltma için bu adımı 3 kez yineleyin.
- Ebeveyn sineklerini içeren Adım 2 Çapraz şişeleri 48 saat boyunca 26 °C'de arkala. Sonra her şişeden tüm ebeveyn sineklerini çıkarın. Daha sonra şişeleri en az 20 gün boyunca 26 °C'de tutun.
- Pupalardan yeni yetişkin soyları çıkıp çıkmadığını görmek için her gün Adım 2 Çapraz şişelerini gözlemleyin. Öyleyse, onları karbondioksitle uyuşturun, uyuşturulmuş sineklerin fenotiplerini puanlayın ve floresan stereomikroskopla donatılmış renkli kamera kullanarak görüntüleyin. Farklı fenotiplere sahip soyların sayısını sayın. Görüntü sonrası işleme ve derleme için görüntü işleme yazılımını kullanın (Şekil 3B – 3C).
NOT: Mendelian genetiği, sineklerin hepsi uygulanabilirse, Adım 2 Haç'tan gelen soylar arasında her biri nüfusun% 25'ini oluşturan 4 tür sinek beklendiğini göstermektedir (Şekil 1B ve Şekil 3A).
- Luciferase tahlil (Şekil 3D)
- 2.4.1-2.4.5 adımlarını tekrarlayarak üçlü transheterozygous sineklerinin yanı sıra kontrol sineklerini de üretin. Erkek sinekleri doğumda toplayın ve 3 günlük olana kadar yaşlandırın.
- 3 günlük sinekleri 1,5 mL santrifüj tüplerine aktarın ve bir pestil ve ticari olarak mevcut luciferaz test kitinin luciferaz liziz tamponu kullanarak onları yalım.
- Piyasada bulunan luciferaz test kiti ve armatürometre kullanarak hem ateş böceği hem de renilla luciferaz aktivitesini ölçmek için her numuneden 5 μL lysed doku kullanın.
3. Üç Bileşenli CasRx Sistemi Kullanılarak Dokuya Özgü In vivo RNA Hedefleme
- UASt-CasRx ve UASt-dCasRx İfade Vektörü Oluşturma
- PCR, plazmid pJFRC81 ve primer 1041.C9 ve 1041.C11 primer'ları kullanarak UASt promotör dizisini güçlendirin; daha sonra PCR, plazmid OA-1050E (Addgene ID #132416) ve primer 1050L kullanarak CasRx parçasını yükseltir. C1 ve 1050E. C4; ve ardından PCR, plazmid OA-1050R (Addgene ID #132417) ve primer 1050L kullanarak dCasRx parçalarını güçlendirir. C1 ve 1050E. C4 (Tablo 1)26. Jel arındırma kiti kullanarak güçlendirilmiş UASt promotör dizisi CasRx ve dCasRx parçalarını jelle arındırın.
- Kısıtlama enzimleri NotI ve PacI24 ile temel vektörü (Addgene plazmid #112686) sindirin. Elde edilen ürünlerde, jel saflaştırma kiti kullanarak temel vektör omurgası olarak adlandırılan daha büyük parçayı jel arındırın.
- Gibson derlemesini kullanarak UASt-CasRx vektörünü temel vektör omurgası, UASt promotör sırası ve CasRx parçası ile birleştirin; ardından Gibson montaj yöntemini kullanarak UASt-dCasRx vektörü temel vektör omurgası, UASt promotör sırası ve dCasRx parçası ile birleştirin25.
NOT: UASt-CasRx vektörü Addgene plasmid #132418 ve UASt-dCasRx vektörü Addgene plasmid #132419
- Transgenik sinekler üretmek
- Sinek embriyosu enjeksiyon hizmetini kullanarak sinek embriyolarına UASt-CasRx vektörü ve 2. kromozomlarında ØC31 entegrasyon bölgesi 8621'den embriyolar enjekte edin; daha sonra sinek embriyosu enjeksiyon hizmetini kullanarak sinek embriyolarına UASt-dCasRx vektörü ve 2. kromozomlarında 8621 sinek ØC31 entegrasyon bölgesinden embriyolar enjekte edin. Enjekte edilen embriyoları 26 °C'de arkala.
- CyO ve Sb işaretleyicileri ile sinekleri çift dengeli heterozipöz çizgiler olarak tutun. NOT: BDSC'deki uçucu hatların kimlikleri 84121 (UASt-CasRx) ve 84120 (UASt-dCasRx) şeklindedir.
- Sinek genetiği (Şekil 1C)
- BDSC'den istediğiniz GAL4 satırlarını sipariş edin; 3.2.2 adımından (veya BDSC'den) ilgili gRNA satırlarını edinin.
NOT: BDSC'den aşağıdaki 2 GAL4 sinek kullanıldı: GAL4-GMR (BDSC Kimliği: #29967), GAL4-y (BDSC Kimliği: #44373). İlk bölümde oluşturulan aynı 3 gRNA satırı kullanıldı: gRNAw (BDSC Kimliği: #84124), gRNAN (BDSC Kimliği #84122), gRNAy(BDSC Kimliği: #84123). - GRNA hattından 5-10 bakire yetişkin dişi sinek toplayın. Çift dengeli heterozygous UASt-CasRx / CyO'dan 2-4 yetişkin erkek sinek toplayın; +/TM6, beyaz gözlü, kıvırcık kanatlı ve dsRed floresan gösteren Sb çizgisi aynı anda. Ebeveyn sinekleri olan toplanan dişi ve erkek sinekleri düzenli bir gıda şişesi içine koyun (bundan böyle Adım 1 Haç olarak adlandırılır). Bu adımı 3 çoğaltma için 3 kez yineleyin. Denetim grubu için UASt-dCasRx/CyO kullanın; +/TM6, Sb hattı ve diğer her şey aynıdır.
- Ebeveyn sineklerini içeren Adım 1 Çapraz şişeleri 48 saat boyunca 26 °C'de arkala. Sonra her şişeden tüm ebeveyn sineklerini çıkarın. Daha sonra şişeleri en az 14 gün boyunca 26 °C'de tutun. Bu süre zarfında, GAL4 hattından 5-10 dişi bakire toplayın. Bu adımı 3 çoğaltma için 3 kez yineleyin.
- Pupalardan yeni bir yetişkin sinek çıkıp çıkmadığını görmek için her gün Adım 1 Çapraz şişelerini gözlemleyin. Öyleyse, onları karbondioksitle uyuşturun, aynı anda dsRed-floresan ve anız fenotiplerine sahip soylardan hem UASt-CasRx (veya UASt-dCasRx) hem de gRNA vektörü ifade eden 2-4 erkek sinek toplayın. Adım 1 Cross'tan toplanan erkekleri GAL4 hattından toplanan 5-10 bakire dişi ile birlikte yeni bir şişeye koyun (bundan böyle Adım 2 Haç olarak adlandırılır). Bu adımı 3 çoğaltma için 3 kez yineleyin.
- Ebeveyn sineklerini içeren Adım 2 Çapraz şişeleri 48 saat boyunca 26 °C'de arkala. Sonra her şişeden tüm ebeveyn sineklerini çıkarın. Daha sonra şişeleri en az 20 gün boyunca 26 °C'de tutun.
- Pupalardan yeni bir yetişkin sinek çıkıp çıkmadığını görmek için her gün Adım 2 Çapraz şişelerini gözlemleyin. Öyleyse, onları karbondioksitle uyuşturun, uyuşturulmuş sineklerin fenotiplerini puanlayın ve floresan stereomikroskopla donatılmış renkli kamera kullanarak görüntüleyin. Farklı fenotiplere sahip soyların sayısını sayın. Görüntü sonrası işleme ve derleme için görüntü işleme yazılımını kullanın (Şekil 4).
NOT: Mendelian genetiği, sineklerin tümü uygulanabilirse, Adım 2 Haç'tan gelen soylar arasında her biri nüfusun% 25'ini oluşturan 4 tür sinek beklendiğini göstermektedir (Şekil 1C).
- BDSC'den istediğiniz GAL4 satırlarını sipariş edin; 3.2.2 adımından (veya BDSC'den) ilgili gRNA satırlarını edinin.
Sonuçlar
İki Bileşenli CasRx Sistemi Kullanılarak Her Yerde Bulunan In vivo RNA Hedeflemesi
Hem Ubiq-CasRx hem de gRNA (hem endojen hem de eksojen genleri hedefleyen) yapılarını ifade eden F1 transheterozygous sinekleri, Ubiq-dCasRx ve gRNA yapılarını ifade eden kontrol sineklerine kıyasla belirgin fenotipler göstermiştir (Şekil 2 ve Şekil 4). Özellikle, transheterozipöz CasRx sinekleri, Ubiq-CasRx sisteminin toksisitesini gösteren transtererozgyous dCasRx sineklerine kıyasla önemli ölçüde daha düşük sağkalım oranlarına sahiptir (Şekil 2A ve Şekil 4A). Hem transheterozygous CasRx hem de dCasRx sineklerinin, Mendelian genetiğine dayanarak beklenen oran olan% 50'den daha az kalıtım oranına sahip olduğunu belirtmek gerekir. Üç hedef genden Ubiq-CasRx/+; U6-gRNAN/+ sinekleri ve Ubiq-CasRx/+; U6-gRNAy/+ sinekler canlı değildir (%0 kalıtım) ve ikinci başlangıç larva aşamasının ötesinde büyümedi (Şekil 2A-2B). Hayatta kalan Ubiq-CasRx/+; Kalıtımı %12,9 olan U6-gRNAw/+ sinekleri belirgin bir tam penetrant beyaz gözlü fenotip göstermiştir (Şekil 2B). CasRx ile ilişkili gözlemlenebilir özelliklere ek olarak, 3 hedef gen için hedef gen transkriptlerinde önemli bir azalmayı doğrulayabildik: Çentik, sarı ve GFP (Şekil 2E-2G). Beyaz gen transkriptlerinde azalma Ubiq-CasRx/+, U6-gRNAw/+ sineklerinde, Ubiq-dCasRx/+, U6-gRNAw/+ sinek kontrolüne kıyasla gözlenmiştir, ancak azalma istatistiksel olarak anlamlı değildir (Şekil 2E - 2F). CasRx'in indüklediği hedef dışı aktivitenin kanıtı, CasRx eksprese eden sineklerden alınan örnekler ile dCasRx eksprese eden sineklerden alınan örnekler arasındaki farklı ifade edilen transkriptler karşılaştırılırken bulunmuştur (Şekil 2E, 2G). Hedef dışı transkriptlerin sayısı önemli ölçüde farklı olarak ifade edilir: beyaz, 253 (toplam transkriptlerin% 1.4'ü); Çentik, 300 (%1,7); sarı, 41 (%0,23); GFP, 5.880 (%33) (Şekil2G). Toplam 17.779 farklı transkriptten 6'sının hedef dışı transkriptleri 4 örnek grubunda da anlamlı bir şekilde farklı ifade edildi. Tespit edilen 6 transkriptten biri, sineklerde apoptoz ve hücresel arreste karışan bir gen olan Gadd45'tir ve CasRx'in enzimatik eyleminin doğrudan hücresel apoptozu tetikleyebileceği veya dolaylı olarak diğer genlerin yanlış ifadesini tetikleyebileceği olasılığını artırmıştır, bu da apoptoza yol açar. Son olarak, Ubiq-CasRx ve Ubiq-dCasRx sineklerinin, muhtemelen yüksek her yerde bulunan ifade ile verilen toksisite nedeniyle homozigöz stoklar olarak kurulmadığını belirtmek gerekir. Sonuç olarak, homozigot gRNA sinek hatları ile geçiş için heterozipöz Ubiq-CasRx/CyO ve Ubiq-dCasRx/CyO sinekleri kullanılmıştır. Özetle, iki bileşenli Ubiq-CasRx sistemi, gözlemlenebilir fenotipler ve transkript azaltma ile sonuçlanan hem endojen hem de eksojen hedefler için her yerde RNA hedeflemesi elde edebilir. Bu sonuçlar ayrıca CasRx aracılı RNA hedeflemenin vivo toksisiteye neden olabileceğini göstermiştir.
Üç Bileşenli CasRx Sistemi Kullanılarak Her Yerde Bulunan In vivo Eksojen RNA Hedeflemesi
İki adımlı haçtan elde edilen sonuçlar, hedef genin eksojen doğasına rağmen (yani, Fluc), F2 üçlü transheterozygotes (Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) üç transjen ifade Ubiq-dCasRx içeren kontrol haçlarına kıyasla% 100 öldürücülük ile sonuçlandı, F2 üçlü transheterozygotlarda (Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) öldürücülük görülmediği durumlarda (Şekil 3B-C ). Daha spesifik olarak, sadece üç transjenin (Ubiq-CasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) kombinasyonu % 100 öldürücülükle (Şekil 3B ve D) sonuçlanırken (Ubiq-CasRx/+; gRNAFluc/TM6) ve (Ubiq-CasRx/+; Ubiq-Fluc-Ubiq-Rluc/TM6) genotipleri uygulanabilirdi ve beklenen Mendelian iletim oranlarına uyan kalıtım oranları ile fenotiplerden yoksundu, Hedef sıranın (yani ateş böceği luciferaz) Ubiq-CasRx/+ ve gRNAFluc ile birlikte kullanılabilirliğinin, muhtemelen Cas13 enzimlerinin ikincil aktivitesinden kaynaklanan gözlenen ölümcüllük fenotipleriyle sonuçlandığını öne sürüyor2,8 . Buna ek olarak, F1 transheterozygotlarında (Ubiq-CasRx/+; gRNAFluc/+ veya Ubiq-CasRx/+; Ubiq-Ubic-Ubiq-Rluc/+) Ubiq-dCasRx kontrollerine (Ubiq-dCasRx/+; gRNAFluc/+ veya Ubiq-dCasRx/+; Ubiq-Fluc-Ubiq-Rluc/+) (Şekil 3B), gözlenen öldürücülük fenotiplerini elde etmek için katalitik olarak aktif bir enzimin gerekli olduğunu gösterir. Ayrıca, tüm uygulanabilir genotiplerin sineklerindeki Fluc ve Rluc ekspresyon seviyeleri, çift luciferase muhabir kontrolüne kıyasla Ubiq-dCasRx üçlü transheterozygotlarında (Ubiq-dCasRx/+; gRNAFluc/Ubiq-Fluc-Ubiq-Rluc) Fluc ifadesinde önemli bir azalma göstermedi. Bu, Fluc protein ekspresyon seviyelerinin dCasRx hedeflemesi ile azalmadığını göstermektedir (Şekil 3D). Birlikte ele alındığında, casrx aracılı iki farklı RNA hedefleme deneyindeki yaygın öldürücülük fenotipi, dokularda her yerde kullanıldığında, CasRx aracılı RNA hedeflemesinin organizma için toksik olabileceğini göstermektedir.
Üç Bileşenli CasRx Sistemi Kullanılarak Dokuya Özgü In vivo RNA Hedefleme
Her yerde bulunan RNA hedefleme deneylerinde gözlenen yüksek toksisite seviyesi, yöntemler bölümünde ayrıntılı olarak açıklanan üç bileşenli CasRx sistem tasarımını kullanarak dokuya özgü RNA hedeflemesini keşfetmemizi istemeye neden oldu. Gerçekten de, genel CasRx ifadesi UASt promotörü kullanılarak Ubiq organizatörüne kıyasla düşürüldüğünde gözlenen toksisite seviyesi azaltıldı, bu üç açıdan örneklenmiştir: 1) UASt-CasRx ve UASt-dCasRx hatları homozigous çizgiler olarak korunmuştur, ancak iki adımlı çapraz şemaya dayanarak çift dengeli UASt-CasRx ve UASt-dCasRx çizgileri haçları gerçekleştirmek için kullanılmıştır, 2) tüm F2 nesil dCasRx üçlü transheterozygous kalıtım oranları beklenen eşleşmiştir 25% Mendelian kalıtım oranı, ve 3) F2 nesil CasRx üçlü transheterozygous ölümcül ölümcüllük fenotip orta derecede azaltılmıştır. Beyaz hedefleme deneyinde, F2 üçlü transheterozygotlarda beklenen% 25 Mendelian kalıtım oranlarından, sadece% 0.57 uygulanabilir yetişkin sinekleri (UASt-CasRx / + + ; gRNAw / GMR-Gal4) gözlendi, bunların hepsi ciddi göz spesifik pigmentasyon ve morfoloji fenotipleri gösterdi (Şekil 4A ve 4B). Beyaz hedefleme çaprazı için CasRx eksprese edici üçlü transheterozygöz F2 kalıtım oranı dCasRx eksprese üçlü transheterozygöz kontrol grubundan (%27,6) önemli ölçüde düşüktü (Şekil 4A). Çentik hedefleme deneyinde, üç transjeni de taşıyan CasRx eksprese üçlü tranheterozygous% 100 ölümcülken, dCasRx kontrol kalıtım oranı% 29.3 idi (Şekil 4A). Sarı hedefleme deneyinde, F2 üçlü transheterozipöz CasRx-expressing, gRNAy ve y-GAL4, dCasRx kontrol grubundan (%25,2) çok daha düşük, %2,67 kalıtım oranına sahip toraks ve karın üzerinde küçük sarı kütikül lekeleri olarak marjinal kitin pigment azalması gösterdi (Şekil4A ). Tüm dCasRx kontrol üçlü transheterozygous sinekler CasRx ifade sinekleri olarak belirgin fenotipler sunmadı, bu da CasRx'in katalitik aktivitesinin gözlenen fenotiplere katkıda bulunduğunu gösterdi. CasRx üçlü transheterozygous grubundaki düşük kalıtım oranı, CasRx RNA hedeflemesinde iki toksisite kaynağının mevcut olduğunu öne sürmüştür: biri CasRx'in yüksek ekspresyumu ile ilişkilidir, toksisitesi kısıtlayıcı CasRx ekspresyumu ile azaltılmıştır, diğeri teminat aktivitesi ile ilişkilidir. Birlikte ele alındığında, bu sonuçlar CasRx sisteminin klasik Gal4 / UASt sisteminden yararlanarak dokuya özgü in vivo RNA hedeflemesi elde edebileceğini ve bu arada toksisiteyi azaltabileceğini göstermiştir. Bununla birlikte, toksisite ve zaman zaman öldürücülük fenotipleri, her yerde bulunan yaklaşımlara kıyasla daha düşük bir şiddet seviyesinde gözlenmiştir, bu da kollateral bölünme aktivitesinin toksisite ile ilişkili olduğunu gösterir.
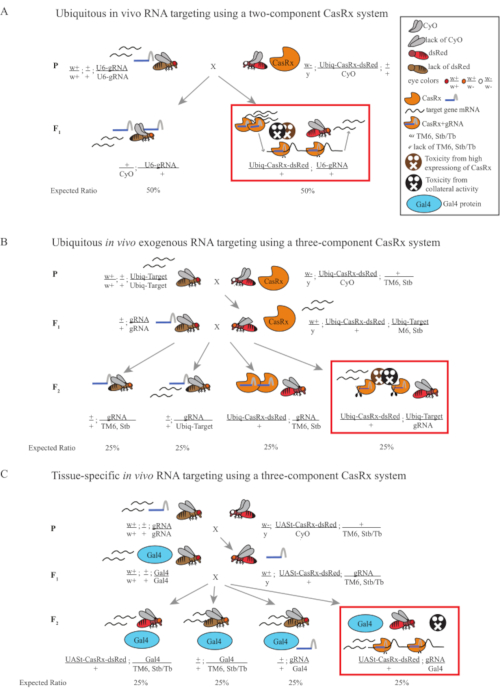
Şekil 1: Cas13D sistemi kullanarak RNA hedeflemesine genel bakış. (A) İki bileşenli casrx sistemi kullanarak her yerde bulunan in vivo RNA hedeflemesinde tek adımlı genetik haçın şemaları. (B) Üç bileşenli CasRx sistemi kullanılarak her yerde bulunan in vivo eksojen RNA hedeflemesinde iki adımlı bir genetik haçın şemaları. (C) Üç bileşenli CasRx sistemi kullanılarak dokuya özgü in vivo RNA hedeflemesinde iki aşamalı genetik haçın şemaları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
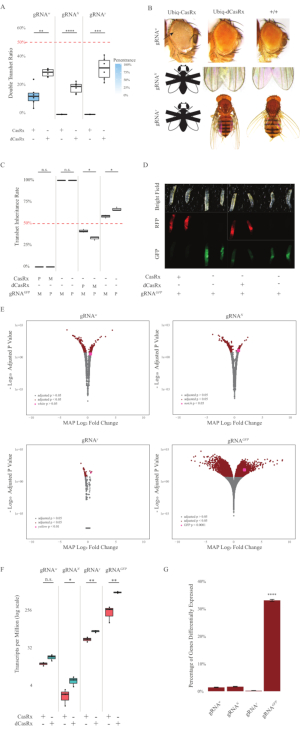
Şekil 2: İki bileşenli CasRx sistemi kullanılarak her yerde bulunan in vivo RNA hedeflemesi (yeniden basılmıştır5). (A) Ubiq-CasRx (veya Ubiq-dCasRx) ve gRNA'ları devralan transheterozigöz sineklerin toplam kalıtım yüzdeleri. Kutu çiziminde mavi gölgelendirme fenotip penetrance gösterir. (B) Transheterozip sineklerin fenotipleri. Oklar gözdeki doku nekrozuna işaret eder. ''X'' ile işaretlenmiş siyah beyaz sinek ölümcüllüğü temsil eder. (C) Ubiq-CasRx (veya Ubiq-dCasRx) ve gRNAGFP-OpIE2-GFP sinekleri arasındaki çift yönlü haçların transtererozigöz sineklerinin toplam kalıtım yüzdeleri. M, CasRx'in anne mirası; P, CasRx'in baba mirası. (D) Baba çetinde F1 larvaları soyları. (E) Transkriptlerin logaritmik kat değişimi için tahmin eden maksimum posteriori değeri. DESeq2 ardışık düzeni kullanıldı. (F) CasRx veya dCasRx ile hedeflenen milyon başına transkript (TPM). (G) CasRx-depentent transkriptlerin farklı ifade edilen transkript yüzdesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
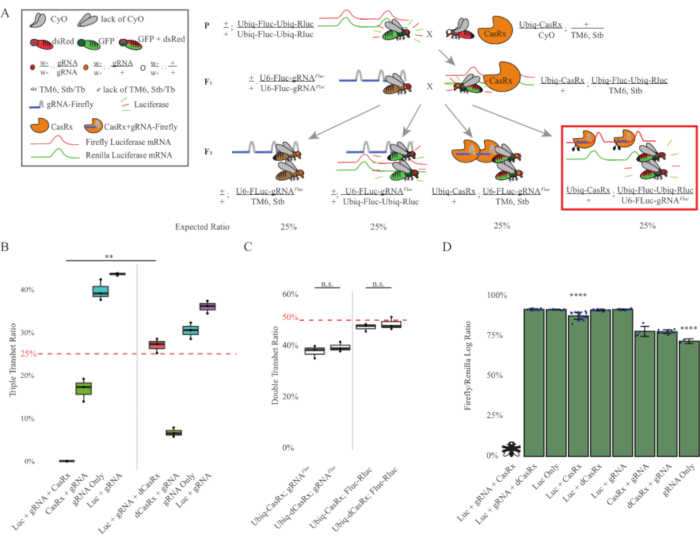
Şekil 3: Üç bileşenli CasRx sistemi kullanılarak her yerde bulunan in vivo eksojen RNA hedeflemesi. (A) İki adımlı genetik haçın şemaları. (B) F2 kuşağında ortaya çıkan tüm genotipler için toplam kalıtım yüzdeleri. F2 soyundaki her üç transjenin (Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc ve gRNAFLuc) kalıtsal olarak devralınması %100 öldürücülükle sonuçlandı ve Ubiq-dCasRx üçlü transheterozygot kontrol grubuna kıyasla önemli ölçüde daha düşüktü (p = 0.001, t-test). (C) Tek başına Ubiq-CasRx/gRNAFluc veya Ubiq-CasRx ve Ubiq-Fluc-Ubiq-Rluc taşımak tek başına ciddi ölümcüllüğe yol açmadı, ve Ubiq-CasRx ve Ubiq-dCasRx transheterozygotlar arasındaki kalıtım oranları önemli ölçüde farklı değildi (sırasıyla p = 0.41 ve p = 0.51, t-test). (D) Luciferaz oranları normalleşen Fluc okumaları Rluc okumaları. Ubiq-CasRx, Ubiq-Fluc-Ubiq-Rluc, gRNAFLuc'u ifade eden üçlü transheterozipöz sinekler embriyonik öldürücüydü, bu da "X" ile bir sinekle temsil edildi ve sonuç olarak luciferaz ekspresyumu ölçülmedi. Ubiq-CasRx/+, Ubiq-Fluc-Ubiq-Rluc/TM6, Stb transheterozygotes'un Fluc/Rluc oranı diğer Ubiq-Fluc-Ubiq-Rluc-expressing gruplarından (p = 1.2e-06 veya daha düşük, t-test) önemli ölçüde daha düşüktü. Yalnızca gRNAFLuc grubundan elde edilen sonuçlar diğer tüm gruplardan önemli ölçüde daha düşüktü (p = 1.2e-06 veya daha düşük, t-test). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
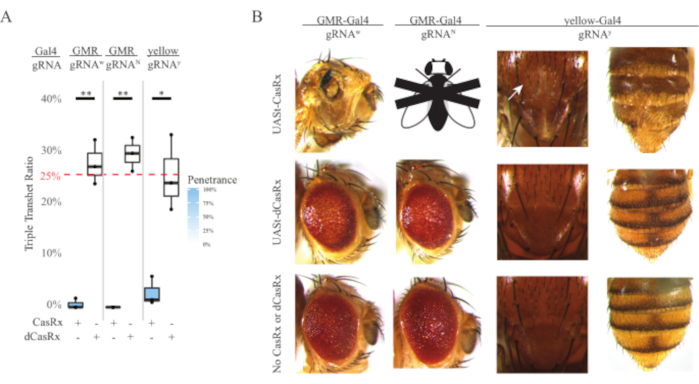
Şekil 4: Üç bileşenli CasRx sistemi (yeniden basılmış5) kullanılarak dokuya özgü in vivo RNA hedeflemesi). (A) Üç transjen (UASt-CasRx veya UASt-dCasRx, gRNAs ve Gal4-driver) taşıyan üçlü transtererozigöz sineklerin toplam kalıtım yüzdesi. (B) Üçlü transheterozip sineklerin fenotipleri. Beyaz ok toraksta kitin pigment azalmasını gösterir. ''X'' ile işaretlenmiş siyah beyaz sinek ölümcüllüğü temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Yapmak | Tarif | Astar | Astar Sırası (5' ila 3') | PCR Şablonu |
| OA-1050E | CasRx | 1050E. C3 | TACTAATTTTCCAC ATCTTATTTTGAC CCGCAGATTAATTA ATGAGCCCCAAGA AGAA | pNLS-RfxCas13d-NLS-HA (pCasRx) |
| 1050E. C4 | CAATTGATTTGTTA TTTTAAAAACGATT CATTCTAGCTAGCT TAAGCGTAATCTGG AACA | |||
| OA-1050R | dCasRx | 1050E. C3 | TACTAATTTTCCAC ATCTTATTTTGAC CCGCAGATTAATTA ATGAGCCCCAAGA AGAA | pNLS-dRfxCas13d-NLS-HA (pdCasRx) |
| 1050E. C4 | CAATTGATTTGTTA TTTTAAAAACGATT CATTCTAGCTAGCT TAAGCGTAATCTG GAACA | |||
| OA-1050L | UASt organizatörü | 1041.C9 | GCGGGTTCTCGA CGGTCACGGCGG GCATGTCGACGC GGCCGCAACCAA CAACACTAGTAG | pJFRC81 |
| 1041.C11 | CTGGCCTCCACC TTTCTCTTCTTCTCT TGGGGCTCATGT TTAAACCCAATT CCCTATTCAGA | |||
| CasRx | 1050L. C1 | AATACAAGAAGA GAACTCTGAATA GGGAATTGGGT TTAAACATGAGC CCCAAGAAGAA | pCasRx | |
| 1050E. C4 | CAATTGATTTGT TATTTTAAAAAC GATTCATTCTA GCTAGCTTAAG CGTAATCTGGA ACA | |||
| OA-1050'LER | UASt organizatörü | 1041.C9 | GCGGGTTCTC GACGGTCACG GCGGGCATGT CGACGCGGCC GCAACCAACAA CACTAGTAG | pJFRC81 |
| 1041.C11 | CTGGCCTCCA CCTTTCTCTTC TTCTTGGGGCT CATGTTTAAAC CCAATTCCCTA TTCAGA | |||
| dCasRx | 1050L. C1 | AATACAAGAAG AGAACTCTGAAT AGGGAATTGGG TTTAAACATGAG CCCCAAGAAGAA | pdCasRx | |
| 1050E. C4 | CAATTGATTTGT TATTTTAAAAAC GATTCATTCTAG CTAGCTTAAGCG TAATCTGGAACA | |||
| OA-1043 | U6:3 organizatör | 1043.C1 | GGGAATTGGGA ATTGGGCAATAT TTAAATGGCGGC GCGCCGAATTCT TTTTTGCTCACCT | Addgene plazmid #164586 |
| 1043.C23 | ACACTAGTGGAT CTCTAGAGGTAC CGTTGCGGCCG CAAAAAGTTGT AATAGCCCCTCA AAACTGGACCTT CCACAACTGCAG CCGACGTTAAAT TGAAA | |||
| OA-1052B | Ubiq organizatörü | 1052B. C1 | GGGAATTGGGCA ATATTTAAATGGC GGCTGCAGCGC GCAGATCGCCGAT | Addgene plazmid #112686 |
| 1052B. C2 | TTTCTTTATGTTT TTGGCGTCTTCC ATCCTAGGTCTG CGGGTCAAAATA GAGATG | |||
| T2A-eGFP | 908A1 | ATAAAGGCCAAG AAGGGCGGAAA GATCGCCGTGG AGGGCAGAGGA AGTCTTCTAACAT GC | Addgene plazmid #112686 | |
| 908A2 | TTGTTATTTTAAAA ACGATTCATTCTA GGCGATCGCTTA CTTGTACAGCTC GTCCATGCC | |||
| Ters Ubiq promotörü | 908A3 | ACCGTGACCTAC ATCGTCGACACTA GTGGATCTCTAGA CGCGCAGATCGC CGATG | Addgene plazmid #112686 | |
| 908A4 | GGATCATAAACTT TCGAAGTCATGC GGCCGCTCTGCG GGTCAAAATAGAG ATGT |
Tablo 1: Bu çalışmada kullanılan moleküler yapı ve astarların listesi. Bu liste, tüm yapıları (hem kimlik hem de açıklama) ve her yapının ilişkili astarlarını (hem kimlik hem de sıralar (5' ila 3')) ve kullanılan şablonları içerir.
Tartışmalar
CasRx sisteminin üç farklı uygulama tasarımı ile bu çalışma, sineklerde vivoprogramlanabilir RNA hedeflemesini gösterdi. Farklı stratejiler, endojen ve eksojen gen hedeflemesi ve dokuya özgü RNA hedeflemesi gibi farklı proje ihtiyaçlarına hitap eder. RNA hedeflemesinin etkileri arasında hedef gen spesifik fenotipik değişiklikler, hedef RNA transkript azaltma ve casrx proteininin yüksek ekspresyumu ve kollateral aktivite ile ilişkili zaman zaman ölümcüllük fenotipleri yer aldı. Genel olarak, bu sonuçlar CasRx sisteminin organizma düzeyinde RNA transkript azaltmayı programlanabilir ve verimli bir şekilde hedefleyebildiğini göstermiştir.
CasRx sisteminin başarılı bir şekilde özelleştirilmesindeki temel faktörlerden biri gRNA'ların tasarımıdır. Özellikle, aşağıdaki tavsiyelere dikkat edilmelidir: hedef sıra yaklaşık 30 nükleotit uzunluğundadır, hedef dizideki poli-U esnemelerinin uzunluğu 4 baz çift veya daha azdır, hedef dizi GC içeriği% 30 - % 70 aralığındadır, hedef sıranın güçlü RNA saç tokası yapıları oluşturacağı tahmin edilmemiştir ve hedef dizi minimum tahmin edilen RNA ikincil veya üçüncül yapı içerir5.
GRNA tasarımlarına ek olarak, her protokoldeki sinek genetiği adımı da başarılı bir uygulamada kritik öneme sahiptir. Soylardaki ebeveynlerden aktarılan tanımlanmış fenotiplerin varlığı veya eksikliği, transtereroziplerde CasRx sistemi tarafından indüklenen fenotiplerin tanımlanması ve ölçülmesi için önemlidir. Ayrıca, dCasRx sineklerini paralel olarak kullanarak kontrol haçlarının kurulması, transheterozipöz soylardaki spesifik olmayan fenotiplerin e elenmesinde de yararlıdır.
Bu sonuçların, CasRx sisteminin bir sınırlaması olan sinekte CasRx ve dCasRx proteinini her yerde ifade ederek ortaya çıkan toksisite sorununu ortaya çıkardığına dikkat etmek gerekir. Sadece Ubiq promotörü altında CasRx veya dCasRx'in her yerde ifade edilmesi, gRNA'lar olmadan, ne Ubiq-CasRx ne de Ubiq-dCasRx sinekleri homozigous çizgiler olarak kurulamadığı için önemsiz fitness maliyetleriyle birlikte geldi. Aksine, UASt-CasRx ve UASt-dCasRx sinekleri sağlıklı homozigöz stoklar olarak kurulabilir, ancak çapraz şemanın tasarımı nedeniyle çift dengeli stoklar olarak tutulurlar, bu da her yerde bulunan CasRx protein ekspresyonunun neden olduğu toksisitenin varlığını destekleyen bir gerçektir. Bir başka destekleyici kanıt, katalize olarak aktif olmayan dCasRx'i içeren kontrol deneylerinde, F1 neslindeki toplam sinek sayısından hem dCasRx hem de gRNA yapılarını taşıyan sineklerin yüzdelerinin sürekli olarak% 50'den düşük olduğu, dCasRx ile ilişkili toksisite yoksa Mendelian genetiğine dayanarak beklenen oranın. Bu, her yerde ifade edilen dCasRx'in gRNA'larla birlikte uçucuda toksisiteye neden olduğunu ve beklenen kalıtım oranının daha az olduğunu gösterdi. Transheterozigöz UASt-dCasRx, gRNA, GAL4 sineklerinin kalıtım oranları, özellikle CasRx ve dCasRx proteinlerinin her yerde ifade edilen toksisitesini düşündüren Mendelian genetiğini takip etti. CRISPR/Cas sisteminde toksisite yeni değildir. Yüksek miktarda Cas9 proteininin sinekler de dahil olmak üzere çeşitli organizmalarda toksik olduğu gösterilmiştir29,30,31,32. Yeni bir çalışma, UAS dizisi ile UAS-Cas9 yapısı33'teki Cas9 dizisi arasında değişen uzunlukta bir açık okuma çerçevesi ekleyerek sineklerde ifade edilen Cas9 protein miktarını ayarlayabilen özelleştirilmiş bir GAL4 /UAS sistemi geliştirmiştir. Bu nedenle, CasRx protein ekspresyon seviyesini ayarlayarak CasRx kaynaklı toksisiteyi azaltmanın yollarını araştırmaya değer.
CasRx ve dCasRx proteinlerinin her yerde ifade edilen toksisitesi dışında, sonuçlar casrx sisteminin spesifik olmayan kollateral hedef dışı etkilerine bağlı ölümcüllük gösterdi, birçok CRISPR sisteminin bir özelliği1,2,7,34. CasRx ve gerekli olmayan gen gRNA ifade eden çift veya üçlü transheterozigöz sineklerin bazılarında, örneğin Çentik hedeflendiğinde, transheterozigous CasRx sinekleri transheterozgyous dCasRx sineklerine kıyasla önemli ölçüde daha düşük sağkalım oranlarına sahiptir. Bu CasRx ve gRNA eksprese edici transheterozipöz sineklerin RNA-seq analizinde hem hedef gen transkript seviyelerinin azalması hem de hedef dışı gen transkriptlerinin azalması gözlenmiştir. Bu kollateral etkiler CasRx'e bağımlı ve hedefe bağımlıydı, çünkü sadece Hem CasRx proteinini hem de gRNA'yı ifade eden transheterozigöz sineklerde gözlendiler. Hedef genlerden biri olan beyazın, beyaz gen CasRx tarafından hedeflendiğinde transkriptlerde sadece sınırlı, istatistiksel olarak anlamlı olmayan bir azalma gösterdiğini ve bunun açık pigment azaltma fenotipinin aksine olduğunu belirtmek gerekir. Bunun, 1) RNA-seq örnek toplamanın zamanlamasının, beyaz genin erken gelişim sırasında en yüksek ifadeye ulaştığı zaman zamanlaması ile iyi hizalanmamış olması ve 2) beyaz genin gözlerdeki lokalize ifadesinin, sadece tüm vücut örneği toplamanın mümkün olduğu erken gelişim aşamasında ilgili dokuların toplanmasını zorlaştırdığı varsayımında bulunur. CasRx sistemindeki ikincil aktiviteyi azaltmak için, gelecekteki çalışmaların organizma düzeyinde hedef dışı fenomen sisteminin altında kalan mekanizmaları tam olarak anlaması için çağrıda bulunulmaktadır.
İlginçtir ki, sineklerde RNA hedefleme Cas13 araçlarını tanımlayan yeni bir çalışma35 , casrx ekspresyumu ile ilişkili genel toksisiteyi birkaç olası nedenden dolayı iyileştirici olarak ortaya çıktı. İlk olarak, yazarlar Cas13 transgenes'i Drosophila'daki ifadeyi optimize etmek için yeniden kodladılar ve mevcut çalışmada kullanılan ubiquitin promotörüne kıyasla daha zayıf ifade eden bir promotör (actin 5C) kullandılar, muhtemelen cas13 ekspresyonunun daha düşük seviyelerine ve dolayısıyla daha az toksisiteye yol açtılar. Gerçekten de, bu çalışma (ve 35'teki yazarlar) UASt-CasRx sineklerinde belirgin bir ölümcüllük gözlemlemediği için, UASt güdümlü CasRx ve dCasRx ekspresyonunun tek başına toksik olmadığı gözlemleri tarafından desteklenmektedir. Ayrıca, bu yazarlar gRNA'larını bu çalışmaya kıyasla farklı kodlamıştır, bu da ifadelerini etkilemiş ve transtererozigöz Cas13 / gRNA sineklerinde sistemin toksisitesini azaltmış olabilir. Örneğin, çalışmalarında iki gRNA U6:3 promotörü kullanılarak ifade edildi ve CasRx35 gerektirmeden tRNA olgunlaşması üzerine gRNA işlenmesini sağlamak için tRNA'lar tarafından kuşatıldı. Tersine, bu çalışmada, gRNA'lar gen başına 4 konuma kadar hedef alan ve bakterilerde bulunan endojen Cas13 dizi yapısını taklit eden diziler olarak kodlanmıştır, bu da Cas13 enziminin her gRNA'yı işlemesini gerektirir. Bu farklı yaklaşımlar gRNA ekspresyon düzeylerinde farklılıklara ve tüm sistemin toksisitesi üzerinde doğal etkileri olabilecek diğer faktörlere yol açmış olabilir. Son olarak, Huynh ve arkadaşları, hedef-Cas/gRNA etkileşimi ve kollateral aktivitede farklılıklara neden olan ve gözlenen ölümcüllük seviyeleri üzerinde etkileri olabilen bu çalışmada hedeflenenlerden farklı genleri hedefledi. Gözlenen toksisitedeki bu farklılıklar, genel sistemlerin geliştirilme yollarını belirlemek için daha fazla araştırma yapılmasını garanti ediyor.
Genel olarak, bu çalışma D. melanogaster'da genetik olarak kodlanmış işlevsel bir programlanabilir RNA hedefleme Cas sisteminin ilk gösterimidir, ancak CasRx sisteminin daha fazla optimizasyonu (bildirilenlere paralel olarak35) hedef dışı öldürücülüğü daha da azaltmak ve CasRx hedefteki bölünmenin etkinliğini artırmak gerekecektir. Cas enzimleri ile RNA hedefleme, böcek vektör kontrolünden terapötik kullanımlara kadar birçok potansiyel uygulamaya sahip hızla gelişen bir alandır1,2,3,4,5,6,7 ve bu protokol, özelleştirme ve sistemin daha da optimizasyonu ile uyumlu olurken, sineklerde ilk CasRx sistemini tasarlamak isteyen herkes için bir başlangıç paketi sunmaktadır. Burada sunulan örnekler, bu sistemin in vivo uygulanması sırasında karşılaşabileceği bir dizi sonucu göstermektedir ve casrx sisteminin uygulamalarındaki performansını değerlendirirken diğer kullanıcılar için ölçüt görevi görebilir.
Açıklamalar
O.S.A. Agragene, Inc.'in kurucusudur, özkaynak menfaati vardır ve şirketin Bilimsel Danışma Kurulu'nda görev yapmaktadır. Bu düzenlemenin şartları, Kaliforniya Üniversitesi, San Diego tarafından çıkar çatışması politikalarına uygun olarak gözden geçirilmiş ve onaylanmıştır. Diğer tüm yazarlar rakip çıkarlar beyan etmemektedir.
Teşekkürler
Bu çalışma kısmen DARPA Güvenli Genler Programı Hibesi (HR0011-17-2-0047) ve O.S.A.'ya verilen NIH ödülleri (R21RAI149161A, DP2AI152071) tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100% Grape Juice | Welch Foods Inc. | N/A | |
| Active Dry Yeast (908g) | Red Star Yeast Company, LLC | N/A | |
| DMC4500 color camera | Leica Microsystems | DMC4500 | |
| Dual-Luciferase Reporter Assay System | Promega | E1910 | |
| GAL4-GMR flies | Bloomington Drosophila Stock Center | 29967 | |
| GAL4-y flies | Bloomington Drosophila Stock Center | 44373 | |
| Glomax 20/20 Luminometer | Promega | E5331 | |
| Illumina HiSeq2500 Sequencer | Illumina, Inc. | HiSeq2500 | |
| M165FC fluorescent stereomicroscope | Leica Microsystems | M165FC | |
| Nanodrop OneC UV-vis spectrophotometer | ThermoFisher | NDONEC-W | |
| NEBNext Ultra II RNA Library Prep Kit | New England Biolabs, Inc. | E7770 | |
| plasmid # 112686 | Addgene | 112686 | |
| plasmid # 112688 | Addgene | 112688 | |
| plasmid # 132416 | Addgene | 132416 | |
| plasmid # 132417 | Addgene | 132417 | |
| plasmid # 132419 | Addgene | 132419 | |
| plasmid # 132420 | Addgene | 132420 | |
| plasmid # 132421 | Addgene | 132421 | |
| plasmid # 132422 | Addgene | 132422 | |
| plasmid # 132425 | Addgene | 132425 | |
| plasmid # 132426 | Addgene | 132426 | |
| plasmid # 133304 | Addgene | 133304 | |
| plasmid # 164586 | Addgene | 164586 | |
| plasmid #132418 | Addgene | 132418 | |
| plasmid pJFRC81 | Addgene | 36432 | |
| Qiagen RNeasy Mini Kit | Qiagen | 74104 | |
| Restriction endonucleases AscI | New England Biolabs Inc. | R0558L | |
| Restriction endonucleases NotI | New England Biolabs Inc. | R0189L | |
| Restriction endonucleases PacI | New England Biolabs Inc. | R0547L | |
| Restriction endonucleases PstI | New England Biolabs Inc. | R0140L | |
| Restriction endonucleases SwaI | New England Biolabs Inc. | R0604L | |
| Restriction endonucleases XbaI | New England Biolabs Inc. | R0145L | |
| RNA 6000 Pico Kit for Bioanalyzer | Agilent Technologies | 5067-1513 | |
| Turbo DNase | Invitrogen | AM2238 | |
| U6-3:4-gRNA-Fluc flies | Bloomington Drosophila Stock Center | 84125 | |
| U6-3:4-gRNA-GFP; OpIE2-GFP flies | Bloomington Drosophila Stock Center | 84986 | |
| U6-3:4-gRNA-N flies | Bloomington Drosophila Stock Center | 84122 | |
| U6-3:4-gRNA-w flies | Bloomington Drosophila Stock Center | 84124 | |
| U6-3:4-gRNA-y flies | Bloomington Drosophila Stock Center | 84123 | |
| UASt-CasRx flies | Bloomington Drosophila Stock Center | 84121 | |
| UASt-dCasRx flies | Bloomington Drosophila Stock Center | 84120 | |
| Ubiq-CasRx flies | Bloomington Drosophila Stock Center | 84118 | |
| Ubiq-dCasRx flies | Bloomington Drosophila Stock Center | 84119 | |
| Ubiq-Firefly-T2A-eGFP-Ubiq-Renilla flies | Bloomington Drosophila Stock Center | 84127 | |
| Zymoclean Gel DNA Recovery Kits | Zymo Research Corporation | D4007 |
Referanslar
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nat Communications. 9, 1911(2018).
- Abudayyeh, O., et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. 353 (6299), 5573(2016).
- East-Seletsky, A., O'Connell, M., Burstein, D., Knott, G., Doudna, J. RNA Targeting by Functionally Orthogonal Type VI-A CRISPR-Cas Enzymes. Molecular Cell. 66 (3), 373-383 (2017).
- Konermann, S., Lotfy, P., Brideau, N., Oki, J., Shokhirev, M., Hsu, P. Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors. Cell. 173 (3), 665-676 (2018).
- Buchman, A., Brogan, D., Sun, R., Yang, T., Hsu, P., Akbari, O. Programmable RNA Targeting Using CasRx in Flies. The CRISPR Journal. 3 (3), 164-176 (2020).
- Kushawah, G., et al. CRISPR-Cas13d Induces Efficient mRNA Knockdown in Animal Embryos. Developmental Cell. 54 (6), 805-817 (2020).
- Abudayyeh, O., et al. RNA targeting with CRISPR-Cas13. Nature. 550, 280-284 (2017).
- Perrimon, N., Ni, J., Perkins, L. In vivo RNAi: today and tomorrow. Cold Spring Harbor Perspectives in Biology. 2, 003640(2010).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448, 151-156 (2007).
- Ni, J., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Ni, J., et al. A genome-scale shRNA resource for transgenic RNAi in Drosophila. Nature Methods. 8, 405-407 (2011).
- Ni, J., et al. Vector and parameters for targeted transgenic RNA interference in Drosophila melanogaster. Nature Methods. 5, 49-51 (2008).
- Heigwer, F., Port, F., Boutros, M. RNA Interference (RNAi) Screening in Drosophila. Genetics. 208 (3), 853-874 (2018).
- Kulkarni, M., et al. Evidence of off-target effects associated with long dsRNAs in Drosophila melanogaster cell-based assays. Nature Methods. 3, 833-838 (2006).
- Ma, Y., Creanga, A., Lum, L., Beachy, P. Prevalence of off-target effects in Drosophila RNA interference screens. Nature. 443, 359-363 (2006).
- Perrimon, N., Mathey-Prevot, B. Matter arising: off-targets and genome-scale RNAi screens in Drosophila. Fly. 1 (1), 1-5 (2007).
- Markstein, M., Pitsouli, C., Villalta, C., Celniker, S., Perrimon, N. Exploiting position effects and the gypsy retrovirus insulator to engineer precisely expressed transgenes. Nature Genetics. 40, 476-483 (2008).
- Champer, J., Buchman, A., Akbari, O. Cheating evolution: engineering gene drives to manipulate the fate of wild populations. Nature Review Genetics. 17 (3), 146-159 (2016).
- Buchman, A., et al. Broad dengue neutralization in mosquitoes expressing an engineered antibody. PLoS Pathogens. 16 (4), 1008103(2020).
- Mathur, G., Sanchez-Vargas, I., Alvarez, D., Olson, K., Marinotti, O., James, A. Transgene-mediated suppression of dengue viruses in the salivary glands of the yellow fever mosquito, Aedes aegypti. Insect Molecular Biology. 19 (6), 753-763 (2011).
- Franz, A., et al. Engineering RNA interference-based resistance to dengue virus type 2 in genetically modified Aedes aegypti. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4198-4203 (2006).
- Yen, P., James, A., Li, J., Chen, C., Failloux, A. Synthetic miRNAs induce dual arboviral-resistance phenotypes in the vector mosquito Aedes aegypti. Communications Biology. 1, 11(2018).
- Buchman, A., et al. Engineered resistance to Zika virus in transgenic Aedes aegypti expressing a polycistronic cluster of synthetic small RNAs. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3656-3661 (2019).
- Addgene. , Available from: https://www.addgene.org/protocols/restriction-digest/ (2020).
- Gibson, D., Young, L., Chuang, R., Venter, J., Hutchison, C., Smith, H. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Addgene. , Available from: https://www.addgene.org/protocols/pcr/ (2020).
- Indiana University Bloomington. , Available from: https://bdsc.indiana.edu/information/recipes/bloomfood.htmL (2020).
- Dobin, A., et al. STAR:ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Jiang, W., Brueggeman, A., Horken, K., Plucinak, T., Weeks, D. Successful transient expression of Cas9 and single guide RNA genes in Chlamydomonas reinhardtii. Eukaryotic Cell. 13 (11), 1465-1469 (2014).
- Poe, A., et al. Robust CRISPR/Cas9-Mediated Tissue-Specific mutagenesis reveals gene redundancy and perdurance in Drosophila. Genetics. 211 (2), 459-472 (2019).
- Port, F., Chen, H., Lee, T., Bullock, S. Optimized CRISPR/Cas tools for efficient ger mLine and somatic genome engineering in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (29), 2967-2976 (2014).
- Yang, S., Li, S., Li, X. Shortening the Half-Life of Cas9 maintains its gene editing ability and reduces neuronal toxicity. Cell Reports. 25 (10), 2653-2659 (2018).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. eLife. 9, 53865(2020).
- Zhang, X., Tee, L., Wang, X., Huang, Q., Yang, S. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy - Nucleic Acids. 4 (17), 264(2015).
- Huynh, N., Depner, N., Larson, R., King-Jones, K. A versatile toolkit for CRISPR-Cas13-based RNA manipulation in Drosophila. Genome Biology. 21, 279(2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır