Method Article
完整小鼠和斑马鱼大脑的深组织三光子荧光显微镜
* 这些作者具有相同的贡献
摘要
三光子显微镜能够以高时空分辨率在活生物组织(如小鼠和斑马鱼大脑)深处进行高对比度荧光成像。
摘要
多光子显微镜技术,如双光子显微镜(2PM)和三光子显微镜(3PM),是具有亚细胞分辨率的深部组织 体内 成像的强大工具。3PM对于在生物学实验室中广泛使用的2PM以上的深部组织成像具有两个主要优点:(i)通过采用~1,300 nm或~1,700 nm激发激光,在散射组织中具有更长的衰减长度;(ii)由于高阶非线性激发而产生的背景荧光较少。因此,3PM允许在散射组织(例如从皮质层到海马体和成年斑马鱼的整个前脑的完整小鼠大脑)的深处进行高对比度的结构和功能成像。
如今,适用于3PM的激光源已经上市,可以将现有的双光子(2P)成像系统转换为三光子(3P)系统。此外,还有多种商用3P显微镜可用,这使得该技术随时可供生物学研究实验室使用。本文展示了典型3PM设置的优化,特别是针对已经具有2P设置的生物学组,并展示了完整小鼠和成年斑马鱼大脑的活体3D成像。该协议涵盖了3P成像的完整实验过程,包括显微镜对准,〜1,300和〜1,700nm激光脉冲的预切,动物制备以及成年斑马鱼和小鼠大脑深处的活体3P荧光成像。
引言
在生命科学中,多光子显微镜(MPM)技术(如2PM和3PM)已成为具有高时空分辨率和散射组织中高对比度的深部体内成像的强大工具。此外,与单光子共聚焦显微镜1,2,3,4相比,这些方法引起的光漂白较少。与2PM相比,3PM对于更深的组织成像是有利的,因为有两个主要特征:(i)采用更长波长的激发(~1,300 nm或~1,700 nm)减少组织散射,以及(ii)高阶激发过程(即荧光信号依赖于3PM激发功率的立方体,而不是2PM中激发功率的平方),抑制不需要的背景荧光3.因此,3PM可以在活组织中更深层区域进行高对比度成像,例如完整成年小鼠大脑3,5,6,7,8,9,10,11和成年斑马鱼12的整个前脑(包括Ca2 +)中的海马体 活动记录和多色观察。此外,通过小鼠和成年斑马鱼的完整头骨12,13获得了3PM的高对比度图像。
如今,适用于~1,300和~1,700 nm的3P激发(3PE)的激发激光源已上市。由于激光扫描系统对于2PM和3PM基本上是相同的,因此在生物学实验室中,通过安装市售的3PE激光器,可以将现有的2P设置转换为3P设置。3P荧光信号取决于物镜的激光功率、脉冲持续时间、激光重复率和数值孔径(NA)。假设衍射极限聚焦(即物镜的后孔径被激发光束过度填充),方程(1)描述了来自3PE产生的焦体积的时间平均荧光光子通量。
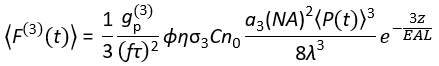 (1)
(1)
其中f是激光重复率,τ是激光脉冲持续时间(半最大值处的全宽),φ是系统收集效率,η是荧光量子效率,σ3是3P吸收截面,C是荧光团浓度,n0是样品介质(例如水)的反射指数,λ是真空中的激发波长, NA是物镜的数值孔径,a3是焦体积的空间积分常数,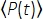 是物镜下的时间平均激发光子通量(光子/秒),z是成像深度,EAL是有效衰减长度14。在这里,我们假设EAL(通常>100μm)远大于显微镜的轴向分辨率(通常<10μm)。在半轴近似下,3 等于 28.114。gp(3) 是激发源的 3次时间相干,对于双曲正割平方脉冲和高斯脉冲,gp(3) 分别为 0.41 和 0.51。通过考虑物镜的荧光采集、物镜的透射率、二向色镜的反射率、滤光片的透射率以及检测器(例如,光电倍增管或PMT)的检测效率,可以估计φ的采集效率。由于3P荧光强度高度依赖于各种参数,因此需要优化3P设置以最大化3P荧光信号。
是物镜下的时间平均激发光子通量(光子/秒),z是成像深度,EAL是有效衰减长度14。在这里,我们假设EAL(通常>100μm)远大于显微镜的轴向分辨率(通常<10μm)。在半轴近似下,3 等于 28.114。gp(3) 是激发源的 3次时间相干,对于双曲正割平方脉冲和高斯脉冲,gp(3) 分别为 0.41 和 0.51。通过考虑物镜的荧光采集、物镜的透射率、二向色镜的反射率、滤光片的透射率以及检测器(例如,光电倍增管或PMT)的检测效率,可以估计φ的采集效率。由于3P荧光强度高度依赖于各种参数,因此需要优化3P设置以最大化3P荧光信号。
该协议说明了典型3P设置的优化过程,这对于具有2P设置并计划将其功能扩展到3P成像或保持其商业3P设置处于最佳性能的生物实验室尤其有用。这篇视频文章还演示了活体动物大脑中的深层组织3P成像。第一部分涉及使用市售激光源和多光子显微镜优化典型的3P设置。第二和第三部分分别描述了斑马鱼和小鼠的准备,用于3PM的神经元结构和活动。小鼠开颅手术以前在方案论文中也有15,16,17的报道。第四部分展示了斑马鱼和小鼠大脑中的活体3P成像。
研究方案
斑马鱼和小鼠的所有动物实验和住宿程序均根据康奈尔大学机构动物护理和使用委员会(IACUC)指南获得批准和实施。斑马鱼和小鼠分别在实验后通过高浓度三卡因溶液和二氧化碳窒息进行安乐死。
1. 三光子显微镜设置的优化
注意:戴上激光安全眼镜以保护眼睛。当放置或移动光学元件时,用光束阻挡器阻挡激光束。要可视化激光,请使用红外查看器或红外探测器卡。
- 打开激光器,将非共线光学参数放大器(NOPA)的惰轮输出的中心波长设置为~1,300 nm或~1,700 nm。
- 在从NOPA信号端口(即~700-900 nm)的光束线上放置一个薄盖玻璃,将一小部分激光束反射到Si光电二极管以获得触发信号(图1)。在盖板玻璃的传输路径中放置阻挡器。
- 在光路上放置脉冲压缩器以预切飞秒激光器,以优化3PM的脉冲持续时间。对于〜1,300 nm光束,放置棱镜对压缩机18,19(例如,N-SF11棱镜对)。对于~1,700 nm激光器,放置厚度为20的~3 mm的Si板。将硅板和激光路径之间的角度设置为布鲁斯特角(约 73.9° 表示 1,700 nm),以最大化激光透射率。旋转硅板,通过最小化反射来实现布鲁斯特角。
- 放置翻转镜,以便在 ~1,300 nm 和 ~1,700 nm 光束线之间方便切换。
- 将安装在旋转载物台上的半波片(例如,适合〜1,300和〜1,700nm的消色差半波片)和偏振分束器(PBS)上以控制激光的强度。在PBS的反射路径中放置一个光束阻滞剂。
注意:激光器需要垂直通过PBS才能达到高消光比。3PM的激光功率通过旋转半波片来控制。 - 在功率控制器之后和光学快门之前的光路中放置一个薄的盖板玻璃,将一小部分激光束反射到功率计上。使用功率计作为"参考功率计",在成像过程中计算物镜下方的激光功率(见步骤1.12)。
- 通过调整反射镜将光束传播到3PM系统中来对齐激光路径。
- 使用平移载物台上的刀刃和功率计测量物镜后孔位置的光束尺寸。确保光束尺寸不太小或太大。
注意:通常,光束略微不足填充高数值孔径物镜,以实现深度组织成像的高功率通量。例如,奥林巴斯物镜后孔径(后孔径直径约15毫米)的光束尺寸约为10-13毫米(1/e2),有助于实现约0.7-0.9的有效数值孔径。当光束尺寸太小时,3P信号变得较弱,空间分辨率因有效NA低而恶化。当光束尺寸过大时,由于物镜后孔的功率损耗,物镜下的最大可用激励功率变得较弱。对于深部组织成像,由于组织中的路径较长,边缘射线也会遭受更高的损失。 - 如果物镜后孔的光束尺寸不合适,请在激光光束路径中放置适当的光学元件,例如凸透镜,以调整光束尺寸。
注:确保激光束不大于振镜,以防止不必要的功率损耗。 - 将物镜置于下午 3 点设置。
- 使用自相关器测量物镜后的脉冲持续时间。如果脉冲持续时间太长(例如,>70 fs),则调整脉冲压缩器以实现较短的脉冲。对于3PM,使用~50-70 fs脉冲,并在激光和物镜之间放置一个迈克尔逊干涉仪,为自相关测量提供延迟。
注:放置在物镜焦点处的具有适当光谱响应的光电二极管(例如,波长大于1,200nm的硅光电二极管)可以方便地用作非线性探测器,并且来自光电二极管的双光子光电流可用于获得自相关迹线20。用于〜1,300 nm的棱镜对压缩机可以通过两种方式进行调整:(1)改变两个棱镜之间的距离;(2)通过垂直于棱镜基线移动棱镜来改变棱镜玻璃中激光束的光程长度。~1,700 nm 的硅板压缩机可以通过用更厚或更薄的 Si 板代替 Si 板来调整。 - 将功率计放在物镜的输出端。测量物镜下的激光功率并读取参考功率计的值(从步骤1.6开始)。计算物镜下和参考功率计处的功率比值。
注意:在成像过程中,物镜下的实际激光功率可以通过功率比和参考功率计的值来计算。 - 从物镜下方取出功率计。
- [可选]验证光子散粒噪声对成像系统性能的限制
注意:要执行此任务,需要以下元素:1)一个荧光素或德克萨斯红色染料池(例如,〜10μM),2)光子计数器,3)示波器。- 将染料池样品置于3PM物镜下。
- 小心地将物镜放在染料池上,直到距离小于物镜的工作距离。
- 将水放在镜头和染料池的盖板玻璃之间。
- 将显微镜的输出功率设置为少量(例如,<1 mW,脉冲重复率约为1 MHz)以定位染料池的表面。
- 启动显微镜的 实时 会话,并将 z 位置 设置为 零。
- 慢慢地将物镜从样品上移开,到达染料池的顶部(如盖玻片产生的三次谐波产生(THG)所示)。
- 将盖板玻璃位置处的 z 位置设置为 零 。
- 略微降低物镜,直到荧光通道中可见清晰的荧光信号。
- 将PMT的输出连接到BNC分路器。将分频器的输出连接到光子计数器和图像采集系统。
- 将激光功率设置为每秒光子计数低于激光重复率的5%的值(例如,当使用1 MHz激光器时为
 50,000光子/秒)。
50,000光子/秒)。 - 使用该软件将视场尽可能减小,并确保整个图像的亮度均匀。
- 将帧速率设置为 1.0 帧/秒。
- 将光子计数器的采集周期设置为 t = 每帧像素数×像素停留时间和适当的鉴别器级别。
- 在等效的时间内同时收集光子计数和像素计数。要获取像素计数,请收集整个图像的平均像素值,以及平均值和标准差值。
- 重复步骤1.14.14,阻挡激发激光,得到暗光子数和像素数。
- 停止 实时 获取软件。
- 从光子计数(在步骤1.14.14中获得)和总像素计数(在步骤1.14.14中获得)中减去暗计数(在步骤1.14.15中获得)。
- 将暗减去的总像素数除以暗减光子数(在步骤1.14.17中获得)。使用获得的值作为从像素值到光子计数的"转换因子"(即像素值/光子)。
- 将像素计数的平均值和标准差(在步骤1.14.14中获得)转换为光子计数,即将它们除以"转换因子"(在步骤1.14.18中获得)。比较光子计数的平均值和标准偏差。如果成像系统性能接近散粒噪声极限,请确保标准差近似等于光子计数均值的平方根。
- [可选]验证显微镜的信号检测效率。
- 为了测试显微镜的性能和信号检测效率,请按照步骤1.14.1-1.14.17获得光子计数。对于步骤1.14.15,创建由染料溶剂制成的空白样品,并在激光上以与染料池相同的功率获得空白样品的光子计数。从染料池中的光子计数中减去空白计数,以获得荧光光子计数。
- 使用荧光素或Texas Red10,22和方程(1)的已知3P横截面(使用有效的NA来正确考虑背孔填充)来计算预期的光子计数,然后将计算值与实验测量的光子计数进行比较。在实验室笔记本中记录两个光子计数作为显微镜的测试结果,以备将来参考。
注意:确保计算值和测量值彼此接近(例如,在系数 2 以内)。这种系统的定量测试对于确保随时间推移的一致成像性能特别有用。
2. 下午3点的鱼品准备
注意:在此程序中戴上手套和实验室外套。根据实验选择成年斑马鱼。在〜15分钟内完成整个准备工作(步骤2.1至2.7)。
- 准备一个培养皿,其中含有约0.5厘米的2%高熔点琼脂。在琼脂上切一个比鱼更长、稍宽的矩形孔。使用蜡将薄管(用于将水灌注到鱼的嘴里)连接到培养皿上,一端在矩形中。使用蜡将较大直径的管道(用于除水)连接到培养皿的边缘。
- 选择鱼进行实验。在Hank溶液中用0.2mg / mL三卡因溶液(pH 7.2)麻醉鱼,直到鱼完全无反应并深部麻醉。
- 将鱼侧放在湿海绵上。使用微量注射器,逆向轨道注入3μL泮库溴铵(0.4μg/ μL在Hank溶液中)以使鱼瘫痪。将鱼短暂地放入汉克的溶液中,以确保其完全瘫痪。
- 将鱼背侧朝上放在培养皿中,头部朝向管子。使用镊子操纵鱼管,轻轻张开鱼的嘴,将管子滑入口中。轻轻地将鱼滑向管子,使管子在鱼的嘴后面。
- 快速但轻轻地干燥鱼周围的琼脂,并去除鱼顶部的水。将一小块实验室组织浸入实验室胶水中,然后将组织放在鱼的两侧的琼脂上,并在鱼的后尾部到鳃上。
注意:不要推鱼或施加压力。小心避免在鳃上沾上胶水。 - 直接在头部表面涂抹一小滴布比卡因,以便在激光接触皮肤的区域成像期间麻醉鱼。
- 将带有鱼的培养皿带到显微镜下,并用鱼类设施的水填充它。将管道连接到水泵,以2 mL / min的速度将系统水泵入鱼的嘴里,并以相同的速率同时从培养皿中取出灌注溶液。确保用水用鼓泡器含氧,并用水族箱加热器加热至~30°C。
注意:鱼现在已准备好进行成像。在成像时,通过监测三次谐波产生(THG)信号中的血流来监测鱼的健康状况(见第4.1节)。3P成像还应与更复杂的鱼类制剂兼容,例如2P成像中使用的那些用于固定头部并允许在虚拟现实成像期间进行身体运动23。这种完全非侵入性的成像避免了其他脊椎动物研究中典型的颅骨切除需求,并且是朝着最大限度地减少侵入性研究和相关疼痛迈出的一步。
3. 下午3点的鼠标准备
注意:在以下过程中戴上手套、外科口罩和实验室外套。根据实验选择鼠标线。手术前应将小鼠置于12:12小时的明暗循环下。整个手术(步骤3.2-3.11)是无菌的,所有手术工具应在使用前进行消毒。开颅手术大约需要1小时。
- 将甜甜圈形(直径4.5-6.5毫米)盖玻片和盖玻片(直径5毫米)放在干净的石伞上。使用针头涂上少量光学粘合剂,将甜甜圈形盖玻片粘在盖玻片盘上。在紫外线下固化副膜上的圆盘甜甜圈盖玻片10-20分钟。从parafilm中取出整个圆盘甜甜圈盖玻片,并用镊子刮掉多余的胶水和70%乙醇以去除碎屑。
注意:盖玻片的厚度约为 0.17 毫米。甜甜圈形盖玻片用于对大脑施加适当的压力以进行慢性成像。 - 在诱导室中用3%异氟醚和20%O2气体混合物麻醉小鼠。称量鼠标重量。将鼠标放在加热垫上俯卧的位置。将加热垫的温度设置为~37°C。
- 通过放置麻醉面罩将上牙固定在立体定位器械的口孔中。将耳杆固定在耳朵上。手术期间用2%异氟醚和20%O2气体混合物维持麻醉。
注意:通过监测小鼠的反应来调整异氟醚的浓度。通过观察呼吸频率(深度睡眠约1 Hz)和捏脚来检查麻醉水平,以检查手术前的任何反应。 - 将眼药膏涂抹在眼睛上以进行润滑。闭上眼睑。打开所有手术灯。手术前根据小鼠体重皮下注射酮洛芬,地塞米松和格隆溴铵。
注意:酮洛芬,地塞米松和格隆溴铵的药物剂量分别为2mg / mL,0.1mg / mL和0.1mg / mL。酮洛芬、地塞米松和格隆溴铵的注射量取决于体重,分别为 2.5 μL/g、2 μL/g 和 2 μL/g。 - 去除头顶和耳朵附近的毛发。
- 用剪刀或理发器剪尽可能多的头发,并从手术部位取下剪掉的头发。
- 涂抹适量脱毛霜。等待 1 分钟。
- 使用浸泡在盐水中的棉签去除头发和乳霜。
- 重复步骤3.5.2和3.5.3,直到头发完全去除。
- 在皮肤上涂抹5%聚维酮碘溶液,然后70%乙醇清洁该区域。重复该过程三次。
- 在头上皮下注射阿托品(基于体重的剂量,0.02-0.05mg / kg)。等待 1 分钟。
- 切开头顶的皮肤以露出头骨。确保 bregma 点和 lambda 点都已公开。使用生物相容性胶水将边缘剩余的皮肤组织粘在颅骨上,以避免钻孔粉尘进入皮肤下方(这可能会引起免疫反应)。
- 使用手术标记在感兴趣区域上绘制一个直径为5 mm的圆圈。例如,选择边缘约2.5毫米侧向和2毫米尾部区域的中心,其覆盖了大部分躯体感觉皮层和视觉皮层。
- 沿着圆圈缓慢钻探,并在完成一半时涂抹盐水以滋润颅骨。减慢后半部分的钻孔速度,在取出颅骨之前用盐水覆盖头骨。用镊子轻轻打开颅骨,涂上一小块浸泡在盐水中的无菌明胶泡沫,以立即阻止大脑中的任何出血。使用生理盐水保持大脑水分。
- 在面向脑组织的准备好的圆盘甜甜圈盖玻片的一侧涂抹一滴盐水。将椎间盘甜甜圈盖玻片的突出椎间盘部分放入颅窗中。使用立体定位装置握住的长杆,将盖玻片颅窗的椎间盘部分轻轻按压到脑表面,确保甜甜圈部分紧紧地覆盖颅骨。用棉签擦干圆盘甜甜圈盖玻片周围的区域。
- 在甜甜圈形边缘下涂上一层生物相容性胶水。在圆盘甜甜圈盖玻片的甜甜圈部分下方和周围涂上一层牙科水泥混合物。在牙科水泥上方再涂一层胶水。在手术过程中,每小时可以皮下注射5%葡萄糖(基于体重的剂量,10μL / g),以提供动物能量。
- 关闭麻醉系统。将鼠标从立体定向装置中释放。立即将鼠标转移到定制的紧凑型立体定向装置上,在〜37°C下使用加热垫和麻醉装置。
- 将鼠标置于定制紧凑型立体定位设备的加热垫上的俯卧位。将温度设置为~37°C。 将上牙固定在立体定向装置的口孔中,并将耳杆固定在小鼠的耳朵上。穿上麻醉管,用1.5%异氟醚和20%O2气体混合物保持麻醉。
注:鼠标现在已准备好进行映像。在以下成像过程中保持鼠标麻醉。通过监测小鼠的反应来调节异氟醚的浓度。
4. 鱼和小鼠大脑的活体成像
- 斑马鱼大脑的活体成像
注意:为了正确定位物镜下的鱼脑,在与激发光相同的路径上使用二次电荷耦合器件(CCD)相机进行宽视场成像。- 设置显微镜并校准功率(如第1节所述)。
- 将低倍率(通常为4倍)物镜放在显微镜上。
- 将装有鱼和管子的培养皿置于显微镜下。
- 使用发光二极管(LED)光源照亮培养皿。
- 打开图像采集软件的 相机 模式(图2)。
- 单击" 实时"。
- 选择屏幕右侧的 通道 A 。
- 调整直方图设置以清晰地查看图像。
注意:这些需要根据需要进行更新。 - 将电机控制器上的电机 设置 设置为 "基本"。
- 降低物镜,直到鱼可见。
注:确保物镜不会与头部发生任何物理接触。 - 将鱼头的中心放在视野的中心。
- 将物镜向上移动,远离鱼头。
- 将低倍率物镜更换为3PM的高数值孔径物镜。
注意:低放大倍率镜头和高数值孔径物镜不需要是同焦的,但必须足够近,以确保鱼在高数值孔径物镜的视野内。 - 慢慢降低物镜,确保物镜不会与头部发生任何物理接触。在CCD相机软件中,当头顶可见时,停止移动物镜。将 z 位置 设置为 0 μm。
注意:使用水浸物镜时,确保物镜下没有气泡。 - 关闭LED光源并关闭系统周围的深色窗帘。
- 将成像采集软件设置为 3P成像的多光子GG 模式,并将物镜下的功率设置为小于1 mW(脉冲重复率约为1 MHz)。
- 将电机控制器上的 电机设置 按钮从 "基本 "更改为" 目标 "。
- 关掉房间里的灯。
- 打开 PMT 并打开 3PM 激励源快门。确保由于自发荧光而出现在荧光信号通道中,以及由于骨的THG而出现在THG信号通道中(图2C)。
- 在更深的成像时,通过增加功率级别在不同深度执行成像。
- 小鼠大脑的活体成像
注意:在成像过程中每小时向麻醉小鼠注射5%葡萄糖;剂量基于体重(10μL / g)。- 将成像采集软件设置为 3P成像的多光子GG 模式,并将物镜下的功率设置为小于1 mW(脉冲重复率约为1 MHz)。
注意:确保手术窗口垂直于物镜放置以减少像差。通过倾斜立体定位装置进行微调。 - 将物镜靠近窗户,在物镜和颅窗之间加水;将所有电机的轴值设置为零。
注意:在~1,700 nm处,H2O中的光吸收很大,在〜1-2 mm的水深后,这显着降低了〜1,700 nm的激光功率。对于~1,700 nm的激发,使用D2O,它在1,700 nm处具有更小的吸收,用于水浸泡以减少水的吸收。 - 单击图像采集软件中的" 实时 "按钮并打开 PMT通道,例如,一个荧光信号通道和一个THG信号通道。根据需要调整 PMT增益 和 背景电平 。
- 通过监测来自大血管和窗户玻璃表面的THG通道,缓慢向上移动物镜以定位窗口表面。如果需要,请调整窗口方向(请参阅步骤 4.2.12 中的注释)。 将电机归零 以定义大脑表面。
- 执行成像并根据成像深度调整功率级别。
- 将成像采集软件设置为 3P成像的多光子GG 模式,并将物镜下的功率设置为小于1 mW(脉冲重复率约为1 MHz)。
结果
成功完成该方案将导致具有最佳光参数(例如,脉冲持续时间,NA)和适合体内3PM 的 动物制剂的正确对齐显微镜。市售的3P设置包括适用于〜1,300 nm和〜1,700 nm的反射镜和透镜;因此,当激发波长在1,300 nm和1,700 nm之间切换时,不需要改变光学元件。如果3P设置中的透镜没有适合1,300和1,700 nm的镀膜,则需要用适当的透镜替换这些透镜以减少激光功率损耗。通过优化的3PM和适当的动物 制备,可以在 大脑深处收集体内荧光和高对比度的THG图像。
图3显示了完整成年斑马鱼的代表性3P图像。使用3PM实现成年斑马鱼大脑中遗传标记神经元的高分辨率,非侵入性和深度成像。虽然已经报道了使用2PM24,25,26,27在成年斑马鱼大脑中进行头畸脑区域的成像,但3PM可以进入整个端脑和更具挑战性或不可能使用其他技术观察的区域。在图3C中可以观察到光学结构和小脑中细胞层的分布。在成功的成像过程中,骨骼在THG通道中可见,神经元在荧光通道中可见。对于成年斑马鱼成像,显微镜的相机功能用于定位鱼(图3A)。这一步对于小鼠大脑成像不是必需的,因为玻璃窗足够大,使大脑易于接近。使用前几节中描述的系统获得了成年斑马鱼大脑的高分辨率结构图像。颅骨可见于THG通道(图3B),这有助于导航大脑并找到顶部表面。如图3C所示,神经元在成人大脑深处具有高信背景比(SBR)是可区分的。由于自发荧光,大脑上方的组织在荧光通道中是可见的。
图4显示了GCaMP6s标记神经元(绿色)和德克萨斯红色标记血管(红色)的多色3P图像以及成年小鼠大脑中的THG(蓝色)信号,激发1,340nm10。这些图像是从以前的工作10中复制的。在 图4中,焦点处的脉冲能量在整个深度保持在~1.5 nJ,以获得足够的荧光和THG信号,最大平均激光功率约为70 mW。脉冲持续时间调整为~60 fs,有效数值孔径为~0.8。通过优化3PM设置,在CA1海马区,成功地从脑表面低至1.2毫米处获得了高对比度图像(图4A,B)。 图4C,D 显示了GCaMP6s标记神经元在750μm深度进行10分钟记录的Ca2 + 活性迹线,显示出高记录保真度。
如果激发激光器未对准,则可能会观察到整个视场的信号亮度不均匀。此外,如果激光参数(例如脉冲持续时间,聚焦时的激发脉冲能量和有效NA)未得到优化,则来自鱼头骨或小鼠大脑开颅窗的THG图像将不可见和/或需要高激发脉冲能量(例如,聚焦时>2 nJ /脉冲)。因此,在开始深部组织成像之前,脑表面的THG信号可以用作优化3PM设置的指标。
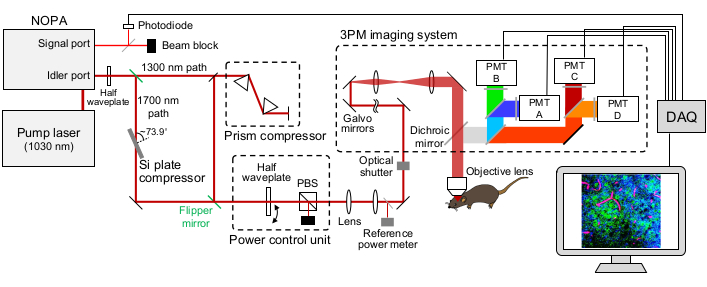
图 1:下午 3点设置的示意图。激发激光器的波长设置为~1,300 nm或~1,700 nm,从NOPA的惰轮端口输出。棱镜对压缩机和硅板压缩机分别用于~1,300 nm和~1,700 nm激光器,以预切激发激光脉冲。~1,300 nm 和 ~1,700 nm 激光束可通过翻转镜进行切换。NOPA的信号端口用于获取触发信号。半波片和PBS用于控制激励功率。荧光和THG由GaAsP PMT检测,二向色镜和带通滤光片的适当组合用于分离荧光和THG信号。缩写:3PM = 三光子显微镜;NOPA = 非共线光学参数放大器;PBS = 偏振分束器;THG = 三次谐波产生;数据采集 = 数据采集;PMT = 光电倍增管。请点击此处查看此图的大图。
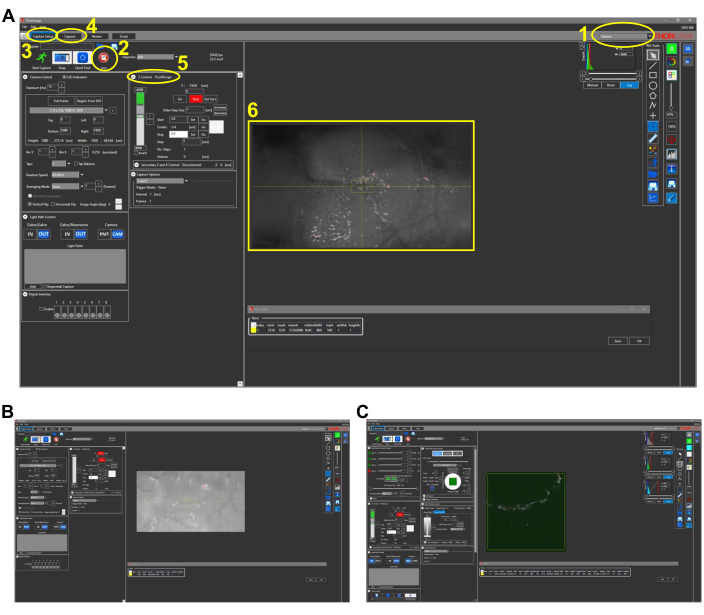
图2:鱼类活体成像的代表性屏幕截图(协议第4.1节)。(A)图像采集软件的相机模式视图,其中4x物镜就位。该软件的主要特点概述和编号如下:1.图像采集软件的成像模式。模式选项包括"相机"、"多光子"和"多光子 GG"。对于使用CCD相机进行白光成像,请选择相机模式。2.单击"实时"按钮打开相机(如果采用多光子选项,则打开PMT),可以观察显微镜的实时视图。3. 在"捕捉设置"选项卡中,设置所需的成像参数(功率、位置、深度)。4. 在"捕获"选项卡中,为要保存的图像分配了一个文件夹位置。可以在此选项卡中启动映像。 5.Z 控制设置通过移动 z 载物台电机来控制成像深度。6.斑马鱼头部的代表性图像。头部的喙侧位于左侧。(B) 25倍物镜相机模式的代表性视图。(C)多光子GG模式的代表性视图,其中包含(B)中所见图像的THG图像。缩写:CCD = 电荷耦合器件;PMT = 光电倍增管;THG = 三次谐波产生。请点击此处查看此图的大图。
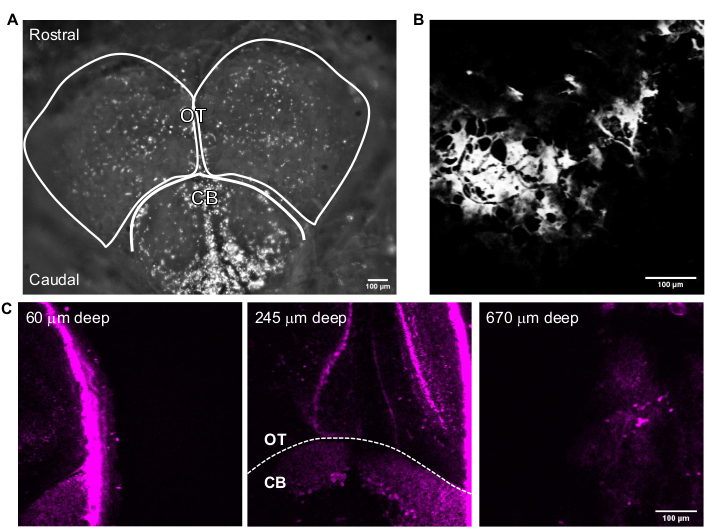
图3:用图像采集软件获取的成年斑马鱼大脑的代表性图像。 (A)用4倍物镜采集成年斑马鱼头部的相机模式图像。图像的顶部是臀部方向。概述了OT波瓣和CB。(B)在 多光子GG 模式下用含有(A)的THG图像的25倍物镜获得的代表性图像。(C)成年斑马鱼大脑在小脑和视构造的交点处的荧光图像,其中GFP在不同深度的神经元细胞质中表达。比例尺 = 100 μm。缩写:OT = 光学泰坦;CB = 小脑;THG = 三次谐波产生;GFP = 绿色荧光蛋白。 请点击此处查看此图的大图。
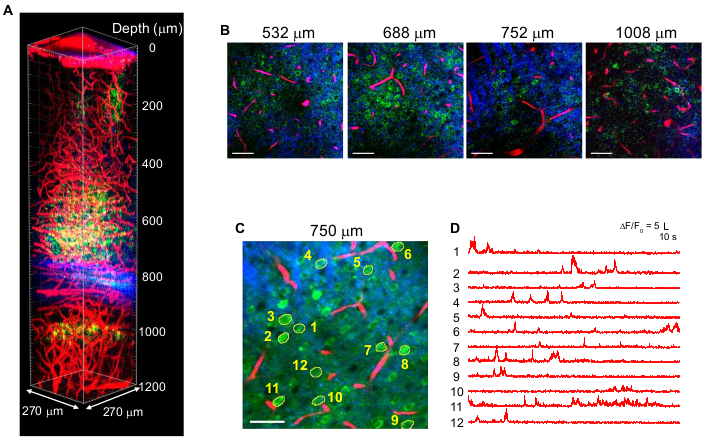
图4:在小鼠大脑中激发1,340nm时,GCaMP6s标记神经元(绿色),德克萨斯红色标记血管(红色)和三次谐波生成(蓝色)的多色 3 PM。激光功率根据成像深度而变化,以在焦点处保持~1.5 nJ脉冲能量。物镜下的最大平均功率为70 mW。(B)在各种成像深度下选择的2D图像。(C) 活动记录点,位于硬脑膜下方750微米处,视场为270×270微米(256×256像素)。(D)在清醒的小鼠中记录的自发性脑活动痕迹来自(C)中指示的标记神经元。帧速率为8.3 Hz,像素停留时间为0.51 μs。激光重复率为2 MHz,物镜下的平均功率为56 mW。每条迹线都归一化到其基线,并使用0.72 s时间常数的hamming窗口进行低通滤波。比例尺 = 50 μm。此图和图例从 10 中复制。缩写:3PM = 三光子显微镜。请点击此处查看此图的大图。
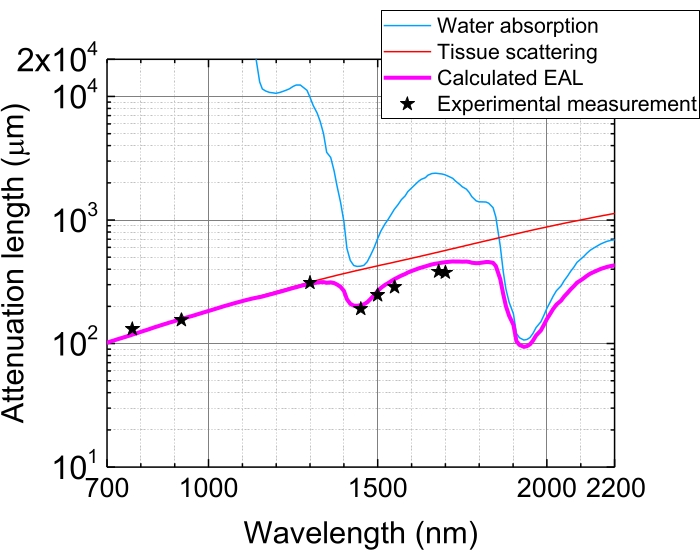
图5:小鼠大脑新皮层的有效衰减长度。EAL(洋红色线)是根据组织散射(红线)和组织中的吸水率(蓝线)计算的,假设75%的水组成。黑色的星星表明EAL在小鼠大脑新皮层3,21,28,29中报告的实验数据。请注意,EAL在不同的组织中有所不同。缩写:EAL = 有效衰减长度。请点击此处查看此图的大图。
| 激发波长 (海里) | 浸水 | 最大激光功率 (兆瓦) | 聚焦时的最大脉冲能量* (新泽西州) | 小鼠皮层中的典型 EAL (微米) | 小鼠皮层成像深度** (毫米) | 物镜下的脉冲能量*** (新泽西州) | 最大激光重复率**** (兆赫) |
| 1300 | H2O 或 D2O |
 100 100 |
 2 2 | ~300人 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210人 | ~0.5 | |||||
| 2.1 | ~1100 | ~0.1 | |||||
| 1700 | D2O |
 50 50 |
 3 3 | ~400人 | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2,5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~190 | ~0.3 |
表1:小鼠皮层成像的典型3 P激发条件。
*具有高NA(〜1.0)物镜,脉冲宽度约为50 fs,以及典型的荧光团,例如荧光蛋白(例如GFP和RFP)。
**假设EAL在整个皮层中是均匀的。
为了在聚焦时达到~1 nJ/脉冲,根据EAL和成像深度计算。
根据物镜下的脉冲能量和最大允许激光功率计算得出。
缩写:3P = 三光子;NA = 数值孔径;GFP = 绿色荧光蛋白;RFP = 红色荧光蛋白;EAL = 有效衰减长度。
讨论
该协议解释了使用商用显微镜和激光源设置3P成像的分步程序。与2PM相比,3PM在需要光学访问的更深层区域(如小鼠脑海马体)中具有优势。虽然3PM主要用于神经科学,但3PM可以潜在地应用于其他组织,如淋巴结,骨骼和肿瘤,以进行深部组织观察。
重要的是要验证成像系统在接近散粒噪声极限的情况下运行,这确保了检测和数据采集电子设备在PMT之后对图像的噪声贡献可以忽略不计。检测到的光子数量的不确定性从根本上受到光子散粒噪声的限制。在典型的多光子显微镜中,使用高增益光电探测器(例如,PMT)可以实现散粒噪声受限性能。光子散粒噪声遵循泊松统计分布,其中分布的标准差等于分布均值的平方根。要验证散粒噪声受限性能,请按照协议部分中的步骤 1.14 操作。
为了避免H2O的光衰减,使用D2O进行浸渍是有帮助的,特别是对于~1,700nm的激发。当使用D2O时,必须每〜10分钟刷新D2O或使用大量D2O以避免在成像过程中更换D2O / H2O。还可以将D2O与室内环境隔离3。如果使用长工作距离(WD)物镜(例如,4毫米或更长的WD)进行成像,浸入液厚度可能超过2-3毫米。增加的厚度使得H2O吸收即使在〜1,300 nm21下也不可忽略不计。因此,当使用长 WD 物镜时,即使对于 1,300 nm 3PM,D2O 也可能是必需的。
由于3P荧光强度取决于焦点处激发脉冲能量的立方体(等式(1)),因此设置适当的激光功率对于获得足够的3P荧光信号同时避免活组织中的热和非线性损伤尤为重要。平均激光功率应保持在热损伤阈值以下。例如,在小鼠大脑中,为了避免热组织损伤,小鼠脑表面上的平均功率应保持在~100 mW或以下,以便在1 mm的深度下激发〜1,300nm,视场(FOV)为230μm x 230μm21。同样,~1,700 nm处的平均功率应保持在~1 mm深度处或低于~50 mW,FOV应保持在~230 μm x 230 μm(未发表的数据)。此外,为避免激发饱和和潜在的非线性损伤,对于~1,300 nm和 ~1,700 nm激发,激励脉冲能量应分别保持在
~1,700 nm激发,激励脉冲能量应分别保持在 2 nJ和3 nJ。
2 nJ和3 nJ。
由于组织中的光吸收和散射,在组织穿透1 EAL后,聚焦处的脉冲能量衰减至1/e(~37%)。EAL在不同的组织和激发波长中变化,例如,在小鼠大脑的新皮层中,EAL在〜1,300nm和〜1,700nm处分别为〜3,29〜300μm和〜400μm(图5)。因此,为了在n个EAL的深度上保持相同的脉冲能量(例如,1 nJ /脉冲),需要将表面脉冲能量乘以1 nJ×en。为了对结构和功能动力学进行快速成像,需要具有高重复率(在1 MHz或更高频率下)的激发激光器来实现5,6,7,10的高帧速率。然而,脉冲能量要求和平均激光功率极限限制了适用的重复频率。
例如,当我们在4个EAL处成像一个中等深度的区域时(即,在1,300 nm激发的小鼠皮层中为~1.2 mm),表面需要~55 nJ /脉冲才能在焦点处保持1 nJ /脉冲。当平均功率限制为100 mW时,我们可以应用~2 MHz的激光重复率。然而,要在7个EAL的深度下进行更深的成像,需要在表面约1,100 nJ /脉冲才能在焦点处保持1 nJ /脉冲。假设最大平均功率为100 mW以避免热损伤,激光重复频率应降低至0.1 MHz,以在表面实现1,100 nJ /脉冲。 表 1总结了小鼠大脑皮层的典型成像条件。请注意, 表 1中的成像深度假设EAL在整个小鼠皮层中是均匀的。
此外,由于深部组织3PM中的激光功率限制,在帧速率和图像像素大小之间存在权衡,这对于钙成像等功能成像尤为重要。每个深度的最大可用激光重复率是根据聚焦时所需的脉冲能量和如上所述的适用平均激光功率决定的,例如,在深度相当于1,300nm激发的~4个EAL的深度下为2 MHz。通常,成像需要每个像素至少一个脉冲。因此,最小可用像素停留时间由激光重复率决定,例如,0.5 μs/像素,2 MHz激励。
为了在3P图像中保持高空间分辨率(横向约1μm),理想情况下将1像素设置为〜1μm 2的面积,例如,对于250 x 250μm 2的FOV,设置为256 x256像素。因此,要使用相当大的视场(例如,250 x 250 μm2,256 x 256 像素)、0.5 MHz、1 MHz 和 2 MHz 脉冲重复率执行快速成像,理论最大帧速率分别为 ~7.6、~15 和 ~30 帧/秒。同样,根据目标深度、扫描速度和视场,优化激光重复率也至关重要,以便在热损伤阈值下施加足够的脉冲能量。为了提高成像速度,自适应激发源可以通过按需向神经元31传递激光脉冲来将所有激发脉冲集中在神经元(即感兴趣区域)上。
与2PM相比,在活组织内通过高度散射介质(例如颅骨,骨骼和小鼠大脑的外囊)的深部成像中为2PM相比是有利的。较长的EAL和3PE的高阶非线性激发有利于深部组织成像。例如,为了在小鼠皮层中对GCaMP6进行成像,920nm激发的2P荧光信号高于在690μm的  浅区域激发1,300nm的3P荧光信号(即,1,300nm处的~2.3 EAL)21。然而,由于在1,300 nm处的EAL比920 nm更长,因此3PE在~690μm的深度和更深的21nm处比2P激发(2PE)具有更强的荧光。该深度被定义为"信号交叉深度",其中2PE和3PE的荧光信号强度相同,具有相同的重复率和相同的最大允许平均功率21。信号交叉深度取决于2PE和3PE的激发波长以及荧光团。
浅区域激发1,300nm的3P荧光信号(即,1,300nm处的~2.3 EAL)21。然而,由于在1,300 nm处的EAL比920 nm更长,因此3PE在~690μm的深度和更深的21nm处比2P激发(2PE)具有更强的荧光。该深度被定义为"信号交叉深度",其中2PE和3PE的荧光信号强度相同,具有相同的重复率和相同的最大允许平均功率21。信号交叉深度取决于2PE和3PE的激发波长以及荧光团。
在实践中,由于吸水率较低,920 nm激发允许比1,300 nm激发更高的平均激光功率。然而,2PE的较高平均功率只会将信号交叉深度推高0.9 EAL4。此外,当样品被密集标记时,3PE具有更高的SBR的额外优势。因此,即使在达到信号交叉长度之前,3PM也可以比2PM更适合成像。例如,当对小鼠脑血管系统进行成像时,其体积分数(即标记密度)为〜2%,1,300nm 3PM,100 mW激发功率优于920nm 2PM,在〜700μm深度下具有200mW激发功率的荧光素。
当通过薄但高度散射的层成像时,3PM也有一个优势,该层可能会扭曲激发光束的点扩散函数并产生散焦背景4。例如,通过小鼠大脑的完整头骨,即使在距离大脑表面13<100μm的浅深度处,2PM图像也会遭受散焦背景的影响。在2PM中观察到类似的散焦背景,通过小鼠大脑32中的白质激发1,280nm。因此,当通过浑浊层对组织进行成像时,无论标记密度如何,高对比度成像的3PM优于2PM。
我们最近报道了一个磁珠幻像和理论分析,表明3PM的成像深度极限超过8个EAL33;8个EAL相当于〜3 mm,小鼠皮层激发〜1,700 nm。然而,目前可用的激光没有足够的脉冲能量在小鼠大脑中达到8个EAL。更强激光器的进一步发展将推动当前3PM的成像深度极限。
披露声明
作者声明没有相互竞争的利益。
致谢
这项工作得到了NSF DBI-1707312 Cornell NeuroNex Hub和NIH 1U01NS103516的支持。
材料
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
参考文献
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。