Method Article
Microscopia a fluorescenza a tre fotoni nei tessuti profondi nel cervello intatto di topo e zebrafish
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La microscopia a tre fotoni consente l'imaging a fluorescenza ad alto contrasto in profondità nei tessuti biologici viventi, come il cervello di topo e zebrafish, con un'elevata risoluzione spaziotemporale.
Abstract
Le tecniche di microscopia multifotonica, come la microscopia a due fotoni (2PM) e la microscopia a tre fotoni (3PM), sono potenti strumenti per l'imaging in vivo dei tessuti profondi con risoluzione subcellulare. 3PM ha due principali vantaggi per l'imaging dei tessuti profondi rispetto alle 2PM che è stato ampiamente utilizzato nei laboratori di biologia: (i) lunghezza di attenuazione più lunga nei tessuti a dispersione impiegando ~ 1.300 nm o ~ 1.700 nm laser di eccitazione; (ii) minore generazione di fluorescenza di fondo a causa dell'eccitazione non lineare di ordine superiore. Di conseguenza, 3PM consente l'imaging strutturale e funzionale ad alto contrasto in profondità all'interno di tessuti sparsi come il cervello di topo intatto dagli strati corticali all'ippocampo e l'intero proencefalo del pesce zebra adulto.
Oggi, le sorgenti laser adatte per le 3PM sono disponibili in commercio, consentendo la conversione di un sistema di imaging a due fotoni (2P) esistente in un sistema a tre fotoni (3P). Inoltre, sono disponibili più microscopi 3P commerciali, il che rende questa tecnica prontamente disponibile per i laboratori di ricerca biologica. Questo documento mostra l'ottimizzazione di una tipica configurazione 3PM, in particolare rivolta ai gruppi di biologia che hanno già una configurazione 2P, e dimostra l'imaging 3D intravitale in cervelli di topi e pesci zebra adulti intatti. Questo protocollo copre l'intera procedura sperimentale di imaging 3P, incluso l'allineamento al microscopio, il prechirping di impulsi laser ~ 1.300 e ~ 1.700 nm, la preparazione animale e l'imaging intravitale a fluorescenza 3P in profondità nel cervello adulto di zebrafish e topo.
Introduzione
Nelle scienze della vita, le tecniche di microscopia multifotonica (MPM), come 2PM e 3PM, sono stati potenti strumenti per l'imaging in vivo profondo con alta risoluzione spaziotemporale e alto contrasto nei tessuti a dispersione. Inoltre, questi metodi causano meno fotosbiancamento rispetto alla microscopia confocale a un fotone 1,2,3,4. Il 3PM è vantaggioso per l'imaging dei tessuti più profondi rispetto al 2PM a causa di due caratteristiche principali: (i) l'impiego di eccitazione a lunghezza d'onda più lunga (~ 1.300 nm o ~ 1.700 nm) riduce la dispersione dei tessuti e (ii) il processo di eccitazione di ordine superiore (cioè, il segnale di fluorescenza dipende dal cubo del potere di eccitazione in 3PM invece del quadrato del potere di eccitazione in 2PM) che sopprime la fluorescenza di fondo indesiderata3 . Di conseguenza, 3PM consente l'imaging ad alto contrasto in regioni più profonde nei tessuti viventi come l'ippocampo in un cervello di topo adulto intatto 3,5,6,7,8,9,10,11 e l'intero proencefalo del pesce zebra adulto12, incluso Ca2+ registrazione dell'attività e osservazioni multicolore. Inoltre, immagini ad alto contrasto sono state ottenute con 3PM attraverso i crani intatti del topo e del pesce zebra adulto12,13.
Oggi, le sorgenti laser di eccitazione adatte per l'eccitazione 3P (3PE) a ~ 1.300 e ~ 1.700 nm sono disponibili in commercio. Poiché il sistema di scansione laser è essenzialmente lo stesso per le 14:00 e le 15:00, la conversione di una configurazione 2P esistente in una configurazione 3P è possibile nei laboratori di biologia con l'installazione di un laser disponibile in commercio per 3PE. Il segnale di fluorescenza 3P dipende dalla potenza del laser, dalla durata dell'impulso, dalla frequenza di ripetizione del laser e dall'apertura numerica (NA) della lente dell'obiettivo. Supponendo una messa a fuoco limitata alla diffrazione (cioè, l'apertura posteriore dell'obiettivo è sovraffollata dal fascio di eccitazione), Eq (1) descrive il flusso di fotoni di fluorescenza media nel tempo dal volume focale risultante da 3PE.
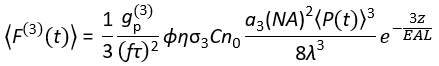 (1)
(1)
Dove f è la velocità di ripetizione del laser, τ è la durata dell'impulso laser (larghezza intera a metà massimo), φ è l'efficienza di raccolta del sistema, η è l'efficienza quantistica della fluorescenza, σ3 è la sezione trasversale di assorbimento 3P, C è la concentrazione di fluoroforo, n0 è l'indice riflettente del mezzo campione (ad esempio, acqua), λ è la lunghezza d'onda di eccitazione nel vuoto, NA è l'apertura numerica della lente dell'obiettivo, un3 è la costante di integrazione spaziale del volume focale, 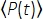 è il flusso di fotoni di eccitazione media nel tempo (fotoni / s) sotto l'obiettivo obiettivo, z è la profondità dell'immagine e EAL è la lunghezza di attenuazione effettiva14. Qui abbiamo ipotizzato che l'EAL (tipicamente > 100 μm) sia molto maggiore della risoluzione assiale del microscopio (tipicamente < 10 μm). Sotto approssimazione paraassiale, un3 è uguale a 28,114. gp(3) è la coerenza temporale del 3° ordine della sorgente di eccitazione, e gp(3) è 0,41 e 0,51 rispettivamente per gli impulsi iperbolico-secante-quadrati e gli impulsi gaussiani. L'efficienza di raccolta φ può essere stimata considerando la raccolta di fluorescenza da parte della lente obiettivo, la trasmittanza della lente dell'obiettivo, la riflettività dello specchio dicroico, la trasmittanza dei filtri e l'efficienza di rilevamento del rivelatore (ad esempio, tubo fotomoltiplicatore o PMT). Poiché l'intensità di fluorescenza 3P dipende fortemente da vari parametri, è necessaria l'ottimizzazione della configurazione 3P per massimizzare i segnali di fluorescenza 3P.
è il flusso di fotoni di eccitazione media nel tempo (fotoni / s) sotto l'obiettivo obiettivo, z è la profondità dell'immagine e EAL è la lunghezza di attenuazione effettiva14. Qui abbiamo ipotizzato che l'EAL (tipicamente > 100 μm) sia molto maggiore della risoluzione assiale del microscopio (tipicamente < 10 μm). Sotto approssimazione paraassiale, un3 è uguale a 28,114. gp(3) è la coerenza temporale del 3° ordine della sorgente di eccitazione, e gp(3) è 0,41 e 0,51 rispettivamente per gli impulsi iperbolico-secante-quadrati e gli impulsi gaussiani. L'efficienza di raccolta φ può essere stimata considerando la raccolta di fluorescenza da parte della lente obiettivo, la trasmittanza della lente dell'obiettivo, la riflettività dello specchio dicroico, la trasmittanza dei filtri e l'efficienza di rilevamento del rivelatore (ad esempio, tubo fotomoltiplicatore o PMT). Poiché l'intensità di fluorescenza 3P dipende fortemente da vari parametri, è necessaria l'ottimizzazione della configurazione 3P per massimizzare i segnali di fluorescenza 3P.
Questo protocollo illustra il processo di ottimizzazione di una tipica configurazione 3P, che sarà utile in particolare per i laboratori di biologia che hanno una configurazione 2P e prevedono di espandere la sua capacità all'imaging 3P o di mantenere la loro configurazione 3P commerciale a prestazioni ottimali. Questo articolo video dimostra anche l'imaging 3P dei tessuti profondi nel cervello animale vivente. La prima sezione affronta l'ottimizzazione di una tipica configurazione 3P con una sorgente laser disponibile in commercio e un microscopio multifotone. La seconda e la terza sezione descrivono la preparazione del pesce zebra e del topo, rispettivamente, per le 15:00 delle strutture e delle attività neuronali. La chirurgia della craniotomia del topo è stata precedentemente riportata in documenti di protocollo e 15,16,17. La quarta sezione dimostra l'imaging 3P intravitale nel cervello di zebrafish e topo.
Protocollo
Tutte le procedure di sperimentazione animale e di stabulazione per pesci zebra e topi sono state approvate e condotte in conformità con le linee guida del Comitato istituzionale per la cura e l'uso degli animali (IACUC) della Cornell University. Zebrafish e topi sono stati eutanasizzati da soluzione di tricaina ad alta concentrazione e asfissia di anidride carbonica, rispettivamente, dopo l'esperimento.
1. Ottimizzazione della configurazione della microscopia a tre fotoni
NOTA: Indossare occhiali di sicurezza laser per la protezione degli occhi. Bloccare il raggio laser con un beam blocker quando l'ottica viene posizionata o spostata. Per visualizzare il laser, utilizzare un visualizzatore a infrarossi o una scheda rilevatore a infrarossi.
- Accendere il laser e impostare la lunghezza d'onda centrale dell'uscita inattiva dell'amplificatore ottico parametrico non collinoso (NOPA) a ~ 1.300 nm o ~ 1.700 nm.
- Posizionare un vetro di copertura sottile sulla linea di fascio dalla porta del segnale di NOPA (cioè ~ 700-900 nm) per riflettere una piccola frazione del raggio laser su un fotodiodo Si per ottenere segnali di attivazione (Figura 1). Posizionare un bloccave nel percorso di trasmissione del vetro di copertura.
- Posizionare i compressori a impulsi sul percorso della luce per prechirpare il laser a femtosecondi per ottimizzare la durata dell'impulso per le 15:00. Per un raggio di ~ 1.300 nm, posizionare un compressore a coppia di prismi 18,19 (ad esempio, coppie di prismi N-SF11). Per un laser ~1.700 nm, posizionare una piastra Si di ~3 mm nello spessore20. Impostare l'angolo tra la piastra Si e il percorso laser all'angolo di Brewster (~ 73,9 ° per 1.700 nm) per massimizzare la trasmissione laser. Ruotare la piastra Si per ottenere l'angolo di Brewster riducendo al minimo il riflesso.
- Posiziona gli specchietti retrovisori per consentire una comoda commutazione tra le linee del fascio ~ 1.300 nm e ~ 1.700 nm.
- Posizionare una mezza piastra d'onda (ad esempio, una mezza piastra d'onda acromatica adatta per ~ 1.300 e ~ 1.700 nm) montata su uno stadio di rotazione e uno splitter a fascio polarizzante (PBS) per controllare l'intensità del laser. Posizionate un bloccatore del fascio nel percorso di riflessione del PBS.
NOTA: il laser deve passare attraverso il PBS perpendicolarmente per ottenere un elevato rapporto di estinzione. La potenza del laser per le 15:00 è controllata ruotando la mezza piastra d'onda. - Posizionare un vetro di copertura sottile nel percorso della luce dopo il controller di alimentazione e prima dell'otturatore ottico per riflettere una piccola frazione del raggio laser a un misuratore di potenza. Utilizzare il misuratore di potenza come "misuratore di potenza di riferimento" per calcolare la potenza del laser sotto l'obiettivo durante l'imaging (vedere il passaggio 1.12).
- Allineare il percorso laser regolando gli specchi per propagare il raggio nel sistema 3PM.
- Misurare la dimensione del fascio nella posizione dell'apertura posteriore dell'obiettivo utilizzando un bordo a coltello su uno stadio di traslazione e un misuratore di potenza. Assicurarsi che la dimensione del fascio non sia troppo piccola o troppo grande.
NOTA: in genere, il fascio sottoriempe leggermente la lente dell'obiettivo NA elevato per ottenere una produttività ad alta potenza per l'imaging dei tessuti profondi. Ad esempio, una dimensione del fascio di ~ 10-13 mm (1 / e2) all'apertura posteriore dell'obiettivo Olympus (~ 15 mm di diametro dell'apertura posteriore) aiuta a raggiungere un NA effettivo di ~ 0,7-0,9. Quando la dimensione del fascio è troppo piccola, il segnale 3P diventa debole e la risoluzione spaziale peggiora a causa del NA basso effettivo. Quando la dimensione del fascio è troppo grande, la massima potenza di eccitazione disponibile sotto l'obiettivo diventa debole a causa della perdita di potenza all'apertura posteriore dell'obiettivo. Per l'imaging dei tessuti profondi, i raggi marginali subiscono anche una perdita maggiore a causa del percorso più lungo nel tessuto. - Se la dimensione del fascio all'apertura posteriore dell'obiettivo non è appropriata, posizionare gli elementi ottici appropriati, come le lenti convesse, nel percorso del raggio laser per regolare la dimensione del fascio.
NOTA: assicurarsi che il raggio laser non sia più grande degli specchi galvo per evitare inutili perdite di potenza. - Posizionare l'obiettivo sulla configurazione 3PM.
- Misurare la durata dell'impulso dopo l'obiettivo utilizzando un autocorrelatore. Regolare il compressore di impulsi per ottenere impulsi più brevi se la durata dell'impulso è troppo lunga (ad esempio, >70 fs). Utilizzare impulsi ~ 50-70 fs per le 15:00 e un interferometro Michelson posizionato tra il laser e l'obiettivo per fornire il ritardo per le misurazioni di autocorrelazione.
NOTA: Un fotodiodo con una risposta spettrale adeguata (ad esempio, un fotodiodo di silicio per una lunghezza d'onda superiore a 1.200 nm) posto al centro dell'obiettivo può comodamente servire come rivelatore non lineare e la fotocorrente a due fotoni dal fotodiodo può essere utilizzata per ottenere le tracce di autocorrelazione20. Il compressore a coppia di prismi per ~ 1.300 nm può essere regolato in due modi: (1) cambiando la distanza tra i due prismi; (2) modificare le lunghezze di percorso del raggio laser nel vetro del prisma spostando il prisma o i prismi perpendicolarmente alla linea di base del prisma. Il compressore a piastra Si per ~ 1.700 nm può essere regolato sostituendo la piastra Si con una piastra Si più spessa o più sottile. - Posizionare un misuratore di potenza all'uscita dell'obiettivo. Misurare la potenza del laser sotto l'obiettivo e leggere il valore del misuratore di potenza di riferimento (dal passaggio 1.6). Calcola il rapporto tra la potenza sotto l'obiettivo e al misuratore di potenza di riferimento.
NOTA: durante l'imaging, la potenza effettiva del laser sotto l'obiettivo può essere calcolata dal rapporto di potenza e dal valore del misuratore di potenza di riferimento. - Estrarre il misuratore di potenza da sotto l'obiettivo.
- [Opzionale] Verificare le prestazioni limitate del rumore di ripresa fotonica del sistema di imaging
NOTA: per eseguire questa attività, sono necessari i seguenti elementi: 1) un pool di coloranti fluorescein o Texas Red (ad esempio, ~ 10 μM), 2) un contatore di fotoni e 3) un oscilloscopio.- Posizionare il campione del pool di coloranti sotto l'obiettivo 3PM.
- Abbassare con attenzione la lente dell'obiettivo sul pool di coloranti fino a quando la distanza non è inferiore alla distanza di lavoro della lente dell'obiettivo.
- Posizionare l'acqua tra la lente e il vetro di copertura della piscina di tintura.
- Impostare la potenza di uscita del microscopio su una piccola quantità (ad esempio, <1 mW con frequenza di ripetizione dell'impulso di ~ 1 MHz) per individuare la superficie del pool di coloranti.
- Avviare la sessione Live del microscopio e impostare la posizione z su zero.
- Spostare lentamente l'obiettivo lontano dal campione per raggiungere la parte superiore del pool di coloranti (come indicato dalla terza generazione armonica (THG) prodotta dal vetro di copertura).
- Impostare la posizione z su zero nella posizione del vetro di copertura.
- Abbassare leggermente l'obiettivo fino a quando un chiaro segnale di fluorescenza è visibile nel canale di fluorescenza.
- Collegare l'uscita del PMT a uno splitter BNC. Collegare le uscite del divisore al contatore di fotoni e al sistema di acquisizione delle immagini.
- Impostare la potenza del laser su un valore in cui i conteggi dei fotoni al secondo sono inferiori al 5% della frequenza di ripetizione del laser (ad esempio,
 50.000 fotoni / s quando viene utilizzato un laser a 1 MHz).
50.000 fotoni / s quando viene utilizzato un laser a 1 MHz). - Riduci il campo visivo al minimo possibile con il software e assicurati che la luminosità sia uniforme in tutta l'immagine.
- Impostare la frequenza fotogrammi su 1,0 fotogrammi al secondo.
- Impostare il periodo di acquisizione del contatore di fotoni su t = numero di pixel per fotogramma × tempo di permanenza dei pixel e un livello di discriminante appropriato.
- Raccogli il conteggio dei fotoni e i conteggi dei pixel contemporaneamente per un periodo equivalente. Per ottenere il numero di pixel, raccogliere i valori medi dei pixel dell'intera immagine, nonché i valori di deviazione media e standard.
- Ripetere il passaggio 1.14.14, bloccando il laser di eccitazione per ottenere il conteggio dei fotoni scuri e il conteggio dei pixel.
- Interrompere l'acquisizione Live del software.
- Sottrarre i conteggi scuri (ottenuti nel passo 1.14.15) dai conteggi dei fotoni (ottenuti nel passo 1.14.14) e dal conteggio totale dei pixel (ottenuto nel passo 1.14.14).
- Dividere il numero totale di pixel sottratti al buio per il conteggio dei fotoni sottratti al buio (ottenuto nel passaggio 1.14.17). Usa il valore ottenuto come "fattore di conversione" (cioè valori di pixel / fotone) da un valore di pixel a un conteggio di fotoni.
- Convertire la deviazione media e standard dei conteggi dei pixel (ottenuti nel passaggio 1.14.14) in conteggi di fotoni, cioè dividendoli per il "fattore di conversione" (ottenuto nel passaggio 1.14.18). Confronta la deviazione media e standard dei conteggi dei fotoni. Assicurarsi che la deviazione standard sia approssimativamente uguale alla radice quadrata della media dei conteggi dei fotoni se le prestazioni del sistema di imaging sono vicine al limite del rumore di ripresa.
- [Opzionale] Verificare l'efficienza di rilevamento del segnale del microscopio.
- Per testare le prestazioni del microscopio e l'efficienza di rilevamento del segnale, seguire i passaggi 1.14.1-1.14.17 per ottenere la conta dei fotoni. Per il passaggio 1.14.15, creare un campione bianco costituito dal solvente per il colorante e ottenere i conteggi dei fotoni per il campione bianco con il laser acceso e alla stessa potenza del pool di coloranti. Sottrarre i conteggi vuoti dai conteggi dei fotoni dal pool di coloranti per ottenere i conteggi dei fotoni di fluorescenza.
- Utilizzare le sezioni trasversali 3P note di fluoresceina o Texas Red10,22 e Eq. (1) (con un NA efficace per tenere conto del riempimento dell'apertura posteriore correttamente) per calcolare i conteggi di fotoni attesi e quindi confrontare il valore calcolato con i conteggi di fotoni misurati sperimentalmente. Registrare entrambi i conteggi dei fotoni nel quaderno di laboratorio come risultati dei test per il microscopio per riferimenti futuri.
NOTA: assicurarsi che i valori calcolati e misurati siano vicini l'uno all'altro (ad esempio, entro un fattore 2). Tali test quantitativi del sistema sono particolarmente utili per garantire prestazioni di imaging coerenti nel tempo.
2. Preparazione del pesce per le 15:00
NOTA: indossare guanti e un camice da laboratorio per questa procedura. Scegli il pesce zebra adulto in base all'esperimento. Completa l'intera preparazione (passaggi da 2.1 a 2.7) entro ~ 15 min.
- Preparare una capsula di Petri con ~ 0,5 cm di agar ad alto punto di fusione al 2%. Tagliare un foro rettangolare nell'agar più lungo e leggermente più largo del pesce. Usa la cera per attaccare tubi sottili (per la perfusione di acqua nella bocca del pesce) alla capsula di Petri con un'estremità nel rettangolo. Utilizzare la cera per attaccare tubi di diametro maggiore (per la rimozione dell'acqua) al bordo della capsula di Petri.
- Scegli il pesce per l'esperimento. Anestetizzare il pesce con 0,2 mg/mL di soluzione di tricaina (pH 7,2) nella soluzione di Hank fino a quando il pesce non risponde completamente e profondamente anestetizzato.
- Metti il pesce su un lato su una spugna bagnata. Usando una microsiringa, iniettare retro-orbitalmente 3 μL di bromuro di pancuronio (0,4 μg / μL nella soluzione di Hank) per paralizzare il pesce. Metti brevemente il pesce nella soluzione di Hank per assicurarti che sia completamente paralizzato.
- Posizionare il pesce dorsale lateralmente verso l'alto nella capsula di Petri con la testa verso il tubo. Usando una pinza per manipolare il tubo, apri delicatamente la bocca del pesce e fai scorrere il tubo in bocca. Far scorrere delicatamente il pesce verso il tubo in modo che il tubo sia nella parte posteriore della bocca del pesce.
- Asciugare rapidamente ma delicatamente l'agar intorno al pesce e rimuovere l'acqua sopra il pesce. Immergere un piccolo pezzo di tessuto di laboratorio nella colla da laboratorio e mettere il tessuto sull'agar su entrambi i lati del pesce e sopra la schiena del pesce caudale alle branchie.
NOTA: non spingere sul pesce o esercitare pressione. Fai attenzione a evitare di ottenere colla sulle branchie. - Applicare una piccola goccia di bupivacaina direttamente sulla superficie della testa per anestetizzare il pesce durante l'imaging nella regione in cui il laser contatterà la pelle.
- Portare la capsula di Petri con il pesce al microscopio e riempirla con acqua di impianto di pesce. Collegare il tubo a una pompa dell'acqua per pompare l'acqua del sistema a 2 ml / min nella bocca del pesce e contemporaneamente rimuovere la soluzione di perfusione dal piatto alla stessa velocità. Assicurarsi che l'acqua sia ossigenata con un gorgogliatore e riscaldata a ~ 30 ° C con un riscaldatore per acquari.
NOTA: il pesce è ora pronto per l'imaging. Monitorare la salute del pesce monitorando il flusso sanguigno nel segnale di terza generazione armonica (THG) durante l'imaging (vedere paragrafo 4.1). L'imaging 3P dovrebbe anche essere compatibile con preparazioni di pesci più sofisticate come quelle utilizzate nell'imaging 2P per fissare la testa e consentire i movimenti del corpo durante l'imaging durante la realtà virtuale23. Questa imaging completamente non invasivo evita la necessità di rimozione del cranio come è tipico in altri studi sui vertebrati ed è un passo verso la riduzione al minimo della ricerca invasiva e del dolore associato.
3. Preparazione del mouse per le 15:00
NOTA: indossare guanti, maschera chirurgica e camice da laboratorio durante le seguenti procedure. Scegli la linea del mouse in base all'esperimento. Il mouse deve essere alloggiato sotto un ciclo di 12:12 ore luce-buio prima dell'intervento chirurgico. L'intero intervento chirurgico (passaggi 3.2-3.11) è asettico e tutti gli strumenti chirurgici devono essere sterilizzati prima dell'uso. La craniotomia richiede ~ 1 ora.
- Posizionare un coperchio a forma di ciambella (diametro 4,5-6,5 mm) e un disco di copertura (diametro 5 mm) su parafilm pulito. Utilizzare un ago per applicare una piccola quantità di adesivo ottico per incollare il coperchio a forma di ciambella sul disco di copertura. Curare il coperchio della ciambella del disco sul parafilm sotto la luce ultravioletta per 10-20 minuti. Rimuovere l'intero coperchio della ciambella dal parafilm e utilizzare una pinzetta per graffiare via la colla in eccesso e il 70% di etanolo per rimuovere i detriti.
NOTA: i coverslip hanno uno spessore di circa 0,17 mm. Il coverslip a forma di ciambella viene utilizzato per applicare una pressione appropriata sul cervello per l'imaging cronico. - Anestetizzare il mouse con il 3% di isoflurano e il 20% di miscela di gas O2 in una camera di induzione. Pesare il mouse. Posizionare il mouse in posizione prona su una piastra riscaldante. Impostare la temperatura della piastra riscaldante su ~37 °C.
- Fissare i denti superiori nel foro della bocca di un apparato stereotassico con il posizionamento di una maschera anestetica. Fissare le barre auricolari alle orecchie. Mantenere l'anestesia con il 2% di isoflurano e il 20% di miscela di gas O2 durante l'intervento chirurgico.
NOTA: Regolare la concentrazione di isoflurano monitorando la risposta del mouse. Controllare il livello di anestesia osservando la frequenza respiratoria (~ 1 Hz per il sonno profondo) e pizzicando i piedi per verificare eventuali reazioni prima dell'intervento chirurgico. - Applicare l'unguento per gli occhi sugli occhi per la lubrificazione. Chiudi le palpebre. Accendi tutte le luci chirurgiche. Iniettare per via sottocutanea ketoprofene, desametasone e glicopirrolato in base al peso corporeo del topo prima dell'intervento chirurgico.
NOTA: Le dosi del farmaco sono 2 mg / mL, 0,1 mg / mL e 0,1 mg / mL per ketoprofene, desametasone e glicopirrolato, rispettivamente. I volumi di iniezione di ketoprofene, desametasone e glicopirrolato dipendono dal peso corporeo e sono rispettivamente di 2,5 μL/g, 2 μL/g e 2 μL/g. - Rimuovere i peli sulla corona della testa e vicino alle orecchie.
- Taglia quanti più capelli possibile con le forbici o un tagliacapelli e rimuovi i capelli tagliati dal sito chirurgico.
- Applicare una quantità appropriata di crema depilatoria. Attendere 1 min.
- Rimuovere i capelli e la crema utilizzando un batuffolo di cotone imbevuto di soluzione salina.
- Ripetere i passaggi 3.5.2 e 3.5.3 fino a quando i capelli non sono completamente rimossi.
- Applicare la soluzione di povidone-iodio al 5% e poi l'etanolo al 70% sulla pelle per pulire l'area. Ripeti il processo tre volte.
- Somministrare un'iniezione sottocutanea di atropina (dose basata sul peso corporeo, 0,02-0,05 mg/kg) sulla testa. Attendere 1 min.
- Taglia la pelle sulla corona della testa per esporre il cranio. Assicurarsi che il punto bregma e il punto lambda siano entrambi esposti. Incollare il tessuto cutaneo rimanente sul bordo del cranio utilizzando colla biocompatibile per evitare che la polvere di perforazione penetri sotto la pelle (che può provocare una risposta immunitaria).
- Utilizzare un marcatore chirurgico per disegnare un cerchio di 5 mm di diametro sull'area di interesse. Ad esempio, scegli il centro dell'area ~ 2,5 mm laterale e 2 mm caudale al bregma, che copre la maggior parte della corteccia somatosensoriale e della corteccia visiva.
- Esercitare lentamente lungo il cerchio e applicare la soluzione salina per idratare il cranio a metà strada. Rallentare la velocità di perforazione per l'ultima metà e coprire il cranio con soluzione salina prima di rimuovere il cranio. Aprire delicatamente il cranio con una pinza e applicare un piccolo pezzo di gelfoam sterile imbevuto di soluzione salina per fermare immediatamente qualsiasi sanguinamento nel cervello. Mantenere il cervello idratato utilizzando la soluzione salina.
- Applicare una goccia di soluzione salina sul lato del disco preparato-ciambella coverslip di fronte al tessuto cerebrale. Posizionare la parte del disco sporgente del coperchio della ciambella del disco nella finestra cranica. Utilizzare una lunga barra tenuta dall'apparato stereotassico per premere delicatamente la parte del disco della finestra cranica coverslip sulla superficie del cervello, assicurandosi che la parte della ciambella copra strettamente il cranio. Asciugare l'area intorno al coperchio della ciambella con un batuffolo di cotone.
- Applicare uno strato di colla biocompatibile sotto il bordo a forma di ciambella. Applicare uno strato di miscela di cemento dentale sotto e intorno alla parte della ciambella del coperchio della ciambella a disco. Applicare un altro strato di colla sopra il cemento dentale. Il glucosio al 5% (dose basata sul peso corporeo, 10 μL/g) può essere iniettato per via sottocutanea ogni ora durante l'intervento chirurgico per fornire energia animale.
- Spegnere il sistema di anestesia. Rilasciare il mouse dall'apparato stereotassico. Trasferire immediatamente il mouse su un apparecchio stereotassico compatto personalizzato, con una piastra riscaldante a ~ 37 ° C e un apparato di anestesia.
- Posizionare il mouse in posizione prona sulla piastra riscaldante dell'apparato stereotassico compatto personalizzato. Impostare la temperatura su ~37 °C. Fissare i denti superiori nel foro della bocca dell'apparato stereotassico e le barre auricolari alle orecchie del mouse. Indossare i tubi anestetici e mantenere l'anestesia con l'1,5% di isoflurano e il 20% di miscela di gas O2.
NOTA: il mouse è ora pronto per l'imaging. Mantenere il mouse anestetizzato durante le seguenti procedure di imaging. Regolare la concentrazione di isoflurano monitorando la risposta del mouse.
4. Imaging intravitale nel cervello di pesci e topi
- Imaging intravitale nel cervello del pesce zebra
NOTA: per localizzare correttamente il cervello del pesce sotto l'obiettivo, viene utilizzata una telecamera CCD (Charge-Coupled Device) secondaria sullo stesso percorso della luce di eccitazione per l'imaging a campo largo.- Impostare il microscopio e calibrare la potenza (come descritto nella sezione 1).
- Posizionare un obiettivo a basso ingrandimento (in genere 4x) sul microscopio.
- Posizionare la capsula di Petri contenente il pesce e i tubi sotto il microscopio.
- Utilizzare una sorgente luminosa a diodi emettitori di luce (LED) per illuminare la capsula di Petri.
- Aprire la modalità Fotocamera del software di acquisizione delle immagini (Figura 2).
- Fai clic su Live.
- Scegli il canale A sul lato destro dello schermo.
- Regolare le impostazioni dell'istogramma per vedere chiaramente l'immagine.
NOTA: questi devono essere aggiornati secondo necessità. - Impostare l'impostazione del motore sul controller del motore su Base.
- Abbassa l'obiettivo fino a quando il pesce non è visibile.
NOTA: Assicurarsi che l'obiettivo non entri in contatto fisico con la testa. - Posiziona il centro della testa del pesce al centro del campo visivo.
- Sposta l'obiettivo verso l'alto e lontano dalla testa del pesce.
- Sostituire l'obiettivo a basso ingrandimento con l'obiettivo NA alto per 3PM.
NOTA: l'obiettivo a basso ingrandimento e l'obiettivo NA alto non devono necessariamente essere parfocali ma devono essere abbastanza vicini da garantire che il pesce rientri nel campo visivo dell'obiettivo NA alto. - Abbassare lentamente la lente dell'obiettivo, assicurandosi che l'obiettivo non abbia alcun contatto fisico con la testa. Nel software della telecamera CCD, interrompere lo spostamento dell'obiettivo quando la parte superiore della testa è visibile. Impostare la posizione z su 0 μm.
NOTA: assicurarsi che non vi siano bolle d'aria sotto la lente dell'obiettivo quando si utilizza un obiettivo ad immersione in acqua. - Spegnere la sorgente luminosa a LED e chiudere la tenda scura attorno al sistema.
- Impostare il software di acquisizione dell'imaging sulla modalità Multiphoton GG per l'imaging 3P e impostare la potenza sotto l'obiettivo su meno di 1 mW (con una frequenza di ripetizione dell'impulso di ~ 1 MHz).
- Modificare il pulsante di impostazione del motore da Base a Obiettivo sul controller del motore.
- Abbassa le luci nella stanza.
- Accendi i PMT e apri l'otturatore della sorgente di eccitazione 3PM. Assicurarsi che un contorno dell'osso appaia nel canale del segnale di fluorescenza a causa dell'autofluorescenza e nel canale del segnale THG a causa del THG dell'osso (Figura 2C).
- Esegui l'imaging a diverse profondità aumentando i livelli di potenza quando si esegue l'imaging più in profondità.
- Imaging intravitale nel cervello del topo
NOTA: Iniettare il 5% di glucosio nel topo anestetizzato ogni ora durante l'imaging; la dose si basa sul peso corporeo (10 μL/g).- Impostare il software di acquisizione dell'imaging sulla modalità Multiphoton GG per l'imaging 3P e impostare la potenza sotto l'obiettivo su meno di 1 mW (con una frequenza di ripetizione dell'impulso di ~ 1 MHz).
NOTA: Assicurarsi che la finestra dell'intervento chirurgico sia posizionata perpendicolarmente alla lente dell'obiettivo per ridurre l'aberrazione. La regolazione fine viene eseguita inclinando l'apparato stereotassico. - Spostare la lente dell'obiettivo vicino alla finestra e applicare acqua tra l'obiettivo e la finestra cranica; impostare i valori degli assi di tutti i motori su zero.
NOTA: l'assorbimento della luce in H2O a ~ 1.700 nm è grande, il che riduce significativamente la potenza laser di ~ 1.700 nm dopo una profondità di ~ 1-2 mm di acqua. Per l'eccitazione di ~ 1.700 nm, utilizzare D2O, che ha un assorbimento molto più piccolo a 1.700 nm, per l'immersione in acqua per ridurre l'assorbimento da parte dell'acqua. - Fare clic sul pulsante Live nel software di acquisizione delle immagini e aprire i canali PMT, ad esempio un canale del segnale di fluorescenza e un canale del segnale THG. Regolare il guadagno PMT e il livello di background in base alle esigenze.
- Spostare lentamente verso l'alto la lente dell'obiettivo per individuare la superficie della finestra monitorando il canale THG dai grandi vasi sanguigni e dalla superficie del vetro della finestra. Se necessario, regolare l'orientamento della finestra (vedere la nota al passaggio 4.2.12). Azzerare i motori per definire la superficie del cervello.
- Eseguire l'imaging e regolare il livello di potenza in base alla profondità di imaging.
- Impostare il software di acquisizione dell'imaging sulla modalità Multiphoton GG per l'imaging 3P e impostare la potenza sotto l'obiettivo su meno di 1 mW (con una frequenza di ripetizione dell'impulso di ~ 1 MHz).
Risultati
Il completamento con successo di questo protocollo si tradurrà in un microscopio correttamente allineato con parametri di luce ottimali (ad esempio, durata dell'impulso, NA) e preparazioni animali appropriate per le 15:00 in vivo . La configurazione 3P disponibile in commercio comprende specchi e lenti appropriati sia per ~ 1.300 nm che per ~ 1.700 nm; pertanto, non è necessario alcun cambiamento nell'ottica quando la lunghezza d'onda di eccitazione viene commutata tra 1.300 nm e 1.700 nm. Se le lenti in una configurazione 3P non hanno un rivestimento appropriato per 1.300 e 1.700 nm, queste devono essere sostituite con quelle appropriate per ridurre la perdita di potenza del laser. Con le 3PM ottimizzate e una corretta preparazione degli animali, è possibile raccogliere immagini in vivo di fluorescenza e THG ad alto contrasto in profondità all'interno del cervello.
La Figura 3 mostra immagini rappresentative 3P di pesci zebra adulti intatti. L'imaging ad alta risoluzione, non invasivo e profondo dei neuroni geneticamente marcati nel cervello del pesce zebra adulto viene ottenuto utilizzando 3PM. Sebbene l'imaging nella regione del telencefalo sia stato riportato nel cervello del pesce zebra adulto utilizzando 2PM 24,25,26,27, 3PM consente l'accesso all'intero telencefalo e alle regioni che sono più difficili o impossibili da osservare usando altre tecniche. La distribuzione degli strati cellulari nel tectum ottico e nel cervelletto può essere osservata nella Figura 3C. In una sessione di imaging di successo, l'osso è visibile nel canale THG e i neuroni visibili nel canale di fluorescenza. Per l'imaging del pesce zebra adulto, la funzione della fotocamera del microscopio è stata utilizzata per localizzare il pesce (Figura 3A). Questo passaggio non è necessario per l'imaging cerebrale del topo in quanto la finestra di vetro è abbastanza grande da rendere il cervello facilmente accessibile. Immagini strutturali ad alta risoluzione del cervello di zebrafish adulto sono state ottenute utilizzando il sistema descritto nelle sezioni precedenti. Il cranio è visto nel canale THG (Figura 3B), che aiuta a navigare nel cervello e trovare la superficie superiore. Come osservato nella Figura 3C, i neuroni sono distinguibili con un elevato rapporto segnale-sfondo (SBR) in profondità nel cervello adulto. Il tessuto sopra il cervello è visibile nel canale di fluorescenza a causa dell'autofluorescenza.
La Figura 4 mostra immagini 3P multicolore di neuroni marcati GCaMP6s (verde) e vasi sanguigni marcati in rosso del Texas (rosso) insieme a segnali THG (blu) nel cervello del topo adulto con eccitazione 1.340 nm10. Le immagini sono riprodotte dal lavoro precedente10. Nella Figura 4, l'energia dell'impulso a fuoco è stata mantenuta a ~ 1,5 nJ nell'intera profondità per ottenere sufficienti segnali di fluorescenza e THG, e la potenza media massima del laser era di ~ 70 mW. La durata dell'impulso è stata regolata a ~ 60 fs e il NA effettivo è stato di ~ 0,8. Con l'ottimizzazione della configurazione 3PM, le immagini ad alto contrasto sono state ottenute con successo fino a 1,2 mm dalla superficie del cervello, nella regione dell'ippocampo CA1 (Figura 4A, B). La Figura 4C,D mostra tracce di attività Ca2+ di neuroni marcati con GCaMP6s a una profondità di 750 μm per una sessione di registrazione di 10 minuti, mostrando un'alta fedeltà di registrazione.
Se il laser di eccitazione è disallineato, si può osservare la non uniformità nella luminosità del segnale in tutto il campo visivo. Inoltre, se i parametri laser, come la durata dell'impulso, l'energia dell'impulso di eccitazione a fuoco e l'efficace NA, non sono ottimizzati, l'immagine THG dal cranio del pesce o dalla finestra craniotomia del cervello del topo non sarà visibile e / o richiede un'elevata energia dell'impulso di eccitazione (ad esempio, >2 nJ / impulso a fuoco). Quindi, i segnali THG sulla superficie del cervello possono essere utilizzati come indicatore per una configurazione ottimizzata delle 15:00 prima di iniziare l'imaging dei tessuti profondi.
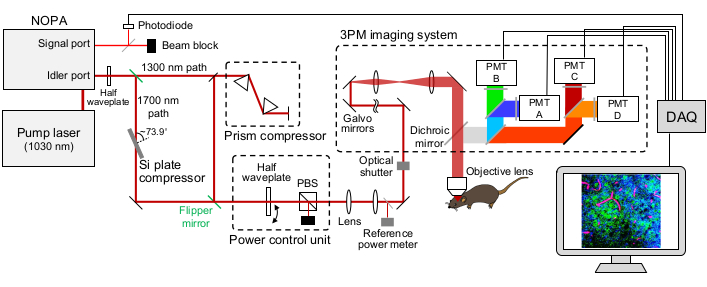
Figura 1: Illustrazione schematica di una configurazione a 3 PM. La lunghezza d'onda del laser di eccitazione è impostata su ~ 1.300 nm o ~ 1.700 nm, in uscita dalla porta folle del NOPA. Il compressore a coppia di prismi e il compressore a piastra Si vengono utilizzati rispettivamente per il laser ~ 1.300 nm e ~ 1.700 nm per prechirp l'impulso laser di eccitazione. I raggi laser ~ 1.300 nm e ~ 1.700 nm possono essere commutati con specchi flipper. La porta del segnale del NOPA viene utilizzata per ottenere il segnale di attivazione. Una mezza piastra d'onda e un PBS vengono utilizzati per controllare la potenza di eccitazione. La fluorescenza e il THG vengono rilevati dai PMT GaAsP. Combinazioni appropriate di specchi dicroici e filtri passa-banda vengono utilizzate per separare i segnali di fluorescenza e THG. Abbreviazioni: 3PM = microscopia a tre fotoni; NOPA = amplificatore parametrico ottico non collinoso; PBS = spaccatelo polarizzante; THG = generazione di terza armonica; DAQ = acquisizione dati; PMT = tubo fotomoltiplicatore. Fare clic qui per visualizzare una versione più grande di questa figura.
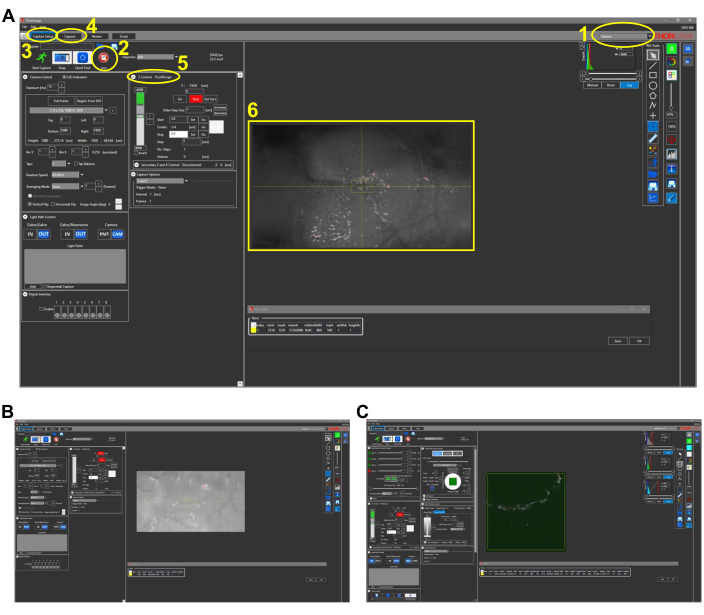
Figura 2: Schermate rappresentative per l'imaging intravitale nei pesci (sezione protocollo 4.1). (A) Visualizzazione in modalità fotocamera del software di acquisizione delle immagini con obiettivo 4x in posizione. Le caratteristiche principali del software sono delineate e numerate come segue: 1. Modalità di imaging del software di acquisizione delle immagini. Le opzioni di modalità sono Fotocamera, Multifotone e Multifotone GG. Per l'imaging a luce bianca con fotocamera CCD, viene scelta la modalità Fotocamera . 2. Facendo clic sul pulsante Live si accende la fotocamera (o PMT se in opzioni multifotone) e si può osservare una visione in tempo reale del microscopio. 3. Nella scheda Capture Setup , vengono impostati i parametri di imaging desiderati (potenza, posizione, profondità). 4. Nella scheda Acquisizione , viene assegnata una posizione della cartella per le immagini da salvare. L'imaging può essere avviato in questa scheda. 5. L'impostazione Z Control controlla la profondità dell'imaging spostando il motore dello stadio z. 6. Immagine rappresentativa di una testa di zebrafish. Il lato rostrale della testa è a sinistra. (B) Vista rappresentativa della modalità Fotocamera con obiettivo 25x. (C) Vista rappresentativa della modalità GG multifotone contenente l'immagine THG dell'immagine vista in (B). Abbreviazioni: CCD = dispositivo ad accoppiamento di carica; PMT = tubo fotomoltiplicatore; THG = terza generazione armonica. Fare clic qui per visualizzare una versione più grande di questa figura.
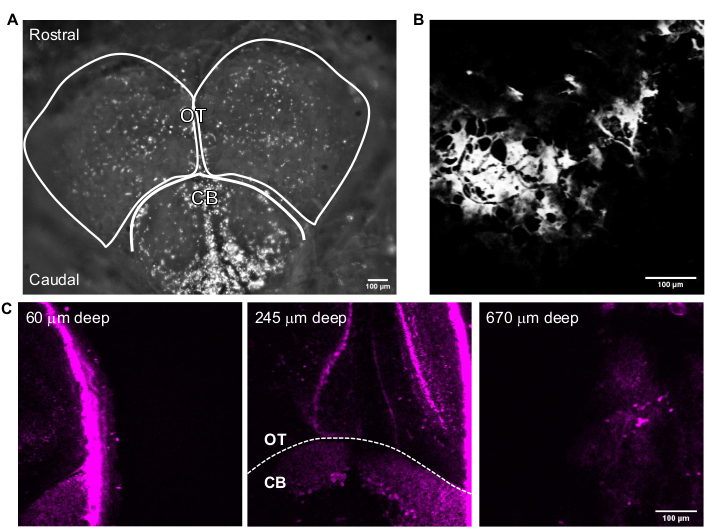
Figura 3: Immagini rappresentative del cervello adulto di zebrafish acquisite con il software di acquisizione delle immagini. (A) Immagine in modalità fotocamera della testa di zebrafish adulto acquisita con un obiettivo 4x. La parte superiore dell'immagine è la direzione rostrale. I lobi OT e CB sono delineati. (B) Immagine rappresentativa acquisita in modalità Multiphoton GG con un obiettivo 25x contenente l'immagine THG di (A). (C) Immagini di fluorescenza del cervello adulto del pesce zebra all'intersezione del cervelletto e del tectum ottico in cui la GFP è espressa nel citoplasma dei neuroni in varie profondità. Barre di scala = 100 μm. Abbreviazioni: OT = optic tectam; CB = cervelletto; THG = generazione di terza armonica; GFP = proteina fluorescente verde. Fare clic qui per visualizzare una versione più grande di questa figura.
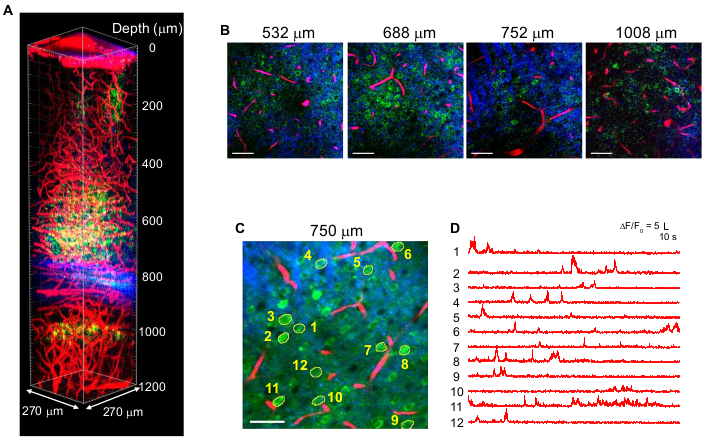
Figura 4: Multicolor 3PM di neuroni GCaMP6marcati s (verde), vasi sanguigni marcati in rosso del Texas (rosso) e terza generazione armonica (blu) su eccitazione di 1.340 nm nel cervello del topo. (A) Immagini Z-stack fino a 1.200 μm dalla superficie cerebrale con un campo visivo di 270 x 270 μm (512 x 512 pixel per fotogramma). La potenza del laser è stata variata in base alla profondità di imaging per mantenere ~ 1,5 nJ di energia dell'impulso al fuoco. La potenza media massima sotto l'obiettivo era di 70 mW. (B) Immagini 2D selezionate a varie profondità di imaging. (C) Sito di registrazione dell'attività a 750 μm sotto la dura con un campo visivo di 270 x 270 μm (256 x 256 pixel). (D) Tracce spontanee di attività cerebrale registrate in un topo sveglio dai neuroni marcati indicati in (C). Il frame rate era di 8,3 Hz, con un tempo di permanenza in pixel di 0,51 μs. La frequenza di ripetizione laser era di 2 MHz e la potenza media sotto l'obiettivo era di 56 mW. Ogni traccia è stata normalizzata alla sua linea di base e filtrata passa-basso utilizzando una finestra di hamming di 0,72 s costante di tempo. Barre di scala = 50 μm. Questa figura e la legenda della figura sono riprodotte da 10. Abbreviazione: 3PM = microscopia a tre fotoni. Fare clic qui per visualizzare una versione più grande di questa figura.
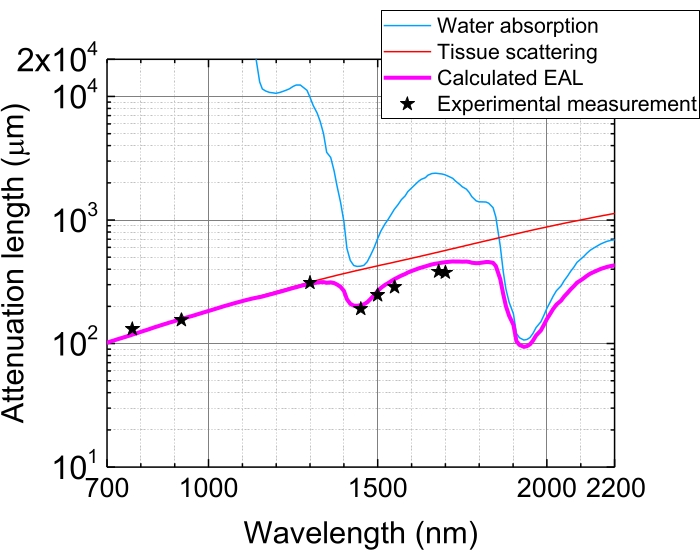
Figura 5: Lunghezza di attenuazione effettiva nella neocorteccia del cervello del topo. L'EAL (linea magenta) viene calcolato dallo scattering tissutale (linea rossa) e dall'assorbimento d'acqua nel tessuto (linea blu), assumendo una composizione acquosa del 75%. Le stelle nere indicano i dati sperimentali riportati di EAL nella neocorteccia del cervello del topo 3,21,28,29. Si noti che EAL varia in diversi tessuti. Abbreviazione: EAL = lunghezza di attenuazione effettiva. Fare clic qui per visualizzare una versione più grande di questa figura.
| Lunghezza d'onda di eccitazione nm) | Acqua per immersione | Potenza laser massima (mW) | Massima energia dell'impulso alla messa a fuoco* (nJ) | EAL tipico nella corteccia del topo (μm) | Profondità di imaging nella corteccia del topo** (mm) | Energia pulsata nell'ambito dell'obiettivo*** (nJ) | Tasso massimo di ripetizione laser**** (MHz) |
| 1300 | H2O o D2O |
 100 100 |
 2 2 | ~300 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210 | ~0,5 | |||||
| 2.1 | ~1100 | ~0,1 | |||||
| 1700 | D2O |
 50 50 |
 3 3 | ~400 | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2,5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~190 · | ~0,3 |
Tabella 1: Condizioni tipiche di eccitazione 3 P per l'imaging della corteccia del topo.
*Con un obiettivo NA elevato (~1.0), larghezza di impulso di ~50 fs e fluorofori tipici come le proteine fluorescenti (ad esempio, GFP e RFP).
** Con l'ipotesi che l'EAL sia uniforme in tutta la corteccia.
Per ottenere ~ 1 nJ / impulso a fuoco, calcolato dall'EAL e dalla profondità di imaging.
Calcolato dall'energia dell'impulso sotto l'obiettivo e dalla massima potenza laser permissiva.
Abbreviazioni: 3P = tre fotoni; NA = apertura numerica; GFP = proteina fluorescente verde; RFP = proteina fluorescente rossa; EAL = lunghezza di attenuazione effettiva.
Discussione
Questo protocollo spiega le procedure passo-passo per l'impostazione dell'imaging 3P con un microscopio commerciale e una sorgente laser. Rispetto alle 14:00, le 15:00 hanno un vantaggio nelle applicazioni che richiedono l'accesso ottico nelle regioni più profonde come nell'ippocampo cerebrale del topo. Sebbene 3PM sia utilizzato principalmente nelle neuroscienze, 3PM può essere potenzialmente applicato in altri tessuti come linfonodi, ossa e tumori per l'osservazione dei tessuti profondi.
È importante verificare che il sistema di imaging funzioni vicino al limite di rumore di ripresa, il che garantisce che l'elettronica di rilevamento e acquisizione dati contribuisca con un rumore trascurabile all'immagine dopo i PMT. L'incertezza nel numero di fotoni rilevati è fondamentalmente limitata dal rumore di ripresa dei fotoni. Le prestazioni limitate del rumore di ripresa possono essere ottenute in un tipico microscopio multifotone utilizzando un fotorivelatore ad alto guadagno (ad esempio, un PMT). Il rumore di ripresa fotonica segue una distribuzione statistica di Poisson, in cui la deviazione standard della distribuzione è uguale alla radice quadrata della media della distribuzione. Per verificare le prestazioni limitate del rumore di tiro, seguire il passaggio 1.14 nella sezione protocollo.
Per evitare l'attenuazione della luce di H2O, è utile utilizzare D2O per l'immersione, in particolare per l'eccitazione di ~ 1.700 nm. Quando si utilizza D2O, è essenziale aggiornare D2O ogni ~ 10 minuti o utilizzare un grande volume di D2O per evitare lo scambio D2O / H2O durante l'imaging. Si può anche sigillare il D2O dall'ambiente della stanza3. Se per l'imaging viene utilizzato un obiettivo a lunga distanza di lavoro (WD) (ad esempio, WD a 4 mm o più), lo spessore del liquido di immersione può superare i 2-3 mm. L'aumento dello spessore rende l'assorbimento di H2O non trascurabile anche a ~1.300 nm21. Pertanto, D2O può essere necessario anche per 1.300 nm 3PM quando si utilizza un obiettivo WD lungo.
Poiché l'intensità di fluorescenza 3P dipende dal cubo dell'energia dell'impulso di eccitazione al fuoco (Eq. (1)), l'impostazione della potenza laser appropriata è particolarmente importante per ottenere adeguati segnali di fluorescenza 3P evitando danni termici e non lineari nei tessuti viventi. La potenza media del laser deve essere mantenuta al di sotto della soglia di danno termico. Nel cervello del topo, ad esempio, per evitare danni al tessuto termico, la potenza media sulla superficie cerebrale del topo deve essere mantenuta pari o inferiore a ~ 100 mW per un'eccitazione di ~ 1.300 nm a una profondità di 1 mm e con un campo visivo (FOV) di 230 μm x 230 μm21. Allo stesso modo, la potenza media a ~ 1.700 nm dovrebbe essere mantenuta pari o inferiore a ~ 50 mW a ~ 1 mm di profondità e un FOV di ~ 230 μm x 230 μm (dati non pubblicati). Inoltre, per evitare la saturazione dell'eccitazione e potenziali danni non lineari, l'energia dell'impulso di eccitazione deve essere mantenuta a  2 nJ e
2 nJ e  3 nJ per ~ 1.300 nm e ~ 1.700 nm di eccitazione, rispettivamente30.
3 nJ per ~ 1.300 nm e ~ 1.700 nm di eccitazione, rispettivamente30.
A causa dell'assorbimento della luce e della dispersione nei tessuti, l'energia dell'impulso a fuoco viene attenuata a 1/e (~ 37%) dopo la penetrazione dei tessuti da parte di 1 EAL. L'EAL varia nei diversi tessuti e con le lunghezze d'onda di eccitazione, ad esempio, nella neocorteccia del cervello del topo, l'EAL è ~ 300 μm e ~ 400 μm a ~ 1.300 nm e ~ 1.700 nm, rispettivamente 3,29 (Figura 5). Pertanto, per mantenere la stessa energia dell'impulso a fuoco (ad esempio, 1 nJ / impulso) a una profondità di n EAL, l'energia dell'impulso superficiale deve essere moltiplicata per 1 nJ × en. Per l'imaging rapido della dinamica strutturale e funzionale, è auspicabile un laser di eccitazione con un'elevata frequenza di ripetizione (a 1 MHz o superiore) per ottenere un frame rate elevato 5,6,7,10. Tuttavia, il requisito di energia dell'impulso e il limite medio di potenza del laser limitano la velocità di ripetizione applicabile.
Ad esempio, quando immaginiamo una regione moderatamente profonda a 4 EAL (cioè ~ 1,2 mm nella corteccia del topo con eccitazione di 1.300 nm), è necessario ~ 55 nJ / impulso sulla superficie per mantenere 1 nJ / impulso a fuoco. Quando il limite di potenza media è di 100 mW, possiamo applicare una frequenza di ripetizione laser di ~ 2 MHz. Tuttavia, per visualizzare immagini più profonde a una profondità di 7 EAL, sono necessari ~ 1.100 nJ / impulso in superficie per mantenere 1 nJ / impulso a fuoco. Supponendo che la potenza media massima sia di 100 mW per evitare danni termici, la frequenza di ripetizione del laser dovrebbe essere ridotta a 0,1 MHz per ottenere un impulso di 1.100 nJ / impulso in superficie. La Tabella 1 riassume le condizioni di imaging tipiche nella corteccia cerebrale del topo. Si noti che le profondità di imaging nella Tabella 1 presuppongono che l'EAL sia uniforme nell'intera corteccia del topo.
Inoltre, a causa della limitazione della potenza del laser nelle 3PM dei tessuti profondi, esiste un compromesso tra il frame rate e la dimensione dei pixel dell'immagine, che è particolarmente importante per l'imaging funzionale come l'imaging del calcio. La massima velocità di ripetizione laser disponibile viene decisa a ciascuna profondità in base all'energia dell'impulso richiesta alla messa a fuoco e alla potenza media del laser applicabile come discusso sopra, ad esempio, 2 MHz a una profondità equivalente a ~ 4 EAL con eccitazione di 1.300 nm. In generale, l'imaging richiede almeno un impulso per pixel. Di conseguenza, il tempo minimo di permanenza dei pixel disponibili è determinato dalla frequenza di ripetizione del laser, ad esempio 0,5 μs / pixel con eccitazione a 2 MHz.
Per mantenere l'alta risoluzione spaziale (~1 μm in laterale) nelle immagini 3P, è ideale impostare 1 pixel su un'area di ~1 μm2, ad esempio 256 x 256 pixel per un FOV di 250 x 250 μm2. Quindi, per eseguire immagini veloci con un FOV considerevolmente grande (ad esempio, 250 x 250 μm2 con 256 x 256 pixel), frequenze di ripetizione degli impulsi di 0,5 MHz, 1 MHz e 2 MHz forniscono frame rate massimi teorici di ~ 7,6, ~ 15 e ~ 30 fotogrammi / s, rispettivamente. Allo stesso modo, l'ottimizzazione della frequenza di ripetizione laser è essenziale, a seconda della profondità target, della velocità di scansione e del FOV, per applicare un'adeguata energia dell'impulso sotto la soglia del danno termico. Per aumentare la velocità di imaging, una sorgente di eccitazione adattiva può essere utilizzata per concentrare tutti gli impulsi di eccitazione sui neuroni (cioè le regioni di interesse) fornendo impulsi laser su richiesta ai neuroni31.
3PM è vantaggioso rispetto a 2PM nell'imaging profondo all'interno di tessuti viventi e attraverso mezzi altamente dispersivi come un cranio, ossa e lo strato di sostanza bianca (cioè la capsula esterna) del cervello del topo. L'EAL più lungo e l'eccitazione non lineare di ordine superiore di 3PE avvantaggiano l'imaging dei tessuti profondi. Ad esempio, per visualizzare GCaMP6 nella corteccia del topo, il segnale di fluorescenza 2P con eccitazione a 920 nm è superiore al segnale di fluorescenza 3P con eccitazione a 1.300 nm in regioni poco profonde a  690 μm (cioè ~ 2,3 EAL a 1.300 nm)21. Tuttavia, a causa dell'EAL più lungo a 1.300 nm rispetto a 920 nm, 3PE dà una fluorescenza più forte dell'eccitazione 2P (2PE) a una profondità di ~ 690 μm epiù profonda 21. Questa profondità è definita come "profondità di crossover del segnale", alla quale le potenze del segnale di fluorescenza di 2PE e 3PE sono identiche con la stessa frequenza di ripetizione e le stesse potenze medie massime consentite21. La profondità di crossover del segnale dipende dalle lunghezze d'onda di eccitazione per 2PE e 3PE e dal fluoroforo.
690 μm (cioè ~ 2,3 EAL a 1.300 nm)21. Tuttavia, a causa dell'EAL più lungo a 1.300 nm rispetto a 920 nm, 3PE dà una fluorescenza più forte dell'eccitazione 2P (2PE) a una profondità di ~ 690 μm epiù profonda 21. Questa profondità è definita come "profondità di crossover del segnale", alla quale le potenze del segnale di fluorescenza di 2PE e 3PE sono identiche con la stessa frequenza di ripetizione e le stesse potenze medie massime consentite21. La profondità di crossover del segnale dipende dalle lunghezze d'onda di eccitazione per 2PE e 3PE e dal fluoroforo.
In pratica, l'eccitazione a 920 nm consente una potenza laser media superiore all'eccitazione di 1.300 nm a causa del minore assorbimento d'acqua. Tuttavia, la maggiore potenza media di 2PE spingerebbe la profondità del crossover del segnale solo di 0,9 EAL4. Inoltre, quando il campione è densamente etichettato, 3PE ha l'ulteriore vantaggio di un SBR molto più elevato. Pertanto, anche prima di raggiungere la lunghezza di crossover del segnale, 3PM può essere migliore per l'imaging rispetto a 2PM. Ad esempio, quando si esegue l'imaging della vascolarizzazione cerebrale del topo, che ha una frazione di volume (cioè densità di etichettatura) di ~ 2%, 1.300 nm 3PM con potenza di eccitazione di 100 mW supera 920 nm 2PM con potenza di eccitazione di 200 mW a una profondità di ~ 700 μm per la fluoresceina.
3PM ha anche un vantaggio quando si esegue l'imaging attraverso uno strato sottile ma altamente scattering che può distorcere la funzione di diffusione del punto del fascio di eccitazione e generare uno sfondo sfocato4. Ad esempio, attraverso il cranio intatto del cervello del topo, le immagini 2PM soffrono dello sfondo sfocato anche alla profondità ridotta di <100 μm dalla superficie cerebrale13. Uno sfondo di sfocatura simile è stato osservato nelle 14:00 con eccitazione di 1.280 nm attraverso la sostanza bianca nel cervello del topo32. Pertanto, quando i tessuti vengono ripresi attraverso strati torbidi, le 15:00 sono preferibili alle 14:00 per l'imaging ad alto contrasto, indipendentemente dalla densità di etichettatura.
Recentemente abbiamo riportato un'analisi teorica e fantasma di perline che mostra che il limite di profondità di imaging di 3PM è superiore a 8 EAL33; 8 EAL equivalgono a ~3 mm con eccitazione di ~1.700 nm nella corteccia del topo. Tuttavia, il laser attualmente disponibile non ha abbastanza energia di impulso per raggiungere 8 EAL nel cervello del topo. L'ulteriore sviluppo di laser più forti spingerà l'attuale limite di profondità di imaging di 3PM.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questo lavoro è stato supportato da NSF DBI-1707312 Cornell NeuroNex Hub e NIH 1U01NS103516.
Materiali
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
Riferimenti
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon