Method Article
Глубокотканная трехфотонная флуоресцентная микроскопия в интактном мозге мышей и рыбок данио
* Эти авторы внесли равный вклад
В этой статье
Резюме
Трехфотонная микроскопия позволяет получать высококонтрастную флуоресцентную визуализацию глубоко в живых биологических тканях, таких как мозг мышей и рыбок данио, с высоким пространственно-временным разрешением.
Аннотация
Методы многофотонной микроскопии, такие как двухфотонная микроскопия (2PM) и трехфотонная микроскопия (3PM), являются мощными инструментами для глубокой визуализации тканей in vivo с субклеточным разрешением. 3PM имеет два основных преимущества для глубокой визуализации тканей в течение 2PM, которые широко используются в биологических лабораториях: (i) более длинная длина затухания в рассеивающих тканях за счет использования ~ 1 300 нм или ~ 1 700 нм лазера возбуждения; (ii) меньшая фоновая флуоресценция за счет нелинейного возбуждения более высокого порядка. В результате 3PM позволяет создавать высококонтрастную структурную и функциональную визуализацию глубоко внутри рассеивающих тканей, таких как неповрежденный мозг мыши от кортикальных слоев до гиппокампа и всего переднего мозга взрослых рыбок данио.
Сегодня лазерные источники, подходящие для 3PM, коммерчески доступны, что позволяет преобразовать существующую двухфотонную (2P) систему визуализации в трехфотонную (3P) систему. Кроме того, доступно несколько коммерческих микроскопов 3P, что делает этот метод легко доступным для биологических исследовательских лабораторий. В этой статье показана оптимизация типичной установки 3PM, особенно ориентированной на биологические группы, которые уже имеют настройку 2P, и демонстрируется прижизненная 3D-визуализация в интактном мозге мышей и взрослых рыбок данио. Этот протокол охватывает полную экспериментальную процедуру визуализации 3P, включая выравнивание микроскопом, предварительное щипцирование ~ 1 300 и ~ 1 700 нм лазерных импульсов, подготовку животных и прижизненную флуоресцентную визуализацию 3P глубоко в мозге взрослых рыбок данио и мышей.
Введение
В области наук о жизни методы многофотонной микроскопии (MPM), такие как 2PM и 3PM, были мощными инструментами для глубокой визуализации in vivo с высоким пространственно-временным разрешением и высокой контрастностью в рассеянных тканях. Кроме того, эти методы вызывают меньшее фотоотбеливание по сравнению с однофотонной конфокальной микроскопией 1,2,3,4. 3PM является преимуществом для визуализации более глубоких тканей по сравнению с 2PM из-за двух основных особенностей: (i) использование более длинноволнового возбуждения (~ 1 300 нм или ~ 1 700 нм) уменьшает рассеяние тканей и (ii) процесс возбуждения более высокого порядка (т. Е. Флуоресцентный сигнал зависит от куба мощности возбуждения в 3PM вместо квадрата мощности возбуждения в 2PM), который подавляет нежелательную фоновую флуоресценцию3 . Следовательно, 3PM обеспечивает высококонтрастную визуализацию в более глубоких областях живых тканей, таких как гиппокамп в неповрежденном мозге взрослой мыши 3,5,6,7,8,9,10,11 и во всем переднем мозге взрослой рыбки данио12, включая Ca2+ запись активности и многоцветные наблюдения. Кроме того, высококонтрастные изображения были получены с 3PM через неповрежденные черепа мышей и взрослых рыбок данио12,13.
Сегодня коммерчески доступны лазерные источники возбуждения, подходящие для возбуждения 3P (3PE) при ~1,300 и ~1,700 нм. Поскольку система лазерного сканирования по существу одинакова для 2PM и 3PM, преобразование существующей установки 2P в установку 3P возможно в биологических лабораториях с установкой коммерчески доступного лазера для 3PE. Флуоресцентный сигнал 3P зависит от мощности лазера, длительности импульса, частоты повторения лазера и числовой апертуры (NA) объектива. Предполагая дифракционно-ограниченную фокусировку (т.е. задняя диафрагма объектива переполнена пучком возбуждения), Eq (1) описывает усредненный по времени поток флуоресцентных фотонов от фокального объема, полученный в результате 3PE.
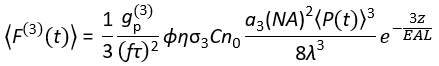 (1)
(1)
Где f - частота повторения лазера, τ - длительность лазерного импульса (полная ширина в половину максимума), φ - эффективность сбора системы, η - квантовая эффективность флуоресценции, σ3 - поперечное сечение поглощения 3P, C - концентрация флуорофора, n0 - отражающий индекс среды образца (например, воды), λ - длина волны возбуждения в вакууме, NA - числовая диафрагма объектива,3 - константа пространственного интегрирования фокального объема, 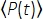 - усредненный по времени поток фотонов возбуждения (фотоны / с) под объективом, z - глубина изображения, а EAL - эффективная длина затухания14. Здесь мы предположили, что EAL (обычно > 100 мкм) намного больше, чем осевое разрешение микроскопа (обычно < 10 мкм). При параксиальном приближении 3 равно 28,114. gp(3) — временная когерентность источника возбуждения3-го порядка, а gp(3) — 0,41 и 0,51 для гиперболически-секанс-квадратных импульсов и гауссовых импульсов соответственно. Эффективность сбора φ может быть оценена путем рассмотрения флуоресцентного сбора объективом, пропускания объектива, отражательной способности дихроичного зеркала, пропускания фильтров и эффективности обнаружения детектора (например, фотоумножителя или PMT). Поскольку интенсивность флуоресценции 3P сильно зависит от различных параметров, требуется оптимизация настройки 3P для максимизации флуоресцентных сигналов 3P.
- усредненный по времени поток фотонов возбуждения (фотоны / с) под объективом, z - глубина изображения, а EAL - эффективная длина затухания14. Здесь мы предположили, что EAL (обычно > 100 мкм) намного больше, чем осевое разрешение микроскопа (обычно < 10 мкм). При параксиальном приближении 3 равно 28,114. gp(3) — временная когерентность источника возбуждения3-го порядка, а gp(3) — 0,41 и 0,51 для гиперболически-секанс-квадратных импульсов и гауссовых импульсов соответственно. Эффективность сбора φ может быть оценена путем рассмотрения флуоресцентного сбора объективом, пропускания объектива, отражательной способности дихроичного зеркала, пропускания фильтров и эффективности обнаружения детектора (например, фотоумножителя или PMT). Поскольку интенсивность флуоресценции 3P сильно зависит от различных параметров, требуется оптимизация настройки 3P для максимизации флуоресцентных сигналов 3P.
Этот протокол иллюстрирует процесс оптимизации типичной установки 3P, который будет полезен, в частности, для биологических лабораторий, которые имеют настройку 2P и планируют расширить свои возможности до 3P-визуализации или поддерживать свою коммерческую настройку 3P на оптимальной производительности. Эта видеостатья также демонстрирует глубоководную визуализацию 3P в мозге живых животных. В первом разделе рассматривается оптимизация типичной установки 3P с коммерчески доступным лазерным источником и многофотонным микроскопом. Второй и третий разделы описывают подготовку рыбок данио и мышей, соответственно, к 3PM нейронных структур и деятельности. Операция по трепанации черепа мышей ранее была зарегистрирована в протокольных документах, а также 15,16,17. Четвертый раздел демонстрирует прижизненную визуализацию 3P в мозге рыбок данио и мышей.
протокол
Все эксперименты на животных и процедуры содержания рыбок данио и мышей были одобрены и проведены в соответствии с руководством Комитета по уходу и использованию животных Корнелльского университета (IACUC). Рыбки данио и мыши были усыплены высококонцентрированным раствором трикаина и асфиксией углекислого газа, соответственно, после эксперимента.
1. Оптимизация настройки трехфотонной микроскопии
ПРИМЕЧАНИЕ: Носите лазерные защитные очки для защиты глаз. Блокируйте лазерный луч блокировщиком луча при размещении или перемещении оптики. Для визуализации лазера используйте инфракрасный просмотрщик или инфракрасную детекторную карту.
- Включите лазер и установите центральную длину волны холденного выхода неколлинеарного оптического параметрического усилителя (NOPA) на ~1 300 нм или ~1 700 нм.
- Поместите тонкое покровное стекло на линию луча от сигнального порта NOPA (т.е. ~700-900 нм), чтобы отразить небольшую часть лазерного луча на фотодиод Si для получения триггерных сигналов (рисунок 1). Поместите блокиратор луча в тракт пропускания покровного стекла.
- Разместите импульсные компрессоры на световом пути, чтобы предварительно закрепить фемтосекундный лазер для оптимизации длительности импульса в течение 3PM. Для пучка ~1 300 нм поместите компрессор призменной пары18,19 (например, пары призм N-SF11). Для лазера ~1 700 нм поместите Si пластину толщиной ~3 мм20. Установите угол между Si-пластиной и лазерным трактом под углом Брюстера (~73,9° для 1 700 нм), чтобы максимизировать коэффициент пропускания лазера. Поверните Si-пластину, чтобы достичь угла Брюстера, минимизируя отражение.
- Разместите зеркала-флипперы, чтобы обеспечить удобное переключение между линиями луча ~1 300 нм и ~1 700 нм.
- Поместите полуволновую пластину (например, ахроматическую полуволновую пластину, подходящую для ~ 1 300 и ~ 1 700 нм), установленную на ступени вращения, и поляризационный разветвитель пучка (PBS) для управления интенсивностью лазера. Поместите блокиратор луча в траекторию отражения PBS.
ПРИМЕЧАНИЕ: Лазер должен проходить через PBS перпендикулярно, чтобы достичь высокого коэффициента вымирания. Мощность лазера для 3PM контролируется вращением полуволновой пластины. - Поместите тонкое покровное стекло в световой тракт после контроллера питания и перед оптическим затвором, чтобы отразить небольшую часть лазерного луча на измеритель мощности. Используйте измеритель мощности в качестве «эталонного измерителя мощности» для расчета мощности лазера под объективом во время визуализации (см. шаг 1.12).
- Выровняйте траекторию лазера, отрегулировав зеркала для распространения луча в систему 3PM.
- Измерьте размер луча в положении заднего отверстия объектива с помощью лезвия ножа на сцене трансляции и измерителя мощности. Убедитесь, что размер луча не слишком мал или слишком велик.
ПРИМЕЧАНИЕ: Как правило, луч немного подсыпает объектив с высоким NA для достижения высокой пропускной способности для глубокой визуализации тканей. Например, размер луча ~10-13 мм (1/e2) на задней апертуре объектива Olympus (диаметр задней апертуры ~15 мм) помогает достичь эффективного NA ~0,7-0,9. Когда размер луча слишком мал, сигнал 3P становится слабым, а пространственное разрешение ухудшается из-за низкого эффективного NA. Когда размер луча слишком велик, максимальная доступная мощность возбуждения под объективом становится слабой из-за потери мощности на заднем отверстии объектива. Для глубокой визуализации тканей маргинальные лучи также страдают от более высоких потерь из-за более длинного пути в ткани. - Если размер луча на задней диафрагме объектива не подходит, поместите соответствующие оптические элементы, такие как выпуклые линзы, на траекторию лазерного луча, чтобы отрегулировать размер луча.
ПРИМЕЧАНИЕ: Убедитесь, что лазерный луч не больше зеркал galvo, чтобы предотвратить ненужную потерю мощности. - Поместите объектив на установку 3PM.
- Измерьте длительность импульса после объектива с помощью автокоррелятора. Отрегулируйте импульсный компрессор для достижения более коротких импульсов, если длительность импульса слишком велика (например, >70 fs). Используйте импульсы ~50-70 fs для 3PM и интерферометр Майкельсона, размещенный между лазером и объективом, чтобы обеспечить задержку для измерений автокорреляции.
ПРИМЕЧАНИЕ: Фотодиод с надлежащим спектральным откликом (например, кремниевый фотодиод для длины волны более 1 200 нм), размещенный в фокусе объектива, может удобно служить нелинейным детектором, а двухфотонный фототок от фотодиода может быть использован для получения автокорреляционных следов20. Компрессор призменной пары для ~1 300 нм может быть отрегулирован двумя способами: (1) изменение расстояния между двумя призмами; (2) изменение длины траектории лазерного луча в призматическом стекле путем перемещения призмы (призм) перпендикулярно исходной линии призмы. Компрессор Si пластины для ~1 700 нм можно отрегулировать, заменив Si-пластину более толстой или тонкой Si-пластиной. - Поместите измеритель мощности на выходе объектива. Измерьте мощность лазера под объективом и считайте значение эталонного измерителя мощности (из шага 1.6). Рассчитайте соотношение мощности под объективом и на эталонном измерителе мощности.
ПРИМЕЧАНИЕ: Во время визуализации фактическая мощность лазера под объективом может быть рассчитана по соотношению мощности и значению эталонного измерителя мощности. - Выньте измеритель мощности из-под объектива.
- [Необязательно] Проверка ограниченной производительности фотонного снимка-шума системы визуализации
ПРИМЕЧАНИЕ: Для выполнения этой задачи необходимы следующие элементы: 1) один флуоресцеиновый или техасский красный красильный пул (например, ~10 мкМ), 2) счетчик фотонов и 3) осциллограф.- Поместите образец бассейна красителей под объектив 3PM.
- Осторожно опустите объектив на бассейн красителей до тех пор, пока расстояние не станет меньше рабочего расстояния объектива.
- Поместите воду между линзой и закрывающим стеклом бассейна с красителями.
- Установите выходную мощность микроскопа на небольшое количество (например, <1 мВт с частотой повторения импульсов ~1 МГц), чтобы найти поверхность бассейна красителей.
- Запустите сеанс Live микроскопа и установите местоположение z равным нулю.
- Медленно отодвиньте объектив от образца, чтобы достичь верхней части бассейна красителей (как указано третьей гармонической генерацией (THG), производимой покровным стеклом).
- Установите расположение z равным нулю в положении защитного стекла.
- Немного опустите объектив до тех пор, пока в флуоресцентном канале не будет виден четкий флуоресцентный сигнал.
- Подключите выход PMT к разветвителю BNC. Подключите выходы делителя к счетчику фотонов и системе сбора изображений.
- Установите мощность лазера на значение, при котором количество фотонов в секунду ниже 5% от скорости повторения лазера (например,
 50 000 фотонов / с при использовании лазера 1 МГц).
50 000 фотонов / с при использовании лазера 1 МГц). - Уменьшите поле зрения до минимально возможного с помощью программного обеспечения и убедитесь, что яркость равномерной по всему изображению.
- Установите частоту кадров равным 1,0 кадра в секунду.
- Установите для периода получения счетчика фотонов значение t = количество пикселей на кадр × время выдержки пикселя и соответствующий уровень дискриминатора.
- Собирайте количество фотонов и пикселей одновременно в течение эквивалентного периода. Чтобы получить количество пикселей, соберите средние значения пикселей всего изображения, а также значения среднего и стандартного отклонения.
- Повторите шаг 1.14.14, блокируя лазер возбуждения для получения количества темных фотонов и пикселей.
- Остановите приобретение программного обеспечения в режиме реального времени.
- Вычтите темные счетчики (полученные на шаге 1.14.15) из подсчета фотонов (полученного на шаге 1.14.14) и общего количества пикселей (полученного на шаге 1.14.14).
- Разделите общее количество темных вычитаемых пикселей на количество темных фотонов (полученное на шаге 1.14.17). Используйте полученное значение в качестве «коэффициента пересчета» (т.е. значений пикселей/фотона) из значения пикселя в количество фотонов.
- Преобразуйте среднее и стандартное отклонение числа пикселей (полученное на шаге 1.14.14) в количество фотонов, т.е. разделив их на «коэффициент пересчета» (полученный на шаге 1.14.18). Сравните среднее и стандартное отклонение количества фотонов. Убедитесь, что стандартное отклонение приблизительно равно квадратному корню среднего значения количества фотонов, если производительность системы визуализации близка к пределу шума выстрела.
- [Необязательно] Проверьте эффективность обнаружения сигнала микроскопом.
- Чтобы проверить производительность микроскопа и эффективность обнаружения сигнала, выполните шаги 1.14.1-1.14.17 для получения количества фотонов. На этапе 1.14.15 создать пустой образец из растворителя для красителя и получить количество фотонов для пустого образца с включенным лазером и с той же мощностью, что и для бассейна красителей. Вычтите количество пустых чисел из подсчета фотонов из бассейна красителей, чтобы получить количество флуоресцентных фотонов.
- Используйте известные поперечные сечения 3P флуоресцеина или Texas Red10,22 и Eq. (1) (с эффективным NA для правильного учета заполнения задней апертуры) для расчета ожидаемого количества фотонов, а затем сравните рассчитанное значение с количеством фотонов, измеренным экспериментально. Запишите оба количества фотонов в лабораторную тетрадь в качестве результатов теста для микроскопа для будущих ссылок.
ПРИМЕЧАНИЕ: Убедитесь, что расчетные и измеренные значения находятся близко друг к другу (например, в пределах коэффициента 2). Такие количественные тесты системы особенно полезны для обеспечения согласованной производительности визуализации с течением времени.
2. Подготовка рыбы к 15:00
ПРИМЕЧАНИЕ: Наденьте перчатки и лабораторное пальто для этой процедуры. Выбирайте взрослую рыбку данио по результатам эксперимента. Завершите всю подготовку (шаги 2.1 -2.7) в течение ~15 мин.
- Приготовьте чашку Петри с ~0,5 см 2% агара с высокой температурой плавления. Вырежьте прямоугольное отверстие в агаре длиннее и немного шире рыбы. Используйте воск, чтобы прикрепить тонкие трубки (для перфузии воды в рот рыбы) к чашке Петри одним концом в прямоугольнике. Используйте воск, чтобы прикрепить трубку большего диаметра (для удаления воды) к краю чашки Петри.
- Выберите рыбу для эксперимента. Обезболивайте рыбу раствором трикаина 0,2 мг/мл (рН 7,2) в растворе Хэнка до тех пор, пока рыба полностью не перестанет реагировать и не будет глубоко обезболена.
- Положите рыбу на бок на мокрую губку. Используя микрошприц, ретроорбитально вводят 3 мкл бромида панкурония (0,4 мкг/мкл в растворе Хэнка), чтобы парализовать рыбу. Поместите рыбу в раствор Хэнка ненадолго, чтобы убедиться, что она полностью парализована.
- Поместите рыбу спинной стороной вверх в чашку Петри головкой к трубке. Используя щипцы для манипулирования трубкой, осторожно откройте рот рыбы и сдвиньте трубку в рот. Осторожно сдвиньте рыбу к трубке так, чтобы трубка была в задней части рта рыбы.
- Быстро, но осторожно высушите агар вокруг рыбы и удалите воду сверху на рыбу. Окуните небольшой кусочек лабораторной ткани в лабораторный клей и нанесите ткань на агар с обеих сторон рыбы и на спину рыбы хвост к жабрам.
ПРИМЕЧАНИЕ: Не давите на рыбу и не надавливайте. Будьте осторожны, чтобы избежать попадания клея на жабры. - Нанесите небольшую каплю бупивакаина непосредственно на поверхность головы, чтобы обезболить рыбу во время визуализации в области, где лазер будет контактировать с кожей.
- Поднесите чашку Петри с рыбой к микроскопу и наполните ее рыбной водой. Подключите трубку к водяному насосу, чтобы закачать системную воду со скоростью 2 мл /мин в рот рыбы и одновременно удалить перфузионный раствор из чашки с той же скоростью. Убедитесь, что вода насыщается кислородом с помощью барботера и нагревается до ~ 30 ° C с помощью аквариумного нагревателя.
ПРИМЕЧАНИЕ: Рыба теперь готова к визуализации. Следите за здоровьем рыб, контролируя кровоток в сигнале третьей гармонической генерации (THG) во время визуализации (см. раздел 4.1). 3P-визуализация также должна быть совместима с более сложными препаратами рыб, такими как те, которые используются в 2P-визуализации, чтобы зафиксировать голову и позволить движения тела во время визуализации во время виртуальной реальности23. Эта полностью неинвазивная визуализация позволяет избежать необходимости удаления черепа, как это типично в других исследованиях позвоночных, и является шагом к минимизации инвазивных исследований и связанной с ними боли.
3. Подготовка мыши к 15:00
ПРИМЕЧАНИЕ: Надевайте перчатки, хирургическую маску и лабораторное покрытие во время следующих процедур. Выберите линию мыши в соответствии с экспериментом. Мышь должна быть размещена под светло-темным циклом 12:12 ч перед операцией. Вся операция (шаги 3.2-3.11) является асептической, и все хирургические инструменты должны быть стерилизованы перед использованием. Трепанация черепа занимает ~1 ч.
- Поместите крышку в форме пончика (диаметром 4,5-6,5 мм) и диск (диаметром 5 мм) на чистую парапленку. Используйте иглу, чтобы нанести небольшое количество оптического клея, чтобы приклеить крышку в форме пончика на диск крышки. Отверните диск-пончик на парапленке под ультрафиолетовым светом в течение 10-20 мин. Снимите весь диск-пончик с парапленки и используйте пинцет, чтобы выцарапать лишний клей и 70% этанола для удаления мусора.
ПРИМЕЧАНИЕ: Толщина чехлов составляет ~0,17 мм. Пончик в форме чехла используется для оказания соответствующего давления на мозг для хронической визуализации. - Обезболивают мышь 3% изофлураном и 20% газовой смесьюO2 в индукционной камере. Взвесьте мышь. Поместите мышь в положение лежа на грелке. Установите температуру грелки на ~37 °C.
- Зафиксируйте верхние зубы в ротовом отверстии стереотаксического аппарата с размещением анестезирующей маски. Закрепите ушные вкладыши к ушам. Поддерживайте анестезию 2% изофлураном и 20% газовой смесью O2 во время операции.
ПРИМЕЧАНИЕ: Отрегулируйте концентрацию изофлурана, отслеживая реакцию мыши. Проверьте уровень анестезии, наблюдая за частотой дыхания (~ 1 Гц для глубокого сна) и зажимая ноги, чтобы проверить любую реакцию перед операцией. - Нанесите глазную мазь на глаза для смазывания. Закройте веки. Включите все хирургические огни. Подкожно вводите кетопрофен, дексаметазон и гликопирролат в зависимости от массы тела мыши перед операцией.
ПРИМЕЧАНИЕ: Дозы препарата составляют 2 мг/мл, 0,1 мг/мл и 0,1 мг/мл для кетопрофена, дексаметазона и гликопирролата соответственно. Инъекционные объемы кетопрофена, дексаметазона и гликопирролата зависят от массы тела и составляют 2,5 мкл/г, 2 мкл/г и 2 мкл/г соответственно. - Удалить волосы на макушке головы и возле ушей.
- Обрежьте как можно больше волос ножницами или машинкой для стрижки волос и удалите обрезанные волосы с места операции.
- Нанесите соответствующее количество крема для депиляции. Подождите 1 мин.
- Удалите волосы и крем с помощью ватного тампона, смоченного в физиологическом растворе.
- Повторяйте шаги 3.5.2 и 3.5.3 до тех пор, пока волосы не будут полностью удалены.
- Нанесите 5% раствор повидона-йода, а затем 70% этанол на кожу для очищения области. Повторите процесс три раза.
- Дают подкожную инъекцию атропина (доза из расчета массы тела, 0,02-0,05 мг/кг) на голову. Подождите 1 мин.
- Вырежьте кожу на макушке головы, чтобы обнажить череп. Убедитесь, что точка брегмы и точка лямбда открыты. Приклейте оставшуюся ткань кожи на краю черепа, используя биосовместимый клей, чтобы избежать попадания пыли сверления под кожу (что может вызвать иммунный ответ).
- Используйте хирургический маркер, чтобы нарисовать круг диаметром 5 мм над интересующей областью. Например, выберите центр области ~2,5 мм боковой и 2 мм каудальной к брегме, которая охватывает большую часть соматосенсорной коры и зрительной коры.
- Медленно сверлите вдоль круга и нанесите физиологический раствор, чтобы увлажнить череп, когда это будет сделано на полпути. Замедлите скорость сверления в течение последней половины и накройте череп физиологическим раствором перед удалением черепа. Осторожно откройте череп щипцами и нанесите небольшой кусочек стерильной гельпены, смоченный в физиологическом растворе, чтобы немедленно остановить любое кровоизлияние в мозг. Поддерживайте гидратацию мозга с помощью физиологического раствора.
- Нанесите каплю физиологического раствора на бок подготовленного диска-пончика, обращенного к мозговой ткани. Поместите выступающую дисковую часть дисковой крышки пончика в краниальное окно. Используйте длинный стержень, удерживаемый стереотаксическим аппаратом, чтобы осторожно надавить дисковой частью черепного окна крышки на поверхность мозга, гарантируя, что часть пончика плотно покрывает череп. Высушите область вокруг диска-пончика ватным тампоном.
- Нанесите слой биосовместимого клея под край в форме пончика. Нанесите слой зубной цементной смеси под и вокруг пончика. Нанесите еще один слой клея поверх зубного цемента. 5% глюкозы (доза, основанная на массе тела, 10 мкл / г) может вводиться подкожно каждый час во время операции для обеспечения животного энергией.
- Выключите систему анестезии. Освободите мышь от стереотаксического аппарата. Немедленно переведите мышь на индивидуальный компактный стереотаксический аппарат с грелкой при температуре ~37 °C и анестезиологическим аппаратом.
- Поместите мышь в положение лежа на грелке настраиваемого компактного стереотаксического аппарата. Установите температуру ~37 °C. Зафиксируйте верхние зубы в ротовом отверстии стереотаксического аппарата и ушные перекладины к ушам мыши. Нанесите на анестетики и поддерживайте анестезию 1,5% изофлурана и 20% газовой смесиO2.
ПРИМЕЧАНИЕ: Теперь мышь готова к созданию изображений. Держите мышь под наркозом во время следующих процедур визуализации. Отрегулируйте концентрацию изофлурана, отслеживая реакцию мыши.
4. Прижизненная визуализация в мозге рыб и мышей
- Прижизненная визуализация в мозге рыбок данио
ПРИМЕЧАНИЕ: Чтобы правильно расположить мозг рыбы под объективом, камера вторичного устройства с зарядовой связью (ПЗС) используется на том же пути, что и свет возбуждения для широкоугольной визуализации.- Настройте микроскоп и откалибруйте мощность (как описано в разделе 1).
- Поместите на микроскоп объектив с низким увеличением (обычно 4x).
- Поместите чашку Петри, содержащую рыбу и трубки, под микроскоп.
- Используйте светодиодный (LED) источник света для освещения чашки Петри.
- Откройте режим камеры программного обеспечения для сбора изображений (рисунок 2).
- Нажмите кнопку Live.
- Выберите канал A в правой части экрана.
- Отрегулируйте параметры гистограммы, чтобы изображение было четко видно.
ПРИМЕЧАНИЕ: Они должны обновляться по мере необходимости. - Установите для параметра двигателя на контроллере двигателя значение Base.
- Опустите объектив до тех пор, пока рыба не станет видимой.
ПРИМЕЧАНИЕ: Убедитесь, что объектив не имеет физического контакта с головой. - Поместите центр головы рыбы в центр поля зрения.
- Переместите цель вверх и подальше от головы рыбы.
- Замените объектив с низким увеличением объективом с высоким NA для 3PM.
ПРИМЕЧАНИЕ: Объектив с низким увеличением и объектив с высоким NA не обязательно должны быть парфокальными, но должны быть достаточно близкими, чтобы рыба находилась в поле зрения объектива с высоким NA. - Медленно опустите объектив, следя за тем, чтобы объектив не вступал в физический контакт с головой. В программном обеспечении ПЗС-камеры остановите перемещение объектива, когда видна верхняя часть головы. Установите для местоположения z значение 0 мкм.
ПРИМЕЧАНИЕ: Убедитесь в отсутствии пузырьков воздуха под объективом при использовании объектива с погружением в воду. - Выключите светодиодный источник света и закройте темную завесу вокруг системы.
- Установите программное обеспечение для сбора изображений в многофотонный режим GG для изображения 3P и установите мощность под объективом менее 1 мВт (с частотой повторения импульсов ~1 МГц).
- Измените кнопку настройки двигателя с Base на Objective на контроллере двигателя.
- Выключите свет в комнате.
- Включите PMT и откройте затвор источника возбуждения 3PM. Убедитесь, что контур кости появляется в сигнальном канале флуоресценции из-за автофлуоресценции и в сигнальном канале THG из-за THG кости (рисунок 2C).
- Выполняйте визуализацию на разных глубинах, увеличивая уровни мощности при более глубоком изображении.
- Прижизненная визуализация в мозге мыши
ПРИМЕЧАНИЕ: Вводите 5% глюкозы в анестезируемую мышь каждый час во время визуализации; доза рассчитывается исходя из массы тела (10 мкл/г).- Установите программное обеспечение для сбора изображений в многофотонный режим GG для изображения 3P и установите мощность под объективом менее 1 мВт (с частотой повторения импульсов ~1 МГц).
ПРИМЕЧАНИЕ: Убедитесь, что операционное окно расположено перпендикулярно объективу, чтобы уменьшить аберрацию. Тонкая регулировка осуществляется путем наклона стереотаксического аппарата. - Переместите объектив близко к окну и нанесите воду между объективом и краниальным окном; установите значения осей всех двигателей равными нулю.
ПРИМЕЧАНИЕ: Поглощение света вH2Oпри ~1,700 нм велико, что значительно снижает мощность ~1,700 нм лазера после глубины ~1-2 мм воды. Для возбуждения ~ 1 700 нм используйте D2O, который имеет гораздо меньшее поглощение при 1 700 нм, для погружения в воду, чтобы уменьшить поглощение водой. - Нажмите кнопку Live в программном обеспечении для сбора изображений и откройте каналы PMT, например, один канал флуоресцентного сигнала и один канал сигнала THG. При необходимости отрегулируйте коэффициент усиления PMT и уровень фона .
- Медленно перемещайтесь вверх по объективу, чтобы найти поверхность окна, контролируя канал THG от крупных кровеносных сосудов и поверхности оконного стекла. При необходимости отрегулируйте ориентацию окна (см. примечание в шаге 4.2.12). Ноль моторов , чтобы определить поверхность мозга.
- Выполняйте визуализацию и регулируйте уровень мощности в соответствии с глубиной изображения.
- Установите программное обеспечение для сбора изображений в многофотонный режим GG для изображения 3P и установите мощность под объективом менее 1 мВт (с частотой повторения импульсов ~1 МГц).
Результаты
Успешное завершение этого протокола приведет к правильно выровненному микроскопу с оптимальными световыми параметрами (например, длительностью импульса, NA) и препаратами животных, подходящими для in vivo 3PM. Коммерчески доступная установка 3P включает в себя соответствующие зеркала и объективы как для ~1,300 нм, так и для ~1,700 нм; поэтому при переключении длины волны возбуждения между 1 300 нм и 1 700 нм не требуется никаких изменений в оптике. Если линзы в установке 3P не имеют соответствующего покрытия для 1 300 и 1 700 нм, их необходимо заменить соответствующими, чтобы уменьшить потери мощности лазера. Благодаря оптимизированному 3PM и правильной подготовке животных, флуоресценция in vivo и изображения THG с высокой контрастностью могут быть собраны глубоко в мозге.
На рисунке 3 показаны репрезентативные изображения 3P неповрежденных взрослых рыбок данио. Высокое разрешение, неинвазивная и глубокая визуализация генетически меченых нейронов в мозге взрослой рыбки данио достигается с использованием 3PM. Хотя сообщалось о визуализации в области теленцефалона в мозге взрослой рыбки данио с использованием2PM 24,25,26,27, 3PM позволяет получить доступ ко всему теленцефалону и областям, которые более сложны или невозможны для наблюдения с использованием других методов. Распределение клеточных слоев в зрительном тектуме и мозжечке можно наблюдать на рисунке 3С. При успешном сеансе визуализации кость видна в канале THG, а нейроны видны в канале флуоресценции. Для визуализации взрослых рыбок данио для обнаружения рыб использовалась функция камеры микроскопа (рисунок 3A). Этот шаг не является необходимым для визуализации мозга мыши, так как стеклянное окно достаточно велико, чтобы сделать мозг легко доступным. Структурные изображения мозга взрослых рыбок данио с высоким разрешением были получены с использованием системы, описанной в предыдущих разделах. Череп виден в канале THG (рисунок 3B), который помогает ориентироваться в мозге и находить верхнюю поверхность. Как показано на рисунке 3C, нейроны различимы с высоким отношением сигнал/фон (SBR) глубоко в мозге взрослого человека. Ткань над мозгом видна в флуоресцентном канале за счет автофлуоресценции.
На рисунке 4 показаны многоцветные 3P-изображения нейронов, меченных GCaMP6s (зеленый) и меченых красным цветом кровеносных сосудов Техаса (красный) вместе с сигналами THG (синий) в мозге взрослой мыши с возбуждением10 340 нм. Изображения воспроизведены из предыдущей работы10. На рисунке 4 энергия импульса в фокусе поддерживалась на уровне ~1,5 нДж на всей глубине для получения достаточной флуоресценции и сигналов THG, а максимальная средняя мощность лазера составляла ~70 мВт. Длительность импульса была скорректирована до ~60 fs, а эффективная NA составила ~0,8. С оптимизацией настройки 3PM были успешно получены высококонтрастные изображения до 1,2 мм от поверхности мозга в области гиппокампа CA1 (рисунок 4A, B). На рисунке 4C, D показаны следы активности Ca2+ нейронов, меченных GCaMP6s, на глубине 750 мкм в течение 10-минутного сеанса записи, демонстрируя высокую точность записи.
Если лазер возбуждения смещен, может наблюдаться неравномерность яркости сигнала по всему полю зрения. Кроме того, если параметры лазера, такие как длительность импульса, энергия импульса возбуждения в фокусе и эффективная NA, не оптимизированы, изображение THG из черепа рыбы или краниотомического окна мозга мыши не будет видно и / или требует высокой энергии импульса возбуждения (например, >2 нДж / импульс в фокусе). Следовательно, сигналы THG на поверхности мозга могут быть использованы в качестве индикатора для оптимизированной настройки 3PM перед началом глубокой визуализации тканей.
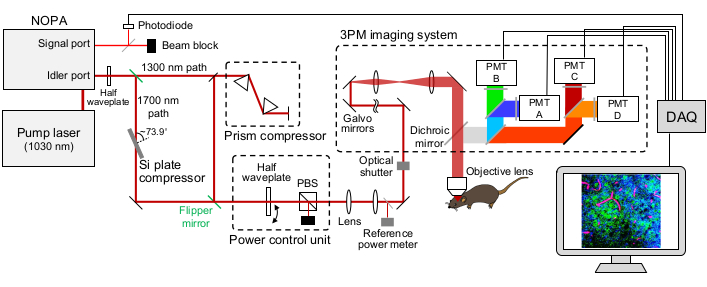
Рисунок 1: Схематическая иллюстрация установки 3PM. Длина волны лазера возбуждения установлена на уровне ~1,300 нм или ~1,700 нм, выход из порта холостого хода NOPA. Компрессор призменной пары и компрессор Si пластины используются для лазера ~1,300 нм и ~1,700 нм, соответственно, для предварительного формирования лазерного импульса возбуждения. Лазерные лучи ~1,300 нм и ~1,700 нм можно переключать с помощью зеркал-флипперов. Сигнальный порт NOPA используется для получения сигнала срабатывания. Полуволновая пластина и PBS используются для управления мощностью возбуждения. Флуоресценция и THG обнаруживаются GaAsP PMT. Соответствующие комбинации дихроичных зеркал и полосовых фильтров используются для разделения флуоресцентных и THG-сигналов. Сокращения: 3ПМ = трехфотонная микроскопия; NOPA = неколлинеарный оптический параметрический усилитель; PBS = поляризационный светоделитель; THG = генерация третьей гармоники; DAQ = сбор данных; PMT = фотоумножительная трубка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
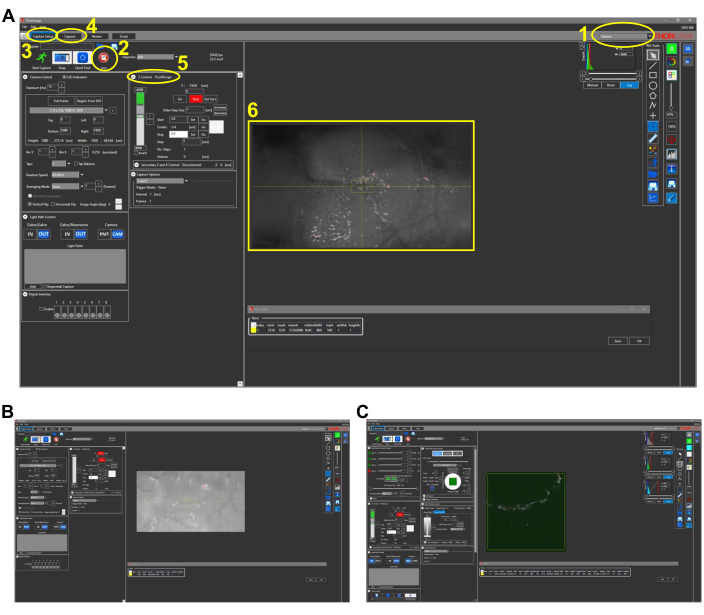
Рисунок 2: Репрезентативные скриншоты для прижизненной визуализации у рыб (раздел протокола 4.1). (A) Вид в режиме камеры программного обеспечения для получения изображения с объективом 4x на месте. Основные характеристики программного обеспечения изложены и пронумерованы следующим образом: 1. Режим визуализации программного обеспечения для получения изображений. Варианты режима: Камера, Многофотонный и Многофотонный GG. Для изображения белым светом с помощью ПЗС-камеры выбирается режим камеры . 2. Нажатие кнопки Live включает камеру (или PMT, если в многофотонных вариантах), и можно наблюдать вид микроскопа в режиме реального времени. 3. На вкладке Capture Setup задаются желаемые параметры изображения (мощность, местоположение, глубина). 4. На вкладке «Захват» для сохраненных изображений назначается расположение папки. Изображение можно запустить на этой вкладке. 5. Настройка Z Control управляет глубиной изображения путем перемещения двигателя z-ступени. 6. Репрезентативное изображение головы рыбки данио. Ростральная сторона головы находится слева. (B) Репрезентативный вид режима камеры с объективом 25x. (C) Репрезентативный вид многофотонного режима GG , содержащий изображение THG изображения, видимого в (B). Сокращения: ПЗС = устройство с зарядовой связью; PMT = фотоумножительная трубка; THG = генерация третьей гармоники. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
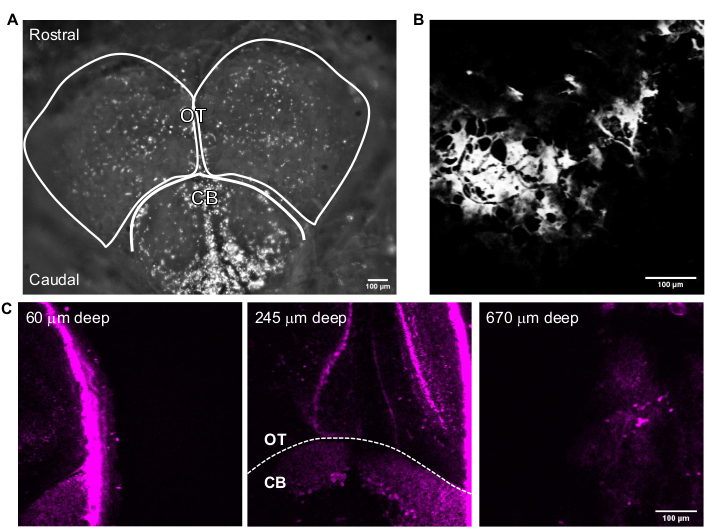
Рисунок 3: Репрезентативные изображения мозга взрослой рыбки данио, полученные с помощью программного обеспечения для получения изображений. (A) Изображение головы взрослой рыбки данио в режиме камеры, полученное с помощью объектива 4x. Верхняя часть изображения – ростральное направление. Очерчены доли ОТ и КБ. (B) Репрезентативное изображение, полученное в многофотонном режиме GG с 25-кратным объективом, содержащим THG изображение (A). (C) Флуоресцентные изображения мозга взрослых рыбок данио на пересечении мозжечка и оптического тектума, где GFP выражается в цитоплазме нейронов различной глубины. Шкала стержней = 100 мкм. Сокращения: OT = оптический тектам; CB = мозжечок; THG = генерация третьей гармоники; GFP = зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
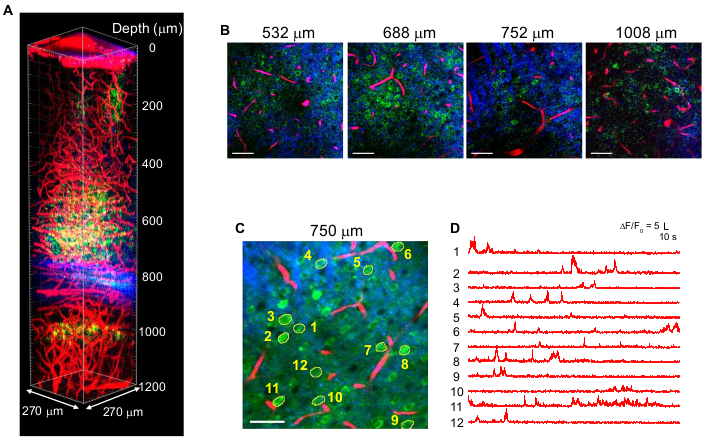
Рисунок 4: Многоцветные 3PM нейронов, меченых GCaMP6s (зеленый), техасские красные кровеносные сосуды (красный) и генерация третьей гармоники (синий) при возбуждении 1 340 нм в мозге мыши. (A) изображения Z-стека до 1 200 мкм с поверхности мозга с полем зрения 270 x 270 мкм (512 x 512 пикселей на кадр). Мощность лазера варьировалась в зависимости от глубины изображения для поддержания энергии импульса ~ 1,5 нДж в фокусе. Максимальная средняя мощность под объективом составила 70 мВт. (B) Выбранные 2D-изображения на различной глубине изображения. (C) Участок регистрации активности на высоте 750 мкм под твердой мозговой оболочкой с полем зрения 270 x 270 мкм (256 x 256 пикселей). (D) Спонтанные следы мозговой активности, записанные у бодрствующей мыши от меченых нейронов, указанных в (C). Частота кадров составила 8,3 Гц, при времени выдержки пикселя 0,51 мкс. Частота повторения лазера составляла 2 МГц, а средняя мощность под объективом составляла 56 мВт. Каждая трассировка была нормализована до исходной линии и отфильтрована нижними частотами с использованием окна хамминга с постоянной времени 0,72 с. Шкала стержней = 50 мкм. Эта цифра и легенда рисунка воспроизводятся из 10. Аббревиатура: 3ПМ = трехфотонная микроскопия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
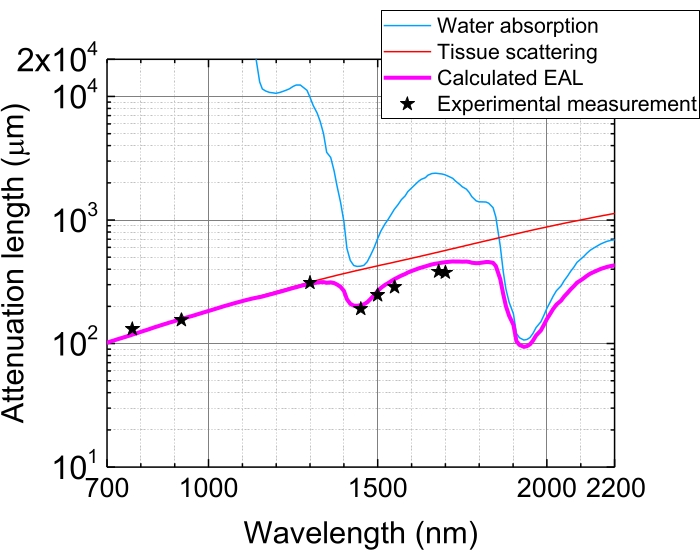
Рисунок 5: Эффективная длина затухания в неокортексе мозга мыши. EAL (пурпурная линия) рассчитывается по рассеянию тканей (красная линия) и поглощению воды в ткани (синяя линия), предполагая 75% водного состава. Черные звезды указывают на сообщенные экспериментальные данные EAL в неокортексе мозга мыши 3,21,28,29. Обратите внимание, что EAL варьируется в разных тканях. Аббревиатура: EAL = эффективная длина затухания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Длина волны возбуждения (нм) | Погружная вода | Максимальная мощность лазера (мВт) | Максимальная энергия импульса в фокусе* (нДж) | Типичный EAL в коре головного мозга мыши (мкм) | Глубина визуализации в коре головного мозга мыши** (мм) | Энергия импульса под цель*** (нДж) | Максимальная частота лазерного повторения**** (МГц) |
| 1300 | Н2О или Д2О |
 100 100 |
 2 2 | ~300 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210 | ~0,5 | |||||
| 2.1 | ~1100 | ~0,1 | |||||
| 1700 | Д2О |
 50 50 |
 3 3 | ~400 | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2,5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~190 | ~0,3 |
Таблица 1: Типичные условия возбуждения 3 P для визуализации коры головного мозга мыши.
* С высоким na (~ 1,0) объективом, шириной импульса ~ 50 fs и типичными флуорофорами, такими как флуоресцентные белки (например, GFP и RFP).
** С предположением, что EAL является однородным во всей коре.
Для достижения ~1 нДж/импульс в фокусе, рассчитывается по EAL и глубине изображения.
Рассчитывается от энергии импульса под объективом и максимальной разрешающей мощности лазера.
Сокращения: 3P = трехфотонный; NA = числовая диафрагма; GFP = зеленый флуоресцентный белок; RFP = красный флуоресцентный белок; EAL = эффективная длина затухания.
Обсуждение
Этот протокол объясняет пошаговые процедуры настройки 3P-визуализации с коммерческим микроскопом и лазерным источником. По сравнению с 2PM, 3PM имеет преимущество в приложениях, требующих оптического доступа в более глубоких областях, таких как гиппокамп мозга мыши. Хотя 3PM в основном используется в неврологии, 3PM может быть потенциально применен в других тканях, таких как лимфатические узлы, кости и опухоли для глубокого наблюдения тканей.
Важно убедиться, что система визуализации работает близко к пределу шума выстрела, что гарантирует, что электроника обнаружения и сбора данных вносит незначительный шум в изображение после PMT. Неопределенность в количестве обнаруженных фотонов фундаментально ограничена шумом фотонного снимка. Ограниченная производительность по шуму выстрела может быть достигнута в типичном многофотонном микроскопе с использованием фотоприемника с высоким коэффициентом усиления (например, PMT). Фотонный шум следует статистическому распределению Пуассона, в котором стандартное отклонение распределения равно квадратному корню среднего распределения. Чтобы проверить производительность ограниченного шума выстрела, выполните шаг 1.14 в разделе протокола.
Чтобы избежать ослабления света на H2O, полезно использовать D2O для погружения, особенно для возбуждения ~ 1 700 нм. Прииспользовании D 2O важно обновлять D2O каждые ~ 10 минут или использовать большой объем D2O, чтобы избежать обмена D2O / H2O во время визуализации. Можно также герметизировать D2O из комнатной среды3. Если для визуализации используется объектив с большим рабочим расстоянием (WD) (например, WD при 4 мм или длиннее), толщина погружной жидкости может превышать 2-3 мм. Увеличенная толщина делает поглощениеH2Oнепренебрежимо малым даже при ~1 300 нм21. Поэтому D 2 O можетпонадобитьсядаже для 1 300 нм 3PM при использовании длинного объектива WD.
Поскольку интенсивность флуоресценции 3P зависит от куба энергии импульса возбуждения в фокусе (экв. (1)), установка соответствующей мощности лазера особенно важна для получения адекватных сигналов флуоресценции 3P, избегая теплового и нелинейного повреждения в живых тканях. Средняя мощность лазера должна быть ниже порога теплового повреждения. В мозге мыши, например, чтобы избежать повреждения термической ткани, средняя мощность на поверхности мозга мыши должна поддерживаться на уровне или ниже ~ 100 мВт для возбуждения ~ 1 300 нм на глубине 1 мм и с полем зрения (FOV) 230 мкм х 230 мкм21. Аналогичным образом, средняя мощность при ~1 700 нм должна поддерживаться на уровне или ниже ~50 мВт на глубине ~1 мм и FOV ~230 мкм x 230 мкм (неопубликованные данные). Кроме того, чтобы избежать насыщения возбуждения и потенциального нелинейного повреждения, энергию импульса возбуждения следует поддерживать на уровне  2 нДж и
2 нДж и  3 нДж для возбуждения ~1 300 нм и ~1 700 нм соответственно30.
3 нДж для возбуждения ~1 300 нм и ~1 700 нм соответственно30.
За счет поглощения и рассеяния света в тканях энергия импульса в фокусе ослабевает до 1/е (~37%) после проникновения в ткани 1 EAL. EAL варьируется в разных тканях и с длинами волн возбуждения, например, в неокортексе мозга мыши, EAL составляет ~ 300 мкм и ~ 400 мкм при ~ 1 300 нм и ~ 1 700 нм, соответственно 3,29 (рисунок 5). Поэтому, чтобы сохранить ту же энергию импульса в фокусе (например, 1 нДж/импульс) на глубине n EAL, энергию поверхностного импульса необходимо умножить на 1 нДж × en. Для быстрой визуализации структурной и функциональной динамики лазер возбуждения с высокой частотой повторения (на 1 МГц и выше) желателен для достижения высокой частоты кадров 5,6,7,10. Однако потребность в энергии импульса и средний предел мощности лазера ограничивают применяемую частоту повторения.
Например, когда мы визуализируем умеренно глубокую область при 4 EAL (то есть ~ 1,2 мм в коре мыши с возбуждением 1 300 нм), ~ 55 нДж / импульс на поверхности требуется для удержания 1 нДж / импульс в фокусе. Когда среднее ограничение мощности составляет 100 мВт, мы можем применить частоту лазерного повторения ~ 2 МГц. Однако для получения более глубокого изображения на глубине 7 EAL требуется ~ 1 100 нДж / импульс на поверхности для поддержания 1 нДж / импульс в фокусе. Предполагая, что максимальная средняя мощность составляет 100 мВт, чтобы избежать теплового повреждения, скорость повторения лазера должна быть уменьшена до 0,1 МГц для достижения 1 100 нДж / импульс на поверхности. В таблице 1 обобщены типичные условия визуализации в коре головного мозга мыши. Обратите внимание, что глубины визуализации в таблице 1 предполагают, что EAL является однородным во всей коре мыши.
Кроме того, из-за ограничения мощности лазера в глубоких тканях 3PM существует компромисс между частотой кадров и размером пикселя изображения, что особенно важно для функциональной визуализации, такой как кальциевая визуализация. Максимальная доступная частота повторения лазера определяется на каждой глубине на основе требуемой импульсной энергии в фокусе и применимой средней мощности лазера, как обсуждалось выше, например, 2 МГц на глубине, эквивалентной ~4 EAL с возбуждением 1 300 нм. Как правило, для визуализации требуется не менее одного импульса на пиксель. Соответственно, минимальное доступное время выдержки пикселя определяется частотой повторения лазера, например, 0,5 мкс/пиксель при возбуждении 2 МГц.
Чтобы сохранить высокое пространственное разрешение (~ 1 мкм в боковом виде) в изображениях 3P, идеально установить 1 пиксель на площадь ~ 1 мкм2, например, 256 x 256 пикселей для FOV 250 x 250 мкм2. Следовательно, для выполнения быстрой визуализации со значительно большим FOV (например, 250 x 250мкм2 с 256 x 256 пикселями), 0,5 МГц, 1 МГц и 2 МГц частоты повторения импульсов дают теоретическую максимальную частоту кадров ~ 7,6, ~ 15 и ~ 30 кадров / с соответственно. Аналогичным образом, оптимизация частоты повторения лазера имеет важное значение, в зависимости от глубины цели, скорости сканирования и FOV, для применения адекватной импульсной энергии при пороге теплового повреждения. Для увеличения скорости визуализации адаптивный источник возбуждения может быть использован для концентрации всех импульсов возбуждения на нейронах (т.е. областях, представляющих интерес) путем доставки лазерных импульсов по требованию к нейронам31.
3PM выгоден по сравнению с 2PM в глубокой визуализации в живых тканях и через сильно рассеивающие среды, такие как череп, кости и слой белого вещества (то есть внешняя капсула) мозга мыши. Более длительный EAL и нелинейное возбуждение 3PE более высокого порядка приносит пользу глубокой тканевой визуализации. Например, для изображения GCaMP6 в коре головного мозга мыши сигнал флуоресценции 2P с возбуждением 920 нм выше, чем сигнал флуоресценции 3P с возбуждением 1 300 нм в неглубоких областях при  690 мкм (т.е. ~ 2,3 EAL при 1 300 нм)21. Однако из-за более длительного EAL при 1 300 нм по сравнению с 920 нм, 3PE дает более сильную флуоресценцию, чем возбуждение 2P (2PE) на глубине ~ 690 мкм и глубже21. Эта глубина определяется как «глубина пересечения сигнала», при которой силы флуоресцентного сигнала 2PE и 3PE идентичны с одинаковой частотой повторения и одинаковой максимально допустимой средней мощностью21. Глубина пересечения сигнала зависит от длин волн возбуждения для 2PE и 3PE и флуорофора.
690 мкм (т.е. ~ 2,3 EAL при 1 300 нм)21. Однако из-за более длительного EAL при 1 300 нм по сравнению с 920 нм, 3PE дает более сильную флуоресценцию, чем возбуждение 2P (2PE) на глубине ~ 690 мкм и глубже21. Эта глубина определяется как «глубина пересечения сигнала», при которой силы флуоресцентного сигнала 2PE и 3PE идентичны с одинаковой частотой повторения и одинаковой максимально допустимой средней мощностью21. Глубина пересечения сигнала зависит от длин волн возбуждения для 2PE и 3PE и флуорофора.
На практике возбуждение 920 нм обеспечивает более высокую среднюю мощность лазера, чем возбуждение 1 300 нм за счет меньшего поглощения воды. Однако более высокая средняя мощность 2PE увеличит глубину пересечения сигнала только на 0,9 EALs4. Кроме того, когда образец плотно маркирован, 3PE имеет дополнительное преимущество в виде гораздо более высокого SBR. Поэтому, даже до достижения длины пересечения сигнала, 3PM может быть лучше для визуализации, чем 2PM. Например, при визуализации сосудистой системы мозга мыши, которая имеет объемную долю (т.е. плотность маркировки) ~2%, 1 300 нм 3ПМ при мощности возбуждения 100 мВт превосходит 920 нм 2ПМ при мощности возбуждения 200 мВт на глубине ~700 мкм для флуоресцеина.
3PM также имеет преимущество при визуализации через тонкий, но сильно рассеивающий слой, который может исказить функцию точечного распространения пучка возбуждения и генерировать фон расфокусировки4. Например, через неповрежденный череп мозга мыши изображения 2PM страдают от расфокусированного фона даже на небольшой глубине <100 мкм от поверхности мозга13. Аналогичный фон расфокусировки наблюдался в 2 часа дня с возбуждением 1,280 нм через белое вещество в мозге мыши32. Поэтому, когда ткани визуализируются через мутные слои, 3PM предпочтительнее 2PM для высококонтрастной визуализации независимо от плотности маркировки.
Недавно мы сообщили о фантомном и теоретическом анализе бусин, показывающем, что предел глубины изображения 3PM составляет более 8 EALs33; 8 EAL эквивалентны ~ 3 мм с возбуждением ~ 1 700 нм в коре мыши. Однако доступный в настоящее время лазер не имеет достаточной импульсной энергии для достижения 8 EAL в мозге мыши. Дальнейшее развитие более сильных лазеров подтолкнет текущий предел глубины изображения в 3PM.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа была поддержана NSF DBI-1707312 Cornell NeuroNex Hub и NIH 1U01NS103516.
Материалы
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
Ссылки
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены