Method Article
Microscopie à fluorescence à trois photons des tissus profonds dans le cerveau intact d’une souris et d’un poisson-zèbre
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La microscopie à trois photons permet une imagerie par fluorescence à contraste élevé en profondeur dans les tissus biologiques vivants, tels que les cerveaux de souris et de poissons-zèbres, avec une résolution spatio-temporelle élevée.
Résumé
Les techniques de microscopie multiphotonique, telles que la microscopie à deux photons (2PM) et la microscopie à trois photons (3PM), sont des outils puissants pour l’imagerie in vivo des tissus profonds avec une résolution subcellulaire. 3PM présente deux avantages majeurs pour l’imagerie des tissus profonds par rapport à 2PM qui a été largement utilisée dans les laboratoires de biologie: (i) une longueur d’atténuation plus longue dans les tissus diffusants en utilisant un laser d’excitation ~ 1 300 nm ou ~ 1 700 nm; (ii) moins de génération de fluorescence de fond en raison d’une excitation non linéaire d’ordre supérieur. En conséquence, 3PM permet une imagerie structurelle et fonctionnelle à contraste élevé profondément dans les tissus de diffusion tels que le cerveau intact de la souris des couches corticales à l’hippocampe et à l’ensemble du cerveau antérieur du poisson-zèbre adulte.
Aujourd’hui, des sources laser adaptées à 3PM sont disponibles dans le commerce, permettant la conversion d’un système d’imagerie à deux photons (2P) existant en un système à trois photons (3P). De plus, plusieurs microscopes 3P commerciaux sont disponibles, ce qui rend cette technique facilement accessible aux laboratoires de recherche en biologie. Cet article montre l’optimisation d’une configuration typique de 15 heures, ciblant en particulier les groupes de biologie qui ont déjà une configuration 2P, et démontre l’imagerie 3D intravitale dans des cerveaux intacts de souris et de poissons-zèbres adultes. Ce protocole couvre la procédure expérimentale complète de l’imagerie 3P, y compris l’alignement au microscope, le prépuce d’impulsions laser ~1 300 et ~1 700 nm, la préparation animale et l’imagerie de fluorescence 3P intravitale au plus profond du cerveau des poissons-zèbres et des souris adultes.
Introduction
Dans les sciences de la vie, les techniques de microscopie multiphotonique (MPM), telles que 2PM et 3PM, ont été des outils puissants pour l’imagerie in vivo profonde avec une résolution spatio-temporelle élevée et un contraste élevé dans les tissus en diffusion. De plus, ces méthodes provoquent moins de photoblanchiment par rapport à la microscopie confocale à un photon 1,2,3,4. 3PM est avantageux pour l’imagerie des tissus plus profonds par rapport à 2PM en raison de deux caractéristiques majeures : (i) l’utilisation d’une excitation de longueur d’onde plus longue (~1 300 nm ou ~1 700 nm) réduit la diffusion tissulaire, et (ii) le processus d’excitation d’ordre supérieur (c’est-à-dire que le signal de fluorescence dépend du cube de la puissance d’excitation en 3PM au lieu du carré de la puissance d’excitation en 2PM) qui supprime la fluorescence de fond indésirable3 . Par conséquent, 3PM permet une imagerie à contraste élevé dans des régions plus profondes des tissus vivants tels que l’hippocampe dans un cerveau de souris adulte intact 3,5,6,7,8,9,10,11 et l’ensemble du cerveau antérieur du poisson-zèbre adulte12, y compris Ca 2+ enregistrement d’activité et observations multicolores. De plus, des images à contraste élevé ont été obtenues à 15h à travers les crânes intacts de souris et de poissons-zèbres adultes12,13.
Aujourd’hui, des sources laser d’excitation adaptées à l’excitation 3P (3PE) à ~1 300 et ~1 700 nm sont disponibles dans le commerce. Comme le système de balayage laser est essentiellement le même pour 14h et 15h, la conversion d’une configuration 2P existante en une configuration 3P est possible dans les laboratoires de biologie avec l’installation d’un laser disponible dans le commerce pour 3PE. Le signal de fluorescence 3P dépend de la puissance du laser, de la durée de l’impulsion, du taux de répétition du laser et de l’ouverture numérique (NA) de l’objectif. En supposant une mise au point limitée par diffraction (c.-à-d. que l’ouverture arrière de la lentille de l’objectif est surchargée par le faisceau d’excitation), Eq (1) décrit le flux de photons de fluorescence moyen dans le temps à partir du volume focal résultant de 3PE.
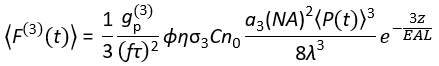 (1)
(1)
Où f est le taux de répétition laser, τ est la durée de l’impulsion laser (pleine largeur à la moitié maximale), φ est l’efficacité de collecte du système, η est l’efficacité quantique de fluorescence, σ3 est la section transversale d’absorption 3P, C est la concentration de fluorophore, n0 est l’indice réfléchissant du milieu de l’échantillon (par exemple, l’eau), λ est la longueur d’onde d’excitation dans le vide, NA est l’ouverture numérique de l’objectif, a3 est la constante d’intégration spatiale du volume focal,  est le flux de photons d’excitation moyenné dans le temps (photons / s) sous l’objectif, z est la profondeur imagée et EAL est la longueur d’atténuation effective14. Ici, nous avons supposé que l’EAL (généralement > 100 μm) est beaucoup plus grande que la résolution axiale du microscope (généralement < 10 μm). Sous approximation paraxiale, un3 est égal à 28,114. gp(3) est la cohérence temporelle du3e ordre de la source d’excitation, et gp(3) est 0,41 et 0,51 pour les impulsions hyperboliques-sécantes-carrées et les impulsions gaussiennes, respectivement. L’efficacité de la collecte φ peut être estimée en tenant compte de la collecte de fluorescence par la lentille de l’objectif, de la transmittance de la lentille de l’objectif, de la réflectivité du miroir dichroïque, de la transmittance des filtres et de l’efficacité de détection du détecteur (par exemple, tube photomultiplicateur ou PMT). Comme l’intensité de fluorescence 3P dépend fortement de divers paramètres, une optimisation de la configuration 3P est nécessaire pour maximiser les signaux de fluorescence 3P.
est le flux de photons d’excitation moyenné dans le temps (photons / s) sous l’objectif, z est la profondeur imagée et EAL est la longueur d’atténuation effective14. Ici, nous avons supposé que l’EAL (généralement > 100 μm) est beaucoup plus grande que la résolution axiale du microscope (généralement < 10 μm). Sous approximation paraxiale, un3 est égal à 28,114. gp(3) est la cohérence temporelle du3e ordre de la source d’excitation, et gp(3) est 0,41 et 0,51 pour les impulsions hyperboliques-sécantes-carrées et les impulsions gaussiennes, respectivement. L’efficacité de la collecte φ peut être estimée en tenant compte de la collecte de fluorescence par la lentille de l’objectif, de la transmittance de la lentille de l’objectif, de la réflectivité du miroir dichroïque, de la transmittance des filtres et de l’efficacité de détection du détecteur (par exemple, tube photomultiplicateur ou PMT). Comme l’intensité de fluorescence 3P dépend fortement de divers paramètres, une optimisation de la configuration 3P est nécessaire pour maximiser les signaux de fluorescence 3P.
Ce protocole illustre le processus d’optimisation d’une configuration 3P typique, ce qui sera particulièrement utile pour les laboratoires de biologie qui ont une configuration 2P et prévoient d’étendre sa capacité à l’imagerie 3P ou de maintenir leur configuration 3P commerciale à des performances optimales. Cet article vidéo démontre également l’imagerie 3P des tissus profonds dans les cerveaux d’animaux vivants. La première section traite de l’optimisation d’une configuration 3P typique avec une source laser disponible dans le commerce et un microscope multiphotonique. Les deuxième et troisième sections décrivent la préparation du poisson-zèbre et de la souris, respectivement, pour 3PM des structures et des activités neuronales. La chirurgie de craniotomie de la souris a déjà été rapportée dans les documents de protocole ainsi que 15,16,17. La quatrième section démontre l’imagerie 3P intravitale dans le cerveau des poissons-zèbres et des souris.
Protocole
Toutes les procédures d’expérimentation et de logement des animaux pour le poisson-zèbre et les souris ont été approuvées et menées conformément aux directives du Comité institutionnel de soins et d’utilisation des animaux de l’Université Cornell (IACUC). Le poisson-zèbre et les souris ont été euthanasiés par solution de tricaïne à haute concentration et asphyxie au dioxyde de carbone, respectivement, après l’expérience.
1. Optimisation de la configuration de la microscopie à trois photons
REMARQUE: Portez des lunettes de sécurité laser pour la protection des yeux. Bloquez le faisceau laser avec un bloqueur de faisceau lorsque des optiques sont placées ou déplacées. Pour visualiser le laser, utilisez une visionneuse infrarouge ou une carte de détecteur infrarouge.
- Allumez le laser et réglez la longueur d’onde centrale de la sortie de ralenti de l’amplificateur paramétrique optique non collinéaire (NOPA) à ~1 300 nm ou ~1 700 nm.
- Placez un verre à couvercle mince sur la ligne de faisceau à partir du port de signal de NOPA (c.-à-d. ~ 700-900 nm) pour réfléchir une petite fraction du faisceau laser vers une photodiode Si afin d’obtenir des signaux de déclenchement (Figure 1). Placez un bloqueur de faisceau dans le chemin de transmission du verre de couverture.
- Placez les compresseurs d’impulsions sur le trajet de la lumière pour prépucer le laser femtoseconde afin d’optimiser la durée de l’impulsion pour 15 heures. Pour un faisceau d’environ 1 300 nm, placez un compresseur à paire deprismes 18,19 (par exemple, paires de prismes N-SF11). Pour un laser ~1 700 nm, placez une plaque Si d’environ 3 mm d’épaisseur20. Réglez l’angle entre la plaque Si et le trajet laser à l’angle du Brewster (~73,9° pour 1 700 nm) pour maximiser la transmittance laser. Faites pivoter la plaque Si pour obtenir l’angle du Brewster en minimisant la réflexion.
- Placez des miroirs flipper pour permettre une commutation pratique entre les lignes de faisceau ~1 300 nm et ~1 700 nm.
- Placez une demi-plaque d’onde (par exemple, une demi-plaque d’onde achromatique adaptée à ~1 300 et ~1 700 nm) montée sur un étage de rotation et un séparateur de faisceau polarisant (PBS) pour contrôler l’intensité du laser. Placez un bloqueur de faisceau dans le chemin de réflexion du PBS.
REMARQUE: Le laser doit traverser le PBS perpendiculairement pour atteindre un taux d’extinction élevé. La puissance laser pour 3PM est contrôlée en faisant pivoter la demi-plaque d’onde. - Placez un verre de couverture mince dans le chemin de la lumière après le contrôleur de puissance et avant l’obturateur optique pour réfléchir une petite fraction du faisceau laser à un capteur de puissance. Utilisez le capteur de puissance comme « capteur de puissance de référence » pour calculer la puissance laser sous l’objectif pendant l’imagerie (voir étape 1.12).
- Alignez la trajectoire du laser en ajustant les miroirs pour propager le faisceau dans le système 3PM.
- Mesurez la taille du faisceau à la position de l’ouverture arrière de l’objectif à l’aide d’un tranchant sur un étage de translation et d’un capteur de puissance. Assurez-vous que la taille du faisceau n’est ni trop petite ni trop grande.
REMARQUE: En règle générale, le faisceau sous-remplit légèrement la lentille de l’objectif NA élevé pour atteindre un débit de puissance élevé pour l’imagerie des tissus profonds. Par exemple, une taille de faisceau d’environ 10-13 mm (1/e2) à l’ouverture arrière de l’objectif Olympus (~15 mm de diamètre d’ouverture arrière) permet d’obtenir un NA effectif de ~0,7-0,9. Lorsque la taille du faisceau est trop petite, le signal 3P devient faible et la résolution spatiale s’aggrave en raison du faible NA effectif. Lorsque la taille du faisceau est trop grande, la puissance d’excitation maximale disponible sous l’objectif devient faible en raison de la perte de puissance à l’ouverture arrière de l’objectif. Pour l’imagerie des tissus profonds, les rayons marginaux subissent également une perte plus élevée en raison du chemin plus long dans le tissu. - Si la taille du faisceau à l’ouverture arrière de l’objectif n’est pas appropriée, placez les éléments optiques appropriés, tels que des lentilles convexes, dans le trajet du faisceau laser pour ajuster la taille du faisceau.
REMARQUE: Assurez-vous que le faisceau laser n’est pas plus grand que les miroirs galvo pour éviter toute perte de puissance inutile. - Placez l’objectif sur la configuration de 15h.
- Mesurez la durée de l’impulsion après l’objectif à l’aide d’un autocorrélateur. Ajustez le compresseur d’impulsions pour obtenir des impulsions plus courtes si la durée de l’impulsion est trop longue (par exemple, >70 fs). Utilisez des impulsions ~50-70 fs pour 15h et un interféromètre Michelson placé entre le laser et l’objectif pour fournir le délai pour les mesures d’autocorrélation.
REMARQUE: Une photodiode avec une réponse spectrale appropriée (par exemple, une photodiode au silicium pour une longueur d’onde supérieure à 1 200 nm) placée au foyer de l’objectif peut facilement servir de détecteur non linéaire, et le photocourant à deux photons de la photodiode peut être utilisé pour obtenir les traces d’autocorrélation20. Le compresseur à paire de prismes pour ~1 300 nm peut être réglé de deux manières: (1) en changeant la distance entre les deux prismes; (2) modifier les longueurs de trajet du faisceau laser dans le verre du prisme en déplaçant le ou les prismes perpendiculairement à la ligne de base du prisme. Le compresseur à plaque Si pour ~1 700 nm peut être ajusté en remplaçant la plaque Si par une plaque Si plus épaisse ou plus mince. - Placez un capteur de puissance à la sortie de l’objectif. Mesurez la puissance laser sous l’objectif et lisez la valeur du capteur de puissance de référence (à partir de l’étape 1.6). Calculer le rapport de la puissance sous l’objectif et au capteur de puissance de référence.
REMARQUE: Pendant l’imagerie, la puissance laser réelle sous l’objectif peut être calculée à partir du rapport de puissance et de la valeur du capteur de puissance de référence. - Retirez le capteur de puissance sous l’objectif.
- [Facultatif] Vérifier les performances limitées du système d’imagerie par bruit de prise de vue de photons
REMARQUE: Pour effectuer cette tâche, les éléments suivants sont nécessaires: 1) un pool de fluorescéine ou de colorant rouge texas (par exemple, ~ 10 μM), 2) un compteur de photons et 3) un oscilloscope.- Placez l’échantillon de la piscine de colorant sous la lentille de l’objectif 3PM.
- Abaissez soigneusement la lentille de l’objectif sur le bassin de colorant jusqu’à ce que la distance soit inférieure à la distance de travail de la lentille de l’objectif.
- Placez de l’eau entre la lentille et le verre de couverture de la piscine de teinture.
- Réglez la puissance de sortie du microscope sur une petite quantité (par exemple, <1 mW avec un taux de répétition d’impulsions d’environ 1 MHz) pour localiser la surface du pool de colorants.
- Démarrez la session Live du microscope et définissez l’emplacement z sur zéro.
- Éloignez lentement l’objectif de l’échantillon pour atteindre le sommet du pool de colorant (comme l’indique la troisième génération harmonique (THG) produite par le verre de couverture).
- Réglez l’emplacement z sur zéro à la position du verre de couverture.
- Abaissez légèrement l’objectif jusqu’à ce qu’un signal de fluorescence clair soit visible dans le canal de fluorescence.
- Connectez la sortie du PMT à un répartiteur BNC. Connectez les sorties du diviseur au compteur de photons et au système d’acquisition d’images.
- Réglez la puissance du laser sur une valeur où le nombre de photons par seconde est inférieur à 5 % du taux de répétition du laser (par exemple,
 50 000 photons/s lorsqu’un laser de 1 MHz est utilisé).
50 000 photons/s lorsqu’un laser de 1 MHz est utilisé). - Réduisez le champ de vision au minimum possible avec le logiciel et assurez-vous que la luminosité est uniforme sur toute l’image.
- Définissez la fréquence d’images sur 1,0 image par seconde.
- Réglez la période d’acquisition du compteur de photons sur t = nombre de pixels par image × temps de séjour des pixels et un niveau de discriminateur approprié.
- Collectez le nombre de photons et le nombre de pixels simultanément pendant une période équivalente. Pour obtenir le nombre de pixels, collectez les valeurs moyennes en pixels de l’image entière, ainsi que les valeurs moyennes et d’écart-type.
- Répétez l’étape 1.14.14, en bloquant le laser d’excitation pour obtenir le nombre de photons sombres et le nombre de pixels.
- Arrêtez l’acquisition en direct du logiciel.
- Soustrayez les nombres d’obscurité (obtenus à l’étape 1.14.15) des nombres de photons (obtenus à l’étape 1.14.14) et le nombre total de pixels (obtenu à l’étape 1.14.14).
- Divisez le nombre total de pixels soustraits sombres par le nombre de photons soustraits sombres (obtenu à l’étape 1.14.17). Utilisez la valeur obtenue comme « facteur de conversion » (c.-à-d. valeurs de pixels/photons) d’une valeur de pixel à un nombre de photons.
- Convertir la moyenne et l’écart-type des nombres de pixels (obtenus à l’étape 1.14.14) en nombres de photons, c’est-à-dire les diviser par le « facteur de conversion » (obtenu à l’étape 1.14.18). Comparez la moyenne et l’écart-type du nombre de photons. Assurez-vous que l’écart-type est approximativement égal à la racine carrée de la moyenne des nombres de photons si les performances du système d’imagerie sont proches de la limite de bruit de prise de vue.
- [Facultatif] Vérifiez l’efficacité de détection du signal du microscope.
- Pour tester les performances du microscope et l’efficacité de la détection du signal, suivez les étapes 1.14.1-1.14.17 pour obtenir le nombre de photons. Pour l’étape 1.14.15, créez un échantillon vierge composé du solvant pour le colorant et obtenez le nombre de photons pour l’échantillon vierge avec le laser allumé et à la même puissance que pour le pool de colorants. Soustrayez les nombres de blancs des nombres de photons du pool de colorants pour obtenir les comptes de photons de fluorescence.
- Utilisez les sections transversales 3P connues de la fluorescéine ou du Texas Red10,22 et Eq. (1) (avec un NA efficace pour tenir compte du remplissage de l’ouverture arrière correctement) pour calculer le nombre de photons attendu, puis comparez la valeur calculée avec le nombre de photons mesuré expérimentalement. Enregistrez les deux nombres de photons dans le cahier de laboratoire en tant que résultats de test pour le microscope pour les références futures.
REMARQUE : S’assurer que les valeurs calculées et mesurées sont proches les unes des autres (p. ex., dans un facteur de 2). De tels tests quantitatifs du système sont particulièrement utiles pour assurer des performances d’imagerie constantes dans le temps.
2. Préparation du poisson pour 15h
REMARQUE: Portez des gants et une blouse de laboratoire pour cette procédure. Choisissez le poisson-zèbre adulte en fonction de l’expérience. Terminez toute la préparation (étapes 2.1 à 2.7) en ~15 min.
- Préparez une boîte de Petri avec environ 0,5 cm de gélose à point de fusion élevé à 2 %. Coupez un trou rectangulaire dans la gélose plus long et légèrement plus large que le poisson. Utilisez de la cire pour fixer un tube mince (pour la perfusion de l’eau dans la bouche du poisson) à la boîte de Pétri avec une extrémité dans le rectangle. Utilisez de la cire pour fixer des tubes de plus grand diamètre (pour éliminer l’eau) au bord de la boîte de Pétri.
- Choisissez des poissons pour l’expérience. Anesthésier le poisson avec une solution de tricaïne à 0,2 mg/mL (pH 7,2) dans la solution de Hank jusqu’à ce que le poisson ne réponde plus et soit profondément anesthésié.
- Placez le poisson sur le côté sur une éponge humide. À l’aide d’un microsyringe, injecter rétro-orbitalement 3 μL de bromure de pancuronium (0,4 μg/μL dans la solution de Hank) pour paralyser le poisson. Placez brièvement le poisson dans la solution de Hank pour vous assurer qu’il est complètement paralysé.
- Placez le poisson côté dorsal dans la boîte de Petri avec la tête vers le tube. À l’aide de pinces pour manipuler le tube, ouvrez doucement la bouche du poisson et faites glisser le tube dans la bouche. Faites glisser doucement le poisson vers le tube afin que le tube soit à l’arrière de la bouche du poisson.
- Séchez rapidement mais doucement la gélose autour du poisson et retirez l’eau sur le dessus du poisson. Trempez un petit morceau de tissu de laboratoire dans de la colle de laboratoire et placez le tissu sur la gélose des deux côtés du poisson et sur le caudale arrière du poisson jusqu’aux branchies.
REMARQUE: Ne poussez pas sur le poisson et n’appliquez pas de pression. Veillez à éviter d’avoir de la colle sur les branchies. - Appliquez une petite goutte de bupivacaïne directement sur la surface de la tête pour anesthésier le poisson lors de l’imagerie dans la région où le laser entrera en contact avec la peau.
- Apportez la boîte de Petri avec le poisson au microscope et remplissez-la d’eau de poisson. Connectez le tube à une pompe à eau pour pomper l’eau du système à 2 mL / min dans la bouche du poisson et retirez simultanément la solution de perfusion de la boîte au même rythme. Assurez-vous que l’eau est oxygénée avec un barboteur et réchauffée à ~ 30 ° C avec un chauffe-aquarium.
REMARQUE: Le poisson est maintenant prêt pour l’imagerie. Surveiller la santé du poisson en surveillant le flux sanguin dans le signal de troisième génération harmonique (THG) lors de l’imagerie (voir rubrique 4.1). L’imagerie 3P devrait également être compatible avec des préparations de poissons plus sophistiquées telles que celles utilisées dans l’imagerie 2P pour fixer la tête et permettre les mouvements du corps lors de l’imagerie pendant la réalité virtuelle23. Cette imagerie complètement non invasive évite le besoin d’ablation du crâne comme c’est typique dans d’autres études sur les vertébrés et constitue une étape vers la minimisation de la recherche invasive et de la douleur associée.
3. Préparation de la souris pour 15h
REMARQUE: Portez des gants, un masque chirurgical et un manteau de laboratoire pendant les procédures suivantes. Choisissez la ligne de la souris en fonction de l’expérience. La souris doit être logée sous un cycle clair-sombre de 12:12 h avant la chirurgie. L’ensemble de la chirurgie (étapes 3.2-3.11) est aseptique et tous les outils chirurgicaux doivent être stérilisés avant utilisation. La craniotomie prend ~1 h.
- Placez un couvercle en forme de beignet (4,5 à 6,5 mm de diamètre) et un disque de couvercle (5 mm de diamètre) sur un parafilm propre. Utilisez une aiguille pour appliquer une petite quantité d’adhésif optique afin de coller le couvercle en forme de beignet sur le disque de couvercle. Durcir le couvercle de beignet à disque sur le parafilm sous la lumière ultraviolette pendant 10-20 min. Retirez tout le couvercle du disque et utilisez une pince à épiler pour rayer l’excès de colle et 70% d’éthanol pour éliminer les débris.
REMARQUE: Les couvercles ont une épaisseur d’environ 0,17 mm. Le couvercle en forme de beignet est utilisé pour appliquer une pression appropriée sur le cerveau pour l’imagerie chronique. - Anesthésier la souris avec 3% d’isoflurane et 20% de mélange de gazO2 dans une chambre à induction. Pesez la souris. Placez la souris en position couchée sur un coussin chauffant. Réglez la température du coussin chauffant à ~37 °C.
- Fixez les dents supérieures dans le trou buccal d’un appareil stéréotaxique avec la mise en place d’un masque anesthésique. Fixez les barres d’oreille aux oreilles. Maintenir l’anesthésie avec 2% d’isoflurane et 20% de mélange de gaz O2 pendant la chirurgie.
REMARQUE: Ajustez la concentration d’isoflurane en surveillant la réponse de la souris. Vérifiez le niveau d’anesthésie en surveillant la fréquence respiratoire (~ 1 Hz pour un sommeil profond) et en pinçant les pieds pour vérifier toute réaction avant la chirurgie. - Appliquez une pommade pour les yeux sur les yeux pour la lubrification. Fermez les paupières. Allumez toutes les lumières de la chirurgie. Injecter par voie sous-cutanée du kétoprofène, de la dexaméthasone et du glycopyrrolate en fonction du poids corporel de la souris avant la chirurgie.
REMARQUE: Les doses de médicament sont de 2 mg / mL, 0,1 mg / mL et 0,1 mg / mL pour le kétoprofène, la dexaméthasone et le glycopyrrolate, respectivement. Les volumes d’injection de kétoprofène, de dexaméthasone et de glycopyrrolate dépendent du poids corporel et sont respectivement de 2,5 μL/g, 2 μL/g et 2 μL/g. - Enlevez les poils sur la couronne de la tête et près des oreilles.
- Coupez autant de cheveux que possible avec des ciseaux ou une tondeuse à cheveux et retirez les cheveux coupés du site chirurgical.
- Appliquez une quantité appropriée de crème dépilatoire. Attendez 1 min.
- Enlevez les poils et la crème à l’aide d’un coton-tige imbibé d’une solution saline.
- Répétez les étapes 3.5.2 et 3.5.3 jusqu’à ce que les poils soient complètement enlevés.
- Appliquez une solution de povidone-iode à 5%, puis 70% d’éthanol sur la peau pour nettoyer la zone. Répétez le processus trois fois.
- Administrer une injection sous-cutanée d’atropine (dose basée sur le poids corporel, 0,02-0,05 mg/kg) sur la tête. Attendez 1 min.
- Coupez la peau sur la couronne de la tête pour exposer le crâne. Assurez-vous que le point bregma et le point lambda sont tous deux exposés. Collez le tissu cutané restant sur le bord du crâne en utilisant de la colle biocompatible pour éviter que la poussière de forage ne pénètre sous la peau (ce qui peut provoquer une réponse immunitaire).
- Utilisez un marqueur chirurgical pour dessiner un cercle de 5 mm de diamètre sur la zone d’intérêt. Par exemple, choisissez le centre de la zone ~2,5 mm latérale et 2 mm caudale à la bregma, qui couvre la majeure partie du cortex somatosensoriel et du cortex visuel.
- Percez lentement le long du cercle et appliquez une solution saline pour hydrater le crâne à mi-chemin. Ralentissez la vitesse de forage pendant la dernière moitié et couvrez le crâne avec une solution saline avant de retirer le crâne. Ouvrez doucement le crâne avec une pince et appliquez un petit morceau de mousse stérile imbibé de solution saline pour arrêter immédiatement tout saignement dans le cerveau. Gardez le cerveau hydraté en utilisant une solution saline.
- Appliquez une goutte de solution saline sur le côté de la housse de beignet à disque préparée face au tissu cérébral. Placez la partie disque saillante du couvercle du disque-beignet dans la fenêtre crânienne. Utilisez une longue barre tenue par l’appareil stéréotaxique pour appuyer doucement sur la partie disque de la fenêtre crânienne de couverture sur la surface du cerveau, en vous assurant que la partie beignet recouvre étroitement le crâne. Séchez la zone autour du couvercle de disque-beignet avec un coton-tige.
- Appliquez une couche de colle biocompatible sous le bord en forme de beignet. Appliquez une couche de mélange de ciment dentaire sous et autour de la partie beignet du couvercle de beignet à disque. Appliquez une autre couche de colle au-dessus du ciment dentaire. 5% de glucose (dose basée sur le poids corporel, 10 μL / g) peut être injecté par voie sous-cutanée toutes les heures pendant la chirurgie pour fournir de l’énergie animale.
- Arrêtez le système d’anesthésie. Relâchez la souris de l’appareil stéréotaxique. Transférez immédiatement la souris sur un appareil stéréotaxique compact personnalisé, avec un coussin chauffant à ~37 °C et un appareil d’anesthésie.
- Placez la souris en position couchée sur le coussin chauffant de l’appareil stéréotaxique compact personnalisé. Réglez la température à ~37 °C. Fixez les dents supérieures dans le trou buccal de l’appareil stéréotaxique et les barres d’oreille aux oreilles de la souris. Mettez sur les tubes anesthésiques et maintenez l’anesthésie avec 1,5% d’isoflurane et 20% de mélange gazeux O2.
REMARQUE: La souris est maintenant prête pour l’imagerie. Gardez la souris anesthésiée pendant les procédures d’imagerie suivantes. Ajustez la concentration d’isoflurane en surveillant la réponse de la souris.
4. Imagerie intravitale dans le cerveau des poissons et des souris
- Imagerie intravitale dans le cerveau du poisson-zèbre
REMARQUE: Pour localiser correctement le cerveau du poisson sous l’objectif, une caméra CCD (Secondary Charge-Coupled Device) est utilisée sur le même chemin que la lumière d’excitation pour l’imagerie à grand champ.- Installez le microscope et calibrez la puissance (comme décrit à la section 1).
- Placez un objectif à faible grossissement (généralement 4x) sur le microscope.
- Placez la boîte de Petri contenant le poisson et les tubes sous le microscope.
- Utilisez une source lumineuse à diode électroluminescente (LED) pour éclairer la boîte de Pétri.
- Ouvrez le mode Caméra du logiciel d’acquisition d’images (Figure 2).
- Cliquez sur Live.
- Choisissez le canal A sur le côté droit de l’écran.
- Ajustez les paramètres de l’histogramme pour voir clairement l’image.
REMARQUE: Ceux-ci doivent être mis à jour au besoin. - Réglez le réglage du moteur sur le contrôleur de moteur sur Base.
- Abaissez l’objectif jusqu’à ce que le poisson soit visible.
REMARQUE: Assurez-vous que l’objectif n’entre aucun contact physique avec la tête. - Placez le centre de la tête de poisson au centre du champ de vision.
- Déplacez l’objectif vers le haut et loin de la tête du poisson.
- Remplacez l’objectif à faible grossissement par l’objectif à na élevé pour 15 heures.
REMARQUE: La lentille à faible grossissement et la lentille à objectif NA élevé n’ont pas besoin d’être parfocales, mais doivent être suffisamment proches pour s’assurer que le poisson se trouve dans le champ de vision de l’objectif NA élevé. - Abaissez lentement la lentille de l’objectif, en veillant à ce que l’objectif n’entre pas en contact physique avec la tête. Dans le logiciel de la caméra CCD, arrêtez de déplacer l’objectif lorsque le haut de la tête est visible. Définissez l’emplacement z sur 0 μm.
REMARQUE: Assurez-vous qu’il n’y a pas de bulles d’air sous la lentille de l’objectif lorsque vous utilisez un objectif à immersion dans l’eau. - Éteignez la source de lumière LED et fermez le rideau sombre autour du système.
- Réglez le logiciel d’acquisition d’imagerie sur le mode Multiphoton GG pour l’imagerie 3P et réglez la puissance sous l’objectif à moins de 1 mW (avec un taux de répétition d’impulsions d’environ 1 MHz).
- Modifiez le bouton de réglage du moteur de Base à Objectif sur le contrôleur du moteur.
- Éteignez les lumières dans la pièce.
- Allumez les PMT et ouvrez l’obturateur de la source d’excitation 15h. Assurez-vous qu’un contour de l’os apparaît dans le canal de signal de fluorescence en raison de l’autofluorescence et dans le canal de signal THG en raison du THG de l’os (Figure 2C).
- Effectuez des images à différentes profondeurs en augmentant les niveaux de puissance lors de l’imagerie plus profonde.
- Imagerie intravitale dans le cerveau de la souris
REMARQUE: Injecter 5% de glucose dans la souris anesthésiée toutes les heures pendant l’imagerie; la dose est basée sur le poids corporel (10 μL/g).- Réglez le logiciel d’acquisition d’imagerie sur le mode Multiphoton GG pour l’imagerie 3P et réglez la puissance sous l’objectif à moins de 1 mW (avec un taux de répétition d’impulsions d’environ 1 MHz).
REMARQUE: Assurez-vous que la fenêtre de chirurgie est placée perpendiculairement à la lentille de l’objectif pour réduire l’aberration. Le réglage fin est effectué en inclinant l’appareil stéréotaxique. - Déplacez la lentille de l’objectif près de la fenêtre et appliquez de l’eau entre l’objectif et la fenêtre crânienne; définissez les valeurs d’axe de tous les moteurs sur zéro.
REMARQUE: L’absorption de la lumière dans H2O à ~ 1 700 nm est grande, ce qui réduit considérablement la puissance laser d’environ 1 700 nm après une profondeur d’environ 1 à 2 mm d’eau. Pour une excitation d’environ 1 700 nm, utilisez D2O, qui a une absorption beaucoup plus faible à 1 700 nm, pour l’immersion dans l’eau afin de réduire l’absorption par l’eau. - Cliquez sur le bouton Live dans le logiciel d’acquisition d’images et ouvrez les canaux PMT, par exemple, un canal de signal de fluorescence et un canal de signal THG. Ajustez le gain PMT et le niveau d’arrière-plan selon vos besoins.
- Remontez lentement la lentille de l’objectif pour localiser la surface de la fenêtre en surveillant le canal THG des gros vaisseaux sanguins et de la surface de la vitre de la fenêtre. Ajustez l’orientation de la fenêtre (voir la note à l’étape 4.2.12) si nécessaire. Mettez à zéro les moteurs pour définir la surface du cerveau.
- Effectuez une imagerie et ajustez le niveau de puissance en fonction de la profondeur d’imagerie.
- Réglez le logiciel d’acquisition d’imagerie sur le mode Multiphoton GG pour l’imagerie 3P et réglez la puissance sous l’objectif à moins de 1 mW (avec un taux de répétition d’impulsions d’environ 1 MHz).
Résultats
La réussite de ce protocole se traduira par un microscope correctement aligné avec des paramètres de lumière optimaux (par exemple, la durée du pouls, NA) et des préparations animales appropriées pour 3PM in vivo . La configuration 3P disponible dans le commerce comprend des miroirs et des objectifs appropriés pour ~ 1 300 nm et ~ 1 700 nm; par conséquent, aucun changement d’optique n’est nécessaire lorsque la longueur d’onde d’excitation est commutée entre 1 300 nm et 1 700 nm. Si les lentilles d’une configuration 3P n’ont pas un revêtement approprié pour 1 300 et 1 700 nm, elles doivent être remplacées par des lentilles appropriées pour réduire la perte de puissance laser. Avec le 3PM optimisé et une préparation animale appropriée, la fluorescence in vivo et les images THG à contraste élevé peuvent être collectées profondément dans le cerveau.
La figure 3 montre des images 3P représentatives de poissons-zèbres adultes intacts. L’imagerie à haute résolution, non invasive et profonde des neurones génétiquement marqués dans le cerveau du poisson-zèbre adulte est réalisée à l’aide de 15 heures. Bien que l’imagerie dans la région du télencéphale ait été rapportée dans le cerveau du poisson zèbre adulte en utilisant2PM 24,25,26,27, 3PM permet d’accéder à l’ensemble du télencéphale et aux régions qui sont plus difficiles ou impossibles à observer en utilisant d’autres techniques. La distribution des couches cellulaires dans le tectum optique et le cervelet peut être observée à la figure 3C. Lors d’une séance d’imagerie réussie, l’os est visible dans le canal THG et les neurones visibles dans le canal de fluorescence. Pour l’imagerie du poisson-zèbre adulte, la fonction de caméra du microscope a été utilisée pour localiser le poisson (Figure 3A). Cette étape n’est pas nécessaire pour l’imagerie cérébrale de la souris car la fenêtre en verre est suffisamment grande pour rendre le cerveau facilement accessible. Des images structurelles à haute résolution du cerveau du poisson zèbre adulte ont été obtenues à l’aide du système décrit dans les sections précédentes. Le crâne est vu dans le canal THG (Figure 3B), ce qui aide à naviguer dans le cerveau et à trouver la surface supérieure. Comme on l’observe à la figure 3C, les neurones se distinguent par un rapport signal/arrière-plan (SBR) élevé profondément dans le cerveau adulte. Le tissu au-dessus du cerveau est visible dans le canal de fluorescence en raison de l’autofluorescence.
La figure 4 montre des images 3P multicolores de neurones marqués GCaMP6s (vert) et de vaisseaux sanguins marqués Texas Red (rouge) ainsi que des signaux THG (bleu) dans le cerveau de souris adulte avec une excitation de 1 340 nm10. Les images sont reproduites à partir de travaux antérieurs10. Dans la figure 4, l’énergie d’impulsion au foyer a été maintenue à ~ 1,5 nJ dans toute la profondeur pour obtenir suffisamment de signaux de fluorescence et de THG, et la puissance laser moyenne maximale était d’environ 70 mW. La durée de l’impulsion a été ajustée à ~60 fs, et le NA effectif était d’environ 0,8. Grâce à l’optimisation de la configuration de 15 heures, des images à contraste élevé ont été obtenues avec succès jusqu’à 1,2 mm de la surface du cerveau, dans la région de l’hippocampe CA1 (Figure 4A, B). La figure 4C,D montre des traces d’activité Ca2+ de neurones marqués GCaMP6s à une profondeur de 750 μm pour une session d’enregistrement de 10 minutes, montrant une haute fidélité d’enregistrement.
Si le laser d’excitation est mal aligné, une non-uniformité de la luminosité du signal dans le champ de vision peut être observée. De plus, si les paramètres du laser, tels que la durée de l’impulsion, l’énergie de l’impulsion d’excitation au foyer et le NA effectif, ne sont pas optimisés, l’image THG du crâne du poisson ou de la fenêtre de craniotomie du cerveau de la souris ne sera pas visible et / ou nécessite une énergie d’impulsion d’excitation élevée (par exemple, >2 nJ / impulsion au foyer). Par conséquent, les signaux THG à la surface du cerveau peuvent être utilisés comme indicateur pour une configuration optimisée de 15 heures avant de commencer l’imagerie des tissus profonds.
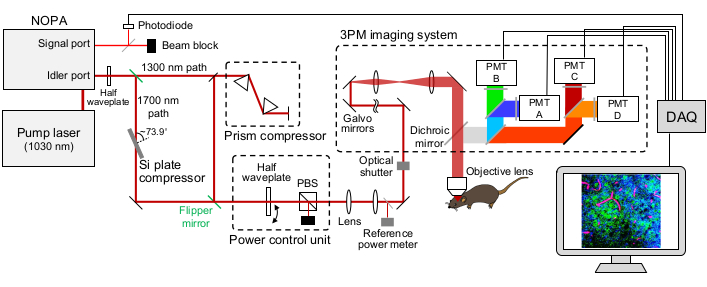
Figure 1 : Illustration schématique d’une configuration à 15heures. La longueur d’onde du laser d’excitation est réglée à ~1 300 nm ou ~1 700 nm, sortie du port de ralenti du NOPA. Le compresseur à paire de prismes et le compresseur à plaque Si sont utilisés pour le laser ~1 300 nm et ~1 700 nm, respectivement, pour prépucer l’impulsion laser d’excitation. Les faisceaux laser ~1 300 nm et ~1 700 nm peuvent être commutés avec des miroirs flipper. Le port de signal du NOPA est utilisé pour obtenir le signal de déclenchement. Une demi-plaque d’onde et un PBS sont utilisés pour contrôler la puissance d’excitation. La fluorescence et le THG sont détectés par les PMT GaAsP. Des combinaisons appropriées de miroirs dichroïques et de filtres passe-bande sont utilisées pour séparer les signaux de fluorescence et de THG. Abréviations : 3PM = microscopie à trois photons ; NOPA = amplificateur paramétrique optique non collinéaire; PBS = séparateur de faisceau polarisant; THG = troisième génération harmonique; DAQ = acquisition de données; PMT = tube photomultiplicateur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
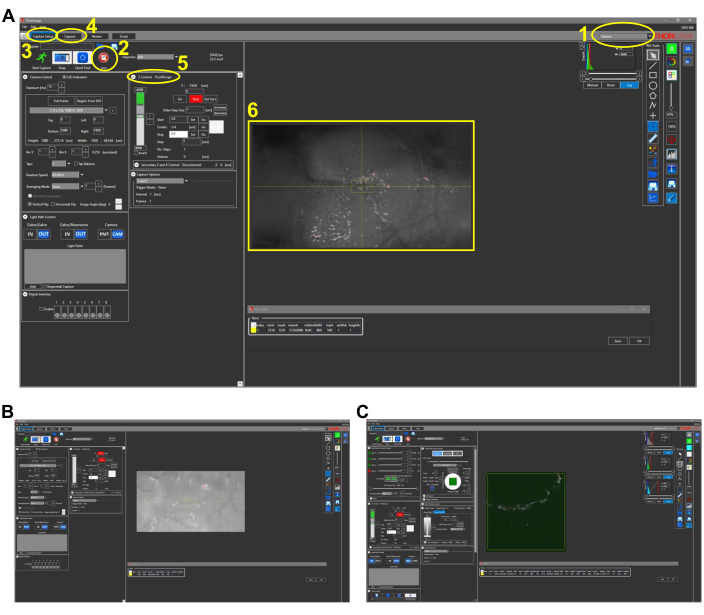
Figure 2 : Captures d’écran représentatives de l’imagerie intravitale chez les poissons (section 4.1 du protocole). (A) Vue en mode caméra du logiciel d’acquisition d’images avec objectif 4x en place. Les principales caractéristiques du logiciel sont décrites et numérotées comme suit: 1. Mode d’imagerie du logiciel d’acquisition d’images. Les options de mode sont Appareil photo, Multiphoton et Multiphoton GG. Pour l’imagerie en lumière blanche avec caméra CCD, le mode Caméra est choisi. 2. Cliquez sur le bouton Live pour allumer l’appareil photo (ou les PMT si dans les options multiphotons), et une vue en temps réel du microscope peut être observée. 3. Dans l’onglet Configuration de la capture, les paramètres d’imagerie souhaités (puissance, emplacement, profondeur) sont définis. 4. Dans l’onglet Capture, un emplacement de dossier est attribué pour les images à enregistrer. L’imagerie peut être démarrée dans cet onglet. 5. Le paramètre Contrôle Z contrôle la profondeur de l’imagerie en déplaçant le moteur de l’étage z. 6. Image représentative d’une tête de poisson zèbre. Le côté rostral de la tête est à gauche. (B) Vue représentative du mode Appareil photo avec objectif 25x. (C) Vue représentative du mode Multiphoton GG contenant l’image THG de l’image vue en (B). Abréviations: CCD = dispositif à couplage de charge; PMT = tube photomultiplicateur; THG = troisième génération harmonique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
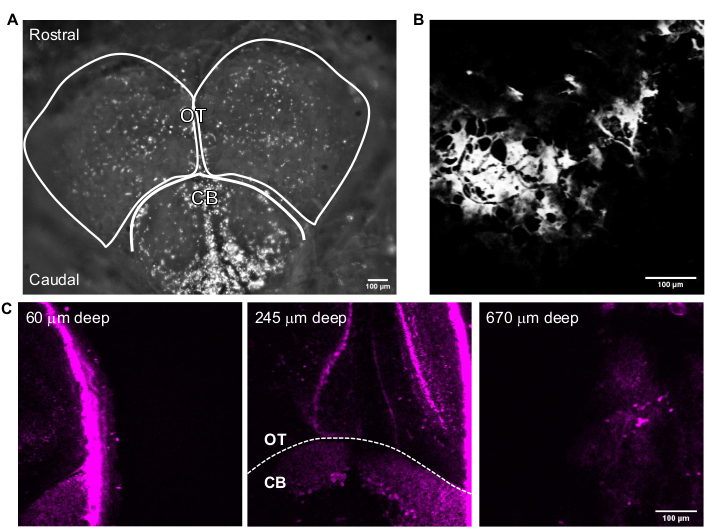
Figure 3 : Images représentatives du cerveau du poisson zèbre adulte acquises avec le logiciel d’acquisition d’images. (A) Image en mode caméra de la tête du poisson zèbre adulte acquise avec un objectif 4x. Le haut de l’image est la direction rostrale. Les lobes OT et CB sont décrits. (B) Image représentative acquise en mode Multiphoton GG avec un objectif 25x contenant l’image THG de (A). (C) Images de fluorescence du cerveau du poisson zèbre adulte à l’intersection du cervelet et du tectum optique où la GFP est exprimée dans le cytoplasme des neurones à différentes profondeurs. Barres d’échelle = 100 μm. Abréviations: OT = tectam optique; CB = cervelet; THG = troisième génération harmonique; GFP = protéine fluorescente verte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
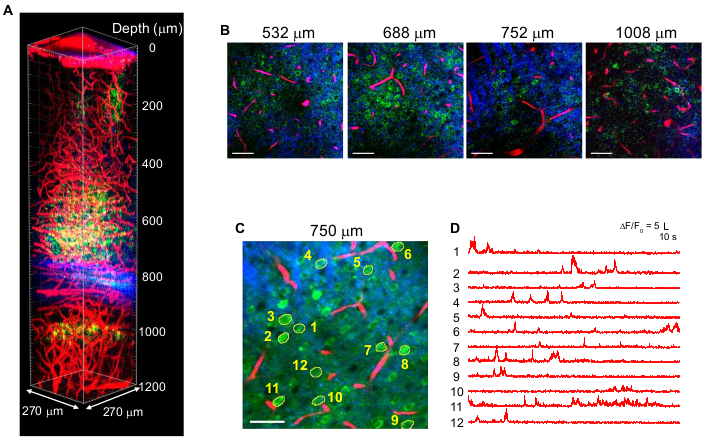
Figure 4 : Multicolore 3 PM de neurones marqués GCaMP6s (vert), Texas Red marqués vaisseaux sanguins (rouge) et troisième génération harmonique (bleu) lors d’une excitation de 1 340 nm dans le cerveau de la souris. (A) Images Z-stack jusqu’à 1 200 μm de la surface du cerveau avec un champ de vision de 270 x 270 μm (512 x 512 pixels par image). La puissance du laser a été modifiée en fonction de la profondeur d’imagerie pour maintenir une énergie d’impulsion d’environ 1,5 nJ au foyer. La puissance moyenne maximale sous l’objectif était de 70 mW. (B) Images 2D sélectionnées à différentes profondeurs d’imagerie. (C) Site d’enregistrement d’activité à 750 μm sous la dure-mère avec un champ de vision de 270 x 270 μm (256 x 256 pixels). (D) Traces spontanées d’activité cérébrale enregistrées chez une souris éveillée à partir des neurones marqués indiqués en (C). La fréquence d’images était de 8,3 Hz, avec un temps de séjour en pixels de 0,51 μs. Le taux de répétition laser était de 2 MHz et la puissance moyenne sous la lentille de l’objectif était de 56 mW. Chaque trace a été normalisée à sa ligne de base et filtrée passe-bas à l’aide d’une fenêtre de hamming de 0,72 s de constante de temps. Barres d’échelle = 50 μm. Cette figure et la légende de la figure sont reproduites à partir de 10. Abréviation : 3PM = microscopie à trois photons. Veuillez cliquer ici pour voir une version agrandie de cette figure.
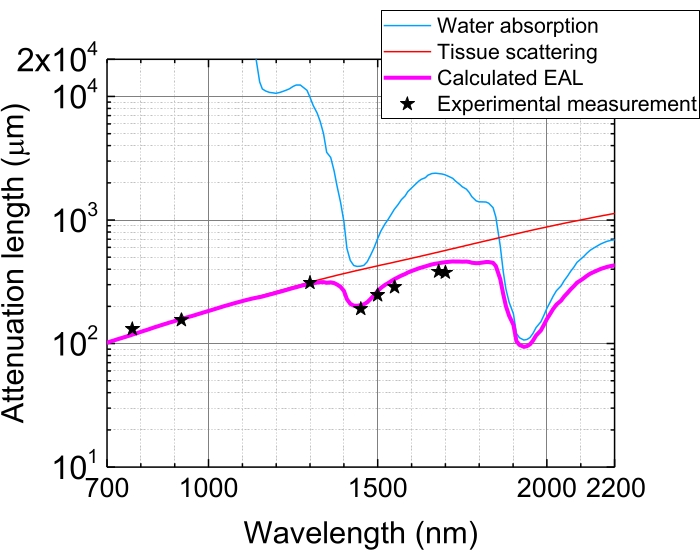
Figure 5 : Longueur d’atténuation effective dans le néocortex du cerveau de la souris. L’EAL (ligne magenta) est calculée à partir de la diffusion tissulaire (ligne rouge) et de l’absorption d’eau dans le tissu (ligne bleue), en supposant une composition en eau de 75%. Les étoiles noires indiquent des données expérimentales rapportées d’EAL dans le néocortex du cerveau de la souris 3,21,28,29. Notez que l’EAL varie selon les tissus. Abréviation : EAL = longueur d’atténuation effective. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Longueur d’onde d’excitation (nm) | Eau d’immersion | Puissance laser maximale (mW) | Énergie d’impulsion maximale au foyer* (nJ) | EAL typique dans le cortex de la souris (μm) | Profondeur d’imagerie dans le cortex de la souris** (mm) | Énergie pulsée dans le cadre de l’objectif*** (nJ) | Taux de répétition laser maximal**** (MHz) |
| 1300 | H2O ou D2O |
 100 100 |
 2 2 | ~300 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210 | ~0,5 | |||||
| 2.1 | ~1100 | ~0,1 | |||||
| 1700 | D2O |
 50 50 |
 3 3 | ~400 | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2,5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~190 | ~0,3 |
Tableau 1 : Conditions typiques d’excitation de 3P pour l’imagerie du cortex de la souris.
*Avec un objectif NA (~1,0) élevé, une largeur d’impulsion d’environ 50 fs et des fluorophores typiques tels que les protéines fluorescentes (par exemple, GFP et RFP).
** Avec l’hypothèse que l’EAL est uniforme dans tout le cortex.
Pour atteindre ~1 nJ/impulsion au foyer, calculé à partir de l’EAL et de la profondeur d’imagerie.
Calculé à partir de l’énergie d’impulsion sous l’objectif et de la puissance maximale permissive du laser.
Abréviations : 3P = trois photons ; NA = ouverture numérique; GFP = protéine fluorescente verte; RFP = protéine fluorescente rouge; EAL = longueur d’atténuation effective.
Discussion
Ce protocole explique les procédures étape par étape pour la mise en place de l’imagerie 3P avec un microscope commercial et une source laser. Par rapport à 14h, 3PM présente un avantage dans les applications nécessitant un accès optique dans les régions plus profondes telles que l’hippocampe cérébral de la souris. Bien que 3PM soit principalement utilisé en neurosciences, 3PM peut être potentiellement appliqué dans d’autres tissus tels que les ganglions lymphatiques, les os et les tumeurs pour l’observation des tissus profonds.
Il est important de vérifier que le système d’imagerie fonctionne à un niveau proche de la limite de bruit de tir, ce qui garantit que l’électronique de détection et d’acquisition de données contribue à un bruit négligeable à l’image après les PMT. L’incertitude du nombre de photons détectés est fondamentalement limitée par le bruit des photons. Un microscope multiphotonique typique peut obtenir des performances limitées en termes de bruit de prise de vue à l’aide d’un photodétecteur à gain élevé (par exemple, un PMT). Le bruit de prise de vue de photons suit une distribution statistique de Poisson, dans laquelle l’écart-type de la distribution est égal à la racine carrée de la moyenne de la distribution. Pour vérifier les performances limitées du bruit de tir, suivez l’étape 1.14 de la section protocole.
Pour éviter l’atténuation de la lumière par H2O, l’utilisation de D2O pour l’immersion est utile, en particulier pour l’excitation d’environ 1 700 nm. Lorsque D2O est utilisé, il est essentiel de rafraîchir D2O toutes les ~10 min ou d’utiliser un grand volume de D2O pour éviter l’échange D2O/H2O pendant l’imagerie. On peut également sceller le D2O de l’environnement de la pièce3. Si une lentille d’objectif à longue distance de travail (WD) (par exemple, WD à 4 mm ou plus) est utilisée pour l’imagerie, l’épaisseur du liquide d’immersion peut dépasser 2-3 mm. L’épaisseur accrue rend l’absorption de H2O non négligeable même à ~1 300 nm21. Par conséquent, D2O peut être nécessaire même pour 1 300 nm 3PM lors de l’utilisation d’un objectif WD long.
Comme l’intensité de fluorescence 3P dépend du cube de l’énergie de l’impulsion d’excitation au foyer (Eq. (1)), le réglage de la puissance laser appropriée est particulièrement important pour obtenir des signaux de fluorescence 3P adéquats tout en évitant les dommages thermiques et non linéaires dans les tissus vivants. La puissance moyenne du laser doit être maintenue en dessous du seuil de dommages thermiques. Dans le cerveau de la souris, par exemple, pour éviter les dommages aux tissus thermiques, la puissance moyenne sur la surface du cerveau de la souris doit être maintenue à ~ 100 mW ou moins pour une excitation d’environ 1 300 nm à une profondeur de 1 mm et avec un champ de vision (FOV) de 230 μm x 230 μm21. De même, la puissance moyenne à ~1 700 nm doit être maintenue à ~50 mW ou moins à ~1 mm de profondeur et un champ de vision d’environ 230 μm x 230 μm (données non publiées). De plus, pour éviter la saturation de l’excitation et les dommages non linéaires potentiels, l’énergie de l’impulsion d’excitation doit être maintenue à  2 nJ et
2 nJ et  3 nJ pour ~1 300 nm et ~1 700 nm d’excitation, respectivement30.
3 nJ pour ~1 300 nm et ~1 700 nm d’excitation, respectivement30.
En raison de l’absorption et de la diffusion de la lumière dans les tissus, l’énergie d’impulsion au foyer est atténuée à 1/e (~ 37%) après pénétration des tissus par 1 EAL. L’EAL varie dans différents tissus et avec les longueurs d’onde d’excitation, par exemple, dans le néocortex du cerveau de la souris, l’EAL est d’environ 300 μm et ~400 μm à ~1 300 nm et ~1 700 nm, respectivement 3,29 (Figure 5). Par conséquent, pour maintenir la même énergie d’impulsion au foyer (par exemple, 1 nJ/impulsion) à une profondeur de n ECL, l’énergie d’impulsion de surface doit être multipliée par 1 nJ × en. Pour une imagerie rapide de la dynamique structurelle et fonctionnelle, un laser d’excitation avec un taux de répétition élevé (à 1 MHz ou plus) est souhaitable pour atteindre une fréquence d’images élevéede 5,6,7,10. Cependant, les besoins en énergie d’impulsion et la limite de puissance laser moyenne limitent le taux de répétition applicable.
Par exemple, lorsque nous imageons une région modérément profonde à 4 EAL (c’est-à-dire ~ 1,2 mm dans le cortex de la souris avec une excitation de 1 300 nm), ~ 55 nJ / impulsion à la surface est nécessaire pour maintenir 1 nJ / impulsion à la mise au point. Lorsque la limite de puissance moyenne est de 100 mW, nous pouvons appliquer un taux de répétition laser d’environ 2 MHz. Cependant, pour imager plus profondément à une profondeur de 7 EAL, ~ 1 100 nJ / impulsion est nécessaire à la surface pour maintenir 1 nJ / impulsion à la mise au point. En supposant que la puissance moyenne maximale est de 100 mW pour éviter les dommages thermiques, le taux de répétition du laser doit être réduit à 0,1 MHz pour atteindre une impulsion de 1 100 nJ / à la surface. Le tableau 1 résume les conditions d’imagerie typiques dans le cortex cérébral de la souris. Notez que les profondeurs d’imagerie du tableau 1 supposent que l’EAL est uniforme dans l’ensemble du cortex de la souris.
De plus, en raison de la limitation de la puissance laser dans les tissus profonds de 3PM, il existe un compromis entre la fréquence d’images et la taille des pixels de l’image, ce qui est particulièrement important pour l’imagerie fonctionnelle telle que l’imagerie calcique. Le taux de répétition laser maximal disponible est décidé à chaque profondeur en fonction de l’énergie d’impulsion requise au foyer et de la puissance laser moyenne applicable, comme indiqué ci-dessus, par exemple 2 MHz à une profondeur équivalente à ~ 4 EAL avec une excitation de 1 300 nm. En général, l’imagerie nécessite au moins une impulsion par pixel. En conséquence, le temps de séjour minimal disponible des pixels est déterminé par le taux de répétition laser, par exemple 0,5 μs/ pixel avec une excitation de 2 MHz.
Pour conserver la haute résolution spatiale (~1 μm en latéral) dans les images 3P, il est idéal de définir 1 pixel sur une zone d’environ 1 μm2, par exemple 256 x 256 pixels pour un champ de vision de 250 x 250 μm2. Par conséquent, pour effectuer une imagerie rapide avec un champ de vision considérablement grand (par exemple, des taux de répétition d’impulsions de 250 x250 μm 2 avec 256 x 256 pixels), de 0,5 MHz, 1 MHz et 2 MHz, donne des fréquences d’images maximales théoriques de ~ 7,6, ~ 15 et ~ 30 images / s, respectivement. De même, l’optimisation du taux de répétition laser est essentielle, en fonction de la profondeur cible, de la vitesse de balayage et du champ de vision, pour appliquer une énergie d’impulsion adéquate sous le seuil de dommages thermiques. Pour augmenter la vitesse d’imagerie, une source d’excitation adaptative peut être utilisée pour concentrer toutes les impulsions d’excitation sur les neurones (c’est-à-dire les régions d’intérêt) en délivrant des impulsions laser à la demande aux neurones31.
3PM est avantageux par rapport à 2PM en imagerie profonde dans les tissus vivants et à travers des milieux à forte diffusion tels qu’un crâne, des os et la couche de substance blanche (c’est-à-dire la capsule externe) du cerveau de la souris. L’EAL plus long et l’excitation non linéaire d’ordre supérieur du 3PE profitent à l’imagerie des tissus profonds. Par exemple, pour imager GCaMP6 dans le cortex de la souris, le signal de fluorescence 2P avec une excitation de 920 nm est supérieur au signal de fluorescence 3P avec une excitation de 1 300 nm dans les régions peu profondes à 690 μm (c’est-à-dire  ~ 2,3 EAL à 1 300 nm)21. Cependant, en raison de l’EAL plus long à 1 300 nm par rapport à 920 nm, le 3PE donne une fluorescence plus forte que l’excitation 2P (2PE) à une profondeur d’environ 690 μm et plus profonde21. Cette profondeur est définie comme la « profondeur de croisement du signal », à laquelle les forces du signal de fluorescence de 2PE et 3PE sont identiques avec le même taux de répétition et les mêmes puissances moyennes maximales admissibles21. La profondeur de croisement du signal dépend des longueurs d’onde d’excitation pour 2PE et 3PE et du fluorophore.
~ 2,3 EAL à 1 300 nm)21. Cependant, en raison de l’EAL plus long à 1 300 nm par rapport à 920 nm, le 3PE donne une fluorescence plus forte que l’excitation 2P (2PE) à une profondeur d’environ 690 μm et plus profonde21. Cette profondeur est définie comme la « profondeur de croisement du signal », à laquelle les forces du signal de fluorescence de 2PE et 3PE sont identiques avec le même taux de répétition et les mêmes puissances moyennes maximales admissibles21. La profondeur de croisement du signal dépend des longueurs d’onde d’excitation pour 2PE et 3PE et du fluorophore.
En pratique, l’excitation de 920 nm permet une puissance laser moyenne supérieure à une excitation de 1 300 nm en raison d’une absorption d’eau moindre. Cependant, la puissance moyenne plus élevée de 2PE ne pousserait la profondeur de croisement du signal que de 0,9 EAL4. De plus, lorsque l’échantillon est densément étiqueté, le 3PE présente l’avantage supplémentaire d’un SBR beaucoup plus élevé. Par conséquent, avant même d’atteindre la longueur de croisement du signal, 3PM peut être meilleur pour l’imagerie que 2PM. Par exemple, lors de l’imagerie du système vasculaire cérébral de la souris, qui a une fraction volumique (c’est-à-dire une densité de marquage) d’environ 2%, 1 300 nm 3PM avec une puissance d’excitation de 100 mW surpasse 920 nm 2PM avec une puissance d’excitation de 200 mW à une profondeur d’environ 700 μm pour la fluorescéine.
3PM présente également un avantage lors de l’imagerie à travers une couche mince mais très diffusante qui peut déformer la fonction d’étalement ponctuel du faisceau d’excitation et générer un arrière-plan de défocalisation4. Par exemple, à travers le crâne intact du cerveau de la souris, les images de 14h souffrent de l’arrière-plan de défocalisation même à la faible profondeur de <100 μm de la surface du cerveau13. Un fond de défocalisage similaire a été observé en 2PM avec une excitation de 1 280 nm à travers la substance blanche dans le cerveau de la souris32. Par conséquent, lorsque les tissus sont imagés à travers des couches troubles, 3PM est préférable à 2PM pour l’imagerie à contraste élevé, quelle que soit la densité d’étiquetage.
Nous avons récemment rapporté un fantôme de perles et une analyse théorique montrant que la limite de profondeur d’imagerie de 15 heures est supérieure à 8EAL 33; 8 EAL équivalent à ~3 mm avec une excitation d’environ 1 700 nm dans le cortex de la souris. Cependant, le laser actuellement disponible n’a pas assez d’énergie d’impulsion pour atteindre 8 EAL dans le cerveau de la souris. La poursuite du développement de lasers plus puissants repoussera la limite actuelle de profondeur d’imagerie de 15 heures.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Ce travail a été soutenu par NSF DBI-1707312 Cornell NeuroNex Hub et NIH 1U01NS103516.
matériels
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
Références
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon