Method Article
מיקרוסקופיה פלואורסצנטית תלת-פוטונית של שלושה פוטונים ברקמות עמוקות במוח של עכברים ושל דגי זברה שלמים
* These authors contributed equally
In This Article
Summary
מיקרוסקופיה של שלושה פוטונים מאפשרת הדמיה פלואורסצנטית בעלת ניגודיות גבוהה בעומק רקמות ביולוגיות חיות, כגון מוחות של עכברים ודגי זברה, ברזולוציה מרחבית-טמפורלית גבוהה.
Abstract
טכניקות מיקרוסקופיית מולטי-פוטון, כגון מיקרוסקופיית שני פוטונים (14:00) ומיקרוסקופיית שלושה פוטונים (15:00), הן כלים רבי עוצמה להדמיית in vivo של רקמות עמוקות ברזולוציה תת-תאית. לשעה 15:00 יש שני יתרונות עיקריים להדמיית רקמות עמוקות במהלך 14:00 שנמצאת בשימוש נרחב במעבדות ביולוגיה: (i) אורך הנחתה ארוך יותר ברקמות פיזור על ידי שימוש בלייזר עירור של כ-1,300 ננומטר או ~1,700 ננומטר; (ii) פחות יצירת פלואורסצנציה ברקע עקב עירור לא ליניארי מסדר גבוה יותר. כתוצאה מכך, השעה 15:00 מאפשרת הדמיה מבנית ותפקודית בעלת ניגודיות גבוהה בעומק רקמות מתפזרות כגון מוח עכבר שלם משכבות קליפת המוח ועד להיפוקמפוס וכל המוח הקדמי של דגי זברה בוגרים.
כיום, מקורות לייזר המתאימים לשעה 15:00 זמינים באופן מסחרי, ומאפשרים המרה של מערכת הדמיה קיימת של שני פוטונים (2P) למערכת תלת-פוטונים (3P). בנוסף, קיימים מספר מיקרוסקופים מסחריים של 3P, מה שהופך את הטכניקה הזו לזמינה למעבדות מחקר ביולוגיות. מאמר זה מראה את האופטימיזציה של הגדרה טיפוסית של 15:00, במיוחד התמקדות בקבוצות ביולוגיה שכבר יש להן הגדרת 2P, ומדגים הדמיה תלת-ממדית תוך-ורידית במוחות של עכברים ושל דגי זברה בוגרים שלמים. פרוטוקול זה מכסה את ההליך הניסיוני המלא של הדמיית 3P, כולל יישור מיקרוסקופ, בדיקה מוקדמת של כ-1,300 ו-1,700 ננומטר פולסים של לייזר, הכנת בעלי חיים והדמיה פלואורסצנטית תוך-ורידית של 3P עמוק במוחות של דגי זברה ועכברים בוגרים.
Introduction
במדעי החיים, טכניקות מיקרוסקופיית מולטי-פוטון (MPM), כגון 14:00 ו-15:00, היו כלים רבי עוצמה להדמיה עמוקה בתוך vivo עם רזולוציה מרחבית-טמפורלית גבוהה וניגודיות גבוהה ברקמות פיזור. בנוסף, שיטות אלה גורמות לפחות הלבנת תמונות בהשוואה למיקרוסקופיה קונפוקלית של פוטון אחד 1,2,3,4. 15:00 הוא יתרון להדמיית רקמות עמוקות יותר בהשוואה לשעה 14:00 בשל שתי תכונות עיקריות: (i) תעסוקה של עירור באורך גל ארוך יותר (~1,300 ננומטר או ~1,700 ננומטר) מפחיתה את פיזור הרקמות, ו-(ii) תהליך העירור מסדר גבוה יותר (כלומר, אות פלואורסצנטי תלוי בקוביית עוצמת העירור בשעה 15:00 במקום בריבוע של עוצמת העירור בשעה 14:00) המדכא את פלואורסצנס הרקע הלא רצוי3 . כתוצאה מכך, 15:00 מאפשר הדמיה עם ניגודיות גבוהה באזורים עמוקים יותר ברקמות חיות כגון ההיפוקמפוס במוח עכבר בוגר שלם 3,5,6,7,8,9,10,11 וכל המוח הקדמי של דגי זברה בוגרים12, כולל Ca 2+ הקלטת פעילות ותצפיות צבעוניות. יתר על כן, תמונות עם ניגודיות גבוהה התקבלו בשעה 15:00 באמצעות גולגולות שלמות של דגי עכבר וזברה בוגרים12,13.
כיום, מקורות לייזר עירור המתאימים לעירור 3P (3PE) ב~1,300 וכ-1,700 ננומטר זמינים באופן מסחרי. מכיוון שמערכת סריקת הלייזר זהה במהותה עבור 14:00 ו-15:00, המרת מערך 2P קיים למערך 3P אפשרית במעבדות ביולוגיה עם התקנת לייזר זמין מסחרית עבור 3PE. אות הפלואורסצנציה 3P תלוי בכוח הלייזר, משך הפולס, קצב החזרה בלייזר ומפתח הצמצם המספרי (NA) של העדשה האובייקטיבית. בהנחה שמיקוד מוגבל עקיפה (כלומר, הצמצם האחורי של העדשה האובייקטיבית מתמלא יתר על המידה על ידי קרן העירור), Eq (1) מתאר את שטף הפוטונים הפלואורסצנטי הממוצע בזמן מנפח המוקד הנובע מ-3PE.
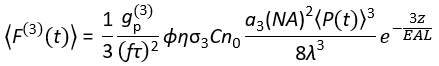 (1)
(1)
כאשר f הוא קצב החזרה בלייזר, τ הוא משך פולס הלייזר (רוחב מלא בחצי מקסימום), φ הוא יעילות איסוף המערכת, η היא היעילות הקוונטית הפלואורסצנטית, σ3 הוא חתך הקליטה של 3P, C הוא ריכוז הפלואורופור, n0 הוא המדד הרפלקטיבי של מדיום הדגימה (למשל, מים), λ הוא אורך הגל של העירור בריק, NA הוא הצמצם המספרי של העדשה האובייקטיבית, 3 הוא קבוע האינטגרציה המרחבית של נפח המוקד, 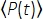 הוא שטף פוטון העירור הממוצע בזמן (פוטונים/ים) תחת העדשה האובייקטיבית, z הוא עומק התמונה, ו- EAL הוא אורך ההנחתה האפקטיבי14. כאן הנחנו כי ה- EAL (בדרך כלל > 100 מיקרומטר) גדול בהרבה מהרזולוציה הצירית של המיקרוסקופ (בדרך כלל < 10 מיקרומטר). תחת קירוב פראקסיאלי,3 שווה ל- 28.114. gp(3) הוא הקוהרנטיות הטמפורליתמסדר 3 של מקור העירור, ו-g p(3) הוא 0.41 ו-0.51 עבור פולסים היפרבוליים-סקאנט-בריבוע ופולסים של גאוס, בהתאמה. ניתן להעריך את יעילות האיסוף φ על ידי התחשבות באיסוף הפלואורסצנטי על ידי העדשה האובייקטיבית, העברת העדשה האובייקטיבית, הרפלקטיביות של המראה הדיכרואית, העברת המסננים ויעילות הגילוי של הגלאי (למשל, שפופרת פוטומולטיפלייר, או PMT). מכיוון שעוצמת הפלואורסצנציה של 3P תלויה מאוד בפרמטרים שונים, נדרשת אופטימיזציה של הגדרת 3P כדי למקסם את אותות הפלואורסצנציה של 3P.
הוא שטף פוטון העירור הממוצע בזמן (פוטונים/ים) תחת העדשה האובייקטיבית, z הוא עומק התמונה, ו- EAL הוא אורך ההנחתה האפקטיבי14. כאן הנחנו כי ה- EAL (בדרך כלל > 100 מיקרומטר) גדול בהרבה מהרזולוציה הצירית של המיקרוסקופ (בדרך כלל < 10 מיקרומטר). תחת קירוב פראקסיאלי,3 שווה ל- 28.114. gp(3) הוא הקוהרנטיות הטמפורליתמסדר 3 של מקור העירור, ו-g p(3) הוא 0.41 ו-0.51 עבור פולסים היפרבוליים-סקאנט-בריבוע ופולסים של גאוס, בהתאמה. ניתן להעריך את יעילות האיסוף φ על ידי התחשבות באיסוף הפלואורסצנטי על ידי העדשה האובייקטיבית, העברת העדשה האובייקטיבית, הרפלקטיביות של המראה הדיכרואית, העברת המסננים ויעילות הגילוי של הגלאי (למשל, שפופרת פוטומולטיפלייר, או PMT). מכיוון שעוצמת הפלואורסצנציה של 3P תלויה מאוד בפרמטרים שונים, נדרשת אופטימיזציה של הגדרת 3P כדי למקסם את אותות הפלואורסצנציה של 3P.
פרוטוקול זה ממחיש את תהליך האופטימיזציה של מערך 3P טיפוסי, שיהיה שימושי במיוחד עבור מעבדות ביולוגיה שיש להן הגדרת 2P ומתכננות להרחיב את יכולתן להדמיית 3P או לשמור על מערך ה-3P המסחרי שלהן בביצועים אופטימליים. מאמר וידאו זה מדגים גם הדמיית 3P של רקמות עמוקות במוחות של בעלי חיים חיים. החלק הראשון עוסק באופטימיזציה של הגדרת 3P טיפוסית עם מקור לייזר זמין מסחרית ומיקרוסקופ מולטיפוטונים. החלק השני והשלישי מתארים את הכנת דגי הזברה והעכבר, בהתאמה, לשעה 15:00 של מבנים ופעילויות עצביות. ניתוח הגולגולת של העכבר דווח בעבר גם בניירות פרוטוקול15,16,17. החלק הרביעי מדגים הדמיה תוך-ורידית של 3P במוחות של דגי זברה ועכברים.
Protocol
כל הניסויים בבעלי חיים ונהלי הדיור של דגי זברה ועכברים אושרו ונערכו בהתאם להנחיות הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת קורנל (IACUC). דגי זברה ועכברים הומתו על ידי תמיסת טריקאין בריכוז גבוה וחנק פחמן דו חמצני, בהתאמה, לאחר הניסוי.
1. אופטימיזציה של מערך המיקרוסקופיה התלת-פוטונית
הערה: הרכיבו משקפי בטיחות בלייזר להגנה על העיניים. חסום את קרן הלייזר באמצעות חוסם קרן כאשר האופטיקה ממוקמת או מועברת. כדי לדמיין את הלייזר, השתמש במציג אינפרא אדום או בכרטיס גלאי אינפרא אדום.
- הפעל את הלייזר והגדר את אורך הגל המרכזי של פלט האידלר של המגבר הפרמטרי האופטי הלא-קולינארי (NOPA) ב~ 1,300 ננומטר או ~ 1,700 ננומטר.
- הניחו כיסוי דקה על קו הקרן מיציאת האות של NOPA (כלומר, כ-700-900 ננומטר) כדי לשקף חלק קטן מקרן הלייזר לפוטודיודה של Si כדי לקבל אותות מפעילים (איור 1). מקם חוסם קורות בנתיב השידור של זכוכית הכיסוי.
- מקם מדחסי פולסים על נתיב האור כדי להקדים את לייזר הפמטו-שניות כדי לייעל את משך הפולס לשעה 15:00. עבור קרן של כ-1,300 ננומטר, הניחו מדחס של זוג מנסרות 18,19 (לדוגמה, זוגות מנסרות N-SF11). עבור לייזר של כ-1,700 ננומטר, הניחו לוחית Si בעובי של כ-3 מ"מ20. הגדר את הזווית בין לוח Si לנתיב הלייזר בזווית של ברוסטר (~73.9° עבור 1,700 ננומטר) כדי למקסם את העברת הלייזר. סובב את צלחת ה- Si כדי להשיג את הזווית של ברוסטר על ידי מזעור ההשתקפות.
- הצב מראות סנפיר כדי לאפשר החלפה נוחה בין קווי הקרן של ~ 1,300 ננומטר ו ~ 1,700 ננומטר.
- מניחים חצי לוחית גל (למשל, חצי לוחית גל אכרומטית המתאימה ל~1,300 ו-~1,700 ננומטר) המותקנת על שלב סיבוב ומפצל קרן מקטב (PBS) כדי לשלוט בעוצמת הלייזר. מקם חוסם קרן בנתיב ההשתקפות של ה- PBS.
הערה: הלייזר צריך לעבור דרך ה- PBS בניצב כדי להשיג יחס הכחדה גבוה. עוצמת הלייזר לשעה 15:00 נשלטת על ידי סיבוב לוחית חצי הגל. - הניחו כיסוי דקה בנתיב האור אחרי בקר החשמל ולפני התריס האופטי כדי לשקף חלק קטן מקרן הלייזר למד מתח. השתמש במד ההספק כ'מד הספק ייחוס' כדי לחשב את עוצמת הלייזר תחת המטרה במהלך ההדמיה (ראה שלב 1.12).
- יישרו את נתיב הלייזר על ידי התאמת המראות להפצת הקרן למערכת של 15:00.
- מדוד את גודל הקרן במיקום הצמצם האחורי של המטרה באמצעות קצה סכין על במת תרגום ומד כוח. ודא שגודל הקרן אינו קטן מדי או גדול מדי.
הערה: בדרך כלל, הקרן ממלאת מעט את העדשה האובייקטיבית הגבוהה של NA כדי להשיג תפוקת הספק גבוהה להדמיית רקמות עמוקות. לדוגמה, גודל קרן של ~10-13 מ"מ (1/e2) בפתח האחורי של מטרת האולימפוס (~15 מ"מ קוטר הצמצם האחורי) עוזר להשיג NA יעיל של ~0.7-0.9. כאשר גודל הקרן קטן מדי, אות ה-3P נחלש, והרזולוציה המרחבית מחמירה בגלל ה-NA האפקטיבי הנמוך. כאשר גודל הקרן גדול מדי, כוח העירור המרבי הזמין תחת המטרה הופך חלש עקב אובדן הכוח בפתח האחורי של המטרה. עבור הדמיית רקמות עמוקות, קרני השוליים סובלות גם מאובדן גבוה יותר בשל הנתיב הארוך יותר ברקמה. - אם גודל הקרן בפתח הצמצם האחורי של המטרה אינו מתאים, מקם אלמנטים אופטיים מתאימים, כגון עדשות קמורות, בנתיב קרן הלייזר כדי להתאים את גודל הקרן.
הערה: ודא שקרן הלייזר אינה גדולה יותר ממראות הגלבו כדי למנוע אובדן הספק מיותר. - מקם את העדשה האובייקטיבית בהתקנת 15:00.
- מדוד את משך הדופק לאחר המטרה באמצעות מתאם אוטומטי. התאם את מדחס הדופק כדי להשיג פולסים קצרים יותר אם משך הפולס ארוך מדי (לדוגמה, >70 fs). השתמש בפולסים של ~ 50-70 fs עבור 15:00 ואינטרפרומטר מיכלסון הממוקם בין הלייזר לבין המטרה לספק את ההשהיה למדידות תיקון אוטומטי.
הערה: פוטודיודה עם תגובה ספקטרלית נכונה (לדוגמה, פוטודיודה מסיליקון עבור אורך גל גדול מ-1,200 ננומטר) הממוקמת במוקד המטרה יכולה לשמש בנוחות כגלאי לא ליניארי, וניתן להשתמש בזרם הפוטו-פוטונים הדו-פוטונים מהפוטודיודה כדי לקבל את עקבות התיקון האוטומטי20. ניתן לכוונן את מדחס זוג המנסרות עבור כ-1,300 ננומטר בשתי דרכים: (1) שינוי המרחק בין שתי המנסרות; (2) שינוי אורכי הנתיב של קרן הלייזר בזכוכית המנסרה על ידי הזזת המנסרה בניצב לקו הבסיס של המנסרה. ניתן לכוונן את מדחס לוחית Si עבור ~ 1,700 ננומטר על ידי החלפת לוחית Si בלוח Si עבה או דק יותר. - הניחו מד הספק בפלט של העדשה האובייקטיבית. מדוד את הספק הלייזר תחת המטרה וקרא את הערך של מד ההספק הייחוס (משלב 1.6). חשב את היחס בין ההספק תחת המטרה ובמד ההספק הייחוס.
הערה: במהלך ההדמיה, ניתן לחשב את הספק הלייזר בפועל תחת המטרה מיחס ההספק והערך של מד ההספק הייחוס. - הוציאו את מד הכוח מתחת למטרה.
- [אופציונלי] אימות ביצועים מוגבלים של רעשי צילום פוטונים של מערכת ההדמיה
הערה: כדי לבצע משימה זו, יש צורך באלמנטים הבאים: 1) פלואורסציין אחד או מאגר צבע אדום טקסס (למשל, ~10 μM), 2) מונה פוטונים, ו-3) אוסצילוסקופ.- הניחו את דגימת מאגר הצבעים מתחת לעדשה האובייקטיבית בשעה 15:00.
- הנמיכו בזהירות את העדשה האובייקטיבית אל מאגר הצבעים עד שהמרחק קטן ממרחק העבודה של העדשה האובייקטיבית.
- מניחים מים בין העדשה לזכוכית הכיסוי של בריכת הצבעים.
- הגדר את הספק הפלט של המיקרוסקופ לכמות קטנה (לדוגמה, <1 mW עם קצב חזרת דופק של כ-1 מגה-הרץ) כדי לאתר את פני השטח של מאגר הצבעים.
- התחל את ההפעלה החיה של המיקרוסקופ והגדר את מיקום z לאפס.
- הזיזו באיטיות את המטרה מהדגימה כדי להגיע לחלק העליון של בריכת הצבעים (כפי שמעיד הדור ההרמוני השלישי (THG) המיוצר על ידי זכוכית הכיסוי).
- הגדר את מיקום z לאפס במיקום של זכוכית הכיסוי.
- הנמיכו מעט את המטרה עד שייראה אות פלואורסצנטי ברור בערוץ הפלואורסצנציה.
- חבר את הפלט של ה- PMT למפצל BNC. חבר את הפלטים של המחיצה למונה הפוטונים ולמערכת רכישת התמונות.
- הגדר את עוצמת הלייזר לערך שבו ספירות הפוטונים בשנייה נמוכות מ-5% מקצב החזרה על הלייזר (לדוגמה,
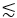 50,000 פוטונים לשנייה כאשר נעשה שימוש בלייזר של 1 מגה-הרץ).
50,000 פוטונים לשנייה כאשר נעשה שימוש בלייזר של 1 מגה-הרץ). - צמצם את שדה הראייה למינימום האפשרי עם התוכנה וודא שהבהירות אחידה בכל התמונה.
- הגדר את קצב הפריימים ל- 1.0 פריימים לשנייה.
- הגדר את תקופת הרכישה של מונה הפוטונים ל - t = מספר פיקסלים למסגרת × זמן השהייה של פיקסלים ורמת מפלה מתאימה.
- אסוף את ספירת הפוטונים ואת ספירת הפיקסלים בו-זמנית לתקופה מקבילה. כדי לקבל את ספירת הפיקסלים, אספו ערכי פיקסלים ממוצעים של התמונה כולה, כמו גם את ערכי הממוצע וסטיית התקן.
- חזור על שלב 1.14.14, וחסום את לייזר העירור כדי לקבל את ספירת הפוטונים הכהים ואת ספירת הפיקסלים.
- עצור את הרכישה החיה של התוכנה.
- הפחת את הספירות הכהות (שהתקבלו בשלב 1.14.15) מספירת הפוטונים (שהתקבלה בשלב 1.14.14) ומספירת הפיקסלים הכוללת (שהתקבלה בשלב 1.14.14).
- חלקו את ספירת הפיקסלים הכוללת עם חיסור כהה בספירת הפוטונים החתירה הכהה (שהתקבלה בשלב 1.14.17). השתמש בערך המתקבל כ'גורם ההמרה' (כלומר, ערכי פיקסלים/פוטון) מערך פיקסלים לספירת פוטון.
- המרת הממוצע וסטיית התקן של ספירת הפיקסלים (המתקבלת בשלב 1.14.14) לספירות פוטונים, כלומר חלוקתן ב'מקדם ההמרה' (המתקבל בשלב 1.14.18). השווה את הממוצע וסטיית התקן של ספירת הפוטונים. ודא שסטיית התקן שווה בערך לשורש הריבועי של ממוצע ספירות הפוטונים אם ביצועי מערכת ההדמיה קרובים לגבול רעש הצילום.
- [אופציונלי] אמת את יעילות זיהוי האותות של המיקרוסקופ.
- כדי לבחון את ביצועי המיקרוסקופ ואת יעילות זיהוי האותות, בצע את השלבים 1.14.1-1.14.14.17 כדי לקבל ספירות פוטונים. עבור שלב 1.14.15, צור דגימה ריקה העשויה מהממס עבור הצבע וקבל את ספירות הפוטונים עבור הדגימה הריקה עם הלייזר על ובאותה עוצמה כמו עבור מאגר הצבעים. הפחת את הספירות הריקות מספירת הפוטונים ממאגר הצבעים כדי לקבל את ספירות הפוטונים הפלואורסצנטיות.
- השתמש בחתכי 3P הידועים של פלואורסצין או טקסס רד10,22 ו- Eq. (1) (עם NA יעיל כדי להסביר את מילוי הצמצם האחורי כראוי) כדי לחשב את ספירות הפוטונים הצפויות ולאחר מכן להשוות את הערך המחושב עם ספירות הפוטונים שנמדדו בניסוי. תעד את שתי ספירות הפוטונים במחברת המעבדה כתוצאות בדיקה למיקרוסקופ להפניות עתידיות.
הערה: ודא שהערכים המחושבים והנמדדים קרובים זה לזה (לדוגמה, בטווח של 2). בדיקות כמותיות כאלה של המערכת שימושיות במיוחד כדי להבטיח ביצועי הדמיה עקביים לאורך זמן.
2. הכנת דגים לשעה 15:00
הערה: ללבוש כפפות ומעיל מעבדה עבור הליך זה. בחר את דגי הזברה הבוגרים על פי הניסוי. סיימו את כל ההכנה (שלבים 2.1 עד 2.7) תוך כ-15 דקות.
- הכינו צלחת פטרי עם כ-0.5 ס"מ של 2% אגר בעל נקודת התכה גבוהה. חותכים חור מלבני באגר ארוך יותר ומעט רחב יותר מהדג. השתמשו בשעווה כדי לחבר צינורות דקים (להזרמת מים לפיו של הדג) לצלחת פטרי עם קצה אחד במלבן. השתמשו בשעווה כדי לחבר צינורות בקוטר גדול יותר (להסרת מים) לקצה צלחת פטרי.
- בחרו דגים לניסוי. מרדימים את הדגים בתמיסת טריקאין של 0.2 מ"ג/מ"ל (pH 7.2) בתמיסה של האנק עד שהדגים לגמרי לא מגיבים ומרדימים עמוקות.
- מניחים את הדג על צדו על ספוג רטוב. באמצעות מיקרו-מזרק, הזריקו באופן רטרו-מסלולי 3 μL של פנקורוניום ברומיד (0.4 מיקרוגרם/מיקרול בתמיסה של האנק) כדי לשתק את הדגים. הניחו את הדג בתמיסה של האנק לזמן קצר כדי לוודא שהוא משותק לחלוטין.
- מניחים את הדגים בצד הגבי בצלחת הפטרי עם הראש לכיוון הצינורות. באמצעות מלקחיים כדי לתפעל את הצינורות, פותחים בעדינות את פיו של הדג ומחליקים את הצינורות לתוך הפה. החליקו בעדינות את הדגים לכיוון הצינורות כך שהצינורות יהיו בחלק האחורי של פיו של הדג.
- מייבשים במהירות אך בעדינות את האגר סביב הדגים ומסירים את המים על גבי הדגים. טובלים חתיכה קטנה של רקמת מעבדה בדבק מעבדה ומניחים את הרקמה על האגר משני צידי הדג ועל גבו של הדג אל הזימים.
הערה: אין ללחוץ על הדגים או להפעיל לחץ. היזהרו להימנע מקבלת דבק על הזימים. - יש למרוח טיפה קטנה של בופיוואקאין ישירות על פני השטח של הראש כדי להרדים את הדגים במהלך ההדמיה באזור שבו הלייזר ייגע בעור.
- הביאו את צלחת הפטרי עם הדגים למיקרוסקופ ומלאו אותה במים של מתקן דגים. חברו את הצינורות למשאבת מים כדי לשאוב מי מערכת בטמפרטורה של 2 מ"ל/דקה לתוך פיו של הדג ובמקביל הסירו את תמיסת הזלוף מהתבשיל באותו קצב. ודא שהמים מחומצנים עם מבעבע ומתחממים ל ~ 30 מעלות צלזיוס עם מחמם אקווריום.
הערה: הדג מוכן כעת להדמיה. עקוב אחר בריאות הדגים על ידי ניטור זרימת הדם באות הדור ההרמוני השלישי (THG) בזמן ההדמיה (ראו סעיף 4.1). הדמיית 3P צריכה להיות תואמת גם לתכשירי דגים מתוחכמים יותר כמו אלה המשמשים בהדמיית 2P כדי לתקן את הראש ולאפשר תנועות גוף תוך כדי הדמיה במהלך מציאות מדומה23. הדמיה לא פולשנית לחלוטין זו מונעת את הצורך בהסרת גולגולת כפי שמקובל במחקרים אחרים על בעלי חוליות ומהווה צעד לקראת מזעור המחקר הפולשני והכאב הנלווה אליו.
3. הכנת עכבר לשעה 15:00
הערה: לבשו כפפות, מסכה כירורגית ומעיל מעבדה במהלך ההליכים הבאים. בחר את קו העכבר בהתאם לניסוי. העכבר צריך להיות מאוחסן תחת מחזור בהיר-כהה של 12:12 שעות לפני הניתוח. הניתוח כולו (שלבים 3.2-3.11) הוא אספטי, ויש לעקר את כל כלי הניתוח לפני השימוש. הגולגולת אורכת כשעה אחת.
- מניחים מכסה בצורת סופגנייה (בקוטר 4.5-6.5 מ"מ) ודיסק כיסוי (קוטר 5 מ"מ) על פרפילם נקי. השתמשו במחט כדי למרוח כמות קטנה של דבק אופטי כדי להדביק את הכיסוי בצורת סופגנייה על דיסק הכיסויים. לרפא את כיסויי הסופגנייה של הדיסק על הפרפילם תחת אור אולטרה סגול למשך 10-20 דקות. הסירו את כל כיסויי סופגניית הדיסק מהפרפילם, והשתמשו בפינצטה כדי לגרד עודפי דבק ו-70% אתנול כדי להסיר פסולת.
הערה: עובי הכיסויים הוא כ-0.17 מ"מ. הכיסוי בצורת סופגנייה משמש להפעלת לחץ מתאים על המוח להדמיה כרונית. - מרדימים את העכבר עם תערובת גזים של 3% איזופלורן ו-20% O2 בתא אינדוקציה. שקלו את העכבר. הניחו את העכבר במצב נוטה על משטח חימום. הגדר את הטמפרטורה של כרית החימום ל ~ 37 °C (74 °F).
- לתקן את השיניים העליונות לתוך חור הפה של מנגנון סטריאוטקסי עם מיקום של מסכת הרדמה. תקן את מוטות האוזניים לאוזניים. יש לשמור על הרדמה עם תערובת גזים של 2% איזופלורןו-20% O 2 במהלך הניתוח.
הערה: התאם את ריכוז האיזופלורן על-ידי ניטור תגובת העכבר. בדקו את רמת ההרדמה על ידי צפייה בקצב הנשימה (כ-1 הרץ לשינה עמוקה) וצביטת כפות הרגליים כדי לבדוק אם יש תגובה כלשהי לפני הניתוח. - יש למרוח משחה לעיניים לצורך שימון. סגרו את העפעפיים. הדליקו את כל אורות הניתוח. תת עורית מזריקים קטופרופן, דקסמתזון וגליקופרולאט המבוססים על משקל גוף העכבר לפני הניתוח.
הערה: מינוני התרופות הם 2 מ"ג/מ"ל, 0.1 מ"ג/מ"ל ו-0.1 מ"ג/מ"ל עבור קטופרופן, דקסמתזון וגליקופרולאט, בהתאמה. נפחי ההזרקה עבור קטופרופן, דקסמתזון וגליקופרולאט תלויים במשקל הגוף והם 2.5 μL/g, 2 μL/g ו-2 μL/g, בהתאמה. - הסר שיער על כתר הראש וליד האוזניים.
- מקצצים כמה שיותר שיער במספריים או קוצץ שיער ומסירים את השיער הקצוץ מאתר הניתוח.
- יש למרוח כמות מתאימה של קרם דפילטורי. המתן דקה אחת.
- מסירים את השיער ושמנת על ידי שימוש במטוש צמר גפן ספוג במי מלח.
- חזור על שלבים 3.5.2 ו- 3.5.3 עד להסרת השיער לחלוטין.
- יש למרוח תמיסת פובידון-יוד של 5% ולאחר מכן 70% אתנול על העור כדי לנקות את האזור. חזור על התהליך שלוש פעמים.
- תנו זריקה תת עורית של אטרופין (מינון המבוסס על משקל הגוף, 0.02-0.05 מ"ג/ק"ג) על הראש. המתן דקה אחת.
- חותכים את העור על כתר הראש כדי לחשוף את הגולגולת. ודאו שנקודת הברגמא ונקודת למבדה חשופות שתיהן. הדביקו את רקמת העור שנותרה על קצה הגולגולת על ידי שימוש בדבק בעל תאימות ביולוגית כדי למנוע חדירה של אבק קידוח מתחת לעור (מה שעלול לעורר תגובה חיסונית).
- השתמש בסמן כירורגי כדי לצייר עיגול בקוטר 5 מ"מ מעל אזור העניין. לדוגמה, בחר את מרכז האזור ~ 2.5 מ"מ לרוחב ו 2 מ"מ caudal לברגמה, המכסה את רוב קליפת המוח סומטוסנסורית ואת קליפת המוח הראייתית.
- קודחים לאורך העיגול באיטיות ומורחים מלוחים כדי לייבש את הגולגולת בסיום מחצית הדרך. האטו את מהירות הקידוח במחצית האחרונה וכיסו את הגולגולת במי מלח לפני הסרת הגולגולת. פותחים את הגולגולת בעדינות עם מלקחיים ומורחים חתיכה קטנה של ג'לפה סטרילית ספוגה במי מלח כדי לעצור מיד כל דימום במוח. שמור על הידרציה של המוח באמצעות מלח.
- יש למרוח טיפה של מי מלח על הצד של כיסויי סופגניית הדיסק המוכנים הפונים אל רקמת המוח. מקם את חלק הדיסק הבולט של כיסויי הסופגנייה של הדיסק לתוך חלון הגולגולת. השתמשו במוט ארוך המוחזק על ידי המנגנון הסטריאוטקסי כדי ללחוץ בעדינות על חלק הדיסק של חלון הגולגולת המכסה את משטח המוח, ולוודא שחלק הסופגנייה מכסה בחוזקה את הגולגולת. יש לייבש את האזור סביב מכסה הדונאטס עם צמר גפן.
- יש למרוח שכבה של דבק תואם ביולוגית מתחת לקצה בצורת סופגנייה. יש למרוח שכבה של תערובת מלט דנטלית מתחת ומסביב לחלק הסופגנייה של מכסה הדונאטס. יש למרוח שכבה נוספת של דבק מעל המלט הדנטלי. 5% גלוקוז (מינון המבוסס על משקל הגוף, 10 μL/g) ניתן להזריק תת עורית כל שעה במהלך הניתוח כדי לספק אנרגיה מן החי.
- כבה את מערכת ההרדמה. שחררו את העכבר מהמנגנון הסטריאוטקטי. העבירו את העכבר למנגנון סטריאוטקטי קומפקטי מותאם אישית באופן מיידי, עם משטח חימום בטמפרטורה של כ-37 מעלות צלזיוס ומכשיר הרדמה.
- מקם את העכבר במצב נוטה על משטח החימום של המנגנון הסטריאוטקסי הקומפקטי המותאם אישית. הגדר את הטמפרטורה ל ~ 37 °C (77 °F). לתקן את השיניים העליונות לתוך חור הפה של המנגנון הסטריאוטקטי ואת מוטות האוזניים לאוזניים של העכבר. שים על צינורות ההרדמה, ולשמור על הרדמה עם 1.5% איזופלורן ו 20% O2 תערובת גז.
הערה: העכבר מוכן כעת להדמיה. שמור על העכבר מורדם במהלך הליכי ההדמיה הבאים. התאם את ריכוז האיזופלורן על-ידי ניטור תגובת העכבר.
4. הדמיה תוך-ורידית במוחות של דגים ועכברים
- הדמיה תוך-ורידית במוח דגי הזברה
הערה: כדי לאתר כראוי את מוח הדגים מתחת לעדשה האובייקטיבית, נעשה שימוש במצלמת מכשיר משני מצומד מטען (CCD) באותו נתיב כמו אור העירור להדמיית שדה רחב.- הגדר את המיקרוסקופ וכייל את הכוח (כמתואר בסעיף 1).
- מקם מטרת הגדלה נמוכה (בדרך כלל פי 4) על המיקרוסקופ.
- הניחו את צלחת הפטרי המכילה את הדגים ואת הצינורות מתחת למיקרוסקופ.
- השתמשו במקור אור של דיודה פולטת אור (LED) כדי להאיר את צלחת הפטרי.
- פתחו את מצב המצלמה של תוכנת רכישת התמונה (איור 2).
- לחץ על בשידור חי.
- בחר ערוץ A בצד ימין של המסך.
- התאם את הגדרות ההיסטוגרמה כדי לראות את התמונה בבירור.
הערה: יש לעדכן אותם לפי הצורך. - הגדר את הגדרת המנוע בבקר המנוע לבסיס.
- הנמיכו את המטרה עד שהדג נראה לעין.
הערה: ודא שהעדשה האובייקטיבית אינה יוצרת כל מגע פיזי עם הראש. - מקם את מרכז ראש הדג במרכז שדה הראייה.
- הזיזו את המטרה למעלה והרחקו מראש הדג.
- החלף את העדשה האובייקטיבית בהגדלה נמוכה בעדשה האובייקטיבית NA הגבוהה לשעה 15:00.
הערה: עדשת ההגדלה הנמוכה והעדשה האובייקטיבית NA הגבוהה אינן צריכות להיות פרפוקליות, אלא חייבות להיות קרובות מספיק כדי להבטיח שהדג נמצא בשדה הראייה של העדשה האובייקטיבית NA הגבוהה. - לאט לאט להוריד את העדשה האובייקטיבית, להבטיח כי המטרה לא עושה כל מגע פיזי עם הראש. בתוכנת מצלמת CCD, הפסק להזיז את המטרה כאשר החלק העליון של הראש גלוי. הגדר את מיקום z ל - 0 μm.
הערה: ודא שאין בועות אוויר מתחת לעדשה האובייקטיבית בעת שימוש במטרה לטבילה במים. - כבו את מקור תאורת ה-LED וסגרו את הווילון הכהה סביב המערכת.
- הגדר את תוכנת רכישת ההדמיה למצב Multiphoton GG להדמיית 3P והגדר את ההספק מתחת לעדשה האובייקטיבית לפחות מ- 1 mW (עם קצב חזרת דופק של ~ 1 MHz).
- שנה את לחצן הגדרת המנוע מבסיס למטרה בבקר המנוע.
- כבה את האורות בחדר.
- הפעל את ה- PMTs ופתח את תריס מקור העירור בשעה 15:00. ודא שקווי מתאר של העצם יופיעו בתעלת האות הפלואורסצנטית עקב אוטופלואורסצנציה ובתעלת האות THG עקב THG של העצם (איור 2C).
- בצע הדמיה בעומקים שונים על-ידי העלאת רמות ההספק בעת הדמיה עמוקה יותר.
- הדמיה תוך-ורידית במוח העכבר
הערה: להזריק 5% גלוקוז לעכבר המרדים כל שעה במהלך ההדמיה; המינון מבוסס על משקל הגוף (10 μL/g).- הגדר את תוכנת רכישת ההדמיה למצב Multiphoton GG להדמיית 3P והגדר את ההספק מתחת לעדשה האובייקטיבית לפחות מ- 1 mW (עם קצב חזרת דופק של ~ 1 MHz).
הערה: ודא שחלון הניתוח ממוקם בניצב לעדשה האובייקטיבית כדי להפחית את סטייה. כוונון עדין מבוצע על ידי הטיית המנגנון הסטריאוטקסי. - הזז את העדשה האובייקטיבית קרוב לחלון והחיל מים בין המטרה לחלון הגולגולת; להגדיר ערכי ציר של כל המנועים לאפס.
הערה:בליעתהאור ב-H 2 O ב-~1,700 ננומטר היא גדולה, מה שמפחית באופן משמעותי את עוצמת הלייזר של ~1,700 ננומטר לאחר עומק של ~1-2 מ"מ מים. עבור עירור של כ-1,700 ננומטר, השתמש ב-D2O, בעל ספיגה קטנה בהרבה ב-1,700 ננומטר, כדי שטבילת מים תפחית את הספיגה על-ידי מים. - לחץ על כפתור Live בתוכנת רכישת התמונה ופתח ערוצי PMT, לדוגמה, ערוץ אות פלואורסצנטי אחד וערוץ אות THG אחד. התאם את רווח ה-PMT ואת רמת הרקע לפי הצורך.
- התקדמו באיטיות במעלה העדשה האובייקטיבית כדי לאתר את משטח החלון על ידי ניטור תעלת ה-THG מכלי הדם הגדולים ומשטח הזכוכית של החלון. התאם את כיוון החלון (ראה את ההערה בשלב 4.2.12) במידת הצורך. אפס את המנועים כדי להגדיר את פני השטח של המוח.
- בצע הדמיה והתאם את רמת ההספק בהתאם לעומק ההדמיה.
- הגדר את תוכנת רכישת ההדמיה למצב Multiphoton GG להדמיית 3P והגדר את ההספק מתחת לעדשה האובייקטיבית לפחות מ- 1 mW (עם קצב חזרת דופק של ~ 1 MHz).
תוצאות
ההשלמה המוצלחת של פרוטוקול זה תביא למיקרוסקופ מיושר כראוי עם פרמטרי אור אופטימליים (למשל, משך פולס, NA) ותכשירים לבעלי חיים המתאימים ל-in vivo 15:00. מערך ה-3P הזמין מסחרית כולל מראות ועדשות מתאימות הן עבור ~ 1,300 ננומטר והן עבור ~ 1,700 ננומטר; לכן, אין צורך בשינוי באופטיקה כאשר אורך הגל של העירור משתנה בין 1,300 ננומטר ל-1,700 ננומטר. אם לעדשות במערך 3P אין ציפוי מתאים ל-1,300 ו-1,700 ננומטר, יש להחליף אותן באלה המתאימות כדי להפחית את אובדן כוח הלייזר. עם 15:00 הממוטב והכנת בעלי חיים נכונה, ניתן לאסוף תמונות פלואורסצנטיות ו-THG in vivo עם ניגודיות גבוהה עמוק בתוך המוח.
איור 3 מציג תמונות מייצגות של 3P של דגי זברה בוגרים שלמים. הדמיה ברזולוציה גבוהה, לא פולשנית ועמוקה של נוירונים המסומנים גנטית במוח דגי הזברה הבוגרים מושגת באמצעות 15:00. למרות שהדמיה באזור הטלנספלון דווחה במוח דגי הזברה הבוגרים באמצעות14:00 24,25,26,27, 15:00 מאפשרת גישה לכל הטלנספלון ולאזורים מאתגרים יותר או בלתי אפשריים לצפייה באמצעות טכניקות אחרות. ניתן לראות את התפלגות שכבות התאים בטקטום האופטי ובמוח הקטן באיור 3C. בסשן הדמיה מוצלח, העצם נראית בתעלת ה-THG ובנוירונים הנראים בתעלת הפלואורסצנציה. להדמיית דגי זברה בוגרים, תכונת המצלמה של המיקרוסקופ שימשה לאיתור הדגים (איור 3A). שלב זה אינו הכרחי להדמיית מוח של עכברים מכיוון שחלון הזכוכית גדול מספיק כדי להפוך את המוח לנגיש בקלות. תמונות מבניות ברזולוציה גבוהה של מוח דגי זברה בוגרים התקבלו באמצעות המערכת שתוארה בסעיפים הקודמים. הגולגולת נראית בתעלת ה-THG (איור 3B), שעוזרת לנווט במוח ולמצוא את המשטח העליון. כפי שנצפה באיור 3C, תאי עצב ניתנים להבחנה עם יחס אות-לרקע גבוה (SBR) עמוק במוח הבוגר. הרקמה שמעל המוח נראית בתעלת הפלואורסצנציה עקב אוטופלואורסצנציה.
איור 4 מראה תמונות צבעוניות של 3P של תאי עצב המסומנים ב-GCaMP6s (ירוק) וכלי דם המסומנים באדום טקסס (אדום) יחד עם אותות THG (כחול) במוח העכבר הבוגר עם עירור של 1,340 ננומטר10. התמונות משוחזרות מעבודות קודמות10. באיור 4, אנרגיית הפולס במוקד נשמרה על ~1.5 nJ בכל העומק כדי לקבל מספיק אותות פלואורסצנטיים ו-THG, והספק הלייזר הממוצע המרבי היה ~70 mW. משך הדופק הותאם ל~60 fs, וה-NA האפקטיבי היה ~0.8. עם אופטימיזציה של ההתקנה של 15:00, תמונות עם ניגודיות גבוהה התקבלו בהצלחה עד 1.2 מ"מ מפני השטח של המוח, באזור ההיפוקמפוס CA1 (איור 4A,B). איור 4C,D מראה עקבות פעילות Ca2+ של נוירונים המסומנים ב-GCaMP6s בעומק של 750 מיקרומטר למשך 10 דקות של הפעלת הקלטה, מה שמראה נאמנות הקלטה גבוהה.
אם לייזר העירור אינו מיושר כהלכה, ניתן להבחין באי-אחידות בבהירות האות על פני שדה הראייה. בנוסף, אם הפרמטרים של הלייזר, כגון משך הדופק, אנרגיית דופק העירור במיקוד וה-NA היעיל, אינם ממוטבים, תמונת ה-THG מגולגולת הדג או מחלון הקרניוטומיה של מוח העכבר לא תהיה גלויה ו/או תדרוש אנרגיית דופק עירור גבוהה (למשל, >2 nJ/pulse במוקד). לפיכך, אותות ה-THG על פני השטח של המוח יכולים לשמש כאינדיקטור להגדרה אופטימלית של 15:00 לפני תחילת הדמיית רקמות עמוקות.
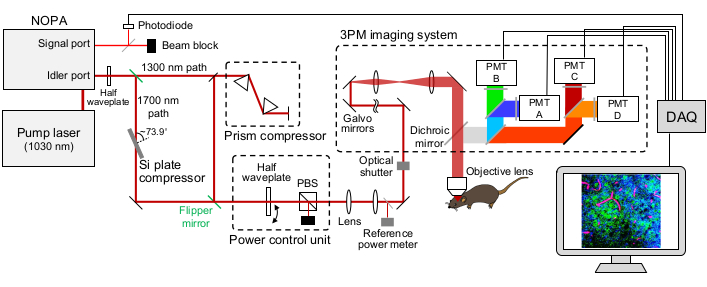
איור 1: איור סכמטי של התקנה של 15:00. אורך הגל של לייזר העירור מוגדר על ~1,300 ננומטר או ~1,700 ננומטר, פלט מיציאת האידלר של ה- NOPA. מדחס זוג המנסרות ומדחס לוחית Si משמשים ללייזר של ~ 1,300 ננומטר ו ~ 1,700 ננומטר, בהתאמה, כדי ליצור מראש את פולס הלייזר של העירור. ניתן להחליף את קרני הלייזר של ~ 1,300 ננומטר ו ~ 1,700 ננומטר עם מראות סנפיר. יציאת האות של ה- NOPA משמשת להשגת האות המפעיל. חצי לוחית גל ו- PBS משמשים לשליטה בכוח העירור. הפלואורסצנציה וה-THG מזוהים על ידי PMTs של GaAsP. שילובים מתאימים של מראות דיכרואיות ומסנני פס פס משמשים להפרדת אותות הפלואורסצנציה וה-THG. קיצורים: 15:00 = מיקרוסקופיית שלושה פוטונים; NOPA = מגבר פרמטרי אופטי לא-קולינארי; PBS = מפצל קרן מקטב; THG = דור הרמוני שלישי; DAQ = רכישת נתונים; PMT = שפופרת פוטומולטיפלייר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
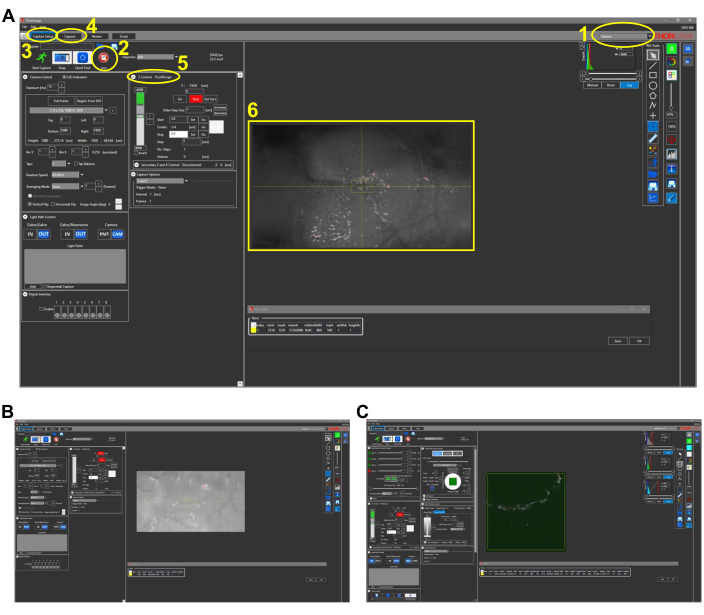
איור 2: צילומי מסך מייצגים להדמיה תוך-ורידית בדגים (סעיף פרוטוקול 4.1). (A) תצוגת מצב מצלמה של תוכנת רכישת התמונה עם עדשה אובייקטיבית 4x במקום. התכונות העיקריות של התוכנה מתוארות וממוספרות באופן הבא: 1. מצב הדמיה של תוכנת רכישת התמונה. אפשרויות המצב הן מצלמה, מולטיפוטון ומולטיפוטון GG. להדמיית אור לבן עם מצלמת CCD, נבחר מצב המצלמה . 2. לחיצה על כפתור Live מפעילה את המצלמה (או PMTs אם באפשרויות מרובות פוטון), וניתן לצפות בתצוגה בזמן אמת של המיקרוסקופ. 3. בכרטיסייה 'הגדרת לכידה ', מוגדרים פרמטרי ההדמיה הרצויים (הספק, מיקום, עומק). 4. בכרטיסייה 'לכידה ', מוקצה מיקום תיקיה לשמירת התמונות. ניתן להתחיל את ההדמיה בכרטיסייה זו. הגדרת בקרת Z שולטת בעומק ההדמיה על ידי הזזת מנוע שלב z. 6. תמונה מייצגת של ראש דג זברה. הצד הרוסטרלי של הראש נמצא בצד שמאל. (B) תצוגה מייצגת של מצב מצלמה עם עדשה אובייקטיבית פי 25. (C) תצוגה מייצגת של מצב Multiphoton GG המכיל את תמונת ה- THG של התמונה הנראית ב- (B). קיצורים: CCD = התקן מצומד לחיוב; PMT = שפופרת פוטומולטיפלייר; THG = דור הרמוני שלישי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
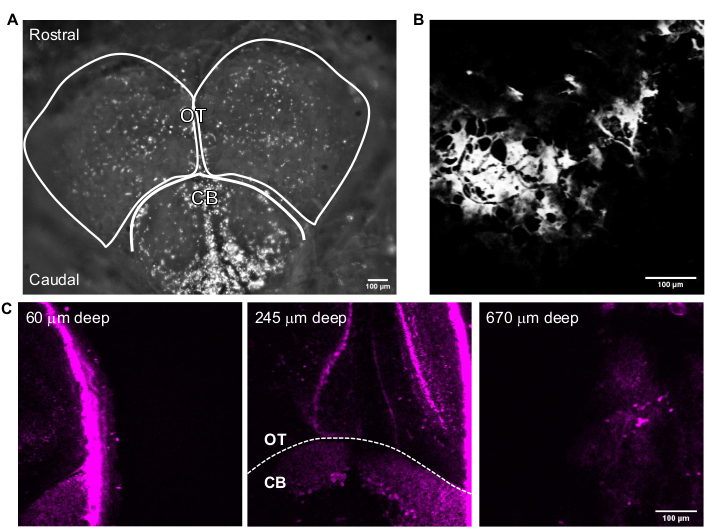
איור 3: תמונות מייצגות של מוח דגי הזברה הבוגרים שנרכשו באמצעות תוכנת רכישת התמונה. (A) תמונת מצב מצלמה של ראש דגי זברה בוגרים שנרכשה עם עדשה אובייקטיבית פי 4. החלק העליון של התמונה הוא הכיוון הרוסטרלי. אונות ה-OT וה-CB מתוארות. (B) תמונה מייצגת שנרכשה במצב Multiphoton GG עם עדשה אובייקטיבית של 25x המכילה את תמונת ה-THG של (A). (C) תמונות פלואורסצנטיות של מוח דגי זברה בוגרים בצומת של המוח הקטן והטקטום האופטי שבו GFP מתבטא בציטופלסמה של נוירונים בעומקים שונים. סרגלי קנה מידה = 100 מיקרומטר. קיצורים: OT = טקטום אופטי; CB = המוח הקטן; THG = דור הרמוני שלישי; GFP = חלבון פלואורסצנטי ירוק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
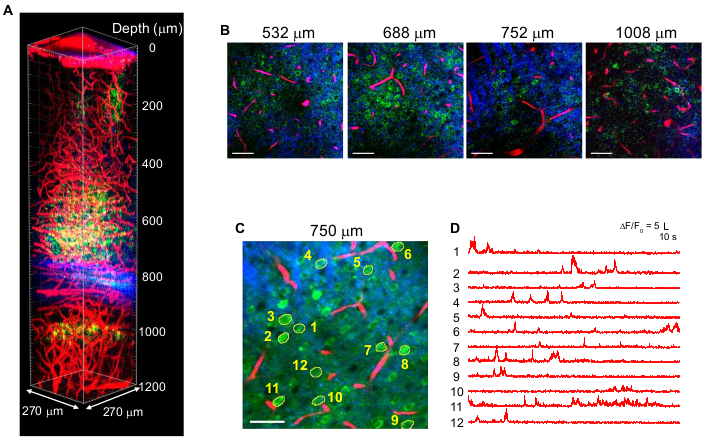
איור 4: 3 PM צבעוניים של תאי עצב המסומנים ב-GCaMP 6 s (ירוק), כלי דם המסומנים באדום טקסס (אדום) ודור שלישי הרמוני (כחול) על עירור של 1,340 ננומטר במוח העכבר. עוצמת הלייזר הייתה מגוונת בהתאם לעומק ההדמיה כדי לשמור על אנרגיית פולס של כ-1.5 nJ במוקד. ההספק הממוצע המרבי תחת היעד היה 70 mW. (B) תמונות דו-ממדיות נבחרות בעומקי הדמיה שונים. (C) אתר הקלטת פעילות במהירות של 750 מיקרומטר מתחת לדורה עם שדה ראייה של 270 x 270 מיקרומטר (256 x 256 פיקסלים). (D) עקבות פעילות מוחית ספונטנית שנרשמו בעכבר ער מהנוירונים המסומנים ב-(C). קצב הפריימים היה 8.3 הרץ, עם זמן השהייה של פיקסלים של 0.51 מיקרון. קצב החזרה בלייזר היה 2 מגה-הרץ, וההספק הממוצע תחת העדשה האובייקטיבית היה 56 mW. כל עקבה נורמלה לקו הבסיס שלה וסוננה במעבר נמוך באמצעות חלון המינג של קבוע זמן של 0.72 שניות. סרגלי קנה מידה = 50 מיקרומטר. דמות זו ומקרא הדמות משוחזרים מ-10. קיצור: 15:00 = מיקרוסקופיה של שלושה פוטונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
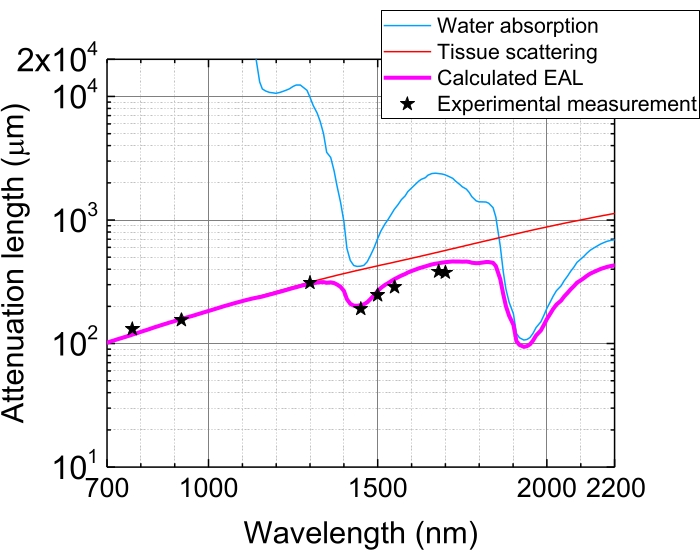
איור 5: אורך הנחתה יעיל בניאוקורטקס של מוח העכבר. EAL (קו מג'נטה) מחושב מפיזור הרקמה (קו אדום) וספיגת המים ברקמה (קו כחול), בהנחה של 75% הרכב מים. הכוכבים השחורים מצביעים על נתונים ניסיוניים מדווחים של EAL בניאוקורטקס של מוח העכבר 3,21,28,29. שים לב כי EAL משתנה ברקמות שונות. קיצור: EAL = אורך הנחתה יעיל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| אורך גל של עירור (נד) | מי טבילה | הספק לייזר מרבי (מ"ו) | אנרגיית דופק מקסימלית במיקוד* (אנ') | EAL טיפוסי בקליפת המוח של העכבר (מיקרומטר) | עומק הדמיה בקליפת המוח של העכבר** (מ"מ) | אנרגיית דופק תחת המטרה*** (אנ') | שיעור חזרות לייזר מרבי**** (מגה-הרץ) |
| 1300 | H2O או D2O |
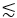 100 100 |
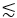 2 2 | כ-300 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210 | ~0.5 | |||||
| 2.1 | ~1100 | ~0.1 | |||||
| 1700 | ד2א |
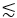 50 50 |
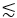 3 3 | כ-400 | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2.5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~190 | ~0.3 |
טבלה 1: תנאי עירור אופייניים של 3 P להדמיית קליפת המוח של העכבר.
*עם מטרה גבוהה של NA (~1.0), רוחב פולס של כ-50 fs, ופלואורופורים טיפוסיים כגון חלבונים פלואורסצנטיים (למשל, GFP ו-RFP).
** מתוך הנחה שה-EAL אחיד בכל קליפת המוח.
כדי להשיג ~ 1 nJ / דופק במוקד, מחושב מתוך ה- EAL ועומק ההדמיה.
מחושב מאנרגיית הדופק תחת המטרה ועוצמת הלייזר המתיר המרבית.
קיצורים: 3P = שלושה פוטונים; NA = מפתח צמצם מספרי; GFP = חלבון פלואורסצנטי ירוק; RFP = חלבון פלואורסצנטי אדום; EAL = אורך הנחתה יעיל.
Discussion
פרוטוקול זה מסביר נהלים שלב אחר שלב להגדרת הדמיית 3P עם מיקרוסקופ מסחרי ומקור לייזר. בהשוואה לשעה 14:00, לשעה 15:00 יש יתרון ביישומים הדורשים גישה אופטית באזורים העמוקים יותר כמו בהיפוקמפוס של מוח העכבר. למרות ש-15:00 משמשת בעיקר במדעי המוח, ניתן ליישם את השעה 15:00 ברקמות אחרות כגון בלוטות לימפה, עצמות וגידולים לתצפית על רקמות עמוקות.
חשוב לוודא שמערכת ההדמיה מתפקדת קרוב למגבלת רעשי הצילום, מה שמבטיח כי האלקטרוניקה לזיהוי ורכישת נתונים תורמת רעש זניח לתמונה לאחר ה-PMTs. חוסר הוודאות במספר הפוטונים שזוהו מוגבל ביסודו על ידי רעש צילום פוטונים. ביצועים מוגבלים של רעשי צילום ניתנים להשגה במיקרוסקופ מולטי-פוטון טיפוסי באמצעות פוטו-דטקטור בעל רווח גבוה (לדוגמה, PMT). רעש צילום פוטון עוקב אחר התפלגות סטטיסטית של פואסון, לפיה סטיית התקן של ההתפלגות שווה לשורש הריבועי של ממוצע ההתפלגות. כדי לאמת את הביצועים המוגבלים של רעש הצילום, בצע את שלב 1.14 במקטע הפרוטוקול.
כדי למנוע הנחתת אור על-ידי H2O, שימוש ב-D2O לטבילה מועיל, במיוחד עבור עירור של כ-1,700 ננומטר. כאשר נעשה שימוש ב- D2O, חיוני לרענן את D2O כל ~ 10 דקות או להשתמש בנפח גדול של D2O כדי למנוע חילופי D2O/ H 2O במהלך ההדמיה. ניתן גם לאטום את ה-D2O מסביבת החדר3. אם עדשת מטרה למרחק עבודה ארוך (WD) (למשל, WD ב-4 מ"מ ומעלה) משמשת להדמיה, עובי נוזל הטבילה יכול לעלות על 2-3 מ"מ. העובי המוגבר הופך את ספיגת H2O לבלתי זניחה אפילו ב-~1,300 ננומטר21. לכן, D2O עשוי להיות נחוץ אפילו עבור 1,300 ננומטר 3PM בעת שימוש בעדשה אובייקטיבית WD ארוכה.
מכיוון שעוצמת הפלואורסצנציה של 3P תלויה בקובייה של אנרגיית פולס העירור במוקד (Eq. (1)), הגדרת כוח הלייזר המתאים חשובה במיוחד להשגת אותות פלואורסצנטיים נאותים של 3P תוך הימנעות מנזק תרמי ולא ליניארי ברקמות חיות. הספק הלייזר הממוצע צריך להישמר מתחת לסף הנזק התרמי. במוח העכבר, לדוגמה, כדי למנוע נזק לרקמות תרמיות, יש לשמור את ההספק הממוצע על פני המוח של העכבר במהירות של כ-100 mW או מתחתיו לצורך עירור של כ-1,300 ננומטר בעומק של 1 מ"מ ועם שדה ראייה (FOV) של 230 μm x 230 μm21. באופן דומה, ההספק הממוצע של ~1,700 ננומטר צריך להישמר ב~ ~ 50 mW או מתחתיו בעומק של ~ 1 מ"מ ו- FOV של ~ 230 μm x 230 μm (נתונים שלא פורסמו). יתר על כן, כדי למנוע רוויית עירור ונזק לא ליניארי פוטנציאלי, יש לשמור על אנרגיית דופק העירור ב-2 nJ ו-3 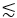
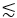 nJ עבור כ-1,300 ננומטר ו-~1,700 ננומטר, בהתאמה30.
nJ עבור כ-1,300 ננומטר ו-~1,700 ננומטר, בהתאמה30.
עקב ספיגת אור ופיזור ברקמות, אנרגיית הדופק במוקד מוחלשת ל-1/e (~37%) לאחר חדירת רקמות ב-1 EAL. ה-EAL משתנה ברקמות שונות ועם אורכי הגל של העירור, למשל, בניאוקורטקס של מוח העכבר, ה-EAL הוא ~300 מיקרומטר ו~400 מיקרומטר ב~1,300 ננומטר ו~1,700 ננומטר, בהתאמה 3,29 (איור 5). לכן, כדי לשמור על אותה אנרגיית דופק בפוקוס (למשל, 1 nJ/pulse) בעומק של n EALs, יש להכפיל את אנרגיית הדופק על פני השטח ב-1 nJ × en. להדמיה מהירה של דינמיקה מבנית ותפקודית, לייזר עירור עם קצב חזרות גבוה (ב-1 מגה-הרץ ומעלה) רצוי כדי להשיג קצב פריימים גבוהשל 5,6,7,10. עם זאת, דרישת אנרגיית הדופק ומגבלת כוח הלייזר הממוצעת מגבילות את קצב החזרה הרלוונטי.
לדוגמה, כאשר אנו מדמיינים אזור עמוק למדי ב-4 EALs (כלומר, כ-1.2 מ"מ בקליפת המוח של העכבר עם עירור של 1,300 ננומטר), נדרש כ-55 nJ/pulse על פני השטח כדי לשמור על 1 nJ/pulse בפוקוס. כאשר מגבלת ההספק הממוצעת היא 100 mW, אנו יכולים להחיל קצב חזרת לייזר של ~2 MHz. עם זאת, כדי לצלם תמונה עמוקה יותר בעומק של 7 EALs, נדרש ~1,100 nJ/pulse במשטח כדי לשמור על 1 nJ/pulse בפוקוס. בהנחה שההספק הממוצע המרבי הוא 100 mW כדי למנוע נזק תרמי, יש להפחית את קצב חזרת הלייזר ל-0.1 MHz כדי להשיג 1,100 nJ/pulse על פני השטח. טבלה 1 מסכמת תנאי הדמיה אופייניים בקליפת המוח של העכבר. שים לב שמעמקי ההדמיה בטבלה 1 מניחים שה-EAL אחיד בקליפת המוח של העכבר כולו.
יתר על כן, בגלל מגבלת כוח הלייזר ברקמות עמוקות בשעה 15:00, קיימת פשרה בין קצב הפריימים לגודל פיקסל התמונה, החשובה במיוחד להדמיה פונקציונלית כגון הדמיית סידן. קצב חזרת הלייזר המרבי הזמין נקבע בכל עומק בהתבסס על אנרגיית הפולס הנדרשת במיקוד ועל הספק הלייזר הממוצע הרלוונטי כפי שפורט לעיל, למשל, 2 מגה-הרץ בעומק שווה ערך לכ-4 EALs עם עירור של 1,300 ננומטר. באופן כללי, הדמיה דורשת לפחות פעימה אחת לכל פיקסל. בהתאם לכך, זמן השהייה המינימלי הזמין של פיקסלים נקבע על ידי קצב החזרה בלייזר, למשל, 0.5 μs/pixel עם עירור של 2 מגה-הרץ.
כדי לשמור על הרזולוציה המרחבית הגבוהה (~1 μm לרוחב) בתמונות 3P, זה אידיאלי להגדיר פיקסל אחד לאזור של ~1 μm2, למשל, 256 x 256 פיקסלים עבור FOV של 250 x 250 μm2. לפיכך, כדי לבצע הדמיה מהירה עם FOV גדול במידה ניכרת (לדוגמה, 250 x 250 מיקרומטר2 עם 256 x 256 פיקסלים), 0.5 מגה-הרץ, 1 מגה-הרץ ו-2 מגה-הרץ קצבי חזרות דופק מספקים קצבי פריימים מרביים תיאורטיים של ~7.6, ~15 ו~30 פריימים לשנייה, בהתאמה. כמו כן, האופטימיזציה של קצב חזרת הלייזר היא חיונית, בהתאם לעומק המטרה, מהירות הסריקה וה- FOV, כדי ליישם אנרגיית פולס נאותה מתחת לסף הנזק התרמי. כדי להגביר את מהירות ההדמיה, ניתן להשתמש במקור עירור אדפטיבי כדי לרכז את כל פעימות העירור על הנוירונים (כלומר, אזורי עניין) על ידי העברת פולסים בלייזר לפי דרישה לנוירונים31.
15:00 הוא יתרון בהשוואה לשעה 14:00 בהדמיה עמוקה בתוך רקמות חיות ובאמצעות אמצעי פיזור גבוהים כגון גולגולת, עצמות ושכבת החומר הלבן (כלומר, הקפסולה החיצונית) של מוח העכבר. ה-EAL הארוך יותר והעירור הלא-ליניארי מסדר גבוה יותר של 3PE מועילים להדמיית רקמות עמוקות. לדוגמה, כדי לצלם GCaMP6 בקליפת המוח של העכבר, אות פלואורסצנטי 2P עם עירור של 920 ננומטר גבוה יותר מאות פלואורסצנטי 3P עם עירור של 1,300 ננומטר באזורים רדודים ב-690 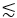 מיקרומטר (כלומר, ~2.3 EALs ב-1,300 ננומטר)21. עם זאת, בשל ה-EAL הארוך יותר ב-1,300 ננומטר בהשוואה ל-920 ננומטר, 3PE נותן פלואורסצנציה חזקה יותר מאשר עירור 2P (2PE) בעומק של כ-690 מיקרומטר ועמוק יותר21. עומק זה מוגדר כ'עומק הצלבת אותות', שבו עוצמות האות הפלואורסצנטיות של 2PE ו-3PE זהות עם אותו קצב חזרה ואותם כוחות ממוצעים מרביים מותרים21. עומק ההצלבה של האות תלוי באורכי הגל של העירור עבור 2PE ו-3PE והפלואורופור.
מיקרומטר (כלומר, ~2.3 EALs ב-1,300 ננומטר)21. עם זאת, בשל ה-EAL הארוך יותר ב-1,300 ננומטר בהשוואה ל-920 ננומטר, 3PE נותן פלואורסצנציה חזקה יותר מאשר עירור 2P (2PE) בעומק של כ-690 מיקרומטר ועמוק יותר21. עומק זה מוגדר כ'עומק הצלבת אותות', שבו עוצמות האות הפלואורסצנטיות של 2PE ו-3PE זהות עם אותו קצב חזרה ואותם כוחות ממוצעים מרביים מותרים21. עומק ההצלבה של האות תלוי באורכי הגל של העירור עבור 2PE ו-3PE והפלואורופור.
בפועל, עירור של 920 ננומטר מאפשר הספק לייזר ממוצע גבוה יותר מאשר עירור של 1,300 ננומטר עקב פחות ספיגת מים. עם זאת, ההספק הממוצע הגבוה יותר של 2PE ידחוף את עומק ההצלבה של האות רק ב-0.9 EALs4. בנוסף, כאשר הדגימה מסומנת בצפיפות, ל- 3PE יש את היתרון הנוסף של SBR גבוה בהרבה. לכן, עוד לפני שמגיעים לאורך ההצלבה של האות, 15:00 יכול להיות טוב יותר להדמיה מאשר 14:00. לדוגמה, כאשר מדמיינים את כלי הדם במוח העכבר, שיש להם שבר נפח (כלומר, צפיפות תיוג) של ~ 2%, 1,300 ננומטר 15:00 עם הספק עירור של 100 mW עולה על 920 ננומטר 14:00 עם הספק עירור של 200 mW בעומק של ~ 700 מיקרומטר עבור פלואורסציין.
ל-15:00 יש גם יתרון בעת הדמיה דרך שכבה דקה אך בעלת פיזור גבוה, שעלולה לעוות את פונקציית ההתפשטות הנקודתית של קרן העירור וליצור רקעמתפרק 4. לדוגמה, דרך הגולגולת השלמה של מוח העכבר, תמונות בשעה 14:00 סובלות מרקע ההדחה אפילו בעומק הרדוד של <100 מיקרומטר מפני השטח של המוח13. רקע דומה של דפוקוס נצפה בשעה 14:00 עם עירור של 1,280 ננומטר דרך החומר הלבן במוח העכבר32. לכן, כאשר רקמות מצולמות דרך שכבות עכורות, 15:00 עדיף על 14:00 להדמיה בניגודיות גבוהה ללא קשר לצפיפות הסימון.
לאחרונה דיווחנו על פנטום חרוזים וניתוח תיאורטי שהראה שמגבלת עומק ההדמיה של 15:00 היא מעל 8 EALs33; 8 EALs שקולים ל~3 מ"מ עם עירור של כ-1,700 ננומטר בקליפת המוח של העכבר. עם זאת, ללייזר הזמין כיום אין מספיק אנרגיית דופק כדי להשיג 8 EALs במוח העכבר. פיתוח נוסף של לייזרים חזקים יותר ידחוף את גבול עומק ההדמיה הנוכחי של 15:00.
Disclosures
המחברים מצהירים שאין להם אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי NSF DBI-1707312 קורנל NeuroNex Hub ו NIH 1U01NS103516.
Materials
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
References
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved