Method Article
インタクトマウスおよびゼブラフィッシュ脳における深部組織3光子蛍光顕微鏡
* これらの著者は同等に貢献しました
要約
3光子顕微鏡は、マウスやゼブラフィッシュの脳などの生体組織の奥深くで、高い時空間分解能で高コントラストの蛍光イメージングを可能にします。
要約
2光子顕微鏡(2PM)や3光子顕微鏡(3PM)などの多光子顕微鏡技術は、細胞内分解能で深部組織 in vivo イメージングのための強力なツールです。3PMは、生物学実験室で広く使用されている2PMを超える深部組織イメージングに2つの主要な利点を有する:(i)〜1,300nmまたは〜1,700nmの励起レーザーを採用することにより、散乱組織における減衰長が長くなる。(ii)高次非線形励起によるバックグラウンド蛍光発生が少ない。その結果、3PMは、皮質層から海馬および成体ゼブラフィッシュの前脳全体まで、無傷のマウス脳などの散乱組織の奥深くにある高コントラストの構造的および機能的イメージングを可能にする。
今日、3PMに適したレーザー光源が市販されており、既存の2光子(2P)イメージングシステムを3光子(3P)システムに変換することができます。さらに、複数の市販の3P顕微鏡が利用可能であるため、この技術は生物学研究所で容易に入手可能です。この論文は、典型的な3PMセットアップの最適化、特にすでに2Pセットアップを持っている生物学グループを標的とし、無傷のマウスおよび成体のゼブラフィッシュ脳における生体内3Dイメージングを実証する。このプロトコルは、顕微鏡アライメント、約1,300および〜1,700nmのレーザーパルスのプレチャーピング、動物の準備、および成体のゼブラフィッシュおよびマウス脳の深部における生体内3P蛍光イメージングを含む、3Pイメージングの完全な実験手順をカバーしています。
概要
生命科学では、2PMや3PMなどの多光子顕微鏡(MPM)技術は、散乱組織において高い時空間分解能と高いコントラストを備えた深部in vivoイメージングのための強力なツールとなっています。さらに、これらの方法は、1光子共焦点顕微鏡1、2、3、4と比較して、より少ないフォトブリーチングを引き起こす。3PMは、(i)より長波長励起(〜1,300nmまたは〜1,700nm)の採用が組織散乱を減少させ、および(ii)高次励起プロセス(すなわち、蛍光シグナルが2PMにおける励起電力の2乗ではなく、3PMにおける励起電力の3乗に依存する)の2つの主要な特徴のために、2PMと比較してより深い組織イメージングに有利である3.その結果、3PMは、無傷の成体マウス脳3、5、6、7、8、9、10、11およびCa2+を含む成体ゼブラフィッシュ12の前脳全体における海馬などの生体組織のより深い領域での高コントラストイメージングを可能にする。 アクティビティの記録と多色の観察。さらに、マウスおよび成体のゼブラフィッシュ12、13の無傷の頭蓋骨を通して3PMで高コントラストの画像が得られている。
今日、〜1,300および〜1,700nmでの3P励起(3PE)に適した励起レーザー光源が市販されている。レーザースキャニングシステムは2PMと3PMで本質的に同じであるため、3PE用の市販のレーザーを設置することで、生物学研究室で既存の2Pセットアップを3Pセットアップに変換することができます。3P蛍光信号は、対物レンズのレーザーパワー、パルス持続時間、レーザー繰り返し速度、および開口数(NA)に依存する。回折制限焦点(すなわち、対物レンズの背面開口が励起ビームによって過充填される)を仮定すると、Eq(1)は、3PEから生じる焦点体積からの時間平均化された蛍光光子束を記述する。
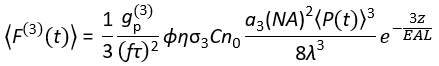 (1)
(1)
ここで、fはレーザー繰り返し速度、τはレーザーパルス持続時間(半値全幅)、φはシステム収集効率、ηは蛍光量子効率、σ3は3P吸収断面、Cは蛍光色素濃度、n0は試料媒質(例えば水)の反射指数、λは真空中の励起波長、 NAは対物レンズの開口数、3は焦点体積の空間積分定数、対物レンズ下の時間平均励起光子束(光子/s)、zは結像深度、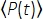 EALは有効減衰長14である。ここでは、EAL(通常は100μm>)が顕微鏡の軸方向分解能(通常は10μm<)よりもはるかに大きいと仮定しました。近軸近似では、a3 は 28.114 に等しくなります。gp(3) は励起源の 3次時間コヒーレンスであり、gp(3) は双曲線 - 正割二乗パルスとガウスパルスでそれぞれ 0.41 と 0.51 です。φ集光効率は、対物レンズによる蛍光の捕集、対物レンズの透過率、ダイクロイックミラーの反射率、フィルタの透過率、検出器(例えば、光電子増倍管、PMT)の検出効率などを考慮することにより推定することができる。3P蛍光強度は様々なパラメータに大きく依存するため、3P蛍光シグナルを最大化するには3Pセットアップの最適化が必要である。
EALは有効減衰長14である。ここでは、EAL(通常は100μm>)が顕微鏡の軸方向分解能(通常は10μm<)よりもはるかに大きいと仮定しました。近軸近似では、a3 は 28.114 に等しくなります。gp(3) は励起源の 3次時間コヒーレンスであり、gp(3) は双曲線 - 正割二乗パルスとガウスパルスでそれぞれ 0.41 と 0.51 です。φ集光効率は、対物レンズによる蛍光の捕集、対物レンズの透過率、ダイクロイックミラーの反射率、フィルタの透過率、検出器(例えば、光電子増倍管、PMT)の検出効率などを考慮することにより推定することができる。3P蛍光強度は様々なパラメータに大きく依存するため、3P蛍光シグナルを最大化するには3Pセットアップの最適化が必要である。
このプロトコルは、典型的な3Pセットアップの最適化プロセスを示しており、特に2Pセットアップを持ち、その機能を3Pイメージングに拡張したり、商用3Pセットアップを最適なパフォーマンスで維持したりする生物学研究所に役立ちます。このビデオ記事はまた、生きている動物の脳における深部組織3Pイメージングを示しています。最初のセクションでは、市販のレーザー光源と多光子顕微鏡による典型的な3Pセットアップの最適化について説明します。第2および第3のセクションでは、ニューロンの構造および活動の3PMに対するゼブラフィッシュおよびマウスの調製についてそれぞれ説明する。マウス開頭手術は、プロトコル論文でも以前に報告されている15,16,17.第4のセクションでは、ゼブラフィッシュとマウスの脳における生体内3Pイメージングを実証します。
プロトコル
ゼブラフィッシュおよびマウスのすべての動物実験および収容手順は、コーネル大学施設動物ケアおよび使用委員会(IACUC)のガイダンスに従って承認され、実施された。ゼブラフィッシュおよびマウスは、実験後に、それぞれ高濃度トリカイン溶液および二酸化炭素窒息によって安楽死させた。
1. 3光子顕微鏡セットアップの最適化
注:目の保護のためにレーザー安全メガネを着用してください。光学系が配置または移動されたときにビームブロッカーでレーザービームをブロックします。レーザーを視覚化するには、赤外線ビューアまたは赤外線検出器カードを使用します。
- レーザーをオンにし、非共線光パラメトリックアンプ(NOPA)のアイドラー出力の中心波長を〜1,300nmまたは〜1,700nmに設定します。
- NOPAの信号ポート(すなわち、約700〜900nm)からのビームライン上に薄いカバーガラスを配置し、レーザービームのごく一部をSiフォトダイオードに反射させてトリガ信号を得る(図1)。カバーガラスの透過経路にビームブロッカーを配置します。
- パルスコンプレッサーを光路に配置してフェムト秒レーザーをプレチャープし、午後3時のパルス持続時間を最適化します。〜1,300nmのビームに対して、プリズム対圧縮機18、19(例えば、N−SF11プリズム対)を配置する。〜1,700nmのレーザーの場合、厚さ20〜3mmのSi板を配置します。Siプレートとレーザー経路の間の角度をブリュースターの角度(1,700nmで約73.9°)に設定して、レーザー透過率を最大化します。Siプレートを回転させて、反射を最小限に抑えてブリュースターの角度を達成します。
- フリッパーミラーを配置して、~1,300 nmと~1,700 nmのビームラインを簡単に切り替えることができます。
- レーザーの強度を制御するために、回転ステージおよび偏光ビームスプリッター(PBS)に取り付けられた半波長板(例えば、〜1,300および〜1,700nmに適した無彩色の第1波長板)を配置する。PBSの反射経路にビームブロッカーを配置します。
注:レーザーは、高い消光比を達成するためにPBSを垂直に通過する必要があります。3PMのレーザー出力は、1/2波長板を回転させることによって制御されます。 - パワーコントローラの後と光シャッターの前に光路に薄いカバーガラスを配置して、レーザービームのごく一部をパワーメーターに反射させます。パワーメータを「基準パワーメータ」として使用して、イメージング中に対物レンズの下のレーザパワーを計算します(ステップ1.12を参照)。
- ミラーを調整してレーザー経路を調整し、ビームを3PMシステムに伝搬させます。
- 平行移動ステージのナイフエッジとパワーメーターを使用して、対物レンズの背面開口部の位置でビームサイズを測定します。ビームサイズが小さすぎたり大きすぎたりしていないことを確認します。
注:通常、ビームは高NA対物レンズをわずかにアンダーフィルして、深部組織イメージングのための高出力スループットを達成します。たとえば、オリンパス対物レンズのバックアパーチャ(バックアパーチャ直径〜15mm)で〜10〜13mm(1/e2)のビームサイズは、〜0.7〜0.9の有効NAを達成するのに役立ちます。ビームサイズが小さすぎると、3P信号が弱くなり、有効NAが低いために空間分解能が悪化する。ビームサイズが大きすぎると、対物レンズのバックアパーチャでの電力損失により、対物レンズの下で利用可能な最大励起パワーが弱くなります。深部組織イメージングの場合、周辺光線は、組織内の経路が長いため、より高い損失を被ります。 - 対物レンズの背面開口のビームサイズが適切でない場合は、凸レンズなどの適切な光学素子をレーザ光路に配置してビームサイズを調整します。
メモ:不要な電力損失を防ぐために、レーザービームがガルボミラーより大きくないことを確認してください。 - 対物レンズを 3PM セットアップに配置します。
- 自己相関器を使用して、目標の後のパルス持続時間を測定します。パルス持続時間が長すぎる場合(例:>70 fs)は、パルスコンプレッサを調整してパルスを短くします。3PMに約50〜70 fsパルスを使用し、レーザーと対物レンズの間に設置されたマイケルソン干渉計を使用して、自己相関測定の遅延を提供します。
注:対物レンズの焦点に配置された適切なスペクトル応答を有するフォトダイオード(例えば、1,200nmを超える波長のシリコンフォトダイオード)は、非線形検出器として便利に機能することができ、フォトダイオードからの2光子光電流を使用して、自己相関トレース20を得ることができる。〜1,300nmのプリズムペアコンプレッサは、2つの方法で調整できます:(1)2つのプリズム間の距離を変更します。(2)プリズムをプリズムのベースラインに対して垂直に動かすことによって、プリズムガラス内のレーザ光の経路長を変更する。〜1,700nmのSiプレートコンプレッサは、Siプレートをより厚くまたはより薄いSiプレートに置き換えることによって調整することができる。 - 対物レンズの出力にパワーメーターを置きます。対物レンズの下のレーザーパワーを測定し、基準パワーメーターの値を読み取ります(ステップ1.6から)。目標の下と基準電力計での電力の比率を計算します。
メモ:イメージング中、対物レンズの下の実際のレーザーパワーは、パワー比と基準パワーメータの値から計算できます。 - 目標の下からパワーメーターを取り出します。
- [オプション]イメージングシステムのフォトンショットノイズ制限性能を検証
注:このタスクを実行するには、1)1つのフルオレセインまたはテキサスレッド染料プール(例えば、〜10μM)、2)フォトンカウンタ、および3)オシロスコープが必要です。- 色素プールサンプルを午後3時の対物レンズの下に置きます。
- 対物レンズの作動距離よりも短くなるまで、対物レンズを染料プールに慎重に下ろします。
- レンズと染料プールのカバーガラスの間に水を入れます。
- 顕微鏡の出力電力を少量(例えば、約1MHzのパルス繰り返しレートで<1mW)に設定して、色素プールの表面の位置を特定します。
- 顕微鏡の ライブ セッションを開始し、 Z位置 を ゼロに設定します。
- 対物レンズをサンプルから遠ざけてゆっくりと移動させ、色素プールの上部に到達します(カバーガラスによって生成される第3高調波発生(THG)によって示されるように)。
- カバーガラス の位置で z 位置を ゼロ に設定します。
- 蛍光チャネルに明確な蛍光シグナルが見えるまで、対物レンズを少し下げます。
- PMT の出力を BNC スプリッタに接続します。分周器の出力をフォトンカウンタと画像取得システムに接続します。
- レーザー出力を、1秒あたりのフォトン数がレーザー繰り返し速度の5%より低い値に設定します(たとえば、
 1MHzレーザーを使用する場合は50,000光子/秒)。
1MHzレーザーを使用する場合は50,000光子/秒)。 - ソフトウェアで視野をできるだけ小さくし、画像全体で明るさが均一であることを確認します。
- フレームレートを 1.0 フレーム/秒に設定します。
- フォトンカウンタの取得期間を t=フレームあたりの画素数×画素滞留時間と適切な判別器レベルに設定します。
- 光子数とピクセル数を同じ期間同時に収集します。ピクセル数を取得するには、画像全体の平均ピクセル値、および平均値と標準偏差値を収集します。
- ステップ1.14.14を繰り返し、励起レーザーをブロックして、暗光子数とピクセル数を取得します。
- ソフトウェアの ライブ 取得を停止します。
- フォトンカウント(ステップ1.14.14で取得)と合計ピクセルカウント(ステップ1.14.14で取得)からダークカウント(ステップ1.14.15で取得)を減算します。
- 暗減算された合計ピクセル数を、暗減算されたフォトン数(ステップ1.14.17で取得)で除算します。取得した値を、ピクセル値からフォトン数への「変換係数」(すなわち、ピクセル値/光子)として使用します。
- ピクセルカウント(ステップ1.14.14で取得)の平均と標準偏差をフォトンカウントに変換する、すなわち、それらを「変換係数」(ステップ1.14.18で取得)で割る。光子数の平均と標準偏差を比較します。イメージングシステムの性能がショットノイズ限界に近い場合は、標準偏差が光子カウントの平均の平方根にほぼ等しいことを確認します。
- [オプション]顕微鏡の信号検出効率を検証します。
- 顕微鏡の性能と信号検出効率をテストするには、手順1.14.1~1.14.17に従って光子数を取得します。ステップ1.14.15では、色素の溶媒で作られたブランクサンプルを作成し、レーザーをオンにして色素プールと同じパワーでブランクサンプルの光子数を取得します。色素プールからのフォトンカウントからブランクカウントを差し引いて、蛍光フォトンカウントを得た。
- フルオレセインまたはテキサスレッド10,22および式(1)の既知の3P断面(バックアパーチャ充填を適切に考慮するための有効なNAを使用)を使用して、予想される光子数を計算し、計算された値を実験的に測定された光子数と比較します。両方の光子数を顕微鏡のテスト結果としてラボノートブックに記録し、将来の参照に役立てます。
メモ: 計算値と測定値が互いに近接していることを確認してください(たとえば、2 倍以内)。システムのこのような定量的試験は、長期にわたって一貫した画像化性能を保証するために特に有用である。
2. 午後3時の魚の準備
メモ:この手順では、手袋とラボコートを着用してください。実験に従って成体のゼブラフィッシュを選択します。準備全体(ステップ2.1〜2.7)を〜15分以内に完了します。
- 〜0.5cmの2%高融点寒天を含むペトリ皿を準備する。寒天の長方形の穴を魚よりも長くてわずかに広く切ります。ワックスを使用して、細いチューブ(魚の口に水を灌流するため)を長方形の一端でペトリ皿に取り付けます。ワックスを使用して、ペトリ皿の端に大口径のチューブ(水分を除去するため)を取り付けます。
- 実験用の魚を選択します。魚が完全に反応せず、深く麻酔されるまで、ハンクの溶液中の0.2 mg / mLトリカイン溶液(pH 7.2)で魚を麻酔します。
- 濡れたスポンジの上に魚を横に置きます。マイクロシリンジを用いて、臭化パンクロニウム3 μL(ハンクス溶液中0.4 μg/μL)を後眼窩に注入し、魚を麻痺させた。魚をハンクの溶液に短時間入れて、完全に麻痺していることを確認します。
- 魚の背側をペトリ皿に並べて、頭をチューブの方に置きます。鉗子を使ってチューブを操作し、魚の口を静かに開き、チューブを口の中にスライドさせます。チューブが魚の口の後ろに来るように、魚をチューブに向かって静かにスライドさせます。
- 魚の周りの寒天を素早く静かに乾燥させ、魚の上の水を取り除きます。実験組織の小片を実験室の接着剤に浸し、魚の両側と魚の後ろの尾からえらまでの寒天の上に組織を置きます。
注:魚を押したり、圧力をかけたりしないでください。えらに接着剤が付着しないように注意してください。 - レーザーが皮膚に接触する領域でのイメージング中に魚を麻酔するために、頭の表面に直接ブピバカインの小さな滴を塗布する。
- 魚の入ったペトリ皿を顕微鏡に持ってきて、魚類施設の水で満たします。チューブをウォーターポンプに接続して、システムの水を2mL/minで魚の口にポンプで送り込み、同時に同じ速度で皿から灌流溶液を取り除きます。水がバブラーで酸素化され、水槽のヒーターで〜30°Cに温められていることを確認してください。
注: これで、魚はイメージングの準備が整いました。イメージング中に第3高調波生成(THG)信号の血流を監視することで、魚の健康状態を監視します(セクション4.1を参照)。3Pイメージングはまた、仮想現実23中に頭部を固定し、身体の動きを可能にするために2Pイメージングで使用されるもののような、より洗練された魚の準備と互換性があるべきである。この完全に非侵襲的なイメージングは、脊椎動物の他の研究で典型的であるように頭蓋骨除去の必要性を回避し、侵襲的研究および関連する痛みを最小限に抑えるための一歩である。
3. 午後3時のマウスの準備
メモ:以下の手順では、手袋、サージカルマスク、白衣を着用してください。実験に従ってマウスの線を選択します。マウスは、手術前に12:12時間の明暗サイクルの下に収容する必要があります。手術全体(ステップ3.2-3.11)は無菌であり、すべての手術器具は使用前に滅菌する必要があります。開頭術には約1時間かかります。
- ドーナツ型(直径4.5~6.5mm)のカバースリップとカバースリップディスク(直径5mm)を清潔なパラフィルムの上に置きます。針を使って少量の光学接着剤を塗布し、ドーナツ型のカバースリップをカバースリップディスクに接着します。パラフィルム上のディスクドーナツカバースリップを紫外線下で10〜20分間硬化させる。パラフィルムからディスクドーナツカバースリップ全体を取り外し、ピンセットを使用して余分な接着剤と70%エタノールを傷つけて破片を取り除きます。
メモ:カバースリップの厚さは約0.17 mmです。ドーナツ型のカバースリップは、慢性イメージングのために脳に適切な圧力をかけるために使用されます。 - 誘導チャンバー内で3%イソフルランおよび20%O2混合ガスでマウスを麻酔する。マウスの重量を量ります。マウスを加熱パッドの上の臥位に置きます。加熱パッドの温度を〜37°Cに設定します。
- 麻酔マスクを配置して、上部の歯を定位装置の口穴に固定する。イヤーバーを耳に固定します。手術中は、2%イソフルランと20%O2混合ガスで麻酔を維持する。
注:マウスの反応を監視することによってイソフルランの濃度を調整します。呼吸数(深い睡眠の場合は〜1Hz)を見て、手術前に足をつまんで反応を確認して麻酔レベルを確認してください。 - 潤滑のために目に目の軟膏を塗布する。まぶたを閉じます。すべての手術用ライトをオンにします。手術前のマウス体重に基づいてケトプロフェン、デキサメタゾン、グリコピロレートを皮下注射する。
注:薬物用量は、ケトプロフェン、デキサメタゾン、およびグリコピロレートに対してそれぞれ2mg / mL、0.1mg / mL、および0.1mg / mLである。ケトプロフェン、デキサメタゾン、およびグリコピロレートの注射量は体重に依存し、それぞれ2.5μL/g、2μL/g、および2μL/gである。 - 頭頂部と耳の近くの髪を取り除きます。
- はさみやバリカンでできるだけ多くの髪をクリップし、クリッピングした髪を手術部位から取り除きます。
- 適量の脱毛クリームを塗布する。1分間待ちます。
- 生理食塩水に浸した綿棒を使用して髪とクリームを取り除きます。
- 毛が完全に取り除かれるまで、手順3.5.2と3.5.3を繰り返します。
- 5%ポビドン - ヨウ素溶液を塗布し、次いで70%エタノールを皮膚に塗布して、その領域を浄化する。このプロセスを 3 回繰り返します。
- 頭部にアトロピン(体重に基づく用量、0.02-0.05mg / kg)の皮下注射を行う。1分間待ちます。
- 頭蓋骨を露出させるために頭蓋骨の皮膚を切断する。ブレグマポイントとラムダポイントの両方が公開されていることを確認します。生体適合性の接着剤を使用して、縁の残りの皮膚組織を頭蓋骨に接着し、ほこりが皮膚の下に侵入するのを防ぎます(免疫応答を誘発する可能性があります)。
- 外科用マーカーを使用して、関心領域上に直径5mmの円を描きます。例えば、体性感覚野と視覚野のほとんどをカバーするブレグマの側方2.5mmおよび尾部2mmの領域の中心を選択する。
- 円に沿ってゆっくりとドリルし、途中で頭蓋骨を水分補給するために生理食塩水を塗ります。頭蓋骨を取り外す前に、最後の半分の掘削速度を遅くし、頭蓋骨を生理食塩水で覆います。鉗子で頭蓋骨を静かに開き、生理食塩水に浸した滅菌ゲルフォームの小片を塗布して、脳内の出血を直ちに止めます。生理食塩水を使用して脳を水分補給してください。
- 脳組織に面した準備されたディスクドーナツカバースリップの側面に生理食塩水を一滴塗布する。ディスクドーナツカバースリップの突き出たディスク部分を頭蓋窓に置きます。定位装置によって保持された長いバーを使用して、カバースリップ頭蓋窓のディスク部分を脳表面に静かに押し付け、ドーナツ部分が頭蓋骨をしっかりと覆うようにする。ディスクドーナツカバースリップの周りの部分を綿棒で乾かします。
- ドーナツ型の縁の下に生体適合性接着剤の層を塗布する。ディスクドーナツカバースリップのドーナツ部分の下と周りに歯科用セメントミックスの層を塗布します。歯科用セメントの上に接着剤の別の層を塗布する。5%グルコース(体重ベースの用量、10μL/g)は、動物のエネルギーを提供するために、手術中に1時間ごとに皮下注射することができます。
- 麻酔システムをシャットダウンします。マウスを定位装置から離す。マウスを、〜37°Cの加熱パッドと麻酔装置を備えた、カスタマイズされたコンパクトな定位装置に直ちに移す。
- カスタマイズされたコンパクトな定位装置の加熱パッド上の傾向がある位置にマウスを置きます。温度を〜37°Cに設定します。 上の歯を定位装置の口穴に固定し、イヤーバーをマウスの耳に固定します。麻酔チューブを着用し、1.5%イソフルランと20%O2混合ガスで麻酔を維持する。
メモ: これで、マウスをイメージングする準備ができました。マウスを麻酔をかけたままにしておき、以下の画像化手順で行ってください。マウスの反応を監視することによってイソフルランの濃度を調整します。
4. 魚類やマウスの脳における生体内イメージング
- ゼブラフィッシュ脳における生体内イメージング
注:対物レンズの下で魚の脳を適切に配置するために、二次電荷結合素子(CCD)カメラが広視野イメージング用の励起光と同じ経路上で使用される。- 顕微鏡をセットアップし、電源を較正します(セクション1を参照)。
- 顕微鏡に低倍率(通常は4倍)の対物レンズを置きます。
- 魚とチューブを入れたペトリ皿を顕微鏡下に置きます。
- 発光ダイオード(LED)光源を使用してペトリ皿を照らします。
- 画像集録ソフトウェアの カメラ モードを開きます(図2)。
- [ ライブ] をクリックします。
- 画面の右側にある チャンネルA を選択します。
- ヒストグラム設定を調整して、画像がはっきりと見えるようにします。
メモ: これらは必要に応じて更新する必要があります。 - モーターコントローラーの モーター設定 を [ベース] に設定します。
- 魚が見えるまで目標を下げます。
メモ: 対物レンズが頭部に物理的に接触していないことを確認します。 - 魚の頭の中心を視野の中心に置きます。
- 目標を上に動かし、魚の頭から遠ざけます。
- 低倍率対物レンズを3PM用の高NA対物レンズに置き換えます。
注:低倍率レンズと高NA対物レンズは、遠焦点である必要はありませんが、魚が高NA対物レンズの視野内にあることを確認するのに十分なほど近くになければなりません。 - 対物レンズをゆっくりと下げ、対物レンズが頭部に物理的に接触しないようにします。CCDカメラソフトウェアでは、頭のてっぺんが見えたら、対物レンズの動きを止めます。 z 位置 を 0 μm に設定します。
メモ: 水浸対物レンズを使用する場合は、対物レンズの下に気泡がないことを確認してください。 - LEDライトをオフにし、システムの周りの暗いカーテンを閉じます。
- イメージング取得ソフトウェアを3Pイメージング用の マルチフォトンGG モードに設定し、対物レンズ下のパワーを1mW未満(約1MHzのパルス繰り返しレート)に設定します。
- モーターコントローラーの モーター設定 ボタンを「 ベース 」から 「目標」 に変更します。
- 部屋の明かりを消す。
- PMTの電源を入れ、3PM励起源シャッターを開きます。骨の輪郭が、自家蛍光による蛍光シグナルチャネルおよび骨のTHGによるTHGシグナルチャネルに現れることを確認します(図2C)。
- より深くイメージングするときにパワーレベルを上げることで、異なる深さでイメージングを実行します。
- マウス脳内の生体内イメージング
注:イメージング中に1時間ごとに麻酔マウスに5%グルコースを注入する。用量は体重(10μL/g)に基づく。- イメージング取得ソフトウェアを3Pイメージング用の マルチフォトンGG モードに設定し、対物レンズ下のパワーを1mW未満(約1MHzのパルス繰り返しレート)に設定します。
メモ:収差を減らすために、手術ウィンドウが対物レンズに対して垂直に配置されていることを確認してください。微調整は、定位装置を傾けることにより行われる。 - 対物レンズを窓の近くに移動し、対物レンズと頭蓋窓の間に水をかけます。すべてのモーターの軸値をゼロに設定します。
注:〜1,700 nmでのH2Oの光吸収は大きく、これは〜1,700 nmの水深後に〜1,700 nmのレーザー出力を著しく低下させる。~1,700 nmの励起では、水による吸収を減らすために、水浸漬に1,700 nmでの吸収がはるかに小さいD2Oを使用します。 - 画像取得 ソフトウェアのライブ ボタンをクリックし、 PMTチャンネル(蛍光シグナルチャンネル1チャンネルとTHGシグナルチャンネル1チャンネルなど)を開きます。必要に応じて PMTゲイン と バックグラウンドレベル を調整します。
- 対物レンズをゆっくりと上に移動し、大血管と窓ガラス表面からのTHGチャネルを監視して窓面を見つけます。必要に応じて、ウィンドウの向きを調整します (ステップ 4.2.12 の注を参照)。脳の表面を定義するために モーターをゼロ にします。
- イメージングを行い、撮影深度に応じてパワーレベルを調整します。
- イメージング取得ソフトウェアを3Pイメージング用の マルチフォトンGG モードに設定し、対物レンズ下のパワーを1mW未満(約1MHzのパルス繰り返しレート)に設定します。
結果
このプロトコールが正常に完了すると、最適な光パラメータ(例えば、パルス持続時間、NA)および in vivo 3PMに適した動物調製物を有する適切に整列された顕微鏡が得られる。市販の3Pセットアップは、〜1,300nmおよび〜1,700nmの両方に適切なミラーおよびレンズを含む。したがって、励起波長を1,300nmと1,700nmの間で切り替えても、光学系の変化は必要ありません。3Pセットアップのレンズに1,300および1,700nmの適切なコーティングがない場合は、レーザー出力損失を低減するために適切なコーティングに交換する必要があります。最適化された3PMと適切な動物調製により、高コントラストの in vivo 蛍光およびTHG画像を脳の奥深くに収集することができます。
図3は、無傷の成体ゼブラフィッシュの代表的な3P画像を示す。成体ゼブラフィッシュ脳内の遺伝子標識ニューロンの高解像度、非侵襲的、および深いイメージングは、3PMを使用して達成される。成体のゼブラフィッシュ脳では2PM24,25,26,27を用いた間脳領域のイメージングが報告されているが、3PMは、間脳全体および他の技術を用いて観察することがより困難または不可能な領域へのアクセスを可能にする。視蓋および小脳における細胞層の分布は、図3Cで観察することができる。成功したイメージングセッションでは、骨はTHGチャネルで見え、ニューロンは蛍光チャネルで見える。成体のゼブラフィッシュイメージングのために、顕微鏡のカメラ機能を使用して魚の位置を特定した(図3A)。このステップは、ガラス窓が脳に簡単にアクセスできるようにするのに十分な大きさであるため、マウスの脳イメージングには必要ありません。成体ゼブラフィッシュ脳の高解像度構造画像は、前のセクションで説明したシステムを使用して得られた。頭蓋骨はTHGチャネルで見られ(図3B)、脳をナビゲートして上面を見つけるのに役立ちます。図3Cで観察されるように、ニューロンは、成人脳の深部において高いシグナル対バックグラウンド比(SBR)で区別可能である。脳の上の組織は、自己蛍光のために蛍光チャネルで見える。
図4は、1,340nm励起を有する成体マウス脳におけるGCaMP6s標識ニューロン(緑色)およびテキサスレッド標識血管(赤色)の多色3P画像とTHG(青色)信号を示す10。画像は前作10から再現したものです。図4では、焦点でのパルスエネルギーは、十分な蛍光およびTHGシグナルを得るために、深さ全体で〜1.5nJに維持され、最大平均レーザーパワーは約70mWであった。パルス持続時間は〜60fsに調整され、有効NAは〜0.8であった。3PMセットアップの最適化により、CA1海馬領域において、脳表面から1.2mmまでの高コントラスト画像が正常に得られた(図4A、B)。図4C,Dは、10分間の記録セッションで750μmの深さにおけるGCaMP6s標識ニューロンのCa2+活性痕跡を示し、高い記録忠実度を示す。
励起レーザの位置がずれていると、視野全体の信号輝度に不均一性が観察されることがあります。さらに、パルス持続時間、焦点時の励起パルスエネルギー、および有効NAなどのレーザーパラメータが最適化されていない場合、魚の頭蓋骨またはマウス脳の開頭窓からのTHG画像は見えず、および/または高い励起パルスエネルギー(例えば、焦点での>2nJ/パルス)を必要とする。したがって、脳表面のTHG信号は、深部組織イメージングを開始する前に、最適化された3PMセットアップの指標として使用できます。
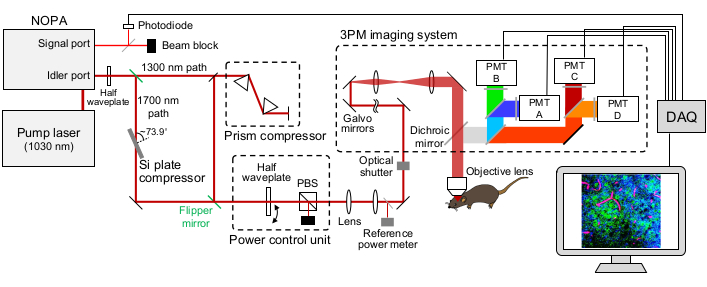
図1:3PMセットアップの概略図 励起レーザーの波長は、〜1,300nmまたは〜1,700nmに設定され、NOPAのアイドラーポートから出力される。プリズム対コンプレッサとSiプレートコンプレッサは、それぞれ〜1,300nmおよび〜1,700nmのレーザに使用され、励起レーザパルスを予感させる。〜1,300nmおよび〜1,700nmのレーザービームは、フリッパーミラーで切り替えることができます。NOPA の信号ポートは、トリガー信号を取得するために使用されます。半波長板とPBSを使用して励起電力を制御します。蛍光とTHGはGaAsP PMTによって検出されます。蛍光シグナルとTHGシグナルを分離するために、ダイクロイックミラーとバンドパスフィルターの適切な組み合わせが使用されます。略語: 3PM = 3光子顕微鏡;NOPA = 非共線光パラメトリックアンプ;PBS = 偏光ビームスプリッタ;THG = 第3高調波生成;DAQ = データ集録;PMT = 光電子増倍管。この図の拡大版を表示するには、ここをクリックしてください。
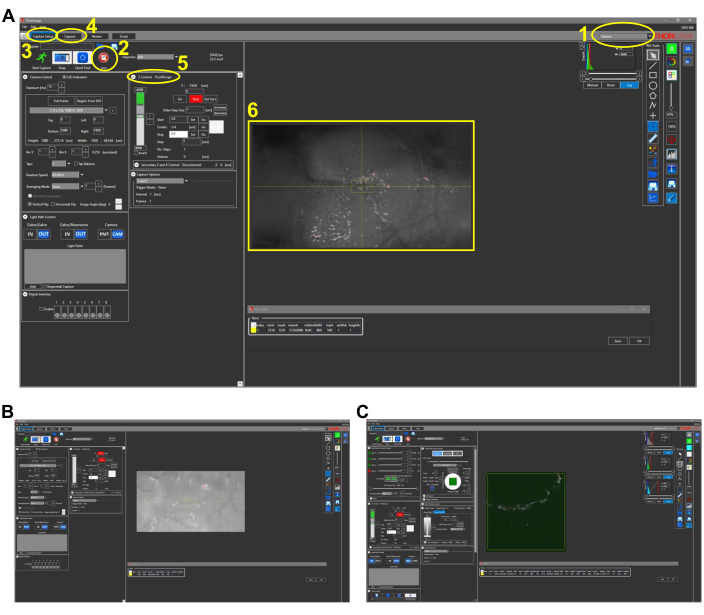
図2:魚のインタビタルイメージングの代表的なスクリーンショット(プロトコルセクション4.1)。 (A)4倍の対物レンズを配置した画像取得ソフトウェアのカメラモードビュー。ソフトウェアの主な機能は、次のように概説され、番号が付けられています:1.画像取得ソフトウェアのイメージングモード。モードオプションは、カメラ、マルチフォトン、マルチフォトンGGです。 CCDカメラによる白色光イメージングでは、カメラモードが選択されます。2. Liveボタンをクリックすると、カメラ(または多光子オプションの場合はPMT)がオンになり、顕微鏡のリアルタイムビューを観察できます。3. キャプチャ設定タブでは、目的のイメージングパラメータ(電力、位置、深度)が設定されます。4. [キャプチャ]タブでは、保存する画像のフォルダの場所が割り当てられます。イメージングは、このタブで開始できます。Z コントロール設定は、z ステージモーターを動かしてイメージングの深度を制御します。6.ゼブラフィッシュの頭の代表的な画像。頭の吻側は左側にあります。(B)25倍の対物レンズを備えたカメラモードの代表的なビュー。(C)(B)に見られる画像のTHG像を含む多光子GGモードの代表的な図。略語: CCD = 電荷結合素子;PMT = 光電子増倍管;THG = 第3高調波生成。この図の拡大版を表示するには、ここをクリックしてください。
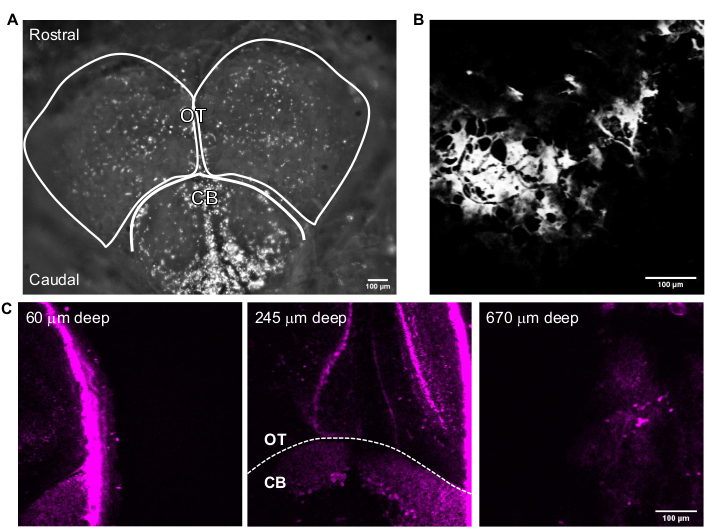
図3:画像取得ソフトで取得した成体ゼブラフィッシュ脳の代表画像。画像の上部は吻側の方向です。OT ローブと CB の概要が示されています。(B)(A)のTHG像を含む25倍の対物レンズを用いて多光子GGモードで取得した代表像。(c)様々な深さのニューロンの細胞質にGFPが発現している小脳と視蓋の交点における成体ゼブラフィッシュ脳の蛍光画像。スケールバー = 100 μm。略語: OT = オプティックテクタム;CB = 小脳;THG = 第3高調波生成;GFP = 緑色蛍光タンパク質。この図の拡大版を表示するには、ここをクリックしてください。
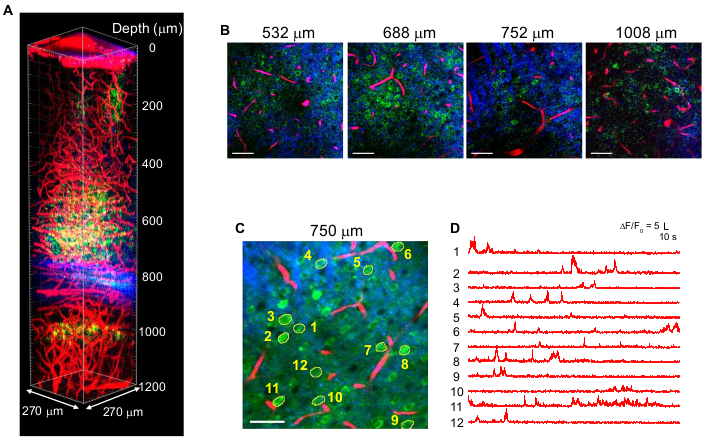
図4:マウス脳で1,340 nm励起したときのGCaMP6s標識ニューロン(緑)、テキサスレッド標識血管(赤)、および第三高調波生成(青)の多色3 PM。 (A)270 x 270 μm(フレームあたり512 x 512ピクセル)の視野で脳表面から1,200 μmまでのZスタック画像。レーザー出力は、焦点で〜1.5nJパルスエネルギーを維持するために、イメージング深度に応じて変化させた。目標の下での最大平均出力は70mWであった。(B)様々な撮像深度で選択された2D画像。(C)270 x 270 μm(256 x 256ピクセル)の視野を有する硬膜下750μmの活動記録部位。(d)(C)に示される標識ニューロンから覚醒マウスに記録された自発的な脳活動痕跡。フレームレートは8.3Hzで、ピクセルドウェルタイムは0.51μsでした。レーザーの繰り返し速度は2MHzであり、対物レンズ下の平均パワーは56mWであった。各トレースはベースラインに正規化され、時定数0.72秒のハミングウィンドウを使用してローパスフィルタリングされました。スケールバー = 50 μm。このフィギュアとフィギュア凡例を10から再現。略語:3PM = 3光子顕微鏡。この図の拡大版を表示するには、ここをクリックしてください。
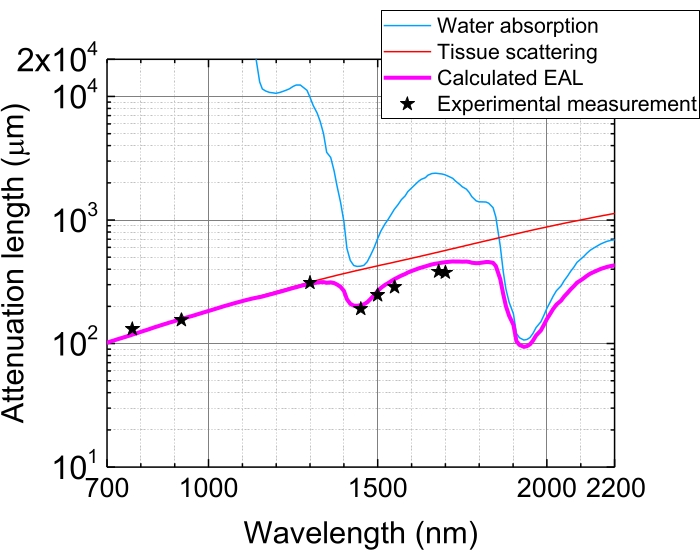
図5:マウス脳の新皮質における有効減衰長。EALは、組織散乱(赤線)と組織中の吸水率(青線)から、75%の水分組成を想定して算出される。黒い星は、マウス脳の新皮質におけるEALの報告された実験データを示す3、21、28、29。EALは組織によって異なることに注意してください。省略形: EAL = 有効減衰長。この図の拡大版を表示するには、ここをクリックしてください。
| 励起波長 (nm) | 浸漬水 | 最大レーザー出力 (ミリアンペア時) | フォーカス時の最大パルスエネルギー* (日本) | マウス皮質における典型的なEALの (μm) | マウス皮質のイメージング深度** (ミリメートル) | 目標の下のパルスエネルギー*** (日本) | 最大レーザー繰り返し速度**** (メガヘルツ) |
| 1300 | H2OまたはD2O |
 100 100 |
 2 2 | ~300 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210 | ~0.5 | |||||
| 2.1 | ~1100 | ~0.1 | |||||
| 1700 | D2O |
 50 50 |
 3 3 | ~400 | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2.5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~190 | ~0.3 |
表1:マウス皮質イメージングのための典型的な3P励起条件。
*高いNA(〜1.0)対物レンズ、〜50fsのパルス幅、および蛍光タンパク質(GFPおよびRFPなど)などの典型的な蛍光色素。
** EALが皮質全体で均一であるという前提で。
焦点で〜1 nJ /パルスを達成するために、EALとイメージング深度から計算されます。
対物レンズの下のパルスエネルギーと最大許容レーザー出力から計算されます。
略語: = 3光子;NA = 開口数;GFP = 緑色蛍光タンパク質;RFP = 赤色蛍光タンパク質;EAL = 有効減衰長。
ディスカッション
このプロトコルでは、市販の顕微鏡とレーザー光源を使用して3Pイメージングを設定するための手順を段階的に説明します。2PMと比較して、3PMは、マウス脳海馬などのより深い領域での光アクセスを必要とするアプリケーションにおいて利点を有する。3PMは主に神経科学で使用されていますが、3PMはリンパ節、骨、腫瘍などの他の組織にも深部組織観察のために適用される可能性があります。
イメージングシステムがショットノイズの限界に近い状態で動作し、検出およびデータ集録エレクトロニクスがPMT後の画像に無視できる程度のノイズで寄与することを確認することが重要です。検出される光子の数の不確実性は、光子ショットノイズによって根本的に制限される。ショットノイズ制限性能は、高利得光検出器(例えば、PMT)を使用する典型的な多光子顕微鏡において達成することができる。フォトンショットノイズはポアソン統計分布に従い、分布の標準偏差は分布の平均の平方根に等しくなります。ショットノイズが制限された性能を確認するには、プロトコルセクションのステップ 1.14 に従います。
H2Oによる光減衰を避けるために、浸漬にD2Oを使用することは、特に〜1,700nmの励起に有用である。D2Oを使用する場合、撮像中のD2O/H2O交換を避けるために、約10分ごとにD2Oをリフレッシュするか、大量のD2Oを使用することが不可欠である。また、室内環境3からD2Oを密閉することもできる。長い作動距離(WD)対物レンズ(例えば、4mm以上のWD)を撮像に使用する場合、浸漬液厚は2〜3mmを超える可能性がある。増加した厚さは、H2O吸収を〜1,300nm21でも無視できないものにする。そのため、長尺WD対物レンズを用いる場合には1,300nm3PMに対してもD2Oが必要となり得る。
3P蛍光強度は焦点における励起パルスエネルギーの3乗に依存するため(式(1))、適切なレーザーパワーを設定することは、生体組織における熱的および非線形損傷を回避しながら適切な3P蛍光信号を得るために特に重要である。平均レーザー出力は、熱損傷しきい値未満に抑える必要があります。例えば、マウス脳では、熱組織損傷を避けるために、マウス脳表面の平均電力は、1mmの深さで、視野(FOV)が230μm x 230μm21で〜1,300nmの励起に対して〜100mW以下に保たれるべきである。同様に、~1,700 nmの平均出力は、~1 mmの深さで~50 mW以下、視野は~230 μm x 230 μm(未発表データ)に維持する必要があります。さらに、励起飽和および潜在的な非線形損傷を避けるために、励起パルスエネルギーは、それぞれ〜1,300nmおよび〜1,700nm励起30に対して2nJおよび 3nJに維持
3nJに維持 されるべきである。
されるべきである。
組織における光吸収および散乱のために、焦点でのパルスエネルギーは、1 EALによる組織の浸透後に1/e(〜37%)に減衰される。EALは、異なる組織および励起波長によって変化し、例えば、マウス脳の新皮質において、EALは、それぞれ〜1,300nmおよび〜1,700nmで〜300μmおよび〜400μmである(図5)。したがって、同じパルスエネルギーをn個のEALの深さで焦点(例えば、1nJ/パルス)に保つには、表面パルスエネルギーに1nJ×enを掛ける必要がある。構造的および機能的ダイナミクスの高速イメージングのためには、高いフレームレート5、6、7、10を達成するために、高い繰り返しレート(1MHz以上)を有する励起レーザが望ましい。ただし、パルスエネルギー要件と平均レーザー出力制限により、適用可能な繰り返し速度が制限されます。
例えば、4つのALA(すなわち、1,300nmの励起でマウス皮質で〜1.2mm)で適度に深い領域を画像化する場合、1nJ/パルスを焦点を合わせ続けるために表面で〜55nJ/パルスが必要です。平均電力制限が100mWの場合、約2MHzのレーザー繰り返しレートを適用できます。しかし、7 EALの深さでより深く画像化するには、焦点が合って1 nJ/パルスを維持するために、表面で約1,100 nJ /パルスが必要です。熱損傷を避けるために最大平均電力が100mWであると仮定すると、表面で1,100nJ/パルスを達成するためには、レーザー繰り返しレートを0.1MHzに低減する必要があります。 表 1は、マウス脳皮質における典型的な画像化条件をまとめたものである。なお、 表 1の撮像深度は、EALがマウス皮質全体で均一であると仮定する。
さらに、深部組織3PMにおけるレーザーパワーの制限のために、フレームレートと画像画素サイズとの間にトレードオフが存在し、これはカルシウムイメージングなどの機能的イメージングにとって特に重要である。利用可能な最大レーザー繰り返し速度は、焦点時の必要なパルスエネルギーと、上記で説明した適用可能な平均レーザー出力(例えば、1,300nm励起で〜4つのEALに相当する深さでの2MHz)に基づいて、各深さで決定されます。一般に、イメージングには、ピクセルごとに少なくとも 1 つのパルスが必要です。したがって、使用可能な最小ピクセル滞留時間は、レーザー繰り返し速度(例えば、2MHz励起で0.5μs/ピクセル)によって決定されます。
画像で高い空間分解能 (横方向で約 1 μm) を維持するには、1 ピクセルを約 1 μm 2 の領域に設定するのが理想的です (たとえば、250 x 250μm 2 の FOV に対して 256 x 256 ピクセル)。したがって、かなり大きなFOV(例えば、256 x 256ピクセルで250 x 250 μm 2)で高速イメージングを実行するには、0.5 MHz、1 MHz、および2 MHzのパルス繰り返しレートは、それぞれ〜7.6、〜15、および〜30フレーム/秒の理論上の最大フレームレートを与える。同様に、レーザー繰り返し速度の最適化は、ターゲット深度、スキャン速度、およびFOVに応じて、熱損傷閾値の下で適切なパルスエネルギーを適用するために不可欠です。画像化速度を増加させるために、適応励起源を使用して、ニューロン31にオンデマンドでレーザーパルスを送達することによって、すべての励起パルスをニューロン(すなわち、関心領域)に集中させることができる。
3PMは、生体組織内の深部イメージングや、マウス脳の頭蓋骨、骨、白質層(すなわち、外部カプセル)などの散乱性の高い媒体を介した深部イメージングにおいて、2PMと比較すると有利である。EALが長く、3PEの高次非線形励起が長いほど、深部組織イメージングに利益をもたらします。例えば、マウス皮質のGCaMP6を画像化すると、920 nmの励起を伴う2P蛍光シグナルは、690 μmの浅い領域  における1,300 nm励起を有する3P蛍光シグナルよりも高い(すなわち、1,300nmで〜2.3 EAL)21。しかし、920nmと比較して1,300nmでのEALが長いため、3PEは〜690μmの深さおよびより深い21で2P励起(2PE)よりも強い蛍光を与える。この深さは「シグナルクロスオーバー深さ」として定義され、2PEおよび3PEの蛍光信号強度は同じ繰り返し速度および同じ最大許容平均乗21で同一である。信号クロスオーバー深度は、2PEと3PEの励起波長と蛍光色素分子によって異なります。
における1,300 nm励起を有する3P蛍光シグナルよりも高い(すなわち、1,300nmで〜2.3 EAL)21。しかし、920nmと比較して1,300nmでのEALが長いため、3PEは〜690μmの深さおよびより深い21で2P励起(2PE)よりも強い蛍光を与える。この深さは「シグナルクロスオーバー深さ」として定義され、2PEおよび3PEの蛍光信号強度は同じ繰り返し速度および同じ最大許容平均乗21で同一である。信号クロスオーバー深度は、2PEと3PEの励起波長と蛍光色素分子によって異なります。
実際には、920nm励起は、吸水率が低いため、1,300nm励起よりも高い平均レーザー出力を可能にします。ただし、平均検出力が2PEが高いほど、信号クロスオーバー深度は0.9 EAL4だけ押し上げられます。さらに、サンプルが高密度に標識されている場合、3PEははるかに高いSBRという追加の利点を有する。したがって、信号クロスオーバー長に達する前であっても、2PMよりも3PMの方がイメージングに適している可能性があります。例えば、〜2%の体積分率(すなわち、標識密度)を有するマウス脳血管系を画像化する場合、フルオレセインについて〜700μmの深さで200mWの励起電力を有する1,300nmの3PMが、100mWの励起電力を有する920nm2PMを上回る。
3PMはまた、励起ビームの点像分布機能を歪め、デフォーカス背景4を生成する可能性がある、薄いが散乱性の高い層を介して撮像する場合にも利点を有する。例えば、マウス脳の無傷の頭蓋骨を通して、2PM画像は、脳表面13から<100μmの浅い深さにおいても焦点ずれの背景に苦しんでいる。同様のデフォーカス背景が、マウス脳32内の白質を通る1,280nm励起を有する2PMにおいて観察された。したがって、組織を濁った層を通して画像化する場合、標識密度にかかわらず、高コントラストイメージングのためには3PM〜2PMが好ましい。
私たちは最近、3PMのイメージング深度限界が8 EAL33を超えていることを示すビーズファントムと理論分析を報告しました。8つのEALは、マウス皮質における〜1,700nmの励起で〜3mmに相当する。しかし、現在利用可能なレーザーは、マウス脳内で8つのEALを達成するのに十分なパルスエネルギーを持っていません。より強力なレーザーのさらなる開発は、現在のイメージング深度限界である3PMを押し上げるでしょう。
開示事項
著者らは、競合する利害関係を宣言していない。
謝辞
この研究はNSF DBI-1707312 Cornell NeuroNex HubとNIH 1U01NS103516によって支援された。
資料
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
参考文献
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved