Method Article
Tiefengewebs-Drei-Photonen-Fluoreszenzmikroskopie in intaktem Maus- und Zebrafischgehirn
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Drei-Photonen-Mikroskopie ermöglicht eine kontrastreiche Fluoreszenzbildgebung tief in lebenden biologischen Geweben wie Maus- und Zebrafischgehirnen mit hoher raumzeitlicher Auflösung.
Zusammenfassung
Multiphotonenmikroskopie-Techniken wie die Zwei-Photonen-Mikroskopie (2PM) und die Drei-Photonen-Mikroskopie (3PM) sind leistungsstarke Werkzeuge für die Tiefengewebe-In-vivo-Bildgebung mit subzellulärer Auflösung. 3PM hat zwei Hauptvorteile für die Tiefengewebebildgebung gegenüber 2PM, die in Biologielabors weit verbreitet ist: (i) längere Dämpfungslänge in streuendem Gewebe durch den Einsatz von ~ 1.300 nm oder ~ 1.700 nm Anregungslaser; (ii) geringere Hintergrundfluoreszenzerzeugung aufgrund einer nichtlinearen Anregung höherer Ordnung. Infolgedessen ermöglicht 3PM eine kontrastreiche strukturelle und funktionelle Bildgebung tief in streuendem Gewebe wie dem intakten Mausgehirn von den kortikalen Schichten bis zum Hippocampus und dem gesamten Vorderhirn erwachsener Zebrafische.
Heute sind Laserquellen, die für 3PM geeignet sind, kommerziell erhältlich, was die Umwandlung eines bestehenden Zwei-Photonen-Bildgebungssystems (2P) in ein Drei-Photonen-System (3P) ermöglicht. Darüber hinaus sind mehrere kommerzielle 3P-Mikroskope erhältlich, wodurch diese Technik für biologische Forschungslaboratorien leicht zugänglich ist. Dieses Papier zeigt die Optimierung eines typischen 3PM-Setups, insbesondere für Biologiegruppen, die bereits ein 2P-Setup haben, und demonstriert intravitale 3D-Bildgebung in intakten Maus- und erwachsenen Zebrafischgehirnen. Dieses Protokoll deckt das gesamte experimentelle Verfahren der 3P-Bildgebung ab, einschließlich Mikroskopausrichtung, Vorzwitschern von ~ 1.300 und ~ 1.700 nm Laserpulsen, Tierpräparation und intravitaler 3P-Fluoreszenzbildgebung tief in erwachsenen Zebrafisch- und Mäusegehirnen.
Einleitung
In den Biowissenschaften waren Multiphotonenmikroskopie-Techniken (MPM) wie 2PM und 3PM leistungsstarke Werkzeuge für die tiefe In-vivo-Bildgebung mit hoher räumlich-zeitlicher Auflösung und hohem Kontrast in streuenden Geweben. Darüber hinaus verursachen diese Methoden weniger Photobleichen im Vergleich zur konfokalen Ein-Photonen-Mikroskopie 1,2,3,4. 3PM ist vorteilhaft für tiefere Gewebebildgebung im Vergleich zu 2PM aufgrund von zwei Hauptmerkmalen: (i) Die Verwendung einer längerwelligen Anregung (~ 1.300 nm oder ~ 1.700 nm) reduziert die Gewebestreuung und (ii) der Anregungsprozess höherer Ordnung (dh das Fluoreszenzsignal hängt vom Würfel der Anregungsleistung in 3PM anstelle des Quadrats der Anregungsleistung in 2PM ab), der die unerwünschte Hintergrundfluoreszenz unterdrückt3 . Folglich ermöglicht 3PM eine kontrastreiche Bildgebung an tieferen Regionen in lebenden Geweben wie dem Hippocampus in einem intakten erwachsenen Mausgehirn 3,5,6,7,8,9,10,11 und dem gesamten Vorderhirn des erwachsenen Zebrafisches 12, einschließlich Ca2+. Aktivitätsaufzeichnung und mehrfarbige Beobachtungen. Darüber hinaus wurden mit 3PM durch die intakten Schädel von Maus und adulten Zebrafischen12,13 kontrastreiche Bilder erhalten.
Heute sind Anregungslaserquellen, die für die 3P-Anregung (3PE) bei ~1.300 und ~1.700 nm geeignet sind, im Handel erhältlich. Da das Laserscanning-System für 2PM und 3PM im Wesentlichen gleich ist, ist die Umstellung eines bestehenden 2P-Setups in ein 3P-Setup in Biologielabors mit der Installation eines kommerziell erhältlichen Lasers für 3PE möglich. Das 3P-Fluoreszenzsignal hängt von der Laserleistung, der Pulsdauer, der Laserwiederholrate und der numerischen Apertur (NA) der Objektivlinse ab. Unter der Annahme eines beugungsbegrenzten Fokus (d. h. die Rückblende der Objektivlinse wird durch den Anregungsstrahl überfüllt), beschreibt Eq (1) den zeitgemittelten Fluoreszenzphotonenfluss aus dem von 3PE resultierenden Brennvolumen.
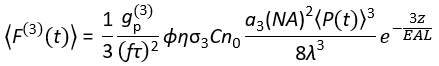 (1)
(1)
Dabei ist f die Laserwiederholrate, τ die Laserpulsdauer (volle Breite bei halbem Maximum), φ ist die Systemsammlungseffizienz, η ist die Fluoreszenzquanteneffizienz, σ 3 ist der 3P-Absorptionsquerschnitt, C ist die Fluorophorkonzentration, n0 ist der Reflexionsindex des Probenmediums (z. B. Wasser), λ ist die Anregungswellenlänge im Vakuum, NA ist die numerische Apertur der Objektivlinse, a 3 ist die räumliche Integrationskonstante des Brennvolumens, ist der zeitgemittelte Anregungsphotonenfluss (Photonen/s) unter der Objektivlinse, 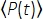 z ist die abgebildete Tiefe und EAL ist die effektive Dämpfungslänge14. Hier haben wir angenommen, dass der EAL (typischerweise > 100 μm) viel größer ist als die axiale Auflösung des Mikroskops (typischerweise < 10 μm). Unter paraxialer Näherung ist eine3 gleich 28,114. GP(3) ist die zeitliche Kohärenz der Anregungsquelle 3. Ordnung, und gp(3) ist 0,41 bzw. 0,51 für hyperbolisch-sekant-quadratische Impulse bzw. Gaußsche Impulse. Die Abscheideeffizienz φ kann unter Berücksichtigung der Fluoreszenzsammlung durch die Objektivlinse, der Transmission der Objektivlinse, der Reflektivität des dichroitischen Spiegels, der Durchlässigkeit der Filter und der Detektionseffizienz des Detektors (z. B. Photomultiplierröhre oder PMT) geschätzt werden. Da die 3P-Fluoreszenzintensität stark von verschiedenen Parametern abhängt, ist eine Optimierung des 3P-Aufbaus erforderlich, um die 3P-Fluoreszenzsignale zu maximieren.
z ist die abgebildete Tiefe und EAL ist die effektive Dämpfungslänge14. Hier haben wir angenommen, dass der EAL (typischerweise > 100 μm) viel größer ist als die axiale Auflösung des Mikroskops (typischerweise < 10 μm). Unter paraxialer Näherung ist eine3 gleich 28,114. GP(3) ist die zeitliche Kohärenz der Anregungsquelle 3. Ordnung, und gp(3) ist 0,41 bzw. 0,51 für hyperbolisch-sekant-quadratische Impulse bzw. Gaußsche Impulse. Die Abscheideeffizienz φ kann unter Berücksichtigung der Fluoreszenzsammlung durch die Objektivlinse, der Transmission der Objektivlinse, der Reflektivität des dichroitischen Spiegels, der Durchlässigkeit der Filter und der Detektionseffizienz des Detektors (z. B. Photomultiplierröhre oder PMT) geschätzt werden. Da die 3P-Fluoreszenzintensität stark von verschiedenen Parametern abhängt, ist eine Optimierung des 3P-Aufbaus erforderlich, um die 3P-Fluoreszenzsignale zu maximieren.
Dieses Protokoll veranschaulicht den Optimierungsprozess eines typischen 3P-Setups, der insbesondere für Biologielabors nützlich sein wird, die über ein 2P-Setup verfügen und planen, seine Fähigkeit auf 3P-Bildgebung auszuweiten oder ihr kommerzielles 3P-Setup mit optimaler Leistung zu halten. Dieser Videoartikel demonstriert auch die 3P-Bildgebung von Tiefengewebe in lebenden Tiergehirnen. Der erste Abschnitt befasst sich mit der Optimierung eines typischen 3P-Aufbaus mit einer handelsüblichen Laserquelle und einem Multiphotonenmikroskop. Der zweite und dritte Abschnitt beschreiben die Vorbereitung von Zebrafischen bzw. Mäusen auf 15 Uhr neuronaler Strukturen und Aktivitäten. Die Kraniotomie-Operation der Maus wurde bereits in Protokollpapieren sowiein 15,16,17 berichtet. Der vierte Abschnitt demonstriert die intravitale 3P-Bildgebung in Zebrafisch- und Mäusegehirnen.
Protokoll
Alle Tierversuche und Haltungsverfahren für Zebrafische und Mäuse wurden in Übereinstimmung mit den Leitlinien des Cornell University Institutional Animal Care and Use Committee (IACUC) genehmigt und durchgeführt. Zebrafische und Mäuse wurden nach dem Experiment durch hochkonzentrierte Tricainlösung bzw. Kohlendioxid-Erstickung eingeschläfert.
1. Optimierung des Drei-Photonen-Mikroskopie-Aufbaus
HINWEIS: Tragen Sie eine Laserschutzbrille zum Schutz der Augen. Blockieren Sie den Laserstrahl mit einem Strahlblocker, wenn Optiken platziert oder bewegt werden. Um den Laser zu visualisieren, verwenden Sie einen Infrarot-Viewer oder eine Infrarot-Detektorkarte.
- Schalten Sie den Laser ein und stellen Sie die mittlere Wellenlänge des Leerlaufausgangs des nicht-kollinearen optischen parametrischen Verstärkers (NOPA) auf ~1.300 nm oder ~1.700 nm ein.
- Platzieren Sie ein dünnes Deckglas auf der Beamline vom Signalport von NOPA (d. h. ~ 700-900 nm), um einen kleinen Teil des Laserstrahls auf eine Si-Fotodiode zu reflektieren, um auslösende Signale zu erhalten (Abbildung 1). Platzieren Sie einen Strahlblocker im Übertragungsweg des Deckglases.
- Platzieren Sie Pulskompressoren auf dem Lichtweg, um den Femtosekundenlaser vorzuchirpen, um die Pulsdauer für 15 Uhr zu optimieren. Für ~1.300 nm Strahl platzieren Sie einen Prismenpaar-Kompressor18,19 (z. B. N-SF11-Prismenpaare). Für einen Laser von ~1.700 nm legen Sie eine Si-Platte mit einer Dicke von ~ 3 mm in der Dicke20. Stellen Sie den Winkel zwischen der Si-Platte und dem Laserpfad auf den Brewster-Winkel (~ 73,9 ° für 1.700 nm) ein, um die Laserdurchlässigkeit zu maximieren. Drehen Sie die Si-Platte, um den Winkel des Brewster zu erreichen, indem Sie die Reflexion minimieren.
- Platzieren Sie Flipperspiegel, um ein bequemes Umschalten zwischen den Strahllinien ~1.300 nm und ~1.700 nm zu ermöglichen.
- Platzieren Sie eine halbe Wellenplatte (z. B. eine achromatische Halbwellenplatte, die für ~ 1.300 und ~ 1.700 nm geeignet ist), die auf einer Rotationsstufe montiert ist, und einen polarisierenden Strahlteiler (PBS), um die Intensität des Lasers zu steuern. Platzieren Sie einen Balkenblocker im Reflexionspfad des PBS.
HINWEIS: Der Laser muss das PBS senkrecht passieren, um eine hohe Extinktionsrate zu erreichen. Die Laserleistung für 3PM wird durch Drehen der halben Wellenplatte gesteuert. - Platzieren Sie ein dünnes Deckglas im Lichtweg nach dem Leistungsregler und vor dem optischen Verschluss, um einen kleinen Teil des Laserstrahls zu einem Leistungsmesser zu reflektieren. Verwenden Sie den Leistungsmesser als "Referenzleistungsmesser", um die Laserleistung unter dem Objektiv während der Bildgebung zu berechnen (siehe Schritt 1.12).
- Richten Sie den Laserpfad aus, indem Sie die Spiegel so einstellen, dass der Strahl in das 3PM-System übertragen wird.
- Messen Sie die Strahlgröße an der Position der hinteren Öffnung des Objektivs mit einer Messerschneide auf einer Übersetzungsstufe und einem Leistungsmesser. Stellen Sie sicher, dass die Strahlgröße nicht zu klein oder zu groß ist.
HINWEIS: Typischerweise unterfüllt der Strahl die hohe NA-Objektivlinse leicht, um einen hohen Leistungsdurchsatz für die Tiefengewebebildgebung zu erreichen. Zum Beispiel hilft eine Strahlgröße von ~ 10-13 mm (1 / e2) an der hinteren Öffnung des Olympus-Objektivs (~ 15 mm Rückenöffnungsdurchmesser), eine effektive NA von ~ 0,7-0,9 zu erreichen. Wenn die Strahlgröße zu klein ist, wird das 3P-Signal schwach und die räumliche Auflösung verschlechtert sich aufgrund der niedrigen effektiven NA. Wenn die Strahlgröße zu groß ist, wird die maximal verfügbare Anregungsleistung unter dem Objektiv aufgrund des Leistungsverlusts an der hinteren Blende des Objektivs schwach. Auch bei der Tiefenbildgebung erleiden die Randstrahlen aufgrund des längeren Weges im Gewebe einen höheren Verlust. - Wenn die Strahlgröße an der hinteren Blende des Objektivs nicht angemessen ist, platzieren Sie geeignete optische Elemente, wie z. B. konvexe Linsen, im Laserstrahlpfad, um die Strahlgröße anzupassen.
HINWEIS: Stellen Sie sicher, dass der Laserstrahl nicht größer als die Galvospiegel ist, um unnötige Leistungsverluste zu vermeiden. - Legen Sie das Objektiv auf das 3PM-Setup.
- Messen Sie die Pulsdauer nach dem Objektiv mit einem Autokorrelator. Stellen Sie den Pulskompressor so ein, dass kürzere Impulse erreicht werden, wenn die Pulsdauer zu lang ist (z. B. >70 fs). Verwenden Sie ~ 50-70 fs Pulse für 3PM und ein Michelson-Interferometer, das zwischen dem Laser und dem Objektiv platziert ist, um die Verzögerung für Autokorrelationsmessungen bereitzustellen.
HINWEIS: Eine Photodiode mit einer richtigen spektralen Reaktion (z. B. eine Silizium-Photodiode für eine Wellenlänge größer als 1.200 nm), die im Fokus des Objektivs platziert ist, kann bequem als nichtlinearer Detektor dienen, und der Zwei-Photonen-Photostrom von der Photodiode kann verwendet werden, um die Autokorrelationsspuren20 zu erhalten. Der Prismenpaar-Kompressor für ~ 1.300 nm kann auf zwei Arten eingestellt werden: (1) Ändern des Abstands zwischen den beiden Prismen; (2) Änderung der Weglängen des Laserstrahls im Prismenglas durch senkrechtes Verschieben des Prismas (der Prismen) senkrecht zur Basislinie des Prismas. Der Si-Plattenkompressor für ~ 1.700 nm kann eingestellt werden, indem die Si-Platte durch eine dickere oder dünnere Si-Platte ersetzt wird. - Platzieren Sie einen Leistungsmesser am Ausgang des Objektivs. Messen Sie die Laserleistung unter dem Objektiv und lesen Sie den Wert des Referenzleistungsmessers ab (ab Schritt 1,6). Berechnen Sie das Verhältnis der Leistung unter dem Objektiv und am Referenzleistungsmesser.
HINWEIS: Während der Bildgebung kann die tatsächliche Laserleistung unter dem Objektiv aus dem Leistungsverhältnis und dem Wert des Referenzleistungsmessers berechnet werden. - Nehmen Sie den Leistungsmesser unter dem Objektiv heraus.
- [Optional] Überprüfen der durch Photonenschussrauschen begrenzten Leistung des Bildgebungssystems
HINWEIS: Um diese Aufgabe auszuführen, werden die folgenden Elemente benötigt: 1) ein Fluorescein- oder Texas Red-Farbstoffpool (z. B. ~ 10 μM), 2) ein Photonenzähler und 3) ein Oszilloskop.- Legen Sie die Farbstoffpoolprobe unter die 3PM-Objektivlinse.
- Senken Sie die Objektivlinse vorsichtig auf den Farbstoffpool, bis der Abstand kleiner ist als der Arbeitsabstand der Objektivlinse.
- Wasser zwischen die Linse und das Deckglas des Färbebeckens legen.
- Stellen Sie die Ausgangsleistung des Mikroskops auf einen kleinen Betrag ein (z. B. <1 mW mit ~ 1 MHz Pulswiederholrate), um die Oberfläche des Farbstoffpools zu lokalisieren.
- Starten Sie die Live-Sitzung des Mikroskops und setzen Sie die z-Position auf Null.
- Bewegen Sie das Objektiv langsam von der Probe weg, um die Oberseite des Farbstoffpools zu erreichen (wie durch die dritte harmonische Generation (THG) angezeigt, die vom Deckglas erzeugt wird).
- Stellen Sie die z-Position an der Position des Deckglases auf Null .
- Senken Sie das Objektiv leicht ab, bis ein klares Fluoreszenzsignal im Fluoreszenzkanal sichtbar ist.
- Schließen Sie den Ausgang des PMT an einen BNC-Splitter an. Verbinden Sie die Ausgänge des Teilers mit dem Photonenzähler und dem Bildaufnahmesystem.
- Stellen Sie die Laserleistung auf einen Wert ein, bei dem die Photonenanzahl pro Sekunde unter 5% der Laserwiederholrate liegt (z. B. 50.000 Photonen/s, wenn ein 1-MHz-Laser verwendet wird).

- Reduzieren Sie das Sichtfeld mit der Software auf ein Minimum und stellen Sie sicher, dass die Helligkeit über das Bild gleichmäßig ist.
- Legen Sie die Bildrate auf 1,0 Frame pro Sekunde fest.
- Stellen Sie den Erfassungszeitraum des Photonenzählers auf t = Anzahl der Pixel pro Bild × Pixelverweilzeit und eine geeignete Diskriminatorstufe ein.
- Erfassen Sie die Photonenanzahl und die Pixelanzahl gleichzeitig für einen entsprechenden Zeitraum. Um die Pixelanzahl zu erhalten, sammeln Sie die durchschnittlichen Pixelwerte des gesamten Bildes sowie die mittleren und Standardabweichungswerte.
- Wiederholen Sie Schritt 1.14.14 und blockieren Sie den Anregungslaser, um die Anzahl der dunklen Photonen und Pixel zu erhalten.
- Stoppen Sie die Live-Erfassung der Software.
- Subtrahiert man die Dunkelzählungen (erhalten in Schritt 1.14.15) von den Photonenzahlen (erhalten in Schritt 1.14.14) und der Gesamtzahl der Pixel (bezogen in Schritt 1.14.14).
- Teilen Sie die dunkel subtrahierte Gesamtpixelanzahl durch die dunkel subtrahierte Photonenzahl (erhalten in Schritt 1.14.17). Verwenden Sie den erhaltenen Wert als "Umrechnungsfaktor" (d. h. Pixelwerte / Photonen) von einem Pixelwert zu einer Photonenanzahl.
- Wandeln Sie den Mittelwert und die Standardabweichung der Pixelanzahl (erhalten in Schritt 1.14.14) in Photonenzahlen um, d. h. sie werden durch den "Umrechnungsfaktor" (in Schritt 1.14.18) dividiert. Vergleichen Sie den Mittelwert und die Standardabweichung der Photonenzählungen. Stellen Sie sicher, dass die Standardabweichung ungefähr gleich der Quadratwurzel des Mittelwerts der Photonenzählungen ist, wenn die Leistung des Bildgebungssystems nahe der Aufnahme-Rausch-Grenze liegt.
- [Optional] Überprüfen Sie die Signalerkennungseffizienz des Mikroskops.
- Um die Mikroskopleistung und die Signaldetektionseffizienz zu testen, führen Sie die Schritte 1.14.1-1.14.17 aus, um Photonenzahlen zu erhalten. Für Schritt 1.14.15 ist eine Blindprobe aus dem Lösungsmittel für den Farbstoff zu erzeugen und die Photonenzahl für die Blindprobe mit eingeschaltetem Laser und mit der gleichen Leistung wie für die Farbstoffgemeinschaft zu erhalten. Subtrahieren Sie die Leerzählungen von den Photonenzahlen aus dem Farbstoffpool, um die Fluoreszenzphotonenzahlen zu erhalten.
- Verwenden Sie die bekannten 3P-Querschnitte von Fluorescein oder Texas Red10,22 und Äq. (1) (mit einem effektiven NA, um die Rückblendenfüllung richtig zu berücksichtigen), um die erwarteten Photonenzahlen zu berechnen und dann den berechneten Wert mit den experimentell gemessenen Photonenzahlen zu vergleichen. Notieren Sie beide Photonenzahlen im Laborbuch als Testergebnisse für das Mikroskop für zukünftige Referenzen.
HINWEIS: Stellen Sie sicher, dass die berechneten und gemessenen Werte nahe beieinander liegen (z. B. innerhalb eines Faktors von 2). Solche quantitativen Tests des Systems sind besonders nützlich, um eine konsistente Bildgebungsleistung im Laufe der Zeit sicherzustellen.
2. Fischzubereitung für 15 Uhr
HINWEIS: Tragen Sie für dieses Verfahren Handschuhe und einen Laborkittel. Wählen Sie den erwachsenen Zebrafisch nach dem Experiment. Beenden Sie die gesamte Vorbereitung (Schritte 2.1 bis 2.7) innerhalb von ~ 15 Minuten.
- Bereiten Sie eine Petrischale mit ~ 0,5 cm 2% Agar mit hohem Schmelzpunkt zu. Schneiden Sie ein rechteckiges Loch in den Agar, das länger und etwas breiter als der Fisch ist. Verwenden Sie Wachs, um dünne Schläuche (zum Durchbluten von Wasser in das Maul des Fisches) an der Petrischale mit einem Ende im Rechteck zu befestigen. Verwenden Sie Wachs, um Schläuche mit größerem Durchmesser (zur Entfernung von Wasser) am Rand der Petrischale zu befestigen.
- Wählen Sie Fisch für das Experiment. Betäuben Sie den Fisch mit 0,2 mg/ml Tricainlösung (pH 7,2) in Hanks Lösung, bis der Fisch völlig unempfindlich und tief betäubt ist.
- Legen Sie den Fisch auf die Seite auf einen nassen Schwamm. Injizieren Sie mit einer Mikrospritze retroorbital 3 μL Pancuroniumbromid (0,4 μg/μL in Hanks Lösung), um den Fisch zu lähmen. Legen Sie den Fisch kurz in Hanks Lösung, um sicherzustellen, dass er vollständig gelähmt ist.
- Legen Sie den Fisch dorsal mit der Seite nach oben in die Petrischale mit dem Kopf zum Schlauch. Verwenden Sie eine Pinzette, um den Schlauch zu manipulieren, öffnen Sie vorsichtig das Maul des Fisches und schieben Sie den Schlauch in den Mund. Schieben Sie den Fisch vorsichtig in Richtung des Schlauches, so dass sich der Schlauch an der Rückseite des Mauls des Fisches befindet.
- Trocknen Sie das Agar schnell, aber vorsichtig um den Fisch herum und entfernen Sie das Wasser auf dem Fisch. Tauchen Sie ein kleines Stück Laborgewebe in Laborkleber und legen Sie das Gewebe auf beiden Seiten des Fisches auf das Agar und über den Rücken des Fisches mit den Kiemen.
HINWEIS: Drücken Sie nicht auf den Fisch und üben Sie keinen Druck aus. Achten Sie darauf, dass Sie keinen Klebstoff auf die Kiemen bekommen. - Tragen Sie einen kleinen Tropfen Bupivacain direkt auf die Oberfläche des Kopfes auf, um den Fisch während der Bildgebung in der Region zu betäuben, in der der Laser die Haut berührt.
- Bringen Sie die Petrischale mit dem Fisch zum Mikroskop und füllen Sie sie mit Fischpflanzenwasser. Schließen Sie den Schlauch an eine Wasserpumpe an, um Systemwasser mit 2 ml/min in das Maul des Fisches zu pumpen und gleichzeitig die Perfusionslösung mit der gleichen Geschwindigkeit aus der Schale zu entfernen. Stellen Sie sicher, dass das Wasser mit einem Bubbler mit Sauerstoff angereichert und mit einer Aquarienheizung auf ~ 30 ° C erwärmt wird.
HINWEIS: Der Fisch ist jetzt bereit für die Bildgebung. Überwachen Sie die Gesundheit der Fische, indem Sie den Blutfluss im Signal der dritten harmonischen Generation (THG) während der Bildgebung überwachen (siehe Abschnitt 4.1). Die 3P-Bildgebung sollte auch mit anspruchsvolleren Fischpräparaten kompatibel sein, wie sie in der 2P-Bildgebung verwendet werden, um den Kopf zu fixieren und Körperbewegungen während der Bildgebung während der virtuellen Realität23 zu ermöglichen. Diese vollständig nicht-invasive Bildgebung vermeidet die Notwendigkeit einer Schädelentfernung, wie sie in anderen Studien an Wirbeltieren typisch ist, und ist ein Schritt zur Minimierung invasiver Forschung und der damit verbundenen Schmerzen.
3. Mausvorbereitung für 15 Uhr
HINWEIS: Tragen Sie während der folgenden Eingriffe Handschuhe, chirurgische Maske und Laborkittel. Wählen Sie die Mauslinie entsprechend dem Experiment aus. Die Maus sollte vor der Operation in einem 12:12 h Hell-Dunkel-Zyklus untergebracht werden. Die gesamte Operation (Schritte 3.2-3.11) ist aseptisch, und alle chirurgischen Werkzeuge sollten vor der Anwendung sterilisiert werden. Die Kraniotomie dauert ~1 h.
- Legen Sie ein Donut-förmiges Deckglas (4,5-6,5 mm Durchmesser) und eine Deckglasscheibe (5 mm Durchmesser) auf sauberen Parafilm. Verwenden Sie eine Nadel, um eine kleine Menge optischen Klebstoffs aufzutragen, um das Donut-förmige Deckglas auf die Deckglasscheibe zu kleben. Härten Sie den Scheiben-Donut-Decklack auf dem Parafilm unter ultraviolettem Licht für 10-20 min aus. Entfernen Sie den gesamten Disk-Donut-Decklack vom Parafilm und verwenden Sie eine Pinzette, um überschüssigen Kleber und 70% Ethanol zu entfernen, um Ablagerungen zu entfernen.
HINWEIS: Die Deckgläser sind ~0,17 mm dick. Das Donut-förmige Deckglas wird verwendet, um bei chronischer Bildgebung angemessenen Druck auf das Gehirn auszuüben. - Betäuben Sie die Maus mit 3% Isofluran und 20%O2 Gasgemisch in einer Induktionskammer. Wiegen Sie die Maus. Platzieren Sie die Maus in einer Bauchlage auf einem Heizkissen. Stellen Sie die Temperatur des Heizkissens auf ~37 °C ein.
- Fixieren Sie die oberen Zähne in das Mundloch eines stereotaktischen Apparates mit der Platzierung einer Anästhesiemaske. Befestigen Sie die Ohrstangen an den Ohren. Aufrechterhaltung der Anästhesie mit 2% Isofluran und 20%O2 Gasgemisch während der Operation.
HINWEIS: Passen Sie die Isoflurankonzentration an, indem Sie die Reaktion der Maus überwachen. Überprüfen Sie das Anästhesieniveau, indem Sie die Atemfrequenz (~ 1 Hz für Tiefschlaf) beobachten und die Füße kneifen, um vor der Operation nach einer Reaktion zu suchen. - Tragen Sie Augensalbe zur Schmierung auf die Augen auf. Schließen Sie die Augenlider. Schalten Sie alle Operationslichter ein. Subkutan injizieren Ketoprofen, Dexamethason und Glykopyrrolat basierend auf dem Körpergewicht der Maus vor der Operation.
HINWEIS: Die Arzneimitteldosen betragen 2 mg / ml, 0,1 mg / ml und 0,1 mg / ml für Ketoprofen, Dexamethason bzw. Glycopyrrolat. Die Injektionsvolumina für Ketoprofen, Dexamethason und Glykopyrrolat hängen vom Körpergewicht ab und betragen 2,5 μL/g, 2 μL/g bzw. 2 μL/g. - Entfernen Sie Haare auf der Krone des Kopfes und in der Nähe der Ohren.
- Schneiden Sie so viele Haare wie möglich mit einer Schere oder einer Haarschneidemaschine und entfernen Sie die abgeschnittenen Haare von der Operationsstelle.
- Tragen Sie eine angemessene Menge Enthaarungscreme auf. Warten Sie 1 min.
- Entfernen Sie Haare und Creme, indem Sie ein Wattestäbchen verwenden, das in Kochsalzlösung getränkt ist.
- Wiederholen Sie die Schritte 3.5.2 und 3.5.3, bis die Haare vollständig entfernt sind.
- Tragen Sie 5% ige Povidon-Jod-Lösung und dann 70% Ethanol auf die Haut auf, um den Bereich zu reinigen. Wiederholen Sie den Vorgang dreimal.
- Geben Sie eine subkutane Injektion von Atropin (Dosis basierend auf dem Körpergewicht, 0,02-0,05 mg/kg) auf den Kopf. Warten Sie 1 min.
- Schneiden Sie die Haut auf der Krone des Kopfes, um den Schädel freizulegen. Stellen Sie sicher, dass sowohl der Bregma-Punkt als auch der Lambda-Punkt freigelegt sind. Kleben Sie das verbleibende Hautgewebe am Rand an den Schädel, indem Sie biokompatiblen Kleber verwenden, um zu vermeiden, dass Bohrstaub unter die Haut eindringt (was eine Immunantwort auslösen kann).
- Verwenden Sie einen chirurgischen Marker, um einen Kreis mit einem Durchmesser von 5 mm über den interessierenden Bereich zu zeichnen. Wählen Sie beispielsweise die Mitte des Bereichs ~ 2,5 mm lateral und 2 mm kaudal zum Bregma aus, der den größten Teil des somatosensorischen Kortex und des visuellen Kortex abdeckt.
- Bohren Sie langsam entlang des Kreises und tragen Sie Kochsalzlösung auf, um den Schädel zu hydratisieren, wenn Sie halb fertig sind. Verlangsamen Sie die Bohrgeschwindigkeit für die letzte Hälfte und bedecken Sie den Schädel mit Kochsalzlösung, bevor Sie den Schädel entfernen. Öffnen Sie den Schädel vorsichtig mit einer Pinzette und tragen Sie ein kleines Stück sterilen Gelschaums auf, das in Kochsalzlösung getränkt ist, um Blutungen im Gehirn sofort zu stoppen. Halten Sie das Gehirn hydratisiert, indem Sie Kochsalzlösung verwenden.
- Tragen Sie einen Tropfen Kochsalzlösung auf die Seite des vorbereiteten Scheiben-Donut-Deckglases auf, das dem Hirngewebe zugewandt ist. Legen Sie den hervorstehenden Scheibenteil des Scheiben-Donut-Deckglases in das Schädelfenster. Verwenden Sie eine lange Stange, die vom stereotaktischen Apparat gehalten wird, um den Scheibenteil des Coverslip-Schädelfensters vorsichtig auf die Gehirnoberfläche zu drücken, um sicherzustellen, dass der Donut-Teil den Schädel fest bedeckt. Trocknen Sie den Bereich um das Scheiben-Donut-Deckglas mit einem Wattestäbchen.
- Tragen Sie eine Schicht biokompatiblen Klebstoffs unter die donutförmige Kante auf. Tragen Sie eine Schicht Zahnzementmischung unter und um den Donut-Teil des Scheiben-Donut-Deckglases auf. Tragen Sie eine weitere Schicht Klebstoff über den Zahnzement auf. 5% Glukose (Dosis basierend auf dem Körpergewicht, 10 μL / g) kann während der Operation jede Stunde subkutan injiziert werden, um tierische Energie zu liefern.
- Schalten Sie das Anästhesiesystem aus. Lassen Sie die Maus aus dem stereotaktischen Gerät los. Übertragen Sie die Maus sofort auf ein kundenspezifisches kompaktes stereotaktisches Gerät mit einem Heizkissen bei ~ 37 ° C und einem Anästhesiegerät.
- Platzieren Sie die Maus in einer Bauchlage auf dem Heizkissen des kundenspezifischen kompakten stereotaktischen Geräts. Stellen Sie die Temperatur auf ~37 °C ein. Fixieren Sie die oberen Zähne in das Mundloch des stereotaktischen Apparates und die Ohrstangen in den Ohren der Maus. Setzen Sie die Anästhesieröhrchen auf und halten Sie die Anästhesie mit 1,5% Isofluran und 20% O2 Gasgemisch aufrecht.
HINWEIS: Die Maus ist jetzt bereit für die Bildgebung. Lassen Sie die Maus während der folgenden bildgebenden Verfahren betäuben. Passen Sie die Konzentration von Isofluran an, indem Sie die Reaktion der Maus überwachen.
4. Intravitale Bildgebung im Gehirn von Fischen und Mäusen
- Intravitale Bildgebung im Zebrafischgehirn
HINWEIS: Um das Fischgehirn unter dem Objektiv richtig zu lokalisieren, wird eine CCD-Kamera (Secondary Charge-Coupled Device) auf demselben Weg wie das Anregungslicht für die Weitfeldbildgebung verwendet.- Richten Sie das Mikroskop ein und kalibrieren Sie die Leistung (wie in Abschnitt 1 beschrieben).
- Platzieren Sie ein Objektiv mit geringer Vergrößerung (typischerweise 4x) auf dem Mikroskop.
- Legen Sie die Petrischale mit dem Fisch und den Röhrchen unter das Mikroskop.
- Verwenden Sie eine Leuchtdioden-Lichtquelle (LED), um die Petrischale zu beleuchten.
- Öffnen Sie den Kameramodus der Bilderfassungssoftware (Abbildung 2).
- Klicken Sie auf Live.
- Wählen Sie Kanal A auf der rechten Seite des Bildschirms aus.
- Passen Sie die Histogrammeinstellungen an, um das Bild klar zu sehen.
HINWEIS: Diese müssen bei Bedarf aktualisiert werden. - Stellen Sie die Motoreinstellung auf der Motorsteuerung auf Base ein.
- Senken Sie das Ziel, bis der Fisch sichtbar ist.
HINWEIS: Stellen Sie sicher, dass die Objektivlinse keinen physischen Kontakt mit dem Kopf hat. - Platzieren Sie die Mitte des Fischkopfes in der Mitte des Sichtfeldes.
- Bewegen Sie das Ziel nach oben und weg vom Fischkopf.
- Ersetzen Sie das Objektiv mit geringer Vergrößerung durch das Objektiv mit hohem NA-Objektiv für 3PM.
HINWEIS: Das Objektiv mit geringer Vergrößerung und das Objektiv mit hohem NA-Objektiv müssen nicht parfokal sein, sondern müssen nahe genug sein, um sicherzustellen, dass sich der Fisch im Sichtfeld des Objektivs mit hohem NA-Objektiv befindet. - Senken Sie die Objektivlinse langsam ab, um sicherzustellen, dass das Objektiv keinen physischen Kontakt mit dem Kopf hat. Hören Sie in der CCD-Kamerasoftware auf, das Objektiv zu bewegen, wenn die Oberseite des Kopfes sichtbar ist. Setzen Sie die z-Position auf 0 μm.
HINWEIS: Stellen Sie sicher, dass sich unter der Objektivlinse keine Luftblasen befinden, wenn Sie ein Wassertauchobjektiv verwenden. - Schalten Sie die LED-Lichtquelle aus und schließen Sie den dunklen Vorhang um das System.
- Stellen Sie die Bilderfassungssoftware für 3P-Bildgebung auf den Multiphotonen-GG-Modus ein und stellen Sie die Leistung unter der Objektivlinse auf weniger als 1 mW ein (mit ~ 1 MHz Pulswiederholrate).
- Ändern Sie die Motoreinstellungstaste auf der Motorsteuerung von Base in Objective .
- Schalten Sie das Licht im Raum aus.
- Schalten Sie die PMTs ein und öffnen Sie den 3PM Erregungsquellenverschluss. Stellen Sie sicher, dass ein Umriss des Knochens im Fluoreszenzsignalkanal aufgrund von Autofluoreszenz und im THG-Signalkanal aufgrund von THG des Knochens erscheint (Abbildung 2C).
- Führen Sie Bildgebungen in verschiedenen Tiefen durch, indem Sie die Leistungsstufen bei tieferer Bildgebung erhöhen.
- Intravitale Bildgebung im Gehirn der Maus
HINWEIS: Injizieren Sie während der Bildgebung jede Stunde 5% Glukose in die betäubte Maus; Die Dosis basiert auf dem Körpergewicht (10 μL/g).- Stellen Sie die Bilderfassungssoftware für 3P-Bildgebung auf den Multiphotonen-GG-Modus ein und stellen Sie die Leistung unter der Objektivlinse auf weniger als 1 mW ein (mit ~ 1 MHz Pulswiederholrate).
HINWEIS: Stellen Sie sicher, dass das Operationsfenster senkrecht zur Objektivlinse platziert ist, um Aberrationen zu reduzieren. Die Feineinstellung erfolgt durch Kippen des stereotaktischen Geräts. - Bewegen Sie die Objektivlinse nahe an das Fenster und tragen Sie Wasser zwischen dem Objektiv und dem Schädelfenster auf. Setzen Sie die Achswerte aller Motoren auf Null.
HINWEIS: Die Lichtabsorption inH2Obei ~1.700 nm ist groß, was die ~1.700 nm Laserleistung nach einer Tiefe von ~1-2 mm Wasser deutlich reduziert. Für ~ 1.700 nm Anregung verwenden Sie D2O, das bei 1.700 nm eine viel geringere Absorption aufweist, um das Eintauchen in Wasser zu reduzieren, um die Absorption durch Wasser zu reduzieren. - Klicken Sie in der Bilderfassungssoftware auf die Schaltfläche Live und öffnen Sie PMT-Kanäle, z.B. einen Fluoreszenzsignalkanal und einen THG-Signalkanal. Passen Sie die PMT-Verstärkung und den Hintergrundpegel nach Bedarf an.
- Bewegen Sie sich langsam die Objektivlinse nach oben, um die Fensteroberfläche zu lokalisieren, indem Sie den THG-Kanal von den großen Blutgefäßen und der Fensterglasoberfläche aus überwachen. Passen Sie bei Bedarf die Fensterausrichtung an (siehe Hinweis in Schritt 4.2.12). Nullen Sie die Motoren , um die Oberfläche des Gehirns zu definieren.
- Führen Sie eine Bildgebung durch und passen Sie die Leistungsstufe entsprechend der Abbildungstiefe an.
- Stellen Sie die Bilderfassungssoftware für 3P-Bildgebung auf den Multiphotonen-GG-Modus ein und stellen Sie die Leistung unter der Objektivlinse auf weniger als 1 mW ein (mit ~ 1 MHz Pulswiederholrate).
Ergebnisse
Der erfolgreiche Abschluss dieses Protokolls führt zu einem richtig ausgerichteten Mikroskop mit optimalen Lichtparametern (z. B. Pulsdauer, NA) und Tierpräparaten, die für in vivo 3PM geeignet sind. Das handelsübliche 3P-Setup umfasst geeignete Spiegel und Linsen für ~1.300 nm und ~1.700 nm; Daher ist keine Änderung der Optik erforderlich, wenn die Anregungswellenlänge zwischen 1.300 nm und 1.700 nm geschaltet wird. Wenn die Linsen in einem 3P-Setup keine geeignete Beschichtung für 1.300 und 1.700 nm haben, müssen diese durch geeignete ersetzt werden, um den Laserleistungsverlust zu reduzieren. Mit der optimierten 3PM und der richtigen Tierpräparation können in vivo Fluoreszenz- und THG-Bilder mit hohem Kontrast tief im Gehirn gesammelt werden.
Abbildung 3 zeigt repräsentative 3P-Bilder von intakten erwachsenen Zebrafischen. Eine hochauflösende, nicht-invasive und tiefe Bildgebung von genetisch markierten Neuronen im erwachsenen Zebrafischgehirn wird mit 3PM erreicht. Obwohl im erwachsenen Zebrafischgehirn mit 2PM24,25,26,27 über eine Bildgebung in der Telenzephalon-Region berichtet wurde, ermöglicht 3PM den Zugang zum gesamten Telencephalon und zu Regionen, die mit anderen Techniken schwieriger oder unmöglich zu beobachten sind. Die Verteilung der Zellschichten im optischen Tectum und Kleinhirn kann in Abbildung 3C beobachtet werden. Bei einer erfolgreichen Bildgebungssitzung ist der Knochen im THG-Kanal und Neuronen im Fluoreszenzkanal sichtbar. Für die Bildgebung von erwachsenen Zebrafischen wurde die Kamerafunktion des Mikroskops verwendet, um den Fisch zu lokalisieren (Abbildung 3A). Dieser Schritt ist für die Bildgebung des Mausgehirns nicht notwendig, da das Glasfenster groß genug ist, um das Gehirn leicht zugänglich zu machen. Hochauflösende Strukturbilder des erwachsenen Zebrafischgehirns wurden mit dem in den vorherigen Abschnitten beschriebenen System erhalten. Der Schädel ist im THG-Kanal zu sehen (Abbildung 3B), der hilft, durch das Gehirn zu navigieren und die obere Oberfläche zu finden. Wie in Abbildung 3C beobachtet, sind Neuronen mit einem hohen Signal-zu-Hintergrund-Verhältnis (SBR) tief im erwachsenen Gehirn unterscheidbar. Das Gewebe über dem Gehirn ist aufgrund der Autofluoreszenz im Fluoreszenzkanal sichtbar.
Abbildung 4 zeigt mehrfarbige 3P-Bilder von GCaMP6s-markierten Neuronen (grün) und Texas Red-markierten Blutgefäßen (rot) zusammen mit THG (blau) Signalen im erwachsenen Mausgehirn mit 1.340 nm Anregung10. Die Bilder stammen aus früheren Arbeiten10. In Abbildung 4 wurde die Pulsenergie im Fokus in der gesamten Tiefe bei ~ 1,5 nJ gehalten, um ausreichende Fluoreszenz- und THG-Signale zu erhalten, und die maximale durchschnittliche Laserleistung betrug ~ 70 mW. Die Pulsdauer wurde auf ~60 fs eingestellt und die effektive NA betrug ~0,8. Mit der Optimierung des 3PM-Aufbaus konnten kontrastreiche Bilder bis zu 1,2 mm von der Gehirnoberfläche in der CA1-Hippocampus-Region erfolgreich erhalten werden (Abbildung 4A,B). Abbildung 4C,D zeigt Ca2+ Aktivitätsspuren von GCaMP6s-markierten Neuronen in einer Tiefe von 750 μm für eine 10-minütige Aufnahmesitzung, die eine hohe Aufnahmetreue zeigt.
Wenn der Anregungslaser falsch ausgerichtet ist, kann eine Ungleichmäßigkeit der Signalhelligkeit über das Sichtfeld beobachtet werden. Wenn die Laserparameter wie die Pulsdauer, die Anregungspulsenergie im Fokus und die effektive NA nicht optimiert sind, ist das THG-Bild vom Fischschädel oder dem Kraniotomiefenster des Mausgehirns nicht sichtbar und / oder erfordert eine hohe Erregungspulsenergie (z. B. >2 nJ / Puls beim Fokus). Daher können die THG-Signale an der Gehirnoberfläche als Indikator für ein optimiertes 3PM-Setup verwendet werden, bevor mit der Tiefengewebebildgebung begonnen wird.
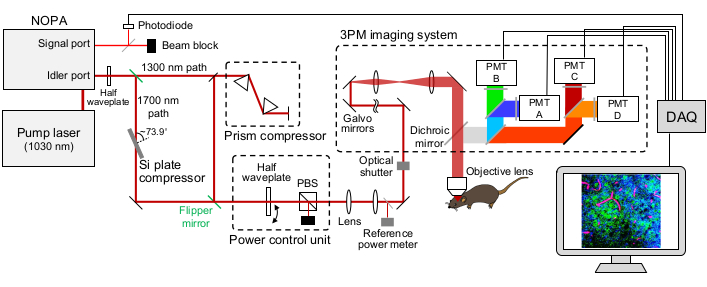
Abbildung 1: Schematische Darstellung eines 15-Uhr-Setups. Die Wellenlänge des Anregungslasers wird auf ~1.300 nm oder ~1.700 nm eingestellt, die vom Leerlaufport des NOPA ausgegeben wird. Der Prismenpaar-Kompressor und der Si-Plattenkompressor werden für den ~1.300-nm- bzw. ~1.700-nm-Laser verwendet, um den Anregungslaserpuls vorzuchirpieren. Die ~1.300 nm und ~1.700 nm Laserstrahlen können mit Flipperspiegeln geschaltet werden. Der Signalport des NOPA wird verwendet, um das auslösende Signal zu erhalten. Eine halbe Wellenplatte und ein PBS werden verwendet, um die Anregungsleistung zu steuern. Die Fluoreszenz und THG werden durch GaAsP PMTs detektiert. Geeignete Kombinationen von dichroitischen Spiegeln und Bandpassfiltern werden verwendet, um die Fluoreszenz- und THG-Signale zu trennen. Abkürzungen: 3PM = Drei-Photonen-Mikroskopie; NOPA = nicht-kollinearer optischer parametrischer Verstärker; PBS = polarisierender Strahlteiler; THG = dritte harmonische Generation; DAQ = Datenerfassung; PMT = Photomultiplierröhre. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
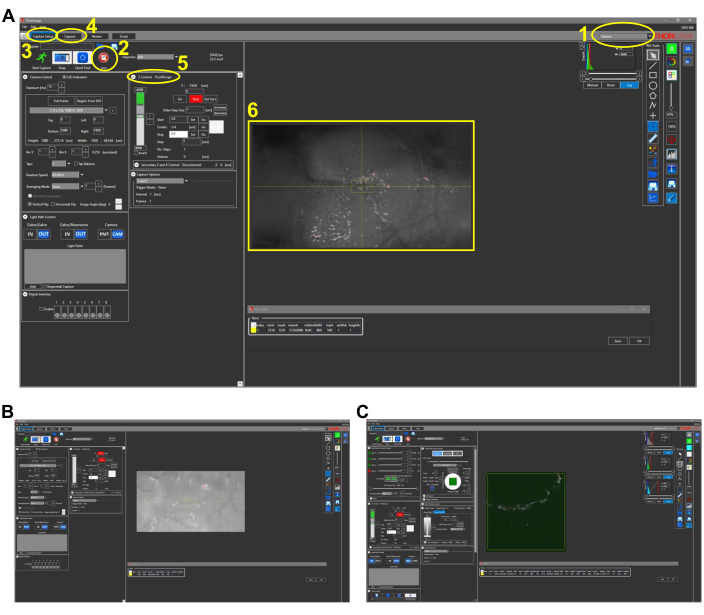
Abbildung 2: Repräsentative Screenshots für die intravitale Bildgebung bei Fischen (Protokollabschnitt 4.1). (A) Kameramodusansicht der Bildaufnahmesoftware mit 4-fachem Objektiv an Ort und Stelle. Die wichtigsten Funktionen der Software sind wie folgt beschrieben und nummeriert: 1. Bildgebungsmodus der Bildaufnahmesoftware. Die Modusoptionen sind Kamera, Multiphoton und Multiphoton GG. Für die Weißlichtbebilderung mit CCD-Kamera wird der Kameramodus gewählt. 2. Wenn Sie auf die Live-Schaltfläche klicken, wird die Kamera eingeschaltet (oder PMTs, wenn sie sich in Multiphotonen-Optionen befinden), und eine Echtzeitansicht des Mikroskops kann beobachtet werden. 3. Auf der Registerkarte Capture Setup werden die gewünschten Bildgebungsparameter (Leistung, Position, Tiefe) eingestellt. 4. Auf der Registerkarte Aufnahme wird ein Ordnerspeicherort für die zu speichernden Bilder zugewiesen. Die Bildgebung kann in diesem Tab gestartet werden. 5. Die Z-Control-Einstellung steuert die Bildtiefe durch Bewegen des Z-Stage-Motors. 6. Repräsentatives Bild eines Zebrafischkopfes. Die rostrale Seite des Kopfes befindet sich auf der linken Seite. (B) Repräsentative Ansicht des Kameramodus mit 25-fachem Objektiv. (C) Repräsentative Ansicht des Multiphotonen-GG-Modus, die das THG-Bild des in (B) gezeigten Bildes enthält. Abkürzungen: CCD = charge-coupled device; PMT = Photomultiplierröhre; THG = dritte harmonische Generation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
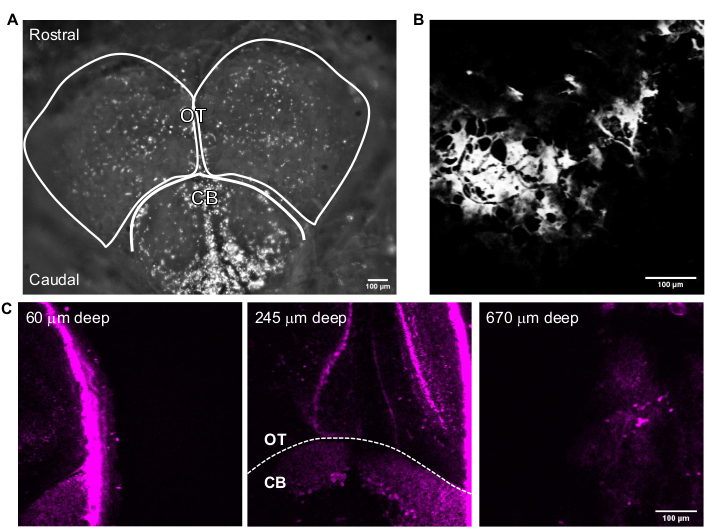
Abbildung 3: Repräsentative Bilder des erwachsenen Zebrafischgehirns, die mit der Bildaufnahmesoftware aufgenommen wurden . (A) Kameramodus-Bild des erwachsenen Zebrafischkopfes, aufgenommen mit einem 4-fachen Objektiv. Der obere Teil des Bildes ist die Rostralrichtung. Die OT-Lappen und CB sind umrissen. (B) Repräsentatives Bild, aufgenommen im Multiphotonen-GG-Modus mit einem 25-fachen Objektiv, das das THG-Bild von (A) enthält. (C) Fluoreszenzbilder des erwachsenen Zebrafischgehirns am Schnittpunkt des Kleinhirns und des optischen Tektums, wo GFP im Zytoplasma von Neuronen in verschiedenen Tiefen exprimiert wird. Maßstabsstäbe = 100 μm. Abkürzungen: OT = optic tectam; CB = Kleinhirn; THG = dritte harmonische Generation; GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
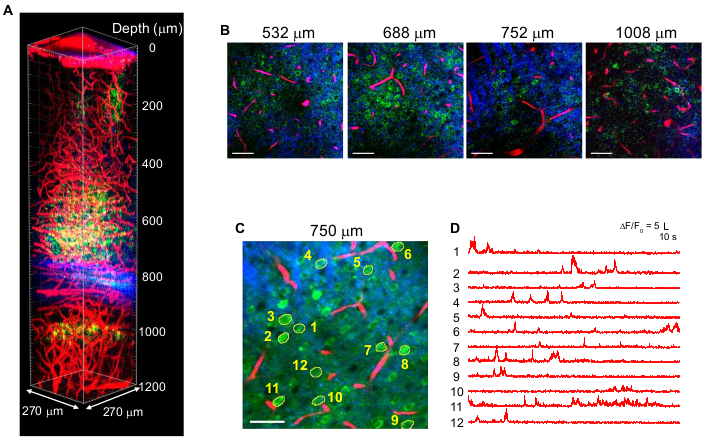
Abbildung 4: Mehrfarbige 3PM von GCaMP6s-markierten Neuronen (grün), Texas Red-markierte Blutgefäße (rot) und dritte harmonische Generation (blau) bei 1.340 nm Anregung im Mäusegehirn. (A) Z-Stack-Bilder bis zu 1.200 μm von der Gehirnoberfläche mit einem Sichtfeld von 270 x 270 μm (512 x 512 Pixel pro Bild). Die Laserleistung wurde je nach Abbildungstiefe variiert, um ~ 1,5 nJ Pulsenergie im Fokus zu halten. Die maximale durchschnittliche Leistung unter dem Ziel betrug 70 mW. (B) Ausgewählte 2D-Bilder in verschiedenen Bildtiefen. (C) Aktivitätsaufzeichnungsstelle in 750 μm unter der Dura mit einem Sichtfeld von 270 x 270 μm (256 x 256 Pixel). (D) Spontane Spuren der Gehirnaktivität, die bei einer wachen Maus von den in (C) angegebenen markierten Neuronen aufgezeichnet wurden. Die Bildrate betrug 8,3 Hz bei einer Pixelverweilzeit von 0,51 μs. Die Laserwiederholrate betrug 2 MHz und die durchschnittliche Leistung unter der Objektivlinse betrug 56 mW. Jede Spur wurde auf ihre Baseline normalisiert und mit einem Hamming-Fenster von 0,72 s Zeitkonstante im Tiefpass gefiltert. Maßstabsstäbe = 50 μm. Diese Figur und die Figurenlegende sind von 10 abgebildet. Abkürzung: 3PM = Drei-Photonen-Mikroskopie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
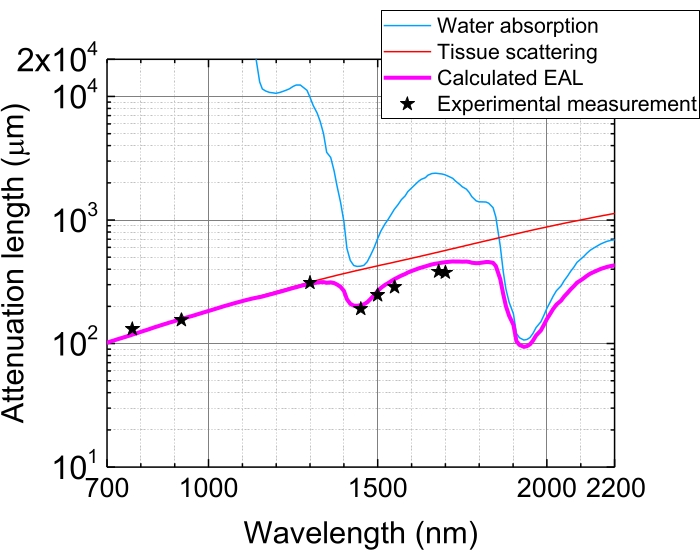
Abbildung 5: Effektive Dämpfungslänge im Neokortex des Mausgehirns. EAL (Magenta-Linie) wird aus der Gewebestreuung (rote Linie) und der Wasseraufnahme im Gewebe (blaue Linie) berechnet, wobei eine Wasserzusammensetzung von 75% angenommen wird. Die schwarzen Sterne zeigen berichtete experimentelle Daten von EAL im Neokortex des Mausgehirns 3,21,28,29. Beachten Sie, dass EAL in verschiedenen Geweben variiert. Abkürzung: EAL = effektive Dämpfungslänge. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Anregungswellenlänge (nm) | Tauchwasser | Maximale Laserleistung (mW) | Maximale Pulsenergie im Fokus* (nJ) | Typische EAL im Mauskortex (μm) | Abbildungstiefe im Mauskortex** (mm) | Pulsenergie unter dem Ziel*** (nJ) | Maximale Laserwiederholrate**** (MHz) |
| 1300 | H2O oder D2O |
 100 100 |
 2 2 | ~300 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210 | ~0,5 | |||||
| 2.1 | ~1100 | ~0,1 | |||||
| 1700 | D2O |
 50 50 |
 3 3 | ~400 Einwohner | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2,5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~190 | ~0,3 |
Tabelle 1: Typische 3-P-Anregungsbedingungen für die Kortexbildgebung der Maus.
* Mit einem hohen NA (~ 1,0) Objektiv, einer Pulsbreite von ~ 50 fs und typischen Fluorophoren wie fluoreszierenden Proteinen (z. B. GFP und RFP).
** Unter der Annahme, dass die EAL im gesamten Kortex einheitlich ist.
Um ~ 1 nJ / Puls im Fokus zu erreichen, berechnet aus dem EAL und der Abbildungstiefe.
Berechnet aus der Pulsenergie unter dem Objektiv und der maximalen permissiven Laserleistung.
Abkürzungen: 3P = Drei-Photonen; NA = numerische Apertur; GFP = grün fluoreszierendes Protein; RFP = rot fluoreszierendes Protein; EAL = effektive Dämpfungslänge.
Diskussion
Dieses Protokoll erklärt Schritt-für-Schritt-Verfahren zum Einrichten der 3P-Bildgebung mit einem kommerziellen Mikroskop und einer Laserquelle. Im Vergleich zu 2PM hat 3PM einen Vorteil bei Anwendungen, die einen optischen Zugang in den tieferen Regionen erfordern, wie z.B. im Hippocampus des Mausgehirns. Obwohl 3PM hauptsächlich in den Neurowissenschaften verwendet wird, kann 3PM möglicherweise in anderen Geweben wie Lymphknoten, Knochen und Tumoren zur Tiefengewebsbeobachtung angewendet werden.
Es ist wichtig zu überprüfen, ob das Bildgebungssystem nahe an der Schussrauschgrenze arbeitet, wodurch sichergestellt wird, dass die Erkennungs- und Datenerfassungselektronik nach den PMTs ein vernachlässigbares Rauschen zum Bild beiträgt. Die Unsicherheit in der Anzahl der detektierten Photonen wird durch Photonenschussrauschen grundlegend begrenzt. Eine begrenzte Leistung bei Schussrauschen kann in einem typischen Multiphotonenmikroskop mit einem Photodetektor mit hoher Verstärkung (z. B. einem PMT) erreicht werden. Das Photonenschussrauschen folgt einer statistischen Poisson-Verteilung, wobei die Standardabweichung der Verteilung gleich der Quadratwurzel des Mittelwerts der Verteilung ist. Führen Sie Schritt 1.14 im Protokollabschnitt aus, um die eingeschränkte Leistung des Aufnahmerauschens zu überprüfen.
Um eine Lichtdämpfung durch H2O zu vermeiden, ist die Verwendung vonD2Ozum Eintauchen hilfreich, insbesondere bei einer Anregung von ~1.700 nm. WennD2Overwendet wird, ist es wichtig, D 2 O alle ~ 10 Minuten zu aktualisieren oder ein großes Volumen von D 2 O zu verwenden, um einen Austausch von D2 O / H2O während der Bildgebung zu vermeiden. Man kann die D2O auch aus der Raumumgebung3 abdichten. Wenn für die Bildgebung ein Objektiv mit langem Arbeitsabstand (WD) (z. B. WD bei 4 mm oder länger) verwendet wird, kann die Dicke der Tauchflüssigkeit 2-3 mm überschreiten. Die erhöhte Dicke macht die H2O-Absorption auch bei ~1.300 nm21 nicht zu vernachlässigen. Daher kann D2O auch für 1.300 nm 3PM erforderlich sein, wenn ein langes WD-Objektiv verwendet wird.
Da die 3P-Fluoreszenzintensität vom Würfel der Anregungspulsenergie am Fokus abhängt (Gl. (1)), ist die Einstellung der entsprechenden Laserleistung besonders wichtig, um ausreichende 3P-Fluoreszenzsignale zu erhalten und gleichzeitig thermische und nichtlineare Schäden in lebendem Gewebe zu vermeiden. Die durchschnittliche Laserleistung sollte unter der thermischen Schadensschwelle gehalten werden. Im Gehirn der Maus zum Beispiel, um thermische Gewebeschäden zu vermeiden, sollte die durchschnittliche Leistung auf der Gehirnoberfläche der Maus bei oder unter ~ 100 mW für ~ 1.300 nm Anregung in einer Tiefe von 1 mm und mit einem Sichtfeld (FOV) von 230 μm x230 μm 21 gehalten werden. Ebenso sollte die durchschnittliche Leistung bei ~1.700 nm bei oder unter ~50 mW in ~1 mm Tiefe und einem FOV von ~230 μm x 230 μm gehalten werden (unveröffentlichte Daten). Um eine Anregungssättigung und mögliche nichtlineare Schäden zu vermeiden, sollte die Anregungsimpulsenergie bei ~ 1.300 nm bzw.~ 1.700 nm Anregung bei  ~
~  1.300 nm gehalten werden.
1.300 nm gehalten werden.
Aufgrund der Lichtabsorption und -streuung in Geweben wird die Pulsenergie im Fokus nach dem Eindringen von Geweben durch 1 EAL auf 1/e (~ 37%) abgeschwächt. Die EAL variiert in verschiedenen Geweben und mit den Anregungswellenlängen, z.B. im Neokortex des Mausgehirns, beträgt die EAL ~300 μm und ~400 μm bei ~1.300 nm bzw. ~1.700 nm bzw. 3,29 (Abbildung 5). Um also die gleiche Pulsenergie im Fokus (z. B. 1 nJ / Puls) in einer Tiefe von n EALs zu halten, muss die Oberflächenpulsenergie mit 1 nJ × en multipliziert werden. Für eine schnelle Abbildung der Struktur- und Funktionsdynamik ist ein Anregungslaser mit einer hohen Wiederholrate (bei 1 MHz oder höher) wünschenswert, um eine hohe Bildratevon 5,6,7,10 zu erreichen. Der Pulsenergiebedarf und die durchschnittliche Laserleistungsgrenze schränken jedoch die anwendbare Wiederholrate ein.
Wenn wir beispielsweise einen mäßig tiefen Bereich bei 4 EALs (dh ~ 1,2 mm im Mauskortex mit 1.300 nm Anregung) abbilden, sind ~ 55 nJ / Puls an der Oberfläche erforderlich, um 1 nJ / Puls im Fokus zu halten. Wenn die durchschnittliche Leistungsbegrenzung 100 mW beträgt, können wir eine Laserwiederholrate von ~ 2 MHz anwenden. Um jedoch tiefer in einer Tiefe von 7 EALs zu fotografieren, sind ~ 1.100 nJ / Puls an der Oberfläche erforderlich, um 1 nJ / Puls im Fokus zu halten. Unter der Annahme, dass die maximale durchschnittliche Leistung 100 mW beträgt, um thermische Schäden zu vermeiden, sollte die Laserwiederholrate auf 0,1 MHz reduziert werden, um einen Puls von 1.100 nJ / Puls an der Oberfläche zu erreichen. Tabelle 1 fasst typische Bildgebungsbedingungen in der Hirnrinde der Maus zusammen. Beachten Sie, dass bei den Abbildungstiefen in Tabelle 1 davon ausgegangen wird, dass die EAL im gesamten Mauskortex einheitlich ist.
Darüber hinaus besteht aufgrund der Laserleistungsbegrenzung im Tiefengewebe 3PM ein Kompromiss zwischen der Bildrate und der Bildpixelgröße, der besonders für die funktionelle Bildgebung wie die Kalziumbildgebung wichtig ist. Die maximal verfügbare Laserwiederholrate wird in jeder Tiefe basierend auf der erforderlichen Pulsenergie im Fokus und der anwendbaren durchschnittlichen Laserleistung, wie oben diskutiert, festgelegt, z. B. 2 MHz in einer Tiefe, die ~ 4 EALs mit 1.300 nm Anregung entspricht. Im Allgemeinen erfordert die Bildgebung mindestens einen Impuls pro Pixel. Dementsprechend wird die minimal verfügbare Pixelverweilzeit durch die Laserwiederholrate bestimmt, z.B. 0,5 μs/Pixel bei 2 MHz Anregung.
Um die hohe räumliche Auflösung (~1 μm in lateral) in 3P-Bildern beizubehalten, ist es ideal, 1 Pixel auf eine Fläche von ~1 μm 2 einzustellen, z.B. 256 x 256 Pixel für ein FOV von 250 x 250 μm2. Um eine schnelle Bildgebung mit einem beträchtlich großen Sichtfeld (z. B. 250 x 250 μm 2 mit 256 x256 Pixeln), 0,5 MHz, 1 MHz und 2 MHz Pulswiederholraten durchzuführen, ergeben sich theoretische maximale Bildraten von ~ 7,6, ~ 15 bzw. ~ 30 Bildern / s. Ebenso ist die Optimierung der Laserwiederholrate in Abhängigkeit von der Zieltiefe, der Scangeschwindigkeit und dem FOV unerlässlich, um eine ausreichende Pulsenergie unterhalb der thermischen Schadensschwelle anzuwenden. Um die Bildgebungsgeschwindigkeit zu erhöhen, kann eine adaptive Erregungsquelle verwendet werden, um alle Erregungsimpulse auf die Neuronen (d.h. Regionen von Interesse) zu konzentrieren, indem Laserpulse bei Bedarf an die Neuronenabgegeben werden 31.
3PM ist vorteilhaft im Vergleich zu 2PM in der Tiefenbildgebung innerhalb lebender Gewebe und durch stark streuende Medien wie einen Schädel, Knochen und die weiße Substanzschicht (dh die äußere Kapsel) des Mausgehirns. Die längere EAL und die nichtlineare Anregung höherer Ordnung von 3PE kommen der Tiefengewebebildgebung zugute. Um beispielsweise GCaMP6 im Mauskortex abzubilden, ist das 2P-Fluoreszenzsignal mit einer Anregung von 920 nm höher als das 3P-Fluoreszenzsignal mit einer Anregung von 1.300 nm in flachen Regionen bei  690 μm (dh ~ 2,3 EALs bei 1.300 nm)21. Aufgrund der längeren EAL bei 1.300 nm im Vergleich zu 920 nm ergibt 3PE jedoch eine stärkere Fluoreszenz als die 2P-Anregung (2PE) in einer Tiefe von ~690 μm und tiefer 21. Diese Tiefe ist definiert als "Signalübergangstiefe", bei der die Fluoreszenzsignalstärken von 2PE und 3PE mit der gleichen Wiederholrate und den gleichen maximal zulässigen Durchschnittsleistungenidentisch sind 21. Die Signalübergangstiefe hängt von den Anregungswellenlängen für 2PE und 3PE und dem Fluorophor ab.
690 μm (dh ~ 2,3 EALs bei 1.300 nm)21. Aufgrund der längeren EAL bei 1.300 nm im Vergleich zu 920 nm ergibt 3PE jedoch eine stärkere Fluoreszenz als die 2P-Anregung (2PE) in einer Tiefe von ~690 μm und tiefer 21. Diese Tiefe ist definiert als "Signalübergangstiefe", bei der die Fluoreszenzsignalstärken von 2PE und 3PE mit der gleichen Wiederholrate und den gleichen maximal zulässigen Durchschnittsleistungenidentisch sind 21. Die Signalübergangstiefe hängt von den Anregungswellenlängen für 2PE und 3PE und dem Fluorophor ab.
In der Praxis ermöglicht die Anregung von 920 nm aufgrund der geringeren Wasseraufnahme eine höhere durchschnittliche Laserleistung als die Anregung von 1.300 nm. Die höhere durchschnittliche Leistung von 2PE würde die Signalübergangstiefe jedoch nur um 0,9 EALs4 erhöhen. Wenn die Probe dicht markiert ist, hat 3PE außerdem den zusätzlichen Vorteil einer viel höheren SBR. Daher kann 3PM bereits vor Erreichen der Signalübergangslänge besser für die Bildgebung sein als 2PM. Bei der Abbildung des Gehirngefäßsystems der Maus, das einen Volumenanteil (d. h. eine Markierungsdichte) von ~ 2% aufweist, übertrifft beispielsweise 1.300 nm 3PM mit 100 mW Erregungsleistung 920 nm 2PM mit 200 mW Anregungsleistung in einer Tiefe von ~ 700 μm für Fluorescein.
3PM hat auch einen Vorteil bei der Abbildung durch eine dünne, aber stark streuende Schicht, die die Punktspreizungsfunktion des Anregungsstrahls verzerren und einen Defokussierungshintergrund erzeugenkann 4. Zum Beispiel leiden 2PM-Bilder durch den intakten Schädel des Mausgehirns selbst in der geringen Tiefe von <100 μm von der Gehirnoberfläche 13 unter dem Defokussierungshintergrund. Ein ähnlicher Defokushintergrund wurde in 2PM mit 1.280 nm Anregung durch die weiße Substanz im Gehirn der Mausbeobachtet 32. Wenn Gewebe durch trüben Schichten abgebildet werden, ist daher 3PM für kontrastreiche Bildgebung unabhängig von der Markierungsdichte besser als 2PM.
Wir berichteten kürzlich über ein Perlenphantom und eine theoretische Analyse, die zeigt, dass die Bildtiefengrenze von 3PM über 8 EALs33 liegt; 8 EALs entsprechen ~3 mm mit ~1.700 nm Anregung im Mauskortex. Der derzeit verfügbare Laser hat jedoch nicht genug Pulsenergie, um 8 EALs im Gehirn der Maus zu erreichen. Die Weiterentwicklung stärkerer Laser wird die derzeitige Abbildungstiefengrenze von 3PM verschieben.
Offenlegungen
Die Autoren erklären keine konkurrierenden Interessen.
Danksagungen
Diese Arbeit wurde von NSF DBI-1707312 Cornell NeuroNex Hub und NIH 1U01NS103516 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
Referenzen
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten