Method Article
Microscopia de fluorescência de três fótons profundos em rato intacto e cérebro de zebrafish
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A microscopia de três fótons permite imagens de fluorescência de alto contraste profundamente em tecidos biológicos vivos, como cérebros de camundongos e zebrafish, com alta resolução espacial.
Resumo
As técnicas de microscopia multifotúr, como microscopia de dois fótons (2PM) e microscopia de três fótons (3PM), são ferramentas poderosas para imagens in vivo de tecido profundo com resolução subcelular. 3PM tem duas grandes vantagens para a imagem de tecido profundo acima de 2PM que tem sido amplamente utilizado em laboratórios de biologia: (i) maior comprimento de atenuação em tecidos de dispersão, empregando ~1.300 nm ou ~1.700 nm laser de excitação; (ii) menor geração de fluorescência de fundo devido à excitação não linear de alta ordem. Como resultado, o 3PM permite imagens estruturais e funcionais de alto contraste profundamente dentro de tecidos de dispersão, como cérebro de rato intacto das camadas corticais para o hipocampo e todo o cérebro de zebrafish adulto.
Hoje, fontes de laser adequadas para 3PM estão disponíveis comercialmente, permitindo a conversão de um sistema de imagem de dois fótons (2P) existente para um sistema de três fótons (3P). Além disso, vários microscópios comerciais 3P estão disponíveis, o que torna essa técnica prontamente disponível para laboratórios de pesquisa em biologia. Este artigo mostra a otimização de uma configuração típica de 3PM, particularmente visando grupos de biologia que já possuem uma configuração 2P, e demonstra imagens 3D intravital em cérebros de camundongos intactos e zebrafish adultos. Este protocolo abrange o procedimento experimental completo de imagens 3P, incluindo alinhamento de microscópio, pré-chir de ~1.300 e ~1.700 nm de pulsos laser, preparação animal e imagens de fluorescência intravital 3P profundas em zebrafish adultos e cérebros de camundongos.
Introdução
Na ciência da vida, técnicas de microscopia multifotual (MPM), como 14h e 15h, têm sido ferramentas poderosas para imagens profundas in vivo com alta resolução espacial e alto contraste em tecidos de dispersão. Além disso, esses métodos causam menos fotobleaching quando comparados à microscopia confocal de um fóton 1,2,3,4. 3PM é vantajoso para imagens de tecido mais profundo quando comparado com 2PM devido a duas características principais: (i) o emprego de excitação de comprimento de onda mais longo (~1.300 nm ou ~1.700 nm) reduz a dispersão tecidual, e (ii) o processo de excitação de ordem superior (ou seja, o sinal de fluorescência depende do cubo do poder de excitação em 3PM em vez do quadrado do poder de excitação em 2PM) que suprime a fluorescência de fundo indesejada3 . Consequentemente, o 3PM permite imagens de alto contraste em regiões mais profundas em tecidos vivos, como o hipocampo em um cérebro de camundongo adulto intacto 3,5,6,7,8,9,10,11 e todo o cérebro de zebrafish adulto12, incluindo Ca2+ registro de atividades e observações multicoloridas. Além disso, imagens de alto contraste foram obtidas com 3PM através dos crânios intactos de camundongos e zebrafishadultos 12,13.
Hoje, fontes de laser de excitação adequadas para excitação 3P (3PE) a ~1.300 e ~1.700 nm estão disponíveis comercialmente. Como o sistema de varredura a laser é essencialmente o mesmo para 14:00 e 15:00, a conversão de uma configuração 2P existente em uma configuração 3P é possível em laboratórios de biologia com a instalação de um laser comercialmente disponível para 3PE. O sinal de fluorescência 3P depende da potência do laser, duração do pulso, taxa de repetição do laser e abertura numérica (NA) da lente objetiva. Assumindo um foco limitado de difração (ou seja, a abertura traseira da lente objetiva é superabastecida pelo feixe de excitação), Eq (1) descreve o fluxo de fótons de fluorescência mediana do volume focal resultante do 3PE.
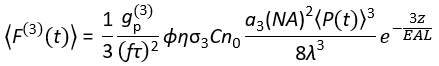 (1)
(1)
Quando f é a taxa de repetição do laser, τ é a duração do pulso do laser (largura total à metade do máximo), φ é a eficiência de coleta do sistema, η é a eficiência quântica da fluorescência, σ3 é a seção transversal de absorção 3P, C é a concentração fluorhoreop, n0 é o índice reflexivo do meio amostral (por exemplo, água), λ é a onda de excitação no vácuo, Na é a abertura numérica da lente objetiva, um3 é a constante de integração espacial do volume focal, 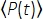 é o fluxo de fóton de excitação (fótons/s) com média de tempo sob a lente objetiva, z é a profundidade imagem, e EAL é o comprimento de atenuação eficaz14. Aqui assumimos que o EAL (tipicamente > 100 μm) é muito maior do que a resolução axial do microscópio (tipicamente < 10 μm). Sob aproximação paraxial, um3 é igual a 28.114. g(3) é a coerência temporal de3ª ordem da fonte de excitação, e gp(3) é 0,41 e 0,51 para pulsos hiperbólicos-secant-quadrados e pulsos gaussianos, respectivamente. A eficiência da coleta φ pode ser estimada considerando a coleta de fluorescência pela lente objetiva, transmissão da lente objetiva, a refletividade do espelhodicróico, a transmissão dos filtros e a eficiência de detecção do detector (por exemplo, tubo fotomultiplier ou PMT). Como a intensidade de fluorescência 3P é altamente dependente de vários parâmetros, a otimização da configuração 3P é necessária para maximizar os sinais de fluorescência 3P.
é o fluxo de fóton de excitação (fótons/s) com média de tempo sob a lente objetiva, z é a profundidade imagem, e EAL é o comprimento de atenuação eficaz14. Aqui assumimos que o EAL (tipicamente > 100 μm) é muito maior do que a resolução axial do microscópio (tipicamente < 10 μm). Sob aproximação paraxial, um3 é igual a 28.114. g(3) é a coerência temporal de3ª ordem da fonte de excitação, e gp(3) é 0,41 e 0,51 para pulsos hiperbólicos-secant-quadrados e pulsos gaussianos, respectivamente. A eficiência da coleta φ pode ser estimada considerando a coleta de fluorescência pela lente objetiva, transmissão da lente objetiva, a refletividade do espelhodicróico, a transmissão dos filtros e a eficiência de detecção do detector (por exemplo, tubo fotomultiplier ou PMT). Como a intensidade de fluorescência 3P é altamente dependente de vários parâmetros, a otimização da configuração 3P é necessária para maximizar os sinais de fluorescência 3P.
Este protocolo ilustra o processo de otimização de uma configuração típica de 3P, que será útil especialmente para laboratórios de biologia que têm uma configuração 2P e planejam expandir sua capacidade para imagens 3P ou manter sua configuração comercial 3P em ótimo desempenho. Este artigo de vídeo também demonstra imagens 3P de tecido profundo em cérebros animais vivos. A primeira seção aborda a otimização de uma configuração típica de 3P com uma fonte laser comercialmente disponível e microscópio multifotônio. A segunda e terceira seções descrevem a preparação de zebrafish e camundongos, respectivamente, para 3PM de estruturas e atividades neuronais. A cirurgia de craniotomia do camundongo foi previamente relatada em documentos de protocolo, bem como 15,16,17. A quarta seção demonstra imagens intravital 3P em zebrafish e cérebros de camundongos.
Protocolo
Todos os procedimentos de experimentação e habitação animal para zebrafish e camundongos foram aprovados e conduzidos de acordo com a orientação do Comitê Institucional de Cuidados e Uso de Animais da Universidade de Cornell (IACUC). Zebrafish e camundongos foram eutanizados por solução de tricaina de alta concentração e asfixia por dióxido de carbono, respectivamente, após o experimento.
1. Otimização da configuração de microscopia de três fótons
NOTA: Use óculos de segurança laser para proteção ocular. Bloqueie o raio laser com um bloqueador de feixe quando a óptica for colocada ou movida. Para visualizar o laser, use um visualizador infravermelho ou um detector infravermelho.
- Ligue o laser e coloque o comprimento de onda central da saída ocética do amplificador óptico não collinear (NOPA) a ~1.300 nm ou ~1.700 nm.
- Coloque um vidro de cobertura fino na linha de luz da porta de sinal do NOPA (ou seja, ~700-900 nm) para refletir uma pequena fração do raio laser para um fotodiodo Si para obter sinais de acionamento (Figura 1). Coloque um bloqueador de feixe no caminho de transmissão do vidro de cobertura.
- Coloque compressores de pulso no caminho da luz para pré-chirp o laser femtosegundo para otimizar a duração do pulso para 3PM. Para ~1.300 nm feixe, coloque um compressor de par de prisma18,19 (por exemplo, pares de prisma N-SF11). Para ~1.700 nm de laser, coloque uma placa Si de ~3 mm de espessura20. Coloque o ângulo entre a placa Si e o caminho laser no ângulo do Brewster (~73,9° por 1.700 nm) para maximizar a transmissão a laser. Gire a placa Si para alcançar o ângulo do Brewster minimizando o reflexo.
- Coloque espelhos de nadadeira para permitir a comutação conveniente entre as linhas de feixe de ~1.300 nm e ~1.700 nm.
- Coloque uma placa de meia onda (por exemplo, uma onda de meia-onda acrática adequada para ~1.300 e ~1.700 nm) montada em um estágio de rotação e um divisor de feixe polarizador (PBS) para controlar a intensidade do laser. Coloque um bloqueador de feixe no caminho de reflexão do PBS.
NOTA: O laser precisa passar pelo PBS perpendicularmente para alcançar uma alta taxa de extinção. A potência laser para 3PM é controlada girando a placa de meia onda. - Coloque um vidro de cobertura fino no caminho da luz após o controlador de alimentação e antes do obturador óptico para refletir uma pequena fração do raio laser para um medidor de potência. Use o medidor de potência como um "medidor de energia de referência" para calcular a potência do laser sob o objetivo durante a imagem (ver passo 1.12).
- Alinhe o caminho do laser ajustando os espelhos para propagar o feixe no sistema 3PM.
- Meça o tamanho do feixe na posição da abertura traseira do objetivo usando uma borda de faca em um estágio de tradução e um medidor de potência. Certifique-se de que o tamanho do feixe não é muito pequeno ou muito grande.
NOTA: Normalmente, o feixe subfilia ligeiramente a lente objetiva na alta para alcançar o rendimento de alta potência para imagens de tecido profundo. Por exemplo, um tamanho de feixe de ~10-13 mm (1/e2) na abertura traseira do objetivo Olympus (~15 mm de diâmetro de abertura traseira) ajuda a alcançar um NA eficaz de ~0,7-0,9. Quando o tamanho do feixe é muito pequeno, o sinal 3P torna-se fraco, e a resolução espacial piora devido ao baixo efetivo NA. Quando o tamanho do feixe é muito grande, o poder máximo disponível de excitação sob o objetivo torna-se fraco devido à perda de energia na abertura traseira do objetivo. Para a imagem de tecido profundo, os raios marginais também sofrem uma perda maior devido ao caminho mais longo no tecido. - Se o tamanho do feixe na abertura traseira do objetivo não for apropriado, coloque elementos ópticos apropriados, como lentes convexas, no caminho do raio laser para ajustar o tamanho do feixe.
NOTA: Certifique-se de que o raio laser não é maior do que os espelhos galvo para evitar perdas desnecessárias de energia. - Coloque a lente objetiva na configuração das 15h.
- Meça a duração do pulso após o objetivo usando um autocorrelador. Ajuste o compressor de pulso para obter pulsos mais curtos se a duração do pulso for muito longa (por exemplo, >70 fs). Use pulsos ~50-70 fs para 3PM e um interferômetro Michelson colocado entre o laser e o objetivo de fornecer o atraso para medições de autocorrelação.
NOTA: Um fotodiodo com uma resposta espectral adequada (por exemplo, um fotodiodo de silício para comprimento de onda superior a 1.200 nm) colocado no foco do objetivo pode convenientemente servir como um detector não linear, e a fotocorrente de dois fótons do fotodiodo pode ser usada para obter os traços de autolcorreção20. O compressor de par de prisma por ~1.300 nm pode ser ajustado de duas maneiras: (1) mudando a distância entre os dois prismas; (2) alterar os comprimentos de caminho do feixe de laser no vidro prisma movendo o prisma perpendicularmente para a linha de base do prisma. O compressor de placa Si por ~1.700 nm pode ser ajustado substituindo a placa Si por uma placa Si mais grossa ou mais fina. - Coloque um medidor de potência na saída da lente objetiva. Meça a potência laser sob o objetivo e leia o valor do medidor de potência de referência (a partir da etapa 1.6). Calcule a razão da potência sob o objetivo e no medidor de potência de referência.
NOTA: Durante a imagem, a potência real do laser sob o objetivo pode ser calculada a partir da razão de potência e do valor do medidor de energia de referência. - Retire o medidor de energia sob o objetivo.
- [Opcional] Verifique o desempenho limitado do sistema de imagem
NOTA: Para realizar esta tarefa, são necessários os seguintes elementos: 1) uma piscina de corante fluoresceína ou Texas Red (por exemplo, ~10 μM), 2) um contador de fótons e 3) um osciloscópio.- Coloque a amostra da piscina de corante sob a lente objetiva das 3PM.
- Abaixe cuidadosamente a lente objetiva na piscina de corantes até que a distância seja menor do que a distância de trabalho da lente objetiva.
- Coloque água entre a lente e o copo de cobertura da piscina de corante.
- Defina a potência de saída do microscópio para uma pequena quantidade (por exemplo, <1 mW com taxa de repetição de pulso de ~1 MHz) para localizar a superfície do pool de corantes.
- Inicie a sessão Ao Vivo do microscópio e defina o local z como zero.
- Mova lentamente o objetivo para longe da amostra para alcançar o topo da piscina de corante (conforme indicado pela terceira geração harmônica (THG) produzida pelo vidro de capa).
- Ajuste o local z para zero na posição do vidro de cobertura.
- Abaixe ligeiramente o objetivo até que um sinal claro de fluorescência seja visível no canal de fluorescência.
- Conecte a saída do PMT a um divisor BNC. Conecte as saídas do divisor ao contador de fótons e ao sistema de aquisição de imagens.
- Defina a potência laser para um valor onde a contagem de fótons por segundo é inferior a 5% da taxa de repetição do laser (por exemplo,
 50.000 fótons/s quando um laser de 1 MHz é usado).
50.000 fótons/s quando um laser de 1 MHz é usado). - Reduza o campo de visão ao mínimo possível com o software e certifique-se de que o brilho seja uniforme em toda a imagem.
- Defina a taxa de quadros para 1,0 quadro por segundo.
- Defina o período de aquisição do contador de fótons para t = número de pixels por quadro × tempo de permanência de pixels e um nível discriminatório apropriado.
- Colete a contagem de fótons e as contagens de pixels simultaneamente por um período equivalente. Para obter a contagem de pixels, colete valores médios de pixels de toda a imagem, bem como os valores médios e de desvio padrão.
- Repita o passo 1.14.14, bloqueando o laser de excitação para obter a contagem de fótons escuros e contagem de pixels.
- Pare a aquisição ao vivo do software.
- Subtrair as contagens escuras (obtidas na etapa 1.14.15) das contagens de fótons (obtidas na etapa 1.14.14) e a contagem total de pixels (obtida na etapa 1.14.14).
- Divida a contagem total de pixels subtraídas escuras pela contagem de fótons subtraídos escuros (obtido na etapa 1.14.17). Use o valor obtido como o 'fator de conversão' (ou seja, valores de pixel/fóton) de um valor de pixel para uma contagem de fótons.
- Converta a média e o desvio padrão das contagens de pixels (obtidas na etapa 1.14.14) em contagens de fótons, ou seja, dividindo-os pelo 'fator de conversão' (obtido na etapa 1.14.18). Compare a média e o desvio padrão das contagens de fótons. Certifique-se de que o desvio padrão seja aproximadamente igual à raiz quadrada da média do fóton conta se o desempenho do sistema de imagem estiver próximo do limite de ruído de tiro.
- [Opcional] Verifique a eficiência de detecção de sinal do microscópio.
- Para testar o desempenho do microscópio e a eficiência de detecção de sinal, siga as etapas 1.14.1-1.14.17 para obter contagem de fótons. Para a etapa 1.14.15, crie uma amostra em branco feita do solvente para o corante e obtenha a contagem de fótons para a amostra em branco com o laser ligado e com a mesma potência da piscina de corante. Subtraia as contagens em branco da contagem de fótons da piscina de corante para obter a contagem de fótons de fluorescência.
- Use as seções cruzadas conhecidas de 3P de fluoresceína ou Texas Red10,22 e Eq. (1) (com um NA eficaz para explicar o preenchimento da abertura traseira corretamente) para calcular as contagens de fótons esperadas e, em seguida, comparar o valor calculado com as contagens de fótons medidos experimentalmente. Registo conta ambos os fótons no caderno de laboratório como resultados de testes para o microscópio para referências futuras.
NOTA: Certifique-se de que os valores calculados e medidos estejam próximos um do outro (por exemplo, dentro de um fator de 2). Tais testes quantitativos do sistema são particularmente úteis para garantir um desempenho de imagem consistente ao longo do tempo.
2. Preparação do peixe para 15h
NOTA: Use luvas e um jaleco para este procedimento. Escolha o zebrafish adulto de acordo com o experimento. Termine toda a preparação (etapas 2.1 a 2.7) dentro de ~15 min.
- Prepare uma placa de Petri com ~0,5 cm de ágar de ponto de fusão de alta. Corte um orifício retangular no ágar mais longo e ligeiramente mais largo que o peixe. Use cera para fixar tubos finos (para perfusão de água na boca do peixe) à placa de Petri com uma extremidade no retângulo. Use cera para fixar tubos de diâmetro maior (para remoção de água) à borda da placa de Petri.
- Escolha peixe para o experimento. Anestesiar o peixe com solução de tricaine de 0,2 mg/mL (pH 7.2) na solução de Hank até que o peixe esteja completamente sem resposta e profundamente anestesiado.
- Coloque o peixe de lado em uma esponja molhada. Usando uma microsinga, injete retro-orbitalmente 3 μL de brometo de pancurônio (0,4 μg/μL na solução de Hank) para paralisar o peixe. Coloque o peixe na solução de Hank brevemente para garantir que ele esteja totalmente paralisado.
- Coloque o peixe dorsal na placa de Petri com a cabeça em direção ao tubo. Usando fórceps para manipular a tubulação, abra suavemente a boca do peixe e deslize a tubulação para dentro da boca. Deslize suavemente o peixe em direção à tubulação para que a tubulação fique na parte de trás da boca do peixe.
- Seque rapidamente, mas suavemente, o ágar ao redor do peixe e remova a água em cima do peixe. Mergulhe um pequeno pedaço de tecido de laboratório em cola de laboratório e coloque o tecido no ágar em ambos os lados do peixe e sobre as costas do peixe caudal para as brânquias.
NOTA: Não empurre o peixe ou aplique pressão. Tenha cuidado para evitar a cola nas brânquias. - Aplique uma pequena gota de bupivacaína diretamente na superfície da cabeça para anestesiar o peixe durante a imagem na região onde o laser entrará em contato com a pele.
- Leve a placa de Petri com o peixe para o microscópio e encha-a com água de peixe- instalação. Conecte a tubulação a uma bomba de água para bombear água do sistema a 2 mL/min na boca do peixe e, simultaneamente, remova a solução de perfusão do prato na mesma velocidade. Certifique-se de que a água é oxigenada com um borbulhador e aquecida a ~30 °C com um aquecedor de aquário.
NOTA: O peixe está pronto para a imagem. Monitore a saúde do peixe monitorando o fluxo sanguíneo no terceiro sinal de geração harmônica (THG) durante a imagem (ver seção 4.1). As imagens 3P também devem ser compatíveis com preparações de peixes mais sofisticadas, como as usadas em imagens 2P para fixar a cabeça e permitir movimentos do corpo durante a imagem durante a realidade virtual23. Essa imagem completamente não invasiva evita a necessidade de remoção do crânio, como é típico em outros estudos de vertebrados e é um passo para minimizar pesquisas invasivas e dor associada.
3. Preparação do rato para 3PM
NOTA: Use luvas, máscara cirúrgica e jaleco durante os seguintes procedimentos. Escolha a linha do mouse de acordo com o experimento. O rato deve ser alojado sob um ciclo claro-escuro de 12:12 h antes da cirurgia. Toda a cirurgia (etapas 3.2-3.11) é asséptica, e todas as ferramentas de cirurgia devem ser esterilizadas antes do uso. A craniotomia leva ~1 h.
- Coloque uma tampa em forma de donut (4,5-6,5 mm de diâmetro) e um disco de deslizamento de tampa (5 mm de diâmetro) em parafilm limpo. Use uma agulha para aplicar uma pequena quantidade de adesivo óptico para colar o deslizamento em forma de donut no disco de deslizamento de tampas. Cure a tampa do disco-donut no parafilm sob luz ultravioleta por 10-20 min. Remova toda a tampa do disco-donut do parafilm e use pinças para riscar o excesso de cola e 70% de etanol para remover detritos.
NOTA: As tampas têm ~0,17 mm de espessura. O deslizamento em forma de rosquinha é usado para aplicar pressão apropriada no cérebro para imagens crônicas. - Anestesiar o rato com 3% de isoflurane e 20% de mistura de gás O2 em uma câmara de indução. Pesar o rato. Coloque o mouse em uma posição propensa em uma almofada de aquecimento. Coloque a temperatura da almofada de aquecimento em ~37 °C.
- Fixar os dentes superiores no orifício bucal de um aparelho estereotaxico com a colocação de uma máscara anestésica. Conserte as barras de ouvido nas orelhas. Mantenha a anestesia com 2% de isoflurane e 20% de mistura de gás O2 durante a cirurgia.
NOTA: Ajuste a concentração de isoflurane monitorando a resposta do mouse. Verifique o nível da anestesia observando a taxa de respiração (~1 Hz para dormir fundo) e beliscando os pés para verificar se há alguma reação antes da cirurgia. - Aplique pomada ocular aos olhos para lubrificação. Feche as pálpebras. Acenda todas as luzes da cirurgia. Subcutâneamente injete cetoprofeno, dexametasona e glicocopiato com base no peso corporal do camundongo antes da cirurgia.
NOTA: As doses da droga são 2 mg/mL, 0,1 mg/mL e 0,1 mg/mL para cetoprofeno, dexametasona e glicopyrrolate, respectivamente. Os volumes de injeção para cetoprofeno, dexametasona e glicocopilato dependem do peso corporal e são de 2,5 μL/g, 2 μL/g e 2 μL/g, respectivamente. - Remova o cabelo na coroa da cabeça e perto das orelhas.
- Corte o máximo de cabelo possível com uma tesoura ou um cortador de cabelo e remova o cabelo cortado do local cirúrgico.
- Aplique uma quantidade adequada de creme depilatório. Espere por 1 min.
- Remova o cabelo e o creme usando um cotonete encharcado em soro fisiológico.
- Repita as etapas 3.5.2 e 3.5.3 até que o cabelo seja completamente removido.
- Aplique 5% de solução de povidone-iodo e, em seguida, 70% de etanol na pele para limpar a área. Repita o processo três vezes.
- Dê uma injeção subcutânea de atropina (dose à base de peso corporal, 0,02-0,05 mg/kg) na cabeça. Espere por 1 min.
- Corte a pele na coroa da cabeça para expor o crânio. Certifique-se de que o ponto de bregma e o ponto lambda estão expostos. Cole o tecido da pele restante na borda do crânio usando cola biocompatível para evitar que o pó de perfuração entre embaixo da pele (o que pode provocar uma resposta imune).
- Use um marcador cirúrgico para desenhar um círculo de 5 mm de diâmetro sobre a área de interesse. Por exemplo, escolha o centro da área ~2,5 mm lateral e 2 mm caudal para o bregma, que cobre a maior parte do córtex somatosensorial e o córtex visual.
- Perfurar ao longo do círculo lentamente e aplicar soro fisiológico para hidratar o crânio quando terminar a metade. Diminua a velocidade de perfuração para a última metade e cubra o crânio com soro fisiológico antes de remover o crânio. Abra o crânio suavemente com fórceps e aplique um pequeno pedaço de gelfoam estéril encharcado em soro fisiológico para parar imediatamente qualquer sangramento no cérebro. Mantenha o cérebro hidratado usando soro fisiológico.
- Aplique uma gota de soro fisiológico na lateral da tampa de disco preparado voltada para o tecido cerebral. Coloque a parte do disco salientes da tampa do disco-donut na janela craniana. Use uma barra longa mantida pelo aparelho estereotaxico para pressionar suavemente a parte do disco da janela craniana de deslizamento de tampas para a superfície cerebral, garantindo que a parte do donut cubra firmemente o crânio. Seque a área ao redor da tampa do disco com um cotonete.
- Aplique uma camada de cola biocompatível sob a borda em forma de donut. Aplique uma camada de mistura de cimento dental por baixo e ao redor da parte de donut da tampa do disco-donut. Aplique outra camada de cola acima do cimento dental. 5% de glicose (dose à base de peso corporal, 10 μL/g) pode ser injetada subcutâneamente a cada hora durante a cirurgia para fornecer energia animal.
- Desligue o sistema de anestesia. Solte o mouse do aparelho estereotático. Transfira o mouse para um aparelho estereotático compacto personalizado imediatamente, com uma almofada de aquecimento a ~37 °C e um aparelho de anestesia.
- Coloque o mouse em uma posição propensa na almofada de aquecimento do aparelho estereotaxico compacto personalizado. Coloque a temperatura em ~37 °C. Fixar os dentes superiores no orifício bucal do aparelho estereotático e nas barras de ouvido nas orelhas do mouse. Coloque os tubos anestésicos e mantenha a anestesia com 1,5% de isoflurane e 20% mistura de gás O2.
NOTA: O mouse está pronto para a imagem. Mantenha o mouse anestesiado durante os seguintes procedimentos de imagem. Ajuste a concentração de isoflurane monitorando a resposta do rato.
4. Imagens intravitais em cérebros de peixes e camundongos
- Imagens intravitais no cérebro de zebrafish
NOTA: Para localizar adequadamente o cérebro do peixe sob a lente objetiva, uma câmera de dispositivo acoplado por carga secundária (CCD) é usada no mesmo caminho que a luz de excitação para imagens de campo largo.- Configure o microscópio e calibrar a potência (conforme descrito na seção 1).
- Coloque um objetivo de baixa ampliação (tipicamente 4x) no microscópio.
- Coloque a placa de Petri contendo o peixe e os tubos sob o microscópio.
- Use uma fonte de luz edisse (LED) emissora de luz para iluminar a placa de Petri.
- Abra o modo Câmera do software de aquisição de imagens (Figura 2).
- Clique ao vivo.
- Escolha o canal A no lado direito da tela.
- Ajuste as configurações do histograma para ver a imagem claramente.
NOTA: Estes precisam ser atualizados conforme necessário. - Ajuste a configuração do motor no controlador do motor para base.
- Abaixe o objetivo até que o peixe seja visível.
NOTA: Certifique-se de que a lente objetiva não faça qualquer contato físico com a cabeça. - Coloque o centro da cabeça do peixe no centro do campo de visão.
- Mova o objetivo para cima e para longe da cabeça de peixe.
- Substitua a lente objetiva de baixa ampliação pela lente objetiva na alta para 3PM.
NOTA: A lente de baixa ampliação e a lente objetiva na alta não precisam ser parfocal, mas devem estar perto o suficiente para garantir que o peixe esteja dentro do campo de visão da lente objetiva na alta. - Abaixe lentamente a lente objetiva, garantindo que o objetivo não faça qualquer contato físico com a cabeça. No software da câmera CCD, pare de mover o objetivo quando a parte superior da cabeça estiver visível. Defina a localização z para 0 μm.
NOTA: Certifique-se de que não há bolhas de ar sob a lente objetiva ao usar um objetivo de imersão na água. - Desligue a fonte de luz LED e feche a cortina escura ao redor do sistema.
- Defina o software de aquisição de imagens para o modo Multiphoton GG para imagens 3P e ajuste a potência sob a lente objetiva para menos de 1 mW (com taxa de repetição de pulso de ~1 MHz).
- Altere o botão de ajuste do motor de Base para Objetivo no controlador do motor.
- Abaixe as luzes da sala.
- Ligue os PMTs e abra o obturador de 3PM. Certifique-se de que um contorno do osso apareça no canal de sinal de fluorescência devido à autofluorescência e no canal de sinal THG devido ao THG do osso (Figura 2C).
- Realize imagens em diferentes profundidades aumentando os níveis de energia quando imagens mais profundas.
- Imagem intravital no cérebro do camundongo
NOTA: Injete 5% de glicose no camundongo anestesiado a cada hora durante a imagem; a dose é baseada no peso corporal (10 μL/g).- Defina o software de aquisição de imagens para o modo Multiphoton GG para imagens 3P e ajuste a potência sob a lente objetiva para menos de 1 mW (com taxa de repetição de pulso de ~1 MHz).
NOTA: Certifique-se de que a janela da cirurgia seja colocada perpendicular à lente objetiva para reduzir a aberração. O ajuste fino é realizado inclinando o aparelho estereotaxo. - Mova a lente objetiva perto da janela e aplique água entre o objetivo e a janela craniana; definir os valores do eixo de todos os motores para zero.
NOTA: A absorção de luz em H2O a ~1.700 nm é grande, o que reduz significativamente a potência laser de ~1.700 nm após uma profundidade de ~1-2 mm de água. Para a excitação de ~1.700 nm, use D2O, que tem absorção muito menor a 1.700 nm, para imersão em água para reduzir a absorção por água. - Clique no botão Live no software de aquisição de imagens e canais PMT abertos, por exemplo, um canal de sinal de fluorescência e um canal de sinal THG. Ajuste o ganho pmt e o nível de fundo conforme necessário.
- Mova-se lentamente para cima da lente objetiva para localizar a superfície da janela monitorando o canal THG a partir dos grandes vasos sanguíneos e da superfície de vidro da janela. Ajuste a orientação da janela (veja a nota na etapa 4.2.12) se necessário. Zero os motores para definir a superfície do cérebro.
- Realize imagens e ajuste o nível de potência de acordo com a profundidade de imagem.
- Defina o software de aquisição de imagens para o modo Multiphoton GG para imagens 3P e ajuste a potência sob a lente objetiva para menos de 1 mW (com taxa de repetição de pulso de ~1 MHz).
Resultados
A conclusão bem sucedida deste protocolo resultará em um microscópio devidamente alinhado com parâmetros de luz ideais (por exemplo, duração do pulso, NA) e preparações animais apropriadas para in vivo 3PM. A configuração 3P comercialmente disponível compreende espelhos e lentes apropriados para ~1.300 nm e ~1.700 nm; portanto, nenhuma alteração na óptica é necessária quando o comprimento de onda de excitação é alternado entre 1.300 nm e 1.700 nm. Se as lentes em uma configuração 3P não tiverem um revestimento adequado para 1.300 e 1.700 nm, estas precisam ser substituídas por as apropriadas para reduzir a perda de energia a laser. Com o otimizado 3PM e a preparação adequada dos animais, imagens de fluorescência in vivo e THG com alto contraste podem ser coletadas profundamente dentro do cérebro.
A Figura 3 mostra imagens representativas 3P de zebrafish adultos intactos. Imagens de alta resolução, não invasivas e profundas de neurônios geneticamente rotulados no cérebro adulto de zebrafish são alcançadas usando 3PM. Embora a imagem na região do telencephalon tenha sido relatada no cérebro adulto de zebrafish usando2PM 24,25,26,27, o 3PM permite o acesso a toda a teleencefalia e regiões mais desafiadoras ou impossíveis de observar usando outras técnicas. A distribuição de camadas celulares no tectum óptico e no cerebelo pode ser observada na Figura 3C. Em uma sessão de imagem bem sucedida, o osso é visível no canal THG e neurônios visíveis no canal de fluorescência. Para imagens de zebrafish adultos, a característica da câmera do microscópio foi usada para localizar o peixe (Figura 3A). Este passo não é necessário para a imagem cerebral do rato, pois a janela de vidro é grande o suficiente para tornar o cérebro facilmente acessível. Imagens estruturais de alta resolução do cérebro de zebrafish adulto foram obtidas utilizando-se o sistema descrito nas seções anteriores. O crânio é visto no canal THG (Figura 3B), que ajuda a navegar pelo cérebro e encontrar a superfície superior. Como observado na Figura 3C, os neurônios são distinguíveis com uma alta relação sinal-fundo (SBR) profundamente no cérebro adulto. O tecido acima do cérebro é visível no canal de fluorescência devido à autofluorescência.
A Figura 4 mostra imagens multicoloridas 3P de neurônios rotulados por GCaMP6s (verde) e vasos sanguíneos rotulados por vermelho do Texas (vermelho) juntamente com sinais THG (azul) no cérebro de camundongo adulto com excitação de 1.340 nm10. As imagens são reproduzidas a partir de trabalhos anteriores10. Na Figura 4, a energia de pulso em foco foi mantida em ~1,5 nJ em toda a profundidade para obter fluorescência suficiente e sinais de THG, e a potência média máxima do laser foi de ~70 mW. A duração do pulso foi ajustada para ~60 fs, e o NA efetivo foi ~0,8. Com a otimização da configuração 3PM, imagens de alto contraste foram obtidas com sucesso até 1,2 mm da superfície cerebral, na região do hipocampo CA1 (Figura 4A,B). Figura 4C,D mostra traços de atividade Ca2+ de neurônios rotulados por GCaMP6s a uma profundidade de 750 μm para uma sessão de gravação de 10 minutos, mostrando alta fidelidade de gravação.
Se o laser de excitação estiver desalinhado, pode-se observar a não-uniformidade no brilho do sinal em todo o campo de visão. Além disso, se os parâmetros do laser, como a duração do pulso, a energia do pulso de excitação em foco e o NA eficaz, não forem otimizados, a imagem thg do crânio do peixe ou da janela de craniotomia do cérebro do camundongo não será visível e/ou requer alta energia de pulso de excitação (por exemplo, >2 nJ/pulso em foco). Assim, os sinais de THG na superfície cerebral podem ser usados como um indicador para uma configuração otimizada de 3PM antes de iniciar a imagem de tecido profundo.
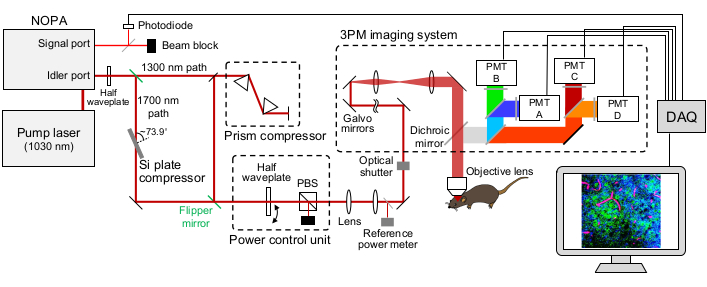
Figura 1: Ilustração esquemática de uma configuração de 3 PM. O comprimento de onda do laser de excitação é definido em ~1.300 nm ou ~1.700 nm, saída da porta ocler do NOPA. O compressor de par de prisma e o compressor de placa Si são usados para o laser de ~1.300 nm e ~1.700 nm, respectivamente, para prechirp do pulso laser de excitação. Os raios laser de ~1.300 nm e ~1.700 nm podem ser trocados com espelhos de nadadeiras. A porta de sinal do NOPA é usada para obter o sinal de acionamento. Uma placa de meia onda e um PBS são usados para controlar o poder de excitação. A fluorescência e o THG são detectados pelos PMTs GaAsP. Combinações apropriadas de espelhosdicróicos e filtros de bandpass são usadas para separar a fluorescência e os sinais de THG. Abreviaturas: 3PM = microscopia de três fótons; NOPA = amplificador óptico não collinear paramétrico; PBS = divisor de feixe polarizador; THG = terceira geração harmônica; DAQ = aquisição de dados; PMT = tubo fotomultiplier. Clique aqui para ver uma versão maior desta figura.
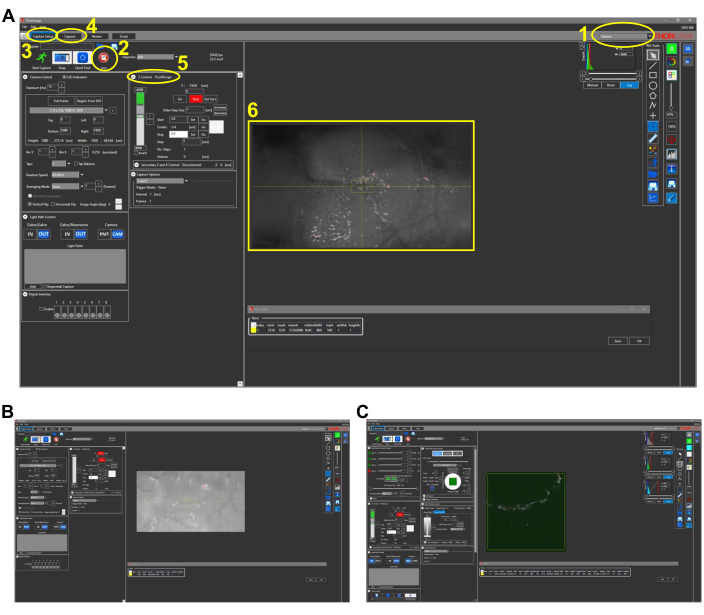
Figura 2: Capturas de tela representativas para imagens intravitais em peixes (seção de protocolo 4.1). (A) Visão do modo de câmera do software de aquisição de imagens com lente objetiva 4x no lugar. As principais características do software são delineadas e numeradas da seguinte forma: 1. Modo de imagem do software de aquisição de imagens. As opções de modo são Camera, Multiphoton e Multiphoton GG. Para imagens de luz branca com câmera CCD, o modo Câmera é escolhido. 2. Clicar no botão Live liga a câmera (ou PMTs se em opções multifotonsas) e uma visão em tempo real do microscópio pode ser observada. 3. Na guia Capture Setup , os parâmetros de imagem desejados (potência, localização, profundidade) são definidos. 4. Na guia Capturar , um local de pasta é atribuído para que as imagens sejam salvas. A imagem pode ser iniciada nesta aba. A configuração Z Control controla a profundidade da imagem movendo o motor do estágio Z. 6. Imagem representativa de uma cabeça de zebrafish. O lado rostral da cabeça está à esquerda. (B) Visão representativa do modo câmera com lente objetiva de 25x. (C) Visão representativa do modo Multiphoton GG contendo a imagem THG da imagem vista em (B). Abreviaturas: CCD = dispositivo acoplado a carga; PMT = tubo fotomultiplier; THG = terceira geração harmônica. Clique aqui para ver uma versão maior desta figura.
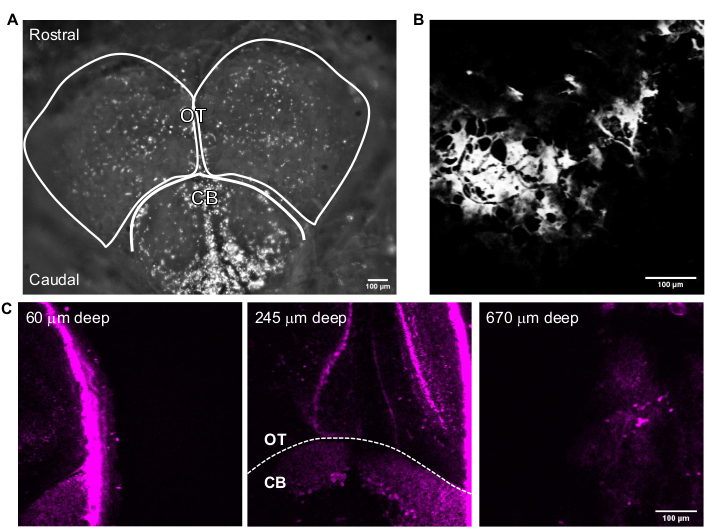
Figura 3: Imagens representativas do cérebro de zebrafish adulto adquirido com o software de aquisição de imagens. (A) Imagem do modo câmera da cabeça de zebrafish adulto adquirida com uma lente objetiva de 4x. O topo da imagem é a direção rostral. Os lóbulos OT e CB estão descritos. (B) Imagem representativa adquirida no modo Multiphoton GG com uma lente objetiva de 25x contendo a imagem THG de (A). (C) Imagens de fluorescência do cérebro de zebrafish adulto na intersecção do cerebelo e do tectum óptico onde o GFP é expresso em citoplasma de neurônios em várias profundidades. Barras de escala = 100 μm. Abreviaturas: OT = tectam óptico; CB = cerebelo; THG = terceira geração harmônica; GFP = proteína fluorescente verde. Clique aqui para ver uma versão maior desta figura.
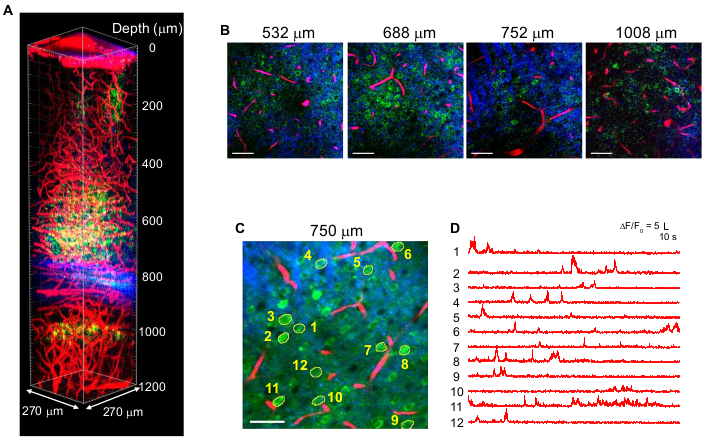
Figura 4: Multicolor 3PM deneurônios rotulados GCaMP 6 (verde), vasos sanguíneos rotulados por vermelho texas (vermelho) e terceira geração harmônica (azul) sobre excitação de 1.340 nm no cérebro do camundongo. (A) Imagens de pilha de Z até 1.200 μm da superfície cerebral com um campo de visão de 270 x 270 μm (512 x 512 pixels por quadro). A potência do laser foi variada de acordo com a profundidade de imagem para manter ~1,5 nJ de energia de pulso no foco. A potência média máxima sob o objetivo foi de 70 mW. (B) Imagens 2D selecionadas em várias profundidades de imagem. (C) Local de gravação de atividade a 750 μm abaixo da dura dura com um campo de visão de 270 x 270 μm (256 x 256 pixels). (D) Traços de atividade cerebral espontânea registrados em um camundongo acordado a partir dos neurônios rotulados indicados em (C). A taxa de quadros foi de 8,3 Hz, com um tempo de 0,51 μs de pixel. A taxa de repetição do laser foi de 2 MHz, e a potência média sob a lente objetiva foi de 56 mW. Cada traço foi normalizado até sua linha de base e filtrado por baixo passe usando uma janela de 0,72 s tempo constante. Barras de escala = 50 μm. Esta figura e a lenda da figura são reproduzidas a partir de 10. Abreviação: 3PM = microscopia de três fótons. Clique aqui para ver uma versão maior desta figura.
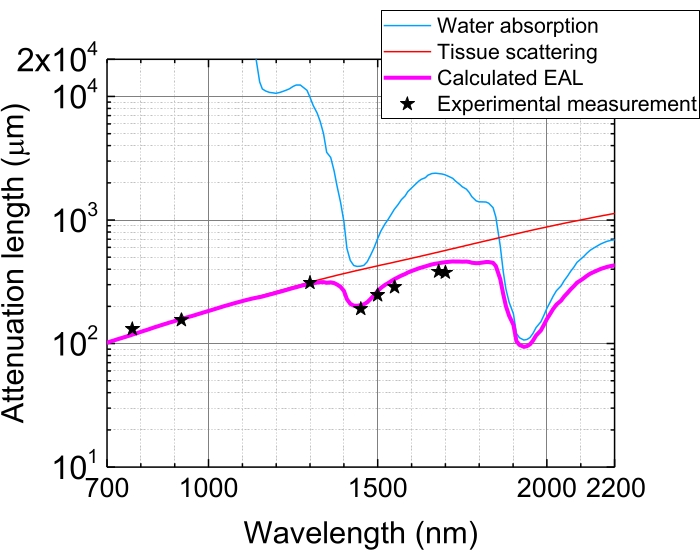
Figura 5: Comprimento de atenuação eficaz no neocórtex do cérebro do camundongo. O EAL (linha magenta) é calculado a partir da dispersão tecidual (linha vermelha) e da absorção de água no tecido (linha azul), assumindo 75% de composição de água. As estrelas negras indicam dados experimentais relatados de EAL no neocórtex do cérebro do camundongo 3,21,28,29. Observe que o EAL varia em diferentes tecidos. Abreviação: EAL = comprimento de atenuação eficaz. Clique aqui para ver uma versão maior desta figura.
| Comprimento de onda de excitação (nm) | Água de imersão | Potência máxima do laser (mW) | Energia máxima de pulso em foco* (nJ) | EAL típico no córtex do mouse (μm) | Profundidade de imagem no córtex do rato** (mm) | Energia de pulso sob o objetivo*** (nJ) | Taxa máxima de repetição de laser**** (MHz) |
| 1300 | H2O ou D2O |
 100 100 |
 2 2 | ~300 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210 | ~0,5 | |||||
| 2.1 | ~1100 | ~0.1 | |||||
| 1700 | D2O |
 50 50 |
 3 3 | ~400 | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2.5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~190 | ~0,3 |
Tabela 1: Condições típicas de excitação 3P para imagens do córtex do rato.
*Com um objetivo de NA (~1.0) alto, largura de pulso de ~50 fs, e fluoroforos típicos, como proteínas fluorescentes (por exemplo, GFP e RFP).
** Com a suposição de que o EAL é uniforme em todo o córtex.
Para alcançar ~1 nJ/pulso em foco, calculado a partir do EAL e da profundidade de imagem.
Calculado a partir da energia de pulso sob o objetivo e a potência laser permissiva máxima.
Abreviaturas: 3P = três fótons; NA = abertura numérica; GFP = proteína fluorescente verde; RFP = proteína fluorescente vermelha; EAL = comprimento de atenuação eficaz.
Discussão
Este protocolo explica os procedimentos passo a passo para a configuração de imagens 3P com uma fonte comercial de microscópio e laser. Em comparação com as 14h, o 3PM tem uma vantagem em aplicações que requerem acesso óptico nas regiões mais profundas, como no hipocampo cerebral do camundongo. Embora o 3PM seja usado principalmente na neurociência, o 3PM pode ser potencialmente aplicado em outros tecidos, como linfonodos, ossos e tumores para observação de tecidos profundos.
É importante verificar se o sistema de imagem funciona próximo ao limite de ruído de tiro, o que garante que os eletrônicos de detecção e aquisição de dados contribuam com ruídos insignificantes para a imagem após os PMTs. A incerteza no número de fótons detectados é fundamentalmente limitada pelo ruído de tiro de fóton. O desempenho limitado com ruído de tiro pode ser alcançado em um microscópio multifotônio típico usando um fotodetetor de alto ganho (por exemplo, um PMT). O ruído do tiro de fóton segue uma distribuição estatística de Poisson, em que o desvio padrão da distribuição é igual à raiz quadrada da média da distribuição. Para verificar o desempenho limitado do ruído de tiro, siga o passo 1.14 na seção protocolo.
Para evitar atenuação leve por H2O, usar D2O para imersão é útil, particularmente para a excitação de ~1.700 nm. Quando D2O é usado, é essencial atualizar D2O a cada ~10 min ou usar um grande volume de D2O para evitar d2O/H2O troca durante a imagem. Pode-se também selar o D2O do ambiente da sala3. Se uma lente objetiva de longa distância de trabalho (WD) (por exemplo, WD a 4 mm ou mais) for usada para imagem, a espessura líquida de imersão pode exceder 2-3 mm. O aumento da espessura torna a absorção H2O não desprezível mesmo em ~1.300 nm21. Portanto, D2O pode ser necessário mesmo para 1.300 nm 3PM ao usar uma lente objetiva WD longa.
Como a intensidade da fluorescência 3P depende do cubo da energia do pulso de excitação no foco (Eq. (1)), definir a potência laser apropriada é particularmente importante para obter sinais adequados de fluorescência 3P, evitando danos térmicos e não lineares nos tecidos vivos. A potência média do laser deve ser mantida abaixo do limiar de dano térmico. No cérebro do camundongo, por exemplo, para evitar danos nos tecidos térmicos, a potência média na superfície cerebral do camundongo deve ser mantida em ou abaixo de ~100 mW para excitação de ~1.300 nm a uma profundidade de 1 mm e com um campo de visão (FOV) de 230 μm x 230 μm21. Da mesma forma, a potência média em ~1.700 nm deve ser mantida em ou abaixo de ~50 mW a ~1 mm de profundidade e um FOV de ~230 μm x 230 μm (dados inéditos). Além disso, para evitar a saturação da excitação e possíveis danos não lineares, a energia de pulso de excitação deve ser mantida em  2 nJ e
2 nJ e  3 nJ por ~1.300 nm e ~1.700 nm excitação, respectivamente30.
3 nJ por ~1.300 nm e ~1.700 nm excitação, respectivamente30.
Devido à absorção de luz e dispersão nos tecidos, a energia do pulso em foco é atenuada a 1/e (~37%) após a penetração de tecidos por 1 EAL. O EAL varia em diferentes tecidos e com os comprimentos de onda de excitação, por exemplo, no neocórtex do cérebro do camundongo, o EAL é ~300 μm e ~400 μm a ~1.300 nm e ~1.700 nm, respectivamente 3,29 (Figura 5). Portanto, para manter a mesma energia de pulso em foco (por exemplo, 1 nJ/pulso) a uma profundidade de n EALs, a energia de pulso da superfície precisa ser multiplicada por 1 nJ × en. Para imagens rápidas de dinâmica estrutural e funcional, um laser de excitação com uma alta taxa de repetição (a 1 MHz ou superior) é desejável alcançar uma alta taxa dequadros 5,6,7,10. No entanto, a exigência de energia de pulso e o limite médio de energia do laser restringem a taxa de repetição aplicável.
Por exemplo, quando percebemos uma região moderadamente profunda em 4 EALs (ou seja, ~1,2 mm no córtex do mouse com excitação de 1.300 nm), ~55 nJ/pulso na superfície é necessário para manter 1 nJ/pulso em foco. Quando a limitação média de energia é de 100 mW, podemos aplicar uma taxa de repetição de laser de ~2 MHz. No entanto, para imagem mais profunda a uma profundidade de 7 EALs, ~1.100 nJ/pulse é necessário na superfície para manter 1 nJ/pulso em foco. Supondo que a potência média máxima seja de 100 mW para evitar danos térmicos, a taxa de repetição do laser deve ser reduzida para 0,1 MHz para alcançar um 1.100 nJ/pulso na superfície. A Tabela 1 resume as condições típicas de imagem no córtex cerebral do camundongo. Observe que as profundidades de imagem na Tabela 1 assumem que o EAL é uniforme em todo o córtex do mouse.
Além disso, devido à limitação de energia do laser no tecido profundo 3PM, existe uma troca entre a taxa de quadros e o tamanho do pixel de imagem, o que é particularmente importante para imagens funcionais, como a imagem de cálcio. A taxa máxima de repetição do laser disponível é decidida em cada profundidade com base na energia de pulso necessária em foco e na potência média de laser aplicável como discutido acima, por exemplo, 2 MHz a uma profundidade equivalente a ~4 EALs com excitação de 1.300 nm. Em geral, a imagem requer pelo menos um pulso por pixel. Assim, o tempo mínimo disponível para o pixel é determinado pela taxa de repetição do laser, por exemplo, 0,5 μs/pixel com excitação de 2 MHz.
Para manter a alta resolução espacial (~1 μm na lateral) em imagens 3P, é ideal definir 1 pixel para uma área de ~1 μm2, por exemplo, 256 x 256 pixels para um FOV de 250 x 250 μm2. Assim, para realizar imagens rápidas com um FOV consideravelmente grande (por exemplo, 250 x 250 μm2 com 256 x 256 pixels), taxas de repetição de pulso de 0,5 MHz, 1 MHz e 2 MHz dão taxas teóricas de quadros máximos de ~7,6, ~15 e ~30 quadros/s, respectivamente. Da mesma forma, a otimização da taxa de repetição do laser é essencial, dependendo da profundidade do alvo, velocidade de varredura e FOV, para aplicar energia de pulso adequada sob o limiar de dano térmico. Para aumentar a velocidade de imagem, uma fonte de excitação adaptativa pode ser usada para concentrar todos os pulsos de excitação nos neurônios (ou seja, regiões de interesse) fornecendo pulsos laser sob demanda para os neurônios31.
3PM é vantajoso quando comparado com 2PM em imagens profundas dentro de tecidos vivos e através de mídias altamente dispersas, como um crânio, ossos e a camada de matéria branca (ou seja, a cápsula externa) do cérebro do camundongo. O EAL mais longo e a excitação não linear de 3PE beneficia a imagem de tecido profundo. Por exemplo, para imagem GCaMP6 no córtex do mouse, o sinal de fluorescência 2P com excitação de 920 nm é maior que o sinal de fluorescência de 3P com excitação de 1.300 nm em regiões rasas a  690 μm (ou seja, ~2,3 EALs a 1.300 nm)21. No entanto, devido ao EAL mais longo em 1.300 nm em comparação com 920 nm, 3PE dá fluorescência mais forte do que excitação 2P (2PE) a uma profundidade de ~690 μm emais profundo 21. Esta profundidade é definida como "profundidade de crossover de sinal", na qual os pontos fortes do sinal de fluorescência de 2PE e 3PE são idênticos com a mesma taxa de repetição e os mesmos poderes médios permitidosmáximos 21. A profundidade do cruzamento de sinal depende dos comprimentos de onda de excitação para 2PE e 3PE e o fluoróforo.
690 μm (ou seja, ~2,3 EALs a 1.300 nm)21. No entanto, devido ao EAL mais longo em 1.300 nm em comparação com 920 nm, 3PE dá fluorescência mais forte do que excitação 2P (2PE) a uma profundidade de ~690 μm emais profundo 21. Esta profundidade é definida como "profundidade de crossover de sinal", na qual os pontos fortes do sinal de fluorescência de 2PE e 3PE são idênticos com a mesma taxa de repetição e os mesmos poderes médios permitidosmáximos 21. A profundidade do cruzamento de sinal depende dos comprimentos de onda de excitação para 2PE e 3PE e o fluoróforo.
Na prática, a excitação de 920 nm permite maior potência média do laser do que 1.300 nm excitação devido à menor absorção de água. No entanto, a maior potência média de 2PE empurraria a profundidade do crossover de sinal apenas em 0,9 EALs4. Além disso, quando a amostra é densamente rotulada, o 3PE tem a vantagem adicional de SBR muito maior. Portanto, mesmo antes de atingir o comprimento do crossover do sinal, o 3PM pode ser melhor para imagens do que 14:00. Por exemplo, ao imaginar a vasculatura cerebral do camundongo, que tem uma fração de volume (ou seja, densidade de rotulagem) de ~2%, 1.300 nm 3PM com poder de excitação de 100 mW supera 920 nm 2PM com 200 mW de poder de excitação a uma profundidade de ~700 μm para fluoresceína.
3PM também tem uma vantagem ao fotografar através de uma camada fina, mas altamente dispersa que pode distorcer a função de propagação de pontos do feixe de excitação e gerar um fundo de desfocal4. Por exemplo, através do crânio intacto do cérebro do camundongo, as imagens das 2PM sofrem do fundo de desfoco mesmo na profundidade rasa de <100 μm da superfície cerebral13. Um fundo de desfoco semelhante foi observado em 2PM com excitação de 1.280 nm através da matéria branca no cérebro do camundongo32. Portanto, quando os tecidos são imagens através de camadas turvas, 3PM é preferível às 14:00 para imagens de alto contraste, independentemente da densidade de rotulagem.
Recentemente, relatamos uma análise fantasma e teórica de contas mostrando que o limite de profundidade de imagem de 3PM é superior a 8 EALs33; 8 EALs são equivalentes a ~3 mm com ~1.700 nm de excitação no córtex do mouse. No entanto, o laser atualmente disponível não tem energia de pulso suficiente para alcançar 8 EALs no cérebro do camundongo. O desenvolvimento adicional de lasers mais fortes empurrará o limite atual de profundidade de imagem de 3PM.
Divulgações
Os autores não declaram interesses concorrentes.
Agradecimentos
Este trabalho foi apoiado pela NSF DBI-1707312 Cornell NeuroNex Hub e NIH 1U01NS103516.
Materiais
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
Referências
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados