Method Article
Microscopía de fluorescencia de tres fotones de tejido profundo en cerebro intacto de ratón y pez cebra
* Estos autores han contribuido por igual
En este artículo
Resumen
La microscopía de tres fotones permite obtener imágenes de fluorescencia de alto contraste en lo profundo de tejidos biológicos vivos, como cerebros de ratón y pez cebra, con alta resolución espaciotemporal.
Resumen
Las técnicas de microscopía multifotónica, como la microscopía de dos fotones (2PM) y la microscopía de tres fotones (3PM), son herramientas poderosas para la obtención de imágenes in vivo de tejidos profundos con resolución subcelular. 3PM tiene dos ventajas principales para las imágenes de tejidos profundos sobre 2PM que se han utilizado ampliamente en los laboratorios de biología: (i) una mayor longitud de atenuación en los tejidos de dispersión mediante el empleo de ~ 1,300 nm o ~ 1,700 nm de láser de excitación; (ii) menos generación de fluorescencia de fondo debido a la excitación no lineal de orden superior. Como resultado, 3PM permite imágenes estructurales y funcionales de alto contraste en lo profundo de los tejidos dispersos, como el cerebro intacto del ratón desde las capas corticales hasta el hipocampo y todo el cerebro anterior del pez cebra adulto.
Hoy en día, las fuentes láser adecuadas para 3PM están disponibles comercialmente, lo que permite la conversión de un sistema de imágenes de dos fotones (2P) existente en un sistema de tres fotones (3P). Además, hay disponibles múltiples microscopios 3P comerciales, lo que hace que esta técnica esté fácilmente disponible para los laboratorios de investigación biológica. Este artículo muestra la optimización de una configuración típica de 3PM, particularmente dirigida a grupos de biología que ya tienen una configuración 2P, y demuestra imágenes 3D intravitales en cerebros intactos de ratones y peces cebra adultos. Este protocolo cubre el procedimiento experimental completo de imágenes 3P, incluida la alineación del microscopio, el prepicado de pulsos láser de ~ 1,300 y ~ 1,700 nm, la preparación animal y las imágenes de fluorescencia 3P intravital en profundidades en cerebros adultos de pez cebra y ratón.
Introducción
En ciencias de la vida, las técnicas de microscopía multifotónica (MPM), como 2PM y 3PM, han sido herramientas poderosas para imágenes profundas in vivo con alta resolución espaciotemporal y alto contraste en tejidos dispersos. Además, estos métodos causan menos fotoblanqueo en comparación con la microscopía confocal de un fotón 1,2,3,4. 3PM es ventajoso para las imágenes de tejidos más profundos en comparación con 2PM debido a dos características principales: (i) el empleo de excitación de longitud de onda más larga (~ 1,300 nm o ~ 1,700 nm) reduce la dispersión del tejido, y (ii) el proceso de excitación de orden superior (es decir, la señal de fluorescencia depende del cubo de la potencia de excitación en 3PM en lugar del cuadrado de la potencia de excitación en 2PM) que suprime la fluorescencia de fondo no deseada3 . En consecuencia, 3PM permite imágenes de alto contraste en regiones más profundas de tejidos vivos como el hipocampo en un cerebro de ratón adulto intacto 3,5,6,7,8,9,10,11 y todo el cerebro anterior del pez cebra adulto12, incluido Ca2+ registro de actividades y observaciones multicolores. Además, se han obtenido imágenes de alto contraste con 3PM a través de los cráneos intactos de ratón y pez cebra adulto12,13.
Hoy en día, las fuentes láser de excitación adecuadas para la excitación 3P (3PE) a ~ 1,300 y ~ 1,700 nm están disponibles comercialmente. Como el sistema de escaneo láser es esencialmente el mismo para 2PM y 3PM, la conversión de una configuración 2P existente en una configuración 3P es posible en los laboratorios de biología con la instalación de un láser disponible comercialmente para 3PE. La señal de fluorescencia 3P depende de la potencia del láser, la duración del pulso, la tasa de repetición del láser y la apertura numérica (NA) de la lente del objetivo. Suponiendo un enfoque limitado por difracción (es decir, la apertura posterior de la lente del objetivo está sobrellenada por el haz de excitación), Eq (1) describe el flujo de fotones de fluorescencia promediado en el tiempo del volumen focal resultante de 3PE.
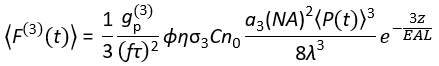 (1)
(1)
Donde f es la tasa de repetición del láser, τ es la duración del pulso del láser (ancho completo a la mitad del máximo), φ es la eficiencia de recolección del sistema, η es la eficiencia cuántica de fluorescencia, σ3 es la sección transversal de absorción 3P, C es la concentración de fluoróforos, n0 es el índice reflectante del medio de muestra (por ejemplo, agua), λ es la longitud de onda de excitación en el vacío, NA es la apertura numérica de la lente del objetivo, un3 es la constante de integración espacial del volumen focal, 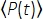 es el flujo de fotones de excitación promediado en el tiempo (fotones / s) debajo de la lente del objetivo, z es la profundidad de la imagen y EAL es la longitud de atenuación efectiva14. Aquí hemos asumido que el EAL (típicamente > 100 μm) es mucho mayor que la resolución axial del microscopio (típicamente < 10 μm). Bajo aproximación paraxial, un3 es igual a 28.114. gp(3) es la coherencia temporal de3er orden de la fuente de excitación, y gp(3) es 0,41 y 0,51 para pulsos hiperbólicos-secantes-cuadrados y pulsos gaussianos, respectivamente. La eficiencia de recolección φ se puede estimar considerando la recolección de fluorescencia por la lente objetivo, la transmitancia de la lente objetivo, la reflectividad del espejo dicroico, la transmitancia de los filtros y la eficiencia de detección del detector (por ejemplo, tubo fotomultiplicador o PMT). Como la intensidad de la fluorescencia 3P depende en gran medida de varios parámetros, se requiere la optimización de la configuración 3P para maximizar las señales de fluorescencia 3P.
es el flujo de fotones de excitación promediado en el tiempo (fotones / s) debajo de la lente del objetivo, z es la profundidad de la imagen y EAL es la longitud de atenuación efectiva14. Aquí hemos asumido que el EAL (típicamente > 100 μm) es mucho mayor que la resolución axial del microscopio (típicamente < 10 μm). Bajo aproximación paraxial, un3 es igual a 28.114. gp(3) es la coherencia temporal de3er orden de la fuente de excitación, y gp(3) es 0,41 y 0,51 para pulsos hiperbólicos-secantes-cuadrados y pulsos gaussianos, respectivamente. La eficiencia de recolección φ se puede estimar considerando la recolección de fluorescencia por la lente objetivo, la transmitancia de la lente objetivo, la reflectividad del espejo dicroico, la transmitancia de los filtros y la eficiencia de detección del detector (por ejemplo, tubo fotomultiplicador o PMT). Como la intensidad de la fluorescencia 3P depende en gran medida de varios parámetros, se requiere la optimización de la configuración 3P para maximizar las señales de fluorescencia 3P.
Este protocolo ilustra el proceso de optimización de una configuración 3P típica, que será útil particularmente para los laboratorios de biología que tienen una configuración 2P y planean expandir su capacidad a imágenes 3P o mantener su configuración 3P comercial con un rendimiento óptimo. Este artículo de video también demuestra imágenes 3P de tejido profundo en cerebros de animales vivos. La primera sección aborda la optimización de una configuración 3P típica con una fuente láser disponible comercialmente y un microscopio multifotónico. Las secciones segunda y tercera describen la preparación del pez cebra y el ratón, respectivamente, para 3PM de estructuras y actividades neuronales. La cirugía de craneotomía de ratón también se ha informado previamente en documentos de protocolo 15,16,17. La cuarta sección muestra imágenes intravitales 3P en cerebros de pez cebra y ratón.
Protocolo
Todos los procedimientos de experimentación y alojamiento de animales para peces cebra y ratones fueron aprobados y llevados a cabo de acuerdo con la guía del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Cornell (IACUC). El pez cebra y los ratones fueron sacrificados por solución de tricaína de alta concentración y asfixia por dióxido de carbono, respectivamente, después del experimento.
1. Optimización de la configuración de microscopía de tres fotones
NOTA: Use gafas de seguridad láser para la protección ocular. Bloquee el rayo láser con un bloqueador de haz cuando se coloquen o muevan las ópticas. Para visualizar el láser, utilice un visor de infrarrojos o una tarjeta de detector de infrarrojos.
- Encienda el láser y establezca la longitud de onda central de la salida de ralentí del amplificador paramétrico óptico no colineal (NOPA) en ~ 1,300 nm o ~ 1,700 nm.
- Coloque un vidrio de cubierta delgada en la línea de haz desde el puerto de señal de NOPA (es decir, ~ 700-900 nm) para reflejar una pequeña fracción del rayo láser a un fotodiodo de Si para obtener señales de activación (Figura 1). Coloque un bloqueador de haz en la ruta de transmisión del vidrio de la cubierta.
- Coloque los compresores de pulso en la trayectoria de la luz para prepintar el láser de femtosegundo para optimizar la duración del pulso para 3PM. Para un haz de ~1.300 nm, coloque un compresor de par de prisma 18,19 (por ejemplo, pares de prismas N-SF11). Para el láser de ~1.700 nm, coloque una placa de Si de ~3 mm de espesor20. Establezca el ángulo entre la placa Si y la trayectoria del láser en el ángulo del Brewster (~ 73.9 ° para 1,700 nm) para maximizar la transmitancia del láser. Gire la placa de Si para lograr el ángulo del Brewster minimizando la reflexión.
- Coloque espejos de aleta para permitir un cambio conveniente entre las líneas de haz de ~ 1,300 nm y ~ 1,700 nm.
- Coloque una media placa de onda (por ejemplo, una media placa de onda acromática adecuada para ~ 1,300 y ~ 1,700 nm) montada en una etapa de rotación y un divisor de haz polarizador (PBS) para controlar la intensidad del láser. Coloque un bloqueador de haz en la trayectoria de reflexión del PBS.
NOTA: El láser necesita pasar a través del PBS perpendicularmente para lograr una alta relación de extinción. La potencia del láser para 3PM se controla girando la media placa de onda. - Coloque un vidrio de cubierta delgada en la trayectoria de la luz después del controlador de potencia y antes del obturador óptico para reflejar una pequeña fracción del rayo láser en un medidor de potencia. Utilice el medidor de potencia como "medidor de potencia de referencia" para calcular la potencia del láser bajo el objetivo durante la toma de imágenes (consulte el paso 1.12).
- Alinee la trayectoria del láser ajustando los espejos para propagar el haz en el sistema 3PM.
- Mida el tamaño del haz en la posición de la abertura posterior del objetivo utilizando un filo de cuchillo en un escenario de traslación y un medidor de potencia. Asegúrese de que el tamaño de la viga no sea demasiado pequeño o demasiado grande.
NOTA: Por lo general, el haz rellena ligeramente la lente de alto objetivo NA para lograr un alto rendimiento de potencia para imágenes de tejido profundo. Por ejemplo, un tamaño de haz de ~10-13 mm (1/e2) en la apertura posterior del objetivo Olympus (~15 mm de diámetro de apertura trasera) ayuda a lograr un NA efectivo de ~0.7-0.9. Cuando el tamaño del haz es demasiado pequeño, la señal 3P se vuelve débil y la resolución espacial empeora debido a la baja efectividad de NA. Cuando el tamaño del haz es demasiado grande, la potencia de excitación máxima disponible debajo del objetivo se debilita debido a la pérdida de potencia en la abertura posterior del objetivo. Para las imágenes de tejido profundo, los rayos marginales también sufren una mayor pérdida debido a la trayectoria más larga en el tejido. - Si el tamaño del haz en la abertura posterior del objetivo no es apropiado, coloque los elementos ópticos apropiados, como las lentes convexas, en la trayectoria del rayo láser para ajustar el tamaño del haz.
NOTA: Asegúrese de que el rayo láser no sea más grande que los espejos galvo para evitar pérdidas de energía innecesarias. - Coloque la lente del objetivo en la configuración de 3PM.
- Mida la duración del pulso después del objetivo utilizando un autocorrelador. Ajuste el compresor de pulsos para lograr pulsos más cortos si la duración del pulso es demasiado larga (por ejemplo, >70 fs). Use pulsos de ~ 50-70 fs para 3PM y un interferómetro Michelson colocado entre el láser y el objetivo para proporcionar el retraso para las mediciones de autocorrelación.
NOTA: Un fotodiodo con una respuesta espectral adecuada (por ejemplo, un fotodiodo de silicio para una longitud de onda superior a 1.200 nm) colocado en el foco del objetivo puede servir convenientemente como un detector no lineal, y la fotocorriente de dos fotones del fotodiodo se puede utilizar para obtener los rastros de autocorrelación20. El compresor de par de prismas para ~1.300 nm se puede ajustar de dos maneras: (1) cambiando la distancia entre los dos prismas; (2) cambiar las longitudes de trayectoria del rayo láser en el vidrio del prisma moviendo el prisma (s) perpendicularmente a la línea de base del prisma. El compresor de placa si para ~1,700 nm se puede ajustar reemplazando la placa Si con una placa Si más gruesa o más delgada. - Coloque un medidor de potencia en la salida de la lente del objetivo. Mida la potencia del láser bajo el objetivo y lea el valor del medidor de potencia de referencia (del paso 1.6). Calcule la relación de la potencia bajo el objetivo y en el medidor de potencia de referencia.
NOTA: Durante la toma de imágenes, la potencia real del láser bajo el objetivo se puede calcular a partir de la relación de potencia y el valor del medidor de potencia de referencia. - Saque el medidor de potencia de debajo del objetivo.
- [Opcional] Verificar el rendimiento limitado del sistema de imágenes con disparo de fotones
NOTA: Para realizar esta tarea, se necesitan los siguientes elementos: 1) una piscina de fluoresceína o tinte Rojo de Texas (por ejemplo, ~ 10 μM), 2) un contador de fotones y 3) un osciloscopio.- Coloque la muestra de la piscina de tinte debajo de la lente del objetivo 3PM.
- Baje cuidadosamente la lente del objetivo sobre el grupo de tinte hasta que la distancia sea menor que la distancia de trabajo de la lente del objetivo.
- Coloque agua entre la lente y el vidrio de la cubierta de la piscina de tinte.
- Ajuste la potencia de salida del microscopio a una pequeña cantidad (por ejemplo, <1 mW con una tasa de repetición de pulso de ~ 1 MHz) para localizar la superficie del grupo de tintes.
- Inicie la sesión en vivo del microscopio y establezca la ubicación z en cero.
- Mueva lentamente el objetivo lejos de la muestra para llegar a la parte superior de la piscina de tinte (como lo indica la tercera generación armónica (THG) producida por el vidrio de la cubierta).
- Establezca la ubicación z en cero en la posición del vidrio de la cubierta.
- Baje ligeramente el objetivo hasta que una señal de fluorescencia clara sea visible en el canal de fluorescencia.
- Conecte la salida del PMT a un divisor BNC. Conecte las salidas del divisor al contador de fotones y al sistema de adquisición de imágenes.
- Establezca la potencia del láser en un valor en el que los recuentos de fotones por segundo sean inferiores al 5% de la tasa de repetición del láser (por ejemplo,
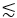 50.000 fotones/s cuando se utiliza un láser de 1 MHz).
50.000 fotones/s cuando se utiliza un láser de 1 MHz). - Reduzca el campo de visión al mínimo posible con el software y asegúrese de que el brillo sea uniforme en toda la imagen.
- Establezca la velocidad de fotogramas en 1,0 fotogramas por segundo.
- Establezca el período de adquisición del contador de fotones en t = número de píxeles por fotograma × tiempo de permanencia de píxeles y un nivel de discriminación adecuado.
- Recopile el recuento de fotones y los recuentos de píxeles simultáneamente durante un período equivalente. Para obtener el recuento de píxeles, recopile los valores medios de píxeles de toda la imagen, así como los valores medios y de desviación estándar.
- Repita el paso 1.14.14, bloqueando el láser de excitación para obtener el recuento de fotones oscuros y los recuentos de píxeles.
- Detenga la adquisición en vivo del software.
- Reste los recuentos de oscuros (obtenidos en el paso 1.14.15) de los recuentos de fotones (obtenidos en el paso 1.14.14) y el recuento total de píxeles (obtenido en el paso 1.14.14).
- Divida el recuento total de píxeles restados en la oscuridad por el recuento de fotones restados en la oscuridad (obtenido en el paso 1.14.17). Utilice el valor obtenido como el "factor de conversión" (es decir, valores de píxeles/fotón) de un valor de píxel a un recuento de fotones.
- Convertir la media y la desviación estándar de los recuentos de píxeles (obtenidos en el paso 1.14.14) en recuentos de fotones, es decir, dividirlos por el "factor de conversión" (obtenido en el paso 1.14.18). Compare la media y la desviación estándar de los recuentos de fotones. Asegúrese de que la desviación estándar sea aproximadamente igual a la raíz cuadrada de la media de los recuentos de fotones si el rendimiento del sistema de imágenes está cerca del límite de ruido de disparo.
- [Opcional] Verifique la eficiencia de detección de señal del microscopio.
- Para probar el rendimiento del microscopio y la eficiencia de detección de señales, siga los pasos 1.14.1-1.14.17 para obtener recuentos de fotones. Para el paso 1.14.15, cree una muestra en blanco hecha del disolvente para el tinte y obtenga los recuentos de fotones para la muestra en blanco con el láser encendido y a la misma potencia que para la piscina de tinte. Reste los recuentos en blanco de los recuentos de fotones del grupo de tintes para obtener los recuentos de fotones de fluorescencia.
- Utilice las secciones transversales 3P conocidas de fluoresceína o Texas Red10,22 y Eq. (1) (con un NA efectivo para tener en cuenta el llenado de la abertura posterior correctamente) para calcular los recuentos de fotones esperados y luego comparar el valor calculado con los recuentos de fotones medidos experimentalmente. Registre ambos recuentos de fotones en el cuaderno de laboratorio como resultados de pruebas para el microscopio para futuras referencias.
NOTA: Asegúrese de que los valores calculados y medidos estén cerca uno del otro (por ejemplo, dentro de un factor de 2). Tales pruebas cuantitativas del sistema son particularmente útiles para garantizar un rendimiento de imagen consistente a lo largo del tiempo.
2. Preparación del pescado para las 3PM
NOTA: Use guantes y una bata de laboratorio para este procedimiento. Elija el pez cebra adulto de acuerdo con el experimento. Termine toda la preparación (pasos 2.1 a 2.7) dentro de ~ 15 min.
- Prepare una placa de Petri con ~ 0.5 cm de agar de alto punto de fusión al 2%. Cortar un agujero rectangular en el agar más largo y ligeramente más ancho que el pescado. Use cera para unir tubos delgados (para la perfusión de agua en la boca del pez) a la placa de Petri con un extremo en el rectángulo. Use cera para unir tubos de mayor diámetro (para eliminar el agua) al borde de la placa de Petri.
- Elija peces para el experimento. Anestesiar el pescado con 0,2 mg/ml de solución de tricaína (pH 7,2) en la solución de Hank hasta que el pescado no responda por completo y esté profundamente anestesiado.
- Coloque el pescado de lado sobre una esponja húmeda. Usando una microjeringa, inyecte retro-orbitalmente 3 μL de bromuro de pancuronio (0.4 μg / μL en la solución de Hank) para paralizar a los peces. Coloque el pescado en la solución de Hank brevemente para asegurarse de que esté completamente paralizado.
- Coloque el dorsal del pescado de lado hacia arriba en la placa de Petri con la cabeza hacia el tubo. Usando fórceps para manipular el tubo, abra suavemente la boca del pez y deslice el tubo hacia la boca. Deslice suavemente el pez hacia el tubo para que el tubo esté en la parte posterior de la boca del pez.
- Seque rápida pero suavemente el agar alrededor del pez y retire el agua sobre el pescado. Sumerja un pequeño trozo de tejido de laboratorio en pegamento de laboratorio y coloque el tejido en el agar a ambos lados del pez y sobre la espalda del pez caudal hasta las branquias.
NOTA: No empuje el pescado ni aplique presión. Tenga cuidado de evitar que el pegamento entre en las branquias. - Aplique una pequeña gota de bupivacaína directamente sobre la superficie de la cabeza para anestesiar a los peces durante las imágenes en la región donde el láser entrará en contacto con la piel.
- Lleve la placa de Petri con el pescado al microscopio y llénela con agua de la instalación de peces. Conecte el tubo a una bomba de agua para bombear agua del sistema a 2 ml / min en la boca del pez y simultáneamente retire la solución de perfusión del plato a la misma velocidad. Asegúrese de que el agua se oxigena con un burbujeador y se calienta a ~ 30 ° C con un calentador de acuario.
NOTA: El pez ya está listo para la obtención de imágenes. Controlar la salud de los peces mediante la monitorización del flujo sanguíneo en la señal de tercera generación armónica (THG) durante la toma de imágenes (ver sección 4.1). Las imágenes 3P también deben ser compatibles con preparaciones de peces más sofisticadas, como las utilizadas en las imágenes 2P para fijar la cabeza y permitir los movimientos del cuerpo durante la toma de imágenes durante la realidad virtual23. Esta imagen completamente no invasiva evita la necesidad de extirpación del cráneo como es típico en otros estudios de vertebrados y es un paso hacia la minimización de la investigación invasiva y el dolor asociado.
3. Preparación del ratón para las 3PM
NOTA: Use guantes, máscara quirúrgica y bata de laboratorio durante los siguientes procedimientos. Elija la línea del mouse de acuerdo con el experimento. El ratón debe estar alojado bajo un ciclo de luz-oscuridad de 12:12 h antes de la cirugía. Toda la cirugía (pasos 3.2-3.11) es aséptica, y todas las herramientas de cirugía deben esterilizarse antes de su uso. La craneotomía tarda ~1 h.
- Coloque un estuche en forma de rosquilla (4,5-6,5 mm de diámetro) y un disco de funda (5 mm de diámetro) en una película limpia. Use una aguja para aplicar una pequeña cantidad de adhesivo óptico para pegar la funda en forma de rosquilla en el disco de la cubierta. Cure el trozo de disco-donut en la parapelícula bajo luz ultravioleta durante 10-20 minutos. Retire toda la cubierta de la dona de disco de la parapelícula y use pinzas para rascar el exceso de pegamento y el etanol al 70% para eliminar los desechos.
NOTA: Las fundas de cubierta tienen un grosor de ~0,17 mm. El capa en forma de rosquilla se utiliza para aplicar la presión adecuada sobre el cerebro para las imágenes crónicas. - Anestesiar al ratón con 3% de isoflurano y 20% de mezcla de gases O2 en una cámara de inducción. Pesa el ratón. Coloque el ratón en posición prona sobre una almohadilla térmica. Ajuste la temperatura de la almohadilla térmica a ~ 37 ° C.
- Fije los dientes superiores en el orificio bucal de un aparato estereotáxico con la colocación de una máscara anestésica. Fije las barras de los oídos a las orejas. Mantenga la anestesia con 2% de isoflurano y 20% de mezcla de gases O2 durante la cirugía.
NOTA: Ajuste la concentración de isoflurano monitoreando la respuesta del ratón. Verifique el nivel de anestesia observando la frecuencia respiratoria (~ 1 Hz para el sueño profundo) y pellizcando los pies para verificar si hay alguna reacción antes de la cirugía. - Aplique ungüento para los ojos en los ojos para la lubricación. Cierre los párpados. Encienda todas las luces de la cirugía. Inyecte por vía subcutánea ketoprofeno, dexametasona y glicopirrolato en función del peso corporal del ratón antes de la cirugía.
NOTA: Las dosis del medicamento son 2 mg / ml, 0.1 mg / ml y 0.1 mg / ml para ketoprofeno, dexametasona y glicopirrolato, respectivamente. Los volúmenes de inyección para ketoprofeno, dexametasona y glicopirrolato dependen del peso corporal y son de 2,5 μL/g, 2 μL/g y 2 μL/g, respectivamente. - Retire el vello en la coronilla de la cabeza y cerca de las orejas.
- Recorte la mayor cantidad de cabello posible con tijeras o un cortapelos y retire el vello recortado del sitio quirúrgico.
- Aplique una cantidad adecuada de crema depilatoria. Espere 1 min.
- Retire el vello y la crema usando un hisopo de algodón empapado en solución salina.
- Repita los pasos 3.5.2 y 3.5.3 hasta que el vello se elimine por completo.
- Aplique una solución de povidona yodada al 5% y luego etanol al 70% en la piel para limpiar el área. Repita el proceso tres veces.
- Administre una inyección subcutánea de atropina (dosis basada en el peso corporal, 0,02-0,05 mg/kg) en la cabeza. Espere 1 min.
- Corte la piel de la coronilla de la cabeza para exponer el cráneo. Asegúrese de que el punto bregma y el punto lambda estén expuestos. Pegue el tejido cutáneo restante en el borde del cráneo mediante el uso de pegamento biocompatible para evitar que el polvo de perforación entre debajo de la piel (lo que puede provocar una respuesta inmune).
- Use un marcador quirúrgico para dibujar un círculo de 5 mm de diámetro sobre el área de interés. Por ejemplo, elija el centro del área ~ 2.5 mm lateral y 2 mm caudal a la bregma, que cubre la mayor parte de la corteza somatosensorial y la corteza visual.
- Perfore a lo largo del círculo lentamente y aplique solución salina para hidratar el cráneo cuando esté a mitad de camino. Reduzca la velocidad de perforación durante la última mitad y cubra el cráneo con solución salina antes de extraer el cráneo. Abra el cráneo suavemente con fórceps y aplique un pequeño trozo de espuma de gel estéril empapado en solución salina para detener inmediatamente cualquier sangrado en el cerebro. Mantenga el cerebro hidratado mediante el uso de solución salina.
- Aplique una gota de solución salina en el costado de la funda de disco-donut preparada frente al tejido cerebral. Coloque la parte del disco sobresaliente de la cubierta de la rosquilla de disco en la ventana craneal. Use una barra larga sostenida por el aparato estereotáxico para presionar suavemente la parte del disco de la ventana craneal de la cubierta sobre la superficie del cerebro, asegurándose de que la parte de la dona cubra firmemente el cráneo. Seque el área alrededor de la funda de la rosquilla de disco con un hisopo de algodón.
- Aplique una capa de pegamento biocompatible debajo del borde en forma de rosquilla. Aplique una capa de mezcla de cemento dental debajo y alrededor de la parte de la rosquilla de la cubierta de la rosquilla de disco. Aplique otra capa de pegamento sobre el cemento dental. Se puede inyectar glucosa al 5% (dosis basada en el peso corporal, 10 μL / g) por vía subcutánea cada hora durante la cirugía para proporcionar energía animal.
- Apague el sistema de anestesia. Suelte el ratón del aparato estereotáctico. Transfiera el ratón a un aparato estereotáctico compacto personalizado inmediatamente, con una almohadilla térmica a ~ 37 ° C y un aparato de anestesia.
- Coloque el ratón en posición prona sobre la almohadilla térmica del aparato estereotáxico compacto personalizado. Ajuste la temperatura a ~37 °C. Fije los dientes superiores en el orificio bucal del aparato estereotáctico y las barras de los oídos en las orejas del ratón. Coloque los tubos anestésicos y mantenga la anestesia con una mezcla de gases al 1,5% de isoflurano y 20% de O2.
NOTA: El ratón ya está listo para la creación de imágenes. Mantenga el ratón anestesiado durante los siguientes procedimientos de diagnóstico por imágenes. Ajuste la concentración de isoflurano monitoreando la respuesta del ratón.
4. Imágenes intravitales en cerebros de peces y ratones
- Imágenes intravitales en el cerebro del pez cebra
NOTA: Para ubicar correctamente el cerebro del pez debajo de la lente del objetivo, se utiliza una cámara de dispositivo secundario de carga acoplada (CCD) en el mismo camino que la luz de excitación para imágenes de campo amplio.- Configure el microscopio y calibre la potencia (como se describe en la sección 1).
- Coloque un objetivo de bajo aumento (generalmente 4x) en el microscopio.
- Coloque la placa de Petri que contiene el pescado y los tubos bajo el microscopio.
- Utilice una fuente de luz de diodo emisor de luz (LED) para iluminar la placa de Petri.
- Abra el modo Cámara del software de adquisición de imágenes (Figura 2).
- Haz clic en Live.
- Elija el canal A en el lado derecho de la pantalla.
- Ajuste la configuración del histograma para ver la imagen con claridad.
NOTA: Estos deben actualizarse según sea necesario. - Establezca la configuración del motor en el controlador del motor en Base.
- Baja el objetivo hasta que el pez sea visible.
NOTA: Asegúrese de que la lente del objetivo no haga ningún contacto físico con la cabeza. - Coloque el centro de la cabeza del pez en el centro del campo de visión.
- Mueva el objetivo hacia arriba y lejos de la cabeza del pez.
- Reemplace la lente de objetivo de bajo aumento con la lente de objetivo de alto NA para 3PM.
NOTA: La lente de bajo aumento y la lente de objetivo de alto NA no necesitan ser parfocales, pero deben estar lo suficientemente cerca como para garantizar que el pez esté dentro del campo de visión de la lente de objetivo de alto NA. - Baje lentamente la lente del objetivo, asegurándose de que el objetivo no haga ningún contacto físico con la cabeza. En el software de la cámara CCD, deje de mover el objetivo cuando la parte superior de la cabeza esté visible. Establezca la ubicación z en 0 μm.
NOTA: Asegúrese de que no haya burbujas de aire debajo de la lente del objetivo cuando use un objetivo de inmersión en agua. - Apague la fuente de luz LED y cierre la cortina oscura alrededor del sistema.
- Configure el software de adquisición de imágenes en el modo Multiphoton GG para imágenes 3P y ajuste la potencia debajo de la lente del objetivo a menos de 1 mW (con una tasa de repetición de pulso de ~ 1 MHz).
- Cambie el botón de configuración del motor de Base a Objetivo en el controlador del motor.
- Apague las luces de la habitación.
- Encienda los PMT y abra el obturador de la fuente de excitación de las 3PM. Asegúrese de que aparezca un contorno del hueso en el canal de señal de fluorescencia debido a la autofluorescencia y en el canal de señal THG debido al THG del hueso (Figura 2C).
- Realice imágenes a diferentes profundidades aumentando los niveles de potencia al obtener imágenes más profundas.
- Imágenes intravitales en el cerebro del ratón
NOTA: Inyecte 5% de glucosa en el ratón anestesiado cada hora durante la toma de imágenes; la dosis se basa en el peso corporal (10 μL/g).- Configure el software de adquisición de imágenes en el modo Multiphoton GG para imágenes 3P y ajuste la potencia debajo de la lente del objetivo a menos de 1 mW (con una tasa de repetición de pulso de ~ 1 MHz).
NOTA: Asegúrese de que la ventana de la cirugía se coloque perpendicular a la lente del objetivo para reducir la aberración. El ajuste fino se realiza inclinando el aparato estereotáxico. - Mueva la lente del objetivo cerca de la ventana y aplique agua entre el objetivo y la ventana craneal; establecer los valores de eje de todos los motores en cero.
NOTA: La absorción de luz en H2O a ~ 1,700 nm es grande, lo que reduce significativamente la potencia del láser de ~ 1,700 nm después de una profundidad de ~ 1-2 mm de agua. Para una excitación de ~1,700 nm, use D2O, que tiene una absorción mucho menor a 1,700 nm, para que la inmersión en agua reduzca la absorción por agua. - Haga clic en el botón Live en el software de adquisición de imágenes y abra los canales PMT, por ejemplo, un canal de señal de fluorescencia y un canal de señal THG. Ajuste la ganancia de PMT y el nivel de fondo según sea necesario.
- Suba lentamente la lente del objetivo para localizar la superficie de la ventana monitoreando el canal THG desde los vasos sanguíneos grandes y la superficie de vidrio de la ventana. Ajuste la orientación de la ventana (consulte la nota en el paso 4.2.12) si es necesario. Cero los motores para definir la superficie del cerebro.
- Realice imágenes y ajuste el nivel de potencia de acuerdo con la profundidad de la imagen.
- Configure el software de adquisición de imágenes en el modo Multiphoton GG para imágenes 3P y ajuste la potencia debajo de la lente del objetivo a menos de 1 mW (con una tasa de repetición de pulso de ~ 1 MHz).
Resultados
La finalización exitosa de este protocolo dará como resultado un microscopio correctamente alineado con parámetros de luz óptimos (por ejemplo, duración del pulso, NA) y preparaciones animales apropiadas para 3PM in vivo . La configuración 3P disponible comercialmente comprende espejos y lentes apropiados para ~ 1,300 nm y ~ 1,700 nm; por lo tanto, no se requiere ningún cambio en la óptica cuando la longitud de onda de excitación se cambia entre 1.300 nm y 1.700 nm. Si las lentes en una configuración 3P no tienen un recubrimiento apropiado para 1,300 y 1,700 nm, estas deben reemplazarse por otras apropiadas para reducir la pérdida de potencia del láser. Con las 3PM optimizadas y la preparación animal adecuada, la fluorescencia in vivo y las imágenes THG con alto contraste se pueden recolectar en lo profundo del cerebro.
La Figura 3 muestra imágenes representativas 3P de peces cebra adultos intactos. Las imágenes de alta resolución, no invasivas y profundas de neuronas genéticamente marcadas en el cerebro adulto del pez cebra se logran utilizando 3PM. Aunque se han reportado imágenes en la región del telencéfalo en el cerebro adulto del pez cebra utilizando 2PM 24,25,26,27, 3PM permite el acceso a todo el telencéfalo y regiones que son más desafiantes o imposibles de observar utilizando otras técnicas. La distribución de las capas celulares en el tectum óptico y el cerebelo se puede observar en la Figura 3C. En una sesión de imágenes exitosa, el hueso es visible en el canal THG y las neuronas visibles en el canal de fluorescencia. Para las imágenes de peces cebra adultos, se utilizó la función de cámara del microscopio para localizar a los peces (Figura 3A). Este paso no es necesario para las imágenes cerebrales del ratón, ya que la ventana de vidrio es lo suficientemente grande como para que el cerebro sea fácilmente accesible. Se obtuvieron imágenes estructurales de alta resolución del cerebro adulto del pez cebra utilizando el sistema descrito en las secciones anteriores. El cráneo se ve en el canal THG (Figura 3B), que ayuda a navegar por el cerebro y encontrar la superficie superior. Como se observa en la Figura 3C, las neuronas son distinguibles con una alta relación señal-fondo (SBR) en lo profundo del cerebro adulto. El tejido sobre el cerebro es visible en el canal de fluorescencia debido a la autofluorescencia.
La Figura 4 muestra imágenes 3P multicolores de neuronas marcadas con GCaMP6s (verde) y vasos sanguíneos marcados con Texas Red (rojo) junto con señales THG (azul) en el cerebro de ratón adulto con excitación de 1,340 nm10. Las imágenes se reproducen a partir de trabajos anteriores10. En la Figura 4, la energía del pulso en el foco se mantuvo en ~ 1.5 nJ en toda la profundidad para obtener suficientes señales de fluorescencia y THG, y la potencia láser promedio máxima fue de ~ 70 mW. La duración del pulso se ajustó a ~ 60 fs, y el NA efectivo fue de ~ 0.8. Con la optimización de la configuración de 3PM, se obtuvieron con éxito imágenes de alto contraste de hasta 1,2 mm de la superficie del cerebro, en la región del hipocampo CA1 (Figura 4A, B). La Figura 4C,D muestra rastros de actividad Ca2+ de neuronas marcadas con GCaMP6s a una profundidad de 750 μm durante una sesión de grabación de 10 minutos, mostrando una alta fidelidad de grabación.
Si el láser de excitación está desalineado, se puede observar no uniformidad en el brillo de la señal en todo el campo de visión. Además, si los parámetros del láser, como la duración del pulso, la energía del pulso de excitación en el foco y el NA efectivo, no están optimizados, la imagen THG del cráneo del pez o la ventana de craneotomía del cerebro del ratón no será visible y / o requerirá una alta energía del pulso de excitación (por ejemplo, >2 nJ / pulso en el enfoque). Por lo tanto, las señales THG en la superficie del cerebro se pueden utilizar como un indicador para una configuración optimizada de 3PM antes de comenzar las imágenes de tejido profundo.
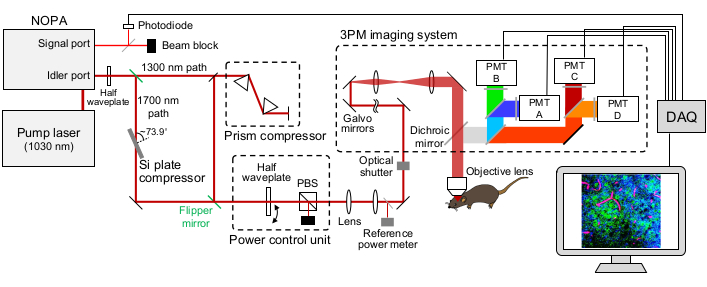
Figura 1: Ilustración esquemática de una configuración de 3PM. La longitud de onda del láser de excitación se establece en ~ 1,300 nm o ~ 1,700 nm, salida del puerto inactivo del NOPA. El compresor de par de prisma y el compresor de placa Si se utilizan para el láser de ~1.300 nm y ~1.700 nm, respectivamente, para prehiltar el pulso láser de excitación. Los rayos láser de ~1.300 nm y ~1.700 nm se pueden conmutar con espejos flipper. El puerto de señal del NOPA se utiliza para obtener la señal de activación. Una media placa de onda y un PBS se utilizan para controlar la potencia de excitación. La fluorescencia y el THG son detectados por los PMT de GaAsP. Se utilizan combinaciones apropiadas de espejos dicroicos y filtros de paso de banda para separar las señales de fluorescencia y THG. Abreviaturas: 3PM = microscopía de tres fotones; NOPA = amplificador paramétrico óptico no colineal; PBS = divisor de haz polarizador; THG = tercera generación armónica; DAQ = adquisición de datos; PMT = tubo fotomultiplicador. Haga clic aquí para ver una versión más grande de esta figura.
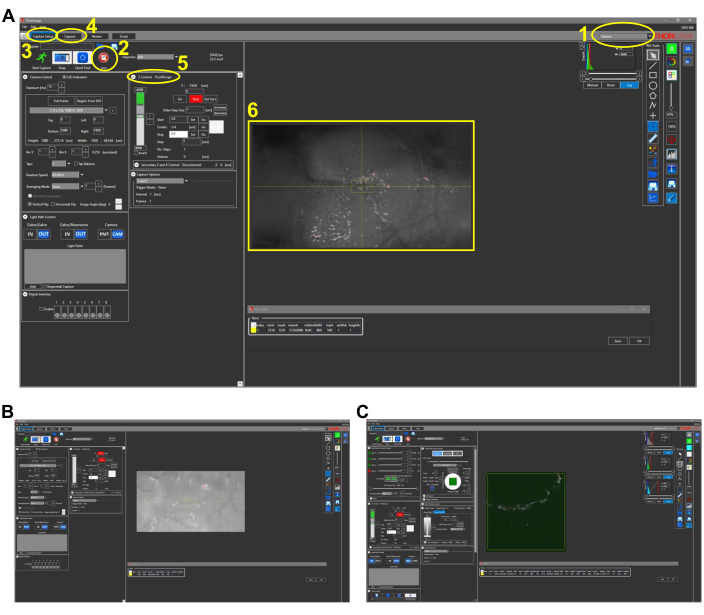
Figura 2: Capturas de pantalla representativas para imágenes intravitales en peces (sección 4.1 del protocolo). (A) Vista en modo de cámara del software de adquisición de imágenes con lente objetivo 4x en su lugar. Las características clave del software se describen y numeran de la siguiente manera: 1. Modo de imagen del software de adquisición de imágenes. Las opciones de modo son Cámara, Multifotón y Multifotón GG. Para obtener imágenes de luz blanca con cámara CCD, se elige el modo Cámara. 2. Al hacer clic en el botón Live se enciende la cámara (o PMT si está en opciones multifotón), y se puede observar una vista en tiempo real del microscopio. 3. En la pestaña Configuración de captura, se establecen los parámetros de imagen deseados (potencia, ubicación, profundidad). 4. En la pestaña Capturar, se asigna una ubicación de carpeta para guardar las imágenes. Las imágenes se pueden iniciar en esta pestaña. 5. El ajuste Z Control controla la profundidad de las imágenes moviendo el motor de la etapa z. 6. Imagen representativa de una cabeza de pez cebra. El lado rostral de la cabeza está a la izquierda. (B) Vista representativa del modo cámara con lente objetivo 25x. (C) Vista representativa del modo Multiphoton GG que contiene la imagen THG de la imagen vista en (B). Abreviaturas: CCD = dispositivo de carga acoplada; PMT = tubo fotomultiplicador; THG = tercera generación armónica. Haga clic aquí para ver una versión más grande de esta figura.
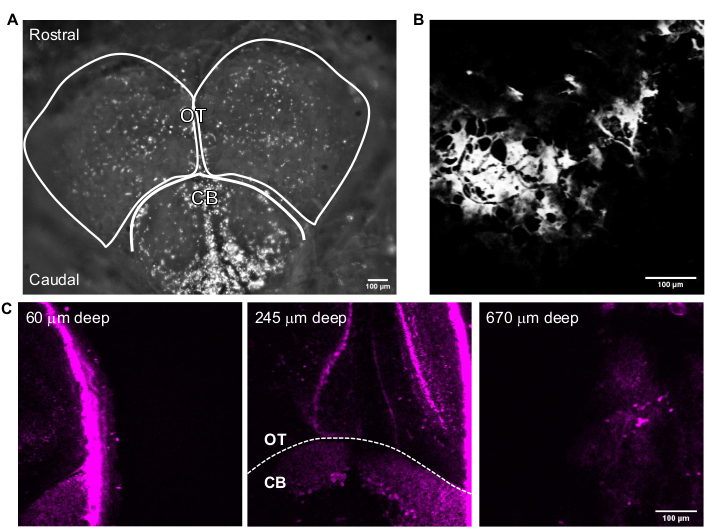
Figura 3: Imágenes representativas del cerebro adulto del pez cebra adquiridas con el software de adquisición de imágenes. (A) Imagen en modo cámara de la cabeza adulta del pez cebra adquirida con una lente de objetivo 4x. La parte superior de la imagen es la dirección rostral. Se delinean los lóbulos OT y CB. (B) Imagen representativa adquirida en modo Multiphoton GG con una lente de objetivo 25x que contiene la imagen THG de (A). (C) Imágenes de fluorescencia del cerebro adulto del pez cebra en la intersección del cerebelo y el tectum óptico donde la GFP se expresa en el citoplasma de las neuronas en varias profundidades. Barras de escala = 100 μm. Abreviaturas: OT = tectam óptico; CB = cerebelo; THG = tercera generación armónica; GFP = proteína fluorescente verde. Haga clic aquí para ver una versión más grande de esta figura.
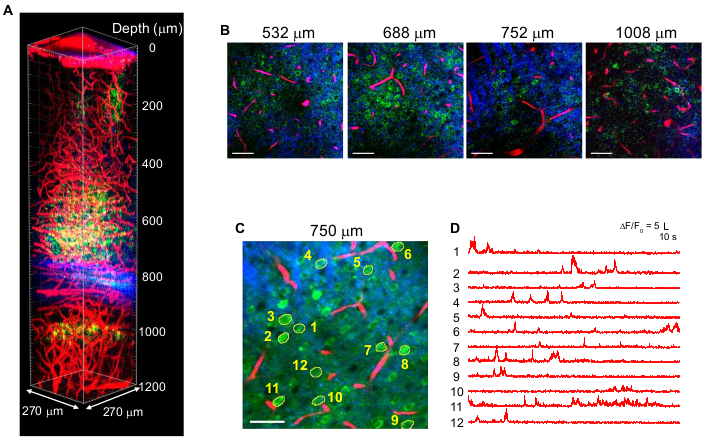
Figura 4: Multicolor 3 PM de neuronas marcadas con GCaMP6s (verde), vasos sanguíneos marcados con rojo de Texas (rojo) y tercera generación armónica (azul) sobre excitación de 1.340 nm en el cerebro del ratón. (A) Imágenes de pila Z de hasta 1.200 μm de la superficie del cerebro con un campo de visión de 270 x 270 μm (512 x 512 píxeles por fotograma). La potencia del láser se varió de acuerdo con la profundidad de la imagen para mantener ~ 1.5 nJ de energía de pulso en el foco. La potencia media máxima del objetivo fue de 70 mW. (B) Imágenes 2D seleccionadas a varias profundidades de imagen. (C) Sitio de registro de actividad a 750 μm debajo de la duramadre con un campo de visión de 270 x 270 μm (256 x 256 píxeles). (D) Rastros de actividad cerebral espontánea registrados en un ratón despierto a partir de las neuronas marcadas indicadas en (C). La velocidad de fotogramas fue de 8,3 Hz, con un tiempo de permanencia de píxeles de 0,51 μs. La tasa de repetición láser fue de 2 MHz, y la potencia promedio bajo la lente del objetivo fue de 56 mW. Cada traza se normalizó a su línea de base y se filtró de paso bajo utilizando una ventana de hamming de 0,72 s constante de tiempo. Barras de escala = 50 μm. Esta figura y la leyenda de la figura se reproducen a partir del 10. Abreviatura: 3PM = microscopía de tres fotones. Haga clic aquí para ver una versión más grande de esta figura.
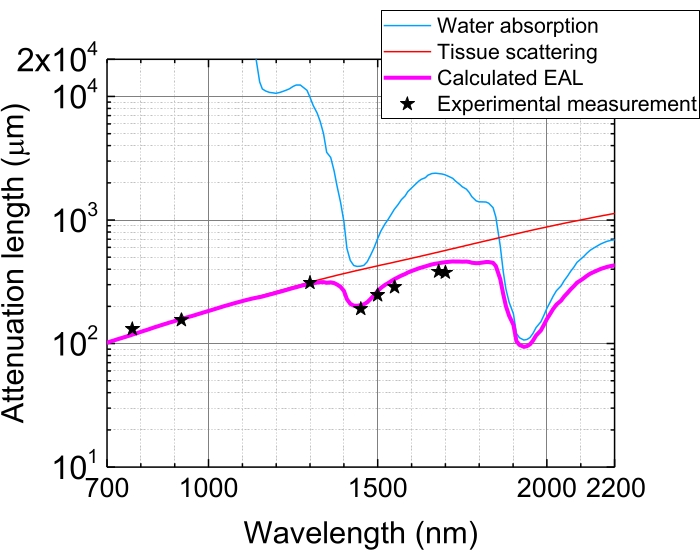
Figura 5: Longitud efectiva de atenuación en la neocorteza del cerebro del ratón. EAL (línea magenta) se calcula a partir de la dispersión del tejido (línea roja) y la absorción de agua en el tejido (línea azul), asumiendo una composición de agua del 75%. Las estrellas negras indican datos experimentales reportados de EAL en la neocorteza del cerebro del ratón 3,21,28,29. Tenga en cuenta que la EAL varía en diferentes tejidos. Abreviatura: EAL = longitud efectiva de atenuación. Haga clic aquí para ver una versión más grande de esta figura.
| Longitud de onda de excitación (nm) | Agua de inmersión | Potencia máxima del láser (mW) | Máxima energía de pulso en el foco* (nJ) | EAL típica en la corteza del ratón (μm) | Profundidad de imagen en la corteza del ratón** (mm) | Energía de pulso bajo el objetivo*** (nJ) | Tasa máxima de repetición láser**** (MHz) |
| 1300 | H2O o D2O |
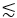 100 100 |
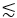 2 2 | ~300 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210 | ~0.5 | |||||
| 2.1 | ~1100 | ~0.1 | |||||
| 1700 | D2O |
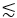 50 50 |
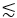 3 3 | ~400 | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2.5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~190 | ~0.3 |
Tabla 1: Condiciones típicas de excitación de 3P para imágenes de la corteza del ratón.
* Con un objetivo de NA alto (~ 1.0), ancho de pulso de ~ 50 fs y fluoróforos típicos como proteínas fluorescentes (por ejemplo, GFP y RFP).
** Con la suposición de que la EAL es uniforme en toda la corteza.
Para lograr ~1 nJ/pulso en el foco, calculado a partir del EAL y la profundidad de la imagen.
Calculado a partir de la energía del pulso bajo el objetivo y la potencia máxima del láser permisivo.
Abreviaturas: 3P = tres fotones; NA = apertura numérica; GFP = proteína fluorescente verde; RFP = proteína fluorescente roja; EAL = longitud efectiva de atenuación.
Discusión
Este protocolo explica los procedimientos paso a paso para configurar imágenes 3P con un microscopio comercial y una fuente láser. En comparación con 2PM, 3PM tiene una ventaja en aplicaciones que requieren acceso óptico en las regiones más profundas, como en el hipocampo cerebral del ratón. Aunque 3PM se usa principalmente en neurociencia, 3PM se puede aplicar potencialmente en otros tejidos como ganglios linfáticos, huesos y tumores para la observación de tejidos profundos.
Es importante verificar que el sistema de imágenes funcione cerca del límite de ruido de disparo, lo que garantiza que la electrónica de detección y adquisición de datos contribuya con un ruido insignificante a la imagen después de los PMT. La incertidumbre en el número de fotones detectados está fundamentalmente limitada por el ruido de disparo de fotones. El rendimiento limitado del ruido de disparo se puede lograr en un microscopio multifotón típico utilizando un fotodetector de alta ganancia (por ejemplo, un PMT). El ruido del disparo de fotones sigue una distribución estadística de Poisson, en la que la desviación estándar de la distribución es igual a la raíz cuadrada de la media de la distribución. Para comprobar el rendimiento limitado del ruido de disparo, siga el paso 1.14 de la sección de protocolo.
Para evitar la atenuación de la luz por H2O, el uso de D2O para la inmersión es útil, particularmente para la excitación de ~ 1,700 nm. Cuando se utiliza D2O, es esencial actualizar D2O cada ~ 10 minutos o usar un gran volumen de D2O para evitar el intercambio de D2O / H2O durante la toma de imágenes. También se puede sellar el D2O del entorno de la habitación3. Si se utiliza una lente de objetivo de larga distancia de trabajo (WD) (por ejemplo, WD a 4 mm o más) para la obtención de imágenes, el espesor del líquido de inmersión puede exceder los 2-3 mm. El aumento del espesor hace que la absorción de H2O no sea despreciable incluso a ~ 1,300 nm21. Por lo tanto, D2O puede ser necesario incluso para 1.300 nm 3PM cuando se utiliza una lente de objetivo WD larga.
Como la intensidad de la fluorescencia 3P depende del cubo de la energía del pulso de excitación en el foco (Eq. (1)), establecer la potencia láser adecuada es particularmente importante para obtener señales de fluorescencia 3P adecuadas al tiempo que se evita el daño térmico y no lineal en los tejidos vivos. La potencia media del láser debe mantenerse por debajo del umbral de daño térmico. En el cerebro del ratón, por ejemplo, para evitar el daño térmico del tejido, la potencia media en la superficie del cerebro del ratón debe mantenerse en o por debajo de ~ 100 mW para ~ 1.300 nm de excitación a una profundidad de 1 mm y con un campo de visión (FOV) de 230 μm x 230 μm21. Del mismo modo, la potencia media a ~1.700 nm debe mantenerse en o por debajo de ~50 mW a ~1 mm de profundidad y un FOV de ~230 μm x 230 μm (datos no publicados). Además, para evitar la saturación de excitación y el daño potencial no lineal, la energía del pulso de excitación debe mantenerse en 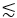 2 nJ y
2 nJ y 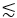 3 nJ para ~ 1,300 nm y ~ 1,700 nm de excitación, respectivamente30.
3 nJ para ~ 1,300 nm y ~ 1,700 nm de excitación, respectivamente30.
Debido a la absorción de luz y la dispersión en los tejidos, la energía del pulso en el foco se atenúa a 1/e (~37%) después de la penetración de los tejidos por 1 EAL. El EAL varía en diferentes tejidos y con las longitudes de onda de excitación, por ejemplo, en la neocorteza del cerebro del ratón, el EAL es de ~300 μm y ~400 μm a ~1.300 nm y ~1.700 nm, respectivamente 3,29 (Figura 5). Por lo tanto, para mantener la misma energía de pulso en el foco (por ejemplo, 1 nJ / pulso) a una profundidad de n EEL, la energía del pulso de superficie debe multiplicarse por 1 nJ × en. Para obtener imágenes rápidas de dinámica estructural y funcional, un láser de excitación con una alta tasa de repetición (a 1 MHz o superior) es deseable para lograr una alta velocidad de fotogramas 5,6,7,10. Sin embargo, el requerimiento de energía de pulso y el límite de potencia promedio del láser restringen la tasa de repetición aplicable.
Por ejemplo, cuando imaginamos una región moderadamente profunda a 4 EEL (es decir, ~ 1.2 mm en la corteza del mouse con excitación de 1,300 nm), se requiere ~ 55 nJ / pulso en la superficie para mantener 1 nJ / pulso enfocado. Cuando la limitación de potencia promedio es de 100 mW, podemos aplicar una tasa de repetición láser de ~ 2 MHz. Sin embargo, para obtener una imagen más profunda a una profundidad de 7 EAL, se requiere ~ 1,100 nJ / pulso en la superficie para mantener 1 nJ / pulso en el enfoque. Suponiendo que la potencia media máxima sea de 100 mW para evitar daños térmicos, la tasa de repetición láser debe reducirse a 0,1 MHz para lograr un pulso de 1.100 nJ/pulso en la superficie. La Tabla 1 resume las condiciones típicas de imagen en la corteza cerebral del ratón. Tenga en cuenta que las profundidades de imagen en la Tabla 1 asumen que el EAL es uniforme en toda la corteza del ratón.
Además, debido a la limitación de potencia del láser en el tejido profundo 3PM, existe una compensación entre la velocidad de fotogramas y el tamaño del píxel de la imagen, lo cual es particularmente importante para las imágenes funcionales, como las imágenes de calcio. La tasa máxima de repetición láser disponible se decide en cada profundidad en función de la energía de pulso requerida en el enfoque y la potencia láser promedio aplicable como se discutió anteriormente, por ejemplo, 2 MHz a una profundidad equivalente a ~ 4 EEL con excitación de 1,300 nm. En general, las imágenes requieren al menos un pulso por píxel. En consecuencia, el tiempo mínimo de permanencia de píxeles disponible está determinado por la tasa de repetición láser, por ejemplo, 0,5 μs / píxel con excitación de 2 MHz.
Para mantener la alta resolución espacial (~1 μm en lateral) en imágenes 3P, es ideal establecer 1 píxel en un área de ~1 μm2, por ejemplo, 256 x 256 píxeles para un FOV de 250 x 250 μm2. Por lo tanto, para realizar imágenes rápidas con un FOV considerablemente grande (por ejemplo, 250 x 250 μm2 con 256 x 256 píxeles), las tasas de repetición de pulsos de 0.5 MHz, 1 MHz y 2 MHz dan velocidades de fotogramas máximas teóricas de ~ 7.6, ~ 15 y ~ 30 cuadros / s, respectivamente. Del mismo modo, la optimización de la tasa de repetición del láser es esencial, dependiendo de la profundidad objetivo, la velocidad de escaneo y el FOV, para aplicar la energía de pulso adecuada por debajo del umbral de daño térmico. Para aumentar la velocidad de imagen, se puede utilizar una fuente de excitación adaptativa para concentrar todos los pulsos de excitación en las neuronas (es decir, regiones de interés) mediante la entrega de pulsos láser a petición a las neuronas31.
3PM es ventajoso en comparación con 2PM en imágenes profundas dentro de tejidos vivos y a través de medios altamente dispersos como un cráneo, huesos y la capa de materia blanca (es decir, la cápsula externa) del cerebro del ratón. La EAL más larga y la excitación no lineal de orden superior de 3PE benefician las imágenes de tejido profundo. Por ejemplo, para obtener imágenes de GCaMP6 en la corteza del ratón, la señal de fluorescencia 2P con excitación de 920 nm es superior a la señal de fluorescencia 3P con excitación de 1.300 nm en regiones poco profundas a 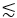 690 μm (es decir, ~ 2.3 EAL a 1.300 nm)21. Sin embargo, debido a la EAL más larga a 1.300 nm en comparación con 920 nm, 3PE da una fluorescencia más fuerte que la excitación 2P (2PE) a una profundidad de ~ 690 μm ymás profunda 21. Esta profundidad se define como "profundidad de cruce de señal", en la que las intensidades de señal de fluorescencia de 2PE y 3PE son idénticas con la misma tasa de repetición y las mismas potencias medias máximas permitidas21. La profundidad de cruce de la señal depende de las longitudes de onda de excitación para 2PE y 3PE y el fluoróforo.
690 μm (es decir, ~ 2.3 EAL a 1.300 nm)21. Sin embargo, debido a la EAL más larga a 1.300 nm en comparación con 920 nm, 3PE da una fluorescencia más fuerte que la excitación 2P (2PE) a una profundidad de ~ 690 μm ymás profunda 21. Esta profundidad se define como "profundidad de cruce de señal", en la que las intensidades de señal de fluorescencia de 2PE y 3PE son idénticas con la misma tasa de repetición y las mismas potencias medias máximas permitidas21. La profundidad de cruce de la señal depende de las longitudes de onda de excitación para 2PE y 3PE y el fluoróforo.
En la práctica, la excitación de 920 nm permite una potencia láser promedio más alta que la excitación de 1.300 nm debido a una menor absorción de agua. Sin embargo, la mayor potencia promedio de 2PE empujaría la profundidad de cruce de la señal solo en 0.9 EALs4. Además, cuando la muestra está densamente etiquetada, 3PE tiene la ventaja adicional de un SBR mucho más alto. Por lo tanto, incluso antes de alcanzar la longitud de cruce de la señal, 3PM puede ser mejor para la imagen que 2PM. Por ejemplo, cuando se toman imágenes de la vasculatura cerebral del ratón, que tiene una fracción de volumen (es decir, densidad de etiquetado) de ~ 2%, 1,300 nm 3PM con una potencia de excitación de 100 mW supera los 920 nm 2PM con una potencia de excitación de 200 mW a una profundidad de ~ 700 μm para la fluoresceína.
3PM también tiene una ventaja cuando se obtienen imágenes a través de una capa delgada pero altamente dispersa que puede distorsionar la función de dispersión de puntos del haz de excitación y generar un fondo de desenfoque4. Por ejemplo, a través del cráneo intacto del cerebro del ratón, las imágenes 2PM sufren del fondo de desenfoque incluso a poca profundidad de <100 μm de la superficie del cerebro13. Se observó un fondo de desenfoque similar en 2PM con excitación de 1.280 nm a través de la materia blanca en el cerebro del ratón32. Por lo tanto, cuando los tejidos se visualizan a través de capas turbias, 3PM es preferible a 2PM para imágenes de alto contraste, independientemente de la densidad de etiquetado.
Recientemente informamos un análisis fantasma y teórico de cuentas que muestra que el límite de profundidad de imagen de 3PM es superior a 8 EAL33; 8 EEL equivalen a ~3 mm con ~1.700 nm de excitación en la corteza del ratón. Sin embargo, el láser actualmente disponible no tiene suficiente energía de pulso para lograr 8 EAL en el cerebro del ratón. Un mayor desarrollo de láseres más fuertes empujará el límite de profundidad de imagen actual de 3PM.
Divulgaciones
Los autores no declaran intereses contrapuestos.
Agradecimientos
Este trabajo fue apoyado por NSF DBI-1707312 Cornell NeuroNex Hub y NIH 1U01NS103516.
Materiales
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
Referencias
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados