Method Article
Sağlam Fare ve Zebra Balığı Beyinde Derin Doku Üç Fotonlu Floresan Mikroskopisi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Üç foton mikroskopisi, fare ve zebra balığı beyinleri gibi canlı biyolojik dokuların derinliklerinde, yüksek uzaysal zamansal çözünürlükte yüksek kontrastlı floresan görüntüleme sağlar.
Özet
İki foton mikroskobu (2PM) ve üç foton mikroskobu (3PM) gibi multifoton mikroskopi teknikleri, hücre altı çözünürlükte derin doku in vivo görüntüleme için güçlü araçlardır. 3PM, biyoloji laboratuvarlarında yaygın olarak kullanılan 2PM'ye göre derin doku görüntüleme için iki önemli avantaja sahiptir: (i) ~ 1.300 nm veya ~ 1.700 nm uyarma lazeri kullanılarak saçılma dokularında daha uzun zayıflama uzunluğu; (ii) daha yüksek dereceli doğrusal olmayan uyarma nedeniyle daha az arka plan floresan üretimi. Sonuç olarak, 3PM, kortikal katmanlardan hipokampusa ve yetişkin zebra balıklarının tüm ön beynine kadar bozulmamış fare beyni gibi saçılma dokularının derinliklerinde yüksek kontrastlı yapısal ve işlevsel görüntülemeye izin verir.
Bugün, 3PM için uygun lazer kaynakları ticari olarak temin edilebilmekte ve mevcut iki fotonlu (2P) görüntüleme sisteminin üç fotonlu (3P) bir sisteme dönüştürülmesini sağlamaktadır. Ek olarak, birden fazla ticari 3P mikroskop mevcuttur, bu da bu tekniği biyoloji araştırma laboratuvarları için hazır hale getirir. Bu makale, özellikle zaten 2P kurulumuna sahip biyoloji gruplarını hedefleyen tipik bir 3PM kurulumunun optimizasyonunu göstermektedir ve bozulmamış fare ve yetişkin zebra balığı beyinlerinde intravital 3D görüntülemeyi göstermektedir. Bu protokol, mikroskop hizalaması, ~ 1.300 ve ~ 1.700 nm lazer darbelerinin ön cıvıltıları, hayvan hazırlığı ve yetişkin zebra balığı ve fare beyinlerinin derinliklerinde intravital 3P floresan görüntüleme dahil olmak üzere 3P görüntülemenin tam deneysel prosedürünü kapsar.
Giriş
Yaşam bilimlerinde, 2PM ve 3PM gibi çoklu foton mikroskopisi (MPM) teknikleri, yüksek uzaysal zamansal çözünürlük ve saçılma dokularında yüksek kontrast ile derin in vivo görüntüleme için güçlü araçlar olmuştur. Ek olarak, bu yöntemler tek fotonlu konfokal mikroskopi 1,2,3,4 ile karşılaştırıldığında daha az fotobeyazlatmaya neden olur. 3PM, iki ana özellik nedeniyle 2PM ile karşılaştırıldığında daha derin doku görüntülemesi için avantajlıdır: (i) daha uzun dalga boyu uyarımı (~1.300 nm veya ~1.700 nm) istihdamı doku saçılımını azaltır ve (ii) istenmeyen arka plan floresansını baskılayan daha yüksek dereceli uyarma işlemi (yani, floresan sinyali, 2PM'deki uyarma gücünün karesi yerine 3PM'deki uyarma gücünün küpüne bağlıdır) 3PM'de uyarılma gücüne bağlıdır3 . Sonuç olarak, 3PM, bozulmamış bir yetişkin fare beynindeki hipokampus 3,5,6,7,8,9,10,11 ve Ca2+ dahil olmak üzere yetişkin zebra balığı 12'nin tüm ön beyni gibi canlı dokuların daha derin bölgelerinde yüksek kontrastlı görüntüleme sağlar. aktivite kaydı ve çok renkli gözlemler. Ayrıca, fare ve yetişkin zebra balığı12,13'ün bozulmamış kafatasları aracılığıyla 3PM ile yüksek kontrastlı görüntüler elde edilmiştir.
Bugün, ~ 1.300 ve ~ 1.700 nm'de 3P uyarma (3PE) için uygun uyarma lazer kaynakları ticari olarak temin edilebilir. Lazer tarama sistemi esasen 2PM ve 3PM için aynı olduğundan, mevcut bir 2P kurulumunu 3P kurulumuna dönüştürmek, biyoloji laboratuvarlarında 3PE için ticari olarak temin edilebilen bir lazerin kurulmasıyla mümkündür. 3P floresan sinyali, objektif lensin lazer gücüne, darbe süresine, lazer tekrarlama hızına ve sayısal açıklığına (NA) bağlıdır. Kırınım sınırlı bir odağın (yani, objektif lensin arka açıklığının uyarma ışını tarafından aşırı doldurulduğunu) varsayarsak, Eq (1), 3PE'den kaynaklanan odak hacminden gelen zaman ortalamalı floresan foton akısını tanımlar.
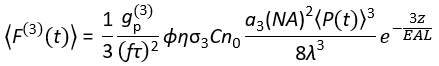 (1)
(1)
Burada f, lazer tekrarlama hızıdır, τ lazer darbe süresidir (maksimum yarıda tam genişlik), φ sistem toplama verimliliğidir, η floresan kuantum verimliliğidir, σ3P absorpsiyon kesitidir, C florofor konsantrasyonudur, n0 numune ortamının yansıtıcı indeksidir (örneğin, su), λ vakumdaki uyarma dalga boyudur, NA, objektif lensin sayısal açıklığıdır, 3, odak hacminin uzamsal entegrasyon sabitidir, 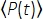 objektif lensin altındaki zaman ortalamalı uyarma foton akısıdır (fotonlar / s), z görüntülenen derinliktir ve EAL etkili zayıflama uzunluğu14'tür. Burada EAL'nin (tipik olarak 100 μm'>) mikroskopun eksenel çözünürlüğünden çok daha büyük olduğunu varsaydık (tipik olarak 10 μm'<). Paraksiyel yaklaşım altında,3 28.114'e eşittir. g p(3), uyarma kaynağının 3. dereceden zamansal tutarlılığıdır ve gp(3), hiperbolik-sekant-kareli darbeler ve gaussian darbeler için sırasıyla 0.41 ve 0.51'dir. φ toplama verimliliği, objektif lens tarafından floresan toplanması, objektif lensin geçirgenliği, dikroik aynanın yansıtıcılığı, filtrelerin geçirgenliği ve dedektörün algılama verimliliği (örneğin, fotoçarpan tüpü veya PMT) dikkate alınarak tahmin edilebilir. 3P floresan yoğunluğu çeşitli parametrelere büyük ölçüde bağlı olduğundan, 3P floresan sinyallerini en üst düzeye çıkarmak için 3P kurulumunun optimizasyonu gerekir.
objektif lensin altındaki zaman ortalamalı uyarma foton akısıdır (fotonlar / s), z görüntülenen derinliktir ve EAL etkili zayıflama uzunluğu14'tür. Burada EAL'nin (tipik olarak 100 μm'>) mikroskopun eksenel çözünürlüğünden çok daha büyük olduğunu varsaydık (tipik olarak 10 μm'<). Paraksiyel yaklaşım altında,3 28.114'e eşittir. g p(3), uyarma kaynağının 3. dereceden zamansal tutarlılığıdır ve gp(3), hiperbolik-sekant-kareli darbeler ve gaussian darbeler için sırasıyla 0.41 ve 0.51'dir. φ toplama verimliliği, objektif lens tarafından floresan toplanması, objektif lensin geçirgenliği, dikroik aynanın yansıtıcılığı, filtrelerin geçirgenliği ve dedektörün algılama verimliliği (örneğin, fotoçarpan tüpü veya PMT) dikkate alınarak tahmin edilebilir. 3P floresan yoğunluğu çeşitli parametrelere büyük ölçüde bağlı olduğundan, 3P floresan sinyallerini en üst düzeye çıkarmak için 3P kurulumunun optimizasyonu gerekir.
Bu protokol, özellikle 2P kurulumuna sahip olan ve kapasitesini 3P görüntülemeye genişletmeyi veya ticari 3P kurulumlarını optimum performansta sürdürmeyi planlayan biyoloji laboratuvarları için yararlı olacak tipik bir 3P kurulumunun optimizasyon sürecini göstermektedir. Bu video makalesi aynı zamanda canlı hayvan beyinlerinde derin doku 3P görüntülemeyi de göstermektedir. İlk bölüm, ticari olarak temin edilebilen bir lazer kaynağı ve çoklu foton mikroskobu ile tipik bir 3P kurulumunun optimizasyonunu ele almaktadır. İkinci ve üçüncü bölümler, nöronal yapıların ve aktivitelerin 3PM için sırasıyla zebra balığı ve fare hazırlığını açıklar. Fare kraniyotomisi ameliyatı daha önce protokol belgelerinde de15,16,17 olarak bildirilmiştir. Dördüncü bölüm, zebra balığı ve fare beyinlerinde intravital 3P görüntülemeyi göstermektedir.
Protokol
Zebra balığı ve fareler için tüm hayvan deneyleri ve barınma prosedürleri, Cornell Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) kılavuzuna uygun olarak onaylanmış ve yürütülmüştür. Zebra balığı ve fareler, deneyden sonra sırasıyla yüksek konsantrasyonlu trikain çözeltisi ve karbondioksit boğulması ile ötenazi yapıldı.
1. Üç fotonlu mikroskopi kurulumunun optimizasyonu
NOT: Göz koruması için lazer güvenlik gözlükleri takın. Optik yerleştirildiğinde veya hareket ettirildiğinde lazer ışınını bir ışın engelleyici ile engelleyin. Lazeri görselleştirmek için kızılötesi görüntüleyici veya kızılötesi dedektör kartı kullanın.
- Lazeri açın ve kollineer olmayan optik parametrik amplifikatörün (NOPA) avara çıkışının merkez dalga boyunu ~1.300 nm veya ~1.700 nm olarak ayarlayın.
- Tetikleyici sinyaller elde etmek için lazer ışınının küçük bir kısmını bir Si fotodiyotuna yansıtmak için NOPA'nın sinyal portundan (yani, ~ 700-900 nm) ışın hattına ince bir kapak camı yerleştirin (Şekil 1). Kapak camının iletim yoluna bir ışın engelleyici yerleştirin.
- Darbe süresini 15:00 için optimize etmek üzere femtosaniye lazeri önceden şekillendirmek için darbeli kompresörleri ışık yoluna yerleştirin. ~1.300 nm ışın için,18,19 prizma çifti kompresör yerleştirin (örneğin, N-SF11 prizma çiftleri). ~ 1.700 nm lazer için,20 kalınlığında ~ 3 mm'lik bir Si plakası yerleştirin. Lazer geçirgenliğini en üst düzeye çıkarmak için Si plakası ile lazer yolu arasındaki açıyı Brewster'ın açısında (1.700 nm için ~ 73.9 °) ayarlayın. Yansımayı en aza indirerek Brewster'ın açısını elde etmek için Si plakasını döndürün.
- ~1.300 nm ve ~1.700 nm ışın hatları arasında rahat geçiş sağlamak için paletli aynalar yerleştirin.
- Lazerin yoğunluğunu kontrol etmek için bir dönme aşamasına ve polarize edici bir ışın ayırıcıya (PBS) monte edilmiş bir yarım dalga plakası (örneğin, ~ 1.300 ve ~ 1.700 nm için uygun bir akromatik yarım dalga plakası) yerleştirin. PBS'nin yansıma yoluna bir ışın engelleyici yerleştirin.
NOT: Yüksek bir yok olma oranı elde etmek için lazerin PBS'den dik olarak geçmesi gerekir. 3PM için lazer gücü, yarım dalga plakasını döndürerek kontrol edilir. - Lazer ışınının küçük bir kısmını bir güç ölçere yansıtmak için güç denetleyicisinden sonra ve optik deklanşörden önce ışık yoluna ince bir kapak camı yerleştirin. Görüntüleme sırasında objektifin altındaki lazer gücünü hesaplamak için güç ölçeri bir 'referans güç ölçer' olarak kullanın (bkz. adım 1.12).
- Işını 3PM sistemine yaymak için aynaları ayarlayarak lazer yolunu hizalayın.
- Çeviri aşamasında bir bıçak kenarı ve bir güç ölçer kullanarak ışın boyutunu hedefin arka açıklığının konumunda ölçün. Kiriş boyutunun çok küçük veya çok büyük olmadığından emin olun.
NOT: Tipik olarak, ışın, derin doku görüntüleme için yüksek güç verimi elde etmek için yüksek NA objektif lensinin biraz altında doldurulur. Örneğin, Olympus objektifinin arka diyafram açıklığında ~10-13 mm (1/e2) ışın boyutu (~15 mm arka diyafram çapı) ~0,7-0,9 etkili bir NA elde edilmesine yardımcı olur. Işın boyutu çok küçük olduğunda, 3P sinyali zayıflar ve düşük etkili NA nedeniyle uzamsal çözünürlük kötüleşir. Işın boyutu çok büyük olduğunda, hedefin arka açıklığındaki güç kaybı nedeniyle hedefin altındaki mevcut maksimum uyarma gücü zayıflar. Derin doku görüntülemesi için, marjinal ışınlar da dokudaki daha uzun yol nedeniyle daha yüksek bir kayba uğrarlar. - Hedefin arka diyaframındaki ışın boyutu uygun değilse, ışın boyutunu ayarlamak için dışbükey lensler gibi uygun optik elemanları lazer ışını yoluna yerleştirin.
NOT: Gereksiz güç kaybını önlemek için lazer ışınının galvo aynalardan daha büyük olmadığından emin olun. - Objektif lensi 3PM kurulumuna yerleştirin.
- Bir otokorelatör kullanarak hedeften sonraki nabız süresini ölçün. Darbe süresi çok uzunsa (ör. >70 fs) daha kısa darbeler elde etmek için darbeli kompresörü ayarlayın. 3PM için ~ 50-70 fs darbeleri ve otokorelasyon ölçümleri için gecikmeyi sağlamak için lazer ile objektif arasına yerleştirilmiş bir Michelson interferometresi kullanın.
NOT: Hedefin odağına yerleştirilen uygun spektral tepkiye sahip bir fotodiyot (örneğin, 1.200 nm'den daha büyük dalga boyu için bir silikon fotodiyot), doğrusal olmayan bir dedektör olarak rahatça hizmet edebilir ve fotodiyottan gelen iki foton fotoakımı, otokorelasyon izlerini elde etmek için kullanılabilir20. ~1.300 nm için prizma çifti kompresör iki şekilde ayarlanabilir: (1) iki prizma arasındaki mesafeyi değiştirmek; (2) Prizma camındaki lazer ışınının yol uzunluklarını, prizmayı prizmanın taban çizgisine dik olarak hareket ettirerek değiştirmek. ~1.700 nm için Si plakalı kompresör, Si plakası daha kalın veya daha ince bir Si plaka ile değiştirilerek ayarlanabilir. - Objektif lensin çıkışına bir güç ölçer yerleştirin. Hedefin altındaki lazer gücünü ölçün ve referans güç ölçerin değerini okuyun (adım 1.6'dan itibaren). Hedefin altındaki ve referans güç ölçerdeki gücün oranını hesaplayın.
NOT: Görüntüleme sırasında, hedefin altındaki gerçek lazer gücü, güç oranından ve referans güç ölçerin değerinden hesaplanabilir. - Güç ölçeri hedefin altından çıkarın.
- [İsteğe bağlı] Görüntüleme sisteminin foton çekim gürültüsünün sınırlı performansını doğrulayın
NOT: Bu görevi yerine getirmek için aşağıdaki elementlere ihtiyaç vardır: 1) bir floresein veya Teksas Kırmızısı boya havuzu (örneğin, ~ 10 μM), 2) bir foton sayacı ve 3) bir osiloskop.- Boya havuzu örneğini 3PM objektif lensin altına yerleştirin.
- Objektif lensin, mesafe objektif lensin çalışma mesafesinden daha az olana kadar dikkatlice boya havuzuna indirin.
- Lens ile boya havuzunun kapak camı arasına su yerleştirin.
- Boya havuzunun yüzeyini bulmak için mikroskobun çıkış gücünü küçük bir miktara (örneğin, ~ 1 MHz darbe tekrarlama hızına sahip <1 mW) ayarlayın.
- Mikroskopun Canlı oturumunu başlatın ve z konumunu sıfıra ayarlayın.
- Boya havuzunun tepesine ulaşmak için hedefi numuneden yavaşça uzaklaştırın (kapak camı tarafından üretilen üçüncü harmonik nesil (THG) ile belirtildiği gibi).
- Kapak camının konumunda z konumunu sıfıra ayarlayın.
- Floresan kanalında net bir floresan sinyali görünene kadar hedefi hafifçe indirin.
- PMT'nin çıkışını bir BNC ayırıcıya bağlayın. Bölücünün çıkışlarını foton sayacına ve görüntü alma sistemine bağlayın.
- Lazer gücünü, saniyedeki foton sayımlarının lazer tekrarlama hızının% 5'inden daha düşük olduğu bir değere ayarlayın (örneğin,
 1 MHz lazer kullanıldığında 50.000 foton / s).
1 MHz lazer kullanıldığında 50.000 foton / s). - Yazılımla görüş alanını mümkün olan en aza indirin ve parlaklığın görüntü boyunca eşit olmasını sağlayın.
- Kare hızını saniyede 1,0 kareye ayarlayın.
- Foton sayacının alma süresini t = kare başına piksel sayısı × piksel bekleme süresi ve uygun bir ayırıcı düzeyi olarak ayarlayın.
- Foton sayısını ve piksel sayımlarını eşdeğer bir süre boyunca aynı anda toplayın. Piksel sayısını elde etmek için, tüm görüntünün ortalama piksel değerlerinin yanı sıra ortalama ve standart sapma değerlerini de toplayın.
- Karanlık foton sayısını ve piksel sayımlarını elde etmek için uyarma lazerini engelleyerek 1.14.14 adımını tekrarlayın.
- Yazılımın Canlı olarak edinilmesini durdurun.
- Karanlık sayımları (adım 1.14.15'te elde edilen) foton sayımlarından (adım 1.14.14'te elde edilen) ve toplam piksel sayısından (adım 1.14.14'te elde edilen) çıkarın.
- Karanlıktan çıkarılan toplam piksel sayısını, karanlıktan çıkarılan foton sayısına bölün (adım 1.14.17'de elde edilmiştir). Elde edilen değeri, bir piksel değerinden bir foton sayısına kadar 'dönüşüm faktörü' (yani, piksel değerleri/foton) olarak kullanın.
- Piksel sayımlarının ortalama ve standart sapmasını (adım 1.14.14'te elde edilen) foton sayımlarına dönüştürün, yani bunları 'dönüşüm faktörüne' bölün (adım 1.14.18'de elde edildi). Foton sayımlarının ortalama ve standart sapmasını karşılaştırın. Görüntüleme sistemi performansı çekim gürültüsü sınırına yakınsa, standart sapmanın yaklaşık olarak foton sayımlarının ortalamasının kareköküne eşit olduğundan emin olun.
- [İsteğe bağlı] Mikroskopun sinyal algılama verimliliğini doğrulayın.
- Mikroskop performansını ve sinyal algılama verimliliğini test etmek için, foton sayımlarını elde etmek üzere 1.14.1-1.14.17 adımlarını izleyin. Adım 1.14.15 için, boya için çözücüden yapılmış boş bir numune oluşturun ve lazer açıkken ve boya havuzuyla aynı güçte boş numune için foton sayımlarını elde edin. Floresan foton sayımlarını elde etmek için boya havuzundan foton sayımlarından boş sayımları çıkarın.
- Beklenen foton sayımlarını hesaplamak için floresein veya Texas Red10,22 ve Eq. (1)'in bilinen 3P kesitlerini kullanın (arka diyafram açıklığının düzgün bir şekilde dolmasını hesaba katmak için etkili bir NA ile) ve ardından hesaplanan değeri deneysel olarak ölçülen foton sayımlarıyla karşılaştırın. Her iki foton sayımını da gelecekteki referanslar için mikroskop için test sonuçları olarak laboratuvar not defterine kaydedin.
NOT: Hesaplanan ve ölçülen değerlerin birbirine yakın olduğundan emin olun (örneğin, 2 faktörü içinde). Sistemin bu tür nicel testleri, zaman içinde tutarlı görüntüleme performansı sağlamak için özellikle yararlıdır.
2. 3PM için balık hazırlığı
NOT: Bu prosedür için eldiven ve laboratuvar önlüğü giyin. Deneye göre yetişkin zebra balığını seçin. Tüm hazırlığı (2.1 ila 2.7. adımlar) ~ 15 dakika içinde bitirin.
- ~ 0,5 cm% 2 yüksek erime noktalı agar içeren bir Petri kabı hazırlayın. Agardaki dikdörtgen bir deliği balıktan daha uzun ve biraz daha geniş kesin. Petri kabına ince borular (suyun balığın ağzına perfüzyonu için) dikdörtgende bir ucu olacak şekilde tutturmak için balmumu kullanın. Petri kabının kenarına daha büyük çaplı borular (suyun giderilmesi için) bağlamak için balmumu kullanın.
- Deney için balık seçin. Balıklar tamamen tepkisiz ve derin anestezi altına alınana kadar Hank çözeltisinde 0.2 mg/mL trikain çözeltisi (pH 7.2) ile balıkları uyuşturun.
- Balığı yan tarafına ıslak bir sünger üzerine yerleştirin. Bir mikroşırınga kullanarak, balıkları felç etmek için retro-orbital olarak 3 μL pankuronyum bromür (Hank çözeltisinde 0.4 μg / μL) enjekte edin. Tamamen felç olduğundan emin olmak için balıkları Hank'in çözeltisine kısaca yerleştirin.
- Balık sırtını Petri kabına yan yana doğru yerleştirin, baş boruya doğru yerleştirin. Boruyu manipüle etmek için forseps kullanarak, balığın ağzını yavaşça açın ve tüpü ağzına kaydırın. Balıkları yavaşça boruya doğru kaydırın, böylece boru balığın ağzının arkasında olacaktır.
- Agar'ı balığın etrafında hızlı ama nazikçe kurutun ve balığın üstündeki suyu çıkarın. Küçük bir laboratuvar dokusu parçasını laboratuvar yapıştırıcısına batırın ve dokuyu balığın her iki tarafındaki agarın üzerine ve balığın sırt kaudalinin üzerinden solungaçlara koyun.
NOT: Balığın üzerine bastırmayın veya basınç uygulamayın. Solungaçlara yapıştırıcı takılmamasına dikkat edin. - Lazerin cilde temas edeceği bölgede görüntüleme sırasında balıkları uyuşturmak için doğrudan başın yüzeyine küçük bir damla bupivakain uygulayın.
- Petri kabını balıkla birlikte mikroskopa getirin ve balık tesisi suyuyla doldurun. Sistem suyunu balığın ağzına 2 mL/dak'da pompalamak için boruyu bir su pompasına bağlayın ve aynı anda perfüzyon çözeltisini çanaktan aynı hızda çıkarın. Suyun bir kabarcıkla oksijenlendiğinden ve bir akvaryum ısıtıcısıyla ~ 30 ° C'ye ısıtıldığından emin olun.
NOT: Balıklar artık görüntüleme için hazırdır. Görüntüleme sırasında üçüncü harmonik jenerasyon (THG) sinyalindeki kan akışını izleyerek balığın sağlığını izleyin (bkz. bölüm 4.1). 3P görüntüleme, sanal gerçeklik23 sırasında görüntüleme sırasında kafayı sabitlemek ve vücut hareketlerine izin vermek için 2P görüntülemede kullanılanlar gibi daha sofistike balık preparatlarıyla da uyumlu olmalıdır. Bu tamamen invaziv olmayan görüntüleme, omurgalıların diğer çalışmalarında tipik olduğu gibi kafatası çıkarılması ihtiyacını önler ve invaziv araştırmaları ve ilişkili ağrıyı en aza indirmeye yönelik bir adımdır.
3. 3PM için fare hazırlığı
NOT: Aşağıdaki prosedürler sırasında eldiven, cerrahi maske ve laboratuvar önlüğü giyin. Denemeye göre fare çizgisini seçin. Fare, ameliyattan önce 12:12 saatlik bir açık-karanlık döngüsünün altına yerleştirilmelidir. Tüm ameliyat (adım 3.2-3.11) aseptiktir ve tüm cerrahi aletler kullanımdan önce sterilize edilmelidir. Kraniotomi ~ 1 saat sürer.
- Temiz parafilm üzerine çörek şeklinde (4,5-6,5 mm çaplı) bir kapak kayması ve bir kapak kaydırma diski (5 mm çapında) yerleştirin. Çörek şeklindeki örtü kapağını kapak kayma diskine yapıştırmak üzere az miktarda optik yapıştırıcı uygulamak için bir iğne kullanın. Parafilm üzerindeki disk-çörek kapağını ultraviyole ışık altında 10-20 dakika boyunca kürleyin. Tüm disk çörek kapağını parafilmden çıkarın ve fazla yapıştırıcıyı çizmek için cımbız ve kalıntıları gidermek için% 70 etanol kullanın.
NOT: Kapak kapakları ~0,17 mm kalınlığındadır. Çörek şeklindeki örtü kayması, kronik görüntüleme için beyne uygun basıncı uygulamak için kullanılır. - Fareyi bir indüksiyon odasında% 3 izofluran ve%20 O2 gaz karışımı ile uyuşturun. Fareyi tartın. Fareyi bir ısıtma yastığı üzerinde eğilimli bir konuma getirin. Isıtma yastığının sıcaklığını ~ 37 ° C'ye ayarlayın.
- Üst dişleri, anestezik bir maskenin yerleştirilmesiyle stereotaksik bir aparatın ağız deliğine sabitleyin. Kulak çubuklarını kulaklara sabitleyin. Ameliyat sırasında anesteziyi %2 izofluran ve %20O2 gaz karışımı ile sürdürün.
NOT: Farenin tepkisini izleyerek izofluran konsantrasyonunu ayarlayın. Solunum hızını izleyerek (derin uyku için ~ 1 Hz) ve ameliyattan önce herhangi bir reaksiyonu kontrol etmek için ayakları sıkıştırarak anestezi seviyesini kontrol edin. - Yağlama için gözlere göz merhemi uygulayın. Göz kapaklarını kapatın. Tüm ameliyat ışıklarını açın. Ameliyattan önce fare vücut ağırlığına bağlı olarak deri altından ketoprofen, deksametazon ve glikopirolat enjekte edilir.
NOT: İlaç dozları ketoprofen, deksametazon ve glikopirolat için sırasıyla 2 mg / mL, 0.1 mg / mL ve 0.1 mg / mL'dir. Ketoprofen, deksametazon ve glikopirolat için enjeksiyon hacimleri vücut ağırlığına bağlıdır ve sırasıyla 2.5 μL / g, 2 μL / g ve 2 μL / g'dir. - Başın tepesindeki ve kulakların yakınındaki tüyleri çıkarın.
- Makas veya saç kesme makinesi ile mümkün olduğunca fazla saç klipsleyin ve kırpılan saçları ameliyat bölgesinden çıkarın.
- Uygun miktarda tüy dökücü krem uygulayın. 1 dakika bekleyin.
- Tuzlu suya batırılmış bir pamuklu çubuk kullanarak saç ve kremi çıkarın.
- Saç tamamen alınana kadar 3.5.2 ve 3.5.3 adımlarını tekrarlayın.
- Bölgeyi temizlemek için cilde% 5 povidon-iyot çözeltisi ve% 70 etanol uygulayın. İşlemi üç kez tekrarlayın.
- Kafaya deri altı atropin enjeksiyonu (vücut ağırlığına göre doz, 0.02-0.05 mg / kg) verin. 1 dakika bekleyin.
- Kafatasını ortaya çıkarmak için başın tepesindeki cildi kesin. Hem bregma noktasının hem de lambda noktasının açığa çıktığından emin olun. Sondaj tozunun cildin altına girmesini önlemek için biyouyumlu yapıştırıcı kullanarak kenarda kalan cilt dokusunu kafatasına yapıştırın (bu da bir bağışıklık tepkisi ortaya çıkarabilir).
- İlgilenilen alanın üzerine 5 mm çapında bir daire çizmek için cerrahi bir işaretleyici kullanın. Örneğin, somatosensoriyel korteksin ve görsel korteksin çoğunu kaplayan bregmaya ~ 2.5 mm lateral ve 2 mm kaudal alanın merkezini seçin.
- Daire boyunca yavaşça delin ve yarı yolda bittiğinde kafatasını nemlendirmek için salin uygulayın. Son yarım için delme hızını yavaşlatın ve kafatasını çıkarmadan önce kafatasını salinle örtün. Kafatasını forseps ile nazikçe açın ve beyindeki kanamayı hemen durdurmak için saline batırılmış küçük bir steril jel köpük parçası uygulayın. Salin kullanarak beyni nemli tutun.
- Hazırlanan disk-çörek kapağının beyin dokusuna bakan tarafına bir damla salin uygulayın. Disk-çörek kapağının çıkıntılı disk kısmını kafatası penceresine yerleştirin. Stereotaksik aparat tarafından tutulan uzun bir çubuk kullanarak, kapak kayması kafatası penceresinin disk kısmını beyin yüzeyine hafifçe bastırın ve çörek kısmının kafatasını sıkıca örtmesini sağlayın. Disk-çörek kapağının etrafındaki alanı pamuklu çubukla kurulayın.
- Çörek şeklindeki kenarın altına biyouyumlu bir yapıştırıcı tabakası uygulayın. Disk-çörek örtü kapağının çörek kısmının altına ve etrafına bir diş çimento karışımı tabakası uygulayın. Diş çimentosunun üzerine başka bir yapıştırıcı tabakası uygulayın. % 5 glikoz (vücut ağırlığına dayalı doz, 10 μL / g), hayvan enerjisini sağlamak için ameliyat sırasında her saat başı deri altından enjekte edilebilir.
- Anestezi sistemini kapatın. Fareyi stereotaktik cihazdan serbest bırakın. Fareyi derhal ~ 37 ° C'de bir ısıtma yastığı ve bir anestezi aparatı ile özelleştirilmiş kompakt bir stereotaktik aparata aktarın.
- Fareyi, özelleştirilmiş kompakt stereotaksik aparatın ısıtma yastığı üzerinde eğilimli bir konuma getirin. Sıcaklığı ~37 °C olarak ayarlayın. Üst dişleri stereotaktik aparatın ağız deliğine ve kulak çubuklarını farenin kulaklarına sabitleyin. Anestezik tüpleri takın ve% 1.5 izofluran ve% 20 O2 gaz karışımı ileanesteziyi sürdürün.
NOT: Fare artık görüntüleme için hazırdır. Aşağıdaki görüntüleme prosedürleri sırasında fareyi anestezi altında tutun. Farenin tepkisini izleyerek izofluran konsantrasyonunu ayarlayın.
4. Balık ve fare beyinlerinde intravital görüntüleme
- Zebra balığı beyninde intravital görüntüleme
NOT: Balık beynini objektif lensin altına düzgün bir şekilde yerleştirmek için, geniş alan görüntüleme için uyarma ışığıyla aynı yolda ikincil bir yük bağlantılı cihaz (CCD) kamera kullanılır.- Mikroskobu kurun ve gücü kalibre edin (bölüm 1'de açıklandığı gibi).
- Mikroskop üzerine düşük büyütmeli (tipik olarak 4x) bir hedef yerleştirin.
- Balıkları ve tüpleri içeren Petri kabını mikroskop altına yerleştirin.
- Petri kabını aydınlatmak için ışık yayan diyot (LED) ışık kaynağı kullanın.
- Görüntü alma yazılımının Kamera modunu açın (Şekil 2).
- Live'ı (Canlı) tıklayın.
- Ekranın sağ tarafındaki A kanalını seçin.
- Görüntüyü net bir şekilde görmek için histogram ayarlarını yapın.
NOT: Bunların gerektiğinde güncelleştirilmesi gerekir. - Motor kontrolöründeki motor ayarını Temel olarak ayarlayın.
- Balık görünene kadar hedefi düşürün.
NOT: Objektif lensin kafa ile herhangi bir fiziksel temas kurmadığından emin olun. - Balık başının merkezini görüş alanının ortasına yerleştirin.
- Hedefi yukarı ve balık kafasından uzağa hareket ettirin.
- Düşük büyütmeli objektif lensi 3PM için yüksek NA objektif lensle değiştirin.
NOT: Düşük büyütmeli lensin ve yüksek NA objektif lensin parfokal olması gerekmez, ancak balığın yüksek NA objektif lensin görüş alanı içinde olmasını sağlamak için yeterince yakın olmalıdır. - Objektif lensi yavaşça alçaltın, hedefin kafa ile herhangi bir fiziksel temas kurmadığından emin olun. CCD kamera yazılımında, başın üst kısmı göründüğünde hedefi hareket ettirmeyi bırakın. z konumunu 0 μm olarak ayarlayın.
NOT: Suya daldırma hedefi kullanırken objektif lensin altında hava kabarcığı olmadığından emin olun. - LED ışık kaynağını kapatın ve sistemin etrafındaki karanlık perdeyi kapatın.
- 3P görüntüleme için görüntüleme alma yazılımını Multiphoton GG moduna ayarlayın ve objektif lensin altındaki gücü 1 mW'ın altına (~1 MHz darbe tekrarlama hızı ile) ayarlayın.
- Motor kontrol ünitesinde motor ayar düğmesini Base'den Objective'e değiştirin.
- Odadaki ışıkları kısın.
- PMT'leri açın ve 3PM uyarım kaynağı deklanşörünü açın. Otofloresan nedeniyle floresan sinyal kanalında ve kemiğin THG'si nedeniyle THG sinyal kanalında kemiğin bir taslağının göründüğünden emin olun (Şekil 2C).
- Daha derin görüntüleme yaparken güç seviyelerini artırarak farklı derinliklerde görüntüleme gerçekleştirin.
- Fare beyninde intravital görüntüleme
NOT: Görüntüleme sırasında anestezi uygulanan fareye her saat başı %5 glikoz enjekte edin; doz vücut ağırlığına (10 μL / g) dayanmaktadır.- 3P görüntüleme için görüntüleme alma yazılımını Multiphoton GG moduna ayarlayın ve objektif lensin altındaki gücü 1 mW'ın altına (~1 MHz darbe tekrarlama hızı ile) ayarlayın.
NOT: Sapmayı azaltmak için ameliyat penceresinin objektif lense dik olarak yerleştirildiğinden emin olun. İnce ayarlama, stereotaksik aparatın eğilmesiyle gerçekleştirilir. - Objektif lensi pencereye yaklaştırın ve objektif ile kraniyal pencere arasına su uygulayın; tüm motorların eksen değerlerini sıfıra ayarlayın.
NOT: ~ 1.700 nm'de H 2 O'daki ışık emilimi büyüktür, bu da ~1-2mm su derinliğinden sonra ~ 1.700 nm lazer gücünü önemli ölçüde azaltır. ~ 1.700 nm uyarma için, suya batırma için 1.700 nm'de çok daha küçük absorpsiyona sahip olanD2O'yu kullanın. - Görüntü alma yazılımındaki Canlı düğmesine tıklayın ve PMT kanallarını açın, örneğin bir floresan sinyal kanalı ve bir THG sinyal kanalı. PMT kazancını ve arka plan seviyesini gerektiği gibi ayarlayın.
- THG kanalını büyük kan damarlarından ve pencere camı yüzeyinden izleyerek pencere yüzeyini bulmak için objektif lensi yavaşça yukarı doğru hareket ettirin. Gerekirse pencere yönünü ayarlayın (adım 4.2.12'deki nota bakın). Beynin yüzeyini tanımlamak için motorları sıfırlayın .
- Görüntüleme gerçekleştirin ve güç seviyesini görüntüleme derinliğine göre ayarlayın.
- 3P görüntüleme için görüntüleme alma yazılımını Multiphoton GG moduna ayarlayın ve objektif lensin altındaki gücü 1 mW'ın altına (~1 MHz darbe tekrarlama hızı ile) ayarlayın.
Sonuçlar
Bu protokolün başarıyla tamamlanması, optimal ışık parametreleri (örneğin, nabız süresi, NA) ve in vivo 3PM için uygun hayvan preparatları ile uygun şekilde hizalanmış bir mikroskopla sonuçlanacaktır. Ticari olarak temin edilebilen 3P kurulumu, hem ~ 1.300 nm hem de ~ 1.700 nm için uygun aynalar ve lenslerden oluşur; bu nedenle, uyarma dalga boyu 1.300 nm ile 1.700 nm arasında değiştirildiğinde optikte herhangi bir değişiklik gerekmez. 3P kurulumundaki lenslerin 1.300 ve 1.700 nm için uygun bir kaplaması yoksa, lazer güç kaybını azaltmak için bunların uygun olanlarla değiştirilmesi gerekir. Optimize edilmiş 3PM ve uygun hayvan hazırlığı ile, yüksek kontrastlı in vivo floresan ve THG görüntüleri beynin derinliklerinde toplanabilir.
Şekil 3, bozulmamış yetişkin zebra balıklarının temsili 3P görüntülerini göstermektedir. Yetişkin zebra balığı beynindeki genetik olarak etiketlenmiş nöronların yüksek çözünürlüklü, invaziv olmayan ve derin görüntülemesi 3PM kullanılarak elde edilir. Telensefalon bölgesindeki görüntüleme, yetişkin zebra balığı beyninde 2PM24,25,26,27 kullanılarak bildirilmiş olmasına rağmen, 3PM, tüm telensefalona ve diğer teknikler kullanılarak gözlemlenmesi daha zor veya imkansız olan bölgelere erişim sağlar. Optik tektum ve beyincikteki hücre tabakalarının dağılımı Şekil 3C'de görülebilir. Başarılı bir görüntüleme seansında, kemik THG kanalında görünür ve nöronlar floresan kanalında görülebilir. Yetişkin zebra balığı görüntülemesinde, balığın yerini belirlemek için mikroskopun kamera özelliği kullanılmıştır (Şekil 3A). Bu adım, fare beyninin görüntülenmesi için gerekli değildir, çünkü cam pencere beynin kolayca erişilebilir olmasını sağlayacak kadar büyüktür. Yetişkin zebra balığı beyninin yüksek çözünürlüklü yapısal görüntüleri, önceki bölümlerde açıklanan sistem kullanılarak elde edilmiştir. Kafatası, beyinde gezinmeye ve üst yüzeyi bulmaya yardımcı olan THG kanalında (Şekil 3B) görülür. Şekil 3C'de gözlemlendiği gibi, nöronlar yetişkin beyninin derinliklerinde yüksek sinyal-arka plan oranı (SBR) ile ayırt edilebilir. Beynin üzerindeki doku, otofloresan nedeniyle floresan kanalında görülebilir.
Şekil 4, GCaMP6s etiketli nöronların (yeşil) ve Teksas Kırmızı etiketli kan damarlarının (kırmızı) çok renkli 3P görüntülerini, yetişkin fare beynindeki THG (mavi) sinyalleri ile birlikte 1.340 nm uyarım10 ile göstermektedir. Görüntüler önceki çalışma10'dan çoğaltılmıştır. Şekil 4'te, odaktaki darbe enerjisi, yeterli floresan ve THG sinyalleri elde etmek için tüm derinlikte ~ 1.5 nJ'de tutuldu ve maksimum ortalama lazer gücü ~ 70 mW idi. Nabız süresi ~ 60 fs'ye ayarlandı ve etkili NA ~ 0.8 idi. 3PM kurulumunun optimizasyonu ile CA1 hipokampus bölgesinde beyin yüzeyinden 1,2 mm'ye kadar yüksek kontrastlı görüntüler başarıyla elde edilmiştir (Şekil 4A,B). Şekil 4C, D, GCaMP6s etiketli nöronların Ca2+ aktivite izlerini, 10 dakikalık bir kayıt oturumu için 750 μm derinlikte gösterir ve yüksek kayıt doğruluğu gösterir.
Uyarma lazeri yanlış hizalanmışsa, görüş alanı boyunca sinyal parlaklığında homojensizlik gözlenebilir. Ek olarak, nabız süresi, odaktaki uyarma darbe enerjisi ve etkili NA gibi lazer parametreleri optimize edilmezse, balık kafatasından veya fare beyninin kraniyotomi penceresinden gelen THG görüntüsü görünmez ve / veya yüksek uyarma darbe enerjisi gerektirir (örneğin, >2 nJ / odakta darbe). Bu nedenle, beyin yüzeyindeki THG sinyalleri, derin doku görüntülemeye başlamadan önce optimize edilmiş bir 3PM kurulumu için bir gösterge olarak kullanılabilir.
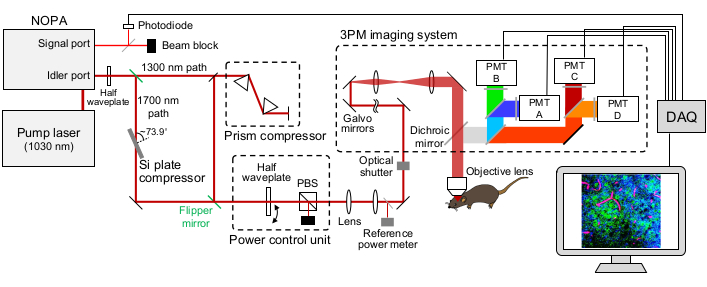
Şekil 1: 15:00 kurulumunun şematik gösterimi. Uyarma lazerinin dalga boyu, NOPA'nın avara portundan çıkan ~ 1.300 nm veya ~ 1.700 nm olarak ayarlanır. Prizma çifti kompresör ve Si plakalı kompresör, uyarma lazer darbesini önceden ayarlamak için sırasıyla ~ 1.300 nm ve ~ 1.700 nm lazer için kullanılır. ~ 1.300 nm ve ~ 1.700 nm lazer ışınları paletli aynalarla değiştirilebilir. NOPA'nın sinyal portu, tetikleyici sinyali elde etmek için kullanılır. Uyarma gücünü kontrol etmek için yarım dalga plakası ve PBS kullanılır. Floresan ve THG, GaAsP PMT'leri tarafından tespit edilir. Floresan ve THG sinyallerini ayırmak için dikroik aynaların ve bandpass filtrelerinin uygun kombinasyonları kullanılır. Kısaltmalar: 3PM = üç foton mikroskopisi; NOPA = kollineer olmayan optik parametrik amplifikatör; PBS = polarize edici ışın ayırıcı; THG = üçüncü harmonik nesil; DAQ = veri toplama; PMT = fotoçarpan tüpü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
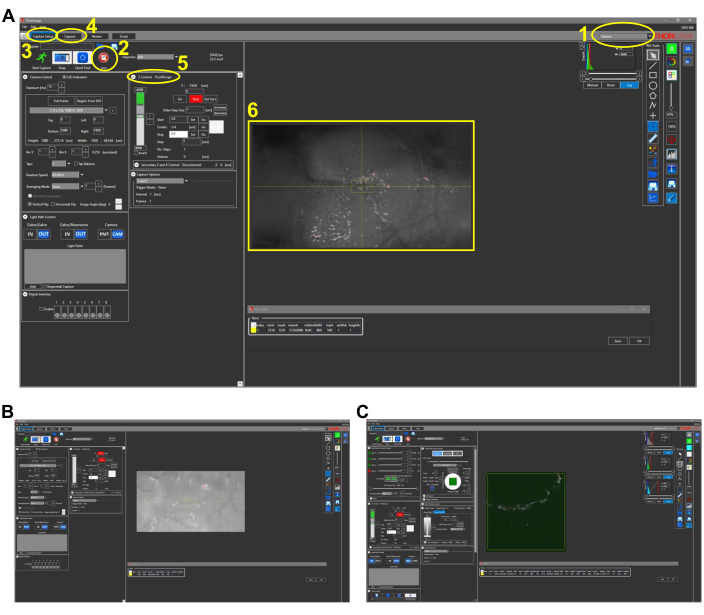
Şekil 2: Balıklarda intravital Görüntüleme için temsili ekran görüntüleri (protokol bölüm 4.1). (A) 4x objektif lens ile görüntü alma yazılımının kamera modunda görünümü. Yazılımın temel özellikleri aşağıdaki gibi özetlenmiş ve numaralandırılmıştır: 1. Görüntü alma yazılımının görüntüleme modu. Mod seçenekleri Kamera, Multifoton ve Multifoton GG'dir. CCD kamera ile beyaz ışıkta görüntüleme için Kamera modu seçilir. 2. Canlı düğmesine tıklandığında kamera açılır (veya çoklu foton seçeneklerinde PMT'ler) ve mikroskopun gerçek zamanlı bir görünümü gözlemlenebilir. 3. Yakalama Ayarları sekmesinde, istenen görüntüleme parametreleri (güç, konum, derinlik) ayarlanır. 4. In Yakala sekmesinde, kaydedilecek görüntüler için bir klasör konumu atanır. Görüntüleme bu sekmeden başlatılabilir. 5. Z Control ayarı, z kademeli motoru hareket ettirerek görüntüleme derinliğini kontrol eder. 6. Bir zebra balığı kafasının temsili görüntüsü. Başın rostral tarafı soldadır. (B) 25x objektif lensle Kamera modunun temsili görünümü. (C) (B)'de görülen görüntünün THG görüntüsünü içeren Multifoton GG modunun temsili görünümü. Kısaltmalar: CCD = şarj bağlantılı cihaz; PMT = fotoçarpan tüpü; THG = üçüncü harmonik nesil. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
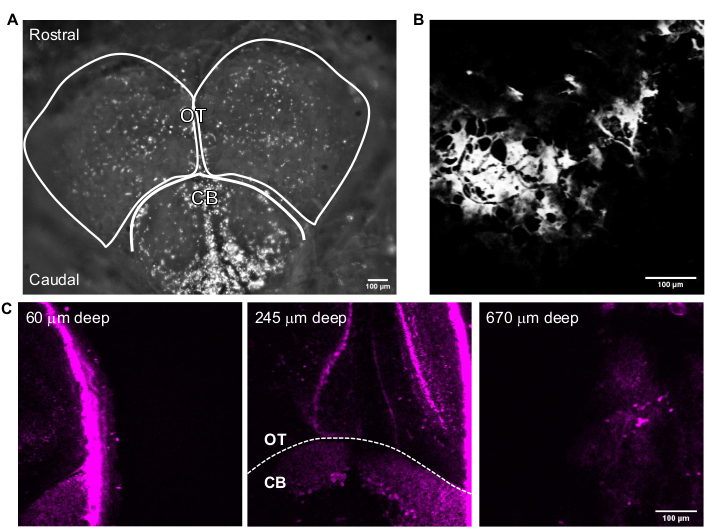
Şekil 3: Görüntü yakalama yazılımı ile elde edilen yetişkin zebra balığı beyninin temsili görüntüleri. (A) 4x objektif lens ile elde edilen yetişkin zebra balığı kafasının kamera modu görüntüsü. Görüntünün üst kısmı rostral yöndür. OT lobları ve CB özetlenmiştir. (B) Multiphoton GG modunda, (A)'nın THG görüntüsünü içeren 25x objektif lens ile elde edilen temsili görüntü. (C) Yetişkin zebra balığı beyninin, beyincik ile GFP'nin çeşitli derinliklerdeki nöronların sitoplazmasında eksprese edildiği optik tektumun kesişimindeki floresan görüntüleri. Ölçek çubukları = 100 μm. Kısaltmalar: OT = optik tektam; CB = beyincik; THG = üçüncü harmonik nesil; GFP = yeşil floresan proteini. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
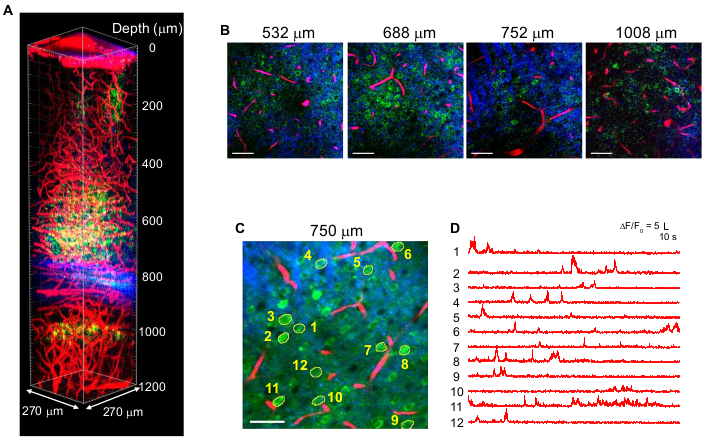
Şekil 4: Fare beyninde 1.340 nm uyarılma üzerine GCaMP6s etiketli nöronların (yeşil), Teksas Kırmızı etiketli kan damarlarının (kırmızı) ve üçüncü harmonik neslin (mavi) çok renkli 3 PM değeri. (A) Z-yığını görüntüleri, 270 x 270 μm (kare başına 512 x 512 piksel) görüş alanıyla beyin yüzeyinden 1.200 μm'ye kadar düşürür. Lazer gücü, odakta ~ 1.5 nJ darbe enerjisini korumak için görüntüleme derinliğine göre değiştirildi. Hedefin altında maksimum ortalama güç 70 mW idi. (B) Çeşitli görüntüleme derinliklerinde seçilen 2D görüntüler. (C) Dura'nın 750 μm altında, 270 x 270 μm (256 x 256 piksel) görüş alanına sahip etkinlik kayıt sitesi. (D) (C)'de belirtilen etiketli nöronlardan uyanık bir farede kaydedilen spontan beyin aktivitesi izleri. Kare hızı 8.3 Hz idi ve piksel bekleme süresi 0.51 μs'dir. Lazer tekrarlama hızı 2 MHz idi ve objektif lensin altındaki ortalama güç 56 mW idi. Her iz taban çizgisine normalleştirildi ve 0.72 s zaman sabiti olan bir hamming penceresi kullanılarak düşük geçişli filtrelendi. Ölçek çubukları = 50 μm. Bu figür ve şekil göstergesi 10'dan çoğaltılmıştır. Kısaltma: 3PM = üç foton mikroskopisi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
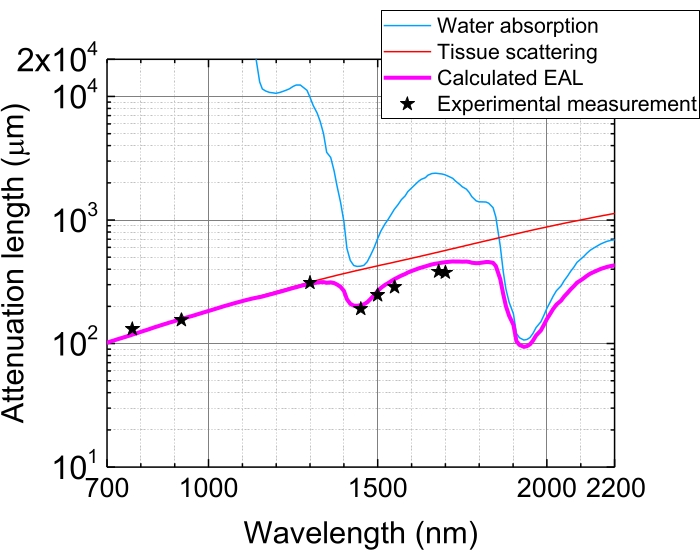
Şekil 5: Fare beyninin neokorteksindeki etkili zayıflama uzunluğu. EAL (macenta hattı), doku saçılmasından (kırmızı çizgi) ve dokudaki su emiliminden (mavi çizgi) hesaplanır ve% 75 su bileşimi varsayılır. Siyah yıldızlar, fare beyninin neokorteksindeki EAL'nin bildirilen deneysel verilerini göstermektedir 3,21,28,29. EAL'nin farklı dokularda değiştiğini unutmayın. Kısaltma: EAL = etkili zayıflama uzunluğu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Uyarma dalga boyu (nm) | Daldırma suyu | Maksimum lazer gücü (mW) | Odakta maksimum darbe enerjisi* (nJ) | Fare korteksindeki tipik EAL (μm) | Fare korteksindeki görüntüleme derinliği** (mm) | Amaç altında darbe enerjisi*** (nJ) | Maksimum lazer tekrarlama oranı**** (MHz) |
| 1300 | H2 O veya D2O |
 100 100 |
 2 2 | ~300 | 0.8 | ~14 | ~7 |
| 1.2 | ~55 | ~2 | |||||
| 1.6 | ~210 | ~0,5 | |||||
| 2.1 | ~ 1100 | ~0,1 | |||||
| 1700 | D2O |
 50 50 |
 3 3 | ~ 400 | 0.8 | ~7 | ~7 |
| 1.2 | ~20 | ~2,5 | |||||
| 1.6 | ~55 | ~1 | |||||
| 2.1 | ~ 190 | ~0,3 |
Tablo 1: Fare korteksi görüntüleme için tipik 3 P uyarma koşulları.
* Yüksek NA (~1.0) hedefi, ~50 fs'lik darbe genişliği ve floresan proteinleri (örneğin, GFP ve RFP) gibi tipik floroforlarla.
** EAL'nin tüm kortekste tek tip olduğu varsayımıyla.
EAL ve görüntüleme derinliğinden hesaplanan odakta ~1 nJ/darbe elde etmek için.
Hedefin altındaki darbe enerjisinden ve izin verilen maksimum lazer gücünden hesaplanır.
Kısaltmalar: 3P = üç foton; NA = sayısal diyafram; GFP = yeşil floresan protein; RFP = kırmızı floresan proteini; EAL = etkili zayıflama uzunluğu.
Tartışmalar
Bu protokol, ticari bir mikroskop ve lazer kaynağı ile 3P görüntüleme kurmak için adım adım prosedürleri açıklamaktadır. 2PM ile karşılaştırıldığında, 3PM, fare beyni hipokampüsü gibi daha derin bölgelerde optik erişim gerektiren uygulamalarda bir avantaja sahiptir. 3PM çoğunlukla sinirbilimde kullanılmasına rağmen, 3PM derin doku gözlemi için lenf düğümleri, kemikler ve tümörler gibi diğer dokularda potansiyel olarak uygulanabilir.
Görüntüleme sisteminin, algılama ve veri toplama elektroniklerinin PMT'lerden sonra görüntüye ihmal edilebilir bir parazit katkıda bulunmasını sağlayan çekim gürültüsü sınırına yakın bir hızda performans gösterdiğini doğrulamak önemlidir. Tespit edilen foton sayısındaki belirsizlik temelde foton atış gürültüsü ile sınırlıdır. Çekim gürültüsü sınırlı performansı, tipik bir çoklu foton mikroskobunda, yüksek kazançlı bir fotodetektör (örneğin, bir PMT) kullanılarak elde edilebilir. Foton atış gürültüsü, dağılımın standart sapmasının dağılım ortalamasının kareköküne eşit olduğu bir Poisson istatistiksel dağılımını izler. Çekim gürültüsü sınırlı performansını doğrulamak için, protokol bölümündeki 1.14 adımını izleyin.
H2 O ile hafif zayıflamayı önlemek için, daldırma için D2O kullanmak, özellikle ~ 1.700 nm uyarma için yararlıdır. D 2O kullanıldığında, görüntüleme sırasında D 2 O / H 2 O değişimini önlemek için her ~ 10 dakikada birD2O'nun yenilenmesi veyabüyük miktarda D2O kullanılması önemlidir. Ayrıca D2O'yu oda ortamından3. Görüntüleme için uzun çalışma mesafesi (WD) objektif lens (örneğin, 4 mm veya daha uzun WD) kullanılıyorsa, daldırma sıvısı kalınlığı 2-3 mm'yi aşabilir. Artan kalınlık,H2O absorpsiyonunu ~ 1.300 nm21'de bile ihmal edilemez hale getirir. Bu nedenle, uzun bir WD objektif lens kullanırken 1.300 nm 3PM için bile D2O gerekli olabilir.
3P floresan yoğunluğu, odaktaki uyarma darbe enerjisinin küpüne bağlı olduğundan (Eq. (1)), canlı dokularda termal ve doğrusal olmayan hasarı önlerken yeterli 3P floresan sinyallerini elde etmek için uygun lazer gücünün ayarlanması özellikle önemlidir. Ortalama lazer gücü termal hasar eşiğinin altında tutulmalıdır. Örneğin, fare beyninde, termal doku hasarını önlemek için, fare beyin yüzeyindeki ortalama güç, 1 mm derinlikte ~1.300 nm uyarma için ~100 mW'da veya altında tutulmalı ve 230 μm x 230 μm21'lik bir görüş alanı (FOV) ile tutulmalıdır. Benzer şekilde, ~ 1.700 nm'deki ortalama güç, ~ 1 mm derinlikte ~ 50 mW'da veya altında tutulmalı ve ~ 230 μm x 230 μm'lik bir FOV (yayınlanmamış veriler). Ayrıca, uyarma doygunluğunu ve potansiyel doğrusal olmayan hasarı önlemek için, uyarma darbe enerjisi sırasıyla ~ 1.300 nm ve ~ 1.700 nm uyarma için 2 nJ ve  3 nJ'de
3 nJ'de  tutulmalıdır.
tutulmalıdır.
Dokulardaki ışık emilimi ve saçılması nedeniyle, odaktaki nabız enerjisi, dokuların 1 EAL tarafından nüfuz edilmesinden sonra 1/e'ye (~% 37) kadar zayıflatılır. EAL farklı dokularda ve uyarma dalga boylarında, örneğin fare beyninin neokorteksinde değişir, EAL ~ 1.300 nm ve ~ 1.700 nm'de ~ 300 μm ve ~ 400 μm'dir, sırasıyla 3,29'dur (Şekil 5). Bu nedenle, aynı darbe enerjisini n EAL derinliğinde odakta (örneğin, 1 nJ / darbe) tutmak için, yüzey darbe enerjisinin 1 nJ × en ile çarpılması gerekir. Yapısal ve fonksiyonel dinamiklerin hızlı görüntülenmesi için, yüksek bir kare hızı 5,6,7,10 elde etmek için yüksek tekrarlama hızına (1 MHz veya daha yüksek) sahip bir uyarma lazeri arzu edilir. Bununla birlikte, darbe enerjisi gereksinimi ve ortalama lazer güç sınırı, uygulanabilir tekrarlama oranını kısıtlar.
Örneğin, 4 EAL'de orta derecede derin bir bölge görüntülediğimizde (yani, 1.300 nm uyarımla fare korteksinde ~ 1.2 mm), 1 nJ / darbeyi odakta tutmak için yüzeyde ~ 55 nJ / darbe gerekir. Ortalama güç sınırlaması 100 mW olduğunda, ~ 2 MHz lazer tekrarlama hızı uygulayabiliriz. Bununla birlikte, 7 EAL derinliğinde daha derin görüntü elde etmek için, odakta 1 nJ / darbeyi korumak için yüzeyde ~ 1.100 nJ / darbe gereklidir. Termal hasarı önlemek için maksimum ortalama gücün 100 mW olduğu varsayılarak, yüzeyde 1.100 nJ / darbe elde etmek için lazer tekrarlama hızı 0,1 MHz'ye düşürülmelidir. Tablo 1, fare beyin korteksindeki tipik görüntüleme koşullarını özetlemektedir. Tablo 1'deki görüntüleme derinliklerinin, EAL'nin tüm fare korteksinde eşit olduğunu varsaydığını unutmayın.
Dahası, derin doku 3PM'deki lazer güç sınırlaması nedeniyle, kare hızı ile görüntü piksel boyutu arasında bir denge vardır, bu da kalsiyum görüntüleme gibi fonksiyonel görüntüleme için özellikle önemlidir. Mevcut maksimum lazer tekrarlama hızı, odaktaki gerekli darbe enerjisine ve yukarıda tartışıldığı gibi uygulanabilir ortalama lazer gücüne bağlı olarak her derinlikte kararlaştırılır, örneğin, 1.300 nm uyarma ile ~ 4 EAL'ye eşdeğer bir derinlikte 2 MHz. Genel olarak, görüntüleme piksel başına en az bir darbe gerektirir. Buna göre, mevcut minimum piksel bekleme süresi, lazer tekrarlama hızına göre belirlenir, örneğin, 2 MHz uyarma ile 0,5 μs / piksel.
3P görüntülerde yüksek uzamsal çözünürlüğü (yanal olarak ~1 μm) korumak için, 1 pikseli ~1 μm2'lik bir alana ayarlamak idealdir, örneğin, 250 x 250 μm2'lik bir FOV için 256 x 256 piksel. Bu nedenle, oldukça büyük bir FOV (örneğin, 256 x 256 piksel ile 250 x250 μm2), 0,5 MHz, 1 MHz ve 2 MHz darbe tekrarlama hızları ile hızlı görüntüleme gerçekleştirmek için sırasıyla ~ 7,6, ~ 15 ve ~ 30 kare / s teorik maksimum kare hızları verir. Benzer şekilde, termal hasar eşiğinin altında yeterli darbe enerjisi uygulamak için hedef derinliğe, tarama hızına ve FOV'a bağlı olarak lazer tekrarlama hızının optimizasyonu esastır. Görüntüleme hızını artırmak için, nöronlara talep üzerine lazer darbeleri göndererek tüm uyarma darbelerini nöronlara (yani ilgi alanlarına) yoğunlaştırmak için uyarlanabilir bir uyarma kaynağı kullanılabilir31.
3PM, canlı dokular içinde derin görüntülemede ve kafatası, kemikler ve fare beyninin beyaz madde tabakası (yani dış kapsül) gibi yüksek oranda saçılan ortamlar aracılığıyla 2PM ile karşılaştırıldığında avantajlıdır. 3PE'nin daha uzun EAL ve daha yüksek dereceli doğrusal olmayan uyarılması derin doku görüntülemeye fayda sağlar. Örneğin, fare korteksindeki GCaMP6'yı görüntülemek için, 920 nm uyarımlı 2P floresan sinyali, 690 μm'de sığ bölgelerde 1.300 nm uyarılma  ile 3P floresan sinyalinden daha yüksektir (yani, 1.300 nm'de ~2.3 EAL)21. Bununla birlikte, 920 nm'ye kıyasla 1.300 nm'de daha uzun EAL nedeniyle, 3PE, ~ 690 μm derinlikte ve daha derin21'de 2P uyarımdan (2PE) daha güçlü floresan verir. Bu derinlik, 2PE ve 3PE'lik floresan sinyal kuvvetlerinin aynı tekrarlama oranı ve aynı izin verilen maksimum ortalama güçler21 ile aynı olduğu 'sinyal çapraz derinliği' olarak tanımlanır. Sinyal çapraz derinliği, 2PE ve 3PE için uyarma dalga boylarına ve florofora bağlıdır.
ile 3P floresan sinyalinden daha yüksektir (yani, 1.300 nm'de ~2.3 EAL)21. Bununla birlikte, 920 nm'ye kıyasla 1.300 nm'de daha uzun EAL nedeniyle, 3PE, ~ 690 μm derinlikte ve daha derin21'de 2P uyarımdan (2PE) daha güçlü floresan verir. Bu derinlik, 2PE ve 3PE'lik floresan sinyal kuvvetlerinin aynı tekrarlama oranı ve aynı izin verilen maksimum ortalama güçler21 ile aynı olduğu 'sinyal çapraz derinliği' olarak tanımlanır. Sinyal çapraz derinliği, 2PE ve 3PE için uyarma dalga boylarına ve florofora bağlıdır.
Uygulamada, 920 nm uyarım, daha az su emilimi nedeniyle 1.300 nm uyarmadan daha yüksek ortalama lazer gücüne izin verir. Bununla birlikte, 2PE'nin daha yüksek ortalama gücü, sinyal çapraz derinliğini yalnızca 0,9 EAL4 ile itecektir. Ek olarak, numune yoğun bir şekilde etiketlendiğinde, 3PE çok daha yüksek SBR'nin ek avantajına sahiptir. Bu nedenle, sinyal çapraz uzunluğuna ulaşmadan önce bile, 3PM, görüntüleme için 2PM'den daha iyi olabilir. Örneğin, ~% 2'lik bir hacim fraksiyonuna (yani etiketleme yoğunluğuna) sahip fare beyin vaskülatürünü görüntülerken, 100 mW uyarma gücüne sahip 1.300 nm 3PM, floresein için ~ 700 μm derinlikte 200 mW uyarma gücü ile 920 nm 2PM'den daha iyi performans gösterir.
3PM ayrıca, uyarma ışınının nokta yayılma işlevini bozabilecek ve bulanıklaştırma arka planıoluşturabilecek ince ama yüksek oranda saçılan bir tabakadan görüntüleme yaparken de bir avantaja sahiptir 4. Örneğin, fare beyninin bozulmamış kafatası boyunca, 2PM görüntüleri, beyin yüzeyinden13 μm <100 μm'lik sığ derinlikte bile bulanıklaştırma arka planından muzdariptir. Benzer bir bulanıklaştırma arka planı, fare beynindeki beyaz madde32 aracılığıyla 1.280 nm uyarılma ile 2PM'de gözlendi. Bu nedenle, dokular bulanık tabakalar yoluyla görüntülendiğinde, etiketleme yoğunluğundan bağımsız olarak yüksek kontrastlı görüntüleme için 3PM'den 2PM'ye tercih edilir.
Son zamanlarda, 3PM'nin görüntüleme derinliği sınırının 8 EAL 33'ün üzerinde olduğunu gösteren bir boncukhayaleti ve teorik analiz bildirdik; 8 EAL, fare korteksinde ~ 1.700 nm uyarma ile ~ 3 mm'ye eşdeğerdir. Bununla birlikte, şu anda mevcut olan lazer, fare beyninde 8 EAL elde etmek için yeterli darbe enerjisine sahip değildir. Daha güçlü lazerlerin daha da geliştirilmesi, mevcut görüntüleme derinliği sınırını 3PM'ye zorlayacaktır.
Açıklamalar
Yazarlar rakip çıkarlar olmadığını beyan ederler.
Teşekkürler
Bu çalışma NSF DBI-1707312 Cornell NeuroNex Hub ve NIH 1U01NS103516 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5% Povidone-iodine | Amazon | NDC 67818-155-32 | Aceptical cleaning of surgical areas |
| 70% Ethanol | Thermo Fisher Scientific | CAS 64-17-5 | Aceptical cleaning of surgical areas |
| Agarose | Sigma | A4718-256 | Preparing zebrafish chamber |
| Atropine | Cornell Veterinary Care | ||
| Bergamo II | Thorlabs | Multiphoton Imaging Microscope | |
| Bupivacaine | Cornell Veterinary Care | ||
| Dexamethasone | Cornell Veterinary Care | ||
| Donut shape glass (ID4.5, OD6.5) | Potomac Photonics | Cover glass used for craniotomy | |
| eye ointment (or topical ophthalmic ointment) | Puralube Vet Ointment | NDC 17033-211-38 | Used as a lubricant to prevent irritation or to relieve dryness of the eye during surgery and anesthesia |
| GaAsP Amplified PMT | Thorlabs | PMT2100 | PMT detector |
| Glucose | Cornell Veterinary Care | ||
| Glycopyrrolate | Cornell Veterinary Care | ||
| Heater (800 W) | Finnex | Aquarium heater for zebrafish water) | |
| Isoflurane USP 250 mL | Piramal | NDC 66794-0013-25 | For anesthesia of mice |
| Ketoprofen | Cornell Veterinary Care | ||
| Kimwipes | Kimtech | Laboratory tissue for preparing zebrafish | |
| Nanofil syringe (10 micrometer) with 36 G needle | WPI | NANOFIL + NF36BV | Syringe and needle for injection of pancuronium bromide |
| Optical Adhesive | Norland | NOA 68 | To stick round coverslip and donut shape glass together. |
| Pancuronium Bromide | Cornell Veterinary Care | ||
| Peristaltic Pump | Elemental Science | ESI MP2 | Water pump for zebrafish setup |
| Polyethylene tubing (I.D. 0.58 mm., O.D. 0.965 mm.) | Elemental Science | MP2 pump tubing | Tubing that goes in the mouth of the zebrafish |
| Round Cover Slip German Glass #1.5, 5 mm | Electron Microscopy Sciences | 7229605 | Cover glass used for craniotomy |
| Spirit-NOPA | Spectra Physics | Tunable Optical Parametric Amplifier | |
| SR400 | Stanford Research Systems | SR400 | Photon counter |
| Standard Photodiode Power Sensor | Thorlabs | S122C | Power detector |
| Sterilized phosphate buffered saline (PBS) | Millipore Sigma | SKU 806552-500ml | Used during mouse brain surgery |
| Surgical drape | Dynarex disposable towel drape | 4410 | For aceptical mouse surgery |
| Thin strip boxing wax | Corning Rubber Co., Inc. | Holding tubing in place in zebrafish chamber | |
| ThorImage | Thorlabs | Image acquisition software | |
| Tricaine (Ethyl-m-aminobenzoate methanesulfonate salt) | MP | 103106 | Zebrafish anesthesia and euthanasia |
| Tygon tubing (I.D. 1/16 in., O.D. 1/8 in.) | Tygon | Tubing for water flow for zebrafish preparation | |
| VaporGuard | VetEquip | 931401 | For recycling isoflurane |
| Vetbond tissue adhesive | 3M | 1469SB | To glue the glass window on the mouse skull, and to glue the laboratory tissue when preparing the fish. |
| XLPLN25XWMP2 | Olympus | Multiphoton Excitation Dedicated Objective |
Referanslar
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
- Wang, T., Xu, C. Three-photon neuronal imaging in deep mouse brain. Optica. 7 (8), 947-960 (2020).
- Ouzounov, D. G., et al. In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nature Methods. 14 (4), 388-390 (2017).
- Weisenburger, S., et al. Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell. 177 (4), 1050-1066 (2019).
- Yildirim, M., Sugihara, H., So, P. T. C., Sur, M. Functional imaging of visual cortical layers and subplate in awake mice with optimized three-photon microscopy. Nature Communications. 10, 177 (2019).
- Takasaki, K., Abbasi-Asl, R., Waters, J. Superficial bound of the depth limit of two-photon imaging in mouse brain. eNeuro. 7 (1), (2020).
- Guesmi, K., et al. Dual-color deep-tissue three-photon microscopy with a multiband infrared laser. Light, Science & Applications. 7, 12 (2018).
- Hontani, Y., Xia, F., Xu, C. Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Science Advances. 7 (12), 3531 (2021).
- Liu, H., et al. In vivo deep-brain structural and hemodynamic multiphoton microscopy enabled by quantum dots. Nano Letters. 19 (8), 5260-5265 (2019).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Wang, T., et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nature Methods. 15 (10), 789-792 (2018).
- Xu, C., Webb, W. W. Multiphoton excitation of molecular fluorophores and nonlinear laser microscopy. Topics in Fluorescence Spectroscopy. 5. , 471-540 (2002).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments: JoVE. (12), e680 (2008).
- Łukasiewicz, K., Robacha, M., Bożycki, &. #. 3. 2. 1. ;., Radwanska, K., Czajkowski, R. Simultaneous two-photon in vivo imaging of synaptic inputs and postsynaptic targets in the mouse retrosplenial cortex. Journal of Visualized Experiments: JoVE. (109), e53528 (2016).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments: JoVE. (123), e52642 (2017).
- Gordon, J. P., Martinez, O. E., Fork, R. L. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150-152 (1984).
- Entenberg, D., et al. Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nature Protocols. 6 (10), 1500-1520 (2011).
- Horton, N. G., Xu, C. Dispersion compensation in three-photon fluorescence microscopy at 1,700 nm. Biomedical Optics Express. 6 (4), 1392-1397 (2015).
- Wang, T., et al. Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. eLife. 9, 53205 (2020).
- Cheng, L. -. C., Horton, N. G., Wang, K., Chen, S. -. J., Xu, C. Measurements of multiphoton action cross sections for multiphoton microscopy. Biomedical Optics Express. 5 (10), 3427-3433 (2014).
- Huang, K. -. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Jacobson, G. A., Rupprecht, P., Friedrich, R. W. Experience-dependent plasticity of odor representations in the telencephalon of zebrafish. Current Biology. 28 (1), 1-14 (2018).
- Li, J., et al. Early development of functional spatial maps in the zebrafish olfactory bulb. Journal of Neuroscience. 25 (24), 5784-5795 (2005).
- Barbosa, J. S., et al. Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain. Science. 348 (6236), 789-793 (2015).
- Dray, N., et al. Large-scale live imaging of adult neural stem cells in their endogenous niche. Development. 142 (20), 3592-3600 (2015).
- Kobat, D., et al. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17 (16), 13354-13364 (2009).
- Wang, M., Wu, C., Sinefeld, D., Li, B., Xia, F., Xu, C. Comparing the effective attenuation lengths for long wavelength in vivo imaging of the mouse brain. Biomedical Optics Express. 9 (8), 3534-3543 (2018).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81 (8), 1015-1047 (2005).
- Li, B., Wu, C., Wang, M., Charan, K., Xu, C. An adaptive excitation source for high-speed multiphoton microscopy. Nature Methods. 17 (2), 163-166 (2019).
- Kobat, D., Horton, N. G., Xu, C. In vivo two-photon microscopy to 1.6-mm depth in mouse cortex. Journal of Biomedical Optics. 16 (10), 106014 (2011).
- Akbari, N., Rebec, M. R., Xia, F., Xu, C. Imaging deeper than the transport mean free path with multiphoton microscopy. Biomedical Optics Express. 13, 452-463 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır