需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
天然细胞中的功能性定点荧光测定法,用于研究骨骼肌兴奋性
摘要
功能性定点荧光测定法是一种实时研究蛋白质结构域运动的方法。该技术在天然细胞中的应用修改现在允许检测和跟踪来自小鼠分离骨骼肌纤维中电压门控Ca2+ 通道的单电压传感器运动。
摘要
功能性定点荧光测定法一直是研究许多膜蛋白(包括电压门控离子通道)的结构-功能关系的首选技术。这种方法主要用于异源表达系统,以同时测量膜电流、通道活性的电表现和荧光测量,报告局部结构域重排。功能性定点荧光测量将电生理学、分子生物学、化学和荧光结合到一个广泛的技术中,允许分别通过荧光和电生理学研究实时结构重排和功能。通常,这种方法需要一个工程电压门控膜通道,其中包含可以通过硫醇反应性荧光染料测试的半胱氨酸。直到最近,用于蛋白质的定点荧光标记的硫醇反应化学仅在非洲爪蟾卵母细胞和细胞系中进行,将该方法的范围限制在原代不可兴奋细胞上。本报告描述了功能性定点荧光测定法在成人骨骼肌细胞中的适用性,以研究激发-收缩耦合的早期步骤,即肌纤维电去极化与肌肉收缩激活相关的过程。本协议描述了使用体内电穿孔将半胱氨酸工程的电压门控Ca2 +通道(CaV1.1)设计和转染到成年小鼠短指屈肌纤维中的方法,以及功能性定点荧光测量所需的后续步骤。这种方法可以适用于研究其他离子通道和蛋白质。使用哺乳动物肌肉的功能性定点荧光测定法与研究兴奋性的基本机制特别相关。
引言
响应活细胞中已知电刺激而跟踪离子通道构象重排的能力是分子生理学有价值的信息来源1。电压门控离子通道是感知跨膜电压变化的膜蛋白,其功能也受电压变化的影响2。上个世纪电压钳技术的发展使生理学家能够实时研究电压门控离子通道响应膜去极化而携带的离子电流3。电压钳技术的使用对于理解可兴奋细胞(如神经元和肌肉)的电特性至关重要。在 1970 年代,电压钳优化允许检测电压门控钙 (Ca V) 和钠 (NaV) 通道4,5 中的门控电流(或电荷移动)。门控电流是非线性电容电流,由电压传感器的运动产生,以响应细胞膜6上的电场变化。门控电流被认为是分子重排的电表现形式,在离子通道打开之前或伴随7。虽然这些电流测量提供了有关通道功能的宝贵信息,但离子电流和门控电流都是电压门控通道7的分子间和分子内构象重排的间接读数。
功能性定点荧光测定法(FSDF;也称为电压钳式荧光测定法,VCF)是在1990年代初开发的8,并且首次提供了直接查看局部构象变化和通道蛋白功能的能力实时。使用通道诱变、电生理学和异源表达系统的组合,可以荧光标记和跟踪特定通道或受体的运动部分,以响应激活刺激9,10。该方法已被广泛用于研究电压门控离子通道8,10,11,12,13,14,15,16,17,18,19中的电压传感机制。权威评论见10,20,21,22,23。
Ca V和NaV通道对于电信号的启动和传播至关重要,由一个主α1亚基组成,该亚基具有一个中心孔和四个不相同的电压传感域2。除了它们独特的一级结构外,Ca V和NaV通道还表示为具有辅助亚基24的多亚基复合物。电压依赖性钾通道(K V)由四个亚基组成,看起来像NaV或CaV25的单个结构域。Ca V 和 NaV 通道的孔形成和电压感应 α1 亚基由单个多肽编码六个独特跨膜段的四个独立结构域(S1-S6;图1A)24,26.由S1至S4跨膜段组成的区域形成电压传感域(VSD),S5和S6跨膜段形成孔域26。在每个VSD中,S4 α螺旋含有带正电荷的精氨酸或赖氨酸(图1A,B),它们响应膜去极化而移动7。数十年的研究和高度多样化的实验方法的结果支持这样一个前提,即S4段向外移动,产生门控电流,以响应膜去极化6。
FSDF 测量与离子通道或其他蛋白质上的特定半胱氨酸残基(即 S4 α-螺旋)偶联的硫醇反应性染料的荧光变化,通过定点诱变工程,因为通道响应膜去极化或其他刺激起作用10。事实上,FSDF最初是为了研究KV通道中的S4段(被提议为通道的主要电压传感器)是否在门控电荷响应膜电位8,10的变化而移动时移动。在电压门控离子通道的情况下,FSDF可以解析四个VSD的独立构象重排(在任何给定时间跟踪一个VSD),同时进行通道函数测量。事实上,使用这种方法,已经表明单个VSD似乎在通道激活和失活的特定方面存在差异性参与12,27,28,29,30。确定每个VSD对通道功能的贡献具有高度相关性,可用于进一步阐明通道操作并潜在地确定药物开发的新靶点。
FSDF在异源表达系统中的使用对于我们从还原论的角度进一步理解通道功能非常有帮助10,23。像许多还原论方法一样,它有优点,但也有局限性。例如,一个主要的限制是异源系统中通道纳米环境的部分重构。通常,离子通道与许多辅助亚基和许多其他改变其功能的蛋白质相互作用31。原则上,使用多个蛋白质编码构建体或多顺反子质粒可以在异源系统中表达不同的通道及其附属亚基,但它们的天然环境不能完全重建30,32。
我们小组最近在天然解离的骨骼肌纤维中发表了FSDF的变体,用于研究激发 - 收缩耦合(ECC)的早期步骤33,34,肌肉纤维电去极化与肌肉收缩的激活相关的过程35,36。这种方法首次允许在成人分化肌纤维37的天然环境中对来自电压门控L型Ca2+通道(CaV1.1,也称为DHPR)的单个S4电压传感器进行运动跟踪。这是通过考虑这种细胞类型的多种特征来实现的,包括细胞的电活动允许快速刺激诱导的自我传播去极化,通过体内电穿孔表达cDNA质粒的能力,细胞内通道的自然高表达和区室组织,以及它与高速成像和电生理记录设备的兼容性。以前,我们使用高速线扫描共聚焦显微镜作为检测设备37。现在,使用光电二极管进行信号采集,介绍了该技术的变体。这种基于光电二极管的检测系统可以促进该技术在其他实验室中的实施。
本文描述了一种在天然电池中利用FSDF研究CaV1.1的单个电压传感器运动的分步协议。虽然CaV1.1通道在整个手稿中被用作一个例子,但该技术可以应用于其他离子通道,受体或表面蛋白的细胞外可访问结构域。
Access restricted. Please log in or start a trial to view this content.
研究方案
该协议已获得马里兰大学机构动物护理和使用委员会的批准。以下协议分为多个子部分,包括(1)分子构建体设计和半胱氨酸反应染料选择,(2) 体内 电穿孔,(3)肌肉解剖和纤维分离,(4)采集设置说明,(5)评估增强绿色荧光蛋白(EGFP)阳性纤维电活性和半胱氨酸染色,以及(6)信号采集和处理。此外,在每节的开头,在骨骼肌纤维中应用FSDF时,会详细介绍一些相关的注意事项。所有方案部分都应使用适当的个人防护设备进行,包括实验室外套和手套。
1. 分子构建体设计及半胱氨酸反应染料选择
- 结构设计是实验成功的关键部分。首先,生成野生型荧光标记的 CaV1.1 cDNA 构建体,并评估其在适当细胞类型中的表达。对于肌纤维,通过使用携带巨细胞病毒(CMV)启动子的质粒可以实现强大的转染效率。在该协议中,使用了已经表征的兔EGFP-CaV1.1质粒38。
注意:当设计cDNA构建体以将半胱氨酸残基引入电压门控离子通道时,半胱氨酸位置至关重要,应仔细考虑。半胱氨酸应可从细胞外空间进入,以允许硫醇偶联染料反应(图1C,D),并且应靠近S4区域以精确跟踪其响应去极化的运动。然而,为了允许染料荧光猝灭响应蛋白质运动,引入的半胱氨酸偶联荧光团应位于两种不同环境的界面(例如,膜和细胞外液; 图 1E)。此外,确保插入的半胱氨酸不会干扰蛋白质功能至关重要。 - 为了获得有关正确半胱氨酸定位的想法,请收集有关通道结构的信息或从其他相关通道蛋白的其他荧光测定实验中收集信息。对于半胱氨酸工程Ca V 1.1构建体的设计,评估通道26的分离冷冻电子显微镜(cryo-EM)结构,并比较来自相关通道(如CaV1.2 12)或其他通道(如振动筛11和NaChBac39)的先前工作的半胱氨酸插入。
- 一旦选择了适当的半胱氨酸位置,使用商业定点诱变试剂盒引入半胱氨酸替代。在本协议中,在CaV1.1的S4电压传感段的每个胞质端独立设计了以下半胱氨酸修饰:VSD-I(L159C),VSD-II(L522C),VSD-III(V893C),VSD-IV(S1231C)和UniProtKB:P07293(图1B)。
- 对于骨骼肌纤维,使用5-羧基四甲基罗丹明甲硫代磺酸盐(MTS-5-TAMRA),其表现出适当和快速扩散到横小管膜系统,这是表面膜的内陷和CaV1.1通道的主要位置。MTS-5-TAMRA在从脂质膜过渡到水性环境时显示荧光降低(图1E)。
注意:Dylight或Alexa-马来酰亚胺衍生物染色表面膜,但不染色横向小管系统。
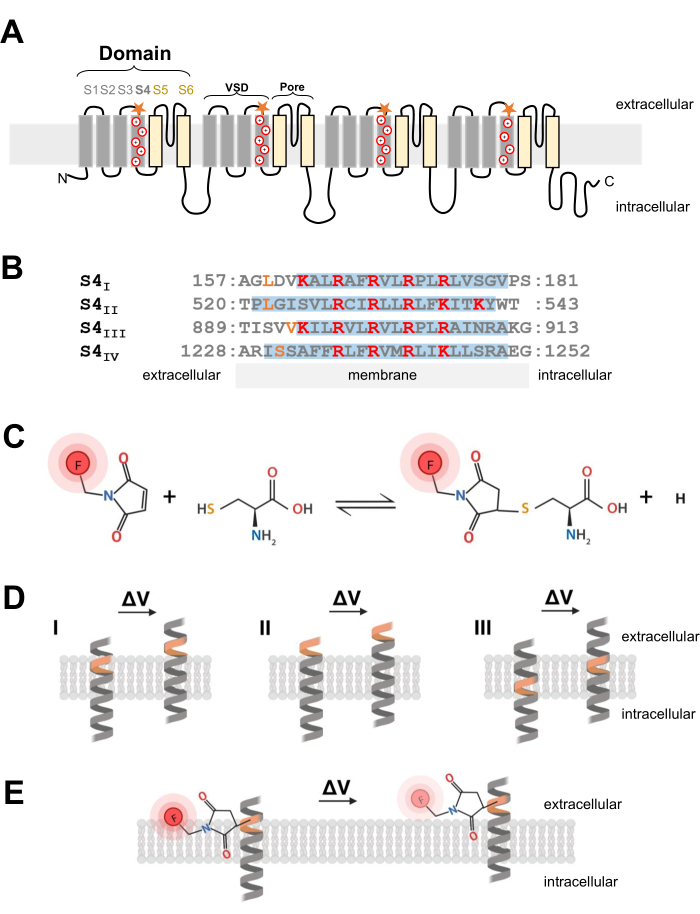
图1:跨膜α螺旋界面处的硫醇-半胱氨酸反应示意图。 (A)L型CaV1.1膜拓扑结构。加号表示S4 α螺旋内的基本残基,橙色星星表示半胱氨酸通过定点诱变引入的位置。(B)兔CaV1.1的S4I到S4IV的序列比对(UniProtKB:P07293)。对电压检测至关重要的带正电荷的精氨酸和赖氨酸残基以红色突出显示,而工程半胱氨酸替代品以橙色表示。该面板改编自参考文献37。(C)半胱氨酸-硫醇荧光分子反应。(D)说明跨膜电压敏感α螺旋内半胱氨酸诱变插入的图表。半胱氨酸应在休息时埋在膜中,并在去极化后可通过细胞外进入(ΔV;如果去极化(II)之前已经可以从细胞外空间获得目标半胱氨酸,或者在去极化后无法从细胞外空间进入半胱氨酸(III),则半胱氨酸示踪通常不太可能发生。(E)与硫醇荧光分子反应后,响应去极化的α螺旋运动降低了MTS-5-TAMRA荧光发射。荧光信号由S4螺旋的运动以及随后的染料相对于膜平面和水环境的运动产生。请点击此处查看此图的大图。
2. 体内 电穿孔
注意:电穿孔实验如前所述进行38 ,并进行修改。在下一节中,该协议设计用于鼠标单脚垫的电穿孔。如果准备了两个爪子,则需要调整体积。
- 将 25-100 μL 质粒溶液以 2-5 μg/μL 分装在置于冰上的 1.5 mL 管中。
- 在无菌盐水中制备 0.5 mL 2 mg/mL 透明质酸酶溶液,并通过安装在 1 mL 注射器的低结合蛋白 0.2 μm 无菌过滤器过滤溶液。在室温下储存在 1.5 mL 管中。
- 使用校准的麻醉装置,通过将小鼠放入麻醉室,在O2 (1L / min)中使用3%-4.5%异氟醚麻醉小鼠。通过使用镊子捏尾巴尖端来确认动物的充分麻醉。达到最佳麻醉时不应观察到任何反应。
- 将鼠标从麻醉室中取出,然后将麻醉鼻罩放在鼠标上。将动物仰卧在覆盖有无菌台垫的等温加热垫上。使用啮齿动物面罩在O2 (1L / min)中使用含有3%异氟醚的啮齿动物面罩继续麻醉。
- 为防止手术过程中眼睛干燥,请用无菌棉尖在动物的眼睛上涂抹一层细薄的人造泪霜。使用浸有乙醇的无菌湿巾对动物的爪子进行消毒。
- 使用 0.5 英寸长的 29 G 无菌胰岛素针,吸出 20 μL 透明质酸酶溶液。在脚跟水平处穿透皮肤,并将针头皮下滑向脚趾根部(图2A)。慢慢注入溶液,同时逐渐向后移动针头。应在爪子下方观察到推注或肿块(图2B)。
注意:根据动物的年龄和爪子的大小,可能无法注射全部溶液。通常,可能会发生通过注射点的小泄漏。 - 如果需要,在适当的爪子消毒后使用另一根无菌针头用另一只爪子重复步骤2.6,如步骤2.5所示。
- 通过将动物从鼻罩上取下来断开麻醉,然后将鼠标放回笼子中,随意获取食物 和水。应在~5分钟内观察到从麻醉中完全恢复。将含有质粒溶液的试管放在工作台上,使其达到室温。
- 1小时后,第二次麻醉动物,将其放在加热垫上,并按照步骤2.3-2.5中所述对爪子进行消毒。
- 使用步骤2.6中描述的相同技术注入10-20μL的cDNA构建体。注入的构建物总量为每爪50-100μg。如果需要,使用另一个无菌注射器对侧爪重复该过程。
- 将动物在等温加热垫上麻醉5分钟,以使cDNA溶液均匀地分散在组织中。
- 按照制造商的建议,打开电穿孔设备并将其连接到双电极阵列。
- 使用饱和乙醇的湿巾对双电极阵列进行消毒。用一只手稳定爪子,首先在脚后跟的皮肤下插入一个电极。然后,将第二个电极插入脚趾的底部,确保两个电极的方向垂直于脚的轴线(图2C)。将探头定向到不会将脚或腿限制在极端角度方向的位置。
注意:使用镊子和定期锐化电极尖端可以促进电极插入。根据动物的年龄,爪子的大小可能会有所不同,电极间距应相应地调整。 - 通过以 1 Hz 施加 20 个脉冲(持续时间为 20 毫秒)来电穿孔肌肉。对于间隔为 1 cm 的电极针,将电压设置为 ~100 V。如果电极间距修改为达到~100 V/cm,则应进行调整。如果电极位置正确,则应在脉冲传递过程中观察到手指的轻微弯曲。
- 如果需要,用对侧爪子重复步骤2.13和2.14。
- 断开麻醉并将动物置于笼子中,与其非电穿孔柜台伴侣隔离, 随意获取食物 和水2小时。应在~10分钟内观察到麻醉完全恢复。将动物放回笼子内。
注意:cDNA构建体的表达高度依赖于编码的蛋白质。蛋白质周转率、cDNA、质粒启动子的数量和质量以及其他变量都会影响构建体的表达。在该实验中,使用CMV启动子的CaV1.1的α1S亚基的最佳表达需要4至6周,但可以在2周内检测到长达12-15个月。
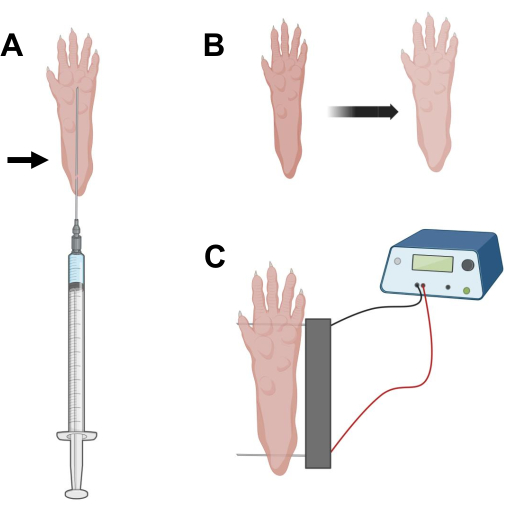
图 2:cDNA 注射和电穿孔电穿孔电极在用于电穿孔的小鼠脚垫中的定位图。 (A)透明质酸酶和cDNA注射的针头位置在小鼠脚垫下。箭头表示通过皮肤插入的点。(B)注射后应暂时观察皮肤轻微变色和爪子尺寸略有增加。(C) 电穿孔的电极阵列定位。请点击此处查看此图的大图。
3. 肌肉解剖和纤维隔离
注意:骨骼肌纤维解离按照前面描述的37,40,41 进行修改。在下一节中,该协议适用于鼠标的两个脚垫。
- 在纤维解离之前,通过在60mm塑料培养皿中将一份固化剂添加到10份弹性体(% w / w)中以达到~5mm的厚度来制备sylgard覆盖的板。使用前让弹性体覆盖板固化过夜。如果在使用前后正确储存并用70%乙醇消毒,可以多次重复使用。
- 在 2 mL 的旋转器最小必需鹰培养基 (S-MEM) 中制备 4 mg I型胶原酶,并补充有 10% 胎牛血清 (FBS;终浓度为 2 mg/mL)。将溶液转移到35mm无涂层塑料板上,并将培养皿置于37°C,5%CO2的培养箱中。
注意:S-MEM是一种改性MEM配方,不含谷氨酰胺和Ca2+。在此步骤中没有Ca2+ 可减少酶消化和研磨过程中的纤维挛缩。 - 在60mm无涂层塑料板中加入5mL补充有10%FBS的S-MEM,并储存在37°C,5%CO2的培养箱中。
- 通过CO2窒息,然后颈椎脱位,对动物实施安乐死。为了减少原代细胞分离期间的污染,将动物尸体浸入70%乙醇中~10秒。用吸波纸取出并擦干胴体,用一把剪刀在脚踝和膝盖之间剪开脚(图3A)。
- 将动物的一只脚固定下来,爪子朝上,在解剖显微镜下以 10 倍放大倍率将解剖销钉固定在弹性体覆盖的板上。
- 用解剖剪刀和细镊子,从爪子上去除皮肤,露出指短屈肌(FDB)肌肉(图3B)。为防止组织干燥,请使用 1,000 μL 移液器向肌肉添加一滴 S-MEM 10% FBS。
- 在脚跟水平,切开肌腱并仔细解剖从脚跟到脚趾的FDB肌肉(图3B)。在进行解剖时尽可能避免肌肉紧张。对组织施加的力过大会导致肌纤维损伤。立即将肌肉放入胶原酶溶液中。
- 对侧足重复步骤3.5-3.7。将解剖的肌肉置于37°C,5%CO 2培养箱中的胶原酶溶液中2 小时45分钟至3小时15分钟。根据胶原酶酶活性和动物的年龄调整孵育时间。
- 在肌肉组织孵育期间,在 35 mm 玻璃底培养皿的中心加入 300 μL 不含血清或抗生素的冷 MEM。将 2 μL 冷层粘连蛋白以 1.20 mg/mL 直接添加到 MEM 中。对所需的菜肴数量重复该过程。将培养皿放入37°C,5%CO2 的细胞培养箱中至少1小时,以使层粘连蛋白聚合。
- 酶消化完成后,使用大口径(5 mm)火抛光玻璃巴斯德移液管和乳胶灯泡将肌肉转移到含有S-MEM 10% FBS的60 mm细胞培养皿中。
- 使用较小孔径(2毫米)的火抛光玻璃巴斯德移液器和乳胶灯泡,在解剖显微镜下轻轻研磨肌肉(图3C)。解离的肌纤维应开始从组织中分离并在溶液中释放。
注意:根据经验,始终首选较少的研磨(15-30 次移液器通道),因为过多的长时间研磨会给纤维带来压力甚至损坏。 - 使用一把细镊子去除任何非肌肉组织,如神经、肌腱或血管(图 3D)。
- 向每个 35 mm 层粘连蛋白涂层玻璃底培养皿中加入 2 mL 温热的 MEM 2% FBS。使用 200 μL 移液器和无菌塑料移液器吸头,将解离的肌纤维转移到 35 mm 层粘连蛋白涂层玻璃底培养皿中(图 3E)。
注意:实现低纤维密度并允许光纤彼此很好地分离对于防止光纤重叠非常重要。 - 将35mm玻璃底培养皿置于37°C,5%CO2的培养箱中。纤维可以在2-20小时的时间范围内使用。
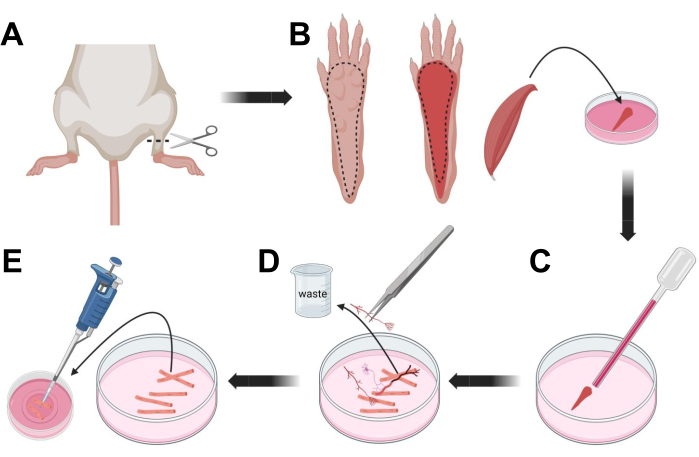
图3;肌肉FDB纤维解剖和解离。 (A)在踝关节上方进行足部解剖(虚线)后,去除脚爪下的皮肤,沿着虚线露出FDB肌肉(B)。肌肉被解剖并放置在胶原酶溶液中。(C)孵育后,对肌肉进行研磨以解离并获得单个肌肉纤维。(D)在将肌纤维转移到层粘连蛋白涂层的玻璃底培养皿之前,使用细镊子去除非肌肉组织和碎片。 请点击此处查看此图的大图。
4. 采集设置说明
注意:采集设置与之前描述的42 相当,但进行了修改(图4A)。
- 打开所有组件:计算机、AD/DA 转换器和路径钳位放大器、显微镜、电动载物台、机械手、光电二极管电源、光源、快门、脉冲发生器和协议编辑器。
- 激活晶体管-晶体管逻辑 (TTL) 触发来自 AD/DA 的 OUT 信号,以控制脉冲发生器、快门和协议编辑器。
- 使用来自脉冲发生器的TTL输出信号并连接到放大器的AD通道,以验证精确的时间触发。在实验之前,应仔细评估对触发一致性的充分控制,以确保适当的设备同步。
注意:在CaV1.1的情况下,预计在刺激后不到4-10毫秒(产生最大电荷运动的时间5)内看到最大信号。信号快速且精确的时间分辨率对于与其他测量(例如钙瞬态或通过电压钳 位测量的 电荷运动)进行比较至关重要。 - 要将激发光聚焦在光纤的特定区域或光斑上(图4B),请使用位于激发光路中的光圈。这只能在EGFP-CaV1.1信号最大的区域进行信号采集(图4B)。
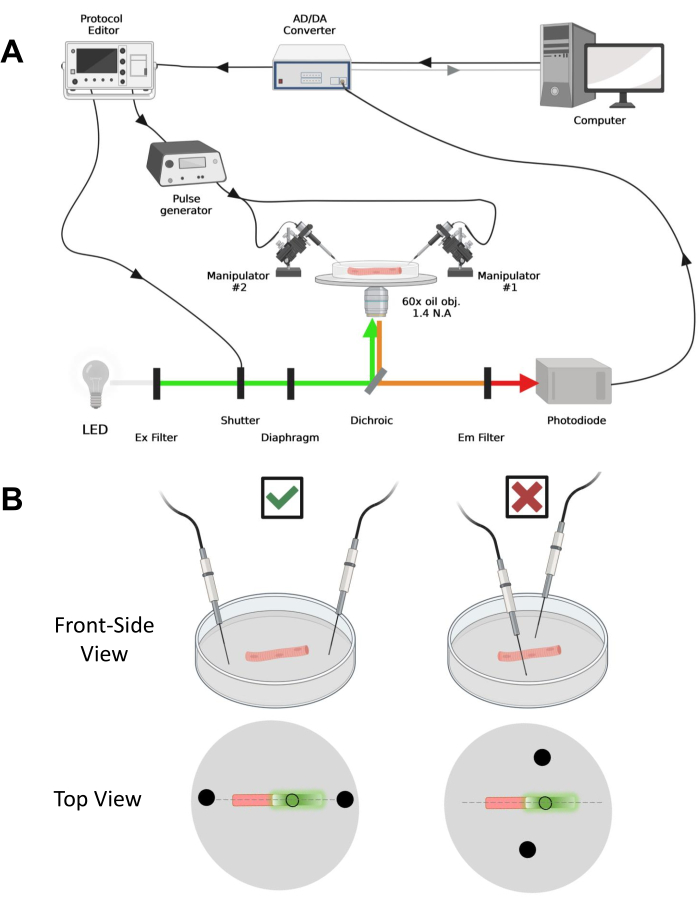
图 4:记录系统的说明。 (A) 说明记录系统不同组件之间连接的图表。该装置包括一个带电动载物台的倒置显微镜、一个发光二极管(LED)光源、一个快门、一个具有跟踪保持功能的基于光电二极管的定制光监控电路43、一个AD/DA转换器(来自膜片钳放大器)、一个模拟脉冲发生器、一个耦合到场刺激电极的外部场刺激单元、 电动机械手,以及用于协议采集、同步和生成的商业软件。用于场刺激的电极由两根铂丝制成,这些铂丝焊接到通过BMC连接器连接到脉冲发生器的铜电缆上。特定的激励和发射滤波器用于检测EGFP和MTS-5-TAMRA信号。为了激发EGFP,使用带有488 nm(± 20 nm)激发(Ex)滤光片和LP510 nm Em滤光片的氙气灯。对于MTS-5-TAMRA,使用530 nm LED光源和LP550 nm Em滤光片。(B) 表达 EGFP-CaV1.1-cys 构建体的光纤视图,其中双场刺激电极(黑色圆圈)在光纤主轴(虚线)的方向正确(左)和不正确(右)。黑色未填充的圆圈表示采集区域,其直径由光圈开口控制,放置在光源前面。请点击此处查看此图的大图。
5. EGFP阳性纤维电活性和半胱氨酸染色的评估
注意:骨骼肌纤维场刺激如前41 所述进行修改。该方法用于(1)识别健康,功能性和电响应的纤维,(2)用半胱氨酸反应性荧光染料染色纤维,以及(3)记录荧光信号以响应传播的动作电位。本节和后续的每一步都应在弱光环境中进行,以减少荧光染料漂白。
- 将含有解离肌纤维的35毫米玻璃底培养皿放在显微镜载物台上。用 1,000 μL 移液器小心地取出培养基,并用 2 mL 室温林格氏溶液替换(成分见 表 1 )。可能需要多轮更换培养基才能完全去除含有游离半胱氨酸的原始细胞培养基。
- 使用机械或电动机械手,将两根铂丝垂直于培养皿底部放置。确保电极端子相对于光纤的纵轴对齐,并且距离光纤末端几毫米,并且电极之间的距离为 5 mm(图 4B)。通过旋转培养皿或将每个电极安装在独立的显微操纵器上来进一步调整电极位置(图4B)。
- 打开透射光,使用20倍物镜找到视野中的光纤。将 EGFP 滤镜立方体移动到光通道中。
注意:使用配备落射荧光和低放大倍率(2x)物镜的显微镜,可以通过评估EGFP表达来评估纤维解离前整个肌肉中的构建体转染效率(图5A)。 - 使用遥控快门,激活 488 nm 激发光以识别 EGFP 阳性光纤。使用电动显微镜载物台将光纤x-y位置存储在培养皿上。EGFP 信号在光纤内通常是异质的(图 4B)。将保存的位置居中到最亮的 EGFP 信号。
- 识别EGFP阳性纤维后,返回到第一个保存的定位。使用手动触发开关,以 1 ms 持续时间和 20 V 幅度提供两个连续刺激脉冲。将脉冲的极性设置为交替。
- 刺激后,观察两个同心均匀的纤维收缩,以响应两个相反极性的脉冲。对交替极性脉冲的响应局部收缩或无收缩表明局部非传播的被动响应或非兴奋性41。在实验的其余部分排除这些纤维。
- 将 2 μL 10 mM MTS-5-TAMRA 溶液直接加入培养皿中,并与 1,000 μL 移液管(10 μM 终浓度)轻轻混合。注意不要移动盘子,否则储存的纤维位置会丢失。孵育4-5分钟,使荧光硫醇分子扩散到横向小管系统腔中。
- 应用双极重复刺激,以 50 Hz 的速率唤起连续动作电位列车,每 1 秒持续 300 毫秒,持续 5 分钟。
注意:脉冲序列使插入EGFP-CaV1.1的S4中的半胱氨酸可与MTS-5-TAMRA反应。纤维响应刺激而机械收缩的能力对于横向小管腔内容物与细胞外环境循环非常重要。 - 用 1,000 μL 移液管从培养皿中取出染色溶液,并用 2 mL 室温林格氏溶液替换。可能需要两到三轮才能完全去除未结合的MTS-5-TAMRA。让染色的纤维从染色方案中恢复至少10分钟。
- 与步骤5.6一样,通过观察响应交变极性的对称光纤收缩来重新评估光纤健康和电活动。从实验的其余部分排除对两种刺激都没有反应的纤维。
- 将MTS-5-TAMRA滤光片立方体移动到光通道中。使用遥控快门激活 533 nm 激发光以确认光纤上的均匀 MTS-5-TAMRA 染色。
注意:用MTS-5-TAMRA染色后,工程和内源性半胱氨酸都与马来酰亚胺衍生物反应(图5B)。因此,很难评估与感兴趣的半胱氨酸的正确反应。CaV1.1主要在横小管中表达,形成可区分的双带图案。使用共聚焦或落射荧光显微镜,x-y图像可用于确认MTS-5-TAMRA的正确染色和横向小管进入和扩散(图5C)。
6. 信号采集与处理
注意:在进行荧光测量之前,必须仔细设计信号采集,以获得最佳的信噪比。较慢的采样率允许更多的光检测,同时减少在蛋白质构象重排期间获取的点数。在EGFP-CaV1.1-cys的情况下,由动作电位波形引起的电荷运动发生在~1-10ms37。为了获得多个点来跟踪运动随时间的变化,采集设置为每点50 μs。
- 用适当的放大系统将光纤放在视野中间。在这些实验中,使用了60倍油1.4数值孔径(NA)倒置物镜。使用电动载物台和隔膜优化照明和光纤位置,以照亮光纤直径的圆形区域,其中EGFP信号最大(图4B)。
- 一旦光纤定位好要采集的位置,在光纤的每一端定位两个独立安装的场刺激铂线。将光纤主轴上的导线对齐成一条直线,并将它们与中心的光纤间隔 5 毫米(图 4B)。
- 将采集激发和发射滤波器设置为 MTS-5-TAMRA 的正确设置。通过执行采集软件中编写的协议开始实验。此步骤触发所有下游设备(即协议编辑器、快门、脉冲发生器)。
注意:该协议允许在传递场刺激之前进行短时间(即10毫秒)的基线采集,以便随后测量静息荧光。 - 以 0.5 或 1 ms、20 V 方波脉冲启动单个或一系列动作电位。尽可能缩短总采集时间,以避免信号漂白。
注意:即使在光纤中心记录,也可能发生与运动相关的荧光信号,并且由于蛋白质-荧光团构象变化,可能会与荧光信号混淆(图5D)。与刺激后电荷运动的预期时间相比,收缩诱导信号应延迟37。 - 为了进一步区分S4运动引起的信号和纤维收缩引起的信号,向记录溶液中加入1 μL 100 mM N-苄基-对甲苯磺酰胺(BTS;50 μM终浓度),以尽量减少收缩反应并重复步骤6.4。纤维药理固定后第二次检测到的信号对应于标记的S4螺旋的分子运动(图5D)。
注意:在使用 BTS 抑制运动后,在没有工程半胱氨酸的情况下,不应在对照 EGFP-CaV1.1 中检测到任何信号。 - 使用相同的设置,在培养皿内没有肌肉纤维或碎片的位置获取类似的信号,以获得背景荧光值。
- 将包含原始荧光 [Fr(t)] 的时间过程的文件从光纤和背景荧光 [Fb(t)] 导入到数据分析软件中。对包含 Fb(t) 的列求平均值以获得均匀的 Fb 值。从 Fr(t) 中减去 Fb 以获得绝对荧光 [F(t)] 值。如果需要,使用平滑功能平滑生成的信号。
注意:有了这个检测系统和采集频率,我们决定使用相邻平均函数,窗口为50个点进行平滑。 - 在刺激前10毫秒的时间间隔内平均基线F(t)值以获得静息荧光值(F0)。从平滑的F(t)中减去F0以获得荧光的绝对变化[ΔF(t)]。然后,为了表示相对于静息荧光(ΔF/F0)随时间的变化,将ΔF(t)除以F0。
- 要评估信号漂白的程度,请定义 ΔF/F0 随时间变化信号的两个点,刺激前后以及远离荧光信号。将线性函数拟合到这两个点以获得基线迹线。随着时间的推移将基线减去 ΔF/F0 以校正信号漂白。
- 从时间列中减去采集起始和来自刺激的反馈信号之间的延迟,得到对应于电刺激开始的t=0。
注意:为了允许多个信号比较,通常需要对信号的幅度进行归一化。根据实验的目的,可以使用不同的方法。在下面的结果部分中,我们对信号动力学感兴趣,因此我们使用了一种简单的方法,该方法由最小达到值(即负去峰值)对每个信号进行归一化。
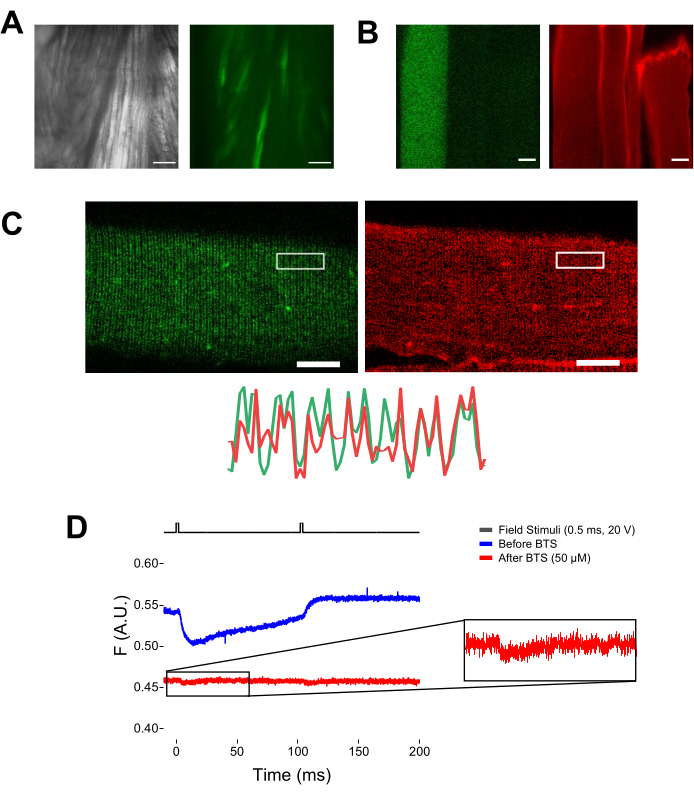
图 5:在没有 MTS-5-TAMRA 染色和代表性原始荧光记录的情况下表达 EGFP-CaV1.1-cys 的成像肌肉纤维。 (A)表达EGFP-CaV1.1 VSD-III构建体的解剖而非解离肌肉的透射(左)和荧光(右)图像的示例。比例尺:100 μm。 (B)在MTS-5-TAMRA染色之前(左)和之后(右)表达EGFP-CaV1.1 VSD-III构建体的肌肉纤维的代表性图像。非转染纤维的内源性半胱氨酸也被染料染色。比例尺:30 μm。 (C) EGFP-Ca V 1.1 VSD-III 构建体的共聚焦图像(左)和 MTS-5-TAMRA 染色(右)显示了肌纤维横向小管系统上 CaV1.1 定位的经典双带模式特征(底部)。比例尺:25 μm。 (D)响应两个刺激的代表性荧光记录,并在用N-苄基-对甲苯磺酰胺(BTS)固定纤维之前(蓝色迹线)和之后(红色迹线)用光电二极管测量。上面的黑线表示通过外部场刺激进行光纤去极化的协议。请点击此处查看此图的大图。
Access restricted. Please log in or start a trial to view this content.
结果
当响应于重复场刺激而触发传播动作电位时,可以跟踪特定电压传感器的运动以响应特定的去极化频率。 如图6A所示,可以跟踪VSD-II标记螺旋的运动,以响应在10 Hz(即间隔100 ms)施加的两个连续去极化中的每一个。信号漂白可以通过减去迹线的基线来校正(图6B)。对第一和第二响应的进一步时间放大(图6C)可以精确观察这些?...
Access restricted. Please log in or start a trial to view this content.
讨论
本文描述了在肌纤维中进行FSDF的分步协议,以研究来自CaV1.1通道的单个电压传感器运动。尽管该技术中组合的步骤数量和方法的多样性可能看起来很复杂,但大多数这些技术通常用于生物物理学家/细胞生物学家实验室。因此,明显的复杂性主要在于将所有各种方法组合在一个单一的集成技术中。通常,在执行多步骤方法时,开始时进行的微小修改的影响只能在后续步骤的后面检测到。通...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者报告没有利益冲突。
致谢
我们感谢J. Vergara博士(加州大学洛杉矶分校)分享EGFP-CaV1.1(兔)野生型质粒。我们感谢耶鲁大学生理学系电子实验室,特别是Henrik Abildgaard设计和建造具有跟踪和保持电路的光电二极管。这项工作得到了美国国立卫生研究院拨款R01-AR075726和R01-NS103777的支持
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
参考文献
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915(2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. Excitation-Contraction Coupling in Skeletal Muscle. , McGraw-Hill. New York. (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. Muscle: Fundamental Biology and Mechanisms of Disease. , Academic Press, Elsevier. 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22(2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118(2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520(2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6(2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109(2022).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。