Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Fluorométrie fonctionnelle dirigée dans des cellules natives pour étudier l’excitabilité des muscles squelettiques
Dans cet article
Résumé
La fluorométrie fonctionnelle dirigée par site est une méthode permettant d’étudier les mouvements du domaine protéique en temps réel. La modification de cette technique pour son application dans les cellules natives permet maintenant la détection et le suivi des mouvements du capteur de tension unique à partir de canaux Ca2+ voltage-dépendants dans des fibres musculaires squelettiques isolées murines.
Résumé
La fluorométrie fonctionnelle dirigée vers le site a été la technique de choix pour étudier la relation structure-fonction de nombreuses protéines membranaires, y compris les canaux ioniques voltage-dépendants. Cette approche a été utilisée principalement dans les systèmes d’expression hétérologues pour mesurer simultanément les courants membranaires, la manifestation électrique de l’activité des canaux et les mesures de fluorescence, rapportant des réarrangements de domaine local. La fluorométrie fonctionnelle dirigée par site combine l’électrophysiologie, la biologie moléculaire, la chimie et la fluorescence en une seule technique de grande envergure qui permet d’étudier les réarrangements structurels en temps réel et la fonction par fluorescence et électrophysiologie, respectivement. En règle générale, cette approche nécessite un canal membranaire voltage-dépendant qui contient une cystéine qui peut être testée par un colorant fluorescent thiol-réactif. Jusqu’à récemment, la chimie réactive aux thiols utilisée pour le marquage fluorescent dirigé des protéines était réalisée exclusivement dans les ovocytes et les lignées cellulaires Xenopus , limitant la portée de l’approche aux cellules primaires non excitables. Ce rapport décrit l’applicabilité de la fluorométrie fonctionnelle dirigée sur le site dans les cellules musculaires squelettiques adultes pour étudier les premières étapes du couplage excitation-contraction, le processus par lequel la dépolarisation électrique des fibres musculaires est liée à l’activation de la contraction musculaire. Le présent protocole décrit les méthodologies de conception et de transfection des canaux Ca2+ voltage-dépendants modifiés par cystéine (CaV1.1) dans les fibres musculaires du fléchisseur digitorum brevis de souris adultes en utilisant l’électroporation in vivo et les étapes ultérieures requises pour les mesures fluorométriques fonctionnelles dirigées vers le site. Cette approche peut être adaptée pour étudier d’autres canaux ioniques et protéines. L’utilisation de la fluorométrie fonctionnelle dirigée sur le site du muscle des mammifères est particulièrement pertinente pour étudier les mécanismes de base de l’excitabilité.
Introduction
La capacité de suivre les réarrangements conformationnels des canaux ioniques en réponse à un stimulus électrique connu dans une cellule vivante est une source d’informations précieuses pour la physiologie moléculaire1. Les canaux ioniques voltage-dépendants sont des protéines membranaires qui détectent les changements de tension transmembranaire, et leur fonction est également affectée par les changements de tension2. Le développement des techniques de pince de tension au siècle dernier a permis aux physiologistes d’étudier, en temps réel, les courants ioniques transportés par les canaux ioniques voltage-dépendants en réponse à la dépolarisation membranaire3. L’utilisation de la technologie de pince de tension a été cruciale pour comprendre les propriétés électriques des cellules excitables telles que les neurones et les muscles. Dans les années 1970, le raffinement de la pince de tension a permis la détection des courants de déclenchement (ou mouvement de charge) dans les canaux 4,5 dépendants de la tensiondu calcium (Ca V) et du sodium (NaV). Les courants de déclenchement sont des courants capacitifs non linéaires qui résultent du mouvement des capteurs de tension en réponse aux changements du champ électrique à travers la membrane cellulaire6. Les courants de déclenchement sont considérés comme une manifestation électrique des réarrangements moléculaires qui précèdent ou accompagnent l’ouverture du canal ionique7. Bien que ces mesures de courant fournissent des informations précieuses sur la fonction du canal, les courants ioniques et les courants de déclenchement sont des lectures indirectes des réarrangements conformationnels inter- et intramoléculaires des canaux voltage-dépendants7.
La fluorométrie fonctionnelle dirigée sur site (FSDF; également appelée fluorométrie à pince de tension, VCF) a été développée au début des années 19908 et, pour la première fois, a permis de visualiser directement les changements conformationnels locaux et la fonction d’une protéine de canal en temps réel. En utilisant une combinaison de mutagénèse des canaux, d’électrophysiologie et de systèmes d’expression hétérologues, il est possible de marquer et de suivre par fluorescence les parties mobiles de canaux ou de récepteurs spécifiques en réponse au stimulus activateur 9,10. Cette approche a été largement utilisée pour étudier les mécanismes de détection de tension dans les canaux ioniques voltage-dépendants 8,10,11,12,13,14,15,16,17,18,19. Pour les examens faisant autorité, voir 10,20,21,22,23.
Les canaux Ca V et NaV, critiques pour l’initiation et la propagation des signaux électriques, sont composés d’une sous-unité principale α1, qui possède un pore central et quatre domaines de détection de tensionnon identiques2. En plus de leur structure primaire distincte, les canaux Ca V et NaV sont exprimés en complexes multi-sous-unités avec des sous-unités auxiliaires24. Les canaux potassiques voltage-dépendants (K V) sont constitués de quatre sous-unités qui ressemblent à un seul domaine de Na V ou CaV25. La sous-unité α1 formant des pores et détectant la tension des canaux Ca V et NaV est formée par un seul polypeptide codant pour quatre domaines individuels de six segments transmembranaires uniques (S1-S6; Figure 1A) 24,26. La région comprise par les segments transmembranaires S1 à S4 forme le domaine de détection de tension (VSD) et les segments transmembranaires S5 et S6 forment le domaine poreux26. Dans chaque VSD, la α-hélice S4 contient de l’arginine ou de la lysine chargée positivement (Figure 1A,B) qui se déplacent en réponse à la dépolarisation de la membrane7. Plusieurs décennies de recherche et les résultats d’approches expérimentales très diverses soutiennent la prémisse selon laquelle les segments S4 se déplacent vers l’extérieur, générant des courants de gating, en réponse à la dépolarisation de la membrane6.
FSDF mesure les changements de fluorescence d’un colorant thiol-réactif conjugué à un résidu spécifique de cystéine (c.-à-d. l’hélice α-hélice S4) sur un canal ionique ou une autre protéine, conçu par mutagénèse dirigée, lorsque le canal fonctionne en réponse à la dépolarisation de la membrane ou à d’autres stimuli10. En fait, FSDF a été développé à l’origine pour étudier si le segment S4 dans les canaux KV, proposé pour être le capteur de tension principal du canal, se déplace lorsque les charges de déclenchement se déplacent en réponse aux changements de potentiel de membrane 8,10. Dans le cas de canaux ioniques voltage-dépendants, FSDF peut résoudre des réarrangements conformationnels indépendants des quatre VSD (suivi d’un VSD à un moment donné), en même temps que les mesures de la fonction du canal. En effet, en utilisant cette approche, il a été démontré que les VSD individuels semblent être impliqués différemment dans des aspects spécifiques de l’activation et de l’inactivation des canaux 12,27,28,29,30. L’identification de la contribution de chaque VSD à la fonction des canaux est d’une grande pertinence et peut être utilisée pour élucider davantage le fonctionnement des canaux et potentiellement identifier de nouvelles cibles pour le développement de médicaments.
L’utilisation de la FSDF dans les systèmes d’expression hétérologues a été extrêmement utile pour approfondir notre compréhension de la fonction des canaux dans une perspective réductionniste10,23. Comme beaucoup d’approches réductionnistes, elle présente des avantages mais a aussi des limites. Par exemple, une limitation majeure est la reconstitution partielle du nanoenvironnement du canal dans le système hétérologue. Souvent, les canaux ioniques interagissent avec de nombreuses sous-unités accessoires et de nombreuses autres protéines qui modifient leur fonction31. En principe, différents canaux et leurs sous-unités accessoires peuvent être exprimés dans des systèmes hétérologues avec l’utilisation de constructions codantes protéiques multiples ou de plasmides polycistroniques, mais leur environnement natif ne peut pas être entièrement reconstitué30,32.
Notre groupe a récemment publié une variante de FSDF dans des fibres musculaires squelettiques dissociées natives pour l’étude des étapes précoces du couplage excitation-contraction (ECC)33,34, le processus par lequel la dépolarisation électrique des fibres musculaires est liée à l’activation de la contraction musculaire35,36. Pour la première fois, cette approche a permis le suivi de mouvement de capteurs de tension S4 individuels à partir du canal Ca2+ de type L voltage-dépendant (CaV1.1, également connu sous le nom de DHPR) dans l’environnement natif d’une fibre musculaire différenciéeadulte 37. Cela a été accompli en considérant de multiples caractéristiques de ce type de cellule, y compris l’activité électrique de la cellule permettant une dépolarisation auto-propagée induite par stimulation rapide, la capacité d’exprimer le plasmide de l’ADNc par électroporation in vivo, la haute expression naturelle et l’organisation compartimentale des canaux dans la cellule, et sa compatibilité avec les dispositifs d’imagerie et d’enregistrement électrophysiologique à grande vitesse. Auparavant, nous utilisions un microscope confocal à balayage linéaire à grande vitesse comme dispositifde détection 37. Maintenant, une variante de la technique est présentée à l’aide d’une photodiode pour l’acquisition du signal. Ce système de détection à base de photodiodes pourrait faciliter la mise en œuvre de cette technique dans d’autres laboratoires.
Ici, un protocole étape par étape pour utiliser FSDF dans les cellules natives pour l’étude du mouvement individuel du capteur de tension à partir de CaV1.1 est décrit. Bien que le canal CaV1.1 ait été utilisé comme exemple tout au long de ce manuscrit, cette technique pourrait être appliquée à des domaines extracellulaires accessibles d’autres canaux ioniques, récepteurs ou protéines de surface.
Protocole
Ce protocole a été approuvé par le comité institutionnel de soin et d’utilisation des animaux de l’Université du Maryland. Le protocole suivant a été divisé en plusieurs sous-sections, comprenant (1) la conception de la construction moléculaire et la sélection du colorant réagissant à la cystéine, (2) l’électroporation in vivo , (3) la dissection musculaire et l’isolement des fibres, (4) la description de la configuration de l’acquisition, (5) l’évaluation de l’activité électrique positive améliorée de la protéine fluorescente verte (EGFP) et la coloration de la cystéine, et (6) l’acquisition et le traitement du signal. De plus, au début de chaque section, certaines considérations pertinentes sont détaillées lors de l’application de FSDF dans une fibre musculaire squelettique. Toutes les sections du protocole doivent être effectuées avec un équipement de protection individuelle approprié, y compris une blouse de laboratoire et des gants.
1. Conception de la construction moléculaire et sélection du colorant réagissant à la cystéine
- La conception de la construction est un élément essentiel du succès de l’expérience. Tout d’abord, générez une construction d’ADNc CaV1.1 de type sauvage, marquée par fluorescence, et évaluez son expression dans le type de cellule approprié. Pour les fibres musculaires, une forte efficacité de transfection peut être obtenue en utilisant un plasmide porteur d’un promoteur de cytomégalovirus (CMV). Dans ce protocole, un plasmide EGFP-CaV1.1 de lapin déjà caractérisé a été utilisé38.
REMARQUE: Lors de l’ingénierie de la construction de l’ADNc pour introduire un résidu de cystéine dans un canal ionique voltage-dépendant, la position de la cystéine est critique et doit être soigneusement examinée. La cystéine doit être accessible depuis l’espace extracellulaire pour permettre une réaction de colorant conjugué au thiol (Figure 1C,D) et doit être proximale à la région S4 pour suivre précisément son mouvement en réponse à la dépolarisation. Cependant, pour permettre l’extinction de la fluorescence du colorant en réponse au mouvement des protéines, le fluorophore conjugué à la cystéine introduit doit se trouver à l’interface de deux environnements différents (p. ex. membrane et liquide extracellulaire; Figure 1E). En outre, il est essentiel de s’assurer que la cystéine insérée n’interfère pas avec la fonction protéique. - Pour se faire une idée de la localisation correcte de la cystéine, recueillir des informations sur la structure des canaux ou à partir d’autres expériences de fluorométrie d’autres protéines de canaux apparentées. Pour la conception de constructions Ca V 1.1modifiées par cystéine, évaluer la structure résolue de cryo-microscopie électronique (cryo-EM) du canal26 et comparer l’insertion de cystéine de travaux antérieurs à partir de canaux connexes tels que CaV1.212, ou d’autres canaux tels que Shaker11 et NaChBac39.
- Une fois que la position appropriée de la cystéine est choisie, utilisez un kit de mutagénèse dirigé vers le site commercial pour introduire des substitutions de cystéine. Dans le présent protocole, les modifications suivantes des cystéines ont été conçues indépendamment sur chaque extrémité cytosolique du segment de détection de tension S4 de CaV1.1 : VSD-I (L159C), VSD-II (L522C), VSD-III (V893C), VSD-IV (S1231C) et UniProtKB: P07293 (Figure 1B).
- Pour les fibres musculaires squelettiques, utilisez le méthanethiosulfonate de 5-carboxytétraméthylrhodamine (MTS-5-TAMRA), qui présente une diffusion appropriée et rapide dans le système membranaire tubulaire transversal, qui est une invagination de la membrane superficielle et l’emplacement prédominant des canaux CaV1.1. Le MTS-5-TAMRA présente une diminution de la fluorescence lors de la transition de la membrane lipidique à un environnement aqueux (Figure 1E).
REMARQUE: Dylight ou dérivés Alexa-maleimide colorent la membrane de surface, mais pas le système tubulaire transversal.
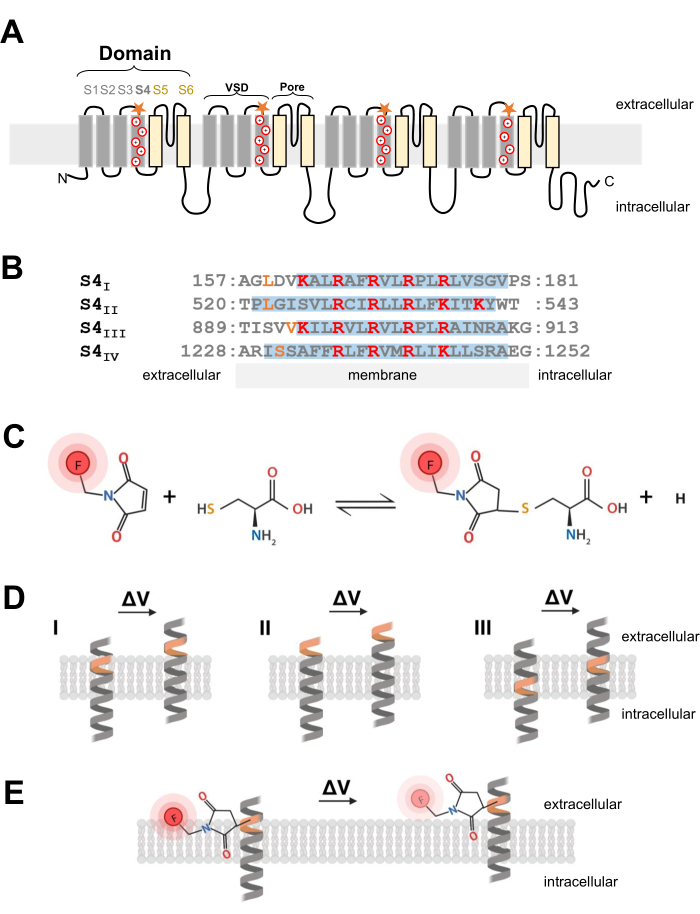
Figure 1 : Schéma de la réaction thiol-cystéine à l’interface d’une α-hélice transmembranaire. (A) Topologie membranaire CaV 1.1 de type L. Les signes plus représentent les résidus basiques dans la α-hélice S4 et les étoiles orange indiquent l’endroit où la cystéine a été introduite par mutagénèse dirigée. (B) Alignement séquentiel de S4I à S4IV du lapin CaV1.1 (UniProtKB: P07293). Les résidus d’arginine et de lysine chargés positivement essentiels pour la détection de tension sont surlignés en rouge, tandis que les substitutions de cystéine modifiées sont indiquées en orange. Ce panneau a été adapté de la référence37. (C) Réaction de la molécule fluorescente cystéine-thiol. (D) Schéma illustrant l’insertion de la mutagénèse de la cystéine dans une α-hélice transmembranaire sensible à la tension. La cystéine doit être enterrée dans la membrane au repos et être accessible de manière extracellulaire après dépolarisation (ΔV; I). Le suivi de la cystéine est généralement peu susceptible de se produire si la cystéine cible est déjà accessible depuis l’espace extracellulaire avant la dépolarisation (II) ou si la cystéine n’est pas accessible depuis l’espace extracellulaire après la dépolarisation (III). (E) Après la réaction avec la molécule fluorescente de thiol, le mouvement en hélice α en réponse à la dépolarisation diminue l’émission de fluorescence MTS-5-TAMRA. Le signal fluorométrique est généré par le mouvement de l’hélice S4 et le mouvement subséquent du colorant par rapport au plan de la membrane et de l’environnement aqueux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Électroporation in vivo
NOTE: Des expériences d’électroporation ont été menées comme décrit précédemment38 avec des modifications. Dans la section suivante, le protocole est conçu pour l’électroporation d’un coussinet de pied de la souris. Les volumes doivent être ajustés si les deux pattes sont préparées.
- Aliquote 25-100 μL de solution plasmidique à 2-5 μg/μL dans un tube de 1,5 mL placé sur de la glace.
- Préparer une solution de 0,5 mL de hyaluronidase à 2 mg/mL dans une solution saline stérile et filtrer la solution à l’aide d’un filtre stérile à faible teneur en protéines de liaison de 0,2 μm monté sur une seringue de 1 mL. Conserver dans un tube de 1,5 ml à température ambiante.
- À l’aide d’un appareil d’anesthésie étalonné, anesthésier une souris en utilisant 3 % à 4,5 % d’isoflurane dans O2 (1 L/min) en plaçant la souris dans la chambre d’anesthésie. Confirmez une anesthésie adéquate de l’animal en pinçant le bout de la queue à l’aide d’une pince à épiler. Aucune réaction ne doit être observée lorsque l’anesthésie optimale est atteinte.
- Retirez la souris de la chambre d’anesthésie et placez un masque nasal d’anesthésie sur la souris. Placez l’animal sur le dos sur un coussin chauffant isotherme recouvert d’un coussin de paillasse stérile. Poursuivre l’anesthésie à l’aide du masque antirongeur contenant 3% d’isoflurane dansO2 (1 L/min).
- Pour éviter la sécheresse oculaire pendant la procédure, appliquez une fine couche de crème lacrymale artificielle sur les yeux de l’animal avec une pointe de coton stérile. Désinfectez la patte de l’animal à l’aide d’une lingette stérile saturée d’alcool éthylique.
- À l’aide d’une aiguille d’insuline stérile de 0,5 po de long de 29 G, aspirer 20 μL de solution de hyaluronidase. Pénétrez la peau au niveau du talon et faites glisser l’aiguille par voie sous-cutanée vers la base des orteils (Figure 2A). Injectez lentement la solution tout en déplaçant progressivement l’aiguille vers l’arrière. Un bolus ou une bosse doit être observé sous la patte (Figure 2B).
REMARQUE : Selon l’âge de l’animal et la taille de la patte, il est probable que la quantité totale de solution ne soit pas injectée. Souvent, une petite fuite au point d’injection peut se produire. - Répétez l’étape 2.6 avec l’autre patte, si vous le souhaitez, en utilisant une autre aiguille stérile après une bonne désinfection des pattes, comme à l’étape 2.5.
- Débranchez l’anesthésie en retirant l’animal du masque nasal et ramenez la souris dans la cage avec accès à la nourriture et à l’eau ad libitum. Une récupération complète de l’anesthésie doit être observée en ~5 min. Placez le tube contenant la solution plasmidique sur le banc pour lui permettre d’atteindre la température ambiante.
- Après 1 h, anesthésiez l’animal une deuxième fois, placez-le sur le coussin chauffant et désinfectez la patte comme décrit aux étapes 2.3-2.5.
- Injecter 10 à 20 μL de la construction de l’ADNc, en utilisant la même technique que celle décrite à l’étape 2.6. La quantité totale de construction injectée est de 50 à 100 μg par patte. Répétez la procédure avec la patte controlatérale si vous le souhaitez à l’aide d’une autre seringue stérile.
- Gardez l’animal sous anesthésie sur le coussin chauffant isotherme pendant 5 minutes pour permettre à la solution d’ADNc de se disperser uniformément à travers le tissu.
- Allumez l’appareil d’électroporation et connectez-le au réseau d’électrodes doubles, comme recommandé par le fabricant.
- Désinfectez le double réseau d’électrodes à l’aide d’une lingette saturée d’alcool éthylique. Stabilisez la patte d’une main et insérez d’abord une électrode sous la peau à l’arrière du talon. Ensuite, insérez la deuxième électrode à la base des orteils, en veillant à ce que les orientations des deux électrodes soient perpendiculaires à l’axe du pied (Figure 2C). Orientez la sonde dans une position qui ne contraint pas le pied ou la jambe dans une orientation angulaire extrême.
NOTE: L’insertion d’électrodes pourrait être facilitée par l’utilisation de pincettes et en affûtant régulièrement les extrémités des électrodes. Selon l’âge de l’animal, la taille de la patte peut varier et l’espacement des électrodes doit être adapté en conséquence. - Électroporate les muscles en appliquant 20 impulsions, d’une durée de 20 ms chacune, à 1 Hz. Pour les aiguilles d’électrode espacées de 1 cm, réglez la tension sur ~100 V. Cela devrait être adapté si l’espacement des électrodes est modifié pour atteindre ~100 V/cm. Une légère flexion des chiffres doit être observée lors de la délivrance d’impulsions si les électrodes sont positionnées correctement.
- Répétez les étapes 2.13 et 2.14 avec la patte controlatérale si vous le souhaitez.
- Débranchez l’anesthésie et placez l’animal dans une cage, isolé de son partenaire de comptoir non électroporé avec un accès ad libitum à la nourriture et à l’eau pendant 2 h. Une récupération complète de l’anesthésie doit être observée en ~10 min. Replacez l’animal à l’intérieur de la cage.
NOTE: L’expression de la ou des constructions de l’ADNc dépend fortement de la protéine codée. Le renouvellement des protéines, la quantité et la qualité de l’ADNc, du promoteur plasmidique et d’autres variables peuvent avoir un impact sur l’expression de construction. Dans cette expérience, l’expression optimale de la sous-unité α1S de CaV1.1 avec un promoteur CMV nécessite 4 à 6 semaines, mais peut être détectée à partir de 2 semaines pendant 12-15 mois.
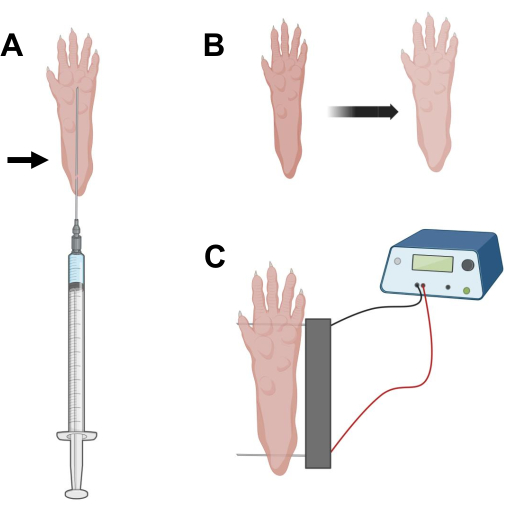
Figure 2 : Schéma de l’injection et de l’électroporation de l’électroporation de l’ADNc positionnant dans un coussinet de pied de souris pour l’électroporation. (A) Position de l’aiguille pour l’injection de hyaluronidase et d’ADNc sous un coussinet de pied de souris. La flèche indique le point d’insertion à travers la peau. (B) Une légère décoloration de la peau et une légère augmentation de la taille des pattes doivent être observées de manière transitoire après l’injection. (C) Positionnement du réseau d’électrodes pour l’électroporation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Dissection musculaire et isolement des fibres
NOTE: La dissociation des fibres musculaires squelettiques a été réalisée comme décrit précédemment 37,40,41 avec des modifications. Dans la section suivante, le protocole convient à deux coussinets de pied de la souris.
- Avant la dissociation des fibres, préparer la plaque recouverte de sylgard en ajoutant une partie d’agent de durcissement à 10 parties d’élastomère (% p/p) dans une boîte de Petri en plastique de 60 mm pour atteindre une épaisseur de ~5 mm. Laisser durcir la plaque recouverte d’élastomère pendant une nuit avant utilisation. Il peut être réutilisé plusieurs fois s’il est correctement stocké et désinfecté avec de l’alcool éthylique à 70% avant et après utilisation.
- Préparer 4 mg de collagénase de type I dans 2 mL de milieu d’aigle essentiel (S-MEM) complété par 10 % de sérum fœtal bovin (FBS; concentration finale de 2 mg/mL). Transférer la solution sur une plaque en plastique non revêtue de 35 mm et placer la capsule dans un incubateur à 37 °C, 5% de CO2.
REMARQUE : S-MEM est une formulation MEM modifiée sans glutamine ni Ca2+. L’absence de Ca2+ à cette étape réduit la contracture des fibres pendant la digestion enzymatique et la trituration. - Ajouter 5 mL de S-MEM complété par 10% FBS dans une plaque de plastique non revêtue de 60 mm et conserver dans l’incubateur à 37 °C, 5% CO2.
- Euthanasier les animaux par asphyxie via CO2 suivie d’une luxation cervicale. Pour réduire la contamination lors de l’isolement des cellules primaires, immerger la carcasse de l’animal dans de l’alcool éthylique à 70% pendant ~10 s. Retirer et sécher la carcasse avec du papier absorbant et couper les pieds avec une paire de ciseaux entre la cheville et le genou (figure 3A).
- Fixez un pied de l’animal, la patte tournée vers le haut, avec des broches de dissection sur la plaque recouverte d’élastomère sous un microscope à dissection à un grossissement de 10x.
- À l’aide de ciseaux à dissection et d’une pince à épiler fine, retirez la peau de la patte pour exposer le muscle fléchisseur du digitorum brevis (FDB) (Figure 3B). Pour prévenir la sécheresse des tissus, ajoutez une goutte de S-MEM 10% FBS au muscle à l’aide d’une pipette de 1 000 μL.
- Au niveau du talon, inciser le tendon et disséquer soigneusement le muscle FDB du talon à l’orteil (Figure 3B). Évitez autant que possible les tensions sur le muscle lors de la dissection. Trop de force appliquée sur les tissus entraînera des dommages aux fibres musculaires. Placez le muscle immédiatement dans la solution de collagénase.
- Répétez les étapes 3.5-3.7 avec le pied controlatéral. Placer le muscle disséqué dans la solution de collagénase dans un incubateur à 37 °C, 5% de CO 2 pendant2 h 45 min à 3 h 15 min. Adapter le temps d’incubation en fonction de l’activité enzymatique de la collagénase et de l’âge de l’animal.
- Pendant l’incubation du tissu musculaire, ajoutez 300 μL de MEM froid sans sérum ni antibiotiques au centre d’un plat en verre de 35 mm. Ajouter 2 μL de laminine froide à 1,20 mg/mL directement dans le MEM. Répétez le processus pour le nombre de plats souhaité. Placer les boîtes dans l’incubateur de culture cellulaire à 37 °C, 5% de CO2 pendant au moins 1 h pour permettre la polymérisation de la laminine.
- Lorsque la digestion enzymatique est terminée, transférer le muscle dans la boîte de culture cellulaire de 60 mm contenant 10% de FBS S-MEM à l’aide d’une pipette Pasteur en verre poli au feu de grand calibre (5 mm) et d’une ampoule en latex.
- À l’aide d’une pipette Pasteur en verre poli au feu de plus petit alésage (2 mm) et d’un bulbe en latex, triturer doucement le muscle au microscope à dissection (figure 3C). Les fibres musculaires dissociées doivent commencer à se détacher du tissu et être libérées dans la solution.
REMARQUE: En règle générale, moins de trituration (15-30 passages de pipette) est toujours préférable, car une trituration trop prolongée peut stresser ou même endommager les fibres. - À l’aide d’une pince à épiler fine, retirez tout tissu non musculaire, comme les nerfs, les tendons ou les vaisseaux sanguins (Figure 3D).
- Ajouter 2 mL de FBS chaud MEM 2% à chaque plat de fond en verre recouvert de laminine de 35 mm. À l’aide d’une pipette de 200 μL et d’un embout de pipette en plastique stérile, transférer les fibres musculaires dissociées dans le plat inférieur en verre recouvert de laminine de 35 mm (figure 3E).
REMARQUE: Atteindre une faible densité de fibres et permettre aux fibres d’être bien séparées les unes des autres est important pour éviter le chevauchement des fibres. - Placer le plat à fond en verre de 35 mm dans l’incubateur à 37 °C, 5% CO2. Les fibres peuvent être utilisées dans un délai de 2 à 20 h.
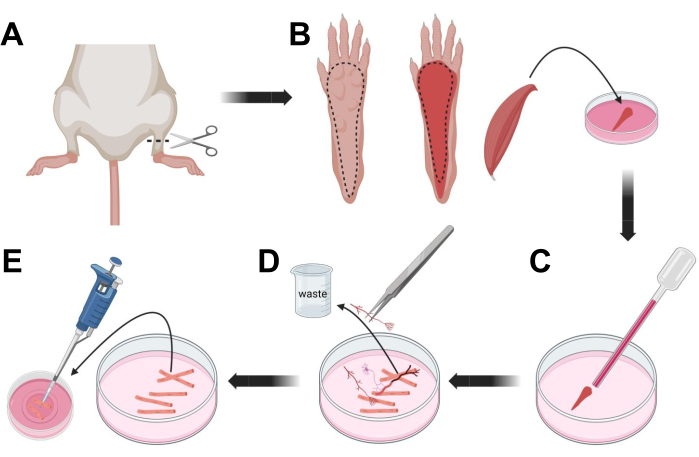
Graphique 3; Dissection et dissociation musculaire des fibres FDB. (A) Après dissection du pied au-dessus de l’articulation de la cheville (ligne pointillée), la peau sous la patte du pied est enlevée, en suivant la ligne pointillée pour exposer le muscle FDB (B). Le muscle est disséqué et placé dans une solution de collagénase. (C) Après incubation, le muscle est trituré pour se dissocier et obtenir des fibres musculaires individuelles. (D) Une pince à épiler fine est utilisée pour enlever les tissus non musculaires et les débris avant de transférer les fibres musculaires dans le plat de culture de fond en verre recouvert de laminine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Description de la configuration de l’acquisition
REMARQUE : La configuration d’acquisition est comparable à celle décrite précédemment42 avec des modifications (Figure 4A).
- Allumez tous les composants : ordinateur, convertisseur AD/DA et amplificateur de pince de chemin, microscope, étage motorisé, manipulateur(s), alimentation de la photodiode, source lumineuse, obturateur lumineux, générateur d’impulsions et éditeur de protocole.
- Activez la logique transistor-transistor (TTL) déclenchant le signal OUT de l’AD/DA pour contrôler le générateur d’impulsions, l’obturateur lumineux et l’éditeur de protocole.
- Utilisez le signal de sortie TTL du générateur d’impulsions et connectez-vous à un canal AD de l’amplificateur pour vérifier le déclenchement temporel précis. Un contrôle adéquat de la cohérence du déclenchement doit être évalué soigneusement avant l’expérience afin d’assurer une synchronisation adéquate de l’appareil.
REMARQUE: Dans le cas de CaV1.1, attendez-vous à voir un signal maximal en moins de 4-10 ms après la stimulation (temps pour développer un mouvement de charge maximal5). Le signal est rapide et une résolution temporelle précise est essentielle pour comparer avec d’autres mesures, telles que le transitoire de calcium ou le mouvement de charge mesuré via une pince de tension. - Pour focaliser la lumière d’excitation sur une zone ou un point spécifique de la fibre (Figure 4B), utilisez un diaphragme positionné dans le trajet de la lumière d’excitation. Cela permet l’acquisition du signal uniquement dans une zone où le signal EGFP-CaV1.1 est maximal (Figure 4B).
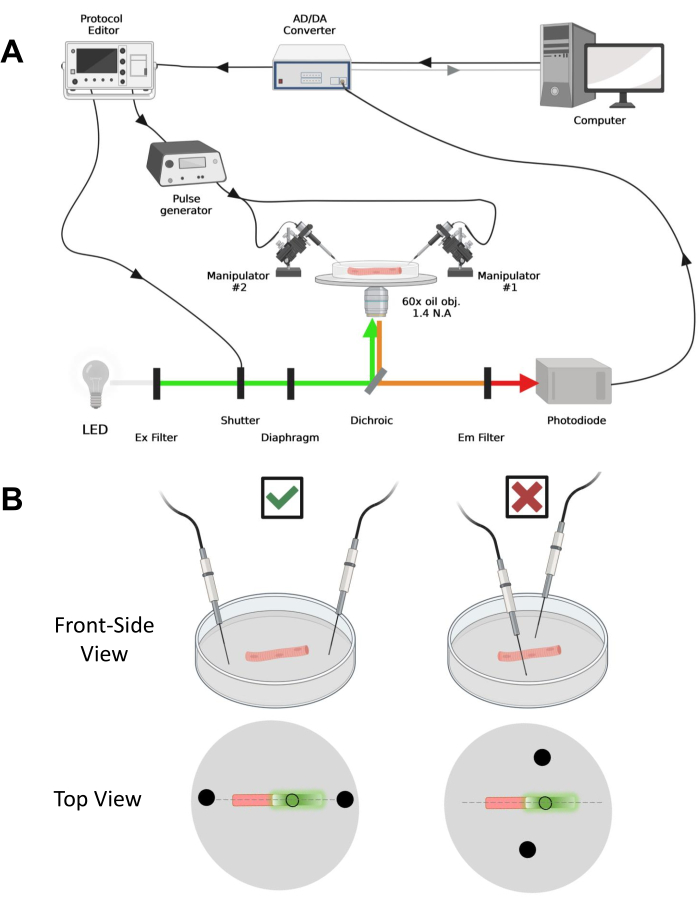
Figure 4: Description du système d’enregistrement. (A) Schéma illustrant la connexion entre les différents composants de l’appareil d’enregistrement. L’installation se compose d’un microscope inversé avec un étage motorisé, d’une source lumineuse à diodes électroluminescentes (LED), d’un obturateur lumineux, d’un circuit de surveillance de la lumière à base de photodiodes sur mesure avec une fonction track and hold43, d’un convertisseur AD/DA (à partir d’un amplificateur patch clamp), d’un générateur d’impulsions analogiques, d’une unité de stimulation de champ externe couplée à des électrodes de stimulation de champ, manipulateurs motorisés et logiciels commerciaux pour l’acquisition, la synchronisation et la génération de protocoles. L’électrode pour la stimulation de champ est constituée de deux fils de platine soudés à des câbles de cuivre reliés au générateur d’impulsions via un connecteur BMC. Des filtres d’excitation et d’émission spécifiques sont utilisés pour détecter les signaux EGFP et MTS-5-TAMRA. Pour exciter EGFP, une lampe au xénon avec un filtre d’excitation (Ex) de 488 nm (± 20 nm) et un filtre Em LP510 nm est utilisée. Pour MTS-5-TAMRA, une source lumineuse LED de 530 nm et un filtre EM LP550 nm sont utilisés. (B) Vue d’une fibre exprimant une construction EGFP-CaV1.1-cys avec les électrodes de stimulation à deux champs (cercles noirs) orientées correctement (à gauche) et mal (à droite) dans l’axe principal des fibres (ligne pointillée). Le cercle noir non rempli représente la zone d’acquisition avec un diamètre contrôlé par l’ouverture du diaphragme, placée devant la source lumineuse. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Évaluation de l’activité électrique des fibres EGFP-positive et de la coloration à la cystéine
REMARQUE: La stimulation du champ des fibres musculaires squelettiques est effectuée comme décrit précédemment41 avec des modifications. Cette approche est utilisée pour (1) identifier les fibres saines, fonctionnelles et électriquement sensibles, (2) colorer les fibres avec le colorant fluorescent réactif à la cystéine, et (3) enregistrer le signal fluorescent en réponse au potentiel d’action propagé. Chaque étape de cette section et de la suivante doit être effectuée dans un environnement peu éclairé afin de réduire le blanchiment par colorant fluorescent.
- Placez le plat inférieur en verre de 35 mm contenant des fibres musculaires dissociées sur la scène du microscope. Retirer délicatement le milieu de culture à l’aide d’une pipette de 1 000 μL et remplacer par 2 mL de solution de Ringer à température ambiante (voir le tableau 1 pour la composition). Plusieurs cycles de remplacement des milieux peuvent être nécessaires pour retirer complètement le milieu de culture cellulaire d’origine contenant des cystéines libres.
- À l’aide d’un manipulateur mécanique ou motorisé, placez les deux fils de platine perpendiculairement au fond de la boîte. Assurez-vous que les bornes des électrodes sont alignées par rapport à l’axe longitudinal de la fibre et à quelques millimètres des extrémités de la fibre, et que la séparation entre les électrodes est de 5 mm (Figure 4B). Ajustez davantage le positionnement de l’électrode en faisant pivoter la parabole ou en montant chaque électrode sur un micromanipulateur indépendant (Figure 4B).
- Allumez la lumière transmise et trouvez les fibres dans le champ de vision à l’aide d’un objectif 20x. Déplacez le cube de filtre EGFP dans la voie de lumière.
NOTE: À l’aide d’un microscope équipé d’épifluorescence et d’un objectif à faible grossissement (2x), il est possible d’évaluer l’efficacité de la transfection de construction dans l’ensemble du muscle avant la dissociation des fibres en évaluant l’expression de l’EGFP (Figure 5A). - À l’aide d’un obturateur télécommandé, activez la lumière d’excitation de 488 nm pour identifier les fibres EGFP-positives. Stockez l’emplacement x-y de la fibre sur la parabole à l’aide d’une platine de microscope motorisée. Le signal EGFP est souvent hétérogène au sein de la fibre (Figure 4B). Centrez la position enregistrée sur le signal EGFP le plus lumineux.
- Après avoir identifié les fibres EGFP-positives, revenez à la première localisation enregistrée. À l’aide d’un interrupteur de déclenchement manuel, délivrez deux impulsions de stimulation séquentielles d’une durée de 1 ms et d’une amplitude de 20 V. Réglez la polarité des impulsions sur alternance.
- Après la stimulation, observez deux contractions concentriques homogènes des fibres en réponse aux deux impulsions de polarité opposée. Une contraction locale ou l’absence de contraction dans les réponses à des impulsions de polarité alternée indique des réponses passives locales non propagées ou une inexcitabilité41. Exclure ces fibres pour le reste de l’expérience.
- Ajouter 2 μL de solution de MTS-5-TAMRA à 10 mM directement dans la capsule et mélanger doucement avec une pipette de 1 000 μL (concentration finale de 10 μM). Veillez à ne pas déplacer le plat, sinon les positions de fibres stockées seront perdues. Incuber pendant 4-5 min pour permettre la diffusion de la molécule de thiol fluorescent dans la lumière du système tubulaire transversal.
- Appliquer des stimulations bipolaires répétitives pour évoquer des trains de potentiel d’action successifs à une vitesse de 50 Hz pendant 300 ms toutes les 1 s pendant 5 min.
REMARQUE: Les trains d’impulsions donnent accès aux cystéines insérées dans le S4 de l’EGFP-CaV1.1 pour réagir avec MTS-5-TAMRA. La capacité de la fibre à se contracter mécaniquement en réponse à la stimulation est importante pour que le contenu de la lumière tubulaire transversale se déroule en cycle avec l’environnement extracellulaire. - Retirer la solution de coloration de la capsule à l’aide d’une pipette de 1 000 μL et la remplacer par 2 ml de solution de Ringer à température ambiante. Deux ou trois tours peuvent être nécessaires pour éliminer complètement le MTS-5-TMRA non conjugué. Laissez la fibre colorée récupérer du protocole de coloration pendant au moins 10 minutes.
- Comme à l’étape 5.6, réévaluer la santé et l’activité électrique des fibres en observant la contraction symétrique des fibres en réponse à l’alternance de polarité. Exclure les fibres qui ne répondent pas aux deux stimulations du reste de l’expérience.
- Déplacez le cube filtrant MTS-5-TAMRA dans la voie lumineuse. À l’aide d’un obturateur télécommandé, activez la lumière d’excitation de 533 nm pour confirmer la coloration homogène MTS-5-TAMRA sur les fibres.
REMARQUE : Lors de la coloration avec MTS-5-TAMRA, les cystéines modifiées et endogènes réagissent avec le dérivé maléimide (Figure 5B). Ainsi, il est difficile d’évaluer la réaction appropriée avec la cystéine d’intérêt. CaV1.1 est principalement exprimé dans le tubule transversal, formant un motif à double bande distinguable. À l’aide d’un microscope confocal ou épifluorescence, une image x-y pourrait être utilisée pour confirmer la coloration correcte et l’entrée et la diffusion transversales des tubules de MTS-5-TAMRA (figure 5C).
6. Acquisition et traitement du signal
REMARQUE: Avant d’effectuer des mesures fluorométriques, l’acquisition du signal doit être soigneusement conçue pour obtenir le rapport signal / bruit optimal. Des taux d’échantillonnage plus lents permettent une meilleure détection de la lumière tout en réduisant le nombre de points qui seraient acquis lors du réarrangement conformationnel des protéines. Dans le cas de l’EGFP-CaV1,1 cys, le mouvement de charge induit par une forme d’onde de potentiel d’action se produit en ~1-10 ms37. Pour obtenir plusieurs points pour suivre l’évolution du mouvement au fil du temps, l’acquisition a été fixée à 50 μs par point.
- Placez la fibre au milieu du champ de vision avec un système de grossissement approprié. Pour ces expériences, un objectif inversé à 1,4 ouverture numérique (NA) à huile 60x a été utilisé. Optimiser l’éclairage et la position de la fibre avec l’étage motorisé et le diaphragme pour éclairer une zone circulaire du diamètre de la fibre, où le signal EGFP est maximal (Figure 4B).
- Une fois la fibre positionnée pour l’acquisition, orientez les deux fils de platine de stimulation de champ montés indépendamment à chaque extrémité de la fibre. Alignez les fils sur l’axe principal des fibres en ligne droite et espacez-les de 5 mm avec la fibre au centre (Figure 4B).
- Réglez les filtres d’excitation et d’émission d’acquisition sur les paramètres appropriés pour MTS-5-TAMRA. Démarrez l’expérience en exécutant le protocole écrit dans le logiciel d’acquisition. Cette étape déclenche tous les dispositifs en aval (c’est-à-dire l’éditeur de protocole, l’obturateur de lumière, le générateur d’impulsions).
REMARQUE : Ce protocole permet une brève période (c.-à-d. 10 ms) d’acquisition de la ligne de base avant la livraison du stimulus de champ pour permettre des mesures ultérieures de la fluorescence au repos. - Initier un seul ou un train de potentiels d’action avec une impulsion carrée de 0,5 ou 1 ms, 20 V. Minimisez autant que possible le temps total d’acquisition pour éviter le blanchiment du signal.
REMARQUE: Même en cas d’enregistrement au centre de la fibre, un signal de fluorescence lié au mouvement peut se produire et peut être confondu avec le signal fluorescent en raison d’un changement conformationnel protéine-fluorophore (Figure 5D). Le signal induit par la contraction doit être retardé par rapport au temps prévu de mouvement de charge après la stimulation37. - Pour distinguer davantage le signal résultant des mouvements S4 de celui dû à la contraction des fibres, ajouter 1 μL de 100 mM de N-benzyl-p-toluène sulfonamide (BTS; concentration finale de 50 μM) à la solution d’enregistrement pour minimiser les réponses contractiles et répéter l’étape 6.4. Les signaux détectés une seconde fois après immobilisation pharmacologique des fibres correspondent au mouvement moléculaire de l’hélice S4 marquée (Figure 5D).
REMARQUE: Aucun signal ne doit être détecté dans le contrôle EGFP-CaV1.1 sans cystéine modifiée après suppression de mouvement avec BTS. - En utilisant les mêmes réglages, acquérir un signal similaire dans un endroit de la parabole où aucune fibre musculaire ni débris ne sont présents pour obtenir une valeur de fluorescence de fond.
- Importez les fichiers qui contiennent le cours temporel de la fluorescence brute [Fr(t)] de la fibre et de la fluorescence de fond [Fb(t)] dans le logiciel d’analyse de données. Faites la moyenne de la colonne qui contient Fb(t) pour obtenir une valeur Fb homogène. Soustrayez Fb du Fr(t) pour obtenir les valeurs absolues de fluorescence [F(t)]. Lissez le signal résultant avec une fonction de lissage si nécessaire.
REMARQUE: Avec ce système de détection et la fréquence d’acquisition, nous avons décidé d’utiliser une fonction de moyenne adjacente avec une fenêtre de 50 points pour le lissage. - Faire la moyenne des valeurs F(t) de base dans un intervalle de temps de 10 ms avant la stimulation pour obtenir une valeur de fluorescence au repos (F0). Soustrayez F0 du F(t) lissé pour obtenir le changement absolu de fluorescence [ΔF(t)]. Ensuite, pour exprimer le changement de fluorescence au fil du temps par rapport à la fluorescence au repos (ΔF/F0), divisez ΔF(t) par F0.
- Pour évaluer l’étendue du blanchiment du signal, définir deux points du signal ΔF/F0 dans le temps, avant et après la stimulation et loin du signal fluorométrique. Ajustez une fonction linéaire à ces deux points pour obtenir une trace de base. Soustrayez la ligne de base à ΔF/F0 au fil du temps pour corriger le blanchiment du signal.
- Soustrayez de la colonne temporelle le délai entre le début de l’acquisition et le signal de rétroaction de la stimulation, pour avoir t = 0 correspondant au début du stimulus électrique.
REMARQUE: Pour permettre plusieurs comparaisons de signaux, il est souvent nécessaire de normaliser l’amplitude du signal. Différentes approches peuvent être utilisées en fonction du but de l’expérience. Dans la section de résultats suivante, nous nous sommes intéressés à la cinétique du signal, nous avons donc utilisé une méthode simple consistant à normaliser chaque signal par la valeur minimale atteinte (c’est-à-dire le pic négatif).
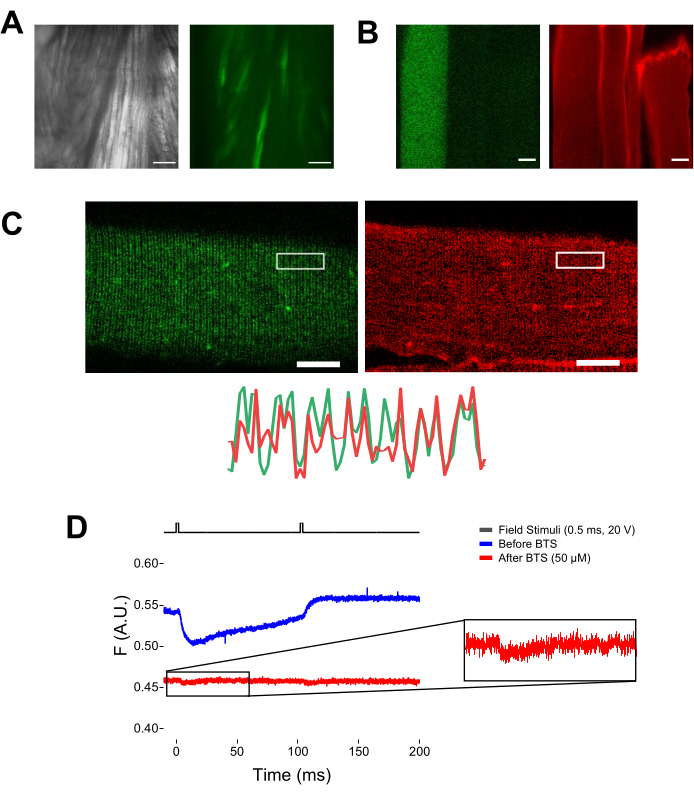
Figure 5 : Imagerie de fibres musculaires exprimant EGFP-CaV1,1-cys sans coloration MTS-5-TAMRA et enregistrement fluorométrique brut représentatif. (A) Exemples d’images transmises (à gauche) et fluorescentes (à droite) du muscle disséqué, non dissocié, exprimant une construction EGFP-CaV1.1 VSD-III. Barre d’échelle: 100 μm. (B) Image représentative d’une fibre musculaire exprimant une construction EGFP-CaV1.1 VSD-III avant (à gauche) et après (à droite) la coloration MTS-5-TAMRA. Les cystéines endogènes de fibres non transfectées sont également colorées par le colorant. Barre d’échelle: 30 μm. (C) L’image confocale d’une construction EGFP-Ca V 1.1 VSD-III (à gauche) et la coloration MTS-5-TAMRA (à droite) montrent un motif classique àdouble bande caractéristique de la localisation CaV1.1 sur le système tubulaire transversal de la fibre musculaire (en bas). Barre d’échelle: 25 μm. (D) Enregistrement fluorométrique représentatif en réponse à deux stimuli et mesuré avec une photodiode avant (trace bleue) et après (trace rouge) immobilisation des fibres avec N-benzyl-p-toluène sulfonamide (BTS). La ligne noire supérieure indique le protocole de dépolarisation des fibres via la stimulation de champ externe. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Lorsque des potentiels d’action de propagation sont déclenchés en réponse à une stimulation de champ répétitive, il est possible de suivre le mouvement spécifique du capteur de tension en réponse à une fréquence spécifique de dépolarisation. Comme le montre la figure 6A, le mouvement des hélices marquées VSD-II peut être suivi en réponse à chacune des deux dépolarisations successives appliquées à 10 Hz (c.-à-d. espacées de 100 ms). Le blanchiment du signal peut être ...
Discussion
Ici, un protocole étape par étape pour effectuer FSDF dans les fibres musculaires pour l’étude des mouvements individuels du capteur de tension du canal CaV1.1 est décrit. Même si le nombre d’étapes et la diversité des approches combinées dans cette technique peuvent sembler complexes, la plupart de ces techniques sont souvent couramment utilisées dans les laboratoires de biophysiciens et de biologistes cellulaires. Ainsi, la complexité apparente réside principalement dans la combinaison de tout...
Déclarations de divulgation
Les auteurs ne signalent aucun conflit d’intérêts.
Remerciements
Nous remercions le Dr J. Vergara (Université de Californie, Los Angeles) d’avoir partagé le plasmide de type sauvage EGFP-CaV1.1 (lapin). Nous remercions le Yale Department of Physiology Electronics Laboratory et surtout Henrik Abildgaard pour la conception et la construction de la photodiode avec circuit de piste et de maintien. Ce travail a été soutenu par les subventions R01-AR075726 et R01-NS103777 des National Institutes of Health
matériels
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
Références
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915 (2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. . Excitation-Contraction Coupling in Skeletal Muscle. , (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. . Muscle: Fundamental Biology and Mechanisms of Disease. , 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22 (2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118 (2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520 (2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6 (2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon