A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פלואורומטריה פונקציונלית מכוונת אתר בתאים מקומיים לחקר עוררות שרירי השלד
In This Article
Summary
פלואורומטריה פונקציונלית מכוונת אתר היא שיטה לחקר תנועות תחום החלבונים בזמן אמת. שינוי טכניקה זו ליישומה בתאים מקומיים מאפשר כעת זיהוי ומעקב אחר תנועות חיישן מתח יחיד מתעלות Ca2+ מגודרות מתח בסיבי שריר שלד מבודדים.
Abstract
פלואורומטריה פונקציונלית מכוונת אתר הייתה הטכניקה הנבחרת לחקור את יחסי מבנה-פונקציה של חלבוני ממברנה רבים, כולל תעלות יונים מגודרות מתח. גישה זו שימשה בעיקר במערכות ביטוי הטרולוגיות כדי למדוד בו זמנית זרמי ממברנה, את הביטוי החשמלי של פעילות התעלות, ומדידות פלואורסצנטיות, המדווחות על סידורים מחדש של תחומים מקומיים. פלואורומטריה פונקציונלית מכוונת אתר משלבת אלקטרופיזיולוגיה, ביולוגיה מולקולרית, כימיה ופלואורסצנטיות לטכניקה רחבה אחת המאפשרת לחקור סידורים מבניים בזמן אמת ותפקוד באמצעות פלואורסצנטיות ואלקטרופיזיולוגיה, בהתאמה. בדרך כלל, גישה זו דורשת תעלת ממברנה מגודרת מתח מהונדסת המכילה ציסטאין שניתן לבדוק על ידי צבע פלואורסצנטי תגובתי תיול. עד לאחרונה, הכימיה הריאקטיבית של תיול המשמשת לתיוג פלואורסצנטי מכוון אתר של חלבונים בוצעה אך ורק בביציות ובקווי תאים של קסנופוס , מה שהגביל את היקף הגישה לתאים ראשוניים שאינם מעוררים. דו"ח זה מתאר את היישום של פלואורומטריה תפקודית מכוונת אתר בתאי שרירי שלד בוגרים כדי לחקור את השלבים המוקדמים של צימוד עירור-כיווץ, התהליך שבו דפולריזציה חשמלית של סיבי שריר קשורה להפעלת התכווצות שרירים. הפרוטוקול הנוכחי מתאר את המתודולוגיות לתכנון והעברה של תעלות Ca2+ מגודרות מתח מהונדסות ציסטאין (CaV1.1) לסיבי שריר של flexor digitorum brevis של עכברים בוגרים באמצעות אלקטרופורציה in vivo ואת השלבים הבאים הדרושים למדידות פלואורומטריה פונקציונאליות מכוונות אתר. גישה זו יכולה להיות מותאמת לחקר תעלות יונים וחלבונים אחרים. השימוש בפלאורומטריה פונקציונלית מכוונת אתר של שרירי יונקים רלוונטי במיוחד לחקר מנגנונים בסיסיים של עוררות.
Introduction
היכולת לעקוב אחר סידורים קונפורמטיביים של תעלות יונים בתגובה לגירוי חשמלי ידוע בתא חי היא מקור למידע רב ערך עבור פיזיולוגיה מולקולרית1. תעלות יונים מגודרות מתח הן חלבוני ממברנה החשים שינויים במתח הטרנסממברנלי, ותפקידם מושפע גם משינויי מתח2. התפתחות טכניקות מהדק מתח במאה הקודמת אפשרה לפיזיולוגים לחקור, בזמן אמת, זרמים יוניים הנישאים על ידי תעלות יונים מגודרות מתח בתגובה לדפולריזציה של הממברנה3. השימוש בטכנולוגיית מהדק מתח היה חיוני להבנת התכונות החשמליות של תאים מעוררים כגון נוירונים ושרירים. בשנות ה-70 של המאה ה-20, עידון מהדק המתח איפשר זיהוי זרמי גאטינג (או תנועת מטען) בתעלות סידן מגודרות מתח (Ca V) ונתרן (NaV) 4,5. זרמי גאטינג הם זרמים קיבוליים לא ליניאריים הנובעים מתנועת חיישני מתח בתגובה לשינויים בשדה החשמלי על פני קרום התא6. זרמי גאטינג נחשבים לביטוי חשמלי של סידורים מולקולריים המקדימים או מלווים את פתיחת תעלת היונים7. בעוד מדידות זרם אלה מספקות מידע רב ערך לגבי תפקוד הערוץ, הן זרמים יוניים והן זרמי גטינג הם קריאות עקיפות של סידורים קונפורמטיביים בין-מולקולריים ותוך-מולקולריים של תעלות מגודרות מתח7.
פלואורומטריה פונקציונלית מכוונת אתר (FSDF; מכונה גם פלואורומטריית מהדק מתח, VCF) פותחה בתחילת שנות התשעים8 וסיפקה לראשונה את היכולת לצפות ישירות בשינויים קונפורמטיביים מקומיים ואת תפקודו של חלבון ערוץ בזמן אמת. באמצעות שילוב של מוטגנזה של תעלות, אלקטרופיזיולוגיה ומערכות ביטוי הטרולוגיות, ניתן לתייג ולעקוב באופן פלואורסצנטי אחר החלקים הנעים של ערוצים או קולטנים ספציפיים בתגובה לגירוי המפעיל 9,10. גישה זו שימשה באופן נרחב לחקר מנגנוני חישת המתח בתעלות יונים מגודרות מתח 8,10,11,12,13,14,15,16,17,18,19. לקבלת סקירות סמכותיות, ראה 10,20,21,22,23.
תעלות Ca V ו-NaV, הקריטיות להפעלה והתפשטות של אותות חשמליים, מורכבות מתת-יחידה ראשית α1, בעלת נקבובית מרכזית וארבעה תחומי חישת מתח לא זהים2. בנוסף למבנה הראשוני הייחודי שלהם, ערוצי Ca V ו- NaV מבוטאים כקומפלקסים מרובי יחידות עם יחידות משנה עזר24. תעלות אשלגן תלויות מתח (K V) מורכבות מארבע תת-יחידות שנראות כמו תחום אחד של Na V או CaV25. תת-היחידה α1 יוצרת נקבוביות וחישת מתח של תעלות Ca V ו-NaV נוצרת על ידי קידוד פוליפפטיד יחיד עבור ארבעה תחומים נפרדים של שישה מקטעים טרנסממברנליים ייחודיים (S1-S6; איור 1A) 24,26. האזור המורכב ממקטעי טרנסממברנה S1 עד S4 יוצרים את תחום חישת המתח (VSD) ומקטעי טרנסממברנה S5 ו-S6 יוצרים את תחום הנקבוביות26. בכל VSD, סליל α S4 מכיל ארגינין או ליזין בעלי מטען חיובי (איור 1A,B) שנעים בתגובה לדפולריזציה של הממברנה7. כמה עשורים של מחקר ותוצאות מגישות ניסיוניות מגוונות ביותר תומכות בהנחה שמקטעי S4 נעים החוצה ויוצרים זרמי גטינג, בתגובה לדפולריזציה של הממברנה6.
FSDF מודד את השינויים הפלואורסצנטיים של צבע תגובתי תיול המצומד לשאריות ציסטאין ספציפיות (כלומר, סליל α S4) על תעלת יונים או חלבון אחר, שהונדסו באמצעות מוטגנזה מכוונת אתר, כאשר התעלה מתפקדת בתגובה לדפולריזציה של הממברנה או גירויים אחרים10. למעשה, FSDF פותח במקור כדי לחקור אם מקטע S4 בערוצי KV, שהוצע להיות חיישן המתח העיקרי של הערוץ, נע כאשר מטעני הגאטינג נעים בתגובה לשינויים בפוטנציאל הממברנה 8,10. במקרה של תעלות יונים מגודרות מתח, FSDF יכול לפתור סידורים קונפורמטיביים עצמאיים של ארבעת ה-VSD (מעקב אחר VSD אחד בכל זמן נתון), במקביל למדידות של פונקציית הערוץ. ואכן, באמצעות גישה זו, הוכח כי VSDs בודדים נראים מעורבים באופן דיפרנציאלי בהיבטים ספציפיים של הפעלת ערוץ והשבתה 12,27,28,29,30. זיהוי התרומה של כל VSD לתפקוד הערוצים הוא בעל רלוונטיות גבוהה וניתן להשתמש בו כדי להבהיר עוד יותר את פעולת הערוץ ואולי לזהות מטרות חדשות לפיתוח תרופות.
השימוש ב-FSDF במערכות ביטוי הטרולוגיות סייע רבות בקידום הבנתנו את תפקוד הערוץ מנקודת מבט רדוקציוניסטית10,23. כמו גישות רדוקציוניסטיות רבות, היא מציגה יתרונות אך יש לה גם מגבלות. לדוגמה, מגבלה עיקרית אחת היא בנייה מחדש חלקית של סביבת ננו התעלה במערכת ההטרולוגית. לעתים קרובות, תעלות יונים מתקשרות עם תת-יחידות עזר רבות וחלבונים רבים אחרים המשנים את תפקידם31. באופן עקרוני, תעלות שונות ותת-היחידות הנלוות שלהן יכולות לבוא לידי ביטוי במערכות הטרולוגיות תוך שימוש במבני קידוד חלבונים מרובים או פלסמידים פוליציסטרוניים, אך לא ניתן לשחזר את סביבתם הטבעית במלואה30,32.
הקבוצה שלנו פרסמה לאחרונה גרסה של FSDF בסיבי שריר שלד מנותקים טבעיים לחקר השלבים המוקדמים של צימוד עירור-כיווץ (ECC)33,34, התהליך שבו דפולריזציה חשמלית של סיבי שריר קשורה להפעלת כיווץ שריר 35,36. בפעם הראשונה, גישה זו אפשרה מעקב תנועה של חיישני מתח S4 בודדים מערוץ Ca2+ מגודר מתח מסוג L (CaV1.1, הידוע גם בשם DHPR) בסביבה הטבעית של סיב שריר מובחןבוגר 37. מטרה זו הושגה על ידי התחשבות במאפיינים רבים של סוג תא זה, כולל הפעילות החשמלית של התא המאפשרת דפולריזציה מהירה המושרה על ידי גירוי עצמי, היכולת לבטא פלסמיד cDNA באמצעות אלקטרופורציה in vivo, הביטוי הגבוה הטבעי והארגון המידור של התעלות בתוך התא, והתאמתו למכשירי הדמיה והקלטה אלקטרופיזיולוגית במהירות גבוהה. בעבר, השתמשנו במיקרוסקופ קונפוקלי לסריקת קווים במהירות גבוהה כמכשיר גילוי37. כעת, וריאציה של הטכניקה מוצגת באמצעות פוטודיודה לקליטת אותות. מערכת זיהוי מבוססת פוטודיודות זו יכולה להקל על יישום טכניקה זו במעבדות אחרות.
כאן מתואר פרוטוקול שלב אחר שלב לניצול FSDF בתאים מקוריים לחקר תנועת חיישן מתח בודד מ- CaV1.1. בעוד ערוץ CaV1.1 שימש כדוגמה לאורך כל כתב היד הזה, טכניקה זו יכולה להיות מיושמת על תחומים נגישים מחוץ לתא של תעלות יונים אחרות, קולטנים, או חלבונים פני השטח.
Access restricted. Please log in or start a trial to view this content.
Protocol
פרוטוקול זה אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת מרילנד. הפרוטוקול הבא חולק למספר תת-סעיפים, המורכבים (1) תכנון מבנה מולקולרי ובחירת צבע מגיב ציסטאין, (2) אלקטרופורציה in vivo , (3) דיסקציה של שרירים ובידוד סיבים, (4) תיאור מערך רכישה, (5) הערכה של חלבון פלואורסצנטי ירוק משופר (EGFP) פעילות חשמלית חיובית של סיבים וצביעת ציסטאין, ו-(6) רכישה ועיבוד של אותות. בנוסף, בתחילת כל סעיף מפורטים כמה שיקולים רלוונטיים בעת יישום FSDF בסיב שריר השלד. כל סעיפי הפרוטוקול צריכים להתבצע עם ציוד מגן אישי מתאים, כולל מעיל מעבדה וכפפות.
1. תכנון מבנה מולקולרי ובחירת צבע תגובת ציסטאין
- תכנון מבנים הוא חלק קריטי בהצלחת הניסוי. ראשית, ליצור מבנה cDNA מסוג פראי, המתויג באופן פלואורסצנטי CaV1.1 ולהעריך את ביטויו בסוג התא המתאים. עבור סיבי שריר, יעילות טרנספקציה חזקה יכולה להיות מושגת באמצעות פלסמיד הנושא מקדם cytomegalovirus (CMV). בפרוטוקול זה, ארנב כבר מאופיין EGFP-CaV1.1 פלסמיד שימש38.
הערה: בעת הנדסת מבנה cDNA כך שיכניס שאריות ציסטאין לתעלת יונים מגודרת מתח, מיקום הציסטאין הוא קריטי ויש לשקול אותו בזהירות. הציסטאין צריך להיות נגיש מהחלל החוץ-תאי כדי לאפשר תגובת צבע מצומד תיול (איור 1C,D), וצריך להיות פרוקסימלי לאזור S4 כדי לעקוב במדויק אחר תנועתו בתגובה לדפולריזציה. עם זאת, כדי לאפשר מרווה פלואורסצנטית של צבע בתגובה לתנועת החלבון, הפלואורופור המצומד של ציסטאין צריך להיות בממשק של שתי סביבות שונות (למשל, ממברנה ונוזל חוץ-תאי; איור 1E). בנוסף, חשוב לוודא שהציסטאין המוחדר אינו מפריע לתפקוד החלבון. - כדי לקבל מושג על לוקליזציה נכונה של ציסטאין, אספו מידע על מבנה התעלה או מניסויים פלואורומטריים אחרים של חלבוני ערוץ קשורים אחרים. לתכנון מבני Ca V 1.1 מהונדסים בציסטאין, העריכו את מבנה מיקרוסקופ הקריו-אלקטרונים (cryo-EM) של ערוץ26 והשוו את החדרת הציסטאין של עבודות קודמות מערוצים קשורים כגון CaV1.2 12, או ערוציםאחרים כגון Shaker11 ו-NaChBac39.
- לאחר בחירת מיקום הציסטאין הנכון, השתמש בערכת מוטגנזה מכוונת אתר מסחרי כדי להציג תחליפי ציסטאין. בפרוטוקול הנוכחי, השינויים הבאים בציסטאין הונדסו באופן עצמאי בכל קצה ציטוסולי של קטע חישת מתח S4 של CaV1.1: VSD-I (L159C), VSD-II (L522C), VSD-III (V893C), VSD-IV (S1231C) ו-UniProtKB: P07293 (איור 1B).
- עבור סיבי שריר השלד, השתמש 5-carboxytetramethylrhodamine methanethiosulfonate (MTS-5-TAMRA), אשר מציג דיפוזיה נכונה ומהירה לתוך מערכת קרום הצינורית הרוחבית, המהווה פלישה של קרום פני השטח ואת המיקום השולט של ערוצי CaV1.1. MTS-5-TAMRA מציג ירידה בפלואורסצנטיות בעת מעבר מקרום השומנים לסביבה מימית (איור 1E).
הערה: נגזרות Dylight או Alexa-maleimide מכתימות את קרום פני השטח אך לא את מערכת הצינוריות הרוחביות.
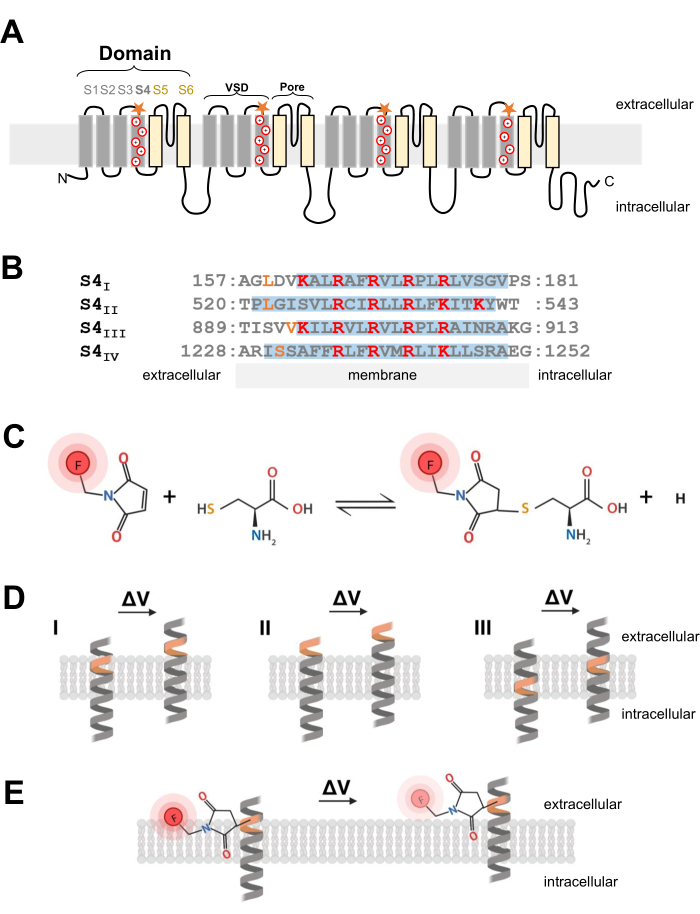
איור 1: סכמה של תגובת תיול-ציסטאין בממשק של סליל α טרנסממברנלי. (A) טופולוגיית קרום CaV 1.1 מסוג L. סימני הפלוס מייצגים שאריות בסיסיות בתוך סליל α S4 והכוכבים הכתומים מציינים את המיקום שבו ציסטאין הוכנס באמצעות מוטגנזה מכוונת אתר. (B) יישור רצף של S4I ל-S4IV של ארנב CaV1.1 (UniProtKB: P07293). ארגינין ושאריות ליזין בעלי מטען חיובי החיוניים לחישת מתח מסומנים באדום, בעוד שתחליפי ציסטאין מהונדסים מסומנים בכתום. לוח זה הותאם מהתייחסות37. (C) תגובת מולקולה פלואורסצנטית של ציסטאין-תיול. (D) תרשים המדגים החדרת מוטגנזה של ציסטאין בתוך סליל α רגיש למתח טרנסממברנלי. ציסטאין צריך להיות קבור בקרום במנוחה ולהיות נגיש מחוץ לתא לאחר depolarization (ΔV; I). מעקב אחר ציסטאין בדרך כלל אינו סביר להתרחש אם ציסטאין המטרה כבר נגיש מהמרחב החוץ-תאי לפני הדפולריזציה (II) או אם הציסטאין אינו נגיש מהמרחב החוץ תאי לאחר דפולריזציה (III). (E) לאחר התגובה עם מולקולת תיול פלואורסצנטית, תנועת הסליל α בתגובה לדפולריזציה מפחיתה את הפלואורסצנטיות MTS-5-TAMRA. האות הפלואורומטרי נוצר על ידי תנועת סליל S4 ותנועת הצבע שלאחר מכן ביחס למישור הממברנה והסביבה המימית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. אלקטרופורציה In vivo
הערה: ניסויי אלקטרופורציה נערכו כמתוארלעיל 38 עם שינויים. בסעיף הבא, הפרוטוקול מיועד אלקטרופורציה של כרית רגל אחת של העכבר. יש לכוונן נפחים אם שתי הכפות מוכנות.
- Aliquot 25-100 μL של תמיסת פלסמיד ב 2-5 מיקרוגרם / μL בצינור 1.5 מ"ל ממוקם על קרח.
- הכינו תמיסה של 0.5 מ"ל של היאלורונידאז 2 מ"ג/מ"ל במי מלח סטריליים וסננו את התמיסה דרך מסנן סטרילי בעל קישור נמוך של 0.2 מיקרומטר המורכב על מזרק 1 מ"ל. יש לאחסן בצינור של 1.5 מ"ל בטמפרטורת החדר.
- באמצעות מכשיר הרדמה מכויל, מרדימים עכבר באמצעות איזופלורן 3%-4.5% ב-O2 (1 ליטר/דקה) על ידי הכנסת העכבר לתא ההרדמה. לאשר הרדמה נאותה של החיה על ידי צביטת קצה הזנב באמצעות זוג פינצטה. אין לראות תגובה כאשר מגיעים להרדמה אופטימלית.
- הסר את העכבר מתא ההרדמה והנח מסכת אף הרדמה על העכבר. הניחו את בעל החיים על גבו על כרית חימום איזותרמית מכוסה בכרית ספסל סטרילית. המשך את ההרדמה באמצעות מסכת מכרסם עם 3% isoflurane ב O2 (1 ליטר / דקה).
- כדי למנוע יובש בעיניים במהלך ההליך, להחיל שכבה דקה של קרם דמעות מלאכותי על העיניים של החיה עם קצה כותנה סטרילי. יש לחטא את כף בעל החיים באמצעות מגבון סטרילי רווי באלכוהול אתילי.
- באמצעות מחט אינסולין סטרילית באורך 0.5 אינץ' 29 גרם, שאפו 20 מיקרוליטר של תמיסת היאלורונידאז. לחדור לעור בגובה העקב ולהחליק את המחט באופן תת-עורי לכיוון בסיס הבהונות (איור 2A). להזריק באיטיות את התמיסה תוך כדי הזזת המחט בהדרגה לאחור. יש לראות בולוס או בליטה מתחת לכפה (איור 2B).
הערה: בהתאם לגיל בעל החיים ולגודל הכפה, סביר להניח שלא ניתן להזריק את מלוא התמיסה הכמותית. לעתים קרובות, דליפה קטנה דרך נקודת ההזרקה עלולה להתרחש. - חזור על שלב 2.6 עם הכף השנייה, אם תרצה, באמצעות מחט סטרילית אחרת לאחר חיטוי כפות מתאים, כמו בשלב 2.5.
- נתקו את חומר ההרדמה על ידי הוצאת בעל החיים ממסכת האף והחזירו את העכבר לכלוב עם גישה למזון ומים עד ליביטום. התאוששות מלאה מהרדמה יש לראות תוך ~5 דקות. הניחו את הצינור המכיל את תמיסת הפלסמיד על הספסל כדי לאפשר לו להגיע לטמפרטורת החדר.
- לאחר שעה אחת, מרדימים את בעל החיים פעם נוספת, מניחים אותו על כרית החימום ומחטאים את הכף כמתואר בשלבים 2.3-2.5.
- הזריקו 10-20 μL של מבנה cDNA, באותה טכניקה המתוארת בשלב 2.6. הכמות הכוללת של המבנה מוזרק הוא 50-100 מיקרוגרם לכל כפה. חזור על ההליך עם הכף הנגדית אם תרצה באמצעות מזרק סטרילי אחר.
- שמור את בעל החיים תחת הרדמה על כרית חימום איזותרמית במשך 5 דקות כדי לאפשר לתמיסת cDNA להתפזר באופן שווה דרך הרקמה.
- הפעל את מכשיר מכשיר האלקטרופורציה וחבר אותו למערך האלקטרודות הכפול, בהתאם להמלצת היצרן.
- יש לחטא את מערך האלקטרודות הכפול באמצעות מגבון רווי באתיל אלכוהול. ייצבו את הכף ביד אחת והכניסו תחילה אלקטרודה אחת מתחת לעור בחלק האחורי של העקב. לאחר מכן, הכניסו את האלקטרודה השנייה לבסיס אצבעות הרגליים, וודאו שהכיוונים של שתי האלקטרודות מאונכים לציר כף הרגל (איור 2C). כיוון את הגשושית בתנוחה שאינה מגבילה את כף הרגל או הרגל בכיוון זוויתי קיצוני.
הערה: החדרת אלקטרודות יכולה להיות קלה יותר באמצעות פינצטה ועל ידי חידוד קבוע של קצות האלקטרודות. בהתאם לגיל החיה, גודל הכף יכול להשתנות ויש להתאים את מרווח האלקטרודות בהתאם. - אלקטרופורציה של השרירים על ידי הפעלת 20 פעימות, משך זמן של 20 אלפיות השנייה/כל אחת, ב-1 הרץ. עבור מחטי אלקטרודה במרווח של 1 ס"מ, הגדר את המתח ל~ 100 V. יש להתאים זאת אם מרווח האלקטרודות משתנה כך שיגיע ל~100 וולט לס"מ. יש לראות כיפוף קל של הספרות במהלך מסירת הדופק אם האלקטרודות ממוקמות כראוי.
- חזור על שלבים 2.13 ו- 2.14 עם הכף הנגדית אם תרצה.
- נתקו את חומר ההרדמה והכניסו את בעל החיים לכלוב, מבודד מחברו הנגדי שאינו מחושמל עם גישה למזון ומים למשך שעתיים. התאוששות מלאה מהרדמה יש לראות תוך ~10 דקות. החזירו את בעל החיים לכלוב.
הערה: ביטוי של מבני cDNA תלוי מאוד בחלבון המקודד. תחלופת חלבונים, כמות ואיכות של cDNA, מקדם פלסמיד ומשתנים אחרים יכולים להשפיע על ביטוי המבנה. בניסוי זה, ביטוי אופטימלי של תת-היחידה α1S של CaV1.1 עם מקדם CMV דורש 4 עד 6 שבועות, אך ניתן לזהות אותו תוך שבועיים למשך עד 12-15 חודשים.
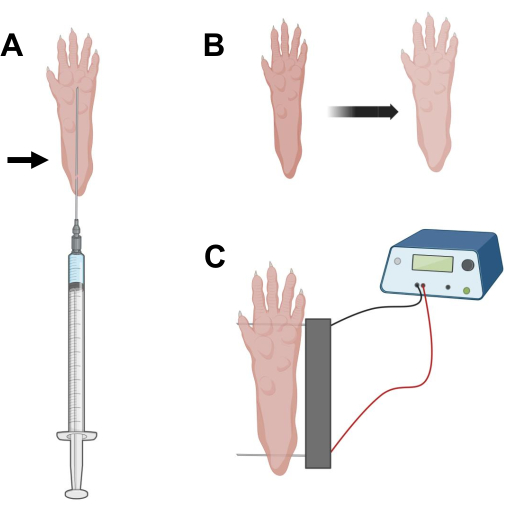
איור 2: דיאגרמה של הזרקת cDNA ומיקום אלקטרודות אלקטרופורציה בכרית רגל של עכבר לצורך אלקטרופורציה . (A) מיקום מחט עבור היאלורונידאז והזרקת cDNA מתחת לכרית רגל של עכבר. החץ מציין את נקודת ההחדרה דרך העור. (B) שינוי צבע קל של העור ועלייה קלה בגודל הכף יש לראות באופן זמני לאחר ההזרקה. (C) מיקום מערך אלקטרודות לצורך אלקטרופורציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. דיסקציה של שרירים ובידוד סיבים
הערה: דיסוציאציה של סיבי שריר השלד בוצעה כמתואר לעיל 37,40,41 עם שינויים. בסעיף הבא, הפרוטוקול מתאים לשתי כריות רגליים של העכבר.
- לפני הדיסוציאציה של הסיבים, הכינו את הצלחת המכוסה בסילגרד על ידי הוספת חלק אחד של חומר מרפא ל-10 חלקים של אלסטומר (% w/w) בצלחת פטרי פלסטיק 60 מ"מ כדי להגיע לעובי של ~5 מ"מ. הניחו לצלחת המכוסה באלסטומר להירפא לילה לפני השימוש. ניתן לעשות בו שימוש חוזר מספר פעמים אם מאחסנים אותו כראוי ומחטאים אותו עם 70% אלכוהול אתילי לפני ואחרי השימוש.
- הכינו 4 מ"ג של קולגנאז מסוג I ב-2 מ"ל של ספינר מדיום נשר חיוני מינימלי (S-MEM) בתוספת 10% נסיוב בקר עוברי (FBS; ריכוז סופי של 2 מ"ג/מ"ל). מעבירים את התמיסה לצלחת פלסטיק לא מצופה בקוטר 35 מ"מ ומניחים את המנה באינקובטור בטמפרטורה של 37°C, 5% CO2.
הערה: S-MEM הוא נוסחת MEM שונה ללא גלוטמין ו-Ca+2. היעדר Ca2+ בשלב זה מפחית את התכווצות הסיבים במהלך עיכול אנזימטי וטריטורציה. - הוסף 5 מ"ל של S-MEM בתוספת 10% FBS בלוח פלסטיק 60 מ"מ לא מצופה ואחסן באינקובטור ב 37 ° C, 5% CO2.
- הרדימו את בעלי החיים על ידי חנק באמצעות CO2 ואחריו נקע צוואר הרחם. כדי להפחית את הזיהום במהלך בידוד תאים ראשוני, השקיעו את פגר החיה ב-70% אלכוהול אתילי למשך ~10 שניות. הוציאו וייבשו את הפגר עם נייר סופג וחתכו את כפות הרגליים בעזרת זוג מספריים בין הקרסול לברך (איור 3A).
- הצמידו רגל אחת של החיה, כשהכף פונה כלפי מעלה, עם סיכות דיסקציה על הצלחת מכוסה האלסטומר תחת מיקרוסקופ דיסקציה בהגדלה של פי 10.
- בעזרת מספריים לדיסקציה ופינצטה עדינה, הסירו את העור מהכף כדי לחשוף את שריר ה-FDB (flexor digitorum brevis) (איור 3B). כדי למנוע יובש ברקמות, הוסיפו טיפה של S-MEM 10% FBS לשריר באמצעות פיפטה של 1,000 μL.
- בגובה העקב, חתכו את הגיד ונתחו בזהירות את שריר ה-FDB מהעקב ועד הבוהן (איור 3B). הימנע מתח על השריר ככל האפשר בעת ביצוע הדיסקציה. כוח רב מדי המופעל על הרקמות יגרום נזק לסיבי השריר. הכניסו את השריר מיד לתמיסת הקולגנאז.
- חזור על שלבים 3.5-3.7 עם כף הרגל הנגדית. הניחו את השריר המנותח בתמיסת הקולגנאז באינקובטור של 37°C, 5% CO2 למשך שעתיים ו-45 דקות עד 3 שעות ו-15 דקות. התאימו את זמן הדגירה בהתאם לפעילות האנזימטית של הקולגנאז ולגיל החיה.
- בזמן שרקמת השריר דוגרת, הוסיפו 300 מיקרוליטר של MEM קר ללא סרום או אנטיביוטיקה במרכז צלחת תחתית זכוכית בקוטר 35 מ"מ. הוסף 2 μL של למינין קר ב 1.20 מ"ג / מ"ל ישירות MEM. חזור על התהליך עבור מספר המנות הרצוי. הכניסו את הכלים לאינקובטור תרבית התאים בטמפרטורה של 37°C, 5% CO2 למשך שעה לפחות כדי לאפשר פילמור למינין.
- כאשר העיכול האנזימטי הושלם, העבירו את השריר לצלחת תרבית תאים בקוטר 60 מ"מ המכילה S-MEM 10% FBS בעזרת פיפטה גדולה (5 מ"מ) מזכוכית מלוטשת אש ונורת לטקס.
- בעזרת פיפטת פסטר קטנה יותר (2 מ"מ) מזכוכית מלוטשת אש ונורת לטקס, הטריטורו בעדינות את השריר תחת מיקרוסקופ דיסקציה (איור 3C). סיבי שריר מנותקים צריכים להתחיל להתנתק מהרקמה ולהשתחרר בתמיסה.
הערה: ככלל אצבע, תמיד עדיף פחות טריטורציה (15-30 מעברי פיפטה), מכיוון שטריטציה ממושכת מדי עלולה לגרום ללחץ או אפילו לנזק לסיבים. - באמצעות זוג פינצטות עדינות, הסירו כל רקמה שאינה שריר, כמו למשל עצבים, גידים או כלי דם (איור 3D).
- הוסף 2 מ"ל של MEM חם 2% FBS לכל צלחת תחתית זכוכית מצופה למינין 35 מ"מ. באמצעות פיפטה של 200 μL וקצה פיפטה סטרילי מפלסטיק, העבירו את סיבי השריר המנותקים לצלחת התחתונה מזכוכית מצופה למינין בקוטר 35 מ"מ (איור 3E).
הערה: חשוב להשיג צפיפות סיבים נמוכה ולאפשר לסיבים להיות מופרדים היטב זה מזה כדי למנוע חפיפת סיבים. - מניחים את צלחת תחתית זכוכית 35 מ"מ באינקובטור ב 37 ° C, 5% CO2. סיבים ניתן להשתמש במסגרת זמן של 2-20 שעות.
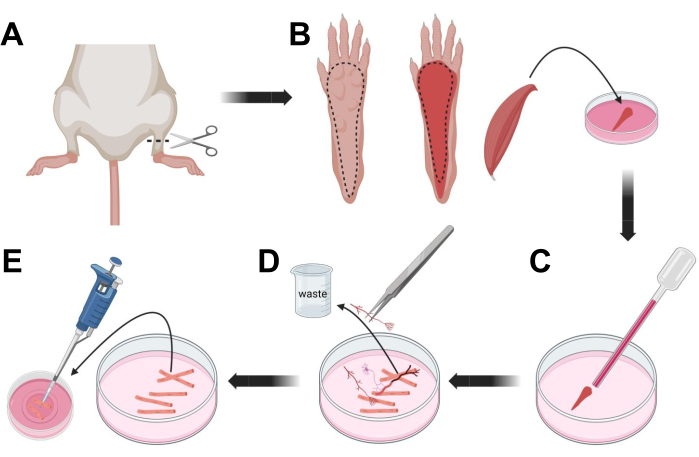
איור 3; דיסקציה ודיסוציאציה של סיבי FDB שריר. (A) לאחר דיסקציה של כף הרגל מעל מפרקי הקרסול (קו מקווקו), העור מתחת לכף הרגל מוסר, בעקבות הקו המקווקו כדי לחשוף את שריר ה-FDB (B). השריר מנותח ומונח בתמיסת קולגנאז. (C) לאחר הדגירה, השריר עובר טריטוציה כדי להתנתק ולקבל סיבי שריר בודדים. (D) פינצטה עדינה משמשת להסרת רקמות שאינן שריר ופסולת לפני העברת סיבי שריר לצלחת תרבית תחתית זכוכית מצופה למינין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. תיאור הגדרת הרכישה
הערה: מערך הרכישה דומה לזה שתואר לפני42 עם שינויים (איור 4A).
- הפעל את כל הרכיבים: מחשב, ממיר AD/DA ומגבר מהדק נתיב, מיקרוסקופ, במה ממונעת, מניפולטור(ים), ספק כוח לפוטודיודה, מקור אור, תריס אור, מחולל פולסים ועורך פרוטוקולים.
- הפעל את לוגיקת טרנזיסטור-טרנזיסטור (TTL) המפעילה אות OUT מה- AD/DA כדי לשלוט במחולל הדופק, בתריס האור ובעורך הפרוטוקול.
- השתמש באות הפלט TTL ממחולל הדופק והתחבר לערוץ AD של המגבר כדי לוודא הפעלה זמנית מדויקת. יש להעריך בזהירות בקרה נאותה של עקביות ההפעלה לפני הניסוי כדי להבטיח סנכרון הולם של המנגנון.
הערה: במקרה של CaV1.1, צפה לראות אות מרבי בפחות מ 4-10 אלפיות השנייה לאחר גירוי (זמן לפתח תנועת טעינה מקסימלית5). האות מהיר ורזולוציית זמן מדויקת היא קריטית להשוואה עם מדדים אחרים, כגון סידן חולף או תנועת מטען הנמדדת באמצעות מהדק מתח. - כדי למקד את אור העירור באזור מסוים או בנקודה מסוימת של הסיב (איור 4B), השתמשו בסרעפת הממוקמת בנתיב אור העירור. זה מאפשר קליטת אות רק באזור שבו אות EGFP-CaV1.1 הוא מקסימלי (איור 4B).
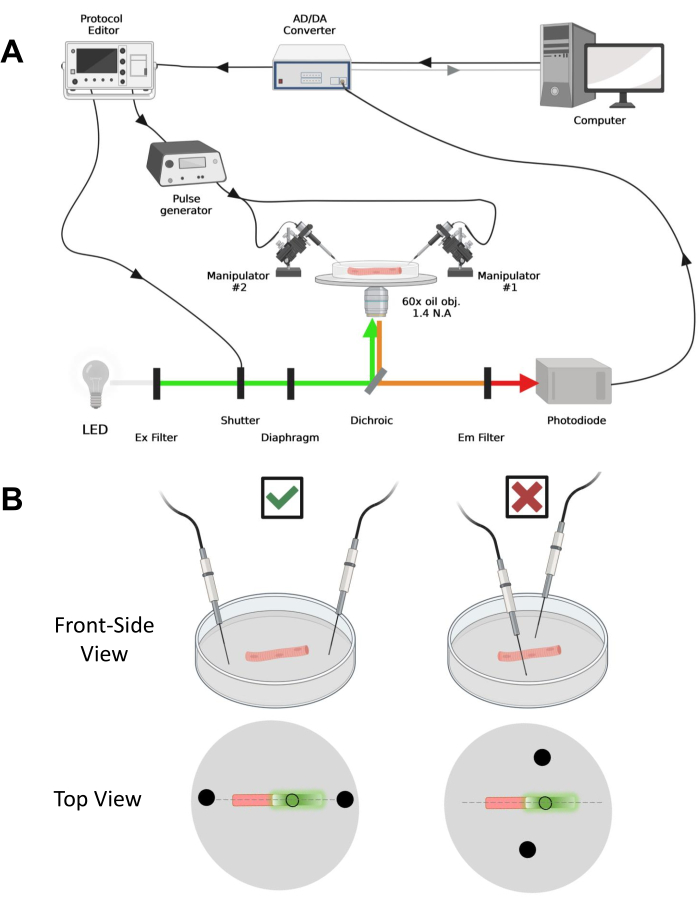
איור 4: תיאור מערכת ההקלטה. (A) תרשים הממחיש את הקשר בין המרכיבים השונים של מערכת ההקלטה. המערך מורכב ממיקרוסקופ הפוך עם שלב ממונע, מקור אור של דיודה פולטת אור (LED), תריס אור, מעגל ניטור אור מבוסס פוטודיודה בהתאמה אישית עם פונקציית מעקב והחזקה43, ממיר AD/DA (ממגבר מהדק תיקון), מחולל פולסים אנלוגי, יחידת גירוי שדה חיצונית המצומדת לאלקטרודות גירוי שדה, מניפולטורים ממונעים, ותוכנות מסחריות לרכישה, סנכרון ויצירת פרוטוקולים. האלקטרודה לגירוי שדה עשויה משני חוטי פלטינה המרותכים לכבלי נחושת המחוברים למחולל הדופק באמצעות מחבר BMC. מסנני עירור ופליטה ספציפיים משמשים לזיהוי אותות EGFP ו- MTS-5-TAMRA. כדי לעורר EGFP, נעשה שימוש במנורת קסנון עם מסנן עירור (Ex) של 488 ננומטר (± 20 ננומטר) ומסנן LP510 ננומטר Em. עבור MTS-5-TAMRA, נעשה שימוש במקור אור LED של 530 ננומטר ובמסנן LP550 ננומטר Em. (B) מבט על סיב המבטא מבנה EGFP-CaV1.1-cys עם אלקטרודות גירוי דו-שדות (עיגולים שחורים) בכיוון הנכון (שמאל) ולא נכון (ימין) בציר הראשי של הסיבים (קו מקווקו). העיגול השחור שאינו ממולא מייצג את אזור הרכישה בקוטר הנשלט על ידי פתח הסרעפת, הממוקם לפני מקור האור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. הערכת פעילות חשמלית של סיבים חיוביים ל-EGFP וצביעת ציסטאין
הערה: גירוי שדה סיבי שריר השלד מתבצע כמתואר לפני41 עם שינויים. גישה זו משמשת כדי (1) לזהות סיבים בריאים, פונקציונליים ומגיבים חשמלית, (2) להכתים את הסיבים בצבע פלואורסצנטי תגובתי ציסטאין, ו-(3) להקליט את האות הפלואורסצנטי בתגובה לפוטנציאל הפעולה המופץ. כל שלב בסעיף זה ובזה שלאחריו צריך להתבצע בסביבת תאורה חלשה כדי להפחית את הלבנה של צבע פלואורסצנטי.
- הניחו את צלחת תחתית הזכוכית בקוטר 35 מ"מ המכילה סיבי שריר מנותקים על במת המיקרוסקופ. מוציאים בזהירות את תרבית החומר עם פיפטה של 1,000 μL ומחליפים ב-2 מ"ל של תמיסה של רינגר בטמפרטורת החדר (ראו טבלה 1 להרכב). ייתכן שיידרשו סבבים מרובים של החלפת מדיה כדי להסיר באופן מלא את מדיית תרבית התאים המקורית המכילה ציסטאין חופשי.
- באמצעות מניפולטור מכני או ממונע, מניחים את שני חוטי הפלטינה בניצב לתחתית המנה. ודאו שהדקי האלקטרודות מיושרים ביחס לציר האורך של הסיב ובמרחק של כמה מילימטרים מקצות הסיב, ושההפרדה בין האלקטרודות היא 5 מ"מ (איור 4B). התאימו עוד יותר את מיקום האלקטרודות על-ידי סיבוב הצלחת או הרכבת כל אלקטרודה על מיקרומניפולטור עצמאי (איור 4B).
- הפעל את האור המשודר ומצא את הסיבים בשדה הראייה באמצעות מטרה של 20x. העבר את קוביית מסנן EGFP לנתיב האור.
הערה: באמצעות מיקרוסקופ המצויד באפיפלואורסצנטיות ומטרת הגדלה נמוכה (2x), ניתן להעריך את יעילות הטרנספקציה של המבנה בכל השריר לפני דיסוציאציה של סיבים על-ידי הערכת ביטוי EGFP (איור 5A). - באמצעות תריס אור הנשלט מרחוק, הפעל את נורית העירור 488 ננומטר כדי לזהות את הסיבים החיוביים ל-EGFP. אחסנו את מיקום הסיב x-y על הצלחת באמצעות שלב מיקרוסקופ ממונע. אות ה-EGFP הוא לעתים קרובות הטרוגני בתוך הסיב (איור 4B). מרכז את המיקום שנשמר לאות EGFP הבהיר ביותר.
- לאחר זיהוי סיבים חיוביים ל-EGFP, חזרו ללוקליזציה הראשונה שנשמרה. באמצעות מתג הדק ידני, ספק שני פעימות גירוי רציפות עם משך של 1ms ומשרעת של 20 V. הגדר את הקוטביות של הפולסים לסירוגין.
- לאחר הגירוי, שימו לב לשני התכווצויות סיבים הומוגניים קונצנטריים בתגובה לשני פולסים של קוטביות הפוכה. התכווצות מקומית או היעדר התכווצות בתגובות לפולסים של קוטביות חלופית מצביעים על תגובות פסיביות מקומיות שאינן מתפשטות או על חוסר עירור41. אל תכלול סיבים אלה למשך שארית הניסוי.
- יש להוסיף 2 מיקרוליטר של תמיסת MTS-5-TAMRA 10 מ"מ ישירות לצלחת ולערבב בעדינות עם פיפטה של 1,000 מיקרוליטר (ריכוז סופי של 10 מיקרומטר). היזהר לא להזיז את המנה, אחרת עמדות הסיבים המאוחסנים יאבדו. יש לדגור במשך 4-5 דקות כדי לאפשר דיפוזיה של מולקולת התיול הפלואורסצנטית לתוך מערכת הצינוריות הרוחבית לומן.
- החל גירויים חוזרים דו-קוטביים כדי לעורר רכבות פוטנציאליות לפעולה עוקבת בקצב של 50 הרץ למשך 300 אלפיות השנייה כל שנייה למשך 5 דקות.
הערה: רכבות הדופק מאפשרות נגישות לציסטאין המוכנס ל-S4 של EGFP-CaV1.1 כדי להגיב עם MTS-5-TAMRA. היכולת של הסיב להתכווץ מכנית בתגובה לגירוי חשובה לתכולת לומן צינורית רוחבית כדי לעבור מחזור עם הסביבה החוץ תאית. - מוציאים את תמיסת הצביעה מהצלחת בפיפטה של 1,000 מיקרוליטר ומחליפים ב-2 מ"ל בטמפרטורת החדר את התמיסה של רינגר. ייתכן שיידרשו שניים או שלושה סיבובים כדי להסיר באופן מלא MTS-5-TAMRA לא מצומד. הניחו לסיב המוכתם להתאושש מפרוטוקול הצביעה למשך 10 דקות לפחות.
- כמו בשלב 5.6, להעריך מחדש את בריאות הסיבים ואת הפעילות החשמלית על ידי התבוננות בהתכווצות סיבים סימטרית בתגובה לקטביות לסירוגין. להוציא סיבים שאינם מגיבים לשני הגירויים משאר הניסוי.
- העבר את קוביית המסנן MTS-5-TAMRA לנתיב האור. באמצעות תריס אור הנשלט מרחוק, הפעל את נורית העירור 533 ננומטר כדי לאשר צביעה הומוגנית של MTS-5-TAMRA על הסיבים.
הערה: בעת צביעה עם MTS-5-TAMRA, הן ציסטאין מהונדס והן ציסטאין אנדוגני מגיבים עם הנגזרת maleimide (איור 5B). לכן, קשה להעריך את התגובה הנכונה עם ציסטאין של עניין. CaV1.1 מתבטא בעיקר בצינורית הרוחבית, ויוצר תבנית פס כפול מובחנת. באמצעות מיקרוסקופ קונפוקלי או אפיפלואורסצנטי, ניתן להשתמש בתמונת x-y כדי לאשר צביעה נכונה וכניסה ודיפוזיה רוחבית של צינוריות MTS-5-TAMRA (איור 5C).
6. רכישת אותות ועיבודם
הערה: לפני ביצוע מדידות פלואורומטריות, יש לתכנן בקפידה את קליטת האות כדי להשיג את יחס האות/רעש האופטימלי. קצבי דגימה איטיים יותר מאפשרים גילוי אור רב יותר תוך הפחתת מספר הנקודות שיירכשו במהלך סידור מחדש של תצורת החלבון. במקרה של EGFP-CaV1.1-cys, תנועת מטען המושרה על ידי צורת גל פוטנציאלית פעולה מתרחשת ב~1-10 ms37. כדי להשיג נקודות מרובות כדי לעקוב אחר התפתחות התנועה לאורך זמן, הרכישה הוגדרה ל-50 מיקרו-שניות לנקודה.
- מניחים את הסיב במרכז שדה הראייה עם מערכת הגדלה מתאימה. עבור ניסויים אלה, נעשה שימוש במטרה הפוכה של 60x שמן 1.4 צמצם מספרי (NA). מטבו את התאורה ואת מיקום הסיב בעזרת השלב הממונע והסרעפת כדי להאיר אזור עגול בקוטר הסיב, שבו אות ה-EGFP הוא מקסימלי (איור 4B).
- לאחר מיקום הסיב לרכישה, כוונו את שני חוטי הפלטינה לגירוי שדה המותקנים באופן עצמאי בכל קצה של הסיב. יישרו את החוטים על הציר הראשי של הסיבים בקו ישר ורחצו אותם במרחק של 5 מ"מ זה מזה עם הסיב במרכז (איור 4B).
- הגדר את מסנני העירור והפליטה של הרכישה להגדרות המתאימות עבור MTS-5-TAMRA. התחל את הניסוי על ידי ביצוע הפרוטוקול שנכתב בתוכנת הרכישה. שלב זה מפעיל את כל המכשירים במורד הזרם (כלומר, עורך פרוטוקולים, תריס אור, מחולל פולסים).
הערה: פרוטוקול זה מאפשר פרק זמן קצר (כלומר, 10 אלפיות השנייה) של רכישה בסיסית לפני מסירת גירוי השדה, כדי לאפשר מדידות עוקבות של פלואורסצנטיות במנוחה. - התחל רכבת אחת או רכבת של פוטנציאלי פעולה עם פולס ריבועי של 0.5 או 1 אלפיות השנייה, 20 וולט. צמצם את זמן הרכישה הכולל ככל האפשר כדי למנוע הלבנת אותות.
הערה: אפילו אם מקליטים במרכז הסיב, אות פלואורסצנטי הקשור לתנועה יכול להתרחש ועלול להתבלבל עם האות הפלואורסצנטי עקב שינוי קונפורמציה של חלבון-פלואורופור (איור 5D). האות המושרה על ידי ההתכווצות צריך להתעכב בהשוואה לזמן הצפוי של תנועת המטען לאחר גירוי37. - כדי להבדיל עוד יותר את האות הנובע מתנועות S4 מזה הנובע מהתכווצות הסיבים, הוסף 1 μL של 100 mM N-benzyl-p-toluene sulphonamide (BTS; ריכוז סופי של 50 μM) לתמיסת ההקלטה כדי למזער את תגובות ההתכווצות ולחזור על שלב 6.4. אותות שזוהו בפעם השנייה לאחר אימוביליזציה פרמקולוגית של סיבים תואמים לתנועה המולקולרית של סליל S4 המתויג (איור 5D).
הערה: אין לזהות אות בבקרה EGFP-CaV1.1 ללא ציסטאין מהונדס לאחר דיכוי תנועה עם BTS. - באמצעות אותן הגדרות, רכשו אות דומה במיקום בתוך הצלחת שבו אין סיב שריר או פסולת כדי לקבל ערך של פלואורסצנטיות רקע.
- יבא את הקבצים המכילים את מהלך הזמן של הפלואורסצנטיות הגולמית [Fr(t)] מהסיבים ופלואורסצנטיות הרקע [Fb(t)] לתוכנת ניתוח הנתונים. ממוצע העמודה המכילה Fb(t) לקבלת ערך Fb הומוגני. חסר Fb מה- Fr(t) כדי לקבל את ערכי הפלואורסצנטיות המוחלטת [F(t)]. החלק את האות שהתקבל בעזרת פונקציית החלקה במידת הצורך.
הערה: בעזרת מערכת זיהוי זו ותדירות הרכישה, החלטנו להשתמש בפונקציית ממוצע סמוכה עם חלון של 50 נקודות להחלקה. - ממוצע ערכי F(t) הבסיסיים במרווח זמן של 10 אלפיות השנייה לפני הגירוי כדי לקבל ערך פלואורסצנטי במנוחה (F0). החסר F0 מה- F(t) המוחלק כדי לקבל את השינוי המוחלט בפלואורסצנטיות [ΔF(t)]. לאחר מכן, כדי לבטא שינוי פלואורסצנטי לאורך זמן ביחס לפלואורסצנטיות במנוחה (ΔF/F0), חלק את ΔF(t) ב-F0.
- כדי להעריך את מידת הלבנת האות, הגדר שתי נקודות מהאות ΔF/F0 לאורך זמן, לפני ואחרי הגירוי והרחק מהאות הפלואורומטרי. התאם פונקציה ליניארית לשתי נקודות אלה כדי לקבל מעקב אחר קו בסיס. החסר את קו הבסיס ל- ΔF/F0 לאורך זמן כדי לתקן הלבנת אותות.
- החסר מעמודת הזמן את ההשהיה בין התחלת הרכישה לבין אות המשוב מהגירוי, כך ש- t = 0 יתאים לתחילת הגירוי החשמלי.
הערה: כדי לאפשר השוואות אותות מרובות, נדרש לעתים קרובות לנרמל את המשרעת של האות. ניתן להשתמש בגישות שונות בהתאם למטרת הניסוי. בחלק התוצאות הבא, התעניינו בקינטיקה של אותות, ולכן השתמשנו בשיטה פשוטה המורכבת מנרמול כל אות בערך המינימלי שהושג (כלומר, השיא השלילי).
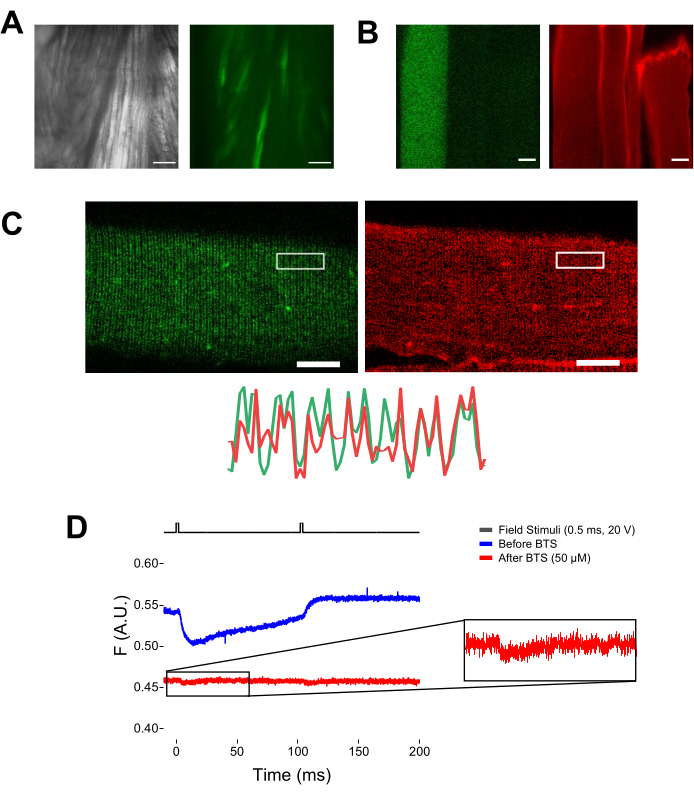
איור 5: הדמיה של סיבי שריר המבטאים EGFP-CaV1.1-cys ללא ועם צביעת MTS-5-TAMRA ותיעוד פלואורומטרי גולמי מייצג. (A) דוגמאות לתמונות משודרות (משמאל) ופלואורסצנטיות (מימין) של השריר המנותח ולא מנותק המבטאות מבנה EGFP-CaV1.1 VSD-III. סרגל קנה מידה: 100 מיקרומטר. (B) תמונה מייצגת של סיב שריר המבטא מבנה EGFP-CaV1.1 VSD-III לפני (משמאל) ואחרי (מימין) צביעת MTS-5-TAMRA. ציסטאין אנדוגני של סיבים שאינם נגועים מוכתמים גם על ידי הצבע. סרגל קנה מידה: 30 מיקרומטר. (C) תמונה קונפוקלית של מבנה EGFP-Ca V 1.1 VSD-III (משמאל) וצביעת MTS-5-TAMRA (מימין) מראה תבנית פס כפול קלאסית האופיינית ללוקליזציה של CaV1.1 עלמערכת הצינוריות הרוחבית של סיב השריר (למטה). סרגל קנה מידה: 25 מיקרומטר. (D) הקלטה פלואורומטרית מייצגת בתגובה לשני גירויים ונמדדת באמצעות פוטודיודה לפני (עקבה כחולה) ואחרי (עקבה אדומה) עם N-benzyl-p-toluene sulphonamide (BTS). הקו השחור העליון מציין את הפרוטוקול לדפולריזציה של סיבים באמצעות גירוי שדה חיצוני. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
כאשר פוטנציאלי פעולה מתפשטים מופעלים בתגובה לגירוי שדה חוזר, ניתן לעקוב אחר תנועת חיישן מתח ספציפי בתגובה לתדר מסוים של דפולריזציה. כפי שניתן לראות באיור 6A, ניתן לעקוב אחר התנועה של סלילים מתויגים VSD-II בתגובה לכל אחד משני דה-פולריזמים עוקבים המופעלים ב-10 הרץ (כלומר, ברווח של...
Access restricted. Please log in or start a trial to view this content.
Discussion
כאן מתואר פרוטוקול שלב אחר שלב לביצוע FSDF בסיבי שריר לחקר תנועות חיישן מתח בודדות מערוץ CaV1.1. למרות שמספר השלבים ומגוון הגישות המשולבות בטכניקה זו עשויים להיראות מורכבים, רוב הטכניקות הללו משמשות לעתים קרובות באופן שגרתי במעבדות ביופיזיקאיות / ביולוגיות של התא. לפיכך, המורכבות לכאורה...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים אינם מדווחים על ניגוד עניינים.
Acknowledgements
אנו מודים לד"ר ג'יי ורגרה (אוניברסיטת קליפורניה, לוס אנג'לס) על שיתוף פלסמיד הבר מסוג EGFP-CaV1.1 (ארנב). אנו מודים למעבדת האלקטרוניקה של המחלקה לפיזיולוגיה של ייל ובמיוחד להנריק אבילגארד על התכנון והבנייה של הפוטודיודה עם מעגל מסילה והחזקה. עבודה זו נתמכה על ידי מענקי המכונים הלאומיים לבריאות R01-AR075726 ו- R01-NS103777
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
References
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915(2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. Excitation-Contraction Coupling in Skeletal Muscle. , McGraw-Hill. New York. (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. Muscle: Fundamental Biology and Mechanisms of Disease. , Academic Press, Elsevier. 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22(2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118(2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520(2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6(2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109(2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved