È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fluorometria funzionale sito-diretta in cellule native per studiare l'eccitabilità del muscolo scheletrico
In questo articolo
Riepilogo
La fluorometria funzionale sito-diretta è un metodo per studiare i movimenti del dominio proteico in tempo reale. La modifica di questa tecnica per la sua applicazione nelle cellule native consente ora il rilevamento e il tracciamento dei movimenti di singoli sensori di tensione dai canali Ca2+ voltaggio-dipendenti nelle fibre muscolari scheletriche isolate murine.
Abstract
La fluorometria funzionale sito-diretta è stata la tecnica scelta per studiare la relazione struttura-funzione di numerose proteine di membrana, compresi i canali ionici voltaggio-dipendenti. Questo approccio è stato utilizzato principalmente nei sistemi di espressione eterologa per misurare simultaneamente le correnti di membrana, la manifestazione elettrica dell'attività dei canali e le misurazioni di fluorescenza, riportando riarrangiamenti di dominio locale. La fluorometria funzionale diretta dal sito combina elettrofisiologia, biologia molecolare, chimica e fluorescenza in un'unica tecnica ad ampio raggio che consente lo studio dei riarrangiamenti strutturali in tempo reale e della funzione attraverso la fluorescenza e l'elettrofisiologia, rispettivamente. Tipicamente, questo approccio richiede un canale di membrana voltaggio-dipendente ingegnerizzato che contiene una cisteina che può essere testata da un colorante fluorescente tiolo-reattivo. Fino a poco tempo fa, la chimica tiolo-reattiva utilizzata per la marcatura fluorescente sito-diretta delle proteine veniva effettuata esclusivamente negli ovociti e nelle linee cellulari di Xenopus , limitando la portata dell'approccio alle cellule primarie non eccitabili. Questo rapporto descrive l'applicabilità della fluorometria funzionale sito-diretta nelle cellule muscolari scheletriche adulte per studiare le prime fasi dell'accoppiamento eccitazione-contrazione, il processo mediante il quale la depolarizzazione elettrica delle fibre muscolari è legata all'attivazione della contrazione muscolare. Il presente protocollo descrive le metodologie per progettare e trasfettare canali Ca2+ voltaggio-dipendenti ingegnerizzati con cisteina (CaV1.1) in fibre muscolari del flessore digitorum brevis di topi adulti utilizzando l'elettroporazione in vivo e le successive fasi richieste per le misure funzionali di fluorometria dirette al sito. Questo approccio può essere adattato per studiare altri canali ionici e proteine. L'uso della fluorometria funzionale sito-diretta del muscolo dei mammiferi è particolarmente rilevante per lo studio dei meccanismi di base dell'eccitabilità.
Introduzione
La capacità di tracciare i riarrangiamenti conformazionali dei canali ionici in risposta a uno stimolo elettrico noto in una cellula vivente è una fonte di informazioni preziose per la fisiologia molecolare1. I canali ionici voltaggio-dipendenti sono proteine di membrana che rilevano i cambiamenti nella tensione transmembrana e la loro funzione è influenzata anche dalle variazioni di tensione2. Lo sviluppo delle tecniche di tension-clamp nel secolo scorso ha permesso ai fisiologi di studiare, in tempo reale, le correnti ioniche trasportate dai canali ionici voltaggio-dipendenti in risposta alla depolarizzazione della membrana3. L'uso della tecnologia dei morsetti di tensione è stato cruciale per comprendere le proprietà elettriche delle cellule eccitabili come neuroni e muscoli. Nel 1970, il raffinamento del morsetto di tensione ha permesso il rilevamento delle correnti di gating (o movimento di carica)nei canali di calcio (Ca V) e sodio (NaV) 4,5. Le correnti di gating sono correnti capacitive non lineari che derivano dal movimento dei sensori di tensione in risposta ai cambiamenti nel campo elettrico attraverso la membrana cellulare6. Le correnti di gating sono considerate una manifestazione elettrica di riarrangiamenti molecolari che precedono o accompagnano l'apertura del canale ionico7. Mentre queste misurazioni di corrente forniscono preziose informazioni sulla funzione del canale, sia le correnti ioniche che le correnti di gating sono letture indirette di riarrangiamenti conformazionali inter- e intra-molecolari dei canali voltaggio-dipendenti7.
La fluorometria funzionale diretta al sito (FSDF; nota anche come fluorometria a morsetto di tensione, VCF) è stata sviluppata nei primi anni 19908 e, per la prima volta, ha fornito la possibilità di visualizzare direttamente i cambiamenti conformazionali locali e la funzione di una proteina canale in tempo reale. Utilizzando una combinazione di mutagenesi dei canali, elettrofisiologia e sistemi di espressione eterologa, è possibile etichettare e tracciare in modo fluorescente le parti mobili di specifici canali o recettori in risposta allo stimolo attivante 9,10. Questo approccio è stato ampiamente utilizzato per studiare i meccanismi di rilevamento della tensione nei canali ionici voltaggio-dipendenti 8,10,11,12,13,14,15,16,17,18,19. Per le recensioni autorevoli, vedi 10,20,21,22,23.
I canali Ca V e NaV, critici per l'avvio e la propagazione dei segnali elettrici, sono composti da una subunità principale α1, che possiede un poro centrale e quattro domini di rilevamento della tensione non identici2. Oltre alla loro distinta struttura primaria, i canali Ca V e NaV sono espressi come complessi multisubunità con subunità ausiliarie24. I canali del potassio voltaggio-dipendenti (K V) sono costituiti da quattro subunità che assomigliano a un singolo dominio di Na V o CaV 25. La subunità α1 che forma i pori e il rilevamento della tensione dei canali Ca V e NaV è formata da un singolo polipeptide che codifica per quattro domini individuali di sei segmenti transmembrana unici (S1-S6; Figura 1A) 24,26. La regione compresa dai segmenti transmembrana da S1 a S4 forma il dominio di rilevamento della tensione (VSD) e i segmenti transmembrana S5 e S6 formano il dominio dei pori26. In ogni VSD, la α-elica S4 contiene arginina o lisina caricata positivamente (Figura 1A,B) che si muovono in risposta alla depolarizzazione della membrana7. Diversi decenni di ricerca e i risultati di approcci sperimentali molto diversi supportano la premessa che i segmenti S4 si spostano verso l'esterno, generando correnti di gating, in risposta alla depolarizzazione della membrana6.
La FSDF misura i cambiamenti di fluorescenza di un colorante tiolo-reattivo coniugato a uno specifico residuo di cisteina (cioè la α-elica S4) su un canale ionico o altra proteina, ingegnerizzata tramite mutagenesi sito-diretta, mentre il canale funziona in risposta alla depolarizzazione della membrana o ad altri stimoli10. In effetti, FSDF è stato originariamente sviluppato per indagare se il segmento S4 nei canali KV, proposto per essere il principale sensore di tensione del canale, si muove quando le cariche di gating si muovono in risposta ai cambiamenti nel potenziale di membrana 8,10. In caso di canali ionici voltaggio-dipendenti, FSDF può risolvere riarrangiamenti conformazionali indipendenti dei quattro VSD (tracciando un VSD in un dato momento), in concomitanza con le misurazioni della funzione del canale. Infatti, utilizzando questo approccio, è stato dimostrato che i singoli VSD sembrano essere coinvolti in modo differenziale in aspetti specifici dell'attivazione e inattivazione del canale 12,27,28,29,30. Identificare il contributo di ciascun VSD alla funzione dei canali è di grande rilevanza e può essere utilizzato per chiarire ulteriormente il funzionamento del canale e potenzialmente identificare nuovi obiettivi per lo sviluppo di farmaci.
L'uso della FSDF nei sistemi di espressione eterologa è stato estremamente utile per approfondire la nostra comprensione della funzione del canale da una prospettiva riduzionista10,23. Come molti approcci riduzionisti, presenta vantaggi ma ha anche dei limiti. Ad esempio, una delle principali limitazioni è la parziale ricostituzione del canale nano ambiente nel sistema eterologo. Spesso i canali ionici interagiscono con numerose subunità accessorie e numerose altre proteine che modificano la loro funzione31. In linea di principio, canali diversi e le loro subunità accessorie possono essere espressi in sistemi eterologhi con l'uso di costrutti codificanti proteine multiple o plasmidi policistronici, ma il loro ambiente nativo non può essere completamente ricostituito30,32.
Il nostro gruppo ha recentemente pubblicato una variante della FSDF nelle fibre muscolari scheletriche dissociate native per lo studio delle prime fasi dell'accoppiamento eccitazione-contrazione (ECC)33,34, il processo mediante il quale la depolarizzazione elettrica delle fibre muscolari è legata all'attivazione della contrazione muscolare35,36. Per la prima volta, questo approccio ha permesso il tracciamento del movimento di singoli sensori di tensione S4 dal canale Ca2+ di tipo L voltaggio-dipendente (CaV1.1, noto anche come DHPR) nell'ambiente nativo di una fibra muscolare differenziata adulta37. Ciò è stato ottenuto considerando molteplici caratteristiche di questo tipo di cellula, tra cui l'attività elettrica della cellula che consente una rapida depolarizzazione auto-propagata indotta dalla stimolazione, la capacità di esprimere il plasmide di cDNA attraverso l'elettroporazione in vivo, l'alta espressione naturale e l'organizzazione compartimentale dei canali all'interno della cellula e la sua compatibilità con l'imaging ad alta velocità e i dispositivi di registrazione elettrofisiologica. In precedenza, abbiamo utilizzato un microscopio confocale a scansione lineare ad alta velocità come dispositivo di rilevamento37. Ora, una variante della tecnica viene presentata utilizzando un fotodiodo per l'acquisizione del segnale. Questo sistema di rilevamento basato su fotodiodi potrebbe facilitare l'implementazione di questa tecnica in altri laboratori.
Qui viene descritto un protocollo passo-passo per utilizzare FSDF in celle native per lo studio del movimento individuale del sensore di tensione da CaV1.1. Mentre il canale CaV1.1 è stato usato come esempio in tutto questo manoscritto, questa tecnica potrebbe essere applicata a domini extracellulari accessibili di altri canali ionici, recettori o proteine di superficie.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Questo protocollo è stato approvato dal Comitato istituzionale per la cura e l'uso degli animali dell'Università del Maryland. Il seguente protocollo è stato suddiviso in più sottosezioni, consistenti in (1) progettazione del costrutto molecolare e selezione del colorante reagente della cisteina, (2) elettroporazione in vivo , (3) dissezione muscolare e isolamento delle fibre, (4) descrizione della configurazione dell'acquisizione, (5) valutazione dell'attività elettrica delle fibre positive della proteina fluorescente verde potenziata (EGFP) e colorazione della cisteina e (6) acquisizione ed elaborazione del segnale. Inoltre, all'inizio di ogni sezione, alcune considerazioni rilevanti sono dettagliate quando si applica la FSDF in una fibra muscolare scheletrica. Tutte le sezioni del protocollo devono essere eseguite con adeguati dispositivi di protezione individuale, compresi un camice da laboratorio e guanti.
1. Progettazione di costrutti molecolari e selezione del colorante che reagisce con la cisteina
- La progettazione dei costrutti è una parte fondamentale del successo dell'esperimento. In primo luogo, generare un costrutto di cDNA CaV 1.1wild-type, contrassegnato con fluorescenza e valutarne l'espressione nel tipo di cellula appropriato. Per le fibre muscolari, una forte efficienza di trasfezione può essere raggiunta utilizzando un plasmide che trasporta un promotore del citomegalovirus (CMV). In questo protocollo, è stato utilizzato un plasmide EGFP-CaV1.1 di coniglio già caratterizzato38.
NOTA: Quando si progetta il costrutto di cDNA per introdurre un residuo di cisteina in un canale ionico voltaggio-dipendente, la posizione della cisteina è critica e deve essere attentamente considerata. La cisteina dovrebbe essere accessibile dallo spazio extracellulare per consentire una reazione di colorante coniugato con tiolo (Figura 1C, D) e dovrebbe essere prossimale alla regione S4 per tracciare con precisione il suo movimento in risposta alla depolarizzazione. Tuttavia, per consentire la tempra della fluorescenza del colorante in risposta al movimento delle proteine, il fluoroforo coniugato con cisteina introdotto dovrebbe essere all'interfaccia di due diversi ambienti (ad esempio, membrana e fluido extracellulare; Figura 1E). Inoltre, è fondamentale assicurarsi che la cisteina inserita non interferisca con la funzione proteica. - Per avere un'idea sulla corretta localizzazione della cisteina, raccogliere informazioni sulla struttura del canale o da altri esperimenti di fluorometria di altre proteine dei canali correlati. Per la progettazione di costrutti Ca V 1.1 ingegnerizzati con cisteina, valutare la struttura della microscopia crioelettronica risolta (crio-EM) del canale26 e confrontare l'inserimento di cisteina di lavori precedenti da canali correlati come CaV1.212 o altri canali come Shaker11 e NaChBac39.
- Una volta scelta la posizione corretta della cisteina, utilizzare un kit di mutagenesi commerciale diretto al sito per introdurre sostituzioni della cisteina. Nel presente protocollo, le seguenti modifiche delle cisteine sono state ingegnerizzate in modo indipendente su ciascuna estremità citosolica del segmento di rilevamento della tensione S4 di CaV1.1: VSD-I (L159C), VSD-II (L522C), VSD-III (V893C), VSD-IV (S1231C) e UniProtKB: P07293 (Figura 1B).
- Per le fibre muscolari scheletriche, utilizzare 5-carbossimetrametilrodamina metanetiosolfonato (MTS-5-TAMRA), che mostra una diffusione corretta e rapida nel sistema di membrana tubulare trasversale, che è un'invaginazione della membrana superficiale e la posizione predominante dei canali CaV1.1. MTS-5-TAMRA mostra una diminuzione della fluorescenza durante la transizione dalla membrana lipidica a un ambiente acquoso (Figura 1E).
NOTA: I derivati Dylight o Alexa-maleimmide colorano la membrana superficiale ma non il sistema tubulare trasversale.
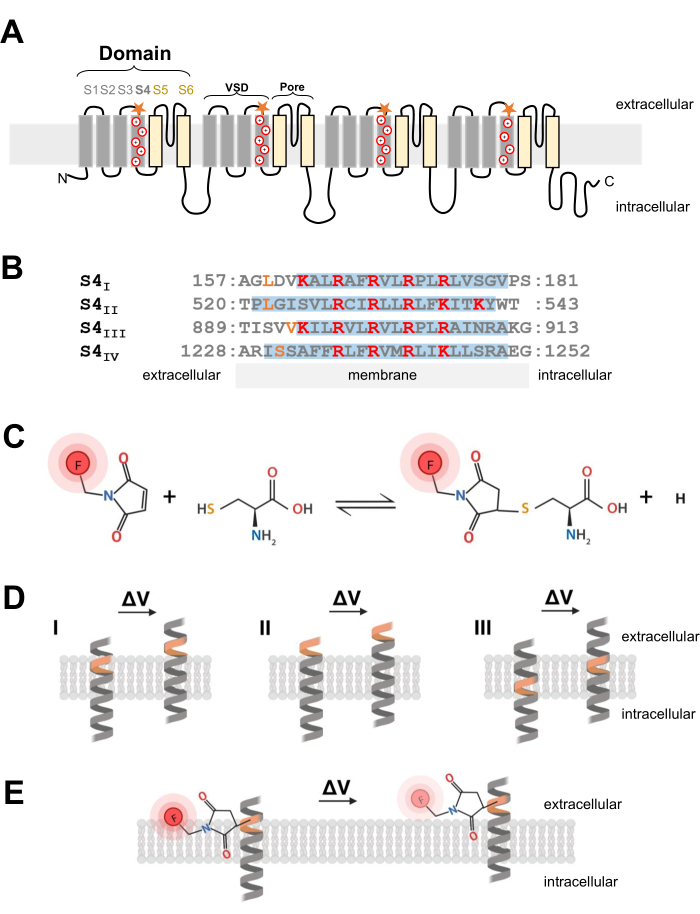
Figura 1: Schema della reazione tiolo-cisteina all'interfaccia di una transmembrana α-elica. (A) Topologia a membrana CaV 1.1di tipo L. I segni più rappresentano i residui basici all'interno della α-elica S4 e le stelle arancioni indicano la posizione in cui la cisteina è stata introdotta attraverso la mutagenesi diretta al sito. (B) Allineamento della sequenza di S4I a S4IV del coniglio CaV1.1 (UniProtKB: P07293). I residui di arginina e lisina caricati positivamente critici per il rilevamento della tensione sono evidenziati in rosso, mentre le sostituzioni ingegnerizzate della cisteina sono indicate in arancione. Questo pannello è stato adattato dalla referenza37. (C) Reazione della molecola fluorescente cisteina-tiolo. (D) Diagramma che illustra l'inserimento della mutagenesi della cisteina all'interno di una α-elica transmembrana sensibile alla tensione. La cisteina deve essere sepolta nella membrana a riposo ed essere accessibile extracellulare dopo la depolarizzazione (ΔV; I). Il tracciamento della cisteina è in genere improbabile che si verifichi se la cisteina bersaglio è già accessibile dallo spazio extracellulare prima della depolarizzazione (II) o se la cisteina non è accessibile dallo spazio extracellulare dopo la depolarizzazione (III). (E) Dopo la reazione con la molecola fluorescente tiolica, il moto α-elica in risposta alla depolarizzazione diminuisce l'emissione di fluorescenza MTS-5-TARRA. Il segnale fluorometrico è generato dal movimento dell'elica S4 e dal successivo movimento del colorante rispetto al piano della membrana e all'ambiente acquoso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Elettroporazione in vivo
NOTA: Gli esperimenti di elettroporazione sono stati condotti come descritto in precedenza38 con modifiche. Nella sezione seguente, il protocollo è progettato per l'elettroporazione di un piedino del mouse. I volumi devono essere regolati se entrambe le zampe sono preparate.
- Aliquot 25-100 μL di soluzione plasmidica a 2-5 μg/μL in una provetta da 1,5 mL posta su ghiaccio.
- Preparare una soluzione da 0,5 mL di 2 mg/mL di ialuronidasi in soluzione salina sterile e filtrare la soluzione attraverso un filtro sterile a basso legame da 0,2 μm montato su una siringa da 1 ml. Conservare in un tubo da 1,5 mL a temperatura ambiente.
- Utilizzando un apparecchio di anestesia calibrato, anestetizzare un topo usando il 3% -4,5% di isoflurano in O2 (1 L / min) posizionando il topo nella camera di anestesia. Confermare un'adeguata anestesia dell'animale pizzicando la punta della coda usando un paio di pinzette. Nessuna reazione deve essere osservata quando viene raggiunta l'anestesia ottimale.
- Rimuovere il mouse dalla camera di anestesia e posizionare una maschera nasale per anestesia sul mouse. Posizionare l'animale sulla schiena su una piastra riscaldante isotermica coperta da un cuscinetto sterile. Continuare l'anestesia utilizzando la maschera del roditore con isoflurano al 3% in O2 (1 L/min).
- Per prevenire la secchezza degli occhi durante la procedura, applicare un sottile strato di crema lacrimale artificiale sugli occhi dell'animale con una punta di cotone sterile. Disinfettare la zampa dell'animale usando una salvietta sterile satura di alcool etilico.
- Utilizzando un ago da insulina sterile da 0,5 in lunghezza 29 G, aspirare 20 μL di soluzione di ialuronidasi. Penetrare la pelle a livello del tallone e far scorrere l'ago per via sottocutanea verso la base delle dita dei piedi (Figura 2A). Iniettare lentamente la soluzione spostando progressivamente l'ago all'indietro. Un bolo o una protuberanza dovrebbero essere osservati sotto la zampa (Figura 2B).
NOTA: A seconda dell'età dell'animale e delle dimensioni della zampa, è probabile che l'intera quantità di soluzione non possa essere iniettata. Spesso, può verificarsi una piccola perdita attraverso il punto di iniezione. - Ripetere il punto 2.6 con l'altra zampa, se lo si desidera, usando un altro ago sterile dopo un'adeguata disinfezione della zampa, come al punto 2.5.
- Scollegare l'anestesia rimuovendo l'animale dalla maschera del naso e riportare il topo nella gabbia con accesso al cibo e all'acqua ad libitum. Il pieno recupero dall'anestesia deve essere osservato in ~ 5 minuti. Posizionare il tubo contenente la soluzione plasmidica sul banco per consentirgli di raggiungere la temperatura ambiente.
- Dopo 1 ora, anestetizzare l'animale una seconda volta, posizionarlo sulla piastra elettrica e disinfettare la zampa come descritto nei passaggi 2.3-2.5.
- Iniettare 10-20 μL del costrutto di cDNA, usando la stessa tecnica descritta al punto 2.6. La quantità totale di costrutto iniettato è di 50-100 μg per zampa. Ripetere la procedura con la zampa controlaterale se lo si desidera utilizzando un'altra siringa sterile.
- Tenere l'animale sotto anestesia sulla piastra riscaldante isotermica per 5 minuti per consentire alla soluzione di cDNA di disperdersi uniformemente attraverso il tessuto.
- Accendere il dispositivo dell'apparecchio di elettroporazione e collegarlo all'array a doppio elettrodo, come raccomandato dal produttore.
- Disinfettare l'array di doppi elettrodi usando una salvietta satura di alcool etilico. Stabilizzare la zampa con una mano e inserire prima un elettrodo sotto la pelle nella parte posteriore del tallone. Quindi, inserire il secondo elettrodo alla base delle dita dei piedi, assicurandosi che gli orientamenti di entrambi gli elettrodi siano perpendicolari all'asse del piede (Figura 2C). Orientare la sonda in una posizione che non vincoli il piede o la gamba in un orientamento angolare estremo.
NOTA: L'inserimento degli elettrodi potrebbe essere facilitato con l'uso di pinzette e affilando regolarmente le punte degli elettrodi. A seconda dell'età dell'animale, la dimensione della zampa può variare e la spaziatura degli elettrodi deve essere adattata di conseguenza. - Elettroporare i muscoli applicando 20 impulsi, 20 ms di durata/ciascuno, a 1 Hz. Per gli aghi degli elettrodi distanziati di 1 cm, impostare la tensione su ~100 V. Questo dovrebbe essere adattato se la spaziatura degli elettrodi viene modificata per raggiungere ~ 100 V / cm. Una leggera flessione delle cifre deve essere osservata durante l'erogazione dell'impulso se gli elettrodi sono posizionati correttamente.
- Ripetere i passaggi 2.13 e 2.14 con la zampa controlaterale, se lo si desidera.
- Scollegare l'anestesia e mettere l'animale in una gabbia, isolato dal suo compagno di banco non elettropolato con accesso al cibo e all'acqua ad libitum per 2 ore. Il pieno recupero dall'anestesia deve essere osservato in ~ 10 minuti. Rimetti l'animale all'interno della gabbia.
NOTA: L'espressione dei costrutti di cDNA dipende fortemente dalla proteina codificata. Il turnover proteico, la quantità e la qualità del cDNA, del promotore del plasmide e di altre variabili possono influire sull'espressione del costrutto. In questo esperimento, l'espressione ottimale della subunità α1S di CaV1.1 con un promotore CMV richiede da 4 a 6 settimane, ma può essere rilevata da 2 settimane fino a 12-15 mesi.
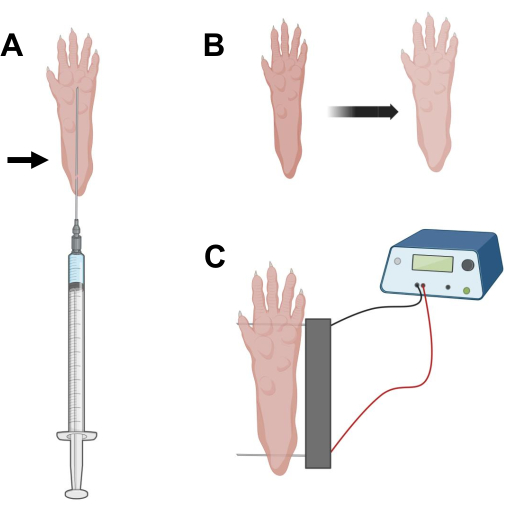
Figura 2: Diagramma del posizionamento dell'elettrodo per iniezione di cDNA ed elettroporazione in un piedino di topo per l'elettroporazione. (A) Posizione dell'ago per l'iniezione di ialuronidasi e cDNA sotto un cuscinetto del piede di topo. La freccia indica il punto di inserimento attraverso la pelle. (B) Una leggera alterazione del colore della pelle e un leggero aumento delle dimensioni della zampa devono essere osservati transitoriamente dopo l'iniezione. (C) Posizionamento dell'array di elettrodi per l'elettroporazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Dissezione muscolare e isolamento delle fibre
NOTA: La dissociazione delle fibre muscolari scheletriche è stata effettuata come descritto in precedenza 37,40,41 con modifiche. Nella sezione seguente, il protocollo è adatto per due piedini del mouse.
- Prima della dissociazione delle fibre, preparare la piastra ricoperta di sylgard aggiungendo una parte di agente polimerizzante a 10 parti di elastomero (% p/p) in una piastra di Petri di plastica da 60 mm per raggiungere uno spessore di ~ 5 mm. Lasciare indurire la piastra ricoperta di elastomero durante la notte prima dell'uso. Questo può essere riutilizzato più volte se correttamente conservato e disinfettato con alcol etilico al 70% prima e dopo l'uso.
- Preparare 4 mg di collagenasi di tipo I in 2 ml di terreno essenziale di coltura (S-MEM) integrato con siero bovino fetale al 10% (FBS; concentrazione finale di 2 mg/ml). Trasferire la soluzione su una piastra di plastica non rivestita da 35 mm e porre il piatto in un incubatore a 37 °C, 5% CO2.
NOTA: S-MEM è una formulazione MEM modificata senza glutammina e Ca2+. L'assenza di Ca2+ in questa fase riduce la contrattura delle fibre durante la digestione enzimatica e la triturazione. - Aggiungere 5 mL di S-MEM integrato con il 10% di FBS in una piastra di plastica non rivestita da 60 mm e conservare nell'incubatore a 37 °C, 5% CO2.
- Eutanasia degli animali per asfissia tramite CO2 seguita da lussazione cervicale. Per ridurre la contaminazione durante l'isolamento cellulare primario, immergere la carcassa animale in alcol etilico al 70% per ~ 10 s. Rimuovere e asciugare la carcassa con carta assorbente e tagliare i piedi con un paio di forbici tra la caviglia e il ginocchio (Figura 3A).
- Appuntare un piede dell'animale, con la zampa rivolta verso l'alto, con perni di dissezione sulla piastra ricoperta di elastomero sotto un microscopio a dissezione con ingrandimento 10x.
- Con forbici da dissezione e pinzette sottili, rimuovere la pelle dalla zampa per esporre il muscolo flessore digitorum brevis (FDB) (Figura 3B). Per prevenire la secchezza dei tessuti, aggiungere una goccia di S-MEM 10% FBS al muscolo utilizzando una pipetta da 1.000 μL.
- A livello del tallone, incidere il tendine e sezionare attentamente il muscolo FDB dal tallone alla punta (Figura 3B). Evitare la tensione sul muscolo il più possibile durante l'esecuzione della dissezione. Troppa forza applicata sui tessuti provocherà danni alle fibre muscolari. Posizionare immediatamente il muscolo nella soluzione di collagenasi.
- Ripetere i passaggi 3,5-3,7 con il piede controlaterale. Posizionare il muscolo sezionato nella soluzione di collagenasi in un incubatore a 37 °C, 5% CO 2 per2 h 45 min a 3 h 15 min. Adattare il tempo di incubazione in base all'attività enzimatica della collagenasi e all'età dell'animale.
- Mentre il tessuto muscolare è in incubazione, aggiungere 300 μL di MEM freddo senza siero o antibiotici al centro di una piastra di fondo di vetro da 35 mm. Aggiungere 2 μL di laminina fredda a 1,20 mg/ml direttamente al MEM. Ripeti il processo per il numero di piatti desiderati. Introdurre i piatti nell'incubatore di coltura cellulare a 37 °C, 5% CO2 per almeno 1 ora per consentire la polimerizzazione della laminina.
- Quando la digestione enzimatica è completa, trasferire il muscolo nel piatto di coltura cellulare da 60 mm contenente S-MEM 10% FBS con l'uso di una pipetta Pasteur in vetro lucidato a fuoco di grandi dimensioni (5 mm) e una lampadina in lattice.
- Utilizzando una pipetta Pasteur in vetro lucidato a fuoco di diametro più piccolo (2 mm) e una lampadina in lattice, triturare delicatamente il muscolo al microscopio a dissezione (Figura 3C). Le fibre muscolari dissociate dovrebbero iniziare a staccarsi dal tessuto ed essere rilasciate nella soluzione.
NOTA: Come regola generale, è sempre preferibile una minore triturazione (15-30 passaggi di pipette), poiché troppa triturazione prolungata può stressare o addirittura danneggiare le fibre. - Utilizzando un paio di pinzette sottili, rimuovere qualsiasi tessuto non muscolare, come nervi, tendini o vasi sanguigni (Figura 3D).
- Aggiungere 2 mL di MEM caldo 2% FBS a ciascuna piastra inferiore in vetro rivestita di laminina da 35 mm. Utilizzando una pipetta da 200 μL e una punta di pipetta di plastica sterile, trasferire le fibre muscolari dissociate sul piatto inferiore di vetro rivestito di laminina da 35 mm (Figura 3E).
NOTA: Ottenere una bassa densità di fibre e consentire alle fibre di essere ben separate l'una dall'altra è importante per evitare la sovrapposizione delle fibre. - Posizionare il piatto inferiore in vetro da 35 mm nell'incubatore a 37 °C, 5% CO2. Le fibre possono essere utilizzate in un lasso di tempo di 2-20 ore.
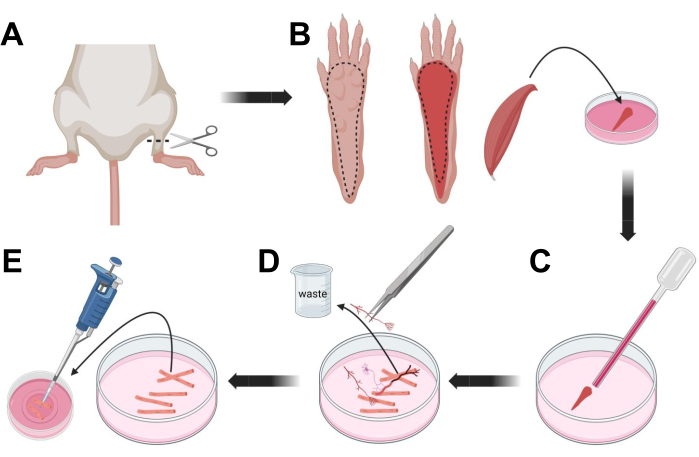
Figura 3; Dissezione e dissociazione delle fibre FDB muscolari. (A) Dopo la dissezione del piede sopra l'articolazione della caviglia (linea tratteggiata), la pelle sotto la zampa del piede viene rimossa, seguendo la linea tratteggiata per esporre il muscolo FDB (B). Il muscolo viene sezionato e posto in soluzione di collagenasi. (C) Dopo l'incubazione, il muscolo viene triturato per dissociarsi e ottenere singole fibre muscolari. (D) Le pinzette fini vengono utilizzate per rimuovere il tessuto non muscolare e i detriti prima di trasferire le fibre muscolari al piatto di coltura del fondo di vetro rivestito di laminina. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Descrizione della configurazione dell'acquisizione
NOTA: la configurazione dell'acquisizione è paragonabile a quella descritta primadel 42 con modifiche (Figura 4A).
- Accendere tutti i componenti: computer, convertitore AD/DA e amplificatore path-clamp , microscopio, stadio motorizzato, manipolatore/i, alimentatore per il fotodiodo, sorgente luminosa, otturatore luminoso, generatore di impulsi ed editor di protocollo.
- Attivare la logica transistor-transistor (TTL) che attiva il segnale OUT dall'AD/DA per controllare il generatore di impulsi, l'otturatore luminoso e l'editor di protocollo.
- Utilizzare il segnale di uscita TTL dal generatore di impulsi e collegarsi a un canale AD dell'amplificatore per verificare l'attivazione temporale precisa. Un adeguato controllo della coerenza di attivazione deve essere valutato attentamente prima dell'esperimento per garantire un'adeguata sincronizzazione dell'apparecchiatura.
NOTA: Nel caso di CaV1.1, aspettatevi di vedere il segnale massimo in meno di 4-10 ms dopo la stimolazione (tempo per sviluppare il movimento di carica massima5). Il segnale è veloce e la risoluzione temporale precisa è fondamentale per confrontarla con altre misure, come il transitorio di calcio o il movimento di carica misurato tramite morsetto di tensione. - Per focalizzare la luce di eccitazione in un'area specifica o in un punto della fibra (Figura 4B), utilizzare un diaframma posizionato nel percorso della luce di eccitazione. Ciò consente l'acquisizione del segnale solo in un'area in cui il segnale EGFP-CaV1.1 è massimo (Figura 4B).
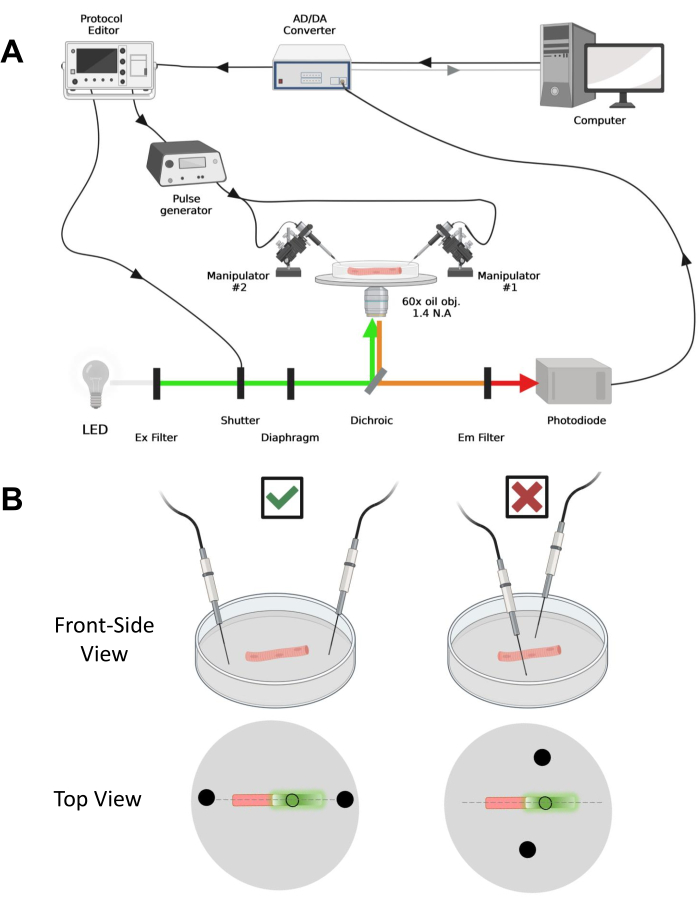
Figura 4: Descrizione del sistema di registrazione. (A) Diagramma che illustra il collegamento tra i diversi componenti del sistema di registrazione. La configurazione consiste in un microscopio invertito con uno stadio motorizzato, una sorgente luminosa a diodi emettitori di luce (LED), un otturatore luminoso, un circuito di monitoraggio della luce basato su fotodiodi su misura con funzione track and hold43, un convertitore AD/DA (da un amplificatore patch mors), un generatore di impulsi analogico, un'unità di stimolazione del campo esterna accoppiata a elettrodi di stimolazione di campo, manipolatori motorizzati e software commerciali per l'acquisizione, la sincronizzazione e la generazione di protocolli. L'elettrodo per la stimolazione del campo è costituito da due fili di platino saldati a cavi di rame collegati al generatore di impulsi tramite un connettore BMC. Specifici filtri di eccitazione ed emissione vengono utilizzati per rilevare sia i segnali EGFP che MTS-5-TARRA. Per eccitare EGFP, viene utilizzata una lampada allo xeno con un filtro di eccitazione (Ex) da 488 nm (± 20 nm) e un filtro Em LP510 nm. Per MTS-5-TAMRA, viene utilizzata una sorgente luminosa a LED da 530 nm e un filtro EM LP550 nm. (B) Vista di una fibra che esprime un costrutto EGFP-CaV1.1-cys con gli elettrodi di stimolazione a due campi (cerchi neri) orientati correttamente (a sinistra) e impropriamente (a destra) nell'asse principale delle fibre (linea tratteggiata). Il cerchio nero non riempito rappresenta l'area di acquisizione con un diametro controllato dall'apertura del diaframma, posta davanti alla sorgente luminosa. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Valutazione dell'attività elettrica delle fibre EGFP-positive e della colorazione della cisteina
NOTA: La stimolazione del campo delle fibre muscolari scheletriche viene eseguita come descritto primadel 41 con modifiche. Questo approccio viene utilizzato per (1) identificare fibre sane, funzionali ed elettricamente reattive, (2) colorare le fibre con il colorante fluorescente reattivo alla cisteina e (3) registrare il segnale fluorescente in risposta al potenziale d'azione propagato. Ogni fase di questa sezione e la successiva devono essere condotte in un ambiente scarsamente illuminato per ridurre lo sbiancamento del colorante fluorescente.
- Posizionare il piatto inferiore di vetro da 35 mm contenente fibre muscolari dissociate sul palco del microscopio. Rimuovere con cautela il terreno di coltura con una pipetta da 1.000 μL e sostituirlo con 2 mL di soluzione di Ringer a temperatura ambiente (vedere Tabella 1 per la composizione). Possono essere necessari più cicli di sostituzione del terreno per rimuovere completamente i terreni di coltura cellulare originali contenenti cisteine libere.
- Utilizzando un manipolatore meccanico o motorizzato, posizionare i due fili di platino perpendicolarmente al fondo del piatto. Assicurarsi che i terminali degli elettrodi siano allineati rispetto all'asse longitudinale della fibra e a pochi millimetri di distanza dalle estremità della fibra e che la separazione tra gli elettrodi sia di 5 mm (Figura 4B). Regolare ulteriormente il posizionamento dell'elettrodo ruotando il piatto o montando ciascun elettrodo su un micromanipolatore indipendente (Figura 4B).
- Accendi la luce trasmessa e trova le fibre nel campo visivo usando un obiettivo 20x. Spostare il cubo del filtro EGFP nel percorso della luce.
NOTA: Utilizzando un microscopio dotato di epifluorescenza e un obiettivo a basso ingrandimento (2x), è possibile valutare l'efficienza di trasfezione del costrutto in tutto il muscolo prima della dissociazione delle fibre valutando l'espressione di EGFP (Figura 5A). - Utilizzando un otturatore telecomandato, attivare la luce di eccitazione a 488 nm per identificare le fibre EGFP-positive. Conservare la posizione della fibra x-y sul piatto utilizzando un palco per microscopio motorizzato. Il segnale EGFP è spesso eterogeneo all'interno della fibra (Figura 4B). Centrare la posizione salvata sul segnale EGFP più luminoso.
- Dopo aver identificato le fibre EGFP-positive, tornare alla prima localizzazione salvata. Utilizzando un interruttore a scatto manuale, erogare due impulsi di stimolazione sequenziale con una durata di 1 ms e un'ampiezza di 20 V. Impostare la polarità degli impulsi su alternati.
- Dopo la stimolazione, osservare due contrazioni concentriche omogenee delle fibre in risposta ai due impulsi di polarità opposta. Una contrazione locale o l'assenza di contrazione nelle risposte a impulsi di polarità alternata indicano risposte passive locali non propagate o non eccitabilità41. Escludere queste fibre per il resto dell'esperimento.
- Aggiungere 2 μL di soluzione MTS-5-TAMRA da 10 mM direttamente nel piatto e mescolare delicatamente con una pipetta da 1.000 μL (concentrazione finale di 10 μM). Fare attenzione a non spostare il piatto, altrimenti le posizioni delle fibre immagazzinate andranno perse. Incubare per 4-5 minuti per consentire la diffusione della molecola di tiolo fluorescente nel lume del sistema tubulo trasversale.
- Applicare stimolazioni ripetitive bipolari per evocare treni di potenziali d'azione successivi a una frequenza di 50 Hz per 300 ms ogni 1 s per 5 minuti.
NOTA: I treni di impulsi danno accessibilità alle cisteine inserite nel S4 di EGFP-CaV1.1 per reagire con MTS-5-TAMRA. La capacità della fibra di contrarsi meccanicamente in risposta alla stimolazione è importante per il contenuto di lumen del tubulo trasversale per il ciclo con l'ambiente extracellulare. - Rimuovere la soluzione colorante dal piatto con una pipetta da 1.000 μL e sostituirla con 2 ml di soluzione di Ringer a temperatura ambiente. Possono essere necessari due o tre cicli per rimuovere completamente MTS-5-TAGRA non coniugato. Lasciare che la fibra macchiata si riprenda dal protocollo di colorazione per almeno 10 minuti.
- Come nel passaggio 5.6, rivalutare la salute delle fibre e l'attività elettrica osservando la contrazione simmetrica delle fibre in risposta alla polarità alternata. Escludere le fibre che non rispondono a entrambe le stimolazioni dal resto dell'esperimento.
- Spostare il cubo del filtro MTS-5-TAMRA nel percorso della luce. Utilizzando un otturatore telecomandato, attivare la luce di eccitazione da 533 nm per confermare la colorazione omogenea MTS-5-TAMRA sulle fibre.
NOTA: Dopo la colorazione con MTS-5-TAMRA, sia le cisteine ingegnerizzate che quelle endogene reagiscono con il derivato maleimmide (Figura 5B). Pertanto, è difficile valutare la reazione corretta con la cisteina di interesse. CaV1.1 è espresso principalmente nel tubulo trasversale, formando un modello a doppia banda distinguibile. Utilizzando un microscopio confocale o epifluorescenza, un'immagine x-y potrebbe essere utilizzata per confermare la corretta colorazione e l'ingresso e la diffusione del tubulo trasversale di MTS-5-TAMRA (Figura 5C).
6. Acquisizione ed elaborazione del segnale
NOTA: Prima di eseguire misure fluorometriche, l'acquisizione del segnale deve essere attentamente progettata per ottenere il rapporto segnale/rumore ottimale. Frequenze di campionamento più lente consentono una maggiore rilevazione della luce, riducendo al contempo il numero di punti che verrebbero acquisiti durante il riarrangiamento conformazionale delle proteine. Nel caso di EGFP-CaV1.1-cys, il movimento di carica indotto da una forma d'onda del potenziale d'azione si verifica in ~1-10 ms37. Per ottenere più punti per tracciare l'evoluzione del moto nel tempo, l'acquisizione è stata impostata a 50 μs per punto.
- Posizionare la fibra al centro del campo visivo con un adeguato sistema di ingrandimento. Per questi esperimenti, è stato utilizzato un obiettivo invertito ad apertura numerica (NA) 60x dell'olio 1,4. Ottimizzare l'illuminazione e la posizione della fibra con il palco motorizzato e il diaframma per illuminare un'area circolare del diametro della fibra, dove il segnale EGFP è massimo (Figura 4B).
- Una volta posizionata la fibra per l'acquisizione, orientare i due fili di platino di stimolazione di campo montati in modo indipendente a ciascuna estremità della fibra. Allineare i fili sull'asse principale delle fibre in linea retta e distanziarli di 5 mm con la fibra al centro (Figura 4B).
- Impostare i filtri di eccitazione ed emissione di acquisizione sulle impostazioni corrette per MTS-5-TAMRA. Avviare l'esperimento eseguendo il protocollo scritto nel software di acquisizione. Questo passaggio attiva tutti i dispositivi a valle (ad esempio, editor di protocollo, otturatore di luce, generatore di impulsi).
NOTA: Questo protocollo consente un breve periodo (cioè 10 ms) di acquisizione basale prima della consegna dello stimolo di campo per consentire successive misurazioni della fluorescenza a riposo. - Avviare un singolo o un treno di potenziali d'azione con un impulso quadrato di 0,5 o 1 ms, 20 V. Ridurre al minimo il tempo totale di acquisizione il più possibile per evitare lo sbiancamento del segnale.
NOTA: Anche se si registra al centro della fibra, potrebbe verificarsi un segnale di fluorescenza correlato al movimento e potrebbe essere confuso con il segnale fluorescente a causa del cambiamento conformazionale proteina-fluoroforo (Figura 5D). Il segnale indotto dalla contrazione deve essere ritardato rispetto al tempo previsto di movimento di carica post-stimolazione37. - Per distinguere ulteriormente il segnale derivante dai movimenti S4 da quello dovuto alla contrazione delle fibre, aggiungere 1 μL di 100 mM di N-benzil-p-toluene sulfonamide (BTS; concentrazione finale di 50 μM) alla soluzione di registrazione per ridurre al minimo le risposte contrattili e ripetere il passaggio 6.4. I segnali rilevati per la seconda volta dopo l'immobilizzazione farmacologica delle fibre corrispondono al movimento molecolare dell'elica S4 marcata (Figura 5D).
NOTA: Nessun segnale deve essere rilevato nel controllo EGFP-CaV1.1 senza cisteina ingegnerizzata dopo soppressione del movimento con BTS. - Utilizzando le stesse impostazioni, acquisire un segnale simile in una posizione all'interno del piatto in cui non sono presenti fibre muscolari né detriti per ottenere un valore di fluorescenza di fondo.
- Importare i file che contengono il corso temporale della fluorescenza grezza [Fr(t)] dalla fluorescenza in fibra e di fondo [Fb(t)] nel software di analisi dei dati. Calcolare la media della colonna che contiene Fb(t) per ottenere un valore Fb omogeneo. Sottrarre Fb dal Fr(t) per ottenere i valori di fluorescenza assoluta [F(t)]. Attenuare il segnale risultante con una funzione di livellamento, se necessario.
NOTA: Con questo sistema di rilevamento e la frequenza di acquisizione, abbiamo deciso di utilizzare una funzione di media adiacente con una finestra di 50 punti per lo smoothing. - Calcolare la media dei valori F(t) al basale in un intervallo di tempo di 10 ms prima della stimolazione per ottenere un valore di fluorescenza a riposo (F0). Sottrarre F0 dalla F(t) levigata per ottenere la variazione assoluta della fluorescenza [ΔF(t)]. Quindi, per esprimere la variazione della fluorescenza nel tempo rispetto alla fluorescenza a riposo (ΔF/F0), dividere ΔF(t) per F0.
- Per valutare l'entità dello sbiancamento del segnale, definire due punti dal segnale ΔF/F0 nel tempo, prima e dopo la stimolazione e lontano dal segnale fluorometrico. Adattare una funzione lineare a questi due punti per ottenere una traccia della linea di base. Sottrarre la linea di base a ΔF/F0 nel tempo per correggere lo sbiancamento del segnale.
- Sottrarre dalla colonna temporale il ritardo tra l'inizio dell'acquisizione e il segnale di feedback dalla stimolazione, per avere t = 0 corrispondente all'inizio dello stimolo elettrico.
NOTA: per consentire confronti di più segnali, è spesso necessario normalizzare l'ampiezza del segnale. È possibile utilizzare approcci diversi a seconda dello scopo dell'esperimento. Nella sezione dei risultati seguenti, eravamo interessati alla cinetica del segnale, quindi abbiamo usato un metodo semplice che consiste nel normalizzare ciascun segnale in base al valore minimo raggiunto (cioè il picco negativo in corso).
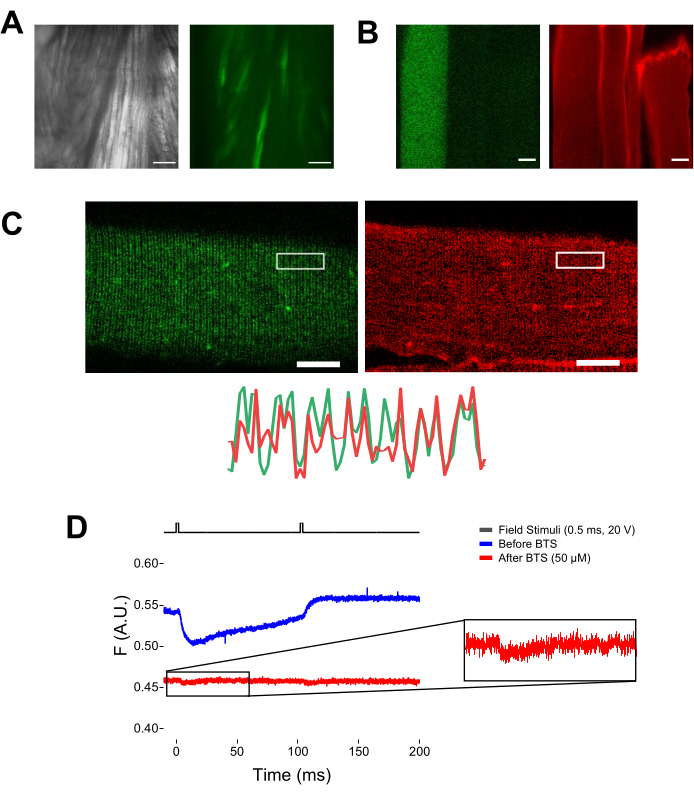
Figura 5: Imaging della fibra muscolare che esprime EGFP-CaV1.1-cys senza e con colorazione MTS-5-TAMRA e registrazione fluorometrica grezza rappresentativa. (A) Esempi di immagini trasmesse (a sinistra) e fluorescenti (a destra) del muscolo sezionato e non dissociato che esprime un costrutto EGFP-CaV1.1 VSD-III. Barra della scala: 100 μm. (B) Immagine rappresentativa di una fibra muscolare che esprime un costrutto EGFP-CaV1.1 VSD-III prima (a sinistra) e dopo (a destra) la colorazione MTS-5-TAMMA. Anche le cisteine endogene di fibre non trasfettate sono macchiate dal colorante. Barra della scala: 30 μm. (C) L'immagine confocale di un costrutto EGFP-Ca V 1.1 VSD-III (a sinistra) e la colorazione MTS-5-TAMRA (a destra) mostrano un classico pattern a doppia banda caratteristico della localizzazione di CaV1.1 sul sistema tubulare trasversale della fibra muscolare (in basso). Barra della scala: 25 μm. (D) Registrazione fluorometrica rappresentativa in risposta a due stimoli e misurata con un fotodiodo prima (traccia blu) e dopo (traccia rossa) immobilizzazione delle fibre con N-benzil-p-toluene sulfonamide (BTS). La linea nera superiore indica il protocollo per la depolarizzazione delle fibre tramite stimolazione del campo esterno. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Quando i potenziali d'azione di propagazione vengono attivati in risposta alla stimolazione ripetitiva del campo, è possibile tracciare il movimento specifico del sensore di tensione in risposta a una specifica frequenza di depolarizzazione. Come mostrato nella Figura 6A, il movimento delle eliche marcate VSD-II può essere tracciato in risposta a ciascuna delle due depolarizzazioni successive applicate a 10 Hz (cioè distanziate di 100 ms). Lo sbiancamento del segnale può essere corretto ...
Access restricted. Please log in or start a trial to view this content.
Discussione
Qui viene descritto un protocollo passo-passo per condurre FSDF nelle fibre muscolari per lo studio dei singoli movimenti del sensore di tensione dal canale CaV1.1. Anche se il numero di passaggi e la diversità degli approcci che sono combinati in questa tecnica possono sembrare complessi, la maggior parte di queste tecniche sono spesso utilizzate di routine nei laboratori di biofisici / biologi cellulari. Pertanto, l'apparente complessità risiede principalmente nella combinazione di tutti i vari approcci in...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non segnalano alcun conflitto di interessi.
Riconoscimenti
Ringraziamo il Dr. J. Vergara (Università della California, Los Angeles) per aver condiviso il plasmide wild-type EGFP-CaV1.1 (coniglio). Si ringrazia lo Yale Department of Physiology Electronics Laboratory e soprattutto Henrik Abildgaard per la progettazione e la realizzazione del fotodiodo con circuito track and hold. Questo lavoro è stato sostenuto dalle sovvenzioni del National Institutes of Health R01-AR075726 e R01-NS103777
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
Riferimenti
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915(2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. Excitation-Contraction Coupling in Skeletal Muscle. , McGraw-Hill. New York. (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. Muscle: Fundamental Biology and Mechanisms of Disease. , Academic Press, Elsevier. 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22(2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118(2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520(2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6(2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109(2022).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon