このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
骨格筋興奮性を研究するための天然細胞における機能部位特異的蛍光測定
要約
機能部位特異的蛍光法は、タンパク質ドメインの動きをリアルタイムで研究する方法です。天然細胞への適用のためのこの技術の修正は、マウス単離された骨格筋線維における電位依存性Ca2+ チャネルからの単一の電圧センサ運動の検出および追跡を可能にするようになった。
要約
機能部位特異的蛍光法は、電位依存性イオンチャネルを含む多数の膜タンパク質の構造と機能の関係を調べるために選択された技術です。このアプローチは、主に異種発現システムで使用され、膜電流、チャネルの活性の電気的発現、および蛍光測定を同時に測定し、ローカルドメインの再配列を報告しています。機能部位特異的蛍光法は、電気生理学、分子生物学、化学、および蛍光を単一の幅広い技術に組み合わせ、蛍光と電気生理学によってそれぞれリアルタイムの構造再配列と機能の研究を可能にします。通常、このアプローチには、チオール反応性蛍光色素で試験できるシステインを含む、設計された電位依存性メンブレンチャネルが必要です。最近まで、タンパク質の部位特異的蛍光標識に使用されるチオール反応性化学は、アフリカツメガエル卵母細胞および細胞株でのみ行われていたため、初代非興奮性細胞へのアプローチの範囲が制限されていました。本報告では、筋線維の電気的脱分極が筋収縮の活性化と関連しているプロセスである興奮収縮結合の初期段階を研究するために、成人骨格筋細胞における機能部位特異的蛍光測定法の適用性について説明します。本プロトコルは、in vivoエレクトロポレーションおよび機能部位特異的蛍光測定に必要なその後のステップを用いて、システイン工学的電位依存性Ca2+チャネル(CaV1.1)を成体マウスの指屈筋筋線維に設計およびトランスフェクトする方法論を説明する。このアプローチは、他のイオンチャネルやタンパク質の研究にも応用できます。哺乳類の筋肉の機能的な部位特異的蛍光法の使用は、興奮性の基本的なメカニズムの研究に特に関連しています。
概要
生細胞内の既知の電気刺激に応答してイオンチャネルの立体配座再配列を追跡する能力は、分子生理学にとって貴重な情報源です1。電位依存性イオンチャネルは、膜貫通電圧の変化を感知する膜タンパク質であり、その機能は電圧変化によっても影響を受けます2。前世紀の電圧クランプ技術の開発により、生理学者は、膜の脱分極に応答して電位依存性イオンチャネルによって運ばれるイオン電流をリアルタイムで研究することができました3。電圧クランプ技術の使用は、ニューロンや筋肉などの興奮性細胞の電気的特性を理解する上で非常に重要です。1970年代には、電圧クランプの改良により、電位依存性カルシウム(Ca V)およびナトリウム(NaV)チャネルのゲーティング電流(または電荷移動)の検出が可能になりました4,5。ゲーティング電流は、細胞膜6を横切る電界の変化に応答した電圧センサの動きから生じる非線形容量性電流である。ゲーティング電流は、イオンチャネルの開口部に先行または付随する分子再配列の電気的発現と見なされます7。これらの電流測定はチャネルの機能に関する貴重な情報を提供しますが、イオン電流とゲート電流はどちらも、電位依存性チャネルの分子間および分子内の立体配座再配列の間接的な読み出しです7。
機能部位特異的蛍光測定法(FSDF、電圧クランプ蛍光測定法、VCFとも呼ばれる)は、1990年代初頭に開発され8、初めて局所的な立体構造の変化とチャネルタンパク質の機能をリアルタイムで直接観察する機能を提供しました。チャネル突然変異誘発、電気生理学、および異種発現システムの組み合わせを使用して、活性化刺激に応答して特定のチャネルまたは受容体の可動部分を蛍光的にタグ付けおよび追跡することができる9、10。このアプローチは、電位依存性イオンチャネル8,10,11,12,13,14,15,16,17,18,19における電圧検出メカニズムの研究に広く用いられてきた。信頼できるレビューについては、10,20,21,22,23を参照してください。
電気信号の開始と伝播に重要なCa VチャネルとNaVチャネルは、中心細孔と4つの非同一電圧検出ドメイン2を有するメインα1サブユニットで構成されています。それらの別個の一次構造に加えて、CaVおよびNaVチャネルは、補助サブユニット24を有するマルチサブユニット複合体として表される。電位依存性カリウムチャネル(KV)は、NaVまたはCaV25の単一ドメインのように見える4つのサブユニットからなる。Ca、VおよびNaVチャネルの孔形成および電圧感知α1サブユニットは、6つの固有の膜貫通セグメントの4つの個別のドメインをコードする単一のポリペプチドによって形成される(S1-S6;図1A)24,26。S1〜S4膜貫通セグメントによって構成される領域は電圧検出ドメイン(VSD)を形成し、S5およびS6膜貫通セグメントは細孔ドメイン26を形成する。各VSDでは、S4 αらせんには、膜脱分極7に応答して移動する正に帯電したアルギニンまたはリジンが含まれています(図1A、B)。数十年の研究と非常に多様な実験的アプローチの結果は、S4セグメントが膜脱分極に応答して外側に移動し、ゲート電流を生成するという前提を支持しています6。
FSDFは、イオンチャネルまたは他のタンパク質上の特定のシステイン残基(すなわち、S4 αヘリックス)に結合したチオール反応性色素の蛍光変化を測定し、部位特異的突然変異誘発によって操作され、チャネルが膜脱分極または他の刺激に応答して機能するにつれて10。実際、FSDFはもともと、チャネルのメイン電圧センサーとして提案されているKVチャネルのS4セグメントが、膜電位の変化に応じてゲーティング電荷が移動するときに動くかどうかを調査するために開発されました8,10。電位依存性イオンチャネルの場合、FSDFはチャネル機能測定と同時に、4つのVSDの独立したコンフォメーション再配列(任意の時点で1つのVSDを追跡)を分解できます。実際、このアプローチを使用して、個々のVSDがチャネルの活性化と不活性化の特定の側面に異なって関与しているように見えることが示されています12、27、28、29、30。チャネルの機能に対する各VSDの寄与を特定することは関連性が高く、チャネル操作をさらに解明し、医薬品開発の新しいターゲットを特定するために使用できます。
異種発現システムにおけるFSDFの使用は、還元主義の観点からチャネル機能の理解を深めるのに非常に役立ちました10,23。多くの還元主義的アプローチと同様に、それは利点を提示しますが、制限もあります。例えば、1つの大きな制限は、異種系におけるチャネルナノ環境の部分的な再構成である。多くの場合、イオンチャネルは、それらの機能を改変する多数の付属サブユニットおよび多数の他のタンパク質と相互作用する31。原則として、異なるチャネルおよびそれらの付属品サブユニットは、複数のタンパク質コードコンストラクトまたはポリシストロニックプラスミドを使用して異種系で発現させることができるが、それらの天然環境を完全に再構成することはできない30,32。
私たちのグループは最近、筋線維の電気的脱分極が筋収縮の活性化に関連しているプロセスである興奮収縮結合(ECC)33,34の初期段階の研究のために、ネイティブの解離骨格筋線維におけるFSDFの変異体を発表しました35,36。初めて、このアプローチは、成人分化筋線維の天然環境における電位依存性L型Ca2+チャネル(CaV1.1、DHPRとしても知られる)からの個々のS4電圧センサの運動追跡を可能にした37。これは、高速刺激による自己増殖脱分極を可能にする細胞の電気的活性、in vivoエレクトロポレーションによるcDNAプラスミドの発現能力、細胞内のチャネルの自然な高発現および区画組織化、高速イメージングおよび電気生理学的記録デバイスとの互換性など、この細胞タイプの複数の特性を考慮することによって達成されました。これまで、検出装置37として高速ライン走査型共焦点顕微鏡を用いた。ここで、信号取得用のフォトダイオードを使用して、この手法のバリエーションを紹介します。このフォトダイオードベースの検出システムは、他の研究室でのこの技術の実装を容易にする可能性があります。
ここでは、CaV1.1からの個々の電圧センサーの動きの研究のためにネイティブセルでFSDFを利用するための段階的なプロトコルについて説明します。この原稿全体で例としてCaV1.1チャネルが使用されてきましたが、この手法は、他のイオンチャネル、受容体、または表面タンパク質の細胞外アクセス可能なドメインに適用できます。
プロトコル
このプロトコルは、メリーランド大学施設動物管理および使用委員会によって承認されました。以下のプロトコルは、(1)分子構築物設計とシステイン反応色素の選択、(2) in vivo エレクトロポレーション、(3)筋解剖と線維分離、(4)取得セットアップの説明、(5)増強された緑色蛍光タンパク質(EGFP)陽性の繊維電気的活性とシステイン染色の評価、および(6)シグナルの取得と処理からなる複数のサブセクションに分かれています。さらに、各セクションの冒頭で、骨格筋線維にFSDFを適用する際のいくつかの関連する考慮事項について詳しく説明します。すべてのプロトコルセクションは、白衣や手袋などの適切な個人用保護具を使用して実行する必要があります。
1. 分子構築設計とシステイン反応色素の選択
- 構築設計は、実験の成功の重要な部分です。まず、野生型の蛍光タグ付きCaV1.1 cDNAコンストラクトを作製し、適切な細胞型での発現を評価します。筋線維の場合、サイトメガロウイルス(CMV)プロモーターを担持するプラスミドを使用することで、強力なトランスフェクション効率を達成できます。このプロトコルでは、既に特徴付けられたウサギEGFP-CaV1.1プラスミド38を使用した。
注:電位依存性イオンチャネルにシステイン残基を導入するようにcDNA構築物を改変する場合、システインの位置は重要であり、慎重に検討する必要があります。システインは、チオール結合色素反応を可能にするために細胞外空間からアクセス可能であり(図1C、D)、脱分極に応答してその動きを正確に追跡するためにS4領域に近接している必要があります。しかし、タンパク質の動きに応答して色素の蛍光消光を可能にするには、導入されたシステイン結合蛍光色素は、2つの異なる環境(例えば、膜と細胞外液; 図1E)。さらに、挿入されたシステインがタンパク質の機能を妨げないようにすることが重要です。 - 適切なシステイン局在化に関するアイデアを得るには、チャネル構造に関する情報を収集するか、他の関連するチャネルタンパク質の他の蛍光測定実験から情報を収集します。システイン工学によるCa V 1.1コンストラクトの設計では、チャネル26の分解クライオ電子顕微鏡(クライオEM)構造を評価し、CaV1.212などの関連チャネル、またはシェーカー11やNaChBac39などの他のチャネルからの以前の研究のシステイン挿入を比較します。
- 適切なシステイン位置を選択したら、市販の部位特異的突然変異誘発キットを使用してシステイン置換を導入します。本プロトコルでは、以下のシステイン修飾を、CaV1.1のS4電圧感知セグメントの各細胞質末端で独立して操作した:VSD-I(L159C)、VSD-II(L522C)、VSD-III(V893C)、VSD-IV(S1231C)、およびUniProtKB:P07293(図1B)。
- 骨格筋線維には、表面膜の陥入およびCaV1.1チャネルの優勢な位置である横細管膜系への適切かつ迅速な拡散を示す5-カルボキシテトラメチルローダミンメタンチオスルホネート(MTS-5-TAMRA)を使用する。MTS-5-TAMRAは、脂質膜から水性環境に移行する際に蛍光の減少を示します(図1E)。
注:ダイライトまたはAlexa-マレイミド誘導体は表面膜を染色しますが、横尿細管システムは染色しません。
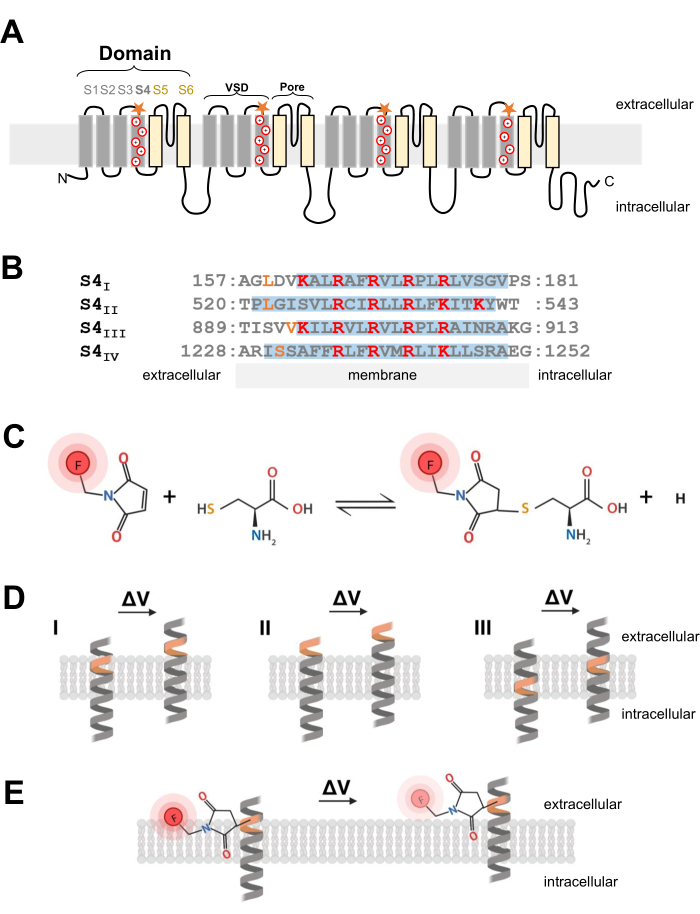
図1:膜貫通αらせんの界面におけるチオール-システイン反応の模式図。 (A)L型CaV1.1膜トポロジー。プラス記号はS4 αらせん内の塩基性残基を表し、オレンジ色の星は部位特異的突然変異誘発によってシステインが導入された場所を示します。(B)ウサギCaV1.1のS4IからS4IVへの配列アラインメント(UniProtKB:P07293)。電圧検出に重要な正に帯電したアルギニン残基とリジン残基は赤で強調表示され、操作されたシステイン置換はオレンジで示されます。このパネルは参考文献37から適応されています。(c)システイン-チオール蛍光分子反応。(d)膜貫通電位感受性αらせん内へのシステイン突然変異誘発作用を示す図である。システインは安静時に膜に埋め込まれ、脱分極後に細胞外にアクセス可能である必要があります(ΔV;システインの追跡は、標的システインが脱分極前に細胞外空間からすでにアクセス可能である場合(II)、または脱分極後にシステインが細胞外空間からアクセスできない場合(III)には通常起こりそうにありません。(e)チオール蛍光分子との反応後、脱分極に応答したαらせん運動によりMTS-5-TAMRA蛍光発光が減少する。蛍光信号は、S4ヘリックスの移動とそれに続くメンブレンと水性環境に対する色素の移動によって生成されます。この図の拡大版を表示するには、ここをクリックしてください。
2. 生体内 エレクトロポレーション
注:エレクトロポレーション実験は、前述のように38 を改変して実施した。次のセクションでは、プロトコルは、マウスの片足パッドのエレクトロポレーション用に設計されています。両方の足を準備する場合は、音量を調整する必要があります。
- 氷上に置いた1.5 mLチューブに2〜5 μg/μLのプラスミド溶液25〜100 μLを分注します。
- 滅菌生理食塩水中の2 mg/mLヒアルロニダーゼの0.5 mL溶液を調製し、1 mLシリンジに取り付けられた低結合タンパク質0.2 μm滅菌フィルターで溶液をろ過します。室温で1.5 mLチューブに保存してください。
- 較正された麻酔装置を使用して、マウスを麻酔室に入れることによって、O2 (1L / min)中の3%〜4.5%イソフルランを使用してマウスを麻酔する。ピンセットを使用して尾の先端をつまんで、動物の適切な麻酔を確認します。最適な麻酔に達したときに反応は観察されません。.
- マウスを麻酔室から取り出し、麻酔ノーズマスクをマウスの上に置きます。滅菌ベンチパッドで覆われた等温加熱パッドの上に動物を仰向けに置きます。O2 (1 L / min)中の3%イソフルランを含むげっ歯類マスクを使用して麻酔を継続します。
- 処置中の目の乾燥を防ぐために、滅菌綿の先端で動物の目に人工涙液クリームの細かい層を塗ります。エチルアルコールで飽和させた滅菌ワイプを使用して動物の足を消毒します。
- 長さ29Gの0.5インチ滅菌インスリン針を用いて、20μLのヒアルロニダーゼ溶液を吸引する。かかとの高さで皮膚を貫通し、つま先の付け根に向かって皮下に針をスライドさせます(図2A)。針を徐々に後方に動かしながら、ゆっくりと溶液を注入します。足の下にボーラスまたはバンプを観察する必要があります(図2B)。
注:動物の年齢や足の大きさによっては、全量の溶液が注入されない可能性があります。多くの場合、注入点からの小さな漏れが発生する可能性があります。 - 必要に応じて、ステップ2.6のように、適切な足の消毒後に別の滅菌針を使用して、もう一方の足で手順2.5を繰り返します。
- 動物をノーズマスクから取り外して麻酔を外し、マウスをケージに戻して、餌と水を 自由に摂取できるようにします。麻酔からの完全な回復は~5分で観察されるべきです。プラスミド溶液を含むチューブをベンチに置き、室温に到達させます。
- 1時間後、動物をもう一度麻酔し、加熱パッドの上に置き、手順2.3〜2.5の説明に従って足を消毒します。
- ステップ2.6で説明したのと同じ手法を使用して、10〜20 μLのcDNA構築物を注入します。注入されるコンストラクトの総量は、足あたり50〜100μgである。必要に応じて、別の滅菌注射器を使用して、反対側の足で手順を繰り返します。
- 動物を等温加熱パッドで5分間麻酔下に置き、cDNA溶液が組織全体に均一に分散できるようにします。
- エレクトロポレーション装置の電源を入れ、製造元の推奨に従って二重電極アレイに接続します。
- エチルアルコールで飽和させたワイプを使用して二重電極アレイを消毒します。片手で足を安定させ、最初にかかとの後ろの皮膚の下に1つの電極を挿入します。次に、つま先の付け根に2番目の電極を挿入し、両方の電極の向きが足の軸に垂直になるようにします(図2C)。足や脚を極端な角度方向に拘束しない位置にプローブを向けます。
注:電極の挿入は、ピンセットを使用し、電極の先端を定期的に鋭くすることで容易になります。動物の年齢に応じて、足のサイズは変化する可能性があり、電極の間隔はそれに応じて調整する必要があります。 - 1Hzで20パルス、持続時間20ミリ秒/それぞれを適用して、筋肉を電気分解します。電極針の間隔が1cmの場合は、電圧を~100Vに設定します。これは、電極間隔が~100 V/cmに達するように変更される場合に調整する必要があります。電極が適切に配置されている場合、パルス配信中に指のわずかな屈曲を観察する必要があります。
- 必要に応じて、反対側の足で手順2.13と2.14を繰り返します。
- 麻酔を外し、動物をケージに入れ、電気孔を通さないカウンターメイトから隔離し、食物と水に2時間 自由 にアクセスします。麻酔からの完全な回復は~10分で観察されるべきです。動物をケージの中に戻します。
注:cDNAコンストラクトの発現は、コードされるタンパク質に大きく依存します。タンパク質の代謝回転、cDNAの量と質、プラスミドプロモーター、およびその他の変数は、構築物の発現に影響を与える可能性があります。この実験では、CMVプロモーターによるCaV1.1のα1Sサブユニットの最適発現には4〜6週間かかりますが、2週間から最大12〜15か月まで検出できます。
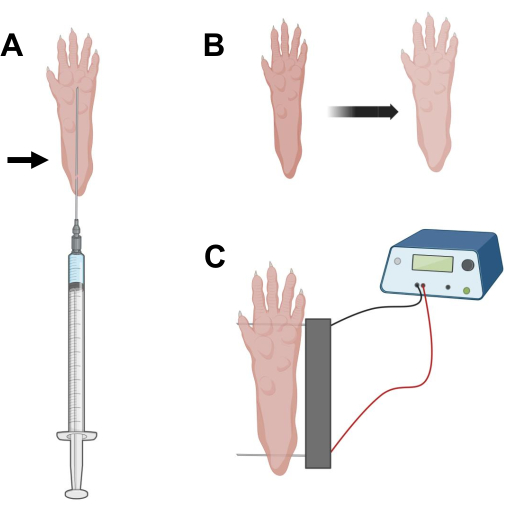
図2:エレクトロポレーション用マウスフットパッドにおけるcDNA注入およびエレクトロポレーションエレクトロポレーション電極位置決めの図。 (A)マウスフットパッド下でのヒアルロニダーゼおよびcDNA注入の針位置。矢印は、スキンを通る挿入点を示します。(B)注射後、皮膚のわずかな変色と足のサイズのわずかな増加を一時的に観察する必要があります。.(C)エレクトロポレーションのための電極アレイの位置決め。この図の拡大版を表示するには、ここをクリックしてください。
3.筋肉解剖と繊維分離
注:骨格筋線維解離は、改変を加えて前述のように行った37、40、41。次のセクションでは、プロトコルはマウスの2つのフットパッドに適しています。
- 繊維が解離する前に、60 mmのプラスチックシャーレでエラストマー10部(%w / w)に硬化剤1部を加えて、厚さが~5 mmになるようにシルガードで覆われたプレートを準備します。エラストマーで覆われたプレートを使用前に一晩硬化させます。これは、使用前と使用後に適切に保管し、70%エチルアルコールで消毒すれば、複数回再利用できます。
- 10%ウシ胎児血清(FBS;最終濃度2 mg / mL)を添加した2 mLのスピナー最小必須ワシ培地(S-MEM)に4 mgのコラゲナーゼI型を調製します。溶液を35 mmのコーティングされていないプラスチックプレートに移し、皿を37°C、5%CO2のインキュベーターに入れます。
注:S-MEMは、グルタミンとCa2+を含まない修飾MEM製剤です。このステップでCa2+ が存在しないと、酵素消化および摩砕中の繊維拘縮が減少します。 - 10%FBSを添加した5 mLのS-MEMを60 mmのコーティングされていないプラスチックプレートに加え、37°C、5%CO2のインキュベーターに保存します。
- CO2による窒息とそれに続く頸部脱臼によって動物を安楽死させる。初代細胞単離中の汚染を減らすために、動物の死骸を70%エチルアルコールに~10秒間沈めます。枝肉を取り外して吸収紙で乾かし、足首と膝の間にハサミで足を切ります(図3A)。
- 動物の片足を、前足を上に向けて、解剖顕微鏡下で10倍の倍率でエラストマーで覆われたプレートに解剖ピンを付けます。
- 解剖はさみと細いピンセットを使用して、足から皮膚を取り除き、指屈筋(FDB)の筋肉を露出させます(図3B)。組織の乾燥を防ぐために、1,000 μLのピペットを使用してS-MEM 10% FBSを筋肉に滴下します。
- かかとの高さで、腱を切開し、FDB筋をかかとからつま先まで注意深く解剖します(図3B)。解剖中はできるだけ筋肉の緊張を避けてください。組織に力を入れすぎると、筋繊維が損傷します。筋肉をすぐにコラゲナーゼ溶液に入れます。
- 反対側の足で手順3.5〜3.7を繰り返します。解剖した筋肉をコラゲナーゼ溶液中の37°C、5%CO2 インキュベーターに2時間45分から3時間15分間入れる。コラゲナーゼ酵素活性と動物の年齢に応じてインキュベーション時間を調整してください。
- 筋肉組織がインキュベートされている間に、35 mmのガラス底皿の中央に血清や抗生物質を含まない300 μLの冷たいMEMを追加します。2 μLのコールドラミニンを1.20 mg/mLでMEMに直接添加します。必要な料理の数だけこのプロセスを繰り返します。ディッシュを37°C、5%CO2 で少なくとも1時間細胞培養インキュベーターに入れ、ラミニン重合を可能にする。
- 酵素消化が完了したら、大口径(5 mm)のファイアポリッシュガラスパスツールピペットとラテックスバルブを使用して、S-MEM 10% FBSを含む60 mm細胞培養皿に筋肉を移します。
- 小口径(2 mm)のファイアポリッシュガラスパスツールピペットとラテックスバルブを使用して、解剖顕微鏡下で筋肉を穏やかに粉砕します(図3C)。解離した筋線維は組織から剥離し始め、溶液中に放出されるはずです。
注:経験則として、長時間の粉砕は繊維にストレスを与えたり損傷したりする可能性があるため、より少ない粉砕(15〜30ピペット通路)が常に推奨されます。 - 細いピンセットを使用して、神経、腱、血管などの筋肉以外の組織をすべて取り除きます(図3D)。
- 2 mLの温かいMEM 2% FBSを各35 mmラミニンコーティングガラス底皿に加えます。200 μLピペットと滅菌プラスチックピペットチップを使用して、解離した筋線維を35 mmラミニンコーティングされたガラス底皿に移します(図3E)。
注:繊維密度を低くし、繊維を互いに十分に分離できるようにすることは、繊維の重なりを防ぐために重要です。 - 35 mmガラス底皿を37°C、5%CO2のインキュベーターに入れます。繊維は2〜20時間の時間枠で使用できます。
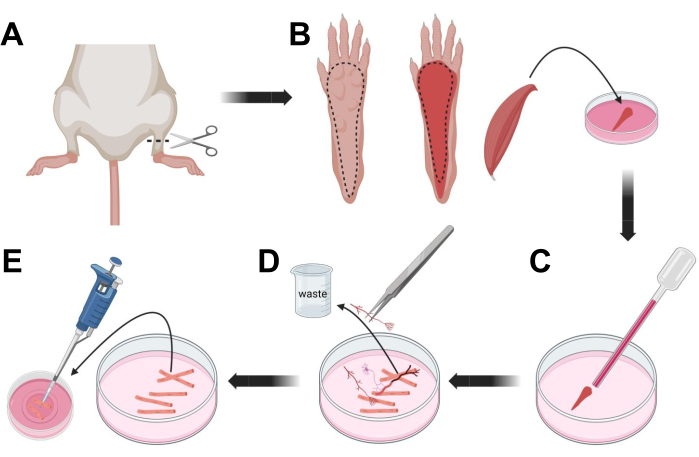
図3;筋肉FDB線維の解剖と解離。 (A)足首関節の上方の足郭清後(破線)、足足の下の皮膚を切除し、破線に従ってFDB筋を露出させる(B)。筋肉を解剖し、コラゲナーゼ溶液に入れる。(C)インキュベーション後、筋肉を粉砕して解離させ、個々の筋線維を得る。(D)ラミニンコートガラス底培養皿に筋繊維を移す前に、細いピンセットを使用して非筋肉組織および破片を除去する。 この図の拡大版を表示するには、ここをクリックしてください。
4. 取得設定の説明
メモ:アクイジションのセットアップは、42 の前に説明したものと同等ですが、変更されています(図4A)。
- コンピューター、AD/DAコンバーター、パスクランプアンプ、顕微鏡、電動ステージ、マニピュレーター、フォトダイオード用電源、光源、ライトシャッター、パルス発生器、プロトコルエディターのすべてのコンポーネントをオンにします。
- AD/DAからのOUT信号をトリガーするトランジスタ-トランジスタロジック(TTL)をアクティブにして、パルス発生器、ライトシャッター、およびプロトコルエディタを制御します。
- パルス発生器からのTTL出力信号を使用し、アンプのADチャンネルに接続して、正確な時間トリガーを確認します。適切な装置の同期を確保するために、実験の前にトリガーの一貫性を適切に制御して慎重に評価する必要があります。
注:CaV1.1の場合、刺激後4〜10ミリ秒未満で最大信号が見られることを期待してください(最大電荷運動が発生する時間5)。信号は高速で正確であり、電圧クランプ を介して 測定されるカルシウム過渡や電荷の動きなどの他の測定値と比較するには、時間分解能が重要です。 - ファイバの特定の領域またはスポットに励起光を集束させるには(図4B)、励起光路に配置されたダイアフラムを使用します。これにより、EGFP-CaV1.1信号が最大となる領域でのみ信号取得が可能になります(図4B)。
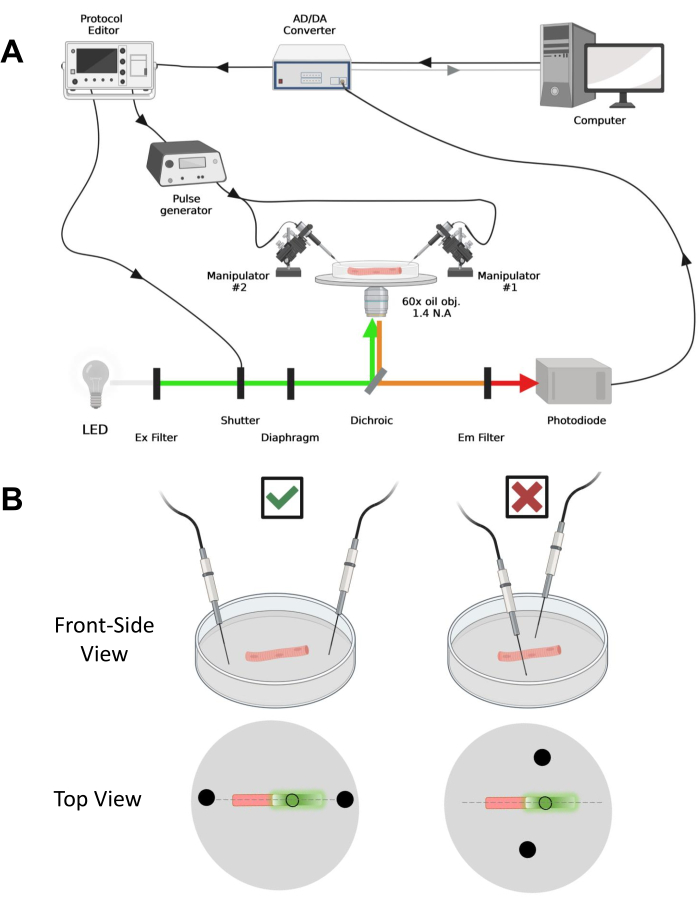
図4:記録システムの説明 。 (a)記録システムの異なる構成要素間の接続を示す図。セットアップは、電動ステージを備えた倒立顕微鏡、発光ダイオード(LED)光源、ライトシャッター、トラックアンドホールド機能を備えたカスタムメイドのフォトダイオードベースの光監視回路43、AD/DAコンバーター(パッチクランプアンプから)、アナログパルス発生器、フィールド刺激電極に結合された外部フィールド刺激ユニット、 電動マニピュレータ、およびプロトコルの取得、同期、および生成のための商用ソフトウェア。電界刺激用の電極は、BMCコネクタ を介して パルス発生器に接続された銅ケーブルに溶接された2本の白金線でできています。EGFPとMTS-5-TAMRAの両方のシグナルを検出するために、特定の励起および発光フィルターが使用されます。EGFPを励起するために、488 nm(± 20 nm)励起(Ex)フィルターとLP510 nm Emフィルターを備えたキセノンランプが使用されます。MTS-5-TAMRAには、530nmのLED光源とLP550nmのEmフィルタが使用されています。(B)EGFP-CaV1.1-cysコンストラクトを発現するファイバーの図で、2視野刺激電極(黒丸)がファイバーの主軸に正しく(左)向き、不適切(右)になっている(破線)。黒い塗りつぶされていない円は、光源の前に配置された、ダイアフラム開口部によって制御される直径を持つ取得領域を表します。 この図の拡大版を表示するには、ここをクリックしてください。
5. EGFP陽性線維の電気的活性とシステイン染色の評価
注:骨格筋線維野刺激は、41 の前述したように、修正を加えて行われる。このアプローチは、(1)健康で機能的で電気的に応答する繊維を同定し、(2)システイン反応性蛍光色素で繊維を染色し、(3)伝播した活動電位に応答して蛍光シグナルを記録するために使用されます。このセクションのすべてのステップと次のセクションは、蛍光染料の漂白を減らすために、暗い環境で実行する必要があります。
- 解離した筋線維を含む35mmのガラス底皿を顕微鏡のステージに置きます。1,000 μLのピペットで培養液を慎重に取り出し、2 mLの室温リンゲル液と交換します(組成については 表1 を参照)。遊離システインを含む元の細胞培養培地を完全に除去するには、複数回の培地交換が必要になる場合があります。
- 機械式または電動マニピュレーターを使用して、2本のプラチナワイヤーを皿の底に垂直に置きます。電極端子がファイバの縦軸に対して位置合わせされ、ファイバの端から数ミリメートル離れていること、および電極間の間隔が5 mmであることを確認します(図4B)。ディッシュを回転させるか、各電極を独立したマイクロマニピュレーターに取り付けることで、電極の位置をさらに調整します(図4B)。
- 透過光をオンにし、20倍の対物レンズを使用して視野内のファイバーを見つけます。EGFPフィルターキューブを光路に移動します。
注:落射蛍光と低倍率(2倍)対物レンズを備えた顕微鏡を使用して、EGFP発現を評価することにより、線維解離前の筋肉全体における構築物のトランスフェクション効率を評価することができます(図5A)。 - リモートコントロールライトシャッターを使用して、488 nmの励起光をアクティブにし、EGFP陽性ファイバーを識別します。ファイバーのx-y位置を電動顕微鏡ステージを使用して皿に保管します。EGFPシグナルは、ファイバ内で不均一であることがよくあります(図4B)。保存した位置を最も明るいEGFP信号の中央に配置します。
- EGFP陽性繊維を同定した後、最初に保存した局在に戻る。手動トリガスイッチを使用して、持続時間が1 ms、振幅が20 Vの2つの連続刺激パルスを供給します。パルスの極性を交互に設定します。
- 刺激後、反対極性の2つのパルスに応答して、2つの同心円状の均質な線維収縮を観察します。交互極性のパルスに対する応答における局所的な収縮または収縮の欠如は、局所的な非伝播受動応答または非興奮性を示す41。実験の残りの部分では、これらの繊維を除外します。
- 2 μLの10 mM MTS-5-TAMRA溶液をディッシュに直接加え、1,000 μLのピペット(最終濃度10 μM)で穏やかに混合します。皿を動かさないように注意してください、さもなければ貯蔵された繊維の位置は失われます。4〜5分間インキュベートして、蛍光チオール分子を横尿細管系内腔に拡散させます。
- バイポーラ反復刺激を適用して、50Hzの速度で1秒ごとに300ミリ秒、5分間連続した活動電位列車を呼び起こします。
注:パルス列は、MTS-5-TAMRAと反応するためにEGFP-CaV1.1のS4に挿入されたシステインへのアクセスを提供します。刺激に応答して機械的に収縮する繊維の能力は、横尿細管内腔の内容物が細胞外環境と循環するために重要です。 - 1,000 μLのピペットでディッシュから染色液を取り出し、2 mLの室温リンゲル液と交換します。非抱合型MTS-5-TAMRAを完全に除去するには、2〜3ラウンドが必要になる場合があります。染色された繊維を染色プロトコルから少なくとも10分間回復させます。
- ステップ5.6と同様に、交互の極性に応答して対称的な繊維の収縮を観察して、繊維の健全性と電気的活動を再評価します。両方の刺激に反応しない繊維を実験の残りの部分から除外します。
- MTS-5-TAMRAフィルターキューブを光路に移動します。リモートコントロールライトシャッターを使用して、533 nmの励起光をアクティブにし、繊維上の均一なMTS-5-TAMRA染色を確認します。
注:MTS-5-TAMRAで染色すると、操作されたシステインと内因性システインの両方がマレイミド誘導体と反応します(図5B)。したがって、目的のシステインとの適切な反応を評価することは困難である。CaV1.1は主に横細管で発現し、識別可能な二重バンドパターンを形成します。共焦点顕微鏡または落射蛍光顕微鏡を使用して、x-y画像を使用して、MTS-5-TAMRAの適切な染色および横尿細管の侵入および拡散を確認することができました(図5C)。
6. 信号の取得と処理
メモ: 蛍光測定を行う前に、最適な信号/雑音比が得られるように信号集録を慎重に設計する必要があります。サンプリングレートを遅くすると、より多くの光検出が可能になり、タンパク質の立体構造再配列中に取得されるポイントの数が減少します。EGFP-CaV1.1-cysの場合、活動電位波形によって誘起される電荷移動は~1-10ミリ秒37で起こる。時間の経過に伴う動きの進展を追跡するために複数のポイントを取得するために、取得はポイントあたり50μsに設定されました。
- 適切な倍率システムで視野の中央にファイバーを配置します。これらの実験では、60倍のオイル1.4開口数(NA)倒立対物レンズを使用しました。電動ステージとダイアフラムで照明とファイバー位置を最適化して、EGFP信号が最大になるファイバーの直径の円形領域を照らします(図4B)。
- ファイバが取得用に配置されたら、独立して取り付けられた2本のフィールド刺激白金線をファイバの両端に向けます。ワイヤをファイバの主軸上に直線的に合わせ、ファイバを中央にして5 mm離します(図4B)。
- アクイジション励起フィルタと蛍光フィルタをMTS-5-TAMRAの適切な設定に設定します。取得ソフトウェアに記述されたプロトコルを実行して実験を開始します。このステップにより、すべてのダウンストリームデバイス(プロトコルエディタ、ライトシャッター、パルス発生器など)がトリガーされます。
注:このプロトコルでは、フィールド刺激の送達前に短時間(つまり、10ミリ秒)のベースライン取得が可能になり、その後の安静時蛍光の測定が可能になります。 - 0.5または1 ms、20 Vの方形パルスで単一または一連の活動電位を開始します。シグナルの白化を避けるために、総アクイジション時間をできるだけ最小限に抑えます。
注:ファイバーの中心で記録した場合でも、タンパク質-蛍光色素の立体構造変化により、運動に関連する蛍光シグナルが発生し、蛍光シグナルと交絡する可能性があります(図5D)。収縮誘導信号は、刺激後の電荷移動の予想時間と比較して遅延されるべきである37。 - S4運動から生じるシグナルと線維収縮によるシグナルをさらに区別するには、収縮反応を最小限に抑えるために1 μLの100 mM N-ベンジル-p-トルエンスルホンアミド(BTS;最終濃度50 μM)を記録溶液に加え、ステップ6.4を繰り返します。繊維薬理学的固定化後に2回目に検出されたシグナルは、タグ付けされたS4ヘリックスの分子運動に対応する(図5D)。
注:BTSによる運動抑制後、操作されたシステインなしでコントロールEGFP-CaV1.1で信号が検出されるべきではありません。 - 同じ設定を使用して、筋繊維や破片が存在しない皿内の場所で同様の信号を取得し、バックグラウンド蛍光の値を取得します。
- ファイバーおよびバックグラウンド蛍光[Fb(t)]からの生蛍光[Fr(t)]の時間経過を含むファイルをデータ解析ソフトウェアにインポートします。Fb(t) を含む列を平均して、均質な Fb 値を取得します。Fr(t)からFbを減算して、絶対蛍光[F(t)]値を取得します。必要に応じて、平滑化機能を使用して結果の信号を平滑化します。
注:この検出システムと取得頻度により、平滑化に50ポイントのウィンドウを持つ隣接平均化関数を使用することにしました。 - 刺激の10ミリ秒前の時間間隔でベースラインF(t)値を平均して、静止蛍光値(F0)を取得しました。平滑化されたF(t)からF0を差し引いて、蛍光の絶対変化[ΔF(t)]を求めます。次に、静止時蛍光(ΔF/F0)に対する経時的な蛍光変化を表すには、ΔF(t)をF0で割ります。
- シグナルの漂白の程度を評価するには、ΔF/F0の経時的な信号から、刺激の前後と蛍光信号から離れた2つのポイントを定義します。これらの2つの点に線形関数を当てはめて、ベースライントレースを取得します。時間の経過とともにベースラインをΔF / F0に引き、シグナルの白化を補正します。
- 刺激からの取得開始とフィードバック信号との間の遅延を時間列から差し引くと、電気刺激の開始に対応するt=0となる。
メモ: 複数の信号比較を可能にするには、多くの場合、信号の振幅を正規化する必要があります。実験の目的に応じて、さまざまなアプローチを使用できます。以下の結果セクションでは、シグナルの動力学に関心があったため、各シグナルを最小到達値(つまり、負の進行ピーク)で正規化する単純な方法を使用しました。
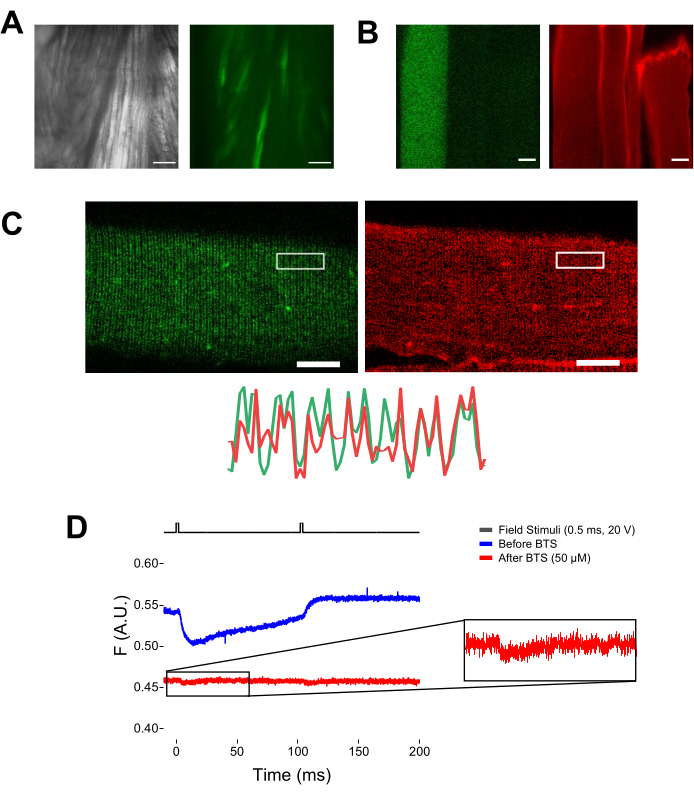
図5:EGFP-CaV1.1-cysを発現する筋線維のイメージング、MTS-5-TAMRA染色の有無にかかわらず、代表的な生蛍光記録。 (a)EGFP-CaV 1.1 VSD-IIIコンストラクトを発現する解剖した、解剖されていない筋肉の透過(左)および蛍光(右)画像の例。スケールバー:100 μm。 (B)MTS-5-TAMRA染色前(左)および染色後(右)にEGFP-CaV1.1 VSD-IIIコンストラクトを発現する筋線維の代表的な画像。トランスフェクションされていない繊維の内因性システインも染料によって染色されます。スケールバー:30 μm。 (C)EGFP-CaV1.1 VSD-IIIコンストラクトの共焦点画像(左)とMTS-5-TAMRA染色(右)は、筋線維の横細管系(下)上のCaV1.1局在に特徴的な古典的なダブルバンドパターンを示しています。スケールバー:25 μm。 (D)2つの刺激に応答し、N-ベンジル-p-トルエンスルホンアミド(BTS)による繊維固定化の前(青色のトレース)および後(赤色のトレース)のフォトダイオードで測定した代表的な蛍光記録。上の黒い線は、外部フィールド刺激によるファイバー脱分極のプロトコルを示しています。この図の拡大版を表示するには、ここをクリックしてください。
結果
反復的な電界刺激に応答して伝播活動電位がトリガされると、脱分極の特定の周波数に応答して特定の電圧センサの動きを追跡することができる。 図6Aに示すように、VSD-IIタグ付きヘリックスの動きは、10Hz(すなわち、100ms間隔で)で適用される2つの連続した脱分極のそれぞれに応じて追跡することができる。シグナルの漂白は、ベースラインをトレースに差し引くこと?...
ディスカッション
ここでは、CaV1.1チャネルからの個々の電圧センサーの動きを研究するために筋線維でFSDFを実施するための段階的なプロトコルについて説明します。この手法で組み合わされるステップ数とアプローチの多様性は複雑に見えるかもしれませんが、これらの手法のほとんどは、生物物理学者/細胞生物学者の研究室で日常的に使用されていることがよくあります。したがって、見かけの複...
開示事項
著者らは利益相反を報告していない。
謝辞
EGFP-CaV1.1(ウサギ)野生型プラスミドを共有してくださったJ. Vergara博士(カリフォルニア大学ロサンゼルス校)に感謝します。イェール大学生理学部電子工学研究所、特にトラックアンドホールド回路を備えたフォトダイオードの設計と構築についてHenrik Abildgaardに感謝します。この作業は、国立衛生研究所の助成金R01-AR075726およびR01-NS103777によってサポートされました
資料
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
参考文献
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915 (2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. . Excitation-Contraction Coupling in Skeletal Muscle. , (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. . Muscle: Fundamental Biology and Mechanisms of Disease. , 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22 (2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118 (2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520 (2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6 (2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved