JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
골격근 흥분성을 연구하기 위한 천연 세포의 기능적 부위 지정 형광 측정
요약
기능적 부위 지정 형광 측정법은 단백질 도메인 동작을 실시간으로 연구하는 방법입니다. 천연 세포에 적용하기 위해 이 기술을 수정하면 이제 쥐 격리 골격근 섬유의 전압 개폐 Ca2+ 채널에서 단일 전압 센서 동작을 감지하고 추적할 수 있습니다.
초록
기능적 부위 지정 형광 측정법은 전압 개폐 이온 채널을 포함한 수많은 막 단백질의 구조-기능 관계를 조사하기 위해 선택되는 기술이었습니다. 이 접근법은 주로 이종 발현 시스템에서 멤브레인 전류, 채널 활동의 전기적 발현 및 형광 측정을 동시에 측정하여 로컬 도메인 재배열을 보고하는 데 사용되었습니다. 기능적 부위 지정 형광 측정법은 전기 생리학, 분자 생물학, 화학 및 형광을 형광 및 전기 생리학을 통해 실시간 구조 재배열 및 기능을 연구할 수 있는 광범위한 단일 기술로 결합합니다. 일반적으로 이 접근 방식에는 티올 반응성 형광 염료로 테스트할 수 있는 시스테인을 포함하는 엔지니어링된 전압 개폐 멤브레인 채널이 필요합니다. 최근까지 단백질의 부위 지향 형광 표지에 사용된 티올 반응성 화학은 Xenopus 난모세포 및 세포주에서만 수행되어 1차 비흥분성 세포에 대한 접근 범위를 제한했습니다. 이 보고서는 근육 섬유의 전기 탈분극이 근육 수축의 활성화와 연결되는 과정인 여기-수축 커플링의 초기 단계를 연구하기 위해 성인 골격근 세포에서 기능적 부위 지시 형광 측정법의 적용 가능성을 설명합니다. 본 프로토콜은 생체 내 전기천공을 사용하여 시스테인 공학 전압 개폐 Ca2+ 채널(CaV1.1)을 설계하고 성인 마우스의 굴근 손가락 브레비스의 근육 섬유로 형질감염시키는 방법론과 기능적 부위 지정 형광 측정 측정에 필요한 후속 단계를 설명합니다. 이 접근법은 다른 이온 채널과 단백질을 연구하는 데 적용할 수 있습니다. 포유류 근육의 기능적 부위 지정 형광 측정법의 사용은 특히 흥분성의 기본 메커니즘을 연구하는 것과 관련이 있습니다.
서문
살아있는 세포에서 알려진 전기적 자극에 대한 반응으로 이온 채널 구조적 재배열을 추적하는 능력은 분자 생리학에 대한 귀중한 정보의 원천입니다1. 전압 개폐 이온 채널은 막횡단 전압의 변화를 감지하는 막 단백질이며, 그 기능도 전압 변화의 영향을 받습니다2. 지난 세기의 전압 클램프 기술의 발전으로 생리학자들은 막 탈분극에 반응하여 전압 개폐 이온 채널에 의해 전달되는 이온 전류를 실시간으로 연구할 수 있었습니다3. 전압 클램프 기술의 사용은 뉴런 및 근육과 같은 흥분성 세포의 전기적 특성을 이해하는 데 중요했습니다. 1970년대에는 전압 클램프 미세 조정을 통해 전압 개폐 칼슘(CaV) 및 나트륨(NaV) 채널 4,5에서 게이팅 전류(또는 전하 이동)를 감지할 수 있었습니다. 게이팅 전류는 세포막6을 가로지르는 전기장의 변화에 반응하여 전압 센서의 움직임에서 발생하는 비선형 용량성 전류입니다. 게이팅 전류는 이온 채널 개방7 이전 또는 수반되는 분자 재배열의 전기적 표현으로 간주된다. 이러한 전류 측정은 채널의 기능에 관한 귀중한 정보를 제공하지만, 이온 전류와 게이팅 전류는 모두 전압 개폐 채널7의 분자 간 및 분자 내 구조적 재배열에 대한 간접적인 판독값입니다.
1990년대 초반에 개발된 기능적 부위 지정 형광 측정법(FSDF, Voltage Clamp Fluorometry, VCF라고도 함)은8 처음으로 국소 구조적 변화와 채널 단백질의 기능을 실시간으로 직접 볼 수 있는 기능을 제공했습니다. 채널 돌연변이 유발, 전기생리학 및 이종 발현 시스템의 조합을 사용하여, 활성화 자극에 반응하여 특정 채널 또는 수용체의 움직이는 부분을 형광으로 태깅하고 추적할 수 있다(9,10). 이 접근법은 전압 개폐 이온 채널 8,10,11,12,13,14,15,16,17,18,19에서 전압 감지 메커니즘을 연구하기 위해 광범위하게 사용되었습니다. 권위 있는 리뷰는 10,20,21,22,23을 참조하십시오.
전기 신호의 개시 및 전파에 중요한 Ca V 및 NaV 채널은 중앙 기공과 4개의 동일하지 않은 전압 감지 도메인2을 가진 메인 α1 서브유닛으로 구성됩니다. 이들의 뚜렷한 1차 구조에 더하여, CaV 및NaV 채널은 보조 서브유닛(24)을 갖는 다중 서브유닛 복합체로서 표현된다. 전압 의존성 칼륨 채널(KV)은 NaV 또는CaV25의 단일 도메인처럼 보이는 4 개의 서브 유닛으로 구성됩니다. CaV 및NaV 채널의 기공 형성 및 전압 감지 α1 서브유닛은 6개의 고유한 막횡단 세그먼트의 4개의 개별 도메인을 암호화하는 단일 폴리펩티드에 의해 형성된다(S1-S6; 그림 1A) 24,26. S1 내지 S4 막횡단 세그먼트로 구성된 영역은 전압 감지 도메인(VSD)을 형성하고, S5 및 S6 막횡단 세그먼트는 공극 도메인(26)을 형성한다. 각 VSD에서 S4 α 나선에는 양전하를 띤 아르기닌 또는 라이신(그림 1A, B)이 포함되어 있으며, 이 아르기닌 또는 라이신은 멤브레인 탈분극에 반응하여 움직입니다7. 수십 년에 걸친 연구와 매우 다양한 실험적 접근 방식의 결과는 S4 세그먼트가 바깥쪽으로 이동하여 막 탈분극에 반응하여 게이팅 전류를 생성한다는 전제를 뒷받침합니다6.
FSDF는 막 탈분극 또는 다른 자극에 반응하여 채널이 기능함에 따라 부위 지정 돌연변이 유발을 통해 조작된 이온 채널 또는 기타 단백질의 특정 시스테인 잔기(즉, S4 α-나선)에 접합된 티올 반응성 염료의 형광 변화를 측정합니다10. 사실, FSDF는 원래 막전위 8,10의 변화에 반응하여 게이팅 전하가 이동할 때 채널의 주 전압 센서로 제안된 KV 채널의 S4 세그먼트가 이동하는지 여부를 조사하기 위해 개발되었습니다. 전압 개폐 이온 채널의 경우, FSDF는 채널 기능 측정과 동시에 4개의 VSD의 독립적인 구조적 재배열을 해결할 수 있습니다(주어진 시간에 하나의 VSD 추적). 실제로, 이러한 접근법을 사용하면, 개별적인 VSD가 채널 활성화 및 불활성화의 특정 양태에 차별적으로 관여하는 것으로 나타났다(12,27,28,29,30). 채널 기능에 대한 각 VSD의 기여도를 식별하는 것은 관련성이 높으며 채널 운영을 추가로 설명하고 잠재적으로 약물 개발을 위한 새로운 목표를 식별하는 데 사용할 수 있습니다.
이종 발현 시스템에서 FSDF의 사용은 환원주의적 관점에서 채널 기능에 대한 이해를 증진하는 데 매우 도움이 되었습니다10,23. 많은 환원주의적 접근 방식과 마찬가지로 장점이 있지만 한계도 있습니다. 예를 들어, 한 가지 주요 한계는 이종 시스템에서 채널 나노 환경의 부분적인 재구성입니다. 종종, 이온 채널은 수많은 부속 서브유닛 및 그 기능을 변형시키는 수많은 다른 단백질과 상호작용한다31. 원칙적으로, 상이한 채널 및 그들의 부속 서브유닛은 다수의 단백질 코딩 구축물 또는 폴리시스트로닉 플라스미드의 사용으로 이종 시스템에서 발현될 수 있지만, 이들의 본래 환경은 완전히 재구성될 수 없다30,32.
우리 그룹은 최근 근육 섬유의 전기 탈분극이 근육 수축의 활성화와 연결되는 과정인 여기-수축 커플링(ECC)33,34의 초기 단계를 연구하기 위해 천연 해리 골격근 섬유에서 FSDF의 변형을 발표했습니다35,36. 처음으로, 이 접근법은 성인 분화 근섬유의 본래 환경에서 전압-개폐 L형Ca2+ 채널(CaV1.1, DHPR로도 알려짐)로부터 개별적인 S4 전압-센서들의 모션 트래킹을 허용하였다37. 이는 빠른 자극 유도 자가 전파 탈분극을 허용하는 세포의 전기적 활성, 생체 내 전기천공을 통해 cDNA 플라스미드를 발현하는 능력, 세포 내 채널의 자연적인 높은 발현 및 구획 조직, 고속 이미징 및 전기생리학적 기록 장치와의 호환성을 포함하여 이 세포 유형의 여러 특성을 고려하여 달성되었습니다. 이전에는 고속 라인 주사 공초점 현미경을 검출 장치(37)로서 사용하였다. 이제 신호 수집을 위해 광 다이오드를 사용하여 기술의 변형이 제시됩니다. 이 포토다이오드 기반 검출 시스템은 다른 실험실에서 이 기술의 구현을 용이하게 할 수 있습니다.
여기에서는 CaV1.1에서 개별 전압 센서 이동을 연구하기 위해 천연 셀에서 FSDF를 활용하는 단계별 프로토콜이 설명되어 있습니다. CaV1.1 채널이 이 원고 전체에서 예로 사용되었지만 이 기술은 다른 이온 채널, 수용체 또는 표면 단백질의 세포 외 접근 가능한 도메인에 적용될 수 있습니다.
프로토콜
이 프로토콜은 메릴랜드 대학교 기관 동물 관리 및 사용 위원회의 승인을 받았습니다. 다음 프로토콜은 (1) 분자 구조 설계 및 시스테인 반응 염료 선택, (2) 생체 내 전기천공, (3) 근육 해부 및 섬유 분리, (4) 획득 설정 설명, (5) 강화된 녹색 형광 단백질(EGFP) 양성 섬유 전기 활성 및 시스테인 염색 평가, (6) 신호 획득 및 처리. 또한 각 섹션의 시작 부분에는 골격근 섬유에 FSDF를 적용할 때 몇 가지 관련 고려 사항이 자세히 설명되어 있습니다. 모든 프로토콜 섹션은 실험실 코트와 장갑을 포함한 적절한 개인 보호 장비를 사용하여 수행해야 합니다.
1. 분자 구조 설계 및 시스테인 반응 염료 선택
- 구조 설계는 실험 성공의 중요한 부분입니다. 먼저, 야생형, 형광 태깅된 CaV1.1 cDNA 구축물을 생성하고, 적절한 세포 유형에서의 그의 발현을 평가한다. 근섬유의 경우, 사이토메갈로바이러스 (CMV) 프로모터를 운반하는 플라스미드를 사용하여 강력한 형질감염 효율을 달성할 수 있다. 이 프로토콜에서, 이미 특성화된 토끼 EGFP-CaV1.1 플라스미드를 사용하였다(38).
참고: 시스테인 잔기를 전압 개폐 이온 채널에 도입하기 위해 cDNA 구조를 조작할 때 시스테인 위치는 매우 중요하므로 신중하게 고려해야 합니다. 시스테인은 티올 공액 염료 반응을 허용하기 위해 세포외 공간에서 접근할 수 있어야 하며(그림 1C, D) 탈분극에 대한 반응으로 시스테인의 움직임을 정확하게 추적하기 위해 S4 영역에 근접해야 합니다. 그러나, 단백질 운동에 반응하여 염료 형광 소광을 허용하기 위해, 도입된 시스테인 접합 형광단은 두 개의 상이한 환경(예를 들어, 막 및 세포외액; 그림 1E). 또한 삽입된 시스테인이 단백질 기능을 방해하지 않도록 하는 것이 중요합니다. - 적절한 시스테인 국소화에 대한 아이디어를 얻으려면 채널 구조 또는 다른 관련 채널 단백질의 다른 형광 측정 실험에서 정보를 수집하십시오. 시스테인 조작 Ca V 1.1 구조체의설계를 위해, 채널26의 분해된 초저온 전자 현미경(cryo-EM) 구조를 평가하고 CaV1.2 12와 같은 관련 채널 또는 Shaker11 및 NaChBac39와 같은 다른 채널에서 이전 작업의 시스테인 삽입을 비교합니다.
- 적절한 시스테인 위치가 선택되면 상업용 부위 지정 돌연변이 유발 키트를 사용하여 시스테인 치환을 도입합니다. 본 프로토콜에서, 다음의 시스테인 변형은 CaV1.1의 S4 전압-감지 세그먼트의 각각의 세포질 말단에서 독립적으로 조작되었다: VSD-I (L159C), VSD-II (L522C), VSD-III (V893C), VSD-IV (S1231C), 및 UniProtKB: P07293 (도 1B).
- 골격근 섬유의 경우, 5- 카르복시 테트라 메틸로 다민 메탄 티오 술포 네이트 (MTS-5-TAMRA)를 사용하는데, 이는 표면막의 침윤 및 CaV1.1 채널의 우세한 위치 인 횡 세뇨관 막 시스템으로의 적절하고 빠른 확산을 나타낸다. MTS-5-TAMRA는 지질막에서 수성 환경으로 전이할 때 형광 감소를 나타냅니다(그림 1E).
참고: Dylight 또는 Alexa-maleimide 유도체는 표면막을 염색하지만 횡세뇨관 시스템은 염색하지 않습니다.
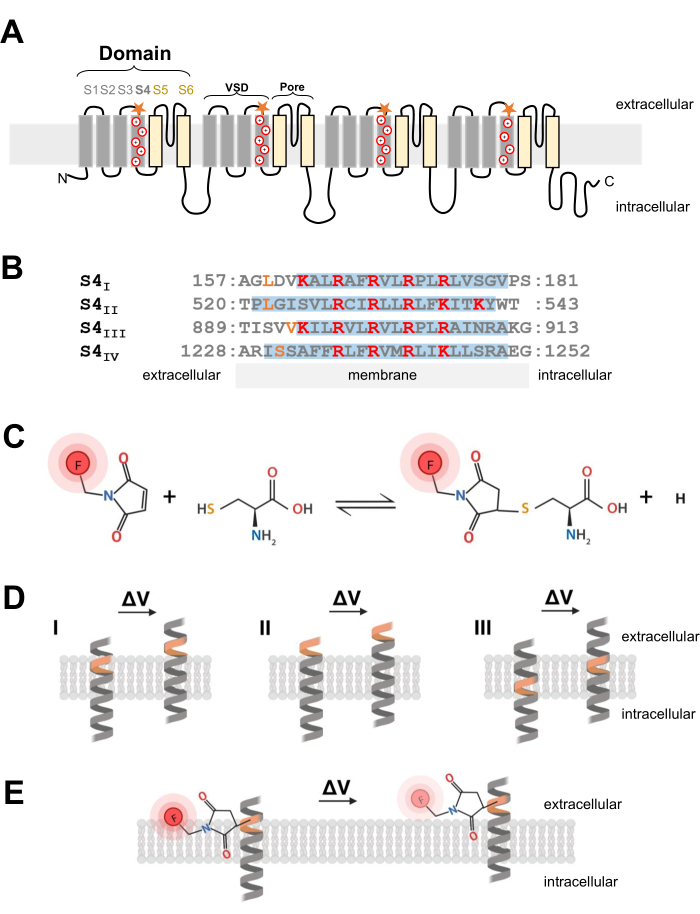
그림 1: 막횡단 α-나선의 계면에서의 티올-시스테인 반응의 개략도. (A) L형 CaV 1.1 멤브레인 토폴로지. 더하기 기호는 S4 α 나선 내의 염기성 잔기를 나타내고 주황색 별은 부위 지정 돌연변이 유발을 통해 시스테인이 도입된 위치를 나타냅니다. (B) 토끼 CaV1.1의 S4I에서 S4IV로의 서열 정렬 (UniProtKB: P07293). 전압 감지에 중요한 양전하를 띤 아르기닌 및 라이신 잔류물은 빨간색으로 강조 표시되고, 조작된 시스테인 치환은 주황색으로 표시됩니다. 이 패널은 참고 문헌37에서 채택되었습니다. (C) 시스테인-티올 형광 분자 반응. (D) 막횡단 전압에 민감한 α-나선 내에서 시스테인 돌연변이 유발 삽입을 보여주는 다이어그램. 시스테인은 정지 상태에서 막에 묻혀 있어야 하며 탈분극 후 세포 외에서 접근할 수 있어야 합니다(ΔV; 시스테인 추적은 일반적으로 표적 시스테인이 탈분극 전에 세포외 공간에서 이미 접근할 수 있는 경우(II) 또는 탈분극 후 세포외 공간에서 시스테인에 접근할 수 없는 경우(III) 발생하지 않을 것입니다. (e) 티올 형광 분자와의 반응 후, 탈분극에 반응하여 α-나선 운동은 MTS-5-TAMRA 형광 방출을 감소시킨다. 형광 신호는 S4 나선의 이동과 멤브레인의 평면 및 수성 환경에 대한 후속 염료 이동에 의해 생성됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 생체 내 전기천공
참고: 전기천공 실험은 이전에 설명한 대로 수행되었습니다38 수정과 함께. 다음 섹션에서 프로토콜은 마우스의 한 발 패드의 전기 천공을 위해 설계되었습니다. 두 발이 준비되면 볼륨을 조정해야합니다.
- 얼음 위에 놓인 1.5mL 튜브에 2-5μg/μL의 플라스미드 용액 25-100μL를 분취합니다.
- 멸균 식염수에 2mg/mL 히알루로니다제 0.5mL 용액을 준비하고 1mL 주사기에 장착된 저결합 단백질 0.2μm 멸균 필터를 통해 용액을 여과합니다. 실온에서 1.5mL 튜브에 보관하십시오.
- 보정된 마취 장치를 사용하여 마우스를 마취실에 넣어 O2 (1L/min)에서 3%-4.5% 이소플루란을 사용하여 마우스를 마취합니다. 핀셋을 사용하여 꼬리 끝을 꼬집어 동물의 적절한 마취를 확인하십시오. 최적의 마취에 도달했을 때 반응이 관찰되어서는 안됩니다.
- 마취실에서 마우스를 꺼내고 마우스 위에 마취 코 마스크를 놓습니다. 멸균 벤치 패드로 덮인 등온 가열 패드에 동물을 등 뒤로 눕히십시오. O2(1L/min)에 3% 이소플루란이 함유된 설치류 마스크를 사용하여 마취를 계속합니다.
- 시술 중 안구 건조를 방지하려면 멸균 면봉으로 동물의 눈에 인공 눈물 크림을 미세하게 바르십시오. 에틸 알코올에 포화 된 멸균 물티슈를 사용하여 동물의 발을 소독하십시오.
- 0.5인치 길이의 29G 멸균 인슐린 바늘을 사용하여 20μL의 히알루로니다제 용액을 흡인합니다. 발 뒤꿈치 높이의 피부를 관통하고 바늘을 발가락 기저부쪽으로 피하 주사합니다 (그림 2A). 바늘을 점진적으로 뒤로 움직이면서 용액을 천천히 주입하십시오. 발 아래에서 볼루스 또는 범프가 관찰되어야합니다 (그림 2B).
참고 : 동물의 나이와 발의 크기에 따라 전체 양의 용액이 주입되지 않을 수 있습니다. 종종 주입 지점을 통한 작은 누출이 발생할 수 있습니다. - 2.5단계에서와 같이 적절한 발 소독 후 다른 멸균 바늘을 사용하여 원하는 경우 다른 발로 2.6단계를 반복합니다.
- 코 마스크에서 동물을 제거하여 마취를 분리하고 마우스를 음식과 물에 자유롭게 접근 할 수있는 케이지로 되돌립니다. 마취에서 완전한 회복은 ~5분 안에 관찰되어야 합니다. 플라스미드 용액이 들어 있는 튜브를 벤치에 놓아 실온에 도달할 수 있도록 합니다.
- 1 시간 후, 동물을 두 번째로 마취시키고, 가열 패드에 올려 놓고, 2.3-2.5 단계에 설명 된대로 발을 소독하십시오.
- 2.6 단계에 기술된 것과 동일한 기술을 사용하여 10-20 μL의 cDNA 구축물을 주입한다. 주입 된 구조물의 총량은 발 당 50-100 μg입니다. 원하는 경우 다른 멸균 주사기를 사용하여 반대쪽 발로 절차를 반복하십시오.
- cDNA 용액이 조직을 통해 고르게 분산되도록 동물을 등온 가열 패드에 5분 동안 마취 상태로 유지합니다.
- electroporation 장치 장치를 켜고 제조업체에서 권장하는 대로 이중 전극 어레이에 연결합니다.
- 에틸 알코올에 포화된 와이프를 사용하여 이중 전극 어레이를 소독합니다. 한 손으로 발을 안정시키고 먼저 발 뒤꿈치 뒤쪽의 피부 아래에 하나의 전극을 삽입하십시오. 그런 다음 두 번째 전극을 발가락 바닥에 삽입하여 두 전극의 방향이 발 축에 수직이 되도록 합니다(그림 2C). 발이나 다리를 극단적인 각도 방향으로 구속하지 않는 위치에 프로브의 방향을 지정합니다.
알림: 전극 삽입은 핀셋을 사용하고 전극 끝을 정기적으로 날카롭게 하여 용이하게 할 수 있습니다. 동물의 나이에 따라 발의 크기가 다를 수 있으며 그에 따라 전극 간격을 조정해야합니다. - 1Hz에서 각각 20ms의 지속 시간/20ms의 펄스를 적용하여 근육을 전기포화합니다. 1cm 간격의 전극 바늘의 경우 전압을 ~100V로 설정합니다. 전극 간격이 ~100V/cm에 도달하도록 수정되는 경우 이를 조정해야 합니다. 전극이 적절하게 배치된 경우 펄스 전달 중에 손가락의 약간의 굴곡이 관찰되어야 합니다.
- 원하는 경우 반대쪽 발로 2.13 및 2.14 단계를 반복합니다.
- 마취를 분리하고 동물을 케이지에 넣고 2 시간 동안 음식과 물을 자유롭게 이용할 수 있는 전기천공되지 않은 카운터 메이트와 격리됩니다. 마취에서 완전한 회복은 ~10분 안에 관찰되어야 합니다. 동물을 케이지 안에 다시 넣으십시오.
참고: cDNA 구조체의 발현은 인코딩된 단백질에 크게 의존합니다. 단백질 회전율, cDNA, 플라스미드 프로모터 및 기타 변수의 양과 질은 작제물 발현에 영향을 미칠 수 있습니다. 이 실험에서, CMV 프로모터를 이용한 CaV1.1의 α1S 서브유닛의 최적 발현은 4 내지 6주가 필요하지만, 2주에서 최대 12-15개월까지 검출될 수 있다.
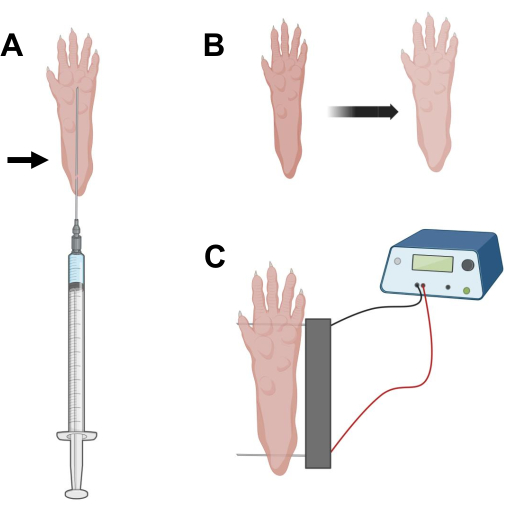
그림 2: 전기천공을 위한 마우스 발 패드의 cDNA 주입 및 전기천공 전기천공 전극 위치 다이어그램. (A) 마우스 발 패드 아래의 히알루로니다제 및 cDNA 주입을 위한 바늘 위치. 화살표는 피부를 통한 삽입 지점을 나타냅니다. (B) 주사 후 피부의 약간의 변색과 발 크기의 약간의 증가가 일시적으로 관찰되어야 합니다. (C) 전기 천공을 위한 전극 어레이 위치 지정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 근육 해부 및 섬유 분리
참고: 골격근 섬유 해리는 이전에 설명한 37,40,41과 같이 수정하여 수행되었습니다. 다음 섹션에서 프로토콜은 마우스의 두 발 패드에 적합합니다.
- 섬유 해리에 앞서, 60mm 플라스틱 페트리 접시에 엘라스토머 10부(% w/w)에 경화제 한 부분을 첨가하여 ~5mm의 두께에 도달하여 실가드 덮개 플레이트를 준비합니다. 사용하기 전에 엘라스토머로 덮인 플레이트가 밤새 경화되도록 하십시오. 사용 전후에 70% 에틸 알코올로 적절하게 보관하고 소독하면 여러 번 재사용할 수 있습니다.
- 4% 소 태아 혈청(FBS, 최종 농도 2mg/mL)이 보충된 스피너 최소 필수 독수리 배지(S-MEM) 2mL에 10mg의 콜라게나제 유형 I을 준비합니다. 용액을 코팅되지 않은 35 mm 플라스틱 플레이트로 옮기고 접시를 37°C, 5%CO2의 인큐베이터에 넣습니다.
참고: S-MEM은 글루타민과 Ca2+가 없는 변형된 MEM 제형입니다. 이 단계에서 Ca2+ 가 없으면 효소 소화 및 분쇄 동안 섬유 구축이 감소합니다. - 10% FBS가 보충된 S-MEM 5mL를 60mm 비코팅 플라스틱 플레이트에 넣고 37°C, 5%CO2의 인큐베이터에 보관합니다.
- CO2를 통한 질식에 이어 자궁경부 탈구에 의해 동물을 안락사시킨다. 1차 세포 분리 중 오염을 줄이려면 동물 사체를 70% 에틸 알코올에 ~10초 동안 담그십시오. 흡수지로 시체를 제거하고 말리고 발목과 무릎 사이의 가위로 발을 자릅니다 (그림 3A).
- 발이 위를 향하도록 동물의 한쪽 발을 고정하고 해부 현미경으로 10x 배율로 엘라스토머 덮개 판에 해부 핀을 씁니다.
- 해부 가위와 가는 핀셋을 사용하여 발에서 피부를 제거하여 FDB(flexor digitorum brevis) 근육을 노출시킵니다(그림 3B). 조직 건조를 방지하기 위해 1,000μL 피펫을 사용하여 근육에 S-MEM 10% FBS 한 방울을 추가합니다.
- 발뒤꿈치 높이에서 힘줄을 절개하고 발뒤꿈치에서 발끝까지 FDB 근육을 조심스럽게 해부합니다(그림 3B). 해부를 수행하는 동안 가능한 한 근육에 긴장을 피하십시오. 조직에 너무 많은 힘을 가하면 근섬유가 손상됩니다. 콜라겐 분해 효소 용액에 즉시 근육을 넣으십시오.
- 반대쪽 발로 3.5-3.7단계를 반복합니다. 해부된 근육을 콜라게나제 용액에 넣고 37°C, 5%CO2 배양기에서 2시간 45분 내지 3시간 15분 동안 배양한다. 콜라게나제 효소 활성과 동물의 나이에 따라 배양 시간을 조정하십시오.
- 근육 조직이 배양되는 동안 35mm 유리 바닥 접시 중앙에 혈청이나 항생제가 없는 차가운 MEM 300μL를 추가합니다. 1.20mg/mL의 저온 라미닌 2μL을 MEM에 직접 추가합니다. 원하는 요리 수에 대해 이 과정을 반복합니다. 디쉬를 37°C, 5%CO2 에서 적어도 1시간 동안 세포 배양 배양기에 넣어 라미닌 중합이 가능하도록 한다.
- 효소 분해가 완료되면 대구경(5mm) 내화 연마 유리 파스퇴르 피펫과 라텍스 전구를 사용하여 S-MEM 10% FBS가 포함된 60mm 세포 배양 접시에 근육을 옮깁니다.
- 더 작은 보어(2mm)의 내화 광택 유리 파스퇴르 피펫과 라텍스 전구를 사용하여 해부 현미경으로 근육을 부드럽게 분쇄합니다(그림 3C). 해리 된 근육 섬유는 조직에서 분리되기 시작하여 용액에서 방출되어야합니다.
알림: 일반적으로 너무 많은 연장된 파쇄는 섬유에 스트레스를 주거나 손상시킬 수 있으므로 더 적은 분쇄(15-30 피펫 통로)가 항상 선호됩니다. - 한 쌍의 미세 핀셋을 사용하여 신경, 힘줄 또는 혈관과 같은 근육이 아닌 조직을 제거합니다(그림 3D).
- 2mm 라미닌 코팅 유리 바닥 접시에 따뜻한 MEM 2% FBS 35mL를 추가합니다. 200μL 피펫과 멸균 플라스틱 피펫 팁을 사용하여 해리된 근섬유를 35mm 라미닌 코팅 유리 바닥 접시에 옮깁니다(그림 3E).
알림: 낮은 섬유 밀도를 달성하고 섬유가 서로 잘 분리되도록 하는 것은 섬유 겹침을 방지하는 데 중요합니다. - 35 mm 유리 바닥 접시를 37°C, 5%CO2의 인큐베이터에 넣는다. 섬유는 2-20 시간의 시간 프레임에서 사용할 수 있습니다.
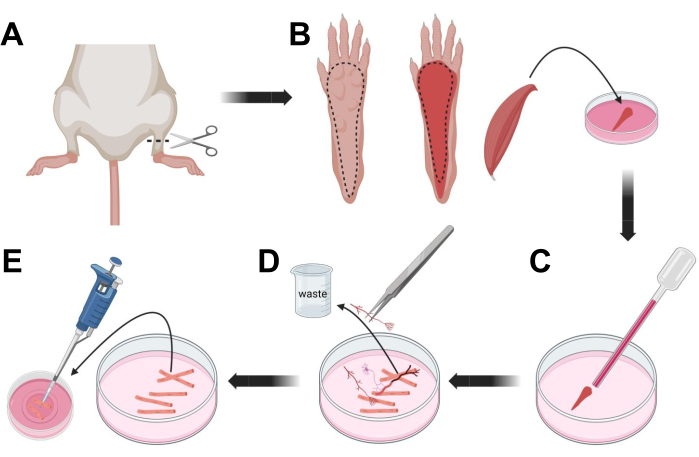
그림 3; 근육 FDB 섬유 해부 및 해리. (A) 발목 관절 위의 발 절개(점선) 후 발바닥 아래의 피부를 제거하고 점선을 따라 FDB 근육(B)을 노출시킵니다. 근육을 해부하고 콜라게나제 용액에 넣습니다. (C) 배양 후, 근육은 해리되고 개별 근육 섬유를 얻기 위해 분쇄됩니다. (D) 미세 핀셋을 사용하여 근육 섬유를 라미닌 코팅 유리 바닥 배양 접시로 옮기기 전에 비근육 조직과 파편을 제거합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 획득 설정 설명
참고: 획득 셋업은 수정 사항(도 42 )을 통해 이전에 설명한 것과 비슷하다(도 4A).
- 컴퓨터, AD/DA 컨버터 및 경로 클램프 증폭기, 현미경, 전동 스테이지, 매니퓰레이터, 포토다이오드용 전원 공급 장치, 광원, 라이트 셔터, 펄스 발생기 및 프로토콜 편집기와 같은 모든 구성 요소를 켭니다.
- AD/DA에서 OUT 신호를 트리거하는 TTL(트랜지스터-트랜지스터 로직)을 활성화하여 펄스 발생기, 라이트 셔터 및 프로토콜 편집기를 제어합니다.
- 펄스 발생기의 TTL 출력 신호를 사용하고 증폭기의 AD 채널에 연결하여 정확한 시간 트리거링을 확인합니다. 적절한 장치 동기화를 보장하기 위해 실험 전에 트리거링 일관성의 적절한 제어를 신중하게 평가해야 합니다.
참고: CaV1.1의 경우 자극 후 4-10ms 이내에 최대 신호를 볼 수 있을 것으로 예상됩니다(최대 충전 이동이 발생하는 시간5). 신호는 빠르고 정확하며 시간 분해능은 전압 클램프를 통해 측정된 칼슘 과도 또는 전하 이동과 같은 다른 측정과 비교하는 데 중요합니다. - 여기광을 광섬유의 특정 영역이나 지점에 집중시키려면(그림 4B) 여기광 경로에 위치한 다이어프램을 사용합니다. 이를 통해 EGFP-CaV1.1 신호가 최대인 영역에서만 신호를 수집할 수 있습니다(그림 4B).
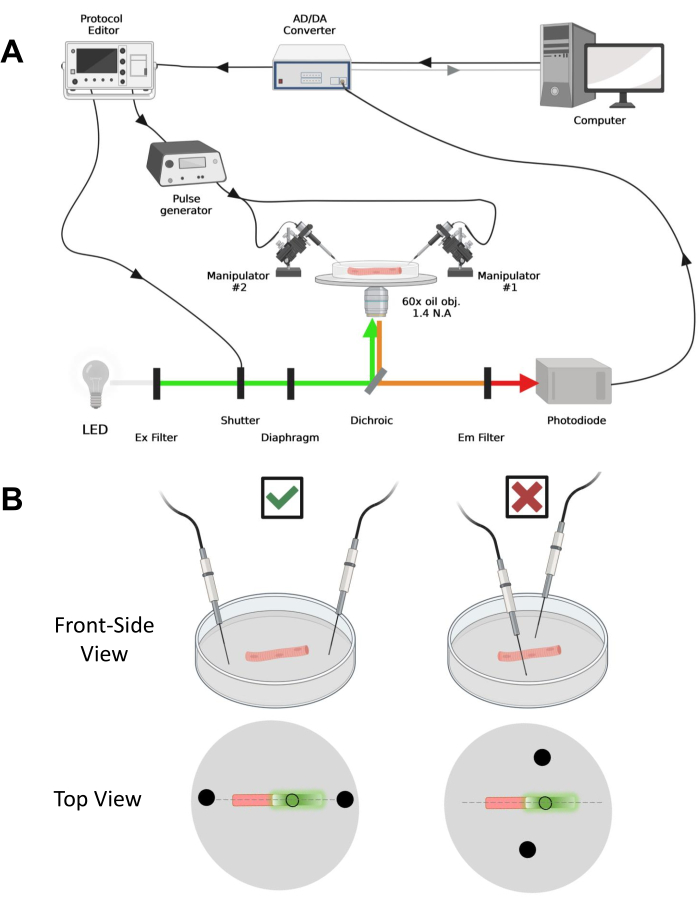
그림 4: 녹음 시스템에 대한 설명. (A) 녹음 시스템의 서로 다른 구성 요소 간의 연결을 보여주는 다이어그램. 이 셋업은 전동 스테이지가 있는 도립 현미경, 발광 다이오드(LED) 광원, 라이트 셔터, 트랙 앤 홀드 기능(43)이 있는 맞춤형 포토다이오드 기반 광 모니터링 회로, AD/DA 컨버터(패치 클램프 증폭기), 아날로그 펄스 발생기, 전계 자극 전극에 연결된 외부 전계 자극 장치, 전동 매니퓰레이터 및 프로토콜의 수집, 동기화 및 생성을 위한 상용 소프트웨어. 전계 자극을 위한 전극은 BMC 커넥터를 통해 펄스 발생기에 연결된 구리 케이블에 용접된 두 개의 백금 와이어로 만들어집니다. 특정 여기 및 방출 필터는 EGFP 및 MTS-5-TAMRA 신호를 모두 감지하는 데 사용됩니다. EGFP를 여기시키기 위해 488nm(± 20nm) 여기(Ex) 필터와 LP510nm Em 필터가 있는 크세논 램프가 사용됩니다. MTS-5-TAMRA의 경우 530nm LED 광원과 LP550nm Em 필터가 사용됩니다. (B) 섬유의 주축(점선)에서 적절하게(왼쪽) 배향되고(오른쪽) 부적절하게(오른쪽) 배향된 2필드 자극 전극(검은색 원)을 갖는 EGFP-CaV1.1-cys 구조를 발현하는 광섬유의 도면. 채워지지 않은 검은색 원은 광원 앞에 배치된 다이어프램 개구부에 의해 제어되는 직경이 있는 획득 영역을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. EGFP 양성 섬유 전기적 활성 및 시스테인 염색 평가
참고: 골격근 섬유장 자극은41 이전에 설명한 바와 같이 수정하여 수행됩니다. 이 접근법은 (1) 건강하고 기능적이며 전기적으로 반응하는 섬유를 식별하고, (2) 시스테인 반응성 형광 염료로 섬유를 염색하고, (3) 전파된 활동 전위에 대한 반응으로 형광 신호를 기록하는 데 사용됩니다. 이 섹션의 모든 단계와 다음 단계는 형광 염료 표백을 줄이기 위해 저조도 환경에서 수행해야 합니다.
- 해리된 근육 섬유가 들어 있는 35mm 유리 바닥 접시를 s에 놓습니다.tage 현미경. 1,000 μL 피펫으로 배양 배지를 조심스럽게 제거하고 2 mL의 실온 링거 용액으로 교체합니다 (조성은 표 1 참조). 유리 시스테인을 함유한 원래의 세포 배양 배지를 완전히 제거하기 위해 여러 차례의 배지 교체가 필요할 수 있습니다.
- 기계식 또는 전동식 매니퓰레이터를 사용하여 두 개의 백금 와이어를 접시 바닥에 수직으로 놓습니다. 전극 단자가 섬유의 세로축을 기준으로 정렬되고 섬유 끝에서 몇 밀리미터 떨어져 있고 전극 사이의 간격이 5mm인지 확인합니다(그림 4B). 접시를 회전시키거나 각 전극을 독립적인 마이크로 매니퓰레이터에 장착하여 전극 위치를 추가로 조정합니다(그림 4B).
- 투과광을 켜고 20x 대물렌즈를 사용하여 시야에서 광섬유를 찾습니다. EGFP 필터 큐브를 조명 경로로 이동합니다.
참고: 에피형광 및 저배율(2x) 대물렌즈가 장착된 현미경을 사용하여 EGFP 발현을 평가하여 섬유 해리 전에 전체 근육에서 구성 형질감염 효율을 평가할 수 있습니다(그림 5A). - 원격 제어 라이트 셔터를 사용하여 488nm 여기광을 활성화하여 EGFP 양성 섬유를 식별합니다. 전동 현미경을 사용하여 접시에 섬유 xy 위치를 보관하십시오.tage. EGFP 신호는 종종 광섬유 내에서 이질적입니다(그림 4B). 저장된 위치를 가장 밝은 EGFP 신호의 중앙에 배치합니다.
- EGFP 양성 섬유를 식별한 후 첫 번째 저장된 현지화로 돌아갑니다. 수동 트리거 스위치를 사용하여 1ms 지속 시간 및 20V 진폭으로 2개의 순차 자극 펄스를 전달합니다. 펄스의 극성을 alternating으로 설정합니다.
- 자극 후, 반대 극성의 두 펄스에 반응하여 두 개의 동심원 균질 섬유 수축을 관찰하십시오. 국소 수축 또는 대체 극성의 펄스에 대한 반응의 수축 부재는 국부적으로 전파되지 않은 수동 반응 또는 비흥분성을 나타낸다41. 실험의 나머지 부분에서 이러한 섬유를 제외합니다.
- 2μL의 10mM MTS-5-TAMRA 용액을 접시에 직접 넣고 1,000μL 피펫(10μM 최종 농도)으로 부드럽게 혼합합니다. 접시를 움직이지 않도록 주의하세요, 그렇지 않으면 보관된 섬유 위치가 손실됩니다. 형광 티올 분자가 횡세뇨관 시스템 내강 내로 확산될 수 있도록 4-5분 동안 배양합니다.
- 양극성 반복 자극을 적용하여 5분 동안 1초마다 300ms 동안 50Hz의 속도로 연속적인 활동 전위 트레인을 유발합니다.
알림: 펄스 트레인은 MTS-5-TAMRA와 반응하기 위해 EGFP-CaV1.1의 S4에 삽입된 시스테인에 대한 접근성을 제공합니다. 자극에 반응하여 기계적으로 수축하는 섬유의 능력은 횡세뇨관 내강 함량이 세포외 환경과 함께 순환하는 데 중요합니다. - 1,000 μL 피펫으로 접시에서 염색 용액을 제거하고 2 mL의 실온 링거 용액으로 교체합니다. 비접합 MTS-5-TAMRA를 완전히 제거하려면 2회 또는 3회가 필요할 수 있습니다. 염색된 섬유가 염색 프로토콜에서 최소 10분 동안 회복되도록 합니다.
- 5.6단계에서와 같이 극성이 바뀐 것에 대한 반응으로 대칭 섬유 수축을 관찰하여 섬유 상태와 전기적 활동을 재평가합니다. 두 자극에 모두 반응하지 않는 섬유는 실험의 나머지 부분에서 제외합니다.
- MTS-5-TAMRA 필터 큐브를 조명 경로로 이동합니다. 원격 제어 라이트 셔터를 사용하여 533nm 여기광을 활성화하여 섬유에서 균일한 MTS-5-TAMRA 염색을 확인합니다.
참고: MTS-5-TAMRA로 염색할 때 조작된 시스테인과 내인성 시스테인 모두 말레이미드 유도체와 반응합니다(그림 5B). 따라서, 관심있는 시스테인과의 적절한 반응을 평가하는 것은 어렵다. CaV1.1은 주로 횡세뇨관에서 발현되어 구별 가능한 이중 밴드 패턴을 형성합니다. 컨포칼 또는 에피형광 현미경을 사용하여 xy 이미지를 사용하여 MTS-5-TAMRA의 적절한 염색 및 횡세뇨관 진입 및 확산을 확인할 수 있습니다(그림 5C).
6. 신호 수집 및 처리
알림: 형광 측정을 수행하기 전에 최적의 신호/잡음 비율을 얻기 위해 신호 수집을 신중하게 설계해야 합니다. 샘플링 속도가 느릴수록 더 많은 빛을 감지할 수 있으며 단백질 구조적 재배열 중에 획득할 수 있는 포인트 수가 줄어듭니다. EGFP-CaV1.1-cys의 경우, 활동 전위 파형에 의해 유도된 전하 이동은 ~1-10ms(37)에서 발생한다. 시간 경과에 따른 모션의 진화를 추적하기 위해 여러 포인트를 얻기 위해 획득을 포인트당 50μs로 설정했습니다.
- 적절한 배율 시스템을 사용하여 시야 중앙에 광섬유를 배치합니다. 이 실험을 위해 60x 오일 1.4 개구수(NA) 반전 대물렌즈를 사용했습니다. 전동식 스테이지와 다이어프램으로 조명과 광섬유 위치를 최적화하여 EGFP 신호가 최대인 광섬유 직경의 원형 영역을 비춥니다(그림 4B).
- 광섬유가 획득을 위해 배치되면 광섬유의 양쪽 끝에 독립적으로 장착된 두 개의 필드 자극 백금 와이어의 방향을 지정합니다. 광섬유의 주축에 있는 전선을 직선으로 정렬하고 중앙에 있는 광섬유와 5mm 간격을 둡니다(그림 4B).
- 획득 여기 및 방출 필터를 MTS-5-TAMRA에 대한 적절한 설정으로 설정합니다. 수집 소프트웨어에 작성된 프로토콜을 실행하여 실험을 시작합니다. 이 단계는 모든 다운스트림 장치(예: 프로토콜 편집기, 라이트 셔터, 펄스 발생기)를 트리거합니다.
참고: 이 프로토콜은 휴지기 형광의 후속 측정을 허용하기 위해 필드 자극을 전달하기 전에 짧은 기간(즉, 10ms)의 기준선 획득을 허용합니다. - 0.5 또는 1 ms, 20 V 스퀘어 펄스로 단일 또는 일련의 활동 전위를 시작합니다. 신호 표백을 방지하기 위해 총 획득 시간을 최대한 최소화합니다.
참고: 섬유 중앙에서 기록하더라도 이동 관련 형광 신호가 발생할 수 있으며 단백질 형광단 구조적 변화로 인해 형광 신호와 혼동될 수 있습니다(그림 5D). 수축-유도 신호는 자극 후의 전하 이동의 예상 시간에 비해 지연되어야 한다(37). - S4 운동에서 발생하는 신호와 섬유 수축으로 인한 신호를 추가로 구별하려면 100mM N-벤질-p-톨루엔 설폰아미드(BTS, 50μM 최종 농도) 1μL를 기록 용액에 추가하여 수축 반응을 최소화하고 6.4단계를 반복합니다. 섬유 약리학적 고정 후 두 번째로 감지된 신호는 태그가 지정된 S4 나선의 분자 운동에 해당합니다(그림 5D).
알림: BTS로 움직임을 억제한 후 엔지니어링된 시스테인이 없는 제어 EGFP-CaV1.1에서 신호가 감지되지 않아야 합니다. - 동일한 설정을 사용하여 배경 형광 값을 얻기 위해 근육 섬유나 파편이 존재하지 않는 접시 내 위치에서 유사한 신호를 획득합니다.
- 광섬유에서 원시 형광 [Fr(t)]의 시간 경과와 배경 형광 [Fb(t)]이 포함된 파일을 데이터 분석 소프트웨어로 가져옵니다. Fb(t)를 포함하는 열의 평균을 구하여 동종 Fb 값을 구합니다. Fr(t)에서 Fb를 빼서 절대 형광[F(t)] 값을 구합니다. 필요한 경우 스무딩 기능으로 결과 신호를 평활화합니다.
참고: 이 감지 시스템과 획득 빈도를 사용하여 평활화를 위해 50포인트의 창이 있는 인접 평균화 기능을 사용하기로 결정했습니다. - 자극 전 10ms의 시간 간격에서 기준선 F(t) 값을 평균하여 휴지기 형광 값(F0)을 얻습니다. 평활화된 F(t)에서 F0를 빼서 형광의 절대 변화[ΔF(t)]를 구합니다. 그런 다음 휴지기 형광(ΔF/F0)에 대한 시간 경과에 따른 형광 변화를 표현하기 위해 ΔF(t)를 F0으로 나눕니다.
- 신호 표백의 정도를 평가하려면 시간 경과에 따른 ΔF/F0에서 자극 전후와 형광 측정 신호에서 멀어지는 두 지점을 정의합니다. 이 두 점에 선형 함수를 피팅하여 기준선 추적을 얻습니다. 신호 표백을 수정하기 위해 시간 경과에 따른 기준선을 ΔF/F0으로 뺍니다.
- 획득 개시와 자극으로부터의 피드백 신호 사이의 지연을 시간 열에서 빼면 전기 자극의 시작에 해당하는 t = 0이 됩니다.
참고: 다중 신호 비교를 허용하려면 신호의 진폭을 정규화해야 하는 경우가 많습니다. 실험의 목적에 따라 다른 접근법을 사용할 수 있습니다. 다음 결과 섹션에서는 신호 동역학에 관심이 있었기 때문에 각 신호를 최소 도달 값(즉, 음의 피크)으로 정규화하는 간단한 방법을 사용했습니다.
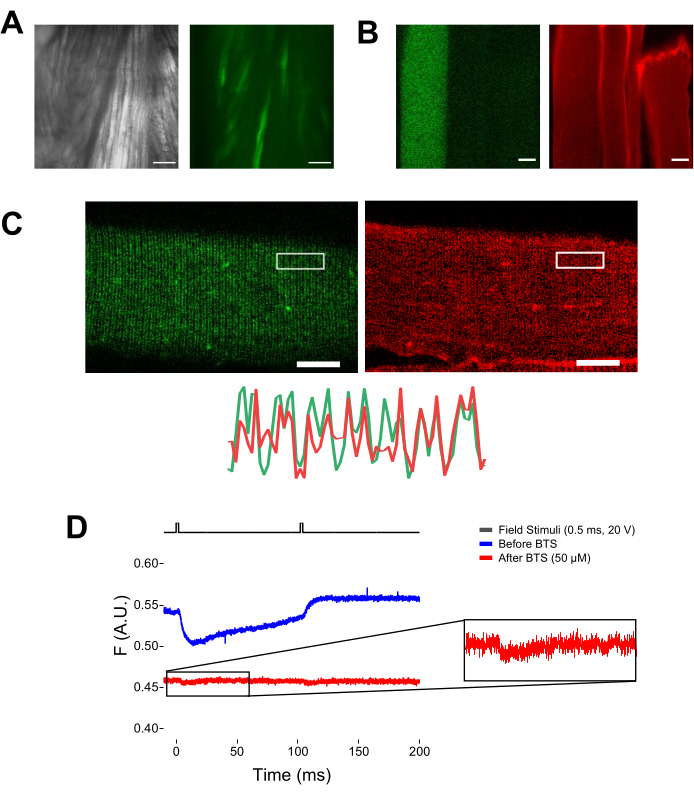
그림 5: MTS-5-TAMRA 염색 없이 EGFP-CaV1.1-cys를 발현하는 근섬유를 이미징하고 대표적인 원시 형광 기록. (A) EGFP-CaV1.1 VSD-III 구축물을 발현하는 해부된, 해리되지 않은 근육의 투과된(좌측) 및 형광(우측) 이미지의 예. 스케일 바: 100μm. (B) MTS-5-TAMRA 염색 전(왼쪽) 및 후(오른쪽) EGFP-CaV1.1 VSD-III 구축물을 발현하는 근섬유의 대표 이미지. 형질감염되지 않은 섬유의 내인성 시스테인은 또한 염료에 의해 염색된다. 스케일 바: 30μm. (C) EGFP-CAV1.1 VSD-III 구조체의 컨포칼 이미지(왼쪽) 및 MTS-5-TAMRA 염색(오른쪽)은 근섬유의 횡세뇨관 시스템에서 CaV1.1 국소화의 고전적인 이중 밴드 패턴 특성을 보여줍니다(아래). 스케일 바: 25μm. (D) 두 가지 자극에 대한 반응으로 대표적인 형광 측정 기록을 하고 N-벤질-p-톨루엔 설폰아미드(BTS)를 사용한 섬유 고정 전(파란색 트레이스) 및 후(빨간색 트레이스) 포토다이오드로 측정했습니다. 상단 검은색 선은 외부 필드 자극을 통한 광섬유 탈분극 프로토콜을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
반복적인 자기장 자극에 대한 응답으로 전파 활동 전위가 트리거되면 특정 주파수의 탈분극에 대한 응답으로 특정 전압 센서 동작을 추적할 수 있습니다. 도 6A에 도시된 바와 같이, VSD-II-태깅된 나선의 움직임은 10Hz(즉, 100ms만큼 이격된)에서 인가된 2개의 연속적인 탈분극 각각에 응답하여 추적될 수 있다. 신호 표백은 트레이스에서 기준선을 빼서 수정할 수 있습니다(
토론
여기서, CaV1.1 채널에서 개별 전압 센서 운동의 연구를 위해 근섬유에서 FSDF를 수행하는 단계별 프로토콜이 설명됩니다. 이 기술에 결합된 단계의 수와 접근 방식의 다양성이 복잡해 보일 수 있지만 이러한 기술의 대부분은 종종 생물 물리학자/세포 생물학자 실험실에서 일상적으로 사용됩니다. 따라서 겉보기 복잡성은 주로 단일 통합 기술에서 모든 다양한 접근 방식의 조합에 있습니다. ...
공개
저자는 이해 상충이 없다고 보고합니다.
감사의 말
EGFP-CaV1.1(토끼) 야생형 플라스미드를 공유해 주신 J. Vergara 박사(University of California, Los Angeles)에게 감사드립니다. 트랙 앤 홀드 회로가 있는 포토다이오드의 설계 및 제작에 대해 Yale Department of Physiology Electronics Laboratory, 특히 Henrik Abildgaard에게 감사드립니다. 이 작업은 국립 보건원 (National Institutes of Health)의 보조금 R01-AR075726 및 R01-NS103777의 지원을 받았다
자료
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
참고문헌
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915 (2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. . Excitation-Contraction Coupling in Skeletal Muscle. , (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. . Muscle: Fundamental Biology and Mechanisms of Disease. , 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22 (2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118 (2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520 (2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6 (2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유