Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Fluorometría funcional dirigida al sitio en células nativas para estudiar la excitabilidad del músculo esquelético
En este artículo
Resumen
La fluorometría funcional dirigida al sitio es un método para estudiar los movimientos del dominio de la proteína en tiempo real. La modificación de esta técnica para su aplicación en células nativas ahora permite la detección y el seguimiento de movimientos de un solo sensor de voltaje de canales Ca2+ dependientes de voltaje en fibras musculares esqueléticas aisladas murinas.
Resumen
La fluorometría funcional dirigida al sitio ha sido la técnica elegida para investigar la relación estructura-función de numerosas proteínas de membrana, incluidos los canales iónicos dependientes de voltaje. Este enfoque se ha utilizado principalmente en sistemas de expresión heterólogos para medir simultáneamente las corrientes de membrana, la manifestación eléctrica de la actividad de los canales y las mediciones de fluorescencia, informando reordenamientos de dominio local. La fluorometría funcional dirigida al sitio combina electrofisiología, biología molecular, química y fluorescencia en una sola técnica de amplio alcance que permite el estudio de reordenamientos estructurales en tiempo real y la función a través de la fluorescencia y la electrofisiología, respectivamente. Por lo general, este enfoque requiere un canal de membrana dependiente de voltaje diseñado que contenga una cisteína que pueda ser probada por un tinte fluorescente reactivo al tiol. Hasta hace poco, la química tiol-reactiva utilizada para el marcado fluorescente dirigido al sitio de proteínas se llevaba a cabo exclusivamente en ovocitos y líneas celulares de Xenopus , restringiendo el alcance del enfoque a las células primarias no excitables. Este informe describe la aplicabilidad de la fluorometría funcional dirigida al sitio en células musculares esqueléticas adultas para estudiar los primeros pasos del acoplamiento excitación-contracción, el proceso por el cual la despolarización eléctrica de la fibra muscular está relacionada con la activación de la contracción muscular. El presente protocolo describe las metodologías para diseñar y transfectar canales de Ca2+ dependientes de voltaje diseñados con cisteína (CaV1.1) en fibras musculares del flexor digitorum brevis de ratones adultos utilizando electroporación in vivo y los pasos posteriores requeridos para mediciones funcionales de fluorometría dirigida al sitio. Este enfoque se puede adaptar para estudiar otros canales iónicos y proteínas. El uso de la fluorometría funcional dirigida al sitio del músculo de mamífero es particularmente relevante para estudiar los mecanismos básicos de excitabilidad.
Introducción
La capacidad de rastrear reordenamientos conformacionales del canal iónico en respuesta a un estímulo eléctrico conocido en una célula viva es una fuente de información valiosa para la fisiología molecular1. Los canales iónicos dependientes de voltaje son proteínas de membrana que detectan cambios en el voltaje transmembrana, y su función también se ve afectada por los cambios de voltaje2. El desarrollo de técnicas de pinza de voltaje en el siglo pasado permitió a los fisiólogos estudiar, en tiempo real, las corrientes iónicas transportadas por canales iónicos dependientes de voltaje en respuesta a la despolarización de la membrana3. El uso de la tecnología de pinza de voltaje ha sido crucial para comprender las propiedades eléctricas de las células excitables, como las neuronas y los músculos. En la década de 1970, el refinamiento de la abrazadera de voltaje permitió la detección de corrientes de entrada (o movimiento de carga) en los canales de calcio (Ca V) y sodio (NaV) dependientes de voltaje 4,5. Las corrientes de activación son corrientes capacitivas no lineales que surgen del movimiento de los sensores de voltaje en respuesta a cambios en el campo eléctrico a través de la membrana celular6. Las corrientes de activación se consideran una manifestación eléctrica de los reordenamientos moleculares que preceden o acompañan a la apertura del canal iónico7. Si bien estas mediciones de corriente proporcionan información valiosa sobre la función del canal, tanto las corrientes iónicas como las corrientes de compuerta son lecturas indirectas de reordenamientos conformacionales intermoleculares e intramoleculares de canales dependientes de voltaje7.
La fluorometría funcional dirigida al sitio (FSDF; también conocida como fluorometría de pinza de voltaje, VCF) se desarrolló a principios de la década de 19908 y, por primera vez, proporcionó la capacidad de ver directamente los cambios conformacionales locales y la función de una proteína de canal en tiempo real. Utilizando una combinación de mutagénesis de canales, electrofisiología y sistemas de expresión heterólogos, es posible etiquetar y rastrear fluorescentemente las partes móviles de canales o receptores específicos en respuesta al estímulo activador 9,10. Este enfoque se ha utilizado ampliamente para estudiar los mecanismos de detección de voltaje en canales iónicos dependientes de voltaje 8,10,11,12,13,14,15,16,17,18,19. Para revisiones autorizadas, véase 10,20,21,22,23.
Los canales Ca V y NaV, críticos para la iniciación y propagación de señales eléctricas, están compuestos por una subunidad principal α1, que posee un poro central y cuatro dominios de detección de voltaje no idénticos2. Además de su estructura primaria distinta, los canales Ca V y NaV se expresan como complejos multisubunidades con subunidades auxiliares24. Los canales de potasio dependientes del voltaje (K V) consisten en cuatro subunidades que se parecen a un solo dominio de Na V o CaV25. La subunidad α1 formadora de poros y sensible a voltaje de los canales Ca V y NaV está formada por un único polipéptido que codifica cuatro dominios individuales de seis segmentos transmembrana únicos (S1-S6; Figura 1A) 24,26. La región compuesta por segmentos transmembrana S1 a S4 forma el dominio de detección de voltaje (VSD) y los segmentos transmembrana S5 y S6 forman el dominio poro26. En cada CIV, la hélice α S4 contiene arginina o lisina cargadas positivamente (Figura 1A,B) que se mueven en respuesta a la despolarización de la membrana7. Varias décadas de investigación y los resultados de enfoques experimentales muy diversos apoyan la premisa de que los segmentos S4 se mueven hacia afuera, generando corrientes de compuerta, en respuesta a la despolarización de la membrana6.
FSDF mide los cambios de fluorescencia de un colorante tiol-reactivo conjugado a un residuo específico de cisteína (es decir, la α-hélice S4) en un canal iónico u otra proteína, diseñada a través de mutagénesis dirigida al sitio, ya que el canal funciona en respuesta a la despolarización de la membrana u otros estímulos10. De hecho, FSDF se desarrolló originalmente para investigar si el segmento S4 en los canales KV, propuesto para ser el sensor de voltaje principal del canal, se mueve cuando las cargas de compuerta se mueven en respuesta a cambios en el potencial de membrana 8,10. En el caso de canales iónicos dependientes de voltaje, FSDF puede resolver reordenamientos conformacionales independientes de los cuatro VSD (rastreando un VSD en un momento dado), simultáneamente con mediciones de función de canal. De hecho, utilizando este enfoque, se ha demostrado que los VSD individuales parecen estar involucrados diferencialmente en aspectos específicos de la activación e inactivación de canales 12,27,28,29,30. La identificación de la contribución de cada VSD a la función de los canales es de gran relevancia y se puede utilizar para dilucidar aún más el funcionamiento del canal y potencialmente identificar nuevos objetivos para el desarrollo de fármacos.
El uso de FSDF en sistemas de expresión heterólogos ha sido extremadamente útil para ampliar nuestra comprensión de la función del canal desde una perspectiva reduccionista10,23. Como muchos enfoques reduccionistas, presenta ventajas pero también tiene limitaciones. Por ejemplo, una limitación importante es la reconstitución parcial del nanoambiente del canal en el sistema heterólogo. A menudo, los canales iónicos interactúan con numerosas subunidades accesorias y muchas otras proteínas que modifican su función31. En principio, diferentes canales y sus subunidades accesorias pueden expresarse en sistemas heterólogos con el uso de múltiples constructos codificantes de proteínas o plásmidos policistrónicos, pero su ambiente nativo no puede ser completamente reconstituido30,32.
Nuestro grupo publicó recientemente una variante de FSDF en fibras musculares esqueléticas disociadas nativas para el estudio de los primeros pasos del acoplamiento excitación-contracción (ECC)33,34, el proceso por el cual la despolarización eléctrica de la fibra muscular está vinculada a la activación de la contracción muscular 35,36. Por primera vez, este enfoque permitió el seguimiento del movimiento de sensores de voltaje S4 individuales del canal Ca2+ tipo L activado por voltaje (CaV1.1, también conocido como DHPR) en el ambiente nativo de una fibra muscular diferenciada adulta37. Esto se logró considerando múltiples características de este tipo de célula, incluida la actividad eléctrica de la célula que permite la despolarización autopropagada inducida por estimulación rápida, la capacidad de expresar plásmido de ADNc a través de electroporación in vivo, la alta expresión natural y la organización compartimental de los canales dentro de la célula, y su compatibilidad con dispositivos de imagen de alta velocidad y grabación electrofisiológica. Anteriormente, utilizamos un microscopio confocal de barrido lineal de alta velocidad como dispositivo de detección37. Ahora, se presenta una variación de la técnica utilizando un fotodiodo para la adquisición de señales. Este sistema de detección basado en fotodiodos podría facilitar la implementación de esta técnica en otros laboratorios.
Aquí, se describe un protocolo paso a paso para utilizar FSDF en celdas nativas para el estudio del movimiento individual del sensor de voltaje de CaV1.1. Si bien el canal CaV1.1 se ha utilizado como ejemplo a lo largo de este manuscrito, esta técnica podría aplicarse a dominios extracelularmente accesibles de otros canales iónicos, receptores o proteínas de superficie.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este protocolo fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Maryland. El siguiente protocolo se ha dividido en múltiples subsecciones, que consisten en (1) diseño de constructo molecular y selección de colorante de reacción a cisteína, (2) electroporación in vivo , (3) disección muscular y aislamiento de fibras, (4) descripción de la configuración de adquisición, (5) evaluación de la actividad eléctrica de fibra positiva de proteína fluorescente verde mejorada (EGFP) y tinción de cisteína, y (6) adquisición y procesamiento de señales. Además, al comienzo de cada sección, se detallan algunas consideraciones relevantes al aplicar FSDF en una fibra muscular esquelética. Todas las secciones del protocolo deben llevarse a cabo con el equipo de protección personal adecuado, incluida una bata de laboratorio y guantes.
1. Diseño de constructo molecular y selección de colorante de reacción de cisteína
- El diseño de la construcción es una parte crítica del éxito del experimento. Primero, genere una construcción de ADNc de CaV1.1 marcada con fluorescencia y evalúe su expresión en el tipo de célula apropiado. Para las fibras musculares, se puede lograr una fuerte eficiencia de transfección mediante el uso de un plásmido que lleva un promotor de citomegalovirus (CMV). En este protocolo, se utilizó un plásmido EGFP-CaV1.1 de conejo ya caracterizado38.
NOTA: Al diseñar la construcción de ADNc para introducir un residuo de cisteína en un canal iónico dependiente de voltaje, la posición de la cisteína es crítica y debe considerarse cuidadosamente. La cisteína debe ser accesible desde el espacio extracelular para permitir una reacción de colorante conjugado con tiol (Figura 1C, D) y debe ser proximal a la región S4 para rastrear con precisión su movimiento en respuesta a la despolarización. Sin embargo, para permitir la extinción de la fluorescencia del colorante en respuesta al movimiento de la proteína, el fluoróforo conjugado con cisteína introducido debe estar en la interfaz de dos entornos diferentes (por ejemplo, membrana y líquido extracelular; Figura 1E). Además, es fundamental asegurarse de que la cisteína insertada no interfiera con la función de la proteína. - Para obtener una idea sobre la localización adecuada de cisteína, reúna información sobre la estructura del canal o de otros experimentos de fluorometría de otras proteínas de canal relacionadas. Para el diseño de construcciones de Ca V 1.1 diseñadas con cisteína, evalúe la estructura resuelta de la criomicroscopía electrónica (crio-EM) del canal26 y compare la inserción de cisteína de trabajos previos de canales relacionados como CaV1.212, u otros canales como Shaker11 y NaChBac39.
- Una vez que se elige la posición correcta de cisteína, use un kit de mutagénesis comercial dirigido al sitio para introducir sustituciones de cisteína. En el protocolo actual, las siguientes modificaciones de cisteínas se diseñaron independientemente en cada extremo citosólico del segmento de detección de voltaje S4 de CaV1.1: VSD-I (L159C), VSD-II (L522C), VSD-III (V893C), VSD-IV (S1231C) y UniProtKB: P07293 (Figura 1B).
- Para las fibras musculares esqueléticas, use metanetosulfonato de 5-carboxitetrametilrodamina (MTS-5-TAMRA), que exhibe una difusión adecuada y rápida en el sistema de membrana del túbulo transversal, que es una invaginación de la membrana superficial y la ubicación predominante de los canales CaV1.1. MTS-5-TAMRA muestra una disminución de la fluorescencia al pasar de la membrana lipídica a un ambiente acuoso (Figura 1E).
NOTA: Los derivados de Dylight o Alexa-maleimida tiñen la membrana superficial pero no el sistema tubular transversal.
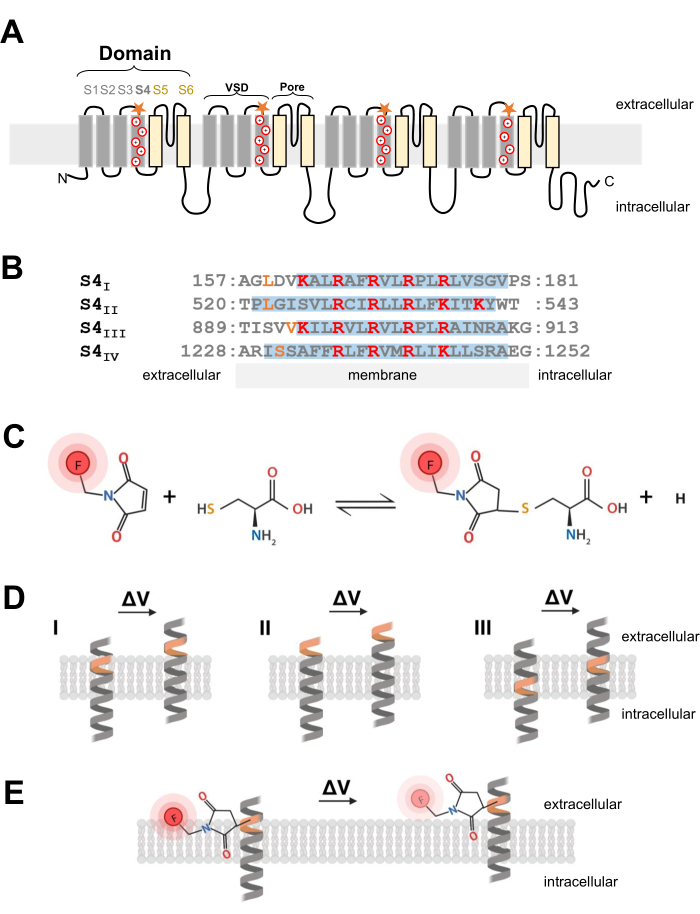
Figura 1: Esquema de la reacción tiol-cisteína en la interfaz de una α-hélice transmembrana. (A) Topología de membrana tipo L CaV 1.1. Los signos más representan residuos básicos dentro de la α-hélice S4 y las estrellas naranjas indican la ubicación donde se introdujo la cisteína a través de la mutagénesis dirigida al sitio. (B) Alineación de secuencia de S4I a S4IV de conejo CaV1.1 (UniProtKB: P07293). Los residuos de arginina y lisina cargados positivamente críticos para la detección de voltaje se resaltan en rojo, mientras que las sustituciones de cisteína diseñadas se indican en naranja. Este panel ha sido adaptado de la referencia37. (C) Reacción de la molécula fluorescente cisteína-tiol. (D) Diagrama que ilustra la inserción de mutagénesis de cisteína dentro de una α-hélice transmembrana sensible al voltaje. La cisteína debe enterrarse en la membrana en reposo y ser accesible extracelularmente después de la despolarización (ΔV; I). Por lo general, es poco probable que ocurra el seguimiento de la cisteína objetivo si la cisteína objetivo ya es accesible desde el espacio extracelular antes de la despolarización (II) o si la cisteína no es accesible desde el espacio extracelular después de la despolarización (III). (E) Después de la reacción con la molécula fluorescente de tiol, el movimiento de α-hélice en respuesta a la despolarización disminuye la emisión de fluorescencia MTS-5-TAMRA. La señal fluorométrica es generada por el movimiento de la hélice S4 y el posterior movimiento del tinte en relación con el plano de la membrana y el ambiente acuoso. Haga clic aquí para ver una versión más grande de esta figura.
2. Electroporación in vivo
NOTA: Los experimentos de electroporación se realizaron como se describió anteriormente38 con modificaciones. En la siguiente sección, el protocolo está diseñado para la electroporación de una almohadilla para el pie del ratón. Los volúmenes deben ajustarse si ambas patas están preparadas.
- Alícuota 25-100 μL de solución plásmida a 2-5 μg/μL en un tubo de 1,5 ml colocado sobre hielo.
- Preparar una solución de 0,5 ml de 2 mg/ml de hialuronidasa en solución salina estéril y filtrar la solución a través de un filtro estéril de proteína de baja unión de 0,2 μm montado en una jeringa de 1 ml. Conservar en un tubo de 1,5 ml a temperatura ambiente.
- Usando un aparato de anestesia calibrado, anestesiar a un ratón usando isoflurano al 3% -4.5% enO2 (1 L / min) colocando al ratón en la cámara de anestesia. Confirme la anestesia adecuada del animal pellizcando la punta de la cola con un par de pinzas. No se debe observar ninguna reacción cuando se alcanza la anestesia óptima.
- Retire el ratón de la cámara de anestesia y coloque una máscara nasal de anestesia sobre el ratón. Coloque al animal boca arriba sobre una almohadilla térmica isotérmica cubierta con una almohadilla de banco estéril. Continuar la anestesia utilizando la máscara de roedor con isoflurano al 3% enO2 (1 L/min).
- Para prevenir la sequedad ocular durante el procedimiento, aplique una fina capa de crema lagrimal artificial en los ojos del animal con una punta de algodón estéril. Desinfecte la pata del animal con una toallita estéril saturada en alcohol etílico.
- Con una aguja de insulina estéril de 0,5 g de 29 G, aspirar 20 μL de solución de hialuronidasa. Penetre la piel a nivel del talón y deslice la aguja por vía subcutánea hacia la base de los dedos de los pies (Figura 2A). Inyecte lentamente la solución mientras mueve progresivamente la aguja hacia atrás. Se debe observar un bolo o protuberancia debajo de la pata (Figura 2B).
NOTA: Dependiendo de la edad del animal y el tamaño de la pata, es probable que no se inyecte la cantidad total de solución. A menudo, puede ocurrir una pequeña fuga a través del punto de inyección. - Repita el paso 2.6 con la otra pata, si lo desea, utilizando otra aguja estéril después de la desinfección adecuada de la pata, como en el paso 2.5.
- Desconecte la anestesia retirando al animal de la máscara nasal y devuelva el ratón a la jaula con acceso a alimentos y agua ad libitum. La recuperación completa de la anestesia debe observarse en ~ 5 min. Coloque el tubo que contiene la solución plásmida en el banco para permitir que alcance la temperatura ambiente.
- Después de 1 h, anestesiar al animal por segunda vez, colocarlo en la almohadilla térmica y desinfectar la pata como se describe en los pasos 2.3-2.5.
- Inyectar 10-20 μL de la construcción de ADNc, utilizando la misma técnica descrita en el paso 2.6. La cantidad total de construcción inyectada es de 50-100 μg por pata. Repita el procedimiento con la pata contralateral si lo desea utilizando otra jeringa estéril.
- Mantenga al animal bajo anestesia en la almohadilla térmica isotérmica durante 5 minutos para permitir que la solución de ADNc se disperse uniformemente a través del tejido.
- Encienda el dispositivo del aparato de electroporación y conéctelo a la matriz de electrodos dobles, según lo recomendado por el fabricante.
- Desinfecte la matriz de electrodos dobles con una toallita saturada en alcohol etílico. Estabilice la pata con una mano y primero inserte un electrodo debajo de la piel en la parte posterior del talón. Luego, inserte el segundo electrodo en la base de los dedos, asegurándose de que las orientaciones de ambos electrodos sean perpendiculares al eje del pie (Figura 2C). Oriente la sonda en una posición que no constriñe el pie o la pierna en una orientación angular extrema.
NOTA: La inserción de electrodos podría facilitarse con el uso de pinzas y afilando regularmente las puntas de los electrodos. Dependiendo de la edad del animal, el tamaño de la pata puede variar y el espacio entre electrodos debe adaptarse en consecuencia. - Electroporar los músculos aplicando 20 pulsos, 20 ms de duración/cada uno, a 1 Hz. Para agujas de electrodos espaciadas a 1 cm, ajuste el voltaje a ~100 V. Esto debe adaptarse si el espaciado de los electrodos se modifica para alcanzar ~ 100 V / cm. Se debe observar una ligera flexión de los dedos durante la administración del pulso si los electrodos están colocados correctamente.
- Repita los pasos 2.13 y 2.14 con la pata contralateral si lo desea.
- Desconecte la anestesia y coloque al animal en una jaula, aislado de su contramate no electroporado con acceso a comida y agua ad libitum durante 2 h. La recuperación completa de la anestesia debe observarse en ~ 10 min. Coloque al animal de nuevo dentro de la jaula.
NOTA: La expresión de las construcciones de ADNc depende en gran medida de la proteína codificada. El recambio de proteínas, la cantidad y la calidad del ADNc, el promotor de plásmidos y otras variables pueden afectar la expresión del constructo. En este experimento, la expresión óptima de la subunidad α1S de CaV1.1 con un promotor de CMV requiere de 4 a 6 semanas, pero puede detectarse a partir de 2 semanas durante un máximo de 12-15 meses.
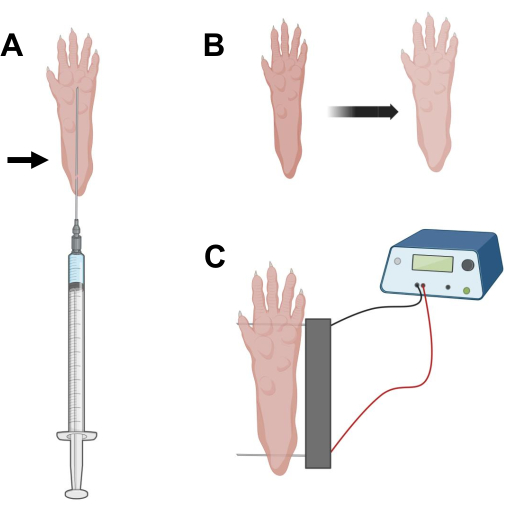
Figura 2: Diagrama de inyección de ADNc y posicionamiento del electrodo de electroporación de electroporación en una almohadilla de pie de ratón para electroporación. (A) Posición de la aguja para la inyección de hialuronidasa y ADNc debajo de una almohadilla para el pie del ratón. La flecha indica el punto de inserción a través de la piel. (B) Se debe observar transitoriamente una ligera decoloración de la piel y un ligero aumento del tamaño de la pata después de la inyección. (C) Posicionamiento de matriz de electrodos para electroporación. Haga clic aquí para ver una versión más grande de esta figura.
3. Disección muscular y aislamiento de fibras
NOTA: La disociación de la fibra muscular esquelética se realizó como se describió anteriormente 37,40,41 con modificaciones. En la siguiente sección, el protocolo es adecuado para dos almohadillas para los pies del mouse.
- Antes de la disociación de la fibra, prepare la placa cubierta de silgard agregando una parte de agente de curado a 10 partes de elastómero (% p/p) en una placa de Petri de plástico de 60 mm para alcanzar un espesor de ~ 5 mm. Deje que la placa cubierta de elastómero se cure durante la noche antes de usarla. Esto se puede reutilizar varias veces si se almacena y desinfecta adecuadamente con alcohol etílico al 70% antes y después de su uso.
- Preparar 4 mg de colagenasa tipo I en 2 ml de medio esencial de águila mínimo (S-MEM) suplementado con 10% de suero fetal bovino (FBS; concentración final de 2 mg/ml). Transfiera la solución a una placa de plástico no recubierta de 35 mm y coloque el plato en una incubadora a 37 °C, 5% deCO2.
NOTA: S-MEM es una formulación MEM modificada sin glutamina yCa2+. La ausencia de Ca2+ en este paso reduce la contractura de la fibra durante la digestión enzimática y la trituración. - Añadir 5 ml de S-MEM suplementado con 10% de FBS en una placa de plástico no recubierta de 60 mm y almacenar en la incubadora a 37 °C, 5% deCO2.
- Eutanasia a los animales por asfixia vía CO2 seguida de luxación cervical. Para reducir la contaminación durante el aislamiento de la célula primaria, sumerja el cadáver del animal en alcohol etílico al 70% durante ~ 10 s. Retire y seque la carcasa con papel absorbente y corte los pies con unas tijeras entre el tobillo y la rodilla (Figura 3A).
- Sujete un pie del animal, con la pata hacia arriba, con pasadores de disección en la placa cubierta de elastómero bajo un microscopio de disección con un aumento de 10x.
- Con tijeras de disección y pinzas finas, retire la piel de la pata para exponer el músculo flexor digitorum brevis (FDB) (Figura 3B). Para evitar la sequedad del tejido, agregue una gota de S-MEM 10% FBS al músculo usando una pipeta de 1,000 μL.
- A nivel del talón, incise el tendón y disecte cuidadosamente el músculo FDB desde el talón hasta el dedo del pie (Figura 3B). Evite la tensión en el músculo tanto como sea posible mientras realiza la disección. Demasiada fuerza aplicada sobre los tejidos resultará en daño a la fibra muscular. Coloque el músculo inmediatamente en la solución de colagenasa.
- Repita los pasos 3.5-3.7 con el pie contralateral. Colocar el músculo disecado en la solución de colagenasa en una incubadora deCO2 al 5% a 37 °C durante 2 h 45 min a 3 h 15 min. Adaptar el tiempo de incubación en función de la actividad enzimática de la colagenasa y de la edad del animal.
- Mientras el tejido muscular se está incubando, agregue 300 μL de MEM fría sin suero ni antibióticos en el centro de un plato con fondo de vidrio de 35 mm. Agregue 2 μL de laminina fría a 1,20 mg/ml directamente a la MEM. Repita el proceso para el número de platos deseado. Colocar los platos en la incubadora de cultivo celular a 37 °C, 5% deCO2 durante al menos 1 h para permitir la polimerización de laminina.
- Cuando se complete la digestión enzimática, transfiera el músculo a la placa de cultivo celular de 60 mm que contiene S-MEM 10% FBS con el uso de una pipeta Pasteur de vidrio pulido al fuego de gran diámetro (5 mm) y una bombilla de látex.
- Con una pipeta Pasteur de vidrio pulido al fuego de menor diámetro (2 mm) y una bombilla de látex, triture suavemente el músculo bajo un microscopio de disección (Figura 3C). Las fibras musculares disociadas deben comenzar a desprenderse del tejido y liberarse en la solución.
NOTA: Como regla general, siempre se prefiere menos trituración (15-30 pasajes de pipeta), ya que demasiada trituración prolongada puede estresar o incluso dañar las fibras. - Con un par de pinzas finas, retire cualquier tejido no muscular, como nervios, tendones o vasos sanguíneos (Figura 3D).
- Agregue 2 ml de MEM 2% FBS caliente a cada plato con fondo de vidrio recubierto de laminina de 35 mm. Con una pipeta de 200 μL y una punta de pipeta de plástico estéril, transfiera las fibras musculares disociadas al plato de fondo de vidrio recubierto de laminina de 35 mm (Figura 3E).
NOTA: Lograr una baja densidad de fibra y permitir que las fibras estén bien separadas entre sí es importante para evitar la superposición de fibras. - Colocar la placa de fondo de vidrio de 35 mm en la incubadora a 37 °C, 5% deCO2. Las fibras se pueden utilizar en un marco de tiempo de 2-20 h.
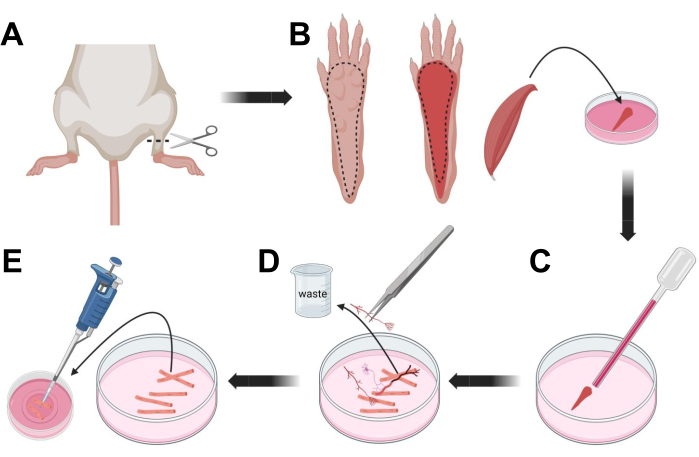
Figura 3; Disección y disociación de fibras FDB musculares. (A) Después de la disección del pie por encima de la articulación del tobillo (línea discontinua), se retira la piel debajo de la pata del pie, siguiendo la línea discontinua para exponer el músculo FDB (B). El músculo se disecciona y se coloca en solución de colagenasa. (C) Después de la incubación, el músculo se tritura para disociarse y obtener fibras musculares individuales. (D) Se utilizan pinzas finas para eliminar el tejido no muscular y los desechos antes de transferir las fibras musculares al plato de cultivo de fondo de vidrio recubierto de laminina. Haga clic aquí para ver una versión más grande de esta figura.
4. Descripción de la configuración de adquisición
NOTA: La configuración de adquisición es comparable a la descrita anteriormente42 con modificaciones (Figura 4A).
- Encienda todos los componentes: computadora, convertidor AD/DA y amplificador de pinza de trayectoria, microscopio, platina motorizada, manipulador(es), fuente de alimentación para el fotodiodo, fuente de luz, obturador de luz, generador de pulsos y editor de protocolo.
- Active la lógica transistor-transistor (TTL) que activa la señal OUT del AD/DA para controlar el generador de pulsos, el obturador de luz y el editor de protocolos.
- Utilice la señal de salida TTL del generador de impulsos y conéctese a un canal AD del amplificador para verificar la activación temporal precisa. El control adecuado de la consistencia de activación debe evaluarse cuidadosamente antes del experimento para garantizar una sincronización adecuada del aparato.
NOTA: En el caso de CaV1.1, espere ver la señal máxima en menos de 4-10 ms después de la estimulación (tiempo para desarrollar el movimiento de carga máxima5). La señal es rápida y la resolución temporal precisa es crítica para comparar con otras medidas, como el transitorio de calcio o el movimiento de carga medido a través de una pinza de voltaje. - Para enfocar la luz de excitación en un área o punto específico de la fibra (Figura 4B), use un diafragma colocado en la trayectoria de la luz de excitación. Esto permite la adquisición de señal solo en un área donde la señal EGFP-CaV1.1 es máxima (Figura 4B).
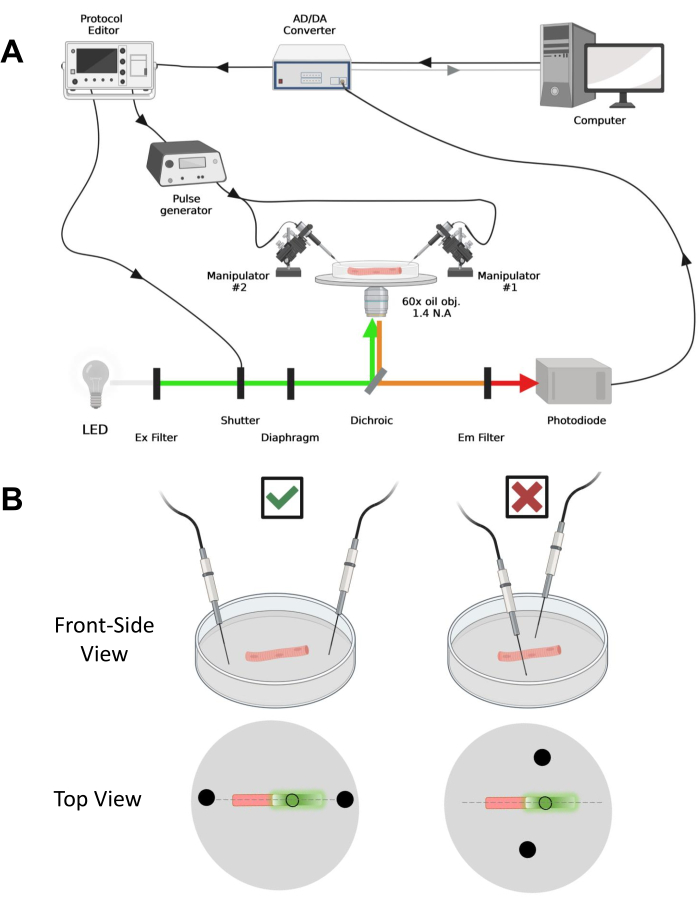
Figura 4: Descripción del sistema de grabación. (A) Diagrama que ilustra la conexión entre los diferentes componentes del sistema de grabación. La configuración consiste en un microscopio invertido con una etapa motorizada, una fuente de luz de diodo emisor de luz (LED), un obturador de luz, un circuito de monitoreo de luz basado en fotodiodos hecho a medida con una función de seguimiento y retención43, un convertidor AD / DA (desde un amplificador de abrazadera de parche), un generador de pulsos analógico, una unidad de estimulación de campo externa acoplada a electrodos de estimulación de campo, manipuladores motorizados y software comercial para la adquisición, sincronización y generación de protocolos. El electrodo para la estimulación de campo está hecho de dos alambres de platino soldados a cables de cobre conectados al generador de impulsos a través de un conector BMC. Se utilizan filtros específicos de excitación y emisión para detectar señales EGFP y MTS-5-TAMRA. Para excitar EGFP, se utiliza una lámpara de xenón con un filtro de excitación (Ex) de 488 nm (± 20 nm) y un filtro Em LP510 nm. Para MTS-5-TAMRA, se utiliza una fuente de luz LED de 530 nm y un filtro Em LP550 nm. (B) Vista de una fibra que expresa una construcción EGFP-CaV1.1-cys con los electrodos de estimulación de dos campos (círculos negros) orientados correctamente (izquierda) e incorrectamente (derecha) en el eje principal de las fibras (línea discontinua). El círculo negro sin relleno representa el área de adquisición con un diámetro controlado por la abertura del diafragma, colocada frente a la fuente de luz. Haga clic aquí para ver una versión más grande de esta figura.
5. Evaluación de la actividad eléctrica de fibra positiva para EGFP y tinción de cisteína
NOTA: La estimulación del campo de fibras musculares esqueléticas se lleva a cabo como se describe antes41 con modificaciones. Este enfoque se utiliza para (1) identificar fibras sanas, funcionales y eléctricamente sensibles, (2) teñir las fibras con el colorante fluorescente reactivo a la cisteína y (3) registrar la señal fluorescente en respuesta al potencial de acción propagado. Cada paso de esta sección y el siguiente debe llevarse a cabo en un ambiente con poca luz para reducir el blanqueamiento de tintes fluorescentes.
- Coloque el plato con fondo de vidrio de 35 mm que contiene fibras musculares disociadas en el escenario del microscopio. Retire con cuidado los medios de cultivo con una pipeta de 1.000 μL y sustitúyalos con 2 ml de solución de Ringer a temperatura ambiente (ver Tabla 1 para la composición). Es posible que se requieran múltiples rondas de reemplazo de medios para eliminar completamente los medios de cultivo celular originales que contienen cisteínas libres.
- Usando un manipulador mecánico o motorizado, coloque los dos cables de platino perpendiculares al fondo del plato. Asegúrese de que los terminales del electrodo estén alineados con respecto al eje longitudinal de la fibra y a unos pocos milímetros de distancia de los extremos de la fibra, y que la separación entre los electrodos sea de 5 mm (Figura 4B). Ajuste aún más el posicionamiento del electrodo girando el plato o montando cada electrodo en un micromanipulador independiente (Figura 4B).
- Encienda la luz transmitida y encuentre las fibras en el campo de visión utilizando un objetivo de 20x. Mueva el cubo de filtro EGFP hacia el camino de la luz.
NOTA: Utilizando un microscopio equipado con epifluorescencia y un objetivo de bajo aumento (2x), es posible evaluar la eficiencia de transfección de constructo en todo el músculo antes de la disociación de la fibra evaluando la expresión de EGFP (Figura 5A). - Usando un obturador de luz controlado a distancia, active la luz de excitación de 488 nm para identificar las fibras positivas de EGFP. Almacene la ubicación de fibra x-y en el plato utilizando una plataforma de microscopio motorizada. La señal EGFP es a menudo heterogénea dentro de la fibra (Figura 4B). Centra la posición guardada en la señal EGFP más brillante.
- Después de identificar las fibras positivas para EGFP, vuelva a la primera localización guardada. Usando un interruptor de disparo manual, administre dos pulsos de estimulación secuencial con una duración de 1 ms y una amplitud de 20 V. Establezca la polaridad de los pulsos en alternancia.
- Después de la estimulación, observe dos contracciones concéntricas de fibras homogéneas en respuesta a los dos pulsos de polaridad opuesta. Una contracción local o la ausencia de contracción en las respuestas a pulsos de polaridad alterna indican respuestas pasivas locales no propagadas o inexcitabilidad41. Excluya estas fibras para el resto del experimento.
- Añadir 2 μL de solución de MTS-5-TAMRA de 10 mM directamente en el plato y mezclar suavemente con una pipeta de 1.000 μL (concentración final de 10 μM). Tenga cuidado de no mover el plato, o las posiciones de fibra almacenadas se perderán. Incubar durante 4-5 min para permitir la difusión de la molécula de tiol fluorescente en el lumen del sistema tubular transversal.
- Aplique estimulaciones repetitivas bipolares para evocar trenes de potencial de acción sucesivos a una velocidad de 50 Hz durante 300 ms cada 1 s durante 5 min.
NOTA: Los trenes de pulsos dan accesibilidad a las cisteínas insertadas en el S4 de EGFP-CaV1.1 para reaccionar con MTS-5-TAMRA. La capacidad de la fibra para contraerse mecánicamente en respuesta a la estimulación es importante para que el contenido de luz del túbulo transversal se cicle con el entorno extracelular. - Retire la solución de tinción del plato con una pipeta de 1.000 μL y sustitúyala con 2 ml de solución de Ringer a temperatura ambiente. Es posible que se requieran dos o tres rondas para eliminar completamente el MTS-5-TABRA no conjugado. Deje que la fibra teñida se recupere del protocolo de tinción durante al menos 10 minutos.
- Como en el paso 5.6, vuelva a evaluar la salud de la fibra y la actividad eléctrica observando la contracción simétrica de la fibra en respuesta a la polaridad alterna. Excluya las fibras que no responden a ambas estimulaciones del resto del experimento.
- Mueva el cubo de filtro MTS-5-TAMRA en la vía de luz. Usando un obturador de luz controlado a distancia, active la luz de excitación de 533 nm para confirmar la tinción homogénea de MTS-5-TAMRA en las fibras.
NOTA: Tras la tinción con MTS-5-TAMRA, tanto las cisteínas modificadas como las endógenas reaccionan con el derivado de maleimida (Figura 5B). Por lo tanto, es difícil evaluar la reacción adecuada con la cisteína de interés. CaV1.1 se expresa principalmente en el túbulo transversal, formando un patrón de doble banda distinguible. Usando un microscopio confocal o de epifluorescencia, se podría usar una imagen x-y para confirmar la tinción adecuada y la entrada y difusión del túbulo transversal de MTS-5-TAMRA (Figura 5C).
6. Adquisición y procesamiento de señales
NOTA: Antes de realizar mediciones fluorométricas, la adquisición de señales debe diseñarse cuidadosamente para obtener la relación señal/ruido óptima. Las velocidades de muestreo más lentas permiten una mayor detección de luz al tiempo que reducen el número de puntos que se adquirirían durante el reordenamiento conformacional de proteínas. En el caso de EGFP-CaV1.1-cys, el movimiento de carga inducido por una forma de onda de potencial de acción ocurre en ~1-10 ms37. Para obtener múltiples puntos para rastrear la evolución del movimiento a lo largo del tiempo, la adquisición se estableció en 50 μs por punto.
- Coloque la fibra en el centro del campo de visión con un sistema de aumento adecuado. Para estos experimentos, se utilizó un objetivo invertido de 60x aceite 1.4 apertura numérica (NA). Optimice la iluminación y la posición de la fibra con la platina motorizada y el diafragma para iluminar un área circular del diámetro de la fibra, donde la señal EGFP es máxima (Figura 4B).
- Una vez que la fibra esté posicionada para la adquisición, oriente los dos cables de platino de estimulación de campo montados independientemente en cada extremo de la fibra. Alinee los cables en el eje principal de las fibras en línea recta y espaciarlos 5 mm de distancia con la fibra en el centro (Figura 4B).
- Ajuste los filtros de excitación y emisión de adquisición a la configuración adecuada para MTS-5-TAMRA. Inicie el experimento ejecutando el protocolo escrito en el software de adquisición. Este paso activa todos los dispositivos descendentes (es decir, editor de protocolo, obturador de luz, generador de pulsos).
NOTA: Este protocolo permite un breve período (es decir, 10 ms) de adquisición de línea de base antes de la entrega del estímulo de campo para permitir mediciones posteriores de fluorescencia en reposo. - Inicie un solo o un tren de potenciales de acción con un pulso cuadrado de 0,5 o 1 ms, 20 V. Minimice el tiempo total de adquisición tanto como sea posible para evitar el blanqueamiento de la señal.
NOTA: Incluso si se graba en el centro de la fibra, podría ocurrir una señal de fluorescencia relacionada con el movimiento y puede confundirse con la señal fluorescente debido al cambio conformacional proteína-fluoróforo (Figura 5D). La señal inducida por contracción debe retrasarse en comparación con el tiempo esperado de movimiento de carga después de la estimulación37. - Para distinguir aún más la señal que surge de los movimientos de S4 de la debida a la contracción de la fibra, agregue 1 μL de 100 mM de N-bencil-p-tolueno sulfonamida (BTS; concentración final de 50 μM) a la solución de grabación para minimizar las respuestas contráctiles y repita el paso 6.4. Las señales detectadas por segunda vez después de la inmovilización farmacológica de la fibra corresponden al movimiento molecular de la hélice S4 marcada (Figura 5D).
NOTA: No se debe detectar ninguna señal en el control EGFP-CaV1.1 sin cisteína diseñada después de la supresión del movimiento con BTS. - Usando la misma configuración, adquiera una señal similar en un lugar dentro del plato donde no haya fibra muscular ni residuos presentes para obtener un valor de fluorescencia de fondo.
- Importe los archivos que contienen el curso temporal de la fluorescencia sin procesar [Fr(t)] de la fibra y la fluorescencia de fondo [Fb(t)] al software de análisis de datos. Promedie la columna que contiene Fb(t) para obtener un valor Fb homogéneo. Resta Fb del Fr(t) para obtener los valores absolutos de fluorescencia [F(t)]. Suaviza la señal resultante con una función de suavizado si es necesario.
NOTA: Con este sistema de detección y la frecuencia de adquisición, decidimos utilizar una función de promedio adyacente con una ventana de 50 puntos para el suavizado. - Promedie los valores basales de F(t) en un intervalo de tiempo de 10 ms antes de la estimulación para obtener un valor de fluorescencia en reposo (F0). Resta F0 del F(t) suavizado para obtener el cambio absoluto en la fluorescencia [ΔF(t)]. Luego, para expresar el cambio de fluorescencia a lo largo del tiempo en relación con la fluorescencia en reposo (ΔF/F0), divida ΔF(t) por F0.
- Para evaluar el grado de blanqueamiento de la señal, defina dos puntos de la señal ΔF/F0 a lo largo del tiempo, antes y después de la estimulación y lejos de la señal fluorométrica. Ajuste una función lineal a estos dos puntos para obtener una traza de línea base. Reste la línea de base a ΔF/F0 con el tiempo para corregir el blanqueamiento de la señal.
- Reste de la columna de tiempo el retraso entre el inicio de la adquisición y la señal de retroalimentación de la estimulación, para que t = 0 corresponda al inicio del estímulo eléctrico.
NOTA: Para permitir múltiples comparaciones de señal, a menudo se requiere normalizar la amplitud de la señal. Se pueden utilizar diferentes enfoques dependiendo del propósito del experimento. En la siguiente sección de resultados, estábamos interesados en la cinética de la señal, por lo que utilizamos un método simple que consiste en normalizar cada señal por el valor mínimo alcanzado (es decir, el pico de ida negativo).
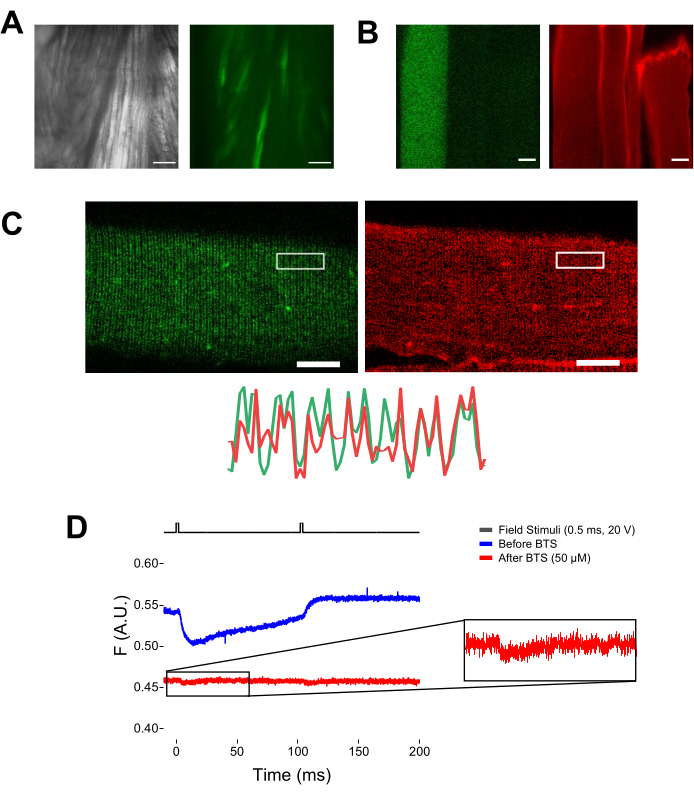
Figura 5: Obtención de imágenes de fibra muscular que expresan EGFP-CaV1.1-cys sin y con tinción MTS-5-TAMRA y registro fluorométrico bruto representativo. (A) Ejemplos de imágenes transmitidas (izquierda) y fluorescentes (derecha) del músculo disecado, no disociado, que expresan una construcción EGFP-CaV1.1 VSD-III. Barra de escala: 100 μm. (B) Imagen representativa de una fibra muscular que expresa una construcción EGFP-CaV1.1 VSD-III antes (izquierda) y después (derecha) de la tinción MTS-5-TAMRA. Las cisteínas endógenas de fibras no transfectadas también se tiñen con el tinte. Barra de escala: 30 μm. (C) La imagen confocal de una construcción EGFP-Ca V 1.1 VSD-III (izquierda) y la tinción MTS-5-TAMRA (derecha) muestran un patrón clásico de doble banda característico de la localización de CaV1.1 en el sistema tubular transversal de la fibra muscular (abajo). Barra de escala: 25 μm. (D) Registro fluorométrico representativo en respuesta a dos estímulos y medido con un fotodiodo antes (traza azul) y después (traza roja) de inmovilización de fibras con N-bencil-p-tolueno sulfonamida (BTS). La línea negra superior indica el protocolo para la despolarización de la fibra a través de la estimulación del campo externo. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Cuando los potenciales de acción de propagación se activan en respuesta a la estimulación repetitiva del campo, es posible rastrear el movimiento específico del sensor de voltaje en respuesta a una frecuencia específica de despolarización. Como se muestra en la Figura 6A, el movimiento de las hélices marcadas con VSD-II se puede rastrear en respuesta a cada una de las dos despolarizaciones sucesivas aplicadas a 10 Hz (es decir, espaciadas por 100 ms). El blanqueamiento de la señal se...
Access restricted. Please log in or start a trial to view this content.
Discusión
Aquí, se describe un protocolo paso a paso para realizar FSDF en fibras musculares para el estudio de movimientos individuales del sensor de voltaje del canal CaV1.1. Aunque el número de pasos y la diversidad de enfoques que se combinan en esta técnica pueden parecer complejos, la mayoría de estas técnicas a menudo se utilizan de forma rutinaria en laboratorios de biofísicos / biólogos celulares. Por lo tanto, la complejidad aparente reside principalmente en la combinación de todos los diversos enfoque...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no informan de ningún conflicto de intereses.
Agradecimientos
Agradecemos al Dr. J. Vergara (Universidad de California, Los Ángeles) por compartir el plásmido de tipo salvaje EGFP-CaV1.1 (conejo). Agradecemos al Laboratorio de Electrónica del Departamento de Fisiología de Yale y especialmente a Henrik Abildgaard por el diseño y la construcción del fotodiodo con circuito de seguimiento y retención. Este trabajo fue apoyado por las subvenciones R01-AR075726 y R01-NS103777 de los Institutos Nacionales de Salud
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
Referencias
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915(2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. Excitation-Contraction Coupling in Skeletal Muscle. , McGraw-Hill. New York. (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. Muscle: Fundamental Biology and Mechanisms of Disease. , Academic Press, Elsevier. 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22(2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118(2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520(2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6(2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109(2022).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados