Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Функциональная сайт-направленная флуорометрия в нативных клетках для изучения возбудимости скелетных мышц
В этой статье
Резюме
Функциональная сайт-направленная флуорометрия — это метод изучения движений белковых доменов в режиме реального времени. Модификация этого метода для его применения в нативных клетках теперь позволяет обнаруживать и отслеживать движения одного датчика напряжения из потенциал-зависимых каналов Ca2+ в изолированных волокнах скелетных мышц мышей.
Аннотация
Функциональная сайт-направленная флуорометрия была методом выбора для исследования взаимосвязи структуры и функции многочисленных мембранных белков, включая потенциал-зависимые ионные каналы. Этот подход использовался в основном в гетерологичных экспрессионных системах для одновременного измерения мембранных токов, электрического проявления активности каналов и измерений флуоресценции, сообщая о локальных доменных перестройках. Функциональная сайт-направленная флуорометрия объединяет электрофизиологию, молекулярную биологию, химию и флуоресценцию в единый широкомасштабный метод, который позволяет изучать структурные перестройки и функции в реальном времени посредством флуоресценции и электрофизиологии соответственно. Как правило, для этого подхода требуется спроектированный потенциал-зависимый мембранный канал, содержащий цистеин, который может быть протестирован тиол-реактивным флуоресцентным красителем. До недавнего времени тиол-реакционноспособная химия, используемая для сайт-направленного флуоресцентного мечения белков, проводилась исключительно в ооцитах и клеточных линиях Xenopus , что ограничивало сферу применения подхода первичными невозбудимыми клетками. В этом отчете описывается применимость функциональной сайт-направленной флуорометрии в клетках скелетных мышц взрослого человека для изучения ранних этапов связи возбуждения-сокращения, процесса, посредством которого электрическая деполяризация мышечных волокон связана с активацией мышечного сокращения. В настоящем протоколе описываются методики проектирования и трансфектирования цистеин-инженерных потенциал-зависимых каналов Ca2+ (CaV1.1) в мышечные волокна сгибателя пальцев взрослых мышей с использованием электропорации in vivo , а также последующие этапы, необходимые для функциональных сайт-направленных флуорометрических измерений. Этот подход может быть адаптирован для изучения других ионных каналов и белков. Использование функциональной сайт-направленной флюорометрии мышц млекопитающих особенно актуально для изучения основных механизмов возбудимости.
Введение
Способность отслеживать конформационные перестройки ионных каналов в ответ на известный электрический стимул в живой клетке является источником ценной информации для молекулярной физиологии1. Потенциал-зависимые ионные каналы представляют собой мембранные белки, которые ощущают изменения трансмембранного напряжения, и на их функцию также влияют изменения напряжения2. Развитие методов зажима напряжения в прошлом веке позволило физиологам изучать в режиме реального времени ионные токи, переносимые потенциал-зависимыми ионными каналами в ответ на деполяризацию мембраны3. Использование технологии зажима напряжения имеет решающее значение для понимания электрических свойств возбудимых клеток, таких как нейроны и мышцы. В 1970-х годах уточнение зажима напряжения позволило обнаружить стробирующие токи (или движение заряда) в потенциал-зависимых каналахкальция (Ca V) и натрия (NaV) 4,5. Стробирующие токи представляют собой нелинейные емкостные токи, возникающие в результате движения датчиков напряжения в ответ на изменения электрического поля через клеточную мембрану6. Стробирующие токи считаются электрическим проявлением молекулярных перегруппировок, которые предшествуют или сопровождают открытие ионного канала7. Хотя эти измерения тока дают ценную информацию о функции канала, как ионные токи, так и стробирующие токи являются косвенными показаниями меж- и внутримолекулярных конформационных перестроек потенциал-зависимых каналов7.
Функциональная сайт-направленная флуорометрия (FSDF; также называемая флюорометрия зажима напряжения, VCF) была разработана в начале 1990-х годов8 и впервые предоставила возможность непосредственно просматривать локальные конформационные изменения и функцию канального белка в режиме реального времени. Используя комбинацию систем мутагенеза каналов, электрофизиологии и гетерологичной экспрессии, можно флуоресцентно помечать и отслеживать движущиеся части определенных каналов или рецепторов в ответ на активирующий стимул 9,10. Этот подход широко использовался для изучения механизмов измерения напряжения в потенциал-зависимых ионных каналах 8,10,11,12,13,14,15,16,17,18,19. Авторитетные обзоры см. в 10,20,21,22,23.
Каналы CaV и NaV, критически важные для инициирования и распространения электрических сигналов, состоят из главной субъединицы α1, которая обладает центральной порой и четырьмя неидентичными доменамиизмерения напряжения 2. В дополнение к их отчетливой первичной структуре, каналы Ca V и NaV выражаются в виде мультисубъединичных комплексов со вспомогательными субъединицами24. Потенциал-зависимые калиевые каналы (K V) состоят из четырех субъединиц, которые выглядят как один домен Na V или CaV25. Порообразующая и чувствительная к напряжению α1-субъединица каналов CaV и NaV образована одним полипептидом, кодирующим четыре отдельных домена из шести уникальных трансмембранных сегментов (S1-S6; Рисунок 1А) 24,26. Область, состоящая из трансмембранных сегментов от S1 до S4, образует чувствительный к напряжению домен (VSD), а трансмембранные сегменты S5 и S6 образуют поровый домен26. В каждом VSD α-спираль S4 содержит положительно заряженный аргинин или лизин (рис. 1A, B), которые движутся в ответ на деполяризациюмембраны 7. Несколько десятилетий исследований и результаты самых разных экспериментальных подходов подтверждают предположение о том, что сегменты S4 движутся наружу, генерируя стробирующие токи, в ответ на деполяризацию мембраны6.
FSDF измеряет флуоресцентные изменения тиол-реактивного красителя, конъюгированного со специфическим остатком цистеина (т.е. α-спиралью S4) на ионном канале или другом белке, сконструированном посредством сайт-направленного мутагенеза, поскольку канал функционирует в ответ на деполяризацию мембраны или другие стимулы10. Фактически, FSDF был первоначально разработан для исследования того, перемещается ли сегмент S4 в каналах KV, предлагаемый в качестве основного датчика напряжения канала, при движении стробирующих зарядов в ответ на изменения мембранного потенциала 8,10. В случае потенциал-зависимых ионных каналов FSDF может разрешать независимые конформационные перегруппировки четырех VSD (отслеживая один VSD в любой момент времени) одновременно с измерениями функции канала. Действительно, используя этот подход, было показано, что отдельные ДМЖП, по-видимому, по-разному участвуют в конкретных аспектах активации и инактивации канала 12,27,28,29,30. Идентификация вклада каждой ДМЖП в функцию каналов имеет большое значение и может быть использована для дальнейшего выяснения работы канала и, возможно, выявления новых мишеней для разработки лекарств.
Использование FSDF в гетерологичных системах экспрессии было чрезвычайно полезным для дальнейшего понимания функции канала с редукционистской точки зрения10,23. Как и многие редукционистские подходы, он имеет преимущества, но также имеет ограничения. Например, одним из основных ограничений является частичное восстановление наносреды канала в гетерологичной системе. Часто ионные каналы взаимодействуют с многочисленными вспомогательными субъединицами и многими другими белками, которые изменяют их функцию31. В принципе, различные каналы и их вспомогательные субъединицы могут быть экспрессированы в гетерологичных системах с использованием множественных белковых кодирующих конструкций или полицистронных плазмид, но их нативная среда не может быть полностью восстановлена30,32.
Наша группа недавно опубликовала вариант FSDF в нативных диссоциированных скелетных мышечных волокнах для изучения ранних стадий связи возбуждения-сокращения (ECC)33,34, процесса, посредством которого электрическая деполяризация мышечных волокон связана с активацией мышечного сокращения 35,36. Впервые этот подход позволил отслеживать движение отдельных датчиков напряжения S4 из управляемого напряжением канала Ca2+ L-типа (CaV1.1, также известного как DHPR) в нативной среде взрослого дифференцированного мышечного волокна37. Это было достигнуто путем рассмотрения множества характеристик этого типа клеток, включая электрическую активность клетки, обеспечивающую быструю самораспространяющуюся деполяризацию, индуцированную стимуляцией, способность экспрессировать плазмиду кДНК посредством электропорации in vivo, естественную высокую экспрессию и компартментную организацию каналов внутри клетки, а также ее совместимость с высокоскоростными устройствами визуализации и электрофизиологической записи. Ранее мы использовали высокоскоростной конфокальный микроскоп с линейным сканированием в качестве детектирующего устройства37. Теперь представлена разновидность методики с использованием фотодиода для сбора сигнала. Эта система детектирования на основе фотодиодов может облегчить внедрение этого метода в других лабораториях.
Здесь описан пошаговый протокол использования FSDF в нативных ячейках для исследования движения индивидуального датчика напряжения от CaV1.1. В то время как канал CaV1.1 использовался в качестве примера в этой рукописи, этот метод может быть применен к внеклеточнодоступным доменам других ионных каналов, рецепторов или поверхностных белков.
Access restricted. Please log in or start a trial to view this content.
протокол
Этот протокол был одобрен Институциональным комитетом по уходу за животными и их использованию Университета Мэриленда. Следующий протокол был разделен на несколько подразделов, состоящих из (1) дизайна молекулярной конструкции и выбора красителя, реагирующего на цистеин, (2) электропорации in vivo , (3) рассечения мышц и выделения волокон, (4) описания установки сбора, (5) оценки положительной электрической активности зеленого флуоресцентного белка (EGFP) и окрашивания цистеина, и (6) сбора и обработки сигналов. Кроме того, в начале каждого раздела подробно описаны некоторые соответствующие соображения при применении FSDF в клетчатке скелетных мышц. Все разделы протокола должны выполняться с надлежащими средствами индивидуальной защиты, включая лабораторный халат и перчатки.
1. Дизайн молекулярной конструкции и выбор красителя, реагирующего на цистеин.
- Проектирование конструкций является важной частью успеха эксперимента. Во-первых, сгенерируйте конструкцию кДНК дикого типа с флуоресцентной меткой CaV1.1 и оцените ее экспрессию в соответствующем типе клеток. Для мышечных волокон сильная эффективность трансфекции может быть достигнута с помощью плазмиды, несущей промотор цитомегаловируса (ЦМВ). В этом протоколе использовалась уже охарактеризованная плазмида кролика EGFP-CaV1.138.
ПРИМЕЧАНИЕ: При разработке конструкции кДНК для введения остатка цистеина в потенциал-зависимый ионный канал положение цистеина имеет решающее значение и должно быть тщательно рассмотрено. Цистеин должен быть доступен из внеклеточного пространства, чтобы обеспечить реакцию тиол-конъюгированного красителя (рис. 1C, D), и должен быть проксимальнее области S4, чтобы точно отслеживать его движение в ответ на деполяризацию. Однако для того, чтобы флуоресценция красителя могла гаситься в ответ на движение белка, введенный цистеиновый конъюгированный флуорофор должен находиться на границе раздела двух различных сред (например, мембраны и внеклеточной жидкости; Рисунок 1E). Кроме того, очень важно убедиться, что вставленный цистеин не влияет на функцию белка. - Чтобы получить представление о правильной локализации цистеина, соберите информацию о структуре канала или из других экспериментов по флуорометрии других родственных канальных белков. Для проектирования конструкций CaV1.1, спроектированных цистеином, оцените разрешенную структуру канала26 с помощью криоэлектронной микроскопии (крио-ЭМ) и сравните вставку цистеина в предыдущих работах из связанных каналов, таких как CaV1.212, или других каналов, таких как шейкер11 и NaChBac39.
- После того, как правильное положение цистеина выбрано, используйте коммерческий набор для мутагенеза, направленного на сайт, для введения цистеиновых замен. В настоящем протоколе на каждом цитозольном конце чувствительного к напряжению сегмента CaV1.1 были независимо сконструированы следующие модификации цистеинов: VSD-I (L159C), VSD-II (L522C), VSD-III (V893C), VSD-IV (S1231C) и UniProtKB: P07293 (рис. 1B).
- Для волокон скелетных мышц используйте метанетиосульфонат 5-карбокситетраметилродамина (MTS-5-TAMRA), который проявляет правильную и быструю диффузию в мембранную систему поперечных канальцев, которая представляет собой инвагинацию поверхностной мембраны и преобладающее расположение каналов CaV1.1. MTS-5-TAMRA демонстрирует снижение флуоресценции при переходе из липидной мембраны в водную среду (рис. 1E).
ПРИМЕЧАНИЕ: Производные Dylight или Alexa-малеимида окрашивают поверхностную мембрану, но не систему поперечных канальцев.
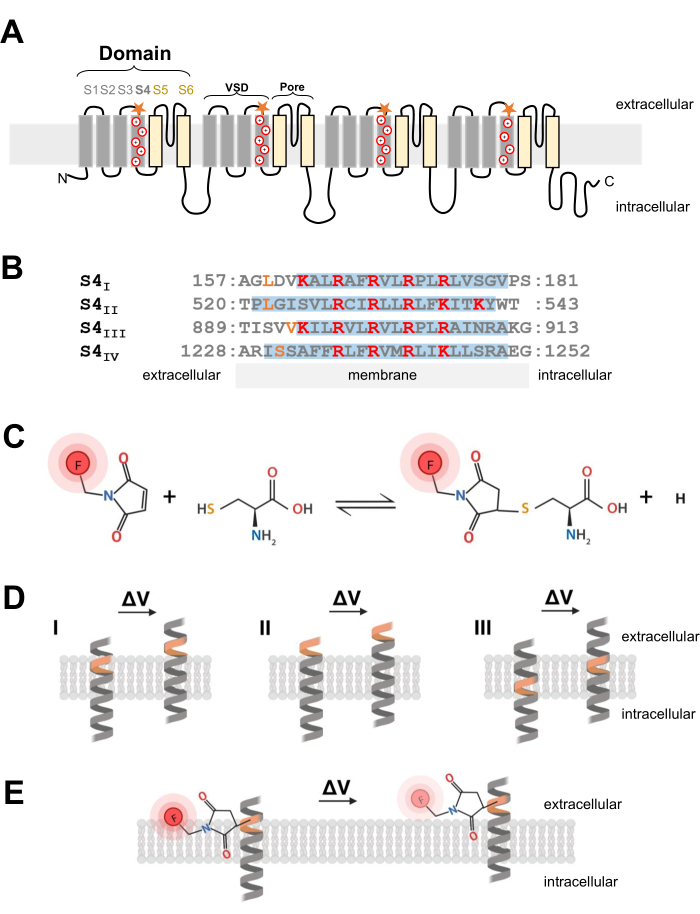
Рисунок 1: Схема тиол-цистеиновой реакции на границе раздела трансмембранной α-спирали. (A) Топология мембраны CaV 1.1 L-типа. Знаки «плюс» представляют собой основные остатки в α-спирали S4, а оранжевые звезды указывают на место, где цистеин был введен посредством сайт-направленного мутагенеза. (B) Выравнивание последовательности S4I - S4IV кролика CaV1.1 (UniProtKB: P07293). Положительно заряженные остатки аргинина и лизина, критически важные для измерения напряжения, выделены красным цветом, в то время как инженерные замены цистеина обозначены оранжевым цветом. Эта панель была адаптирована из ссылки37. (C) Реакция флуоресцентной молекулы цистеина-тиола. (D) Диаграмма, иллюстрирующая вставку мутагенеза цистеина в трансмембранную чувствительную к напряжению α-спираль. Цистеин должен быть похоронен в мембране в состоянии покоя и быть доступным внеклеточно после деполяризации (ΔV; I). Отслеживание цистеина, как правило, маловероятно, если целевой цистеин уже доступен из внеклеточного пространства до деполяризации (II) или если цистеин недоступен из внеклеточного пространства после деполяризации (III). (E) После реакции с тиоловой флуоресцентной молекулой движение α-спирали в ответ на деполяризацию уменьшает флуоресцентное излучение MTS-5-TAMRA. Флуорометрический сигнал генерируется движением спирали S4 и последующим движением красителя относительно плоскости мембраны и водной среды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Электропорация in vivo
ПРИМЕЧАНИЕ: Эксперименты по электропорации проводились, как описаноранее 38 с модификациями. В следующем разделе протокол предназначен для электропорации одной ножной подушечки мыши. Объемы нужно регулировать, если подготовлены обе лапы.
- Аликвот 25-100 мкл раствора плазмиды в дозе 2-5 мкг/мкл в пробирке объемом 1,5 мл, помещенной на лед.
- Приготовьте 0,5 мл раствора гиалуронидазы 2 мг/мл в стерильном физиологическом растворе и отфильтруйте раствор через стерильный фильтр с низким связывающим белком 0,2 мкм, установленный на шприце объемом 1 мл. Хранить в пробирке объемом 1,5 мл при комнатной температуре.
- Используя калиброванный наркозный аппарат, обезболите мышь, используя 3%-4,5% изофлурана в O2 (1 л / мин), поместив мышь в анестезиологическую камеру. Подтвердите адекватную анестезию животного, зажав кончик хвоста с помощью пинцета. Никакой реакции не должно наблюдаться при достижении оптимальной анестезии.
- Извлеките мышь из наркозной камеры и наденьте на мышь маску для анестезии. Положите животное на спину на изотермическую грелку, накрытую стерильной подушкой для скамейки. Продолжайте анестезию, используя маску грызуна с 3% изофлураном вО2 (1 л / мин).
- Чтобы предотвратить сухость глаз во время процедуры, нанесите тонкий слой искусственного слезного крема на глаза животного стерильным ватным наконечником. Продезинфицируйте лапу животного с помощью стерильной салфетки, пропитанной этиловым спиртом.
- Используя стерильную инсулиновую иглу длиной 0,5 г 29 г, аспирируйте 20 мкл раствора гиалуронидазы. Проникните в кожу на уровне пятки и проведите иглой подкожно к основанию пальцев ног (рис. 2А). Медленно вводите раствор, постепенно перемещая иглу назад. Под лапой должен наблюдаться болюс или шишка (рис. 2Б).
ПРИМЕЧАНИЕ: В зависимости от возраста животного и размера лапы, вполне вероятно, что полное количество раствора может быть введено не так. Нередко может произойти небольшая утечка через точку впрыска. - Повторите шаг 2.6 с другой лапой, если хотите, используя другую стерильную иглу после надлежащей дезинфекции лапы, как на шаге 2.5.
- Отключите анестезию, сняв животное с носовой маски, и верните мышь в клетку с доступом к еде и воде ad libitum. Полное восстановление после анестезии должно наблюдаться через ~5 мин. Поместите пробирку с раствором плазмиды на скамью, чтобы она достигла комнатной температуры.
- Через 1 ч обезболивайте животное во второй раз, положите его на грелку и продезинфицируйте лапу, как описано в шагах 2.3-2.5.
- Вводят 10-20 мкл конструкции кДНК, используя ту же методику, что и на шаге 2.6. Общее количество вводимого конструкта составляет 50-100 мкг на лапу. При желании повторите процедуру с контралатеральной лапой, используя другой стерильный шприц.
- Держите животное под наркозом на изотермической грелке в течение 5 минут, чтобы раствор кДНК равномерно распределился по ткани.
- Включите устройство электропорационного аппарата и подключите его к массиву двойных электродов в соответствии с рекомендациями производителя.
- Продезинфицируйте массив двойных электродов с помощью салфетки, пропитанной этиловым спиртом. Стабилизируйте лапу одной рукой и сначала вставьте один электрод под кожу в задней части пятки. Затем вставьте второй электрод у основания пальцев ног, убедившись, что ориентация обоих электродов перпендикулярна оси стопы (рис. 2C). Ориентируйте зонд в положении, которое не сковывает стопу или ногу в экстремальной угловой ориентации.
ПРИМЕЧАНИЕ: Введение электродов может быть облегчено с помощью пинцета и регулярной заточки кончиков электродов. В зависимости от возраста животного размер лапы может варьироваться, и расстояние между электродами должно быть соответствующим образом адаптировано. - Электропогандируйте мышцы, применяя 20 импульсов длительностью 20 мс каждый с частотой 1 Гц. Для игл электродов, расположенных на расстоянии 1 см, установите напряжение ~100 В. Это должно быть адаптировано, если расстояние между электродами изменено до ~ 100 В / см. Небольшое сгибание пальцев должно наблюдаться во время подачи импульса, если электроды расположены правильно.
- При желании повторите шаги 2.13 и 2.14 контралатеральной лапой.
- Отсоедините анестезию и поместите животное в клетку, изолированную от его неэлектропорированного партнера с доступом к пище и воде ad libitum на 2 часа. Полное восстановление после анестезии должно наблюдаться через ~10 мин. Поместите животное обратно в клетку.
ПРИМЕЧАНИЕ: Экспрессия конструкции (конструкций) кДНК сильно зависит от кодируемого белка. Оборот белка, количество и качество кДНК, промотор плазмиды и другие переменные могут влиять на экспрессию конструкции. В этом эксперименте оптимальная экспрессия α1S-субъединицы CaV1.1 с промотором ЦМВ занимает от 4 до 6 недель, но может быть обнаружена от 2 недель до 12-15 месяцев.
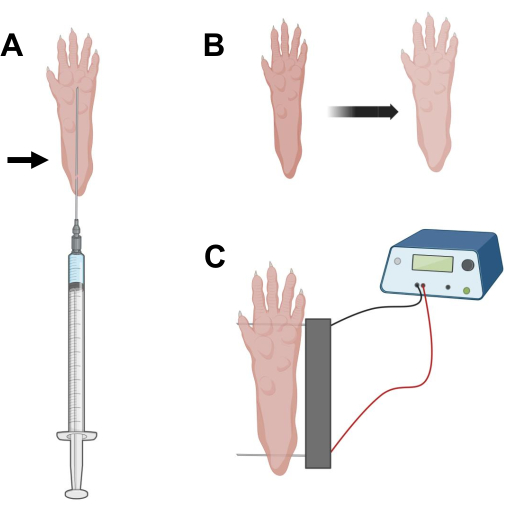
Рисунок 2: Схема инъекции кДНК и электропорационного электрода, расположенного в коврике для ног мыши для электропорации. (A) Положение иглы для инъекции гиалуронидазы и кДНК под подушечкой для ног мыши. Стрелка указывает точку введения через кожу. (B) После инъекции следует временно наблюдать незначительное обесцвечивание кожи и небольшое увеличение размера лапы. (C) Позиционирование электродной решетки для электропорации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Рассечение мышц и изоляция волокон
ПРИМЕЧАНИЕ: Диссоциацию волокон скелетных мышц проводили, как описано ранее 37,40,41 с модификациями. В следующем разделе протокол подходит для двух подушечек ног мыши.
- Перед диссоциацией волокон подготовьте пластину, покрытую силгардом, добавив одну часть отвердителя к 10 частям эластомера (% по массе) в пластиковой чашке Петри диаметром 60 мм, чтобы достичь толщины ~ 5 мм. Перед использованием дайте пластине, покрытой эластомером, затвердеть в течение ночи. Его можно использовать несколько раз при правильном хранении и дезинфекции 70% этиловым спиртом до и после использования.
- Приготовьте 4 мг коллагеназы I типа в 2 мл прядильной минимальной эссенциальной орлиной среды (S-MEM) с добавлением 10% эмбриональной бычьей сыворотки (FBS; конечная концентрация 2 мг / мл). Перелейте раствор на пластиковую пластину без покрытия диаметром 35 мм и поместите чашку в инкубатор при температуре 37 °C, 5% CO2.
ПРИМЕЧАНИЕ: S-MEM - это модифицированная формула MEM без глютамина и Ca2+. Отсутствие Ca2+ на этом этапе снижает контрактуру клетчатки во время ферментативного пищеварения и растирания. - Добавьте 5 мл S-MEM с добавлением 10% FBS в пластиковую пластину диаметром 60 мм без покрытия и храните в инкубаторе при температуре 37 °C, 5% CO2.
- Усыпить животных путем удушья через CO2 с последующим вывихом шейки матки. Чтобы уменьшить загрязнение во время первичной изоляции клеток, погрузите тушу животного в 70% этиловый спирт на ~ 10 с. Снимите и обсушите тушку впитывающей бумагой и разрежьте ножницами ступни между лодыжкой и коленом (рис. 3A).
- Придавите одну ногу животного лапой вверх с помощью диссекционных штифтов на пластине, покрытой эластомером, под диссекционным микроскопом при 10-кратном увеличении.
- С помощью ножниц для рассечения и тонкого пинцета снимите кожу с лапы, чтобы обнажить мышцу-сгибатель пальцев (FDB) (рис. 3B). Чтобы предотвратить сухость тканей, добавьте каплю S-MEM 10% FBS в мышцу с помощью пипетки объемом 1,000 мкл.
- На уровне пятки надрежьте сухожилие и тщательно рассеките мышцу FDB от пятки до носка (рис. 3B). Избегайте напряжения мышцы, насколько это возможно, во время выполнения рассечения. Слишком большая сила, приложенная к тканям, приведет к повреждению мышечных волокон. Немедленно поместите мышцу в раствор коллагеназы.
- Повторите шаги 3.5-3.7 с контралатеральной стопой. Поместите рассеченную мышцу в раствор коллагеназы в инкубатор с температурой 37 °C, 5% CO 2 на период от2 ч 45 мин до 3 ч 15 мин. Адаптируйте время инкубации в зависимости от ферментативной активности коллагеназы и возраста животного.
- Пока мышечная ткань инкубируется, добавьте 300 мкл холодного MEM без сыворотки или антибиотиков в центр чашки со стеклянным дном диаметром 35 мм. Добавьте 2 мкл холодного ламинина в дозе 1,20 мг/мл непосредственно в МЭМ. Повторите процесс для желаемого количества блюд. Поместите посуду в инкубатор клеточных культур при температуре 37 °C, 5% CO2 в течение не менее 1 часа, чтобы обеспечить полимеризацию ламинина.
- Когда ферментативное пищеварение будет завершено, перенесите мышцу в чашку для культивирования клеток диаметром 60 мм, содержащую S-MEM 10% FBS, с помощью пипетки Пастера из полированного стекла большого диаметра (5 мм) и латексной колбы.
- Используя пастеровскую стеклянную пипетку Пастера меньшего диаметра (2 мм) и латексную колбу, аккуратно растирайте мышцу под диссекционным микроскопом (рис. 3C). Диссоциированные мышечные волокна должны начать отделяться от ткани и высвобождаться в растворе.
ПРИМЕЧАНИЕ: Как правило, всегда предпочтительнее меньшее растирание (15-30 проходов пипетки), так как слишком длительное растирание может вызвать напряжение или даже повредить волокна. - С помощью тонкого пинцета удалите любую немышечную ткань, такую как нервы, сухожилия или кровеносные сосуды (рис. 3D).
- Добавьте 2 мл теплого MEM 2% FBS в каждую стеклянную посуду диаметром 35 мм, покрытую ламинином. Используя пипетку объемом 200 мкл и стерильный пластиковый наконечник пипетки, перенесите диссоциированные мышечные волокна в стеклянную нижнюю чашку диаметром 35 мм, покрытую ламинином (рис. 3E).
ПРИМЕЧАНИЕ: Достижение низкой плотности волокон и обеспечение хорошего отделения волокон друг от друга важно для предотвращения перекрытия волокон. - Поместите чашку со стеклянным дном диаметром 35 мм в инкубатор при температуре 37 °C, 5% CO2. Волокна можно использовать в течение 2-20 часов.
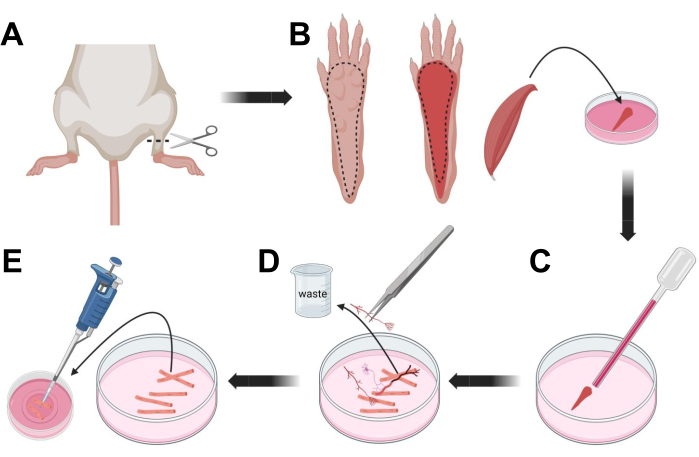
Рисунок 3; Расслоение и диссоциация мышечных волокон FDB. (A) После рассечения стопы над сочленением голеностопного сустава (пунктирная линия) кожа под лапой стопы удаляется по пунктирной линии, чтобы обнажить мышцу FDB (B). Мышца рассекается и помещается в раствор коллагеназы. (C) После инкубации мышца растирается для диссоциации и получения отдельных мышечных волокон. (D) Тонкий пинцет используется для удаления немышечной ткани и мусора перед переносом мышечных волокон в культуральную чашку со стеклянным дном, покрытую ламинином. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Описание установки сбора данных
ПРИМЕЧАНИЕ: Схема сбора данных сопоставима с описанной выше42 с модификациями (рис. 4А).
- Включите все компоненты: компьютер, АЦП/ЦАП и усилитель, микроскоп, моторизованный столик, манипулятор(ы), источник питания фотодиода, источник света, световой затвор, генератор импульсов и редактор протоколов.
- Активируйте транзисторно-транзисторную логику (TTL), запускающую выходной сигнал от AD/DA, для управления генератором импульсов, световым затвором и редактором протоколов.
- Используйте выходной сигнал TTL от генератора импульсов и подключитесь к AD-каналу усилителя, чтобы проверить точное временное срабатывание. Адекватный контроль согласованности запуска должен быть тщательно оценен перед экспериментом, чтобы обеспечить адекватную синхронизацию аппарата.
ПРИМЕЧАНИЕ: В случае CaV1.1 ожидайте увидеть максимальный сигнал менее чем через 4-10 мс после стимуляции (время для развития максимального движения заряда5). Сигнал быстрый, и точное временное разрешение имеет решающее значение для сравнения с другими показателями, такими как переходный процесс кальция или движение заряда, измеренное с помощью зажима напряжения. - Чтобы сфокусировать возбуждающий свет в определенной области или пятне волокна (рис. 4B), используйте диафрагму, расположенную на пути возбуждающего света. Это позволяет регистрировать сигнал только в той области, где сигнал EGFP-CaV1.1 максимален (рис. 4B).
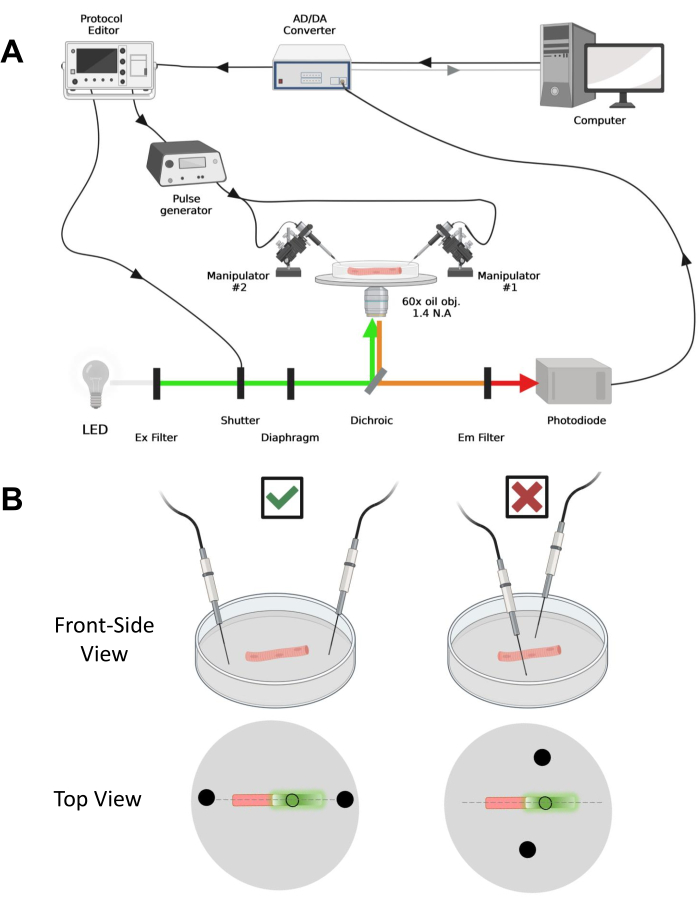
Рисунок 4: Описание системы записи . (A) Схема, иллюстрирующая связь между различными компонентами регистрирующей системы. Установка состоит из инвертированного микроскопа с моторизованным столиком, источника света на светодиодах (LED), светового затвора, изготовленной по индивидуальному заказу схемы контроля освещенности на основе фотодиодов с функцией43 трека и удержания, АЦП/ЦАП преобразователя (от усилителя патч-зажима), аналогового генератора импульсов, блока стимуляции внешнего поля, соединенного с электродами стимуляции поля, моторизованные манипуляторы и коммерческое программное обеспечение для сбора, синхронизации и генерации протоколов. Электрод для полевой стимуляции изготовлен из двух платиновых проводов, приваренных к медным кабелям, соединенным с генератором импульсов через разъем BMC. Специальные фильтры возбуждения и излучения используются для обнаружения сигналов как EGFP, так и MTS-5-TAMRA. Для возбуждения EGFP используется ксеноновая лампа с фильтром возбуждения (Ex) 488 нм (± 20 нм) и ЭМ-фильтром LP510 нм. Для MTS-5-TAMRA используется светодиодный источник света 530 нм и ЭМ-фильтр LP550 нм. (B) Вид волокна, выражающего конструкцию EGFP-CaV1.1-cys, с электродами стимуляции двух полей (черные круги), правильно ориентированными (слева) и неправильно (справа) по главной оси волокон (пунктирная линия). Черный незаполненный круг представляет собой область захвата с диаметром, контролируемым отверстием диафрагмы, расположенную перед источником света. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Оценка EGFP-положительной электрической активности волокон и окрашивание цистеином
ПРИМЕЧАНИЕ: Стимуляция поля волокон скелетных мышц проводится, как описано выше41 , с модификациями. Этот подход используется для (1) идентификации здоровых, функциональных и электрически чувствительных волокон, (2) окрашивания волокон цистеин-реактивным флуоресцентным красителем и (3) записи флуоресцентного сигнала в ответ на распространяемый потенциал действия. Каждый этап этого и следующего разделов следует проводить в условиях низкой освещенности, чтобы уменьшить отбеливание флуоресцентным красителем.
- Поместите 35-миллиметровую чашку со стеклянным дном, содержащую диссоциированные мышечные волокна, на столик микроскопа. Осторожно удалите питательные среды пипеткой объемом 1000 мкл и замените раствором Рингера комнатной температуры 2 мл (состав см. в таблице 1 ). Для полного удаления исходных сред для культивирования клеток, содержащих свободные цистеины, может потребоваться несколько раундов замены среды.
- Используя механический или моторизованный манипулятор, поместите два платиновых провода перпендикулярно дну тарелки. Убедитесь, что клеммы электродов выровнены относительно продольной оси волокна и на расстоянии нескольких миллиметров от концов волокна, а расстояние между электродами составляет 5 мм (рис. 4B). Далее отрегулируйте положение электрода, либо вращая тарелку, либо устанавливая каждый электрод на независимый микроманипулятор (рис. 4B).
- Включите проходящий свет и найдите волокна в поле зрения с помощью 20-кратного объектива. Переместите куб фильтра EGFP в световой путь.
ПРИМЕЧАНИЕ: Используя микроскоп, оснащенный эпифлуоресценцией и объективом с малым увеличением (2x), можно оценить эффективность конструктной трансфекции во всей мышце до диссоциации волокон, оценив экспрессию EGFP (рис. 5A). - Используя световой затвор с дистанционным управлением, активируйте возбуждающий свет с длиной волны 488 нм, чтобы идентифицировать EGFP-положительные волокна. Храните расположение волокна x-y на чашке с помощью моторизованного столика микроскопа. Сигнал EGFP часто неоднороден в пределах волокна (рис. 4B). Отцентрируйте сохраненное положение по самому яркому сигналу EGFP.
- После выявления EGFP-положительных волокон вернитесь к первой сохраненной локализации. С помощью ручного триггерного переключателя подайте два последовательных импульса стимуляции длительностью 1 мс и амплитудой 20 В. Установите полярность импульсов на переменную.
- После стимуляции наблюдайте два концентрических однородных сокращения волокон в ответ на два импульса противоположной полярности. Локальное сокращение или отсутствие сокращения в ответах на импульсы переменной полярности указывают на локальные, нераспространяющиеся пассивные реакции или невозбудимость41. Исключите эти волокна до конца эксперимента.
- Добавьте 2 мкл 10 мМ раствора MTS-5-TAMRA непосредственно в чашку и аккуратно перемешайте пипеткой объемом 1000 мкл (конечная концентрация 10 мкМ). Следите за тем, чтобы не перемещать тарелку, иначе сохраненные позиции волокон будут потеряны. Инкубировать в течение 4-5 минут, чтобы обеспечить диффузию молекулы флуоресцентного тиола в просвет поперечной системы канальцев.
- Применяйте биполярные повторяющиеся стимуляции, чтобы вызвать последовательные поезда потенциалов действия с частотой 50 Гц в течение 300 мс каждые 1 с в течение 5 минут.
ПРИМЕЧАНИЕ: Последовательности импульсов обеспечивают доступ к цистеинам, вставленным в S4 EGFP-CaV1.1, для реакции с MTS-5-TAMRA. Способность волокна механически сокращаться в ответ на стимуляцию важна для того, чтобы содержимое просвета поперечных канальцев циркулировало с внеклеточной средой. - Удалите красящий раствор из посуды пипеткой объемом 1,000 мкл и замените 2 мл раствора Рингера комнатной температуры. Для полного удаления несопряженного МТС-5-ТАМРА может потребоваться два или три патрона. Дайте окрашенному волокну восстановиться после протокола окрашивания в течение не менее 10 минут.
- Как и на шаге 5.6, повторно оцените работоспособность волокна и электрическую активность, наблюдая симметричное сжатие волокна в ответ на переменную полярность. Исключите волокна, которые не реагируют на обе стимуляции, из остальной части эксперимента.
- Переместите фильтрующий куб MTS-5-TAMRA в световой тракт. Используя световой затвор с дистанционным управлением, активируйте возбуждающий свет с длиной волны 533 нм, чтобы подтвердить однородное окрашивание MTS-5-TAMRA на волокнах.
ПРИМЕЧАНИЕ: При окрашивании MTS-5-TAMRA как инженерные, так и эндогенные цистеины реагируют с производным малеимида (рис. 5B). Таким образом, трудно оценить правильную реакцию с интересующим цистеином. CaV1.1 в основном экспрессируется в поперечных канальцах, образуя различимый двухполосный рисунок. Используя конфокальный или эпифлуоресцентный микроскоп, изображение x-y может быть использовано для подтверждения правильного окрашивания и поперечного входа в канальцы и диффузии MTS-5-TAMRA (рис. 5C).
6. Сбор и обработка сигналов
ПРИМЕЧАНИЕ: Перед выполнением флуорометрических измерений сбор сигнала должен быть тщательно спроектирован для получения оптимального соотношения сигнал/шум. Более медленная частота дискретизации позволяет обнаруживать больше света, уменьшая при этом количество точек, которые будут получены во время конформационной перестройки белка. В случае EGFP-CaV1.1-cys движение заряда, индуцированное формой волны потенциала действия, происходит за ~1-10мс 37. Чтобы получить несколько точек для отслеживания эволюции движения с течением времени, сбор данных был установлен на 50 мкс на точку.
- Поместите волокно в середину поля зрения с правильной системой увеличения. Для этих экспериментов использовался перевернутый объектив с 60-кратной масляной апертурой 1.4 (NA). Оптимизируйте освещение и положение волокна с помощью моторизованного столика и диафрагмы, чтобы осветить круглую область диаметра волокна, где сигнал EGFP максимален (рис. 4B).
- После того, как волокно будет позиционировано для захвата, сориентируйте два независимо установленных платиновых провода для стимуляции поля на каждом конце волокна. Выровняйте провода по главной оси волокон по прямой линии и расположите их на расстоянии 5 мм друг от друга так, чтобы волокно находилось в центре (рис. 4В).
- Установите фильтры возбуждения и излучения сбора данных на соответствующие настройки для MTS-5-TAMRA. Начните эксперимент с выполнения протокола, написанного в программном обеспечении для сбора данных. На этом этапе запускаются все последующие устройства (например, редактор протоколов, световой затвор, генератор импульсов).
ПРИМЕЧАНИЕ: Этот протокол допускает короткий период (т.е. 10 мс) сбора исходных данных перед доставкой полевого стимула, чтобы обеспечить последующие измерения флуоресценции в состоянии покоя. - Инициируйте одиночный или последовательный потенциалы действия с помощью квадратного импульса 0,5 или 1 мс 20 В. Максимально минимизируйте общее время сбора данных, чтобы избежать обесцвечивания сигнала.
ПРИМЕЧАНИЕ: Даже при записи в центре волокна может возникнуть сигнал флуоресценции, связанный с движением, который может быть перепутан с флуоресцентным сигналом из-за конформационного изменения белка-флуорофора (рис. 5D). Сигнал, вызванный сокращением, должен быть задержан по сравнению с ожидаемым временем движения заряда после стимуляции37. - Чтобы дополнительно отличить сигнал, возникающий от движений S4, от сигнала, вызванного сокращением волокна, добавьте 1 мкл 100 мМ N-бензил--толуолсульфонамида (BTS; конечная концентрация 50 мкМ) в регистрирующий раствор, чтобы свести к минимуму сократительные реакции, и повторите шаг 6.4. Сигналы, обнаруженные во второй раз после фармакологической иммобилизации волокна, соответствуют молекулярному движению меченой спирали S4 (рис. 5D).
ПРИМЕЧАНИЕ: Ни один сигнал не должен быть обнаружен в контроле EGFP-CaV1.1 без инженерного цистеина после подавления движения с помощью BTS. - Используя те же настройки, получите аналогичный сигнал в месте внутри тарелки, где нет ни мышечного волокна, ни мусора, чтобы получить значение фоновой флуоресценции.
- Импортируйте файлы, содержащие временной ход необработанной флуоресценции [Fr(t)] из волокна и фоновой флуоресценции [Fb(t)], в программное обеспечение для анализа данных. Усредните столбец, содержащий Fb(t), чтобы получить однородное значение Fb. Вычтите Fb из Fr (t), чтобы получить значения абсолютной флуоресценции [F (t)]. При необходимости сгладьте полученный сигнал с помощью функции сглаживания.
ПРИМЕЧАНИЕ: При такой системе детектирования и частоте сбора данных мы решили использовать функцию усреднения смежных областей с окном в 50 пунктов для сглаживания. - Усредните исходные значения F(t) за 10 мс до стимуляции, чтобы получить значение флуоресценции в состоянии покоя (F0). Вычтите F0 из сглаженного F(t), чтобы получить абсолютное изменение флуоресценции [ΔF(t)]. Затем, чтобы выразить изменение флуоресценции с течением времени относительно флуоресценции в состоянии покоя (ΔF/F0), разделите ΔF(t) на F0.
- Чтобы оценить степень обесцвечивания сигнала, определите две точки от сигнала ΔF/F0 во времени, до и после стимуляции и вдали от флуорометрического сигнала. Подгоните линейную функцию к этим двум точкам, чтобы получить базовую трассировку. Вычтите базовую линию до ΔF/F0 с течением времени, чтобы скорректировать обесцвечивание сигнала.
- Вычтите из столбца времени задержку между началом сбора и сигналом обратной связи от стимуляции, чтобы получить t = 0, соответствующее началу электрического стимула.
ПРИМЕЧАНИЕ: Чтобы разрешить многократное сравнение сигналов, часто требуется нормализовать амплитуду сигнала. В зависимости от цели эксперимента могут использоваться различные подходы. В следующем разделе результатов нас интересовала кинетика сигнала, поэтому мы использовали простой метод, состоящий из нормализации каждого сигнала по минимальному достигнутому значению (т.е. отрицательному пику).
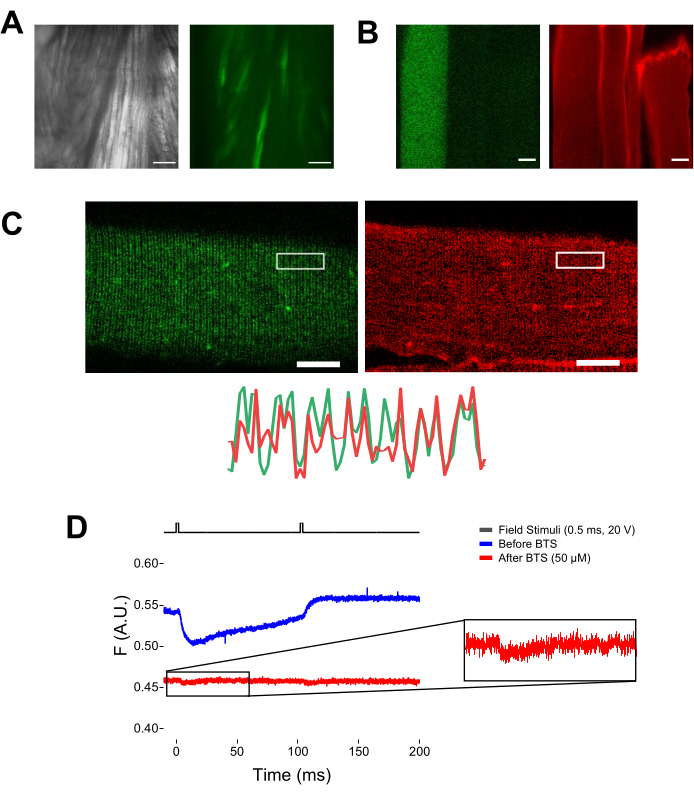
Рисунок 5: Визуализация мышечного волокна, экспрессирующего EGFP-CaV1.1-cys, без окрашивания MTS-5-TAMRA и с репрезентативной необработанной флуорометрической записью. (A) Примеры передаваемых (слева) и флуоресцентных (справа) изображений рассеченной, не диссоциированной мышцы, экспрессирующей конструкцию EGFP-CaV1.1 VSD-III. Масштабная линейка: 100 мкм. (B) Репрезентативное изображение мышечного волокна, экспрессирующего конструкцию EGFP-CaV 1.1VSD-III, до (слева) и после (справа) окрашивания MTS-5-TAMRA. Эндогенные цистеины нетрансфицированных волокон также окрашиваются красителем. Масштабная линейка: 30 мкм. (C) Конфокальное изображение конструкции EGFP-Ca V1.1VSD-III (слева) и окрашивание MTS-5-TAMRA (справа) показывают классический двухполосный рисунок, характерный для локализации CaV1.1 на поперечной системе канальцев мышечного волокна (внизу). Масштабная линейка: 25 мкм. (D) Репрезентативная флуорометрическая запись в ответ на два стимула и измеренная с помощью фотодиода до (синий след) и после (красный след) иммобилизации волокна N-бензил--толуолсульфонамидом (BTS). Верхняя черная линия указывает на протокол деполяризации волокна с помощью стимуляции внешним полем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Когда распространяющиеся потенциалы действия срабатывают в ответ на повторяющуюся стимуляцию поля, можно отслеживать определенное движение датчика напряжения в ответ на определенную частоту деполяризации. Как показано на рисунке 6A, движение спиралей, помеченных VSD-II,...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Здесь описан пошаговый протокол проведения FSDF в мышечных волокнах для исследования движений отдельных датчиков напряжения от канала CaV1.1. Несмотря на то, что количество этапов и разнообразие подходов, которые сочетаются в этой технике, могут показаться сложными, большинство из э?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов.
Благодарности
Мы благодарим доктора Джей Вергару (Калифорнийский университет, Лос-Анджелес) за то, что он поделился плазмидой дикого типа EGFP-CaV1.1 (кролик). Мы благодарим лабораторию электроники Йельского факультета физиологии и особенно Хенрика Абильдгаарда за проектирование и создание фотодиода с дорожкой и цепью удержания. Эта работа была поддержана грантами Национального института здравоохранения R01-AR075726 и R01-NS103777
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
Ссылки
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915(2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. Excitation-Contraction Coupling in Skeletal Muscle. , McGraw-Hill. New York. (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. Muscle: Fundamental Biology and Mechanisms of Disease. , Academic Press, Elsevier. 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22(2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118(2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520(2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6(2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109(2022).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены