需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
聚乙二醇水凝胶中的肿瘤球状体制造和封装用于研究球状体-基质相互作用
摘要
在这里,我们提出了一种方案,可以快速、稳健和廉价地制造肿瘤球体,然后进行水凝胶封装。它广泛适用,因为它不需要专门的设备。它对于探索球状体-基质相互作用和建立 体外 组织生理学或病理学模型特别有用。
摘要
球状体的三维 (3D) 封装对于充分复制肿瘤微环境以实现最佳细胞生长至关重要。 在这里,我们设计了一个用于球状体封装的 体外 3D 胶质母细胞瘤模型,以模拟肿瘤细胞外微环境。 首先,我们使用聚二甲基硅氧烷形成方形金字塔形微孔模具。然后使用这些微孔模具制造肿瘤球体,其尺寸严格控制在50-500μm之间。 一旦球状体形成,它们就会被收获并封装在聚乙二醇(PEG)基水凝胶中。PEG水凝胶是球状体封装的多功能平台,因为水凝胶的刚度、降解性和细胞粘附性等特性可以独立调节。 在这里,我们使用具有代表性的软(~8 kPa)水凝胶来封装胶质母细胞瘤球状体。 最后,开发了一种通过共聚焦显微镜获得高质量图像的球状体染色和成像方法。 由于致密的球状体核心和相对稀疏的外围,成像可能很困难,但使用透明溶液和共聚焦光学切片有助于缓解这些成像困难。 总之,我们展示了一种制造均匀球体的方法,将它们封装在PEG水凝胶中,并对封装的球体进行共聚焦显微镜检查,以研究球体生长和各种细胞-基质相互作用。
引言
肿瘤球体已成为研究癌症病因、病理学和药物反应性的有用体外工具1。传统上,球状体是在低粘附板或生物反应器等条件下培养的,其中细胞间粘附优于细胞表面粘附2。然而,现在人们认识到,为了更忠实地概括肿瘤微环境,体外球状体模型应该同时捕获细胞-细胞和细胞-基质相互作用。这促使多个小组设计支架,例如水凝胶,其中球体可以封装3,4。这种基于水凝胶的球状体模型能够阐明细胞-细胞和细胞-基质对各种细胞行为的相互作用,例如活力、增殖、干性或治疗反应性3。
在这里,我们描述了一种在聚乙二醇(PEG)水凝胶中封装胶质母细胞瘤球状体的方案。有多篇关于胶质母细胞瘤细胞球状体包封在水凝胶中的文献报道。例如,通过将 U87 细胞封装在装饰有 RGDS 粘附配体的 PEG 水凝胶中并与酶可裂解肽交联来形成球状体,以确定水凝胶刚度对细胞行为的影响5。U87细胞也已在其他基于PEG或基于透明质酸的水凝胶中形成,以扩大癌症干细胞群6或探索基质介导的化疗耐药机制7,8,9。胶质母细胞瘤球状体也被封装在明胶水凝胶中,以研究小胶质细胞和癌细胞之间的串扰及其对细胞侵袭的影响10。总体而言,此类研究证明了基于水凝胶的体外模型在了解胶质母细胞瘤病理学和设计治疗方法方面的效用。
此外,还有用于肿瘤球状体制造和水凝胶封装的不同方法11。例如,分散的细胞可以接种在水凝胶中,并允许随着时间的推移形成球状体5,12。这种方法的一个缺点是形成的球体的多分散性,这可能导致不同的细胞反应。为了产生均匀的球状体,可以将细胞封装在微凝胶中并长时间培养,直到它们侵入并重塑凝胶13,或者可以将细胞沉积在具有球形"孔"的模板化凝胶中并允许聚集14。这些方法的缺点是它们的相对复杂性,需要液滴发生器或其他方式来形成微凝胶或凝胶中的"孔",以及球状体生长和成熟所需的时间。或者,球状体可以在微孔9,15,16或悬挂板17,18中预先形成,然后封装在水凝胶中,类似于此处描述的技术。这些方法更简单,可以以更高的通量方式完成。有趣的是,已经表明球状体形成方法可以影响球状体细胞的行为,例如基因表达、细胞增殖或药物反应性19,20。
在这里,我们专注于胶质母细胞瘤,因为它是一种实体瘤,其天然环境是柔软的纳米多孔脑基质21,可以用柔软的纳米多孔水凝胶来模拟。胶质母细胞瘤也是最致命的脑癌,目前尚无治愈方法22.然而,这里描述的方案可用于封装代表任何实体瘤的球状体。我们选择使用通过迈克尔型加成反应23形成的PEG水凝胶。PEG 是一种合成的、不可降解的、生物相容性的水凝胶,具有惰性,可作为支架和物理细胞支撑,但不支持细胞附着23。细胞粘附性可以通过全蛋白或粘附配体的拴系24单独添加,并且可以通过PEG聚合物链的化学修饰或水解或酶促降解的交联剂25,26来增加可降解性。这允许独立于机械或物理水凝胶特性调整生化特性,这在研究细胞-基质相互作用时可能是有利的。迈克尔型凝胶化学是选择性的,发生在生理条件下;因此,它允许通过简单地将球状体与水凝胶前体溶液混合来封装球体。
总的来说,这里介绍的方法有几个值得注意的特点。首先,在多孔组件中制造肿瘤球体高效、快速,并且所需材料的成本低。其次,球状体以各种尺寸大批量生产,具有低多分散性。最后,只需要市售材料。通过探索底物特性对球状细胞活力、环状度和细胞干性的影响,说明了该方法的实用性。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 溶液制备
- 聚二甲基硅氧烷(PDMS)前驱体溶液的制备
- 制备负PDMS前驱体溶液(也用于胶水前驱体溶液)。用刮刀将弹性体舀入称重舟中并称重。将固化剂以 1:10 的比例添加到弹性体基材中。使用塑料称重舟中的刮刀轻轻彻底地混合PDMS和固化剂。
注意:将该PDMS前体溶液倒入6孔方形金字塔形微孔板中以形成负模。这与用于胶水前体溶液的溶液相同。 - 制备正PDMS前体溶液。用刮刀将弹性体底座舀入称重舟中并称重。将固化剂以 1:9 的比例添加到弹性体基体中。使用塑料称重舟中的刮刀轻轻彻底地混合PDMS和固化剂。
注意:该PDMS前体溶液随后倒入负极模具上以形成正极模具。
- 制备负PDMS前驱体溶液(也用于胶水前驱体溶液)。用刮刀将弹性体舀入称重舟中并称重。将固化剂以 1:10 的比例添加到弹性体基材中。使用塑料称重舟中的刮刀轻轻彻底地混合PDMS和固化剂。
- pH 8的0.3 M三乙醇胺(TEA)缓冲液的制备
- 使用移液器辅助工具将 1 mL TEA 和 9 mL 1x 磷酸盐缓冲盐水 (PBS) 移液至 50 mL 锥形中,以制备 0.75 M TEA 溶液。使用 1 N HCl 或 1 N NaOH 将溶液滴定至 pH 值为 8。然后,加入足够的 1x PBS 以达到 25 mL 的最终体积,以达到 0.3 M 的最终 TEA 浓度,pH 值为 8。
注意: 将 HCl 和 NaOH 溶液储存在室温 (RT) 的易燃柜中。搬运时穿戴个人防护装备。
- 使用移液器辅助工具将 1 mL TEA 和 9 mL 1x 磷酸盐缓冲盐水 (PBS) 移液至 50 mL 锥形中,以制备 0.75 M TEA 溶液。使用 1 N HCl 或 1 N NaOH 将溶液滴定至 pH 值为 8。然后,加入足够的 1x PBS 以达到 25 mL 的最终体积,以达到 0.3 M 的最终 TEA 浓度,pH 值为 8。
- 制备完整介质
- 要制备完整的培养基,将 10% (w/v) 或 56 mL 胎牛血清和 1% (w/v) 或 5.6 mL 青霉素和链霉素加入 500 mL RPMI 培养基中。
- 使用前将溶液置于37°C10-20分钟或直到溶液变热。
- 将溶液储存在0-4°C长达6个月。
- 制备20%(w/v)聚乙二醇(PEG)储备溶液
注:计算基于 100 μL 溶液,可根据需要按比例放大或缩小。- 要制备 20% w/v 4 臂 PEG-丙烯酸酯 (4-arm PEG-Ac) 的 100 μL 储备溶液,在微量离心管中称量 20 mg 4 臂 PEG-Ac 粉末。加入 70 μL 0.3 M TEA 缓冲液,然后涡旋溶液约 30 秒或直至完全溶解。通过加入足够的TEA缓冲液(~27μL)以达到100μL的最终溶液体积,考虑由于粉末溶解引起的体积变化。
- 要制备 20% w/v PEG-diSH 的 100 μL 储备溶液,请在微量离心管中称取 20 mg PEG-diSH 粉末。加入 70 μL TEA 缓冲液,然后涡旋溶液约 30 秒或直至完全溶解。通过加入足够的TEA缓冲液(~27μL)以达到100μL的最终溶液体积,考虑由于粉末溶解引起的体积变化。
注意:PEG粉末具有很强的吸湿性,需要储存在-20°C的干燥容器中。 将其从冰箱中取出时,让 PEG 粉末解冻 10 分钟,然后打开瓶子称量粉末。在将瓶子放回冰箱之前,用氮气或氩气等惰性气体吹扫瓶子以置换潮湿的空气。4臂PEG-Ac的储备溶液可以在使用前在4°C下储存长达2周。PEG-diSH的储备溶液需要在使用前立即制备,并且不能储存,因为硫醇基团相互反应形成二硫键。
- 2% v/v基底膜基质溶液的制备
- 要制备 2% v/v 基底膜基质工作溶液,将 20 μL 基底膜基质(无 LDEV)加入 9.98 mL 完全培养基中,并通过上下移液 ~10 次充分混合。在4°C(冰上)制备溶液,然后将其加热至37°C(在烤箱或培养箱中)并立即使用。
注意:基底膜基质将在>10°C下开始形成凝胶,因此请务必在2-6°C下将基底膜基质溶液与完全培养基混合。 步骤 1.3 中描述了完整的介质组合。
- 要制备 2% v/v 基底膜基质工作溶液,将 20 μL 基底膜基质(无 LDEV)加入 9.98 mL 完全培养基中,并通过上下移液 ~10 次充分混合。在4°C(冰上)制备溶液,然后将其加热至37°C(在烤箱或培养箱中)并立即使用。
- 细胞固定液的制备
- 要制备含有 4% w/v 多聚甲醛和 0.1% v/v 非离子表面活性剂的 1 mL 细胞固定溶液,首先混合 891 μL 的 1x PBS 和 108 μL 多聚甲醛(37% w/v 浓度),然后加入 1 μL 非离子表面活性剂(100% 浓度)。充分混合溶液。
注意:每次进行固定时,固定溶液都应新鲜。
注意:多聚甲醛是易燃的,可能在空气中形成可燃粉尘浓度。它会引起皮肤刺激和严重的眼睛损伤。避免吸气,因为它可能会引起呼吸道刺激。在化学通风橱中处理多聚甲醛并穿戴个人防护装备。处理后彻底洗手。非离子表面活性剂会引起皮肤刺激和严重的眼睛损伤。搬运时戴上防护手套和护目镜或面部防护装置。为避免释放到环境中,请在化学通风橱中打开瓶子。处理后彻底洗手。
- 要制备含有 4% w/v 多聚甲醛和 0.1% v/v 非离子表面活性剂的 1 mL 细胞固定溶液,首先混合 891 μL 的 1x PBS 和 108 μL 多聚甲醛(37% w/v 浓度),然后加入 1 μL 非离子表面活性剂(100% 浓度)。充分混合溶液。
- 染色溶液的制备
- 要制备 3 mM 的 3,3'-二己基氧杂羰花青碘化物 (DiOC),将 2.65 mg DiOC 混合在 1 mL DMSO 中。
- 要制备 1.5 mM 碘化丙啶溶液 (PI),将 1 mg PI 混合在 1 mL 去离子水中。
- 球状体清除溶液的制备
- 在 1x PBS 中制备 20%、40% 和 80% v/v 甲酰胺的澄清溶液,用于球状体澄清。
- 要制备 10 mL 的 20% v/v 甲酰胺,将 8 mL 的 1x PBS 和 2 mL 的甲酰胺混合。要制备 10 mL 40% v/v 甲酰胺,请混合 6 mL 1x PBS,然后混合 4 mL 甲酰胺。要制备 10 mL 80% v/v 甲酰胺,将 2 mL 的 1x PBS 和 8 mL 甲酰胺混合。
- 将甲酰胺和1x PBS混合后,通过涡旋约30秒混合溶液。
- 在 1x PBS 中制备 20%、40% 和 80% v/v 甲酰胺的澄清溶液,用于球状体澄清。
2. 方形金字塔形微孔的制备
- 如 图1所示,制造方形金字塔形微孔的负PDMS模具。
- 准备 2 g (~1 mL) 负性 PDMS 前体溶液,并将其倒入 6 孔方形金字塔形母模的一个孔中。请注意,1 mL 完全覆盖板的一个孔。用PDMS覆盖母模后,将6孔方形金字塔板放入真空干燥器中,使PDMS前体溶液脱气30分钟。然后,通过将板放入60°C烘箱中24小时来固化PDMS。
注意: 确保取下板盖进行脱气并重新盖上进行固化。在真空干燥器中或用惰性气体(如氮气或氩气)吹扫溶液。如果负性模具前体溶液在 30 分钟后仍有气泡,表明脱气不充分,请将其放入真空干燥器中再放置 30 分钟。同时使用一个或多个板孔来制备一个或多个PDMS负模。可以使用不同尺寸的方形金字塔形微孔,如400和800μm边长,如 表1所示。无论方形金字塔尺寸如何,都使用相同数量的 PDMS。 - 一旦PDMS在仍然温暖的情况下固化,用刮刀小心地从主模具中取出负性PDMS模具,并使用活检冲床在直径为35毫米的板坯上切割负性模具。放入培养皿中,盖上盖子,继续RT固化24小时。
注意: 要去除负极模具,请使用刮刀在孔板和 PDMS 模具之间,然后轻轻将负极模具从主模具中拉出。模具被切割成 35 毫米的板坯,以适合 35 毫米的培养皿。模具可以制成其他尺寸,以适合不同直径的板材。35 mm 负模板可以储存,在室温下防尘,并重复使用 6 个月。
- 准备 2 g (~1 mL) 负性 PDMS 前体溶液,并将其倒入 6 孔方形金字塔形母模的一个孔中。请注意,1 mL 完全覆盖板的一个孔。用PDMS覆盖母模后,将6孔方形金字塔板放入真空干燥器中,使PDMS前体溶液脱气30分钟。然后,通过将板放入60°C烘箱中24小时来固化PDMS。
- 制备方形金字塔形微孔的正PDMS模具。
- 将负PDMS模具的35 mm板放入35 mm培养皿中,纹理微孔朝上。
- 如上所述制备2.5g(~1.2mL)阳性PDMS前体溶液,并将其倒入35mm培养皿中的负极模具上,以完全覆盖负极模具。然后如上所述将前驱体溶液脱气30分钟,并将其放入60°C烘箱中3-4小时。
注意:由于PDMS是粘性的,因此被困在负极模具下的空气会形成气泡。如果负模下形成气泡,请用刮刀轻轻向下推模具以释放气泡。如果气泡残留,继续脱气 30 分钟,或用刮刀轻轻搅拌正模溶液,直至气泡爆裂。 - PDMS正模固化后,从35毫米培养皿中取出模具,并立即从负极模具中剥离正极模具。
注意:时机对于正模的成功剥离很重要。去除时,最好用剃须刀轻轻切开正极模具,露出正负极模具之间的界面,然后将模具相互剥离。然后剥离圆形模具的边缘。轻轻地从正极模具上剥离负极模具。
- 将模具粘在 48 孔板的孔底部。
注意:这里使用 48 孔板,但只要将模板切割成正确的直径(例如,6 孔板的直径为 96 毫米),就可以使用其他板。- 使用 10 毫米活检冲床将正模切成板。
注意: 从一个直径为 35 毫米的正模中可以切割大约 4 个模具(每个直径为 10 毫米)。 - 为了将模具粘合到48孔板的底部,如前所述27制备PDMS胶水前体溶液(~0.5mL或1g)。用镊子将10mm正模的平坦面(不是带有微孔图案的一侧)轻轻浸入PDMS前体溶液中。小心地将 48 孔板的每个孔放置一个模具,然后使用镊子轻轻将每个模具压到孔底。将组装好的板放在60°C烘箱中4-24小时,使PDMS胶水固化。
注意:如果PDMS胶水前体溶液沾到正模微孔上,可以用软纸擦掉,并可以重复该步骤。粘合时,确保胶水没有覆盖微孔。 - 使用 1000 μL 移液管向 48 孔板的每个孔中加入 300 μL 70% 乙醇,对模具进行灭菌。吸出70%乙醇,并将48孔板在紫外线(302nm)下未覆盖的组织培养罩中放置2小时。
注意: 模具可以使用 6 个月,并根据需要重新消毒。
- 使用 10 毫米活检冲床将正模切成板。
3. 多细胞肿瘤球状体的形成、收获和水凝胶包封
注意:本节中概述的方案适用于U87人胶质母细胞瘤细胞系(参见 图1 和 图2),但类似的方案可用于其他癌细胞类型。
- 多细胞肿瘤球状体形成
- 首先用抗粘冲洗溶液洗涤微孔模具,方法是使用 1000 μL 移液管向每个孔中加入 300 μL 溶液。然后,以1620× g 离心3分钟,并使用真空泵和巴斯德移液管吸出溶液。
注意:在细胞接种之前立即执行此步骤。 - 在37°C下,将细胞暴露于每cm2 培养瓶面积的~80μL0.25%胰蛋白酶/ EDTA5分钟。 例如,1 mL 胰蛋白酶/EDTA 适用于 T-25 细胞培养瓶。通过加入相同体积的完全细胞培养基来中和胰蛋白酶。例如,向含胰蛋白酶的 T-25 细胞培养瓶中加入 1 mL 完全培养基。从组织培养瓶中收集细胞。
- 将 10 μL 细胞悬液转移到血细胞计数器的每个端口中进行细胞计数。使用倒置显微镜计数细胞总数,并从至少 8 个象限中平均该细胞计数,确保每个血细胞计数器象限中的细胞数为 20-50,以获得良好的细胞计数结果。将计算出的数字乘以 104 以确定最终细胞浓度。
- 将收集的细胞重悬于补充有10%胎牛血清和1%青霉素/链霉素的完整RPMI细胞培养基中,达到所需的最终细胞浓度,具体取决于所需的球状体大小,如 表1所示。
注意:800 μm 微孔将在 48 孔板的一个孔中产生 ~75 个球体,而 400 μm 微孔将在 48 孔板的一个孔中产生 ~300 个球体。 - 将500μL所需浓度的细胞悬液置于微孔中,并将板以1620× g 离心3分钟。将板置于37°C和5%CO2 的加湿培养箱中24小时,以形成球状体。
注意:如果不形成球状体,则可以使用基底膜基质的2%v / v与完全培养基相结合来重悬细胞(步骤1.5中的更多详细信息)。
- 首先用抗粘冲洗溶液洗涤微孔模具,方法是使用 1000 μL 移液管向每个孔中加入 300 μL 溶液。然后,以1620× g 离心3分钟,并使用真空泵和巴斯德移液管吸出溶液。
- 球体收获
- 使用 1000 μL 移液器,将 500 μL 完全培养基牢固地移液到孔中。使用孔中的 500 μL 培养基,通过在象限上下移液三到四次来冲洗孔的四个象限(特别是顶部、底部、左侧和右侧象限)以去除球状体。使用 1000 μL 移液管轻轻吸入含有球状体(总共~1000 μL)的培养基到微量离心管中,并使球状体沉降到底部。
- 除去上清液并将球状体重悬至所需的最终浓度。例如,为了在封装后在 20 μL 凝胶中获得 ~8 个球体,将球体重悬于 100 μL 培养基中,在球体悬浮液中产生 ~75 个球体/100 μL 的球体浓度。
- 球状体封装在水凝胶中,如 图2所示。
- 为了制备 100 μL 的 10% w/v PEG 水凝胶前体溶液,将 50 μL 球状悬浮液混合,然后加入 30 μL 20% w/v 4 臂 PEG-Ac,最后在微量离心管中加入 20 μL 20% w/v PEG-diSH。这将给出丙烯酸酯 (Ac) 与硫醇 (SH) 基团的化学摩尔比,确保最佳交联。通过上下移液~10次混合凝胶前体溶液。
注意:可以根据需要更改水凝胶成分、体积和聚合物协同作用。所得水凝胶将缓慢降解且非细胞粘附剂。为了使水凝胶细胞具有粘附性,可以添加粘附配体,例如RGDS。为了使水凝胶可酶降解,可以添加两端含有半胱氨酸残基的酶促降解肽交联剂。转移球状体时,轻轻移液两次以去除球状体并将它们悬浮液,以确保球状体均匀分布。 - 将 20 μL 凝胶前体溶液移液在两个衬有 1 mm 硅垫片的封口膜衬里载玻片之间移液,并将载玻片与凝胶前体溶液置于 37 °C、5% CO2 培养箱中 15 分钟以允许凝胶化。
注意: 确保两个载玻片被封口膜覆盖,以形成疏水表面,以便在凝胶化时易于剥离。可以使用疏水涂层溶液代替封口膜。20 μL 体积的水凝胶前体溶液在膨胀前将产生直径为 ~6 毫米、高度为 1 毫米的水凝胶板。可以使用任何间隔物类型和厚度,但建议凝胶厚度保持在或低于 1 毫米(较厚的水凝胶会限制氧气扩散和营养物质向细胞的运输),但大于球体直径(以便球体完全封装在凝胶中)。可以使用任何体积的水凝胶前体溶液。20-30 μL 凝胶适用于 24 孔板。 - 水凝胶凝胶凝胶化完成后,将两个载玻片分开,然后用刮刀轻轻将凝胶从玻璃板上剥离。将凝胶放入 24 孔板中,每孔一个,确保含有球体的表面朝上。
注意:在凝胶化过程中,球状体会落到凝胶的底部,因此将它们倒置进行培养将确保球状体靠近水凝胶表面,以便更好地获得营养和氧气。凝胶化可以通过观察残留在微量离心管中的任何水凝胶前体溶液来监测,而不是通过倒置管并注意凝胶停止流动的时间来形成板坯。 - 向每个孔中加入完全培养基(~500μL),并确保水凝胶完全浸没。将多孔板置于37°C和5%CO2 的湿润培养箱中,每2-3天更换一次培养基培养细胞。
注意:水凝胶可以培养长达 4 周或直到水凝胶降解,每隔一天更换一次培养基。
- 为了制备 100 μL 的 10% w/v PEG 水凝胶前体溶液,将 50 μL 球状悬浮液混合,然后加入 30 μL 20% w/v 4 臂 PEG-Ac,最后在微量离心管中加入 20 μL 20% w/v PEG-diSH。这将给出丙烯酸酯 (Ac) 与硫醇 (SH) 基团的化学摩尔比,确保最佳交联。通过上下移液~10次混合凝胶前体溶液。
4.荧光染色
- 细胞活力
- 使用染色剂 3,3'-二己基氧杂羰花青碘化物 (DiOC) 对所有细胞的线粒体和内质网进行染色,以确定细胞活力。使用浓度为 0.02 μg/mL 的 DiOC (3 mM)。具体来说,使用20μL移液管将每1000μL培养基中加入2μL DiOC到培养解离细胞的烧瓶中(在第3节中球状体形成过程之前至少24小时)。等待 24 小时让 DiOC 染色细胞。
- 使用核和染色体染色剂,碘化丙啶,PI(1.50mM),仅进入死细胞。要对细胞进行染色,首先吸出所有培养基并使用 1000 μL 移液管加入 500 μL 1x PBS 冲洗凝胶,使凝胶完全浸没。
- 吸出 PBS 并加入 500 μL 新鲜培养基,然后向每个孔中加入 30 μL PI 溶液(即每 100 μL 培养基 6 μL)。用铝箔盖住孔板以保护其免受光线照射。将孔板置于37°C和5%CO2 的培养箱中,并等待30分钟,让PI染色死细胞。
- 取下箔片并从孔中吸出培养基。使用 1000 μL 移液管加入 500 μL 1x PBS 浸没水凝胶。吸出 1x PBS 并重复冲洗两次。向每个孔中加入 500 μL 培养基,并在荧光倒置显微镜或共聚焦显微镜下成像。
- 通过比较 DiOC(所有细胞)与 PI(死细胞)的面积来计算细胞活力,如公式 1 所示,使用来自共聚焦显微镜或倒置荧光显微镜的 z 堆栈图像。
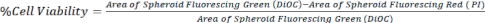 方程 1.
方程 1.
5. 包封球体的免疫荧光固定、染色、透明和成像
- 固定和染色
- 从培养水凝胶的孔中吸出培养基,并通过将 500 μL 1x PBS 直接移液到水凝胶上冲洗水凝胶。轻轻吸出 1x PBS。
- 使用 1000 μL 移液管每孔加入 500 μL 体积的固定溶液,将球状体固定在 24 孔板中。让固定剂在室温下浸泡凝胶30分钟,使用1000μL移液管取出固定溶液并丢弃在指定的废物容器中。
- 通过向每个孔中加入 500 μL 1x PBS 冲洗水凝胶。使用 1000 μL 移液管吸出 1x PBS,并重复 PBS 冲洗两次。将孔板储存在4°C下每孔500μL1x PBS中长达1周或立即使用。
注意:吸气PBS和固定溶液时,注意不要将水凝胶拉入移液管。通过将板倾斜到 ~45 度角来做到这一点,这将有助于看到水凝胶并防止意外误吸。
注意:甲醛在吸入和接触时有毒。在化学通风橱中戴上手套处理。 - 为了对细胞进行染色,将水凝胶封装的球状体与巢蛋白 (200 μg/mL) 和 SOX2 (200 μg/mL) 一抗以 1:200 的抗体稀释度孵育:PBS。使用 1000 μL 移液器从孔中抽出 1x PBS。向每个孔中加入 50 μL 稀释的抗体。等待 24 小时完成染色。然后,使用 1000 μL 移液管除去染色溶液并适当丢弃废物。
- 使用 1000 μL 移液管加入 500 μL 1xPBS,足以浸没水凝胶。吸气 PBS 并重复两次。在立即成像或成像之前,将染色和浸没的水凝胶储存在4°C的1x PBS中长达2周。
注意:根据抗体的不同,可能需要进行细微的优化,以确保正确的染色。浓度(1:200)和时间(24小时)明显高于典型的2D单层细胞培养,因为3D染色需要通过水凝胶和球状体扩散。
- 对球状体进行染色后,清除球状体,通过用甲酰胺的连续浓度增加(可选)代替PBS来提高成像的透明度。
- 从每个孔中吸出 1x PBS。向每个孔中加入 500 μL 20% (v/v) 甲酰胺,并让水凝胶孵育 90 分钟。使用 1000 μL 移液管吸出甲酰胺,并将废物收集在废物容器中。
- 向孔中加入 500 μL 40% (v/v) 甲酰胺。让水凝胶在溶液中孵育90分钟。吸出甲酰胺并将废物收集在废物容器中。
- 向每个孔中加入 500 μL 80% v/v 甲酰胺并孵育 90 分钟。吸出甲酰胺并丢弃在废物容器中。加入 500 μL 100% (v/v) 甲酰胺,并在成像前孵育 24 小时。清理完成后,通过实验室废物管理系统的适当服务妥善处理甲酰胺废物。
注意:清除允许对球状体的核心进行共聚焦成像,如果仅研究椭球体的外围,则可以选择。
- 使用共聚焦显微镜对水凝胶封装的球状体进行成像。
注意:任何显微镜 - 倒置、荧光或共聚焦 - 都可用于细胞成像;然而,共聚焦允许分离单个平面。- 将水凝胶置于带有玻璃盖玻片底部的腔室孔中,并将球状体尽可能靠近盖玻片放置。
注意: 可以使用玻璃盖玻片或带有玻璃盖玻片底部的腔室孔。保持水凝胶水合至关重要,因为脱水样品会导致成像质量差。 - 使用长工作距离物镜 (10x-20x) 对样品进行成像,以便使用 Z 堆栈深入球体进行成像以进行 3D 重建。
注意:更高的放大倍率物镜允许更详细的成像和光学切片,但会牺牲图像深度。 - 使用公式 2 量化光学截面中存在的信号量相对于已清除和未清除信号的椭球体总面积。
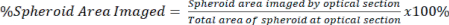 方程2
方程2
- 将水凝胶置于带有玻璃盖玻片底部的腔室孔中,并将球状体尽可能靠近盖玻片放置。
Access restricted. Please log in or start a trial to view this content.
结果
基于球状体的药物筛选平台用于研究化疗效果,由于强调在复制天然组织的生物材料中球状体封装后调节肿瘤微环境,因此越来越受到追捧。在这里,我们开发了一种多细胞肿瘤球状体制备方法,随后在3D水凝胶中进行封装和成像。在微孔模具中制备球体(图3A,B),从而产生具有球形形状和严格控制的多分散性的球体。例如,对于每个微孔有 3,300 个细胞的球?...
Access restricted. Please log in or start a trial to view this content.
讨论
基于水凝胶的多细胞肿瘤球状体模型正在越来越多地被开发,以推进癌症治疗的发现11,13,29。它们是有益的,因为它们以可控的方式模拟肿瘤微环境的关键参数,尽管它们很复杂,但比体内模型更简单、更便宜,并且许多与高通量筛选技术兼容。水凝胶生物材料可以被调整以模拟肿瘤细胞外基质并促进细胞-基质相互作用,而球...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
这项工作由圣路易斯大学向 Silviya P Zustiak 博士提供的启动资金以及圣路易斯大学亨利和阿米莉亚·纳斯鲁拉神经科学中心授予 Silviya P Zustiak 博士的种子基金资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 70% Ethanol | Fisher Scientific | LC22210-4 | |
| 15 mL Conicals | FALCON | 352097 | |
| 24-Well Plate Ultra Low Attachment plates | Fisher Scientific | 07-200-602 | |
| 35 mm Petri Dish | Amazon | 706011 | |
| 4-arm poly(ethylene glycol)-acrylate (4-arm PEG-Ac; 10 kDa) | Laysan Bio | ACRL-PEG-ACRL-10K-5g | |
| 50 mL Conicals | Fisher Scinetific | 3181345107 | |
| 6-well AggreWell 400 | StemCell Technologies, Vancouver, Canada | 34421 | Square pyramidal microwells |
| anti-adherence rinsing solution | StemCell Technologies, Vancouver, Canada | Cat #: 07010 | |
| Aspartic Acid-Arginine-Cysteine-Glycine-Valine-Proline-Methionine-Serine-Methionine-Arginine-Glycine-Cysteine-Arginine- Aspartic Acid (DRCG-VPMSMR-GCRD) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Chemical Fume Hood | KEWAUNEE | 99151 | |
| Corning Matrigel Basement Membrane Matrix, LDEV Free | Corning | 356234 | Basement membrane matrix |
| Detergent - Triton-X | Sigma Aldrich | T8787 | Nonionic surfactant |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | BP231-100 | |
| Disposable Pipettes (1 mL, 2 mL, 5 mL, 10 mL, 25 mL, 50 mL) | Fisher Scinetific | 1 mL: 13-678-11B, 2mL: 05214038, 5mL(FALCON): 357529, 10mL: 13-678-11E, 25mL: 13-678-11, 50mL: 13-678-11F | |
| Fetal Bovine Serum | HyClone | SH30073-03 | |
| Formaldehyde 37% Solution | Sigma Aldrich | F1635 | |
| Glass Plates | Slumpys | GBS4100SFSL | |
| Glass Transfer Pipettes | Fisher Scinetific | 5 3/4": 1367820A, 9":136786B | |
| Glycine-Arginine-Cysteine-Aspartic Acid-Arginine-Glycine-Aspartic Acid-Serine (GRCD-RGDS) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Hemacytometer | Bright-Line | 383684 | |
| Hydrophobic solution - Repel Silane | GE Healthcare Bio-Sciences | 17-1332-01 | |
| Incubator | NUAIRE | NU-8500 | |
| Inverted Microscope (Axiovert 25) | Zeiss | 663526 | |
| Invitrogen DiOC16(3) (3,3'-Dihexadecyloxacarbocyanine Perchlorate) | Fisher Scientific | D1125 | |
| Leica Confocal SP8 | Leica Microsystems Inc. | ||
| Light and Flourescent Microscope (Axiovert 200M) | Zeiss | 3820005619 | |
| Micro centrifuge tubes | Fisher Scientific | 2 mL: 02681258 | |
| Microscope Software | Zeiss | AxioVision Rel. 4.8.2 | |
| Nestin Alexa Fluor 594 | Santa Cruz Biotechnology | sc-23927 | |
| Parafilm | PARAFILM | PM992 | |
| PBS (1x), pH 7.4 | HyClone | SH30256.01 | |
| Penicillin Streptomycin | MP Biomedicals | 1670046 | |
| Pipette Aid | Drummond Scientific Co. | P-76864 | |
| Pipette Tips (1–200 µL, 101–1000 µL) | Fisher Scinetific | 2707509 | |
| Plastic Standard Disposable Transfer Pipettes | Fisher Scientific | 13-711-9D | |
| Plastic Weigh Boats (100 mL) | Amazon | mdo-azoc-1030 | |
| poly(ethylene glycol)-dithiol (PEG-diSH; 3.4 kDa) | Laysan Bio | SH-PEG-SH-3400-5g | |
| Polydimehylsiloxane (PDMS) [Slygard 182 Elastomer Kit] | Elsworth Adhesives | 3097358-1004 | Polydimethylsiloxane |
| Powder Free Examination Gloves | Quest | 92897 | |
| Propidium iodide, 1 mg/mL aqueous soln. | Fisher Scientific | AAJ66584AB | |
| RPMI-1640 Medium (1x) | HyClone | SH30027-02 | |
| Silicone spacers - Silicone sheet, 0.5 mm thick/13 cm x 18 cm | Grace Bio-Labs | JTR-S-0.5 | |
| SOX2 Alexa Fluor 488 | Santa Cruz Biotechnology | sc-365823 | |
| Tissue Culture Hood | NUAIRE | NU-425-600 | |
| Triethanolamine, ≥99.0% (GC) | Sigma Aldrich | 90279 | |
| U-87 MG human glioblastoma cells | American Type Culture Collection | HTB-14 |
参考文献
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Costa, E. C., de Melo-Diogo, D., Moreira, A. F., Carvalho, M. P., Correia, I. J. Spheroids formation on non-adhesive surfaces by liquid overlay technique: Considerations and practical approaches. Biotechnology Journal. 13 (1), 1700417(2018).
- Li, Y., Kumacheva, E. Hydrogel microenvironments for cancer spheroid growth and drug screening. Science Advances. 4 (4), eaas8998(2018).
- Kamatar, A., Gunay, G., Acar, H. Natural and synthetic biomaterials for engineering multicellular tumor spheroids. Polymers. 12 (11), 2506(2020).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular Pharmaceutics. 11 (7), 2115-2125 (2014).
- Nakod, P. S., Kim, Y., Rao, S. S. Three-dimensional biomimetic hyaluronic acid hydrogels to investigate glioblastoma stem cell behaviors. Biotechnology and Bioengineering. 117 (2), 511-522 (2020).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85, 128-146 (2020).
- Pedron, S., et al. Hyaluronic acid-functionalized gelatin hydrogels reveal extracellular matrix signals temper the efficacy of erlotinib against patient-derived glioblastoma specimens. Biomaterials. 219, 119371(2019).
- Hill, L., Bruns, J., Zustiak, S. P. Hydrogel matrix presence and composition influence drug responses of encapsulated glioblastoma spheroids. Acta Biomaterialia. 132, 437-447 (2021).
- Chen, J. -W. E., et al. Crosstalk between microglia and patient-derived glioblastoma cells inhibit invasion in a three-dimensional gelatin hydrogel model. Journal of Neuroinflammation. 17 (1), 346(2020).
- Thakuri, P. S., Liu, C., Luker, G. D., Tavana, H. Biomaterials-based approaches to tumor spheroid and organoid modeling. Advanced Healthcare Materials. 7 (6), 1700980(2018).
- Shin, S., et al. Alginate-marine collagen-agarose composite hydrogels as matrices for biomimetic 3D cell spheroid formation. RSC Advances. 6 (52), 46952-46965 (2016).
- Pradhan, S., Clary, J. M., Seliktar, D., Lipke, E. A. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 115, 141-154 (2017).
- Imaninezhad, M., Hill, L., Kolar, G., Vogt, K., Zustiak, S. P. Templated macroporous polyethylene glycol hydrogels for spheroid and aggregate cell culture. Bioconjugate Chemistry. 30 (1), 34-46 (2018).
- Mirab, F., Kang, Y. J., Majd, S. Preparation and characterization of size-controlled glioma spheroids using agarose hydrogel microwells. PLoS One. 14 (1), e0211078(2019).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments: JoVE. 81, e50665(2013).
- Timmins, N. E., Nielsen, L. K. Generation of Multicellular Tumor Spheroids by the Hanging-Drop Method. Hauser, H., Fussenegger, M. 140, Springer, Humana Press, NJ. (2007).
- Zhao, L., et al. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Scientific Reports. 9 (1), 19717(2019).
- Amaral, R. L., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605(2017).
- Gencoglu, M. F., et al. Comparative study of multicellular tumor spheroid formation methods and implications for drug screening. ACS Biomaterials Science & Engineering. 4 (2), 410-420 (2018).
- Zhang, C., Liu, C., Zhao, H. Mechanical properties of brain tissue based on microstructure. Journal of the Mechanical Behavior of Biomedical Materials. 126, 104924(2021).
- Alifieris, C., Trafalis, D. T. Glioblastoma multiforme: Pathogenesis and treatment. Pharmacology & Therapeutics. 152, 63-82 (2015).
- Zustiak, S. P., Leach, J. B. Hydrolytically degradable poly (ethylene glycol) hydrogel scaffolds with tunable degradation and mechanical properties. Biomacromolecules. 11 (5), 1348-1357 (2010).
- Zustiak, S. P., Wei, Y., Leach, J. B. Protein-hydrogel interactions in tissue engineering: Mechanisms and applications. Tissue Engineering Part B: Reviews. 19 (2), 160-171 (2013).
- Kroger, S. M., et al. Design of hydrolytically degradable polyethylene glycol crosslinkers for facile control of hydrogel degradation. Macromolecular Bioscience. 20 (10), 2000085(2020).
- Raeber, G., Lutolf, M., Hubbell, J. Molecularly engineered PEG hydrogels: a novel model system for proteolytically mediated cell migration. Biophysical Journal. 89 (2), 1374-1388 (2005).
- Bruns, J., Egan, T., Mercier, P., Zustiak, S. P. Glioblastoma spheroid growth and chemotherapeutic responses in single and dual-stiffness hydrogels. Acta Biomaterialia. 163, 400-414 (2023).
- Kuwajima, T., et al. ClearT: a detergent-and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Holt, S. E., Ward, E. S., Ober, R. J., Alge, D. L. Shooting for the moon: using tissue-mimetic hydrogels to gain new insight on cancer biology and screen therapeutics. MRS Communications. 7 (3), 427-441 (2017).
- Jain, E., Scott, K. M., Zustiak, S. P., Sell, S. A. Fabrication of polyethylene glycol-based hydrogel microspheres through electrospraying. Macromolecular Materials and Engineering. 300 (8), 823-835 (2015).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948(2016).
- Lee, K. -H., Kim, T. -H. Recent advances in multicellular tumor spheroid generation for drug screening. Biosensors. 11 (11), 445(2021).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。