Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sferoid-Matriks Etkileşimlerini İncelemek için Polietilen Glikol Hidrojellerde Tümör Sferoid Üretimi ve Kapsüllenmesi
Bu Makalede
Özet
Burada, tümör sferoidlerinin hızlı, sağlam ve ucuz bir şekilde üretilmesini ve ardından hidrojel kapsüllenmesini sağlayan bir protokol sunuyoruz. Özel ekipman gerektirmediği için yaygın olarak uygulanabilir. Sferoid-matriks etkileşimlerini araştırmak ve in vitro doku fizyolojisi veya patoloji modelleri oluşturmak için özellikle yararlı olacaktır.
Özet
Sferoidlerin üç boyutlu (3D) kapsüllenmesi, optimal hücre büyümesi için tümör mikroçevresini yeterince kopyalamak için çok önemlidir. Burada, tümör hücre dışı mikroçevreyi taklit etmek için sferoid kapsülleme için bir in vitro 3D glioblastoma modeli tasarladık. İlk olarak, polidimetilsiloksan kullanarak kare piramidal mikrokuyu kalıpları oluşturduk. Bu mikrokuyu kalıpları daha sonra 50-500 μm arasında sıkı bir şekilde kontrol edilen boyutlara sahip tümör sferoidlerini imal etmek için kullanıldı. Sferoidler oluşturulduktan sonra, hasat edildi ve polietilen glikol (PEG) bazlı hidrojeller içinde kapsüllendi. PEG hidrojelleri, sertlik, bozunabilirlik ve hücre yapışkanlığı gibi hidrojel özellikleri bağımsız olarak ayarlanabildiğinden, küresel kapsülleme için çok yönlü bir platformdur. Burada, glioblastoma sferoidlerini kapsüllemek için temsili bir yumuşak (~8 kPa) hidrojel kullandık. Son olarak, konfokal mikroskopi ile yüksek kaliteli görüntüler elde etmek için sferoidleri boyamak ve görüntülemek için bir yöntem geliştirilmiştir. Yoğun sferoid çekirdek ve nispeten seyrek çevre nedeniyle, görüntüleme zor olabilir, ancak bir temizleme solüsyonu ve konfokal optik kesit kullanmak bu görüntüleme zorluklarını hafifletmeye yardımcı olur. Özetle, tek tip sferoidler üretmek, bunları PEG hidrojellerinde kapsüllemek ve sferoid büyümesini ve çeşitli hücre-matris etkileşimlerini incelemek için kapsüllenmiş sferoidler üzerinde konfokal mikroskopi gerçekleştirmek için bir yöntem gösteriyoruz.
Giriş
Tümör sferoidleri, kanser etiyolojisi, patolojisi ve ilaç yanıtını incelemede yararlı in vitro araçlar olarak ortaya çıkmıştır1. Geleneksel olarak, sferoidler, hücre-hücre yapışmasının hücre yüzeyi yapışmasına göre tercih edildiği düşük yapışma plakaları veya biyoreaktörler gibi koşullarda kültürlenmiştir2. Bununla birlikte, tümör mikroçevresini daha sadık bir şekilde özetlemek için, in vitro sferoid modellerin hem hücre-hücre hem de hücre-matris etkileşimlerini yakalaması gerektiği artık kabul edilmektedir. Bu, birden fazla grubu, sferoidlerin kapsüllenebileceği hidrojeller gibi iskeleler tasarlamaya sevk etti 3,4. Bu tür hidrojel bazlı sferoid modeller, canlılık, proliferasyon, kök veya tedaviye yanıt verme gibi çeşitli hücre davranışları üzerindeki hücre-hücre ve hücre-matris etkileşimlerinin aydınlatılmasını sağlar3.
Burada, glioblastoma sferoidlerinin polietilen glikol (PEG) hidrojeller içinde kapsüllenmesi için bir protokol açıklıyoruz. Hidrojellerde glioblastoma hücre sferoid kapsüllemesi ile ilgili çok sayıda literatür raporu vardır. Örneğin, hidrojel sertliğinin hücre davranışı üzerindeki etkisini belirlemek için bir RGDS yapışkan ligand ile süslenmiş ve enzimatik olarak bölünebilir bir peptit ile çapraz bağlanmış PEG hidrojellerinde U87 hücrelerinin kapsüllenmesiyle sferoidler oluşturuldu5. U87 hücreleri, kanser kök hücre popülasyonunugenişletmek 6 veya kemoterapi direncinin matris aracılı mekanizmalarını keşfetmek için diğer PEG bazlı veya hyaluronik asit bazlı hidrojellerdede oluşturulmuştur 7,8,9. Glioblastoma sferoidleri, mikroglia ve kanser hücreleri arasındaki karışmayı ve bunun hücre istilası üzerindeki etkisini incelemek için jelatin hidrojeller içinde kapsüllenmiştir10. Genel olarak, bu tür çalışmalar, glioblastoma patolojisini anlamada ve tedavilerin tasarlanmasında hidrojel bazlı in vitro modellerin faydasını göstermiştir.
Ayrıca, tümör sferoid üretimi ve hidrojel kapsülleme için farklı yöntemler vardır11. Örneğin, dağılmış hücreler hidrojeller içinde tohumlanabilir ve zamanla sferoidler oluşturmasına izin verilebilir 5,12. Böyle bir yöntemin bir dezavantajı, diferansiyel hücre tepkilerine yol açabilecek oluşan sferoidlerin polidispersitedir. Tek tip sferoidler üretmek için, hücreler mikrojeller içinde kapsüllenebilir ve jeli13 istila edip yeniden şekillendirene kadar uzun süreler boyunca kültürlenebilir veya hücreler küresel 'deliklere' sahip şablonlu jellerde biriktirilebilir vetoplanmasına izin verilebilir 14. Bu yöntemlerin dezavantajı, göreceli karmaşıklıkları, mikrojeller veya jeldeki 'delikler' oluşturmak için bir damlacık üretecine veya başka araçlara ihtiyaç duyulması ve sferoidlerin büyümesi ve olgunlaşması için geçen süredir. Alternatif olarak, sferoidlermikro kuyucuklarda 9,15,16 veya asılı damla plakalarında17,18 önceden oluşturulabilir ve daha sonra burada açıklanan tekniğe benzer şekilde bir hidrojel içinde kapsüllenebilir. Bu yöntemler daha basittir ve daha yüksek aktarım hızı bir şekilde yapılabilir. İlginç bir şekilde, sferoid oluşum yönteminin, gen ekspresyonu, hücre proliferasyonu veya ilaca yanıt verme gibi sferoid hücre davranışlarını etkileyebileceği gösterilmiştir19,20.
Burada, doğal ortamı yumuşak, nano gözenekli bir hidrojel tarafından taklit edilebilen yumuşak, nano gözenekli beyin matrisi21 olan katı bir tümör olduğu için glioblastoma odaklanıyoruz. Glioblastoma aynı zamanda tedavisi olmayan en ölümcül beyin kanseridir22. Bununla birlikte, burada açıklanan protokol, herhangi bir katı tümörü temsil eden sferoidlerin kapsüllenmesi için kullanılabilir. Michael tipi bir ekleme reaksiyonu23 ile oluşturulan PEG hidrojellerini kullanmayı seçtik. PEG, inert olan ve iskele ve fiziksel hücre desteği görevi gören ancak hücre bağlanmasını desteklemeyen sentetik, bozunmayan ve biyouyumlu bir hidrojeldir23. Hücre yapışkanlığı, tüm proteinlerin veya yapışkan ligandların24 bağlanması yoluyla ayrı olarak eklenebilir ve parçalanabilirlik, PEG polimer zincirinin veya hidrolitik veya enzimatik olarak parçalanabilen çapraz bağlayıcıların25,26 kimyasal modifikasyonları yoluyla eklenebilir. Bu, biyokimyasal özelliklerin, hücre-matris etkileşimlerinin incelenmesinde avantajlı olabilecek mekanik veya fiziksel hidrojel özelliklerinden bağımsız olarak ayarlanmasına izin verir. Michael tipi jelleşme kimyası seçicidir ve fizyolojik koşullarda gerçekleşir; bu nedenle, sferoidleri hidrojel öncü çözeltisi ile karıştırarak sferoid kapsüllemeye izin verir.
Genel olarak, burada sunulan metodolojinin birkaç dikkate değer özelliği vardır. İlk olarak, çok kuyulu bir düzenekte tümör sferoidlerinin üretilmesi verimli, hızlıdır ve gerekli malzemelerin maliyeti düşüktür. İkincisi, sferoidler, düşük polidispersiteye sahip çeşitli boyutlarda büyük partiler halinde üretilir. Son olarak, yalnızca ticari olarak temin edilebilen malzemeler gereklidir. Metodolojinin faydası, substrat özelliklerinin küresel hücre canlılığı, döngüsellik ve hücre saplılığı üzerindeki etkisi araştırılarak gösterilmektedir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Çözeltilerin hazırlanması
- Polidimetilsiloksan (PDMS) öncü çözeltisinin hazırlanması
- Negatif PDMS öncü çözeltisini hazırlayın (tutkal öncü çözeltisi için de kullanılır). Elastomeri bir spatula kullanarak bir tartım teknesine alın ve tartın. Sertleştiriciyi elastomer tabanına 1:10 oranında ekleyin. PDMS ve sertleştirici maddeyi plastik tartı teknesindeki spatulayı kullanarak nazikçe ve iyice karıştırın.
NOT: Bu PDMS öncü çözeltisi, negatif kalıbı oluşturmak için 6 oyuklu kare piramidal mikrokuyu plakasına dökülür. Bu, tutkal öncü çözeltisi için kullanılan çözeltinin aynısıdır. - Pozitif PDMS öncü çözeltisini hazırlayın. Elastomer tabanı bir spatula kullanarak tartım teknesine alın ve tartın. Sertleştiriciyi elastomer tabana 1:9 oranında ekleyin. PDMS ve sertleştirici maddeyi plastik tartı teknesindeki spatulayı kullanarak nazikçe ve iyice karıştırın.
NOT: Bu PDMS öncü çözeltisi daha sonra pozitif kalıbı oluşturmak için negatif kalıba dökülür.
- Negatif PDMS öncü çözeltisini hazırlayın (tutkal öncü çözeltisi için de kullanılır). Elastomeri bir spatula kullanarak bir tartım teknesine alın ve tartın. Sertleştiriciyi elastomer tabanına 1:10 oranında ekleyin. PDMS ve sertleştirici maddeyi plastik tartı teknesindeki spatulayı kullanarak nazikçe ve iyice karıştırın.
- pH 8'lik 0,3 M trietanolamin (TEA) tamponunun hazırlanması
- 0,75 M TEA çözeltisi oluşturmak için bir pipet yardımcısı kullanarak 1 mL TEA ve 9 mL 1x fosfat tamponlu salin (PBS) 50 mL'lik bir koniğe pipetleyin. Çözeltiyi 1 N HCl veya 1 N NaOH kullanarak 8 pH'a titre edin. Ardından, pH'ı 8 olan 0,3 M'lik bir nihai TEA konsantrasyonu elde etmek için 25 mL'lik bir nihai hacim elde etmek için yeterli 1x PBS ekleyin.
DİKKAT: HCl ve NaOH çözeltilerini oda sıcaklığında (RT) yanıcı bir dolapta saklayın. Kullanım sırasında kişisel koruyucu ekipman giyin.
- 0,75 M TEA çözeltisi oluşturmak için bir pipet yardımcısı kullanarak 1 mL TEA ve 9 mL 1x fosfat tamponlu salin (PBS) 50 mL'lik bir koniğe pipetleyin. Çözeltiyi 1 N HCl veya 1 N NaOH kullanarak 8 pH'a titre edin. Ardından, pH'ı 8 olan 0,3 M'lik bir nihai TEA konsantrasyonu elde etmek için 25 mL'lik bir nihai hacim elde etmek için yeterli 1x PBS ekleyin.
- Komple medyanın hazırlanması
- Tüm ortamı hazırlamak için,% 10 (a / h) veya 56 mL fetal sığır serumu ve% 1 (a / h) veya 5.6 mL penisilin ve streptomisin 500 mL RPMI ortamına ekleyin.
- Kullanmadan önce çözeltiyi 37 °C'de 10-20 dakika veya çözelti ısınana kadar yerleştirin.
- Solüsyonu 0-4 °C'de 6 aya kadar saklayın.
- %20 (a/h) polietilen glikol (PEG) stok çözeltilerinin hazırlanması
NOT: Hesaplama, gerektiğinde ölçeklendirilebilen veya küçültülebilen 100 μL'lik çözeltilere dayanmaktadır.- %20 w/v 4 kollu PEG-Akrilat (4 kollu PEG-Ac) içeren 100 μL'lik bir stok çözeltisi hazırlamak için, bir mikrofüj tüpünde 20 mg 4 kollu PEG-Ac tozu tartın. 70 μL 0.3 M TEA tamponu ekleyin, ardından çözeltiyi yaklaşık 30 saniye veya tamamen eriyene kadar girdaplayın. 100 μL'lik bir nihai çözelti hacmine ulaşmak için yeterli TEA tamponu (~27 μL) ekleyerek toz çözünmesinden kaynaklanan hacim değişimini hesaba katın.
- %20 w/v PEG-diSH'lik 100 μL'lik bir stok çözeltisi hazırlamak için, bir mikrofüj tüpünde 20 mg PEG-diSH tozu tartın. 70 μL TEA tamponu ekleyin, ardından çözeltiyi yaklaşık 30 saniye veya tamamen eriyene kadar vorteksleyin. 100 μL'lik bir nihai çözelti hacmine ulaşmak için yeterli TEA tamponu (~27 μL) ekleyerek toz çözünmesinden kaynaklanan hacim değişimini hesaba katın.
NOT: PEG tozu çok higroskopiktir ve -20 °C'de kurutulmuş bir kapta saklanması gerekir. Dondurucudan çıkarırken, tozu tartmak için şişeyi açmadan önce PEG tozunun 10 dakika çözülmesini bekleyin. Dondurucuya geri koymadan önce nemli havanın yerini almak için şişeyi nitrojen veya argon gibi inert bir gazla boşaltın. 4 kollu PEG-Ac'nin stok çözeltisi, kullanımdan önce 2 haftaya kadar 4 °C'de saklanabilir. PEG-diSH'in stok çözeltisinin kullanımdan hemen önce hazırlanması gerekir ve tiyol grupları disülfür bağları oluşturmak için birbirleriyle reaksiyona girdiğinden saklanamaz.
- %2 v/v bazal membran matris çözeltisinin hazırlanması
- %2 v/v bazal membran matrisi çalışma solüsyonu hazırlamak için, 9,98 mL tam ortama 20 μL bazal membran matrisi (LDEV'siz) ekleyin ve ~10 kez yukarı ve aşağı pipetleyerek iyice karıştırın. Çözeltiyi 4 °C'de (buz üzerinde) hazırlayın, ardından 37 °C'ye ısıtın (fırında veya inkübatörde) ve hemen kullanın.
NOT: Bazal membran matrisi >10 °C'de bir jel oluşturmaya başlayacaktır, bu nedenle bazal membran matris solüsyonunu 2-6 °C'de komple ortamla karıştırdığınızdan emin olun. Ortam bileşiminin tamamı adım 1.3'te açıklanmıştır.
- %2 v/v bazal membran matrisi çalışma solüsyonu hazırlamak için, 9,98 mL tam ortama 20 μL bazal membran matrisi (LDEV'siz) ekleyin ve ~10 kez yukarı ve aşağı pipetleyerek iyice karıştırın. Çözeltiyi 4 °C'de (buz üzerinde) hazırlayın, ardından 37 °C'ye ısıtın (fırında veya inkübatörde) ve hemen kullanın.
- Hücre fiksatif çözeltisinin hazırlanması
- %4 w/v paraformaldehit ve %0.1 v/v noniyonik yüzey aktif madde içeren 1 mL hücre fiksatif çözeltisi hazırlamak için önce 891 μL 1x PBS ve 108 μL paraformaldehit (%37 w/v konsantrasyon) karıştırın ve ardından 1 μL noniyonik yüzey aktif madde (%100 konsantrasyon) ekleyin. Çözeltiyi iyice karıştırın.
NOT: Fiksatif solüsyon her fiksasyon yapıldığında taze yapılmalıdır.
DİKKAT: Paraformaldehit yanıcıdır ve havada yanıcı toz konsantrasyonları oluşturabilir. Cilt tahrişine ve ciddi göz hasarına neden olur. Solunum yolu tahrişine neden olabileceğinden nefes almaktan kaçının. Paraformaldehiti kimyasal davlumbazda tutun ve kişisel koruyucu ekipman giyin. Kullandıktan sonra ellerinizi iyice yıkayın. Noniyonik yüzey aktif madde cilt tahrişine ve ciddi göz hasarına neden olur. Kullanım sırasında koruyucu eldiven ve göz koruması veya yüz koruması kullanın. Çevreye salınmasını önlemek için şişeyi kimyasal bir davlumbazda açın. Kullandıktan sonra ellerinizi iyice yıkayın.
- %4 w/v paraformaldehit ve %0.1 v/v noniyonik yüzey aktif madde içeren 1 mL hücre fiksatif çözeltisi hazırlamak için önce 891 μL 1x PBS ve 108 μL paraformaldehit (%37 w/v konsantrasyon) karıştırın ve ardından 1 μL noniyonik yüzey aktif madde (%100 konsantrasyon) ekleyin. Çözeltiyi iyice karıştırın.
- Boyama solüsyonlarının hazırlanması
- 3 mM 3,3'-diheksiloksakarbosiyanin iyodür (DiOC) hazırlamak için, 2.65 mg DiOC'yi 1 mL DMSO içinde karıştırın.
- 1.5 mM propidyum iyodür çözeltisi (PI) hazırlamak için, 1 mg PI'yi 1 mL deiyonize su içinde karıştırın.
- Küresel temizleme çözeltisinin hazırlanması
- Küresel temizleme için 1x PBS'de %20, %40 ve %80 v/v formamid temizleme solüsyonları hazırlayın.
- 10 mL %20 v/v formamid yapmak için 8 mL 1x PBS ve ardından 2 mL formamid karıştırın. 10 mL %40 v/v formamid yapmak için 6 mL 1x PBS ve ardından 4 mL formamid karıştırın. 10 mL %80 v/v formamid yapmak için 2 mL 1x PBS ve ardından 8 mL formamid karıştırın.
- Formamid ve 1x PBS'yi birleştirdikten sonra, çözeltiyi yaklaşık 30 saniye vorteksleyerek karıştırın.
- Küresel temizleme için 1x PBS'de %20, %40 ve %80 v/v formamid temizleme solüsyonları hazırlayın.
2. Kare piramidal mikro kuyuların imalatı
- Şekil 1'de gösterildiği gibi kare piramidal mikro kuyuların negatif PDMS kalıbını imal edin.
- 2 g (~ 1 mL) negatif PDMS öncü çözeltisi hazırlayın ve 6 oyuklu kare piramidal ana kalıbın bir kuyucuğuna dökün. 1 mL'nin plakanın bir kuyusunu tamamen kapladığını unutmayın. Ana kalıbı PDMS ile kapladıktan sonra, 6 oyuklu kare piramidal plakayı bir vakumlu desikatöre yerleştirerek PDMS öncü solüsyonunun gazını 30 dakika boyunca boşaltın. Ardından, plakayı 24 saat boyunca 60 °C'lik bir fırına koyarak PDMS'yi kürleyin.
NOT: Gaz giderme için plaka kapağının çıkarıldığından ve kürleme için tekrar takıldığından emin olun. Çözeltiyi bir vakumlu desikatörde veya nitrojen veya argon gibi inert bir gazla temizleme yoluyla gazdan arındırın. Negatif küf öncü çözeltisinde 30 dakika sonra hala kabarcıklar varsa, bu da yetersiz gaz gidermeyi gösterirse, 30 dakika daha vakumlu bir kurutucuya koyun. Bir veya daha fazla PDMS negatif kalıbı hazırlamak için aynı anda bir veya daha fazla plaka kuyusu kullanın. Tablo 1'de gösterildiği gibi 400 ve 800 μm kenar uzunlukları gibi farklı boyutlarda kare piramidal mikro kuyular kullanılabilir. Kare piramidal boyutlardan bağımsız olarak aynı miktarda PDMS kullanılır. - PDMS hala sıcakken sertleştikten sonra, negatif PDMS kalıbını bir spatula kullanarak ana kalıptan dikkatlice çıkarın ve negatif kalıbı bir biyopsi zımbası kullanarak 35 mm çapında bir levha halinde kesin. Bir Petri kabına yerleştirin ve kapağı kapatın ve 24 saat daha RT'nin kürlenmesine izin verin.
NOT: Negatif kalıpları çıkarmak için, kuyu plakası ile PDMS kalıbı arasına girmek için bir spatula kullanın ve negatif kalıbı ana kalıptan yavaşça çekin. Kalıp, 35 mm'lik bir Petri kabına uyacak şekilde 35 mm'lik plakalar halinde kesilir. Kalıplar, farklı çaplardaki plakalara uyacak şekilde başka boyutlarda yapılabilir. 35 mm'lik negatif kalıp plakaları RT'de saklanabilir, tozdan korunabilir ve 6 ay boyunca tekrar kullanılabilir.
- 2 g (~ 1 mL) negatif PDMS öncü çözeltisi hazırlayın ve 6 oyuklu kare piramidal ana kalıbın bir kuyucuğuna dökün. 1 mL'nin plakanın bir kuyusunu tamamen kapladığını unutmayın. Ana kalıbı PDMS ile kapladıktan sonra, 6 oyuklu kare piramidal plakayı bir vakumlu desikatöre yerleştirerek PDMS öncü solüsyonunun gazını 30 dakika boyunca boşaltın. Ardından, plakayı 24 saat boyunca 60 °C'lik bir fırına koyarak PDMS'yi kürleyin.
- Kare piramidal mikro kuyuların pozitif PDMS kalıbını hazırlayın.
- Negatif PDMS kalıbının 35 mm'lik levhalarını, dokulu mikro kuyucuklar yukarı bakacak şekilde 35 mm'lik bir Petri kabına yerleştirin.
- Yukarıdaki gibi 2,5 g (~ 1,2 mL) pozitif PDMS öncü çözeltisi hazırlayın ve negatif kalıbı tamamen kaplamak için 35 mm'lik Petri kabındaki negatif kalıba dökün. Daha sonra öncü çözeltiyi yukarıdaki gibi 30 dakika gazdan arındırın ve 3-4 saat boyunca 60 ° C fırına koyun.
NOT: PDMS viskoz olduğundan, negatif kalıbın altında sıkışan havadan bir kabarcık oluşabilir. Negatif kalıbın altında bir kabarcık oluşursa, kabarcığı serbest bırakmak için bir spatula kullanarak kalıbı hafifçe aşağı doğru itin. Hava kabarcıkları kalırsa, 30 dakika boyunca gazdan arındırmaya devam edin veya bir spatula alın ve kabarcıklar patlayana kadar pozitif kalıp çözeltisini hafifçe karıştırın. - Pozitif PDMS kalıbı sertleştikten sonra, kalıpları 35 mm'lik Petri kabından çıkarın ve pozitif kalıbı hemen negatif kalıptan soyun.
NOT: Pozitif kalıbın başarılı bir şekilde soyulması için zamanlama önemlidir. Çıkarma işlemi en iyi şekilde, pozitif ve negatif kalıp arasındaki arayüzü ortaya çıkarmak için bir ustura kullanarak pozitif kalıbı hafifçe keserek ve kalıpları birbirinden soyarak yapılır. Ardından dairesel kalıbın kenarlarını soyun. Negatif kalıbı pozitif kalıptan yavaşça soyun.
- Kalıpları 48 oyuklu bir plakanın kuyularının dibine yapıştırın.
NOT: Burada 48 oyuklu bir plaka kullanılır, ancak kalıp plakaları doğru çaplarda kesildiği sürece diğer plakalar da kullanılabilir (örneğin, 96 oyuklu bir plaka için 6 mm çapında).- Pozitif kalıpları 10 mm'lik bir biyopsi zımbası kullanarak plakalar halinde kesin.
NOT: 35 mm çapında bir pozitif kalıptan yaklaşık 4 kalıp (her biri 10 mm çapında) kesilebilir. - Kalıpları 48 oyuklu bir plakanın dibine yapıştırmak için, PDMS tutkal öncü çözeltisini (~ 0.5 mL veya 1 g) daha önce açıklandığı gibihazırlayın 27. 10 mm'lik pozitif kalıbın düz tarafını (mikro kuyu desenli tarafı değil) PDMS öncü çözeltisine hafifçe daldırmak için cımbız kullanın. 48 oyuklu bir plakanın oyuğuna dikkatlice bir kalıp yerleştirin ve cımbızı kullanarak her kalıbı kuyu dibine hafifçe bastırın. PDMS yapıştırıcısının sertleşmesini sağlamak için monte edilmiş plakayı 60 °C'lik bir fırına 4-24 saat yerleştirin.
NOT: PDMS tutkal öncü çözeltisi pozitif kalıp mikro kuyularına bulaşırsa, yumuşak kağıt mendil kullanılarak silinebilir ve adım tekrarlanabilir. Yapıştırırken, tutkalın mikro kuyuları örtmediğinden emin olun. - 1000 μL'lik bir pipet kullanarak 48 oyuklu plakanın her bir oyuğuna 300 μL %70 etanol ekleyerek kalıpları sterilize edin. % 70 etanolü aspire edin ve 48 oyuklu plakayı 2 saat boyunca UV (302 nm) altında bir doku kültürü başlığına yerleştirin.
NOT: Kalıplar 6 ay boyunca kullanılabilir ve gerektiğinde yeniden sterilize edilebilir.
- Pozitif kalıpları 10 mm'lik bir biyopsi zımbası kullanarak plakalar halinde kesin.
3. Hidrojellerde çok hücreli tümör sferoid oluşumu, hasadı ve kapsüllenmesi
NOT: Bu bölümde özetlenen protokol U87 insan glioblastoma hücre hattı içindir (bkz. Şekil 1 ve Şekil 2), ancak benzer bir protokol diğer kanser hücresi tipleri ile de kullanılabilir.
- Çok hücreli tümör sferoid oluşumu
- 1000 μL'lik bir pipet kullanarak her bir kuyucuğa 300 μL solüsyon ekleyerek önce mikro kuyu kalıplarını yapışma önleyici bir durulama solüsyonu ile yıkayın. Ardından, 3 dakika boyunca 1620 x g'da santrifüjleyin ve bir vakum pompası ve bir Pasteur pipeti kullanarak çözeltiyi aspire edin.
NOT: Bu adımı hücre tohumlamadan hemen önce gerçekleştirin. - Hücreleri, 37 ° C'de 5 dakika boyunca kültür şişesi alanının hercm2'si başına ~ 80 μL% 0.25 tripsin / EDTA'ya maruz bırakın. Örneğin, bir T-25 hücre kültürü şişesi için 1 mL tripsin/EDTA uygundur. Aynı hacimde tam hücre kültürü ortamı ekleyerek tripsini nötralize edin. Örneğin, tripsin içeren T-25 hücre kültürü şişesine 1 mL tam ortam ekleyin. Hücreleri doku kültürü şişesinden toplayın.
- Hücre sayımı için 10 μL hücre süspansiyonunu bir hemositometrenin her bir portuna aktarın. Toplam hücre sayısını saymak için ters çevrilmiş bir mikroskop kullanın ve bu hücre sayımının ortalamasını en az 8 kadrandan alın, böylece iyi hücre sayımı sonuçları için her hemositometre kadranındaki hücre sayısının 20-50 olduğundan emin olun. Nihai hücre konsantrasyonunu belirlemek için hesaplanan sayıyı 10:4 ile çarpın.
- Toplanan hücreleri, Tablo 1'de gösterildiği gibi, istenen sferoid boyutuna bağlı olarak, istenen son hücre konsantrasyonunda% 10 fetal sığır serumu ve% 1 penisilin / streptomisin ile desteklenmiş tam RPMI hücre kültürü ortamında yeniden süspanse edin.
NOT: 800 μm'lik mikro kuyular, 48 oyuklu bir plakanın bir oyuğunda ~75 sferoid verecek ve 400 μm'lik mikro kuyular, 48 oyuklu bir plakanın bir oyuğunda ~300 sferoid verecektir. - Mikrokuyucuklara istenen konsantrasyonda 500 μL hücre süspansiyonu yerleştirin ve plakayı 3 dakika boyunca 1620 x g'da santrifüjleyin. Plakayı 37 °C'de ve %5CO2'de nemlendirilmiş bir inkübatöre yerleştirin 24 saat boyunca kürelerin oluşmasına izin verin.
NOT: Sferoidler oluşmazsa, hücreleri yeniden süspanse etmek için tam ortamla birleştirilmiş bazal membran matrisinin %2 v/v'si kullanılabilir (daha fazla ayrıntı adım 1.5'te).
- 1000 μL'lik bir pipet kullanarak her bir kuyucuğa 300 μL solüsyon ekleyerek önce mikro kuyu kalıplarını yapışma önleyici bir durulama solüsyonu ile yıkayın. Ardından, 3 dakika boyunca 1620 x g'da santrifüjleyin ve bir vakum pompası ve bir Pasteur pipeti kullanarak çözeltiyi aspire edin.
- Sferoidler hasadı
- 1000 μL'lik bir pipet kullanarak, 500 μL'lik tam ortamı kuyuya sıkıca pipetleyin. Kuyudan 500 μL ortam kullanarak, küreleri yerinden çıkarmak için çeyreklerde üç ila dört kez yukarı ve aşağı pipetleyerek kuyunun dört çeyreğini (özellikle üst, alt, sol ve sağ kadranları) yıkayın. Sferoidleri içeren ortamı (toplam ~ 1000 μL) 1000 μL'lik bir pipet kullanarak bir mikrosantrifüj tüpüne nazikçe aspire edin ve sferoidlerin dibe çökmesine izin verin.
- Süpernatanı çıkarın ve sferoidleri istenen son konsantrasyona kadar yeniden süspanse edin. Örneğin, kapsüllemeden sonra 20 μL'lik bir jelde ~8 sferoid elde etmek için, sferoidleri 100 μL ortamda yeniden süspanse ederek sferoid süspansiyonda ~75 sferoid/100 μL'lik bir sferoid konsantrasyonu elde edin.
- Şekil 2'de gösterildiği gibi hidrojellerde sferoidlerin kapsüllenmesi.
- 100 μL %10 w/v PEG hidrojel öncü çözeltisi oluşturmak için, 50 μL sferoid süspansiyonu, ardından 30 μL %20 w/v 4 kollu PEG-Ac ve son olarak 20 μL %20 w/v PEG-diSH'yi bir mikrosantrifüj tüpünde birleştirin. Bu, optimum çapraz bağlanmayı sağlayan akrilat (Ac) ile tiyol (SH) gruplarının stokiyometrik molar oranını verecektir. Jel öncü solüsyonunu ~10 kez yukarı ve aşağı pipetleyerek karıştırın.
NOT: Hidrojel bileşimi, hacmi ve polimer uyumu gerektiği gibi değiştirilebilir. Ortaya çıkan hidrojeller yavaş yavaş bozunacak ve hücre dışı yapışkan olacaktır. Hidrojel hücre yapıştırıcısını yapmak için, RGDS gibi bir yapışkan ligand eklenebilir. Hidrojeli enzimatik olarak parçalanabilir hale getirmek için, her iki ucunda sistein kalıntıları içeren enzimatik olarak parçalanabilen bir peptit çapraz bağlayıcı eklenebilir. Sferoidleri aktarırken, sferoidleri yerinden çıkarmak için çözeltiyi iki kez hafifçe pipetleyin ve sferoidlerin eşit dağılımını sağlamak için süspansiyona getirin. - 1 mm silikon ara parçalarla ayrılmış iki parafilm kaplı cam slayt arasına 20 μL jel öncü solüsyonu pipetleyin ve jelleşmeyi sağlamak için jel öncü solüsyonlu slaytları 37 °C, %5CO2 inkübatörde 15 dakika boyunca yerleştirin.
NOT: Jelleşme üzerine kolay soyulmaya izin veren hidrofobik bir yüzey oluşturmak için iki cam slaytın parafilmle kaplandığından emin olun. Parafilm yerine hidrofobik bir kaplama çözeltisi kullanılabilir. 20 μL hacminde bir hidrojel öncü çözeltisi, şişmeden önce ~6 mm çapında ve 1 mm yüksekliğinde bir hidrojel levha ile sonuçlanacaktır. Herhangi bir ara parça tipi ve kalınlığı kullanılabilir, ancak jel kalınlığının 1 mm veya altında tutulması önerilir (daha kalın hidrojeller oksijen difüzyonunu ve besinlerin hücrelere taşınmasını sınırlayabilir), ancak küresel çaptan daha büyük (böylece sferoidler jel içinde tamamen kapsüllenir). Hidrojel öncü çözeltisinin herhangi bir hacmi kullanılabilir. 20-30 μL'lik jeller, 24 oyuklu bir plaka için uygundur. - Hidrojel jelleşmesi tamamlandıktan sonra, iki cam slaytı ayırın ve bir spatula kullanarak jelleri cam plakadan nazikçe soyun. Jelleri, her oyuk için bir tane olmak üzere 24 oyuklu bir plakaya yerleştirin ve sferoidleri içeren yüzeyin yukarı bakmasını sağlayın.
NOT: Sferoidler jelleşme sırasında jelin dibine düşecektir, bu nedenle onları kültürleme için ters çevirmek, besinlere ve oksijene daha iyi erişim için sferoidlerin hidrojelin yüzeyine yakın olmasını sağlayacaktır. Jelleşme, mikrosantrifüj tüpünde kalan ve tüpü ters çevirerek ve jelin akışını durdurduğu zamanı not ederek levha oluşturmak için kullanılmayan herhangi bir hidrojel öncü çözeltisini gözlemleyerek izlenebilir. - Her kuyucuğa tam ortam (~500 μL) ekleyin ve hidrojelin tamamen daldırıldığından emin olun. Çok kuyulu plakayı 37 °C ve% 5 CO2'de nemlendirilmiş bir inkübatöre yerleştirin ve hücreleri her 2-3 günde bir ortam değişiklikleriyle kültürleyin.
NOT: Hidrojeller 4 haftaya kadar veya hidrojeller bozulana kadar kültürlenebilir ve ortam iki günde bir değiştirilebilir.
- 100 μL %10 w/v PEG hidrojel öncü çözeltisi oluşturmak için, 50 μL sferoid süspansiyonu, ardından 30 μL %20 w/v 4 kollu PEG-Ac ve son olarak 20 μL %20 w/v PEG-diSH'yi bir mikrosantrifüj tüpünde birleştirin. Bu, optimum çapraz bağlanmayı sağlayan akrilat (Ac) ile tiyol (SH) gruplarının stokiyometrik molar oranını verecektir. Jel öncü solüsyonunu ~10 kez yukarı ve aşağı pipetleyerek karıştırın.
4. Floresan boyama
- Hücre canlılığı
- Hücre canlılığını belirlemek için tüm hücrelerin mitokondri ve endoplazmik retikulumunu boyayan 3,3'-diheksiloksakarbosiyanin iyodür (DiOC) boyasını kullanın. DiOC'yi (3 mM) 0,02 μg/mL konsantrasyonda kullanın. Spesifik olarak, ayrışmış hücreleri kültürleyen şişeye her 1000 μL ortam başına 2 μL DiOC eklemek için 20 μL'lik bir pipet kullanın (bölüm 3'teki sferoidlerin oluşum sürecinden en az 24 saat önce). DiOC'nin hücreleri boyaması için 24 saat bekleyin.
- Sadece ölü hücrelere giren nükleer ve kromozom boyası, propidyum iyodür, PI (1.50 mM) kullanın. Hücreleri boyamak için önce tüm ortamı aspire edin ve jeli 1000 μL'lik bir pipet kullanarak 500 μL 1x PBS ekleyerek durulayın, böylece jel tamamen suya batırılır.
- PBS'yi aspire edin ve 500 μL taze ortam ekleyin, ardından her bir oyuğa 30 μL PI çözeltisi ekleyin (yani, her 100 μL ortam başına 6 μL). Işıktan korumak için kuyu plakasını alüminyum folyo ile örtün. Kuyu plakasını 37 °C ve% 5 CO2'de bir inkübatöre yerleştirin ve PI'nin ölü hücreleri boyaması için 30 dakika bekleyin.
- Folyoyu çıkarın ve ortamı kuyulardan aspire edin. Hidrojeli daldırmak için 500 μL 1x PBS eklemek için 1000 μL'lik bir pipet kullanın. 1x PBS'yi aspire edin ve durulamayı iki kez daha tekrarlayın. Her oyuğa 500 μL ortam ekleyin ve floresan ters çevrilmiş veya konfokal mikroskop altında görüntüleyin.
- Konfokal mikroskoptan veya ters çevrilmiş floresan mikroskoptan alınan z-yığını görüntülerini kullanarak, denklem 1'de gösterildiği gibi DiOC (tüm hücreler) alanını PI (ölü hücreler) ile karşılaştırarak hücre canlılığını hesaplayın.
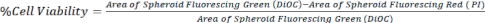 Eşitlik 1.
Eşitlik 1.
5. İmmünofloresan fiksasyonu, boyanması, temizlenmesi ve kapsüllenmiş sferoidlerin görüntülenmesi
- Fiksasyon ve boyama
- Hidrojellerin kültürlendiği oyuklardan ortamı aspire edin ve 500 μL 1x PBS'yi doğrudan hidrojellerin üzerine pipetleyerek hidrojelleri durulayın. 1x PBS'yi nazikçe aspire edin.
- Oyuk başına 500 μL hacimde fiksatif çözelti eklemek için 1000 μL'lik bir pipet kullanarak 24 oyuklu plakadaki sferoidleri sabitleyin. Fiksatifin jelleri RT'de 30 dakika ıslatmasına izin verin. Fiksatif solüsyonu 1000 μL'lik bir pipet kullanarak çıkarın ve belirlenmiş bir atık kabına atın.
- Her kuyucuğa 500 μL 1x PBS ekleyerek hidrojelleri durulayın. 1000 μL'lik bir pipet kullanarak 1x PBS'yi aspire edin ve PBS durulamasını iki kez daha tekrarlayın. Kuyu plakasını kuyu başına 500 μL 1x PBS'de 4 °C'de 1 haftaya kadar saklayın veya hemen kullanın.
NOT: PBS ve fiksatif solüsyonu aspire ederken hidrojelleri pipete çekmemeye dikkat edin. Bunu, plakayı ~45 derecelik bir açıyla eğerek yapın, bu da hidrojellerin görülmesine ve kazara aspirasyonun önlenmesine yardımcı olacaktır.
DİKKAT: Formaldehit solunduğunda ve temas ettiğinde toksiktir. Kimyasal davlumbazda eldivenlerle tutun. - Hücreleri boyamak için, hidrojel kapsüllü sferoidleri Nestin (200 μg / mL) ve SOX2 (200 μg / mL) için birincil antikorlarla 1:200 antikor seyreltmesinde inkübe edin: PBS. Kuyucuklardan 1x PBS'yi aspire etmek için 1000 μL'lik bir pipet kullanın. Her oyuğa 50 μL seyreltilmiş antikor ekleyin. Boyamanın tamamlanması için 24 saat bekleyin. Ardından, 1000 μL'lik bir pipet kullanarak boyama solüsyonunu çıkarın ve atıkları uygun şekilde atın.
- Hidrojeli daldırmak için yeterli olan 500 μL 1xPBS eklemek için 1000 μL'lik bir pipet kullanın. PBS'yi aspire edin ve iki kez daha tekrarlayın. Lekeli ve batık hidrojeli 1x PBS'de 4 °C'de görüntüleme veya görüntüden hemen önce 2 haftaya kadar saklayın.
NOT: Uygun boyamayı sağlamak için antikora bağlı olarak küçük optimizasyonlar gerekebilir. Konsantrasyon (1:200) ve zaman (24 saat), tipik 2D tek katmanlı hücre kültüründen önemli ölçüde daha yüksektir, çünkü 3D boyama, hidrojel ve sferoidler yoluyla difüzyon gerektirir.
- Sferoidleri boyadıktan sonra, PBS'yi sıralı bir formamid konsantrasyon artışı (isteğe bağlı) ile değiştirerek görüntüleme için şeffaflığı artırmak için sferoidi temizleyin.
- Her kuyudan 1x PBS'yi aspire edin. Her kuyucuğa 500 μL %20 (h/h) formamid ekleyin ve hidrojelin 90 dakika inkübe etmesine izin verin. Formamidi 1000 μL'lik bir pipet kullanarak aspire edin ve atıkları bir atık kabında toplayın.
- Kuyuya 500 μL %40 (h/h) formamid ekleyin. Hidrojelin çözelti içinde 90 dakika inkübe etmesine izin verin. Formamidi aspire edin ve atıkları atık kabında toplayın.
- Her bir kuyucuğa 500 μL %80 v/v formamid ekleyin ve 90 dakika inkübe edin. Formamidi aspire edin ve atık kabına atın. 500 μL %100 (h/h) formamid ekleyin ve görüntülemeden önce 24 saat inkübasyona izin verin. Temizleme işlemi bittiğinde, formamid atıklarını bir laboratuvar atık yönetim sisteminin uygun hizmetleri aracılığıyla uygun şekilde bertaraf edin.
NOT: Temizleme, sferoidin çekirdeğine konfokal görüntülemeye izin verir ve yalnızca sferoidin çevresi araştırılıyorsa isteğe bağlıdır.
- Konfokal mikroskopi kullanılarak hidrojel kapsüllü sferoidlerin görüntülenmesi.
NOT: Hücre görüntüleme için herhangi bir mikroskop - ters, floresan veya konfokal - kullanılabilir; Bununla birlikte, konfokal, tek düzlemlerin izolasyonuna izin verir.- Hidrojelleri cam lamel tabanları olan odacıklı kuyucuklara yerleştirin ve sferoidleri lamel mümkün olduğunca yakın konumlandırın.
NOT: Cam lameller veya cam lamel tabanlı odacıklı kuyular kullanılabilir. Susuz numuneler düşük görüntüleme kalitesine neden olacağından hidrojelleri nemli tutmak çok önemlidir. - 3D rekonstrüksiyonlar için Z-yığınları kullanarak sferoidin derinliklerinde görüntülemeye izin vermek için numuneleri uzun çalışma mesafesi objektifiyle (10x-20x) görüntüleyin.
NOT: Daha yüksek büyütme hedefleri, daha ayrıntılı görüntülemeye ve optik kesitlere izin verir, ancak görüntü derinliğinden ödün verir. - Denklem 2'yi kullanarak hem temizlenmiş hem de temizlenmemiş sinyal için sferoidin toplam alanına göre optik bölümde bulunan sinyal miktarını ölçün.
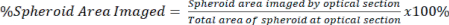 Eşitlik 2
Eşitlik 2
- Hidrojelleri cam lamel tabanları olan odacıklı kuyucuklara yerleştirin ve sferoidleri lamel mümkün olduğunca yakın konumlandırın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Kemoterapötik etkileri incelemek için sferoid bazlı ilaç tarama platformları, doğal dokuyu kopyalayan biyomalzemelerde sferoid kapsülleme üzerine tümör mikroçevresinin modüle edilmesine yapılan vurgu nedeniyle giderek daha fazla aranmaktadır. Burada, çok hücreli tümör sferoid hazırlığı ve ardından bir 3D hidrojel içinde kapsülleme ve görüntüleme için bir yöntem geliştirdik. Sferoidler, mikrokuyu kalıplarında hazırlanır (Şekil 3A,B), bu da ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Hidrojel bazlı çok hücreli tümör sferoid modelleri, kanser terapötik keşiflerini ilerletmek için giderek daha fazla geliştirilmektedir 11,13,29. Faydalıdırlar çünkü tümör mikroçevresinin temel parametrelerini kontrollü bir şekilde taklit ederler ve karmaşıklıklarına rağmen in vivo modellere göre kullanımı daha basit ve daha ucuzdur ve birçoğu yüksek verimli tarama teknolojileriyle uyumludur. Hidroje...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Saint Louis Üniversitesi tarafından Dr. Silviya P Zustiak'a sağlanan başlangıç fonlarının yanı sıra Saint Louis Üniversitesi'ndeki Henry ve Amelia Nasrallah Sinirbilim Merkezi'nden Dr. Silviya P Zustiak'a verilen bir tohum hibesi ile finanse edildi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 70% Ethanol | Fisher Scientific | LC22210-4 | |
| 15 mL Conicals | FALCON | 352097 | |
| 24-Well Plate Ultra Low Attachment plates | Fisher Scientific | 07-200-602 | |
| 35 mm Petri Dish | Amazon | 706011 | |
| 4-arm poly(ethylene glycol)-acrylate (4-arm PEG-Ac; 10 kDa) | Laysan Bio | ACRL-PEG-ACRL-10K-5g | |
| 50 mL Conicals | Fisher Scinetific | 3181345107 | |
| 6-well AggreWell 400 | StemCell Technologies, Vancouver, Canada | 34421 | Square pyramidal microwells |
| anti-adherence rinsing solution | StemCell Technologies, Vancouver, Canada | Cat #: 07010 | |
| Aspartic Acid-Arginine-Cysteine-Glycine-Valine-Proline-Methionine-Serine-Methionine-Arginine-Glycine-Cysteine-Arginine- Aspartic Acid (DRCG-VPMSMR-GCRD) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Chemical Fume Hood | KEWAUNEE | 99151 | |
| Corning Matrigel Basement Membrane Matrix, LDEV Free | Corning | 356234 | Basement membrane matrix |
| Detergent - Triton-X | Sigma Aldrich | T8787 | Nonionic surfactant |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | BP231-100 | |
| Disposable Pipettes (1 mL, 2 mL, 5 mL, 10 mL, 25 mL, 50 mL) | Fisher Scinetific | 1 mL: 13-678-11B, 2mL: 05214038, 5mL(FALCON): 357529, 10mL: 13-678-11E, 25mL: 13-678-11, 50mL: 13-678-11F | |
| Fetal Bovine Serum | HyClone | SH30073-03 | |
| Formaldehyde 37% Solution | Sigma Aldrich | F1635 | |
| Glass Plates | Slumpys | GBS4100SFSL | |
| Glass Transfer Pipettes | Fisher Scinetific | 5 3/4": 1367820A, 9":136786B | |
| Glycine-Arginine-Cysteine-Aspartic Acid-Arginine-Glycine-Aspartic Acid-Serine (GRCD-RGDS) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Hemacytometer | Bright-Line | 383684 | |
| Hydrophobic solution - Repel Silane | GE Healthcare Bio-Sciences | 17-1332-01 | |
| Incubator | NUAIRE | NU-8500 | |
| Inverted Microscope (Axiovert 25) | Zeiss | 663526 | |
| Invitrogen DiOC16(3) (3,3'-Dihexadecyloxacarbocyanine Perchlorate) | Fisher Scientific | D1125 | |
| Leica Confocal SP8 | Leica Microsystems Inc. | ||
| Light and Flourescent Microscope (Axiovert 200M) | Zeiss | 3820005619 | |
| Micro centrifuge tubes | Fisher Scientific | 2 mL: 02681258 | |
| Microscope Software | Zeiss | AxioVision Rel. 4.8.2 | |
| Nestin Alexa Fluor 594 | Santa Cruz Biotechnology | sc-23927 | |
| Parafilm | PARAFILM | PM992 | |
| PBS (1x), pH 7.4 | HyClone | SH30256.01 | |
| Penicillin Streptomycin | MP Biomedicals | 1670046 | |
| Pipette Aid | Drummond Scientific Co. | P-76864 | |
| Pipette Tips (1–200 µL, 101–1000 µL) | Fisher Scinetific | 2707509 | |
| Plastic Standard Disposable Transfer Pipettes | Fisher Scientific | 13-711-9D | |
| Plastic Weigh Boats (100 mL) | Amazon | mdo-azoc-1030 | |
| poly(ethylene glycol)-dithiol (PEG-diSH; 3.4 kDa) | Laysan Bio | SH-PEG-SH-3400-5g | |
| Polydimehylsiloxane (PDMS) [Slygard 182 Elastomer Kit] | Elsworth Adhesives | 3097358-1004 | Polydimethylsiloxane |
| Powder Free Examination Gloves | Quest | 92897 | |
| Propidium iodide, 1 mg/mL aqueous soln. | Fisher Scientific | AAJ66584AB | |
| RPMI-1640 Medium (1x) | HyClone | SH30027-02 | |
| Silicone spacers - Silicone sheet, 0.5 mm thick/13 cm x 18 cm | Grace Bio-Labs | JTR-S-0.5 | |
| SOX2 Alexa Fluor 488 | Santa Cruz Biotechnology | sc-365823 | |
| Tissue Culture Hood | NUAIRE | NU-425-600 | |
| Triethanolamine, ≥99.0% (GC) | Sigma Aldrich | 90279 | |
| U-87 MG human glioblastoma cells | American Type Culture Collection | HTB-14 |
Referanslar
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Costa, E. C., de Melo-Diogo, D., Moreira, A. F., Carvalho, M. P., Correia, I. J. Spheroids formation on non-adhesive surfaces by liquid overlay technique: Considerations and practical approaches. Biotechnology Journal. 13 (1), 1700417(2018).
- Li, Y., Kumacheva, E. Hydrogel microenvironments for cancer spheroid growth and drug screening. Science Advances. 4 (4), eaas8998(2018).
- Kamatar, A., Gunay, G., Acar, H. Natural and synthetic biomaterials for engineering multicellular tumor spheroids. Polymers. 12 (11), 2506(2020).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular Pharmaceutics. 11 (7), 2115-2125 (2014).
- Nakod, P. S., Kim, Y., Rao, S. S. Three-dimensional biomimetic hyaluronic acid hydrogels to investigate glioblastoma stem cell behaviors. Biotechnology and Bioengineering. 117 (2), 511-522 (2020).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85, 128-146 (2020).
- Pedron, S., et al. Hyaluronic acid-functionalized gelatin hydrogels reveal extracellular matrix signals temper the efficacy of erlotinib against patient-derived glioblastoma specimens. Biomaterials. 219, 119371(2019).
- Hill, L., Bruns, J., Zustiak, S. P. Hydrogel matrix presence and composition influence drug responses of encapsulated glioblastoma spheroids. Acta Biomaterialia. 132, 437-447 (2021).
- Chen, J. -W. E., et al. Crosstalk between microglia and patient-derived glioblastoma cells inhibit invasion in a three-dimensional gelatin hydrogel model. Journal of Neuroinflammation. 17 (1), 346(2020).
- Thakuri, P. S., Liu, C., Luker, G. D., Tavana, H. Biomaterials-based approaches to tumor spheroid and organoid modeling. Advanced Healthcare Materials. 7 (6), 1700980(2018).
- Shin, S., et al. Alginate-marine collagen-agarose composite hydrogels as matrices for biomimetic 3D cell spheroid formation. RSC Advances. 6 (52), 46952-46965 (2016).
- Pradhan, S., Clary, J. M., Seliktar, D., Lipke, E. A. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 115, 141-154 (2017).
- Imaninezhad, M., Hill, L., Kolar, G., Vogt, K., Zustiak, S. P. Templated macroporous polyethylene glycol hydrogels for spheroid and aggregate cell culture. Bioconjugate Chemistry. 30 (1), 34-46 (2018).
- Mirab, F., Kang, Y. J., Majd, S. Preparation and characterization of size-controlled glioma spheroids using agarose hydrogel microwells. PLoS One. 14 (1), e0211078(2019).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments: JoVE. 81, e50665(2013).
- Timmins, N. E., Nielsen, L. K. Generation of Multicellular Tumor Spheroids by the Hanging-Drop Method. Hauser, H., Fussenegger, M. 140, Springer, Humana Press, NJ. (2007).
- Zhao, L., et al. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Scientific Reports. 9 (1), 19717(2019).
- Amaral, R. L., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605(2017).
- Gencoglu, M. F., et al. Comparative study of multicellular tumor spheroid formation methods and implications for drug screening. ACS Biomaterials Science & Engineering. 4 (2), 410-420 (2018).
- Zhang, C., Liu, C., Zhao, H. Mechanical properties of brain tissue based on microstructure. Journal of the Mechanical Behavior of Biomedical Materials. 126, 104924(2021).
- Alifieris, C., Trafalis, D. T. Glioblastoma multiforme: Pathogenesis and treatment. Pharmacology & Therapeutics. 152, 63-82 (2015).
- Zustiak, S. P., Leach, J. B. Hydrolytically degradable poly (ethylene glycol) hydrogel scaffolds with tunable degradation and mechanical properties. Biomacromolecules. 11 (5), 1348-1357 (2010).
- Zustiak, S. P., Wei, Y., Leach, J. B. Protein-hydrogel interactions in tissue engineering: Mechanisms and applications. Tissue Engineering Part B: Reviews. 19 (2), 160-171 (2013).
- Kroger, S. M., et al. Design of hydrolytically degradable polyethylene glycol crosslinkers for facile control of hydrogel degradation. Macromolecular Bioscience. 20 (10), 2000085(2020).
- Raeber, G., Lutolf, M., Hubbell, J. Molecularly engineered PEG hydrogels: a novel model system for proteolytically mediated cell migration. Biophysical Journal. 89 (2), 1374-1388 (2005).
- Bruns, J., Egan, T., Mercier, P., Zustiak, S. P. Glioblastoma spheroid growth and chemotherapeutic responses in single and dual-stiffness hydrogels. Acta Biomaterialia. 163, 400-414 (2023).
- Kuwajima, T., et al. ClearT: a detergent-and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Holt, S. E., Ward, E. S., Ober, R. J., Alge, D. L. Shooting for the moon: using tissue-mimetic hydrogels to gain new insight on cancer biology and screen therapeutics. MRS Communications. 7 (3), 427-441 (2017).
- Jain, E., Scott, K. M., Zustiak, S. P., Sell, S. A. Fabrication of polyethylene glycol-based hydrogel microspheres through electrospraying. Macromolecular Materials and Engineering. 300 (8), 823-835 (2015).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948(2016).
- Lee, K. -H., Kim, T. -H. Recent advances in multicellular tumor spheroid generation for drug screening. Biosensors. 11 (11), 445(2021).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır