JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
스페로이드-매트릭스 상호 작용 연구를 위한 폴리에틸렌 글리콜 하이드로겔의 종양 스페로이드 제조 및 캡슐화
요약
여기에서는 종양 스페로이드를 빠르고 강력하며 저렴하게 제조한 후 하이드로겔 캡슐화를 수행할 수 있는 프로토콜을 제시합니다. 특수 장비가 필요하지 않기 때문에 널리 적용 가능합니다. 스페로이드 매트릭스 상호 작용을 탐색하고 체외 조직 생리학 또는 병리학 모델을 구축하는 데 특히 유용할 것입니다.
초록
스페로이드의 3차원(3D) 캡슐화는 최적의 세포 성장을 위해 종양 미세환경을 적절하게 복제하는 데 매우 중요합니다. 여기에서 우리는 종양 세포외 미세환경을 모방하기 위해 스페로이드 캡슐화를 위한 시험관 내 3D 교모세포종 모델을 설계했습니다. 먼저, 폴리디메틸실록산을 사용하여 정사각형 피라미드형 마이크로웰 몰드를 형성했습니다. 그런 다음 이 마이크로웰 몰드를 사용하여 50-500μm의 엄격하게 제어된 크기의 종양 스페로이드를 제작했습니다. 스페로이드가 형성되면 수거하여 폴리에틸렌 글리콜(PEG) 기반 하이드로겔에 캡슐화했습니다. PEG 하이드로겔은 스페로이드 캡슐화를 위한 다목적 플랫폼으로, 강성, 분해성 및 세포 접착성과 같은 하이드로겔 특성을 독립적으로 조정할 수 있습니다. 여기서는 대표적인 연화(~8kPa) 하이드로겔을 사용하여 교모세포종 스페로이드를 캡슐화했습니다. 마지막으로, 스페로이드를 염색하고 이미지화하는 방법이 개발되어 컨포칼 현미경을 통해 고품질 이미지를 얻을 수 있습니다. 조밀한 스페로이드 코어와 상대적으로 희박한 주변부로 인해 이미징이 어려울 수 있지만 투명화 용액과 공초점 광학 절편을 사용하면 이러한 이미징 어려움을 완화하는 데 도움이 됩니다. 요약하면, 균일한 스페로이드를 제조하고, PEG 하이드로겔에 캡슐화하고, 캡슐화된 스페로이드에 대해 공초점 현미경을 수행하여 스페로이드 성장 및 다양한 세포-기질 상호 작용을 연구하는 방법을 보여줍니다.
서문
종양 스페로이드는 암 병인학, 병리학 및 약물 반응성을 연구하는 데 유용한 시험관 내 도구로 부상했습니다1. 전통적으로 스페로이드는 저접착 플레이트 또는 바이오리액터와 같은 조건에서 배양되어 왔으며, 세포 표면 접착보다 세포간 접착이 선호됩니다2. 그러나 이제 종양 미세환경을 보다 충실하게 재현하기 위해 시험관 내 스페로이드 모델은 세포-세포 및 세포-기질 상호 작용을 모두 캡처해야 한다는 것이 인식되었습니다. 이로 인해 여러 그룹이 스페로이드를 캡슐화할 수 있는 하이드로겔과 같은 스캐폴드를 설계하게 되었습니다 3,4. 이러한 하이드로겔 기반 스페로이드 모델은 생존율, 증식, 줄기성 또는 치료 반응성과 같은 다양한 세포 거동에 대한 세포-세포 및 세포-매트릭스 상호 작용을 규명할 수 있습니다3.
여기서는 폴리에틸렌 글리콜(PEG) 하이드로겔에서 교모세포종 스페로이드를 캡슐화하기 위한 프로토콜을 설명합니다. 하이드로겔의 교모세포종 세포 스페로이드 캡슐화에 대한 여러 문헌 보고가 있습니다. 예를 들어, RGDS 접착 리간드로 장식된 PEG 하이드로겔에 U87 세포를 캡슐화하고 효소로 절단할 수 있는 펩타이드로 가교하여 세포 거동에 대한 하이드로겔 강성의 효과를 측정함으로써 스페로이드를 형성했습니다5. U87 세포는 암 줄기세포 집단을 확장하기 위해 다른 PEG 기반 또는 히알루론산 기반 하이드로겔에서도 형성되었으며,6 화학요법 내성의 매트릭스 매개 메커니즘을 탐색하기 위해형성되었습니다 7,8,9. 교모세포종 스페로이드는 또한 미세아교세포와 암세포 사이의 누화와 세포 침습에 미치는 영향을 연구하기 위해 젤라틴 하이드로겔에 캡슐화되었습니다10. 전반적으로, 이러한 연구는 교모세포종 병리를 이해하고 치료법을 고안하는 데 하이드로겔 기반 시험관 내 모델의 유용성을 입증했습니다.
또한, 종양 스페로이드 제조 및 하이드로겔 캡슐화를 위한 다양한 방법이 있다11. 예를 들어, 분산된 세포는 하이드로겔에 파종될 수 있고 시간이 지남에 따라 스페로이드를 형성할 수 있습니다 5,12. 이러한 방법의 한 가지 단점은 형성된 스페로이드의 다분산성으로, 이는 세포 반응 차이를 유발할 수 있습니다. 균일한 스페로이드를 생산하기 위해, 세포를 마이크로겔에 캡슐화하고 겔13에 침입하여 리모델링할 때까지 장기간 배양하거나, 세포를 구형 '구멍'이 있는 템플릿 겔에 증착하고 응집시키도록 허용할 수 있다14. 이러한 방법의 단점은 상대적인 복잡성, 마이크로겔 또는 겔의 '구멍'을 형성하기 위한 액적 발생기 또는 기타 수단의 필요성, 스페로이드가 성장하고 성숙하는 데 걸리는 시간입니다. 대안적으로, 스페로이드는 마이크로웰(9,15,16) 또는 행잉-드롭 플레이트(17,18)에서 예비-형성될 수 있고, 이어서 여기에 설명된 기술과 유사하게 하이드로겔에 캡슐화될 수 있다. 이러한 방법은 더 간단하며 더 높은 처리량 방식으로 수행할 수 있습니다. 흥미롭게도, 스페로이드 형성 방법은 유전자 발현, 세포 증식 또는 약물 반응성과 같은 스페로이드 세포 거동에 영향을 미칠 수 있음이 밝혀졌다19,20.
여기서 우리는 교모세포종에 초점을 맞추는데, 교모세포종은 부드러운 나노다공성 하이드로겔로 모방할 수 있는 부드러운 나노다공성 뇌 기질21을 본래 환경에 있는 고형 종양이기 때문입니다. 교모세포종은 또한 치료법이 없는 가장 치명적인 뇌종양이다22. 그러나, 여기에 기술된 프로토콜은 임의의 고형 종양을 나타내는 스페로이드의 캡슐화에 사용될 수 있다. 우리는 마이클 형 첨가 반응23을 통해 형성되는 PEG 하이드로 겔을 사용하기로 결정했습니다. PEG는 불활성이고 스캐폴딩 및 물리적 세포 지지체 역할을 하지만 세포 부착을 지지하지 않는 합성, 비분해성 및 생체 적합성 하이드로겔입니다(23). 세포 접착성은 전체 단백질 또는 접착 리간드(24)의 테더링을 통해 별도로 첨가될 수 있고, 분해성은 PEG 중합체 사슬 또는 가수분해 또는 효소적으로 분해되는 가교결합제(25,26)의 화학적 변형을 통해 첨가될 수 있다. 이를 통해 기계적 또는 물리적 하이드로겔 특성과 독립적으로 생화학적 특성을 조정할 수 있으며, 이는 세포-매트릭스 상호 작용을 연구하는 데 유리할 수 있습니다. 마이클 유형 겔화 화학은 선택적이며 생리적 조건에서 발생합니다. 따라서 스페로이드를 하이드로겔 전구체 용액과 혼합하기만 하면 스페로이드 캡슐화가 가능합니다.
전반적으로 여기에 제시된 방법론에는 몇 가지 주목할 만한 특징이 있습니다. 첫째, 멀티웰 어셈블리에서 종양 스페로이드를 제조하는 것이 효율적이고 빠르며 필요한 재료의 비용이 저렴합니다. 둘째, 스페로이드는 다분산성이 낮은 다양한 크기의 대량 생산됩니다. 마지막으로, 상업적으로 이용 가능한 재료만 필요합니다. 이 방법론의 유용성은 스페로이드 세포 생존율, 순환성 및 세포 줄기에 대한 기질 특성의 효과를 탐구함으로써 설명됩니다.
프로토콜
1. 솔루션 준비
- 폴리디메틸실록산(PDMS) 전구체 용액의 제조
- 네거티브 PDMS 전구체 용액(접착제 전구체 용액에도 사용됨)을 준비합니다. 주걱을 사용하여 엘라스토머를 계량 보트에 퍼서 무게를 잰다. 경화제를 엘라스토머 베이스에 1:10 비율로 추가합니다. 플라스틱 계량 보트의 주걱을 사용하여 PDMS와 경화제를 부드럽고 완전히 혼합합니다.
알림: 이 PDMS 전구체 용액을 6웰 정사각형 피라미드 마이크로웰 플레이트에 부어 네거티브 몰드를 형성합니다. 이것은 접착제 전구체 용액에 사용되는 것과 동일한 용액입니다. - 포지티브 PDMS 전구체 용액을 준비합니다. 주걱을 사용하여 엘라스토머 베이스를 계량 보트에 퍼서 무게를 잰다. 경화제를 엘라스토머 베이스에 1:9 비율로 추가합니다. 플라스틱 계량 보트의 주걱을 사용하여 PDMS와 경화제를 부드럽고 완전히 혼합합니다.
참고: 이 PDMS 전구체 용액은 나중에 음극 금형에 부어 양극 금형을 형성합니다.
- 네거티브 PDMS 전구체 용액(접착제 전구체 용액에도 사용됨)을 준비합니다. 주걱을 사용하여 엘라스토머를 계량 보트에 퍼서 무게를 잰다. 경화제를 엘라스토머 베이스에 1:10 비율로 추가합니다. 플라스틱 계량 보트의 주걱을 사용하여 PDMS와 경화제를 부드럽고 완전히 혼합합니다.
- pH 8의 0.3M 트리에탄올아민(TEA) 완충액 제조
- 피펫 보조제를 사용하여 1mL의 TEA와 9mL의 1x 인산염 완충 식염수(PBS)를 50mL 원뿔형에 피펫팅하여 0.75M TEA 용액을 만듭니다. 1N HCl 또는 1N NaOH를 사용하여 용액을 pH 8로 적정합니다. 그런 다음 pH 8에서 0.3M의 최종 TEA 농도를 달성하기 위해 25mL의 최종 부피를 달성하기 위해 충분한 1x PBS를 추가합니다.
주의 : HCl 및 NaOH 용액은 실온(RT)의 가연성 캐비닛에 보관하십시오. 취급 시 개인 보호 장비를 착용하십시오.
- 피펫 보조제를 사용하여 1mL의 TEA와 9mL의 1x 인산염 완충 식염수(PBS)를 50mL 원뿔형에 피펫팅하여 0.75M TEA 용액을 만듭니다. 1N HCl 또는 1N NaOH를 사용하여 용액을 pH 8로 적정합니다. 그런 다음 pH 8에서 0.3M의 최종 TEA 농도를 달성하기 위해 25mL의 최종 부피를 달성하기 위해 충분한 1x PBS를 추가합니다.
- 완전한 매체 준비
- 전체 배지를 준비하려면 500mL RPMI 배지에 소 태아 혈청 10%(w/v) 또는 56mL와 페니실린 및 스트렙토마이신 1%(w/v) 또는 5.6mL를 추가합니다.
- 용액을 37°C에서 10-20분 동안 또는 사용하기 전에 용액이 따뜻해질 때까지 둡니다.
- 용액을 0-4 °C에서 최대 6개월 동안 보관합니다.
- 20%(w/v) 폴리에틸렌 글리콜(PEG) 원액 준비
참고: 계산은 필요에 따라 확장 또는 축소할 수 있는 100μL 용액을 기반으로 합니다.- 20% w/v 4-arm PEG-Acrylate(4-arm PEG-Ac)의 100μL 원액을 준비하려면 미세분리 튜브에서 4-arm PEG-Ac 분말 20mg을 칭량합니다. 70μL의 0.3M TEA 완충액을 첨가한 다음 약 30초 동안 또는 완전히 용해될 때까지 용액을 소용돌이칩니다. 최종 용액 부피 100μL에 도달하기에 충분한 TEA 완충액(~27μL)을 추가하여 분말 용해로 인한 부피 변화를 고려합니다.
- 20% w/v PEG-diSH의 100μL 원액을 준비하려면 미세분리 튜브에서 PEG-diSH 분말 20mg을 칭량합니다. 70μL의 TEA 완충액을 첨가한 다음 약 30초 동안 또는 완전히 용해될 때까지 용액을 소용돌이칩니다. 최종 용액 부피 100μL에 도달하기에 충분한 TEA 완충액(~27μL)을 추가하여 분말 용해로 인한 부피 변화를 고려합니다.
알림: PEG 분말은 흡습성이 매우 높으며 -20°C의 건조된 용기에 보관해야 합니다. 냉동실에서 꺼낼 때는 PEG 분말을 10분 동안 해동한 후 병을 열어 분말의 무게를 잰다. 냉동실로 되돌리기 전에 질소나 아르곤과 같은 불활성 가스로 병을 퍼지하여 습한 공기를 대체하십시오. 4-암 PEG-Ac의 원액은 사용 전 최대 2주 동안 4°C에서 보관할 수 있습니다. PEG-diSH의 원액은 사용 직전에 준비해야 하며 티올기가 서로 반응하여 이황화 결합을 형성하기 때문에 보관할 수 없습니다.
- 2% v/v 기저막 매트릭스 용액의 제조
- 2% v/v 기저막 매트릭스 작업 용액을 준비하려면 20μL의 기저막 매트릭스(LDEV 없음)를 9.98mL의 전체 배지에 추가하고 위아래로 피펫팅하여 ~10회 완전히 혼합합니다. 4 °C (얼음 위)에서 용액을 준비한 다음 37 °C (오븐 또는 인큐베이터)로 데우고 즉시 사용하십시오.
알림: 기저막 매트릭스는 >10°C에서 겔을 형성하기 시작하므로 기저막 매트릭스 용액을 2-6°C에서 완전한 매체와 혼합해야 합니다. 전체 미디어 구성은 1.3단계에서 설명합니다.
- 2% v/v 기저막 매트릭스 작업 용액을 준비하려면 20μL의 기저막 매트릭스(LDEV 없음)를 9.98mL의 전체 배지에 추가하고 위아래로 피펫팅하여 ~10회 완전히 혼합합니다. 4 °C (얼음 위)에서 용액을 준비한 다음 37 °C (오븐 또는 인큐베이터)로 데우고 즉시 사용하십시오.
- 세포 고정 용액의 제조
- 파라포름알데히드 4% w/v 및 비이온성 계면활성제 0.1% v/v를 함유한 세포 고정액 1mL를 제조하려면 먼저 1x PBS 891μL와 파라포름알데히드 108μL(농도 37% w/v)를 혼합한 다음 비이온성 계면활성제 1μL(100% 농도)를 첨가합니다. 용액을 잘 섞는다.
알림: 고정액은 고정을 수행할 때마다 새로 만들어야 합니다.
주의 : 파라포름알데히드는 가연성이며 공기 중에 가연성 먼지 농도를 형성할 수 있습니다. 피부 자극과 심각한 눈 손상을 일으킵니다. 호흡기 자극을 유발할 수 있으므로 숨을 들이쉬지 마십시오. 파라포름알데히드를 화학 흄 후드에서 취급하고 개인 보호 장비를 착용하십시오. 취급 후에는 손을 깨끗이 씻으십시오. 비이온성 계면활성제는 피부 자극과 심각한 눈 손상을 일으킵니다. 취급 시 보호 장갑과 보안경 또는 안면 보호구를 착용하십시오. 환경으로 방출되는 것을 방지하려면 화학 흄 후드에서 병을 여십시오. 취급 후에는 손을 깨끗이 씻으십시오.
- 파라포름알데히드 4% w/v 및 비이온성 계면활성제 0.1% v/v를 함유한 세포 고정액 1mL를 제조하려면 먼저 1x PBS 891μL와 파라포름알데히드 108μL(농도 37% w/v)를 혼합한 다음 비이온성 계면활성제 1μL(100% 농도)를 첨가합니다. 용액을 잘 섞는다.
- 염색 용액의 준비
- 3,3'-디헥실록사카르보시아닌 요오드화물(DiOC) 3mM을 제조하려면 DMSO 1mL에 DiOC 2.65mg을 혼합합니다.
- 1.5mM의 프로피듐 요오드화물 용액(PI)을 제조하려면 1mL의 탈이온수에 PI 1mg을 혼합합니다.
- 스페로이드 투명화 용액의 제조
- 스페로이드 투명화를 위해 1x PBS에서 포름아미드 20%, 40% 및 80% v/v의 투명화 용액을 준비합니다.
- 20% v/v 포름아미드 10mL를 만들려면 1x PBS 8mL와 포름아미드 2mL를 혼합합니다. 10mL의 40% v/v 포름아미드를 만들려면 1x PBS 6mL와 포름아미드 4mL를 혼합합니다. 10mL의 80% v/v 포름아미드를 만들려면 1x PBS 2mL와 포름아미드 8mL를 혼합합니다.
- 포름 아미드와 1x PBS를 결합 한 후 약 30 초 동안 와류하여 용액을 혼합합니다.
- 스페로이드 투명화를 위해 1x PBS에서 포름아미드 20%, 40% 및 80% v/v의 투명화 용액을 준비합니다.
2. 정연한 피라미드 모양의 마이크로웰 제작
- 그림 1과 같이 정사각형 피라미드형 마이크로웰의 네거티브 PDMS 금형을 제작합니다.
- 2g(~1mL)의 음성 PDMS 전구체 용액을 준비하여 6웰 정사각형 피라미드 마스터 몰드의 웰 하나에 붓습니다. 1mL는 플레이트의 웰 하나를 완전히 덮습니다. 마스터 몰드를 PDMS로 덮은 후 6웰 정사각형 피라미드 플레이트를 진공 데시케이터에 넣어 PDMS 전구체 용액을 30분 동안 탈기합니다. 그런 다음 플레이트를 60°C 오븐에 24시간 동안 넣어 PDMS를 경화합니다.
알림: 가스 제거를 위해 플레이트 뚜껑을 제거하고 경화를 위해 다시 놓으십시오. 진공 데시케이터에서 또는 질소 또는 아르곤과 같은 불활성 가스로 퍼지를 통해 용액을 탈기합니다. 30분 후에도 음극 몰드 전구체 용액에 여전히 기포가 있어 부적절한 탈기를 나타내는 경우 진공 데시케이터에 추가로 30분 동안 두십시오. 하나 이상의 플레이트 웰을 동시에 사용하여 하나 이상의 PDMS 네거티브 몰드를 준비합니다. 표 1과 같이 400 및 800 μm 측면 길이와 같은 다양한 크기의 정사각형 피라미드형 마이크로웰을 사용할 수 있습니다. 정사각형 피라미드 크기에 관계없이 동일한 양의 PDMS가 사용됩니다. - PDMS가 아직 따뜻할 때 경화되면 주걱을 사용하여 마스터 금형에서 음극 PDMS 금형을 조심스럽게 제거하고 생검 펀치를 사용하여 직경 35mm 슬래브에서 음극 금형을 절단합니다. 페트리 접시에 담고 뚜껑을 덮고 추가로 24시간 동안 계속 경화시킵니다.
알림: 네거티브 몰드를 제거하려면 주걱을 사용하여 웰 플레이트와 PDMS 몰드 사이를 이동하고 마스터 몰드에서 네거티브 몰드를 부드럽게 잡아당깁니다. 금형은 35mm 페트리 접시에 맞도록 35mm 슬래브로 절단됩니다. 금형은 직경이 다른 판에 맞게 다른 크기로 만들 수 있습니다. 35mm 네거티브 몰드 슬래브는 보관이 가능하고, RT에서 먼지로부터 보호되며, 6개월 동안 재사용할 수 있습니다.
- 2g(~1mL)의 음성 PDMS 전구체 용액을 준비하여 6웰 정사각형 피라미드 마스터 몰드의 웰 하나에 붓습니다. 1mL는 플레이트의 웰 하나를 완전히 덮습니다. 마스터 몰드를 PDMS로 덮은 후 6웰 정사각형 피라미드 플레이트를 진공 데시케이터에 넣어 PDMS 전구체 용액을 30분 동안 탈기합니다. 그런 다음 플레이트를 60°C 오븐에 24시간 동안 넣어 PDMS를 경화합니다.
- 정사각형 피라미드 마이크로웰의 포지티브 PDMS 금형을 준비합니다.
- 네거티브 PDMS 몰드의 35mm 슬래브를 질감이 있는 마이크로웰이 위를 향하도록 하여 35mm 페트리 접시에 놓습니다.
- 위와 같이 2.5g(~1.2mL)의 positive PDMS 전구체 용액을 준비하고 35mm 페트리 접시의 negative mold에 부어 negative mold를 완전히 덮습니다. 그런 다음 위와 같이 전구체 용액을 30분 동안 탈기하고 60°C 오븐에 3-4시간 동안 넣습니다.
알림: PDMS는 점성이 있기 때문에 네거티브 몰드 아래에 갇힌 공기로 인해 기포가 형성될 수 있습니다. 네거티브 몰드 아래에 기포가 형성되면 주걱을 사용하여 몰드를 부드럽게 아래로 눌러 기포를 해제합니다. 기포가 남아 있으면 30분 동안 가스 제거를 계속하거나 주걱을 사용하여 기포가 터질 때까지 양극 곰팡이 용액을 부드럽게 저어줍니다. - 포지티브 PDMS 몰드가 경화되면 35mm 페트리 접시에서 몰드를 제거하고 즉시 네거티브 몰드에서 포지티브 몰드를 벗겨냅니다.
알림: 포지티브 몰드의 성공적인 박리를 위해서는 타이밍이 중요합니다. 제거는 면도기를 사용하여 양극 곰팡이를 약간 절단하여 양극 곰팡이와 음극 곰팡이 사이의 인터페이스를 노출시키고 금형을 서로 벗겨내는 것이 가장 좋습니다. 그런 다음 원형 몰드의 가장자리를 벗겨냅니다. 포지티브 몰드에서 네거티브 몰드를 부드럽게 벗겨냅니다.
- 금형을 48웰 플레이트의 웰 바닥에 붙입니다.
참고: 여기서는 48웰 플레이트가 사용되지만 몰드 슬래브가 올바른 직경으로 절단되는 한 다른 플레이트를 사용할 수 있습니다(예: 6웰 플레이트의 경우 직경 96mm).- 10mm 생검 펀치를 사용하여 포지티브 몰드를 슬래브로 자릅니다.
알림: 직경 35mm 포지티브 몰드 1개에서 약 4개의 몰드(각 직경 10mm)를 절단할 수 있습니다. - 몰드를 48웰 플레이트의 바닥에 접착하려면, 앞서 설명한 바와 같이 PDMS 접착제 전구체 용액(~0.5mL 또는 1g)을 준비한다27. 핀셋을 사용하여 10mm 포지티브 몰드의 평평한 면(마이크로웰 패턴이 있는 면이 아님)을 PDMS 전구체 용액에 부드럽게 담그십시오. 48웰 플레이트의 웰당 하나의 몰드를 조심스럽게 배치하고 핀셋을 사용하여 각 몰드를 웰 바닥까지 부드럽게 누릅니다. 조립된 플레이트를 60°C 오븐에 4-24시간 동안 넣어 PDMS 접착제가 경화되도록 합니다.
알림: PDMS 접착제 전구체 용액이 포지티브 몰드 마이크로웰에 닿으면 연티슈 페이퍼를 사용하여 닦아낼 수 있으며 단계를 반복할 수 있습니다. 접착 할 때 접착제가 마이크로 웰을 덮지 않도록하십시오. - 1000μL 피펫을 사용하여 300μL의 70% 에탄올을 48웰 플레이트의 각 웰에 추가하여 금형을 멸균합니다. 70% 에탄올을 흡인하고 뚜껑을 덮지 않은 48웰 플레이트를 UV(302nm) 하에서 조직 배양 후드에 2시간 동안 둡니다.
알림: 금형은 6개월 동안 사용할 수 있으며 필요에 따라 다시 멸균할 수 있습니다.
- 10mm 생검 펀치를 사용하여 포지티브 몰드를 슬래브로 자릅니다.
3. 하이드로겔에서 다세포 종양 스페로이드 형성, 수확 및 캡슐화
참고: 이 섹션에 설명된 프로토콜은 U87 인간 교모세포종 세포주( 그림 1 및 그림 2 참조)를 위한 것이지만 다른 암 세포 유형에도 유사한 프로토콜을 사용할 수 있습니다.
- 다세포 종양 스페로이드 형성
- 1000μL 피펫을 사용하여 각 웰에 300μL의 용액을 추가하여 접착 방지 헹굼 용액으로 마이크로웰 몰드를 먼저 세척합니다. 그런 다음 1620 x g 에서 3분 동안 원심분리하고 진공 펌프와 파스퇴르 피펫을 사용하여 용액을 흡입합니다.
참고: 셀 시드 직전에 이 단계를 수행합니다. - 세포를 37°C에서 5분 동안 배양 플라스크 영역의 각cm2 당 ~80μL의 0.25% 트립신/EDTA에 노출시킵니다. 예를 들어, 1mL의 트립신/EDTA는 T-25 세포 배양 플라스크에 적합합니다. 동일한 부피의 완전한 세포 배양 배지를 추가하여 트립신을 중화합니다. 예를 들어, 트립신 함유 T-25 세포 배양 플라스크에 1mL의 완전한 배지를 추가합니다. 조직 배양 플라스크에서 세포를 수집합니다.
- 세포 계수를 위해 세포 현탁액 10μL를 혈구분석기의 각 포트로 옮깁니다. 도립 현미경을 사용하여 총 세포 수를 계산하고 최소 8개 사분면에서 해당 세포 수를 평균화하여 각 혈구계 사분면의 세포 수가 20-50이 되도록 하여 좋은 세포 수 결과를 얻을 수 있습니다. 계산된 숫자에 104 를 곱하여 최종 세포 농도를 결정합니다.
- 표 1에 표시된 바와 같이 원하는 스페로이드 크기에 따라 원하는 최종 세포 농도에서 10% 소 태아 혈청 및 1% 페니실린/스트렙토마이신이 보충된 완전한 RPMI 세포 배양 배지에 수집된 세포를 재현탁시킵니다.
참고: 800μm 마이크로웰은 48웰 플레이트의 한 웰에서 ~75개의 스페로이드를 생성하고, 400μm 마이크로웰은 48웰 플레이트의 한 웰에서 ~300개의 스페로이드를 생성합니다. - 500μL의 셀 현탁액을 마이크로웰에 원하는 농도로 놓고 플레이트를 1620 x g 에서 3분 동안 원심분리합니다. 플레이트를 37°C 및 5% CO2 의 가습 인큐베이터에 24시간 동안 넣어 스페로이드가 형성되도록 합니다.
참고: 스페로이드가 형성되지 않으면 전체 배지와 결합된 기저막 매트릭스의 2% v/v를 사용하여 세포를 재현탁할 수 있습니다(자세한 내용은 1.5단계 참조).
- 1000μL 피펫을 사용하여 각 웰에 300μL의 용액을 추가하여 접착 방지 헹굼 용액으로 마이크로웰 몰드를 먼저 세척합니다. 그런 다음 1620 x g 에서 3분 동안 원심분리하고 진공 펌프와 파스퇴르 피펫을 사용하여 용액을 흡입합니다.
- 스페로이드 수확
- 1000 μL 피펫을 사용하여 500 μL의 완전한 배지를 웰에 단단히 피펫팅합니다. 웰에서 500μL의 배지를 사용하여 사분면에서 위아래로 3-4회 피펫팅하여 웰의 4개 사분면(특히 상단, 하단, 왼쪽 및 오른쪽 사분면)을 플러시하여 스페로이드를 제거합니다. 1000μL 피펫을 사용하여 스페로이드가 포함된 배지(총 ~1000μL)를 마이크로 원심분리 튜브에 부드럽게 흡입하고 스페로이드가 바닥에 가라앉도록 합니다.
- 상층액을 제거하고 스페로이드를 원하는 최종 농도로 재현탁시킵니다. 예를 들어, 캡슐화 후 20μL 겔에서 ~8개의 스페로이드를 얻으려면 100μL의 배지에 스페로이드를 재현탁시켜 스페로이드 현탁액에서 ~75 스페로이드/100μL의 스페로이드 농도를 산출합니다.
- 그림 2와 같이 하이드로겔의 스페로이드 캡슐화.
- 100μL의 10% w/v PEG 하이드로겔 전구체 용액을 생성하려면 50μL의 스페로이드 현탁액을 결합한 다음 30μL의 20% w/v 4-arm PEG-Ac를 결합하고 마지막으로 20μL의 20% w/v PEG-diSH를 마이크로 원심분리 튜브에 결합합니다. 이렇게 하면 아크릴레이트(Ac)와 티올(SH) 그룹의 화학량론적 몰비가 최적의 가교를 보장합니다. 겔 전구체 용액을 위아래로 피펫팅하여 ~10회 혼합합니다.
알림: 하이드로겔 구성, 부피 및 폴리머 결합은 필요에 따라 변경할 수 있습니다. 생성된 하이드로겔은 서서히 분해되고 비세포 접착제가 됩니다. 하이드로겔 셀 접착제를 만들기 위해, RGDS와 같은 접착 리간드를 첨가할 수 있다. 하이드로겔을 효소적으로 분해할 수 있도록 하기 위해, 양쪽 말단에 시스테인 잔기를 함유하는 효소적으로 분해성 펩타이드 가교제를 첨가할 수 있다. 스페로이드를 옮길 때 용액을 부드럽게 피펫팅하여 스페로이드를 제거하고 현탁액으로 가져와 스페로이드가 고르게 분포되도록 합니다. - 겔 전구체 용액 20μL를 1mm 실리콘 스페이서로 분리된 두 개의 파라필름 라이닝 유리 슬라이드 사이에 피펫팅하고 겔 전구체 용액이 있는 슬라이드를 37°C, 5%CO2 인큐베이터에 15분 동안 넣어 겔화를 허용합니다.
알림: 두 개의 유리 슬라이드가 파라필름으로 덮여 있어 겔화 시 쉽게 벗겨질 수 있는 소수성 표면을 만듭니다. 파라필름 대신 소수성 코팅 용액을 사용할 수 있습니다. 20μL 부피의 하이드로겔 전구체 용액은 팽창 전에 직경 ~6mm, 높이 1mm의 하이드로겔 슬래브를 생성합니다. 모든 스페이서 유형 및 두께를 사용할 수 있지만 겔 두께는 1mm 이하로 유지하되(하이드로겔이 두꺼우면 산소 확산 및 세포로의 영양소 전달이 제한될 수 있음) 스페로이드 직경보다 크게 유지하는 것이 좋습니다(스페로이드가 겔에 완전히 캡슐화되도록). 임의의 부피의 하이드로겔 전구체 용액을 사용할 수 있습니다. 20-30 μL 겔은 24웰 플레이트에 적합합니다. - 하이드로겔 겔화가 완료되면 두 개의 유리 슬라이드를 분리하고 주걱을 사용하여 유리판에서 겔을 부드럽게 떼어냅니다. 겔을 웰당 하나씩 24웰 플레이트에 넣고 스페로이드가 포함된 표면이 위를 향하도록 합니다.
알림: 스페로이드는 겔화 중에 겔 바닥으로 떨어지므로 배양을 위해 뒤집으면 스페로이드가 하이드로겔 표면 근처에 있어 영양분과 산소에 더 잘 접근할 수 있습니다. 겔화는 마이크로 원심분리기 튜브에 남아 있는 하이드로겔 전구체 용액을 관찰하여 모니터링할 수 있으며, 튜브를 뒤집고 겔이 흐름을 멈추는 시간을 기록하여 슬래브를 만드는 데 사용되지 않습니다. - 각 웰에 완전한 배지(~500μL)를 추가하고 하이드로겔이 완전히 잠기도록 합니다. 멀티웰 플레이트를 37°C 및 5%CO2 의 가습 인큐베이터에 넣고 2-3일마다 배지 변화로 세포를 배양합니다.
참고: 하이드로겔은 최대 4주 동안 또는 하이드로겔이 분해될 때까지 배양할 수 있으며, 이틀에 한 번씩 배지를 교체합니다.
- 100μL의 10% w/v PEG 하이드로겔 전구체 용액을 생성하려면 50μL의 스페로이드 현탁액을 결합한 다음 30μL의 20% w/v 4-arm PEG-Ac를 결합하고 마지막으로 20μL의 20% w/v PEG-diSH를 마이크로 원심분리 튜브에 결합합니다. 이렇게 하면 아크릴레이트(Ac)와 티올(SH) 그룹의 화학량론적 몰비가 최적의 가교를 보장합니다. 겔 전구체 용액을 위아래로 피펫팅하여 ~10회 혼합합니다.
4. 형광 염색
- 세포 생존력
- 모든 세포의 미토콘드리아와 소포체를 염색하는 염색 3,3'-dihexyloxacarbocyanine iodide (DiOC)를 사용하여 세포 생존율을 측정합니다. 0.02μg/mL 농도의 DiOC(3mM)를 사용합니다. 구체적으로, 20μL 피펫을 사용하여 해리된 세포를 배양하는 플라스크에 배지 1000μL당 2μL의 DiOC를 추가합니다(섹션 3의 스페로이드 형성 과정 최소 24시간 전). DiOC가 세포를 염색할 때까지 24시간 동안 기다립니다.
- 죽은 세포에만 들어가는 핵 및 염색체 염색제인 프로피듐 요오드화물(propidium iodide, PI)(1.50mM)을 사용합니다. 세포를 염색하려면 먼저 모든 배지를 흡인하고 1000μL 피펫을 사용하여 겔을 헹구고 500μL의 1x PBS를 추가하여 겔이 완전히 잠기도록 합니다.
- PBS를 흡입하고 500μL의 새 배지를 추가한 다음 30μL의 PI 용액을 각 웰에 추가합니다(즉, 배지 100μL당 6μL). 빛으로부터 보호하기 위해 알루미늄 호일로 웰 플레이트를 덮으십시오. 웰 플레이트를 37°C 및 5%CO2 의 인큐베이터에 놓고 PI가 죽은 세포를 염색할 때까지 30분 동안 기다립니다.
- 호일을 제거하고 우물에서 매체를 흡입합니다. 1000μL 피펫을 사용하여 500μL의 1x PBS를 추가하여 하이드로겔을 담그십시오. 1x PBS를 흡입하고 헹굼을 두 번 더 반복합니다. 각 웰에 500μL의 배지를 추가하고 형광 도립 또는 컨포칼 현미경으로 이미지를 생성합니다.
- 컨포칼 현미경 또는 도립 형광 현미경의 z-stack 이미지를 사용하여 방정식 1에 표시된 대로 DiOC(모든 세포)의 면적과 PI(죽은 세포)의 면적을 비교하여 세포 생존율을 계산합니다.
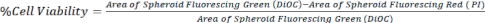 식 1.
식 1.
5. 캡슐화된 스페로이드의 면역형광 고정, 염색, 투명화 및 이미징
- 고정 및 염색
- 하이드로겔이 배양된 웰에서 배지를 흡인하고 500μL의 1x PBS를 하이드로겔에 직접 피펫팅하여 하이드로겔을 헹굽니다. 1x PBS를 부드럽게 흡입합니다.
- 1000μL 피펫을 사용하여 웰당 500μL 부피의 고정 용액을 추가하여 24웰 플레이트에 스페로이드를 고정합니다. 고정액을 실온에서 30분 동안 담그십시오. 1000μL 피펫을 사용하여 고정액을 제거하고 지정된 폐기물 용기에 버립니다.
- 각 웰에 500μL의 1x PBS를 추가하여 하이드로겔을 헹굽니다. 1000μL 피펫을 사용하여 1x PBS를 흡입하고 PBS 헹굼을 두 번 더 반복합니다. 웰 플레이트를 웰당 500μL의 1x PBS에 4°C에서 최대 1주일 동안 보관하거나 즉시 사용할 수 있습니다.
알림: PBS 및 고정 용액을 흡입할 때 하이드로겔을 피펫으로 당기지 않도록 주의하십시오. 플레이트를 ~45도 각도로 기울이면 하이드로겔을 보고 우발적인 흡인을 방지하는 데 도움이 됩니다.
주의 : 포름알데히드는 흡입 및 접촉 시 독성이 있습니다. 화학 흄 후드에 장갑을 끼고 취급하십시오. - 세포를 염색하기 위해 하이드로겔 캡슐화된 스페로이드를 Nestin(200μg/mL) 및 SOX2(200μg/mL)에 대한 1차 항체와 함께 항체(PBS)의 1:200으로 희석하여 배양합니다. 1000μL 피펫을 사용하여 웰에서 1x PBS를 흡입합니다. 희석된 항체 50μL를 각 웰에 추가합니다. 염색이 완료될 때까지 24시간 동안 기다립니다. 그런 다음 1000μL 피펫을 사용하여 염색 용액을 제거하고 폐기물을 적절하게 폐기합니다.
- 1000μL 피펫을 사용하여 하이드로겔을 담그기에 충분한 500μL의 1xPBS를 추가합니다. PBS를 흡인하고 두 번 더 반복합니다. 염색 및 수중 하이드로겔을 4°C의 1x PBS에 최대 2주 동안 보관한 후 즉시 이미징 또는 이미징합니다.
참고: 적절한 염색을 위해 항체에 따라 약간의 최적화가 필요할 수 있습니다. 3D 염색에는 하이드로겔과 스페로이드를 통한 확산이 필요하기 때문에 농도(1:200)와 시간(24시간)이 일반적인 2D 단층 세포 배양보다 훨씬 높습니다.
- 스페로이드를 염색한 후 PBS를 포름아미드의 순차적 농도 증가(선택 사항)로 대체하여 이미징의 투명도를 개선하기 위해 스페로이드를 제거합니다.
- 각 웰에서 1x PBS를 흡입합니다. 각 웰에 500μL의 20%(v/v) 포름아미드를 추가하고 하이드로겔을 90분 동안 배양합니다. 1000μL 피펫을 사용하여 포름아미드를 흡입하고 폐기물을 폐기물 용기에 모읍니다.
- 웰에 500μL의 40%(v/v) 포름아미드를 추가합니다. 하이드로겔을 용액에서 90분 동안 배양합니다. 포름아미드를 흡인하고 폐기물 용기에 폐기물을 수집합니다.
- 각 웰에 500μL의 80% v/v 포름아미드를 추가하고 90분 동안 배양합니다. 포름아미드를 흡인하고 폐기물 용기에 버리십시오. 500μL의 포름아미드 100%(v/v)를 추가하고 이미징 전에 24시간 배양을 허용합니다. 청소가 끝나면 실험실 폐기물 관리 시스템의 적절한 서비스를 통해 포름아미드 폐기물을 적절하게 처리하십시오.
참고: 클리어링은 스페로이드의 코어에 대한 컨포칼 이미징을 허용하며 스페로이드의 주변만 조사하는 경우 선택 사항입니다.
- 컨포칼 현미경을 사용한 하이드로겔 캡슐화된 스페로이드 이미징.
참고: 모든 현미경(도립, 형광 또는 공초점)을 세포 이미징에 사용할 수 있습니다. 그러나 공초점은 단일 평면의 분리를 허용합니다.- 유리 커버슬립 바닥이 있는 챔버 웰에 하이드로겔을 놓고 스페로이드를 커버슬립에 최대한 가깝게 배치합니다.
알림: 유리 커버슬립 또는 유리 커버슬립 바닥이 있는 챔버 웰을 사용할 수 있습니다. 하이드로겔을 수분으로 유지하는 것이 중요한데, 탈수된 샘플은 이미징 품질을 저하시킬 수 있기 때문입니다. - 긴 작동 거리 대물렌즈(10x-20x)로 샘플을 이미징하여 3D 재구성을 위한 Z 스택을 사용하여 스페로이드 깊숙한 곳까지 이미징할 수 있습니다.
NOTE: 배율이 높은 대물렌즈는 더 세밀한 이미징과 광학 절편이 가능하지만 이미지 깊이를 희생합니다. - 방정식 2를 사용하여 cleared 신호와 uncleared 신호 모두에 대해 스페로이드의 전체 면적을 기준으로 광학 섹션에 존재하는 신호의 양을 정량화합니다.
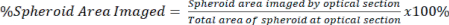 식 2
식 2
- 유리 커버슬립 바닥이 있는 챔버 웰에 하이드로겔을 놓고 스페로이드를 커버슬립에 최대한 가깝게 배치합니다.
결과
화학 요법 효과를 연구하기 위한 스페로이드 기반 약물 스크리닝 플랫폼은 자연 조직을 복제하는 생체 재료에서 스페로이드 캡슐화 시 종양 미세환경을 조절하는 데 중점을 두기 때문에 점점 더 많은 수요가 증가하고 있습니다. 여기에서 우리는 다세포 종양 스페로이드 제제와 3D 하이드로겔에서의 후속 캡슐화 및 이미징을 위한 방법을 개발했습니다. 스페로이드는 마이크로웰 몰드(
토론
하이드로겔 기반 다세포 종양 스페로이드 모델은 암 치료 발견을 발전시키기 위해 점점 더 많이 개발되고 있습니다 11,13,29. 이 모델은 통제된 방식으로 종양 미세환경의 주요 파라미터를 모방하고, 복잡성에도 불구하고 in vivo 모델보다 사용이 간단하고 저렴하며, 많은 모델이 고처리량 스크리닝 기술과 호환되기 때문에 유용?...
공개
저자는 공개할 것이 없습니다.
감사의 말
이 연구는 세인트루이스 대학교가 실비야 P 주스티악 박사에게 제공한 창업 자금과 세인트루이스 대학교의 헨리 앤 아멜리아 나스랄라 신경과학 센터(Henry and Amelia Nasrallah Center for Neuroscience)가 실비야 P 주스티악 박사에게 수여한 시드 그랜트로 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 70% Ethanol | Fisher Scientific | LC22210-4 | |
| 15 mL Conicals | FALCON | 352097 | |
| 24-Well Plate Ultra Low Attachment plates | Fisher Scientific | 07-200-602 | |
| 35 mm Petri Dish | Amazon | 706011 | |
| 4-arm poly(ethylene glycol)-acrylate (4-arm PEG-Ac; 10 kDa) | Laysan Bio | ACRL-PEG-ACRL-10K-5g | |
| 50 mL Conicals | Fisher Scinetific | 3181345107 | |
| 6-well AggreWell 400 | StemCell Technologies, Vancouver, Canada | 34421 | Square pyramidal microwells |
| anti-adherence rinsing solution | StemCell Technologies, Vancouver, Canada | Cat #: 07010 | |
| Aspartic Acid-Arginine-Cysteine-Glycine-Valine-Proline-Methionine-Serine-Methionine-Arginine-Glycine-Cysteine-Arginine- Aspartic Acid (DRCG-VPMSMR-GCRD) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Chemical Fume Hood | KEWAUNEE | 99151 | |
| Corning Matrigel Basement Membrane Matrix, LDEV Free | Corning | 356234 | Basement membrane matrix |
| Detergent - Triton-X | Sigma Aldrich | T8787 | Nonionic surfactant |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | BP231-100 | |
| Disposable Pipettes (1 mL, 2 mL, 5 mL, 10 mL, 25 mL, 50 mL) | Fisher Scinetific | 1 mL: 13-678-11B, 2mL: 05214038, 5mL(FALCON): 357529, 10mL: 13-678-11E, 25mL: 13-678-11, 50mL: 13-678-11F | |
| Fetal Bovine Serum | HyClone | SH30073-03 | |
| Formaldehyde 37% Solution | Sigma Aldrich | F1635 | |
| Glass Plates | Slumpys | GBS4100SFSL | |
| Glass Transfer Pipettes | Fisher Scinetific | 5 3/4": 1367820A, 9":136786B | |
| Glycine-Arginine-Cysteine-Aspartic Acid-Arginine-Glycine-Aspartic Acid-Serine (GRCD-RGDS) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Hemacytometer | Bright-Line | 383684 | |
| Hydrophobic solution - Repel Silane | GE Healthcare Bio-Sciences | 17-1332-01 | |
| Incubator | NUAIRE | NU-8500 | |
| Inverted Microscope (Axiovert 25) | Zeiss | 663526 | |
| Invitrogen DiOC16(3) (3,3'-Dihexadecyloxacarbocyanine Perchlorate) | Fisher Scientific | D1125 | |
| Leica Confocal SP8 | Leica Microsystems Inc. | ||
| Light and Flourescent Microscope (Axiovert 200M) | Zeiss | 3820005619 | |
| Micro centrifuge tubes | Fisher Scientific | 2 mL: 02681258 | |
| Microscope Software | Zeiss | AxioVision Rel. 4.8.2 | |
| Nestin Alexa Fluor 594 | Santa Cruz Biotechnology | sc-23927 | |
| Parafilm | PARAFILM | PM992 | |
| PBS (1x), pH 7.4 | HyClone | SH30256.01 | |
| Penicillin Streptomycin | MP Biomedicals | 1670046 | |
| Pipette Aid | Drummond Scientific Co. | P-76864 | |
| Pipette Tips (1–200 µL, 101–1000 µL) | Fisher Scinetific | 2707509 | |
| Plastic Standard Disposable Transfer Pipettes | Fisher Scientific | 13-711-9D | |
| Plastic Weigh Boats (100 mL) | Amazon | mdo-azoc-1030 | |
| poly(ethylene glycol)-dithiol (PEG-diSH; 3.4 kDa) | Laysan Bio | SH-PEG-SH-3400-5g | |
| Polydimehylsiloxane (PDMS) [Slygard 182 Elastomer Kit] | Elsworth Adhesives | 3097358-1004 | Polydimethylsiloxane |
| Powder Free Examination Gloves | Quest | 92897 | |
| Propidium iodide, 1 mg/mL aqueous soln. | Fisher Scientific | AAJ66584AB | |
| RPMI-1640 Medium (1x) | HyClone | SH30027-02 | |
| Silicone spacers - Silicone sheet, 0.5 mm thick/13 cm x 18 cm | Grace Bio-Labs | JTR-S-0.5 | |
| SOX2 Alexa Fluor 488 | Santa Cruz Biotechnology | sc-365823 | |
| Tissue Culture Hood | NUAIRE | NU-425-600 | |
| Triethanolamine, ≥99.0% (GC) | Sigma Aldrich | 90279 | |
| U-87 MG human glioblastoma cells | American Type Culture Collection | HTB-14 |
참고문헌
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Costa, E. C., de Melo-Diogo, D., Moreira, A. F., Carvalho, M. P., Correia, I. J. Spheroids formation on non-adhesive surfaces by liquid overlay technique: Considerations and practical approaches. Biotechnology Journal. 13 (1), 1700417 (2018).
- Li, Y., Kumacheva, E. Hydrogel microenvironments for cancer spheroid growth and drug screening. Science Advances. 4 (4), eaas8998 (2018).
- Kamatar, A., Gunay, G., Acar, H. Natural and synthetic biomaterials for engineering multicellular tumor spheroids. Polymers. 12 (11), 2506 (2020).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular Pharmaceutics. 11 (7), 2115-2125 (2014).
- Nakod, P. S., Kim, Y., Rao, S. S. Three-dimensional biomimetic hyaluronic acid hydrogels to investigate glioblastoma stem cell behaviors. Biotechnology and Bioengineering. 117 (2), 511-522 (2020).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85, 128-146 (2020).
- Pedron, S., et al. Hyaluronic acid-functionalized gelatin hydrogels reveal extracellular matrix signals temper the efficacy of erlotinib against patient-derived glioblastoma specimens. Biomaterials. 219, 119371 (2019).
- Hill, L., Bruns, J., Zustiak, S. P. Hydrogel matrix presence and composition influence drug responses of encapsulated glioblastoma spheroids. Acta Biomaterialia. 132, 437-447 (2021).
- Chen, J. -. W. E., et al. Crosstalk between microglia and patient-derived glioblastoma cells inhibit invasion in a three-dimensional gelatin hydrogel model. Journal of Neuroinflammation. 17 (1), 346 (2020).
- Thakuri, P. S., Liu, C., Luker, G. D., Tavana, H. Biomaterials-based approaches to tumor spheroid and organoid modeling. Advanced Healthcare Materials. 7 (6), 1700980 (2018).
- Shin, S., et al. Alginate-marine collagen-agarose composite hydrogels as matrices for biomimetic 3D cell spheroid formation. RSC Advances. 6 (52), 46952-46965 (2016).
- Pradhan, S., Clary, J. M., Seliktar, D., Lipke, E. A. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 115, 141-154 (2017).
- Imaninezhad, M., Hill, L., Kolar, G., Vogt, K., Zustiak, S. P. Templated macroporous polyethylene glycol hydrogels for spheroid and aggregate cell culture. Bioconjugate Chemistry. 30 (1), 34-46 (2018).
- Mirab, F., Kang, Y. J., Majd, S. Preparation and characterization of size-controlled glioma spheroids using agarose hydrogel microwells. PLoS One. 14 (1), e0211078 (2019).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments: JoVE. 81, e50665 (2013).
- Timmins, N. E., Nielsen, L. K., Hauser, H., Fussenegger, M. . Generation of Multicellular Tumor Spheroids by the Hanging-Drop Method. 140, (2007).
- Zhao, L., et al. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Scientific Reports. 9 (1), 19717 (2019).
- Amaral, R. L., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Gencoglu, M. F., et al. Comparative study of multicellular tumor spheroid formation methods and implications for drug screening. ACS Biomaterials Science & Engineering. 4 (2), 410-420 (2018).
- Zhang, C., Liu, C., Zhao, H. Mechanical properties of brain tissue based on microstructure. Journal of the Mechanical Behavior of Biomedical Materials. 126, 104924 (2021).
- Alifieris, C., Trafalis, D. T. Glioblastoma multiforme: Pathogenesis and treatment. Pharmacology & Therapeutics. 152, 63-82 (2015).
- Zustiak, S. P., Leach, J. B. Hydrolytically degradable poly (ethylene glycol) hydrogel scaffolds with tunable degradation and mechanical properties. Biomacromolecules. 11 (5), 1348-1357 (2010).
- Zustiak, S. P., Wei, Y., Leach, J. B. Protein-hydrogel interactions in tissue engineering: Mechanisms and applications. Tissue Engineering Part B: Reviews. 19 (2), 160-171 (2013).
- Kroger, S. M., et al. Design of hydrolytically degradable polyethylene glycol crosslinkers for facile control of hydrogel degradation. Macromolecular Bioscience. 20 (10), 2000085 (2020).
- Raeber, G., Lutolf, M., Hubbell, J. Molecularly engineered PEG hydrogels: a novel model system for proteolytically mediated cell migration. Biophysical Journal. 89 (2), 1374-1388 (2005).
- Bruns, J., Egan, T., Mercier, P., Zustiak, S. P. Glioblastoma spheroid growth and chemotherapeutic responses in single and dual-stiffness hydrogels. Acta Biomaterialia. 163, 400-414 (2023).
- Kuwajima, T., et al. ClearT: a detergent-and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Holt, S. E., Ward, E. S., Ober, R. J., Alge, D. L. Shooting for the moon: using tissue-mimetic hydrogels to gain new insight on cancer biology and screen therapeutics. MRS Communications. 7 (3), 427-441 (2017).
- Jain, E., Scott, K. M., Zustiak, S. P., Sell, S. A. Fabrication of polyethylene glycol-based hydrogel microspheres through electrospraying. Macromolecular Materials and Engineering. 300 (8), 823-835 (2015).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948 (2016).
- Lee, K. -. H., Kim, T. -. H. Recent advances in multicellular tumor spheroid generation for drug screening. Biosensors. 11 (11), 445 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유