Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изготовление и инкапсуляция сфероидов опухолей в гидрогелях полиэтиленгликоля для изучения сфероидно-матричных взаимодействий
В этой статье
Резюме
Здесь мы представляем протокол, который позволяет быстро, надежно и дешево изготавливать опухолевые сфероиды с последующей гидрогелевой инкапсуляцией. Он широко применим, так как не требует специализированного оборудования. Это было бы особенно полезно для изучения сфероидно-матричных взаимодействий и построения in vitro моделей физиологии тканей или патологии.
Аннотация
Трехмерная (3D) инкапсуляция сфероидов имеет решающее значение для адекватной репликации микроокружения опухоли для оптимального роста клеток. Здесь мы разработали 3D-модель глиобластомы in vitro для инкапсуляции сфероида, чтобы имитировать внеклеточное микроокружение опухоли. Сначала мы сформировали квадратные пирамидальные формы для микролунок с использованием полидиметилсилоксана. Эти формы с микролунками затем использовались для изготовления опухолевых сфероидов с жестко контролируемыми размерами от 50 до 500 мкм. После того, как сфероиды были сформированы, их собирали и инкапсулировали в гидрогели на основе полиэтиленгликоля (ПЭГ). Гидрогели ПЭГ являются универсальной платформой для инкапсуляции сфероидов, поскольку такие свойства гидрогеля, как жесткость, разлагаемость и адгезивность ячеек, можно настраивать независимо друг от друга. Здесь мы использовали репрезентативный мягкий (~8 кПа) гидрогель для инкапсуляции сфероидов глиобластомы. Наконец, был разработан метод окрашивания и изображения сфероидов для получения высококачественных изображений с помощью конфокальной микроскопии. Из-за плотного сфероидального ядра и относительно редкой периферии визуализация может быть затруднена, но использование очищающего раствора и конфокального оптического секционирования помогает облегчить эти трудности визуализации. Таким образом, мы демонстрируем метод получения однородных сфероидов, инкапсуляции их в гидрогели ПЭГ и проведения конфокальной микроскопии на инкапсулированных сфероидах для изучения роста сфероидов и различных взаимодействий между клеткой и матриксом.
Введение
Опухолевые сфероиды оказались полезными инструментами in vitro при изучении этиологии, патологии и реакции на лекарственные препараты1. Традиционно сфероиды культивировались в таких условиях, как пластины с низкой адгезией или биореакторы, где клеточная адгезия предпочтительнее клеточной адгезии2. Тем не менее, в настоящее время признано, что для более точного повторения микроокружения опухоли сфероидные модели in vitro должны охватывать как межклеточные, так и межклеточные матриксные взаимодействия. Это побудило несколько групп разработать каркасы, такие как гидрогели, в которых сфероиды могут быть инкапсулированы 3,4. Такие сфероидные модели на основе гидрогеля позволяют прояснить межклеточные и клеточно-матриксные взаимодействия на различные клеточные поведенческие процессы, такие как жизнеспособность, пролиферация, стволовость или реакция на терапию3.
В данной статье мы опишем протокол инкапсуляции сфероидов глиобластомы в гидрогели из полиэтиленгликоля (ПЭГ). Существует множество литературных сообщений об инкапсуляции сфероидов клеток глиобластомы в гидрогелях. Например, сфероиды были образованы путем инкапсуляции клеток U87 в гидрогели PEG, украшенные адгезивным лигандом RGDS и сшитые ферментативно расщепляемым пептидом для определения влияния жесткости гидрогеля на поведение клеток5. Клетки U87 также были сформированы в других гидрогелях на основе ПЭГ или гиалуроновой кислоты для расширения популяции раковых стволовых клеток6 или для изучения матрикс-опосредованных механизмов резистентности к химиотерапии 7,8,9. Сфероиды глиобластомы также были инкапсулированы в желатиновые гидрогели для изучения перекрестных помех между микроглией и раковыми клетками и их влияния на клеточную инвазию. В целом, такие исследования продемонстрировали полезность моделей in vitro на основе гидрогеля для понимания патологии глиобластомы и разработки методов лечения.
Кроме того, существуют различные методы изготовления сфероида опухоли и инкапсуляции гидрогеля11. Например, дисперсные клетки можно было бы посеять в гидрогели и позволить им образовывать сфероиды с течением времени 5,12. Одним из недостатков такого метода является полидисперсность образующихся сфероидов, что может привести к дифференциальным клеточным реакциям. Для получения однородных сфероидов клетки могут быть инкапсулированы в микрогели и культивироваться в течение длительных периодов времени до тех пор, пока они не вторгнутся в гель13 и не ремоделируют его, или клетки могут быть помещены в шаблонные гели со сферическими «отверстиями» и позволить им агрегировать14. Недостатком этих методов является их относительная сложность, необходимость в капельном генераторе или других средствах для образования микрогелей или «дырок» в геле, а также время, необходимое для роста и созревания сфероидов. В качестве альтернативы сфероиды могут быть предварительно сформированы в микролунках 9,15,16 или в висячих планшетах 17,18, а затем инкапсулированы в гидрогель, аналогично описанному здесь методу. Эти методы более просты и могут быть выполнены с более высокой пропускной способностью. Интересно, что было показано, что метод образования сфероидов может влиять на поведение сфероидных клеток, такое как экспрессия генов, пролиферация клеток или реакция на лекарственные препараты 19,20.
Здесь мы сосредоточимся на глиобластоме, поскольку это солидная опухоль, родной средой которой является мягкая нанопористая матрица мозга21, которую можно имитировать мягким нанопористым гидрогелем. Глиобластома также является самым смертоносным раком головного мозга, от которого нетлекарства. Однако описанный здесь протокол может быть использован для инкапсуляции сфероидов, представляющих любую солидную опухоль. Мы решили использовать гидрогели ПЭГ, которые образуются в результате реакции присоединения типа Майкла23. ПЭГ представляет собой синтетический, неразлагаемый и биосовместимый гидрогель, который инертен и служит каркасом и физической опорой клетки, но не поддерживает прикрепление клетки23. Клеточная адгезивность может быть добавлена отдельно путем связывания цельных белков или адгезивных лигандов24, а разлагаемость может быть добавлена путем химических модификаций полимерной цепи ПЭГ или гидролитически или ферментативно разлагаемых сшивающих агентов 25,26. Это позволяет настраивать биохимические свойства независимо от механических или физических свойств гидрогеля, что может быть полезно при изучении взаимодействий между клеткой и матриксом. Химия гелеобразования типа Майкла избирательна и происходит в физиологических условиях; Следовательно, он позволяет инкапсулировать сфероиды, просто смешивая сфероиды с раствором прекурсора гидрогеля.
В целом, методология, представленная здесь, имеет несколько примечательных характеристик. Во-первых, изготовление опухолевых сфероидов в многолуночной сборке является эффективным, быстрым, а стоимость необходимых материалов невысокой. Во-вторых, сфероиды производятся большими партиями различных размеров с низкой полидисперсностью. Наконец, требуются только имеющиеся в продаже материалы. Полезность методологии проиллюстрирована изучением влияния свойств субстрата на жизнеспособность сфероидных клеток, циркулярность и стволовость клеток.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Приготовление растворов
- Приготовление раствора-прекурсора полидиметилсилоксана (ПДМС)
- Приготовьте негативный раствор прекурсора PDMS (также используется для раствора прекурсора клея). Зачерпните эластомер в лодку для весов с помощью шпателя и взвесьте его. Добавьте отвердитель к эластомерному основанию в соотношении 1:10. Осторожно и тщательно смешайте PDMS и отвердитель с помощью шпателя в пластиковой весовой лодке.
ПРИМЕЧАНИЕ: Этот раствор прекурсора PDMS заливается в 6-луночную квадратную пирамидальную микролунку для формирования отрицательной формы. Это тот же раствор, который используется для раствора прекурсора клея. - Приготовьте положительный раствор прекурсора PDMS. Зачерпните эластомерное основание в лодку весов с помощью шпателя и взвесьте его. Добавьте отвердитель к эластомерной основе в соотношении 1:9. Осторожно и тщательно смешайте PDMS и отвердитель с помощью шпателя в пластиковой весовой лодке.
ПРИМЕЧАНИЕ: Этот раствор прекурсора PDMS позже заливается на отрицательную форму, чтобы сформировать положительную форму.
- Приготовьте негативный раствор прекурсора PDMS (также используется для раствора прекурсора клея). Зачерпните эластомер в лодку для весов с помощью шпателя и взвесьте его. Добавьте отвердитель к эластомерному основанию в соотношении 1:10. Осторожно и тщательно смешайте PDMS и отвердитель с помощью шпателя в пластиковой весовой лодке.
- Приготовление 0,3 М триэтаноламинового (ТЭА) буфера рН 8
- Пипетку 1 мл TEA и 9 мл 1x фосфатно-солевого буфера (PBS) в коническую форму объемом 50 мл с помощью вспомогательного средства для пипетки для создания 0,75 М раствора TEA. Ститруйте раствор до рН 8, используя 1 N HCl или 1 N NaOH. Затем добавьте достаточное количество 1x PBS для достижения конечного объема 25 мл для достижения конечной концентрации TEA 0,3 M с pH 8.
ВНИМАНИЕ: Храните растворы HCl и NaOH в легковоспламеняющемся шкафу при комнатной температуре (RT). При работе с ними надевайте средства индивидуальной защиты.
- Пипетку 1 мл TEA и 9 мл 1x фосфатно-солевого буфера (PBS) в коническую форму объемом 50 мл с помощью вспомогательного средства для пипетки для создания 0,75 М раствора TEA. Ститруйте раствор до рН 8, используя 1 N HCl или 1 N NaOH. Затем добавьте достаточное количество 1x PBS для достижения конечного объема 25 мл для достижения конечной концентрации TEA 0,3 M с pH 8.
- Подготовка готовой среды
- Для приготовления полной среды добавляют 10% (w/v) или 56 мл фетальной бычьей сыворотки и 1% (w/v) или 5,6 мл пенициллина и стрептомицина в среду RPMI объемом 500 мл.
- Перед использованием поместите раствор при температуре 37 °C на 10-20 минут или пока раствор не станет теплым.
- Хранить раствор при температуре 0-4 °C до 6 месяцев.
- Приготовление 20% (по массе) исходных растворов полиэтиленгликоля (ПЭГ)
ПРИМЕЧАНИЕ: Расчет основан на растворах объемом 100 мкл, которые могут быть увеличены или уменьшены по мере необходимости.- Для приготовления исходного раствора объемом 100 мкл 20% 4-плечевого ПЭГ-акрилата (4-плечевого ПЭГ-Ac) взвешивают 20 мг 4-плечевого порошка PEG-Ac в пробирке для микрофуги. Добавьте 70 мкл 0,3 М буфера TEA, затем перемешайте раствор в течение примерно 30 с или до полного растворения. Учет изменения объема из-за растворения порошка можно путем добавления достаточного количества буфера TEA (~27 мкл) для достижения конечного объема раствора в 100 мкл.
- Для приготовления исходного раствора объемом 100 мкл 20% массы PEG-diSH взвешивают 20 мг порошка PEG-diSH в пробирке для микрофуги. Добавьте 70 мкл буфера TEA, затем взбалтывайте раствор в течение примерно 30 с или до полного растворения. Учет изменения объема из-за растворения порошка можно путем добавления достаточного количества буфера TEA (~27 мкл) для достижения конечного объема раствора в 100 мкл.
ПРИМЕЧАНИЕ: Порошок ПЭГ очень гигроскопичен и должен храниться в высушенном контейнере при температуре -20 °C. Вынимая его из морозильной камеры, дайте порошку PEG оттаять в течение 10 минут, прежде чем открывать бутылку для взвешивания порошка. Продуйте бутылку инертным газом, таким как азот или аргон, чтобы вытеснить влажный воздух, прежде чем возвращать его в морозильную камеру. Исходный раствор 4-плечевого PEG-Ac можно хранить при температуре 4 °C до 2 недель перед использованием. Исходный раствор PEG-diSH должен быть приготовлен непосредственно перед использованием и не может храниться, поскольку тиоловые группы реагируют друг с другом с образованием дисульфидных связей.
- Приготовление 2%-ного раствора матрицы базальной мембраны
- Для приготовления 2% рабочего раствора матрицы базальной мембраны v/v добавьте 20 мкл матрицы базальной мембраны (без LDEV) к 9,98 мл полной среды и тщательно перемешайте, пипетируя вверх и вниз ~10 раз. Приготовьте раствор при 4 °C (на льду), затем подогрейте его до 37 °C (в духовке или инкубаторе) и сразу же используйте.
ПРИМЕЧАНИЕ: Матрица базальной мембраны начнет образовывать гель при >10 °C, поэтому обязательно смешайте раствор матрицы базальной мембраны с полной средой при температуре 2-6 °C. Полный состав носителя описан на шаге 1.3.
- Для приготовления 2% рабочего раствора матрицы базальной мембраны v/v добавьте 20 мкл матрицы базальной мембраны (без LDEV) к 9,98 мл полной среды и тщательно перемешайте, пипетируя вверх и вниз ~10 раз. Приготовьте раствор при 4 °C (на льду), затем подогрейте его до 37 °C (в духовке или инкубаторе) и сразу же используйте.
- Приготовление клеточного фиксирующего раствора
- Для приготовления 1 мл раствора клеточного фиксатора, содержащего 4% массы параформальдегида и 0,1% v/v неионогенного поверхностно-активного вещества, сначала смешивают 891 мкл 1x PBS и 108 мкл параформальдегида (концентрация 37% w/v), а затем добавляют 1 мкл неионогенного поверхностно-активного вещества (100% концентрации). Тщательно перемешайте раствор.
ПРИМЕЧАНИЕ: Фиксирующий раствор следует обновлять каждый раз, когда выполняется фиксация.
ВНИМАНИЕ: Параформальдегид легко воспламеняется и может образовывать в воздухе горючую пыль. Он вызывает раздражение кожи и серьезное повреждение глаз. Избегайте вдыхания, так как это может вызвать раздражение дыхательных путей. Работайте с параформальдегидом в химическом вытяжном шкафу и носите средства индивидуальной защиты. Тщательно вымойте руки после работы. Неионогенное поверхностно-активное вещество вызывает раздражение кожи и серьезное повреждение глаз. При работе надевайте защитные перчатки и средства защиты глаз или лица. Во избежание попадания в окружающую среду откройте флакон в химическом вытяжном шкафу. Тщательно вымойте руки после работы.
- Для приготовления 1 мл раствора клеточного фиксатора, содержащего 4% массы параформальдегида и 0,1% v/v неионогенного поверхностно-активного вещества, сначала смешивают 891 мкл 1x PBS и 108 мкл параформальдегида (концентрация 37% w/v), а затем добавляют 1 мкл неионогенного поверхностно-активного вещества (100% концентрации). Тщательно перемешайте раствор.
- Приготовление красящих растворов
- Для приготовления 3 мМ 3,3'-дигексилоксакарбоцианина йодида (DiOC) смешайте 2,65 мг DiOC с 1 мл DMSO.
- Для приготовления 1,5 мМ раствора йодида пропидия (ПИ) смешивают 1 мг ПИ в 1 мл деионизированной воды.
- Приготовление раствора для очистки сфероидов
- Приготовьте клиринговые растворы 20%, 40% и 80% формамида в 1x PBS для очистки сфероида.
- Чтобы получить 10 мл 20% формамида, смешайте 8 мл 1x PBS, а затем 2 мл формамида. Чтобы получить 10 мл 40% формамида, смешайте 6 мл 1x PBS, а затем 4 мл формамида. Чтобы получить 10 мл 80% формамида, смешайте 2 мл 1x PBS, а затем 8 мл формамида.
- После соединения формамида и 1х ПБС перемешивают раствор вихревым способом в течение примерно 30 с.
- Приготовьте клиринговые растворы 20%, 40% и 80% формамида в 1x PBS для очистки сфероида.
2. Изготовление квадратных пирамидальных микролунок
- Изготовьте отрицательную пресс-форму PDMS из квадратных пирамидальных микролунок, как показано на рисунке 1.
- Приготовьте 2 г (~1 мл) отрицательного раствора прекурсора PDMS и вылейте его на одну лунку 6-луночной квадратной пирамидальной мастер-формы. Обратите внимание, что 1 мл полностью покрывает одну лунку пластины. После покрытия основной формы PDMS дегазируйте раствор прекурсора PDMS в течение 30 минут, поместив 6-луночную квадратную пирамидальную пластину в вакуумный эксикатор. Затем отвержите PDMS, поместив пластину в духовку при температуре 60 °C на 24 часа.
ПРИМЕЧАНИЕ: Убедитесь, что крышка пластины снята для дегазации и снова установлена для отверждения. Дегазируйте раствор в вакуумном эксикаторе или путем продувки инертным газом, таким как азот или аргон. Если через 30 минут в отрицательном растворе-прекурсоре плесени все еще остаются пузырьки, указывающие на недостаточную дегазацию, поместите его в вакуумный эксикатор еще на 30 минут. Используйте одну или несколько пластинчатых лунок одновременно для подготовки одной или нескольких негативных форм PDMS. Можно использовать квадратные пирамидальные микролунки различных размеров, например, с длиной сторон 400 и 800 мкм, как показано в таблице 1. Одно и то же количество PDMS используется независимо от размеров квадратных пирамид. - После того, как PDMS затвердеет, пока он еще теплый, осторожно извлеките негативную форму PDMS из основной формы с помощью шпателя и разрежьте негативную форму на пластине диаметром 35 мм с помощью биопсийного пуансона. Поместите в чашку Петри, накройте крышкой и дайте продолжить отверждение RT еще в течение 24 часов.
ПРИМЕЧАНИЕ: Чтобы удалить негативные формы, используйте шпатель, чтобы пробраться между пластиной лунки и формой PDMS, и осторожно вытащите негативную форму из основной формы. Форма разрезается на пластины диаметром 35 мм, чтобы они соответствовали размеру чашки Петри диаметром 35 мм. Формы могут быть изготовлены в других размерах для размещения плит разного диаметра. Пластины пресс-формы диаметром 35 мм можно хранить, защищать от пыли в RT и повторно использовать в течение 6 месяцев.
- Приготовьте 2 г (~1 мл) отрицательного раствора прекурсора PDMS и вылейте его на одну лунку 6-луночной квадратной пирамидальной мастер-формы. Обратите внимание, что 1 мл полностью покрывает одну лунку пластины. После покрытия основной формы PDMS дегазируйте раствор прекурсора PDMS в течение 30 минут, поместив 6-луночную квадратную пирамидальную пластину в вакуумный эксикатор. Затем отвержите PDMS, поместив пластину в духовку при температуре 60 °C на 24 часа.
- Приготовьте положительную пресс-форму PDMS из квадратных пирамидальных микролунок.
- Поместите 35-миллиметровые пластины отрицательной формы PDMS в 35-миллиметровую чашку Петри текстурированными микролунками вверх.
- Приготовьте 2,5 г (~1,2 мл) положительного раствора прекурсора PDMS, как указано выше, и вылейте его на негативную форму в чашке Петри диаметром 35 мм, чтобы полностью покрыть отрицательную форму. Затем дегазируйте раствор прекурсора на 30 минут, как указано выше, и поместите его в печь с температурой 60 °C на 3-4 часа.
ПРИМЕЧАНИЕ: Поскольку PDMS вязкий, пузырь может образоваться из воздуха, попавшего под отрицательную форму. Если под отрицательной формой образуется пузырь, осторожно надавите на форму с помощью шпателя, чтобы выпустить пузырь. Если пузырьки воздуха остались, продолжайте дегазацию в течение 30 минут или возьмите шпатель и осторожно перемешайте положительный раствор плесени, пока пузырьки не лопнут. - Как только положительная плесень PDMS затвердеет, извлеките формы из чашки Петри диаметром 35 мм и немедленно очистите положительную форму от отрицательной.
ПРИМЕЧАНИЕ: Время важно для успешного отслаивания положительной формы. Удаление лучше всего выполнить, слегка разрезав положительную форму с помощью бритвы, чтобы обнажить границу раздела между положительной и отрицательной формами, и отделив формы друг от друга. Затем отклейте края круглой формы. Аккуратно отделите негативную форму от положительной.
- Приклейте формочки ко дну лунок 48-луночной пластины.
ПРИМЕЧАНИЕ: Здесь используется 48-луночная пластина, но можно использовать и другие пластины, если плиты формы нарезаны на правильные диаметры (например, 6 мм в диаметре для 96-луночной пластины).- Разрежьте позитивные формы на пластины с помощью 10-миллиметрового биопсийного пуансона.
ПРИМЕЧАНИЕ: Из одной положительной формы диаметром 35 мм можно вырезать примерно 4 формы (каждая диаметром 10 мм). - Чтобы приклеить формы к нижней части 48-луночной пластины, приготовьте раствор прекурсора клея PDMS (~0,5 мл или 1 г), как описано ранее27. С помощью пинцета аккуратно опустите плоскую сторону (не сторону с рисунком микролунок) 10-миллиметровой положительной формы в раствор прекурсора PDMS. Осторожно поместите по одной форме в лунку 48-луночной пластины и осторожно прижмите каждую форму ко дну лунки с помощью пинцета. Поместите собранную пластину в духовку при температуре 60 °C на 4-24 часа, чтобы клей PDMS затвердел.
ПРИМЕЧАНИЕ: Если раствор прекурсора клея PDMS попадет на положительные микролунки пресс-формы, его можно стереть мягкой папиросной бумагой, и этот шаг можно повторить. При склеивании следите за тем, чтобы клей не покрывал микролунки. - Стерилизуйте формы, добавляя 300 мкл 70% этанола в каждую лунку 48-луночного планшета с помощью пипетки на 1000 мкл. Аспирируйте 70% этанол и поместите 48-луночный планшет открытым в колпак для культуры тканей под ультрафиолетовым излучением (302 нм) на 2 часа.
ПРИМЕЧАНИЕ: Формы можно использовать в течение 6 месяцев и повторно стерилизовать по мере необходимости.
- Разрежьте позитивные формы на пластины с помощью 10-миллиметрового биопсийного пуансона.
3. Образование, сбор и инкапсуляция сфероидов многоклеточных опухолей в гидрогелях
ПРИМЕЧАНИЕ: Протокол, описанный в этом разделе, предназначен для клеточной линии глиобластомы человека U87 (см. Рисунок 1 и Рисунок 2), но аналогичный протокол может быть использован и для других типов раковых клеток.
- Образование сфероида многоклеточной опухоли
- Сначала промойте формы для микролунок раствором для ополаскивания, препятствующим прилипанию, добавив 300 мкл раствора в каждую лунку с помощью пипетки на 1000 мкл. Затем центрифугу при 1620 х г в течение 3 мин и аспирировать раствор с помощью вакуумного насоса и пипетки Пастера.
ПРИМЕЧАНИЕ: Выполняйте этот шаг непосредственно перед посевом клеток. - Подвергают клетки воздействию ~80 мкл 0,25% трипсина/ЭДТА на каждый см2 площади колбы для культивирования в течение 5 мин при 37 °C. Например, 1 мл трипсина/ЭДТА подходит для колбы с клеточной культурой Т-25. Нейтрализуют трипсин, добавив такой же объем полной питательной среды клеток. Например, добавьте 1 мл полной среды в трипсинсодержащую колбу с клеточной культурой Т-25. Соберите клетки из колбы для культуры тканей.
- Перенесите 10 мкл клеточной суспензии в каждый порт гемоцитометра для подсчета клеток. Используйте перевернутый микроскоп для подсчета общего количества клеток и усредните это количество клеток по крайней мере из 8 квадрантов, убедившись, что количество клеток в каждом квадранте гемоцитометра составляет 20-50 для получения хороших результатов подсчета клеток. Умножьте вычисленное число на 10:4 , чтобы определить конечную концентрацию клеток.
- Ресуспендировать собранные клетки в полной питательной среде RPMI, дополненной 10% фетальной бычьей сывороткой и 1% пенициллином/стрептомицином в желаемой конечной концентрации клеток, в зависимости от желаемого размера сфероида, как показано в таблице 1.
ПРИМЕЧАНИЕ: Микролунки диаметром 800 мкм дадут ~75 сфероидов в одной лунке 48-луночной пластины, а микролунки 400 мкм дадут ~300 сфероидов в одной лунке 48-луночной пластины. - Поместите 500 мкл клеточной суспензии желаемой концентрации в микролунки и центрифугируйте планшет при 1620 x g в течение 3 мин. Поместите планшет в увлажненный инкубатор при температуре 37 °C и 5%CO2 на 24 часа, чтобы образовались сфероиды.
ПРИМЕЧАНИЕ: Если сфероиды не образуются, 2% v/v матрицы базальной мембраны в сочетании с полной средой могут быть использованы для ресуспендирования клеток (подробнее на шаге 1.5).
- Сначала промойте формы для микролунок раствором для ополаскивания, препятствующим прилипанию, добавив 300 мкл раствора в каждую лунку с помощью пипетки на 1000 мкл. Затем центрифугу при 1620 х г в течение 3 мин и аспирировать раствор с помощью вакуумного насоса и пипетки Пастера.
- Сбор сфероидов
- С помощью пипетки на 1000 мкл плотно заколите в лунку 500 мкл полной среды. Используя 500 мкл среды из лунки, промыть четыре квадранта лунки (в частности, верхний, нижний, левый и правый квадранты) путем пипетирования вверх и вниз в квадрантах три-четыре раза, чтобы сместить сфероиды. Осторожно аспирируйте среду, содержащую сфероиды (всего ~1000 мкл), в микроцентрифужную пробирку с помощью пипетки на 1000 мкл и дайте сфероидам осесть на дно.
- Удалите надосадочную жидкость и ресуспендируйте сфероиды до желаемой конечной концентрации. Например, чтобы получить ~8 сфероидов в геле объемом 20 мкл после инкапсуляции, ресуспендируйте сфероиды в 100 мкл среды, получив концентрацию сфероида ~75 сфероидов/100 мкл в суспензии сфероида.
- Инкапсуляция сфероидов в гидрогели, как показано на рисунке 2.
- Для создания 100 мкл 10%-ного раствора прекурсора гидрогеля ПЭГ смешайте 50 мкл суспензии сфероида, затем 30 мкл 20% с 4-плечевым PEG-Ac и, наконец, 20 мкл 20% массы ПЭГ-diSH в микроцентрифужной пробирке. Это даст стохиометрическое молярное соотношение акрилатных (Ac) и тиоловых (SH) групп, обеспечивающее оптимальное сшивание. Смешайте раствор геля-прекурсора, пипетируя вверх и вниз ~ 10 раз.
ПРИМЕЧАНИЕ: Состав гидрогеля, объем и оркестрация полимера могут быть изменены по мере необходимости. Полученные гидрогели будут медленно разлагаться и не будут клеиться. Чтобы сделать гидрогелевую ячейку адгезивной, можно добавить адгезивный лиганд, такой как RGDS. Чтобы сделать гидрогель ферментативно разлагаемым, можно добавить ферментативно разлагаемый пептидный сшиватель, содержащий остатки цистеина на обоих концах. При переносе сфероидов осторожно пипетируйте раствор дважды, чтобы сместить сфероиды и привести их во взвесь, чтобы обеспечить равномерное распределение сфероидов. - Поместите пипетку 20 мкл раствора гелевого прекурсора между двумя предметными стеклами с парапленкой, разделенными силиконовыми прокладками диаметром 1 мм, и поместите предметные стекла с раствором гелевого прекурсора в инкубатор с 5% CO2 при температуре 37 °C на 15 мин для обеспечения гелеобразования.
ПРИМЕЧАНИЕ: Убедитесь, что два предметных стекла покрыты парапленкой, чтобы создать гидрофобную поверхность, позволяющую легко отслаиваться после гелеобразования. Вместо парапленки можно использовать раствор гидрофобного покрытия. Объем раствора прекурсора гидрогеля объемом 20 мкл приведет к получению гидрогелевой пластины диаметром ~6 мм и высотой 1 мм до набухания. Можно использовать любой тип и толщину спейсера, но рекомендуется, чтобы толщина геля была не менее 1 мм (более толстые гидрогели могут ограничить диффузию кислорода и транспорт питательных веществ к клеткам), но больше, чем диаметр сфероида (чтобы сфероиды были полностью инкапсулированы в гель). Можно использовать любой объем раствора прекурсора гидрогеля. Гели объемом 20-30 мкл подходят для 24-луночного планшета. - После завершения гелеобразования отделите два предметных стекла и аккуратно снимите гели со стеклянной пластины с помощью шпателя. Поместите гели в 24-луночную пластину, по одной на лунку, убедившись, что поверхность, содержащая сфероиды, обращена вверх.
ПРИМЕЧАНИЕ: Сфероиды будут падать на дно геля во время гелеобразования, поэтому их инвертирование для культивирования гарантирует, что сфероиды будут находиться близко к поверхности гидрогеля для лучшего доступа к питательным веществам и кислороду. Гелеобразование можно контролировать, наблюдая за любым раствором прекурсора гидрогеля, остающимся в пробирке микроцентрифуги и не используемым для создания пластин, перевернув пробирку и отметив время, когда гель перестает течь. - Добавьте полную среду (~500 мкл) в каждую лунку и убедитесь, что гидрогель полностью погружен в воду. Поместите мультилуночный планшет в увлажненный инкубатор при температуре 37 °C и 5%CO2 и культивируйте клетки со сменой среды каждые 2-3 дня.
ПРИМЕЧАНИЕ: Гидрогели можно культивировать до 4 недель или до тех пор, пока гидрогели не разложатся, меняя среду через день.
- Для создания 100 мкл 10%-ного раствора прекурсора гидрогеля ПЭГ смешайте 50 мкл суспензии сфероида, затем 30 мкл 20% с 4-плечевым PEG-Ac и, наконец, 20 мкл 20% массы ПЭГ-diSH в микроцентрифужной пробирке. Это даст стохиометрическое молярное соотношение акрилатных (Ac) и тиоловых (SH) групп, обеспечивающее оптимальное сшивание. Смешайте раствор геля-прекурсора, пипетируя вверх и вниз ~ 10 раз.
4. Флуоресцентное окрашивание
- Жизнеспособность клеток
- Для определения жизнеспособности клеток используют краситель 3,3'-дигексилоксакарбоцианина йодид (DiOC), который окрашивает митохондрии и эндоплазматический ретикулум всех клеток. Используйте DiOC (3 мМ) в концентрации 0,02 мкг/мл. В частности, с помощью пипетки на 20 мкл добавляют 2 мкл DiOC на каждые 1000 мкл среды в колбу для культивирования диссоциированных клеток (не менее чем за 24 ч до процесса образования сфероидов в разделе 3). Подождите 24 часа, пока DiOC окрасит клетки.
- Используют ядерный и хромосомный краситель, йодид пропидия, PI (1,50 мМ), который проникает только в мертвые клетки. Чтобы окрасить клетки, сначала отсосите всю среду и промойте гель с помощью пипетки на 1000 мкл, чтобы добавить 500 мкл 1x PBS, чтобы гель полностью погрузился в воду.
- Аспирируйте PBS и добавьте 500 мкл свежей среды, а затем 30 мкл раствора PI в каждую лунку (т. е. 6 мкл на каждые 100 мкл среды). Накройте пластину лунки алюминиевой фольгой, чтобы защитить ее от света. Поместите планшет лунки в инкубатор при температуре 37 °C и 5%CO2 и подождите 30 минут, пока PI окрасит мертвые клетки.
- Снимите фольгу и аспирируйте среду из лунок. С помощью пипетки на 1000 мкл добавьте 500 мкл 1x PBS для погружения гидрогеля. Аспирируйте 1x PBS и повторите полоскание еще два раза. Добавьте 500 мкл среды в каждую лунку и получите изображение под флуоресцентным инвертированным или конфокальным микроскопом.
- Рассчитайте жизнеспособность клеток, сравнив площадь DiOC (все клетки) с PI (мертвыми клетками), как показано в уравнении 1, используя изображения z-стека из конфокального микроскопа или инвертированного флуоресцентного микроскопа.
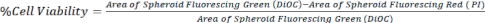 Уравнение 1.
Уравнение 1.
5. Иммунофлуоресцентная фиксация, окрашивание, очистка и визуализация инкапсулированных сфероидов
- Фиксация и окрашивание
- Аспирируйте среду из лунок, где культивируются гидрогели, и промойте гидрогели путем пипетирования 500 мкл 1x PBS непосредственно на гидрогели. Осторожно аспирируйте 1x PBS.
- Зафиксируйте сфероиды в 24-луночном планшете с помощью пипетки на 1000 мкл, чтобы добавить 500 мкл объема фиксирующего раствора на лунку. Дайте фиксатору впитать гели в течение 30 минут при RT. Удалите раствор фиксатора с помощью пипетки на 1000 мкл и выбросьте в специальный контейнер для отходов.
- Промойте гидрогели, добавив 500 мкл 1x PBS в каждую лунку. Аспирируйте 1x PBS с помощью пипетки на 1000 мкл и повторите промывку PBS еще два раза. Храните луночный планшет в 500 мкл 1x PBS на лунку при температуре 4 °C в течение 1 недели или используйте немедленно.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не втянуть гидрогели в пипетку при аспирации PBS и фиксирующего раствора. Сделайте это, наклонив пластину под углом ~45 градусов, что поможет увидеть гидрогели и предотвратить случайную аспирацию.
ВНИМАНИЕ: Формальдегид токсичен при вдыхании и контакте. Обрабатывайте в перчатках в химическом вытяжном шкафу. - Для окрашивания клеток инкубируют инкапсулированные гидрогелем сфероиды с первичными антителами к Nestin (200 мкг/мл) и SOX2 (200 мкг/мл) в разведении 1:200 антитела: PBS. Используйте пипетку на 1000 мкл для аспирации 1x PBS из лунок. Добавьте 50 мкл разбавленного антитела в каждую лунку. Подождите 24 часа, чтобы окрашивание было завершено. Затем удалите раствор красителя с помощью пипетки на 1000 мкл и выбросьте отходы соответствующим образом.
- С помощью пипетки на 1000 мкл добавьте 500 мкл 1xPBS, чего достаточно для погружения гидрогеля. Аспирируйте PBS и повторите его еще два раза. Храните окрашенный и погруженный гидрогель в 1x PBS при 4 °C в течение 2 недель перед визуализацией или изображением немедленно.
ПРИМЕЧАНИЕ: В зависимости от антител может потребоваться незначительная оптимизация, чтобы обеспечить надлежащее окрашивание. Концентрация (1:200) и время (24 ч) значительно выше, чем в типичной 2D-монослойной клеточной культуре, поскольку 3D-окрашивание требует диффузии через гидрогель и сфероиды.
- После окрашивания сфероидов очистите сфероид для улучшения прозрачности для визуализации, заменив PBS последовательным увеличением концентрации формамида (опционально).
- Аспирируйте 1x PBS из каждой лунки. Добавьте 500 мкл 20% (v/v) формамида в каждую лунку и дайте гидрогелю инкубироваться в течение 90 минут. Аспирируйте формамид с помощью пипетки на 1000 мкл и собирайте отходы в контейнер для отходов.
- Добавьте в лунку 500 мкл 40% (v/v) формамида. Дайте гидрогелю настояться в растворе в течение 90 мин. Аспирируйте формамид и собирайте отходы в контейнер для отходов.
- Добавьте 500 мкл 80% формамида v/v в каждую лунку и инкубируйте в течение 90 мин. Аспирируйте формамид и выбросьте в контейнер для отходов. Добавьте 500 мкл 100% (v/v) формамида и дайте 24 часа инкубации перед визуализацией. После завершения очистки надлежащим образом утилизируйте отходы формамида с помощью соответствующих служб лабораторной системы управления отходами.
ПРИМЕЧАНИЕ: Очистка позволяет получить конфокальную визуализацию ядра сфероида и не является обязательной, если исследуется только периферия сфероида.
- Визуализация инкапсулированных гидрогелем сфероидов с помощью конфокальной микроскопии.
ПРИМЕЧАНИЕ: Любой микроскоп - инвертированный, флуоресцентный или конфокальный - может быть использован для визуализации клеток; Однако конфокальная позволяет изолировать отдельные плоскости.- Поместите гидрогели в камерные лунки со стеклянным покровным дном и расположите сфероиды как можно ближе к покровному стекле.
ПРИМЕЧАНИЕ: Можно использовать стеклянные покровные стекла или камерные колодцы со стеклянным покровным дном. Крайне важно поддерживать гидратацию гидрогелей, так как обезвоженные образцы приведут к ухудшению качества визуализации. - Визуализируйте образцы с помощью объектива с большим рабочим расстоянием (10x-20x), чтобы получить изображения вглубь сфероида с помощью Z-стеков для 3D-реконструкций.
ПРИМЕЧАНИЕ: Объективы с более высоким увеличением обеспечивают более детальное изображение и оптическое сечение, но жертвуют глубиной изображения. - Количественно определите количество сигнала, присутствующего в оптическом сечении, по отношению к общей площади сфероида как для очищенного, так и для неочищенного сигнала, используя уравнение 2.
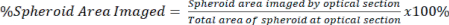 Уравнение 2
Уравнение 2
- Поместите гидрогели в камерные лунки со стеклянным покровным дном и расположите сфероиды как можно ближе к покровному стекле.
Access restricted. Please log in or start a trial to view this content.
Результаты
Платформы скрининга лекарственных средств на основе сфероидов для изучения химиотерапевтических эффектов становятся все более востребованными из-за акцента на модуляцию микроокружения опухоли при инкапсуляции сфероида в биоматериалах, реплицирующих нативную ткань. Здесь мы разраб...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Модели многоклеточных сфероидов опухолей на основе гидрогеля все чаще разрабатываются для продвижения терапевтических открытий в области лечения рака 11,13,29. Они полезны тем, что контролируемо эмулируют ключевые параметры микроокруж?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была профинансирована за счет стартовых средств, предоставленных доктору Сильвии. Зустиак Университетом Сент-Луиса, а также за счет начального гранта от Центра неврологии Генри и Амелии Насраллы при Университете Сент-Луиса, присужденного доктору Сильвии. Зустиак.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 70% Ethanol | Fisher Scientific | LC22210-4 | |
| 15 mL Conicals | FALCON | 352097 | |
| 24-Well Plate Ultra Low Attachment plates | Fisher Scientific | 07-200-602 | |
| 35 mm Petri Dish | Amazon | 706011 | |
| 4-arm poly(ethylene glycol)-acrylate (4-arm PEG-Ac; 10 kDa) | Laysan Bio | ACRL-PEG-ACRL-10K-5g | |
| 50 mL Conicals | Fisher Scinetific | 3181345107 | |
| 6-well AggreWell 400 | StemCell Technologies, Vancouver, Canada | 34421 | Square pyramidal microwells |
| anti-adherence rinsing solution | StemCell Technologies, Vancouver, Canada | Cat #: 07010 | |
| Aspartic Acid-Arginine-Cysteine-Glycine-Valine-Proline-Methionine-Serine-Methionine-Arginine-Glycine-Cysteine-Arginine- Aspartic Acid (DRCG-VPMSMR-GCRD) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Chemical Fume Hood | KEWAUNEE | 99151 | |
| Corning Matrigel Basement Membrane Matrix, LDEV Free | Corning | 356234 | Basement membrane matrix |
| Detergent - Triton-X | Sigma Aldrich | T8787 | Nonionic surfactant |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | BP231-100 | |
| Disposable Pipettes (1 mL, 2 mL, 5 mL, 10 mL, 25 mL, 50 mL) | Fisher Scinetific | 1 mL: 13-678-11B, 2mL: 05214038, 5mL(FALCON): 357529, 10mL: 13-678-11E, 25mL: 13-678-11, 50mL: 13-678-11F | |
| Fetal Bovine Serum | HyClone | SH30073-03 | |
| Formaldehyde 37% Solution | Sigma Aldrich | F1635 | |
| Glass Plates | Slumpys | GBS4100SFSL | |
| Glass Transfer Pipettes | Fisher Scinetific | 5 3/4": 1367820A, 9":136786B | |
| Glycine-Arginine-Cysteine-Aspartic Acid-Arginine-Glycine-Aspartic Acid-Serine (GRCD-RGDS) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Hemacytometer | Bright-Line | 383684 | |
| Hydrophobic solution - Repel Silane | GE Healthcare Bio-Sciences | 17-1332-01 | |
| Incubator | NUAIRE | NU-8500 | |
| Inverted Microscope (Axiovert 25) | Zeiss | 663526 | |
| Invitrogen DiOC16(3) (3,3'-Dihexadecyloxacarbocyanine Perchlorate) | Fisher Scientific | D1125 | |
| Leica Confocal SP8 | Leica Microsystems Inc. | ||
| Light and Flourescent Microscope (Axiovert 200M) | Zeiss | 3820005619 | |
| Micro centrifuge tubes | Fisher Scientific | 2 mL: 02681258 | |
| Microscope Software | Zeiss | AxioVision Rel. 4.8.2 | |
| Nestin Alexa Fluor 594 | Santa Cruz Biotechnology | sc-23927 | |
| Parafilm | PARAFILM | PM992 | |
| PBS (1x), pH 7.4 | HyClone | SH30256.01 | |
| Penicillin Streptomycin | MP Biomedicals | 1670046 | |
| Pipette Aid | Drummond Scientific Co. | P-76864 | |
| Pipette Tips (1–200 µL, 101–1000 µL) | Fisher Scinetific | 2707509 | |
| Plastic Standard Disposable Transfer Pipettes | Fisher Scientific | 13-711-9D | |
| Plastic Weigh Boats (100 mL) | Amazon | mdo-azoc-1030 | |
| poly(ethylene glycol)-dithiol (PEG-diSH; 3.4 kDa) | Laysan Bio | SH-PEG-SH-3400-5g | |
| Polydimehylsiloxane (PDMS) [Slygard 182 Elastomer Kit] | Elsworth Adhesives | 3097358-1004 | Polydimethylsiloxane |
| Powder Free Examination Gloves | Quest | 92897 | |
| Propidium iodide, 1 mg/mL aqueous soln. | Fisher Scientific | AAJ66584AB | |
| RPMI-1640 Medium (1x) | HyClone | SH30027-02 | |
| Silicone spacers - Silicone sheet, 0.5 mm thick/13 cm x 18 cm | Grace Bio-Labs | JTR-S-0.5 | |
| SOX2 Alexa Fluor 488 | Santa Cruz Biotechnology | sc-365823 | |
| Tissue Culture Hood | NUAIRE | NU-425-600 | |
| Triethanolamine, ≥99.0% (GC) | Sigma Aldrich | 90279 | |
| U-87 MG human glioblastoma cells | American Type Culture Collection | HTB-14 |
Ссылки
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Costa, E. C., de Melo-Diogo, D., Moreira, A. F., Carvalho, M. P., Correia, I. J. Spheroids formation on non-adhesive surfaces by liquid overlay technique: Considerations and practical approaches. Biotechnology Journal. 13 (1), 1700417(2018).
- Li, Y., Kumacheva, E. Hydrogel microenvironments for cancer spheroid growth and drug screening. Science Advances. 4 (4), eaas8998(2018).
- Kamatar, A., Gunay, G., Acar, H. Natural and synthetic biomaterials for engineering multicellular tumor spheroids. Polymers. 12 (11), 2506(2020).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular Pharmaceutics. 11 (7), 2115-2125 (2014).
- Nakod, P. S., Kim, Y., Rao, S. S. Three-dimensional biomimetic hyaluronic acid hydrogels to investigate glioblastoma stem cell behaviors. Biotechnology and Bioengineering. 117 (2), 511-522 (2020).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85, 128-146 (2020).
- Pedron, S., et al. Hyaluronic acid-functionalized gelatin hydrogels reveal extracellular matrix signals temper the efficacy of erlotinib against patient-derived glioblastoma specimens. Biomaterials. 219, 119371(2019).
- Hill, L., Bruns, J., Zustiak, S. P. Hydrogel matrix presence and composition influence drug responses of encapsulated glioblastoma spheroids. Acta Biomaterialia. 132, 437-447 (2021).
- Chen, J. -W. E., et al. Crosstalk between microglia and patient-derived glioblastoma cells inhibit invasion in a three-dimensional gelatin hydrogel model. Journal of Neuroinflammation. 17 (1), 346(2020).
- Thakuri, P. S., Liu, C., Luker, G. D., Tavana, H. Biomaterials-based approaches to tumor spheroid and organoid modeling. Advanced Healthcare Materials. 7 (6), 1700980(2018).
- Shin, S., et al. Alginate-marine collagen-agarose composite hydrogels as matrices for biomimetic 3D cell spheroid formation. RSC Advances. 6 (52), 46952-46965 (2016).
- Pradhan, S., Clary, J. M., Seliktar, D., Lipke, E. A. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 115, 141-154 (2017).
- Imaninezhad, M., Hill, L., Kolar, G., Vogt, K., Zustiak, S. P. Templated macroporous polyethylene glycol hydrogels for spheroid and aggregate cell culture. Bioconjugate Chemistry. 30 (1), 34-46 (2018).
- Mirab, F., Kang, Y. J., Majd, S. Preparation and characterization of size-controlled glioma spheroids using agarose hydrogel microwells. PLoS One. 14 (1), e0211078(2019).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments: JoVE. 81, e50665(2013).
- Timmins, N. E., Nielsen, L. K. Generation of Multicellular Tumor Spheroids by the Hanging-Drop Method. Hauser, H., Fussenegger, M. 140, Springer, Humana Press, NJ. (2007).
- Zhao, L., et al. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Scientific Reports. 9 (1), 19717(2019).
- Amaral, R. L., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605(2017).
- Gencoglu, M. F., et al. Comparative study of multicellular tumor spheroid formation methods and implications for drug screening. ACS Biomaterials Science & Engineering. 4 (2), 410-420 (2018).
- Zhang, C., Liu, C., Zhao, H. Mechanical properties of brain tissue based on microstructure. Journal of the Mechanical Behavior of Biomedical Materials. 126, 104924(2021).
- Alifieris, C., Trafalis, D. T. Glioblastoma multiforme: Pathogenesis and treatment. Pharmacology & Therapeutics. 152, 63-82 (2015).
- Zustiak, S. P., Leach, J. B. Hydrolytically degradable poly (ethylene glycol) hydrogel scaffolds with tunable degradation and mechanical properties. Biomacromolecules. 11 (5), 1348-1357 (2010).
- Zustiak, S. P., Wei, Y., Leach, J. B. Protein-hydrogel interactions in tissue engineering: Mechanisms and applications. Tissue Engineering Part B: Reviews. 19 (2), 160-171 (2013).
- Kroger, S. M., et al. Design of hydrolytically degradable polyethylene glycol crosslinkers for facile control of hydrogel degradation. Macromolecular Bioscience. 20 (10), 2000085(2020).
- Raeber, G., Lutolf, M., Hubbell, J. Molecularly engineered PEG hydrogels: a novel model system for proteolytically mediated cell migration. Biophysical Journal. 89 (2), 1374-1388 (2005).
- Bruns, J., Egan, T., Mercier, P., Zustiak, S. P. Glioblastoma spheroid growth and chemotherapeutic responses in single and dual-stiffness hydrogels. Acta Biomaterialia. 163, 400-414 (2023).
- Kuwajima, T., et al. ClearT: a detergent-and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Holt, S. E., Ward, E. S., Ober, R. J., Alge, D. L. Shooting for the moon: using tissue-mimetic hydrogels to gain new insight on cancer biology and screen therapeutics. MRS Communications. 7 (3), 427-441 (2017).
- Jain, E., Scott, K. M., Zustiak, S. P., Sell, S. A. Fabrication of polyethylene glycol-based hydrogel microspheres through electrospraying. Macromolecular Materials and Engineering. 300 (8), 823-835 (2015).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948(2016).
- Lee, K. -H., Kim, T. -H. Recent advances in multicellular tumor spheroid generation for drug screening. Biosensors. 11 (11), 445(2021).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены