È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fabbricazione e incapsulamento di sferoidi tumorali in idrogel di polietilenglicole per lo studio delle interazioni sferoide-matrice
In questo articolo
Riepilogo
Qui, presentiamo un protocollo che consente la fabbricazione rapida, robusta ed economica di sferoidi tumorali seguita dall'incapsulamento dell'idrogel. È ampiamente applicabile in quanto non richiede attrezzature specializzate. Sarebbe particolarmente utile per esplorare le interazioni sferoide-matrice e costruire modelli di fisiologia o patologia tissutale in vitro .
Abstract
L'incapsulamento tridimensionale (3D) degli sferoidi è fondamentale per replicare adeguatamente il microambiente tumorale per una crescita cellulare ottimale. Qui, abbiamo progettato un modello di glioblastoma 3D in vitro per l'incapsulamento sferoidale per imitare il microambiente extracellulare del tumore. Innanzitutto, abbiamo formato stampi per micropozzetti piramidali quadrati utilizzando il polidimetilsilossano. Questi stampi per micropozzetti sono stati poi utilizzati per fabbricare sferoidi tumorali con dimensioni strettamente controllate da 50 a 500 μm. Una volta formati, gli sferoidi sono stati raccolti e incapsulati in idrogel a base di polietilenglicole (PEG). Gli idrogel PEG sono una piattaforma versatile per l'incapsulamento degli sferoidi, poiché le proprietà dell'idrogel come la rigidità, la degradabilità e l'adesività cellulare possono essere regolate in modo indipendente. In questo caso, abbiamo utilizzato un idrogel morbido rappresentativo (~8 kPa) per incapsulare gli sferoidi del glioblastoma. Infine, è stato sviluppato un metodo per colorare e visualizzare gli sferoidi per ottenere immagini di alta qualità tramite microscopia confocale. A causa del denso nucleo sferoidale e della periferia relativamente scarsa, l'imaging può essere difficile, ma l'uso di una soluzione di purificazione e di un sezionamento ottico confocale aiuta ad alleviare queste difficoltà di imaging. In sintesi, mostriamo un metodo per fabbricare sferoidi uniformi, incapsularli in idrogel PEG ed eseguire la microscopia confocale sugli sferoidi incapsulati per studiare la crescita degli sferoidi e le varie interazioni cellula-matrice.
Introduzione
Gli sferoidi tumorali sono emersi come utili strumenti in vitro nello studio dell'eziologia, della patologia e della risposta ai farmacidel cancro 1. Tradizionalmente, gli sferoidi sono stati coltivati in condizioni come piastre a bassa adesione o bioreattori, in cui l'adesione cellula-cellula è favorita rispetto all'adesione cellula-superficie2. Tuttavia, è ormai riconosciuto che per ricapitolare più fedelmente il microambiente tumorale, i modelli di sferoidi in vitro dovrebbero catturare sia le interazioni cellula-cellula che cellula-matrice. Ciò ha spinto diversi gruppi a progettare scaffold, come gli idrogel, in cui gli sferoidi possono essere incapsulati 3,4. Tali modelli di sferoidi basati su idrogel consentono di chiarire le interazioni cellula-cellula e cellula-matrice su vari comportamenti cellulari, come la vitalità, la proliferazione, la staminalità o la risposta alla terapia3.
Qui descriviamo un protocollo per l'incapsulamento di sferoidi di glioblastoma in idrogel di polietilenglicole (PEG). Ci sono diversi rapporti in letteratura sull'incapsulamento di sferoidi delle cellule di glioblastoma in idrogel. Ad esempio, gli sferoidi sono stati formati incapsulando cellule U87 in idrogel PEG decorati con un ligando adesivo RGDS e reticolati con un peptide enzimaticamente scissibile per determinare l'effetto della rigidità dell'idrogel sul comportamento cellulare5. Le cellule U87 sono state formate anche in altri idrogel a base di PEG o acido ialuronico per espandere la popolazione di cellule staminali tumorali6 o per esplorare i meccanismi mediati dalla matrice di resistenza alla chemioterapia 7,8,9. Gli sferoidi del glioblastoma sono stati anche incapsulati in idrogel di gelatina per studiare il crosstalk tra microglia e cellule tumorali e il suo effetto sull'invasione cellulare10. Nel complesso, tali studi hanno dimostrato l'utilità dei modelli in vitro a base di idrogel nella comprensione della patologia del glioblastoma e nell'ideazione di trattamenti.
Inoltre, esistono diversi metodi per la fabbricazione di sferoidi tumorali e l'incapsulamento dell'idrogel11. Ad esempio, le cellule disperse potrebbero essere seminate in idrogel e lasciate formare sferoidi nel tempo 5,12. Uno svantaggio di tale metodo è la polidispersione degli sferoidi formati, che potrebbe portare a risposte cellulari differenziali. Per produrre sferoidi uniformi, le cellule potrebbero essere incapsulate in microgel e coltivate per lunghi periodi fino a quando non invadono e rimodellano il gel13, oppure le cellule potrebbero essere depositate in gel modellati con "fori" sferici e lasciate aggregare14. Lo svantaggio di questi metodi è la loro relativa complessità, la necessità di un generatore di goccioline o di altri mezzi per formare microgel o i "buchi" nel gel e il tempo necessario agli sferoidi per crescere e maturare. In alternativa, gli sferoidi possono essere preformati in micropozzetti 9,15,16 o in piastre a goccia sospesa 17,18 e quindi incapsulati in un idrogel, in modo simile alla tecnica qui descritta. Questi metodi sono più semplici e possono essere eseguiti con una velocità effettiva più elevata. È interessante notare che è stato dimostrato che il metodo di formazione degli sferoidi può influenzare i comportamenti delle cellule sferoidi, come l'espressione genica, la proliferazione cellulare o la risposta ai farmaci19,20.
Qui, ci concentriamo sul glioblastoma poiché è un tumore solido il cui ambiente nativo è la matrice cerebralemorbida e nanoporosa 21, che può essere imitata da un idrogel morbido e nanoporoso. Il glioblastoma è anche il tumore cerebrale più mortale per il quale non esiste una cura disponibile22. Tuttavia, il protocollo qui descritto può essere utilizzato per l'incapsulamento di sferoidi che rappresentano qualsiasi tumore solido. Abbiamo scelto di utilizzare idrogel PEG che si formano attraverso una reazione di addizione di tipo Michael23. Il PEG è un idrogel sintetico, non degradabile e biocompatibile, inerte e che funge da impalcatura e supporto fisico delle cellule, ma non supporta l'attaccamento cellulare23. L'adesività cellulare può essere aggiunta separatamente tramite il legame di proteine intere o ligandi adesivi24 e la degradabilità può essere aggiunta tramite modifiche chimiche della catena polimerica PEG o reticolanti idroliticamente o enzimaticamente degradabili25,26. Ciò consente di regolare le proprietà biochimiche indipendentemente dalle proprietà meccaniche o fisiche dell'idrogel, il che potrebbe essere vantaggioso nello studio delle interazioni cellula-matrice. La chimica di gelificazione di tipo Michael è selettiva e avviene in condizioni fisiologiche; Quindi, consente l'incapsulamento degli sferoidi semplicemente mescolando gli sferoidi con la soluzione precursore dell'idrogel.
Nel complesso, la metodologia qui presentata presenta diverse caratteristiche degne di nota. Innanzitutto, la fabbricazione di sferoidi tumorali in un gruppo multipozzetto è efficiente, rapida e il costo dei materiali richiesti è basso. In secondo luogo, gli sferoidi sono prodotti in grandi lotti in una varietà di dimensioni con bassa polidispersione. Infine, sono richiesti solo materiali disponibili in commercio. L'utilità della metodologia è illustrata esplorando l'effetto delle proprietà del substrato sulla vitalità, la circolarità e la staminalità delle cellule sferoidi.
Protocollo
1. Preparazione delle soluzioni
- Preparazione di una soluzione di precursore del polidimetilsilossano (PDMS)
- Preparare la soluzione negativa del precursore del PDMS (utilizzata anche per la soluzione del precursore della colla). Raccogli l'elastomero in una bilancia usando una spatola e pesalo. Aggiungere l'agente indurente alla base elastomerica in rapporto 1:10. Mescolare il PDMS e l'agente indurente delicatamente e accuratamente utilizzando la spatola nella bilancia di plastica.
NOTA: Questa soluzione precursore PDMS viene versata nella piastra a micropozzetti piramidale quadrata a 6 pozzetti per formare lo stampo negativo. Questa è la stessa soluzione che viene utilizzata per la soluzione precursore della colla. - Preparare la soluzione positiva del precursore del PDMS. Raccogli la base di elastomero nella pesa usando una spatola e pesala. Aggiungere l'agente indurente alla base elastomerica in rapporto 1:9. Mescolare il PDMS e l'agente indurente delicatamente e accuratamente utilizzando la spatola nella bilancia di plastica.
NOTA: Questa soluzione precursore PDMS viene successivamente versata sullo stampo negativo per formare lo stampo positivo.
- Preparare la soluzione negativa del precursore del PDMS (utilizzata anche per la soluzione del precursore della colla). Raccogli l'elastomero in una bilancia usando una spatola e pesalo. Aggiungere l'agente indurente alla base elastomerica in rapporto 1:10. Mescolare il PDMS e l'agente indurente delicatamente e accuratamente utilizzando la spatola nella bilancia di plastica.
- Preparazione di un tampone 0,3 M di trietanolammina (TEA) a pH 8
- Pipettare 1 mL di TEA e 9 mL di 1x soluzione salina tamponata con fosfato (PBS) in un conico da 50 mL utilizzando un ausilio per pipette per creare una soluzione di TEA 0,75 M. Titolare la soluzione a un pH di 8 utilizzando 1 N HCl o 1 N NaOH. Quindi, aggiungere una quantità sufficiente di PBS 1x per ottenere un volume finale di 25 mL per ottenere una concentrazione finale di TEA di 0,3 M con un pH di 8.
ATTENZIONE: Conservare le soluzioni di HCl e NaOH in un armadio infiammabile a temperatura ambiente (RT). Indossare dispositivi di protezione individuale durante la manipolazione.
- Pipettare 1 mL di TEA e 9 mL di 1x soluzione salina tamponata con fosfato (PBS) in un conico da 50 mL utilizzando un ausilio per pipette per creare una soluzione di TEA 0,75 M. Titolare la soluzione a un pH di 8 utilizzando 1 N HCl o 1 N NaOH. Quindi, aggiungere una quantità sufficiente di PBS 1x per ottenere un volume finale di 25 mL per ottenere una concentrazione finale di TEA di 0,3 M con un pH di 8.
- Preparazione di terreni completi
- Per preparare il terreno completo, aggiungere il 10% (p/v) o 56 ml di siero fetale bovino e l'1% (p/v) o 5,6 mL di penicillina e streptomicina a 500 mL di terreno RPMI.
- Porre la soluzione a 37 °C per 10-20 minuti o fino a quando la soluzione non è calda prima dell'uso.
- Conservare la soluzione a 0-4 °C per un massimo di 6 mesi.
- Preparazione di soluzioni madre di polietilenglicole (PEG) al 20% (p/v)
NOTA: Il calcolo si basa su soluzioni da 100 μL che possono essere scalate verso l'alto o verso il basso in base alle esigenze.- Per preparare una soluzione madre da 100 μL di PEG-acrilato al 20% p/v a 4 bracci (PEG-Ac a 4 bracci), pesare 20 mg di polvere di PEG-Ac a 4 bracci in una provetta per microfuge. Aggiungere 70 μL di tampone TEA 0,3 M, quindi agitare la soluzione per circa 30 s o fino a completa dissoluzione. Tenere conto della variazione di volume dovuta alla dissoluzione della polvere aggiungendo una quantità sufficiente di tampone TEA (~27 μL) per raggiungere un volume finale della soluzione di 100 μL.
- Per preparare una soluzione madre da 100 μL di PEG-diSH al 20% p/v, pesare 20 mg di polvere di PEG-diSH in una provetta per microfuge. Aggiungere 70 μL di tampone TEA, quindi agitare la soluzione per circa 30 secondi o fino a completa dissoluzione. Tenere conto della variazione di volume dovuta alla dissoluzione della polvere aggiungendo una quantità sufficiente di tampone TEA (~27 μL) per raggiungere un volume finale della soluzione di 100 μL.
NOTA: La polvere di PEG è molto igroscopica e deve essere conservata in un contenitore essiccato a -20 °C. Quando lo si estrae dal congelatore, lasciare scongelare la polvere di PEG per 10 minuti prima di aprire il flacone per pesare la polvere. Spurgare la bottiglia con un gas inerte come azoto o argon per spostare l'aria umida prima di rimetterla nel congelatore. La soluzione madre di PEG-Ac a 4 bracci può essere conservata a 4 °C per un massimo di 2 settimane prima dell'uso. La soluzione madre di PEG-diSH deve essere preparata immediatamente prima dell'uso e non può essere conservata perché i gruppi tiolici reagiscono tra loro per formare legami disolfuro.
- Preparazione di una soluzione di matrice di membrana basale al 2% v/v
- Per preparare una soluzione di lavoro a matrice di membrana basale al 2% v/v, aggiungere 20 μL di matrice di membrana basale (priva di LDEV) a 9,98 mL di terreno completo e mescolare accuratamente pipettando su e giù ~10 volte. Preparare la soluzione a 4 °C (con ghiaccio), quindi riscaldarla a 37 °C (in forno o in incubatrice) e consumarla immediatamente.
NOTA: La matrice di membrana basale inizierà a formare un gel a >10 °C, quindi assicurarsi di miscelare la soluzione di matrice di membrana basale con il terreno completo a 2-6 °C. La composizione completa del supporto è descritta al punto 1.3.
- Per preparare una soluzione di lavoro a matrice di membrana basale al 2% v/v, aggiungere 20 μL di matrice di membrana basale (priva di LDEV) a 9,98 mL di terreno completo e mescolare accuratamente pipettando su e giù ~10 volte. Preparare la soluzione a 4 °C (con ghiaccio), quindi riscaldarla a 37 °C (in forno o in incubatrice) e consumarla immediatamente.
- Preparazione della soluzione fissativa cellulare
- Per preparare 1 mL di soluzione fissativa cellulare contenente il 4% p/v di paraformaldeide e lo 0,1% v/v di tensioattivo non ionico, miscelare prima 891 μL di 1x PBS e 108 μL di paraformaldeide (concentrazione 37% p/v), quindi aggiungere 1 μL di tensioattivo non ionico (concentrazione 100%). Mescolare accuratamente la soluzione.
NOTA: La soluzione fissativa deve essere preparata fresca ogni volta che viene eseguita la fissazione.
ATTENZIONE: La paraformaldeide è infiammabile e può formare concentrazioni di polvere combustibile nell'aria. Provoca irritazioni cutanee e gravi danni agli occhi. Evitare di inspirare poiché potrebbe causare irritazione respiratoria. Maneggiare la paraformaldeide in una cappa per aspiratori chimici e indossare dispositivi di protezione individuale. Lavarsi accuratamente le mani dopo la manipolazione. Il tensioattivo non ionico provoca irritazione cutanea e gravi danni agli occhi. Indossare guanti protettivi e protezione per gli occhi o per il viso durante la manipolazione. Per evitare il rilascio nell'ambiente, aprire la bottiglia in una cappa chimica. Lavarsi accuratamente le mani dopo la manipolazione.
- Per preparare 1 mL di soluzione fissativa cellulare contenente il 4% p/v di paraformaldeide e lo 0,1% v/v di tensioattivo non ionico, miscelare prima 891 μL di 1x PBS e 108 μL di paraformaldeide (concentrazione 37% p/v), quindi aggiungere 1 μL di tensioattivo non ionico (concentrazione 100%). Mescolare accuratamente la soluzione.
- Preparazione delle soluzioni coloranti
- Per preparare 3 mM di ioduro di 3,3'-diesiloxacarbocianina (DiOC), mescolare 2,65 mg di DiOC in 1 mL di DMSO.
- Per preparare 1,5 mM di soluzione di ioduro di propidio (PI), mescolare 1 mg di PI in 1 mL di acqua deionizzata.
- Preparazione della soluzione di purificazione sferoidale
- Preparare soluzioni di chiarificazione al 20%, 40% e 80% v/v di formammide in PBS 1x per la pulizia degli sferoidi.
- Per ottenere 10 mL di formammide al 20% v/v, mescolare 8 mL di 1x PBS seguiti da 2 mL di formammide. Per ottenere 10 mL di formammide al 40% v/v, mescolare 6 mL di 1x PBS seguiti da 4 mL di formammide. Per ottenere 10 mL di formammide all'80% v/v, mescolare 2 mL di 1x PBS seguiti da 8 mL di formammide.
- Dopo aver combinato la formammide e 1x PBS, mescolare la soluzione mediante vortex per circa 30 s.
- Preparare soluzioni di chiarificazione al 20%, 40% e 80% v/v di formammide in PBS 1x per la pulizia degli sferoidi.
2. Fabbricazione di micropozzetti piramidali quadrati
- Fabbricare uno stampo PDMS negativo di micropozzetti piramidali quadrati come mostrato nella Figura 1.
- Preparare 2 g (~1 mL) di soluzione negativa di precursore PDMS e versarla su un pozzetto di uno stampo master piramidale quadrato a 6 pozzetti. Si noti che 1 mL copre completamente un pozzetto della piastra. Dopo aver coperto lo stampo principale con PDMS, degassare la soluzione precursore PDMS per 30 minuti posizionando la piastra piramidale quadrata a 6 pozzetti in un essiccatore sottovuoto. Quindi, polimerizzare il PDMS mettendo la piastra in un forno a 60 °C per 24 ore.
NOTA: Assicurarsi che il coperchio della piastra sia stato rimosso per il degasaggio e riposizionato per l'indurimento. Degassare la soluzione in un essiccatore sottovuoto o attraverso lo spurgo con un gas inerte come azoto o argon. Se la soluzione negativa del precursore della muffa presenta ancora bolle dopo 30 minuti, che indicano un degasaggio inadeguato, metterla in un essiccatore sottovuoto per altri 30 minuti. Utilizzare uno o più pozzetti per piastre contemporaneamente per preparare uno o più stampi negativi PDMS. Possono essere utilizzati micropozzetti piramidali quadrati di diverse dimensioni, come lunghezze laterali di 400 e 800 μm, come mostrato nella Tabella 1. La stessa quantità di PDMS viene utilizzata indipendentemente dalle dimensioni piramidali quadrate. - Una volta che il PDMS si è indurito mentre è ancora caldo, rimuovere con cautela lo stampo PDMS negativo dallo stampo principale utilizzando una spatola e tagliare lo stampo negativo in una lastra di 35 mm di diametro utilizzando un punzone per biopsia. Mettere in una capsula di Petri e coprire con il coperchio e consentire la polimerizzazione continua RT per altre 24 ore.
NOTA: Per rimuovere gli stampi negativi, utilizzare una spatola per interporsi tra la piastra del pozzetto e lo stampo PDMS ed estrarre delicatamente lo stampo negativo dallo stampo principale. Lo stampo viene tagliato in lastre da 35 mm per adattarsi a una capsula di Petri da 35 mm. Gli stampi possono essere realizzati in altre dimensioni per adattarsi a piastre di diverso diametro. Le lastre di stampo negativo da 35 mm possono essere conservate, protette dalla polvere a RT e riutilizzate per 6 mesi.
- Preparare 2 g (~1 mL) di soluzione negativa di precursore PDMS e versarla su un pozzetto di uno stampo master piramidale quadrato a 6 pozzetti. Si noti che 1 mL copre completamente un pozzetto della piastra. Dopo aver coperto lo stampo principale con PDMS, degassare la soluzione precursore PDMS per 30 minuti posizionando la piastra piramidale quadrata a 6 pozzetti in un essiccatore sottovuoto. Quindi, polimerizzare il PDMS mettendo la piastra in un forno a 60 °C per 24 ore.
- Preparare uno stampo PDMS positivo di micropozzetti piramidali quadrati.
- Posizionare le lastre da 35 mm dello stampo PDMS negativo in una capsula di Petri da 35 mm con i micropozzetti testurizzati rivolti verso l'alto.
- Preparare 2,5 g (~1,2 mL) di soluzione di precursore PDMS positivo come sopra e versarlo sullo stampo negativo nella capsula di Petri da 35 mm per coprire completamente lo stampo negativo. Quindi degassare la soluzione precursore per 30 minuti come sopra e metterla in forno a 60 °C per 3-4 ore.
NOTA: Poiché il PDMS è viscoso, può formarsi una bolla dall'aria intrappolata sotto lo stampo negativo. Se si forma una bolla sotto lo stampo negativo, spingere delicatamente lo stampo verso il basso usando una spatola per rilasciare la bolla. Se rimangono bolle d'aria, continuare il degasaggio per 30 minuti o prendere una spatola e mescolare delicatamente la soluzione di muffa positiva fino a quando le bolle non scoppiano. - Una volta che lo stampo PDMS positivo si è indurito, rimuovere gli stampi dalla piastra di Petri da 35 mm e staccare immediatamente lo stampo positivo dallo stampo negativo.
NOTA: La tempistica è importante per il successo della rimozione dello stampo positivo. La rimozione viene eseguita al meglio tagliando leggermente lo stampo positivo usando un rasoio per esporre l'interfaccia tra lo stampo positivo e negativo e staccando gli stampi l'uno dall'altro. Quindi staccare i bordi dello stampo circolare. Staccare delicatamente lo stampo negativo dallo stampo positivo.
- Incollare gli stampi sul fondo dei pozzetti di una piastra da 48 pozzetti.
NOTA: In questo caso viene utilizzata una piastra a 48 pozzetti, ma è possibile utilizzare altre piastre purché le lastre dello stampo siano tagliate nei diametri corretti (ad esempio, 6 mm di diametro per una piastra a 96 pozzetti).- Tagliare gli stampi positivi in lastre utilizzando un punzone per biopsia da 10 mm.
NOTA: È possibile tagliare circa 4 stampi (ciascuno di 10 mm di diametro) da uno stampo positivo di 35 mm di diametro. - Per incollare gli stampi sul fondo di una piastra a 48 pozzetti, preparare la soluzione di precursore della colla PDMS (~0,5 mL o 1 g) come descritto in precedenza27. Utilizzare una pinzetta per immergere delicatamente il lato piatto (non il lato con il modello di micropozzetti) dello stampo positivo da 10 mm nella soluzione precursore PDMS. Posizionare con cura uno stampo per pozzetto di una piastra da 48 pozzetti e premere delicatamente ogni stampo sul fondo del pozzetto usando la pinzetta. Mettere la piastra assemblata in un forno a 60 °C per 4-24 ore per consentire alla colla PDMS di polimerizzare.
NOTA: Se la soluzione del precursore della colla PDMS viene a contatto con i micropozzetti positivi dello stampo, può essere rimossa con carta velina morbida e il passaggio può essere ripetuto. Durante l'incollaggio, assicurarsi che la colla non copra i micropozzetti. - Sterilizzare gli stampi aggiungendo 300 μL di etanolo al 70% in ciascun pozzetto della piastra a 48 pozzetti utilizzando una pipetta da 1000 μL. Aspirare l'etanolo al 70% e posizionare la piastra a 48 pozzetti scoperta in una cappa per coltura tissutale sotto i raggi UV (302 nm) per 2 ore.
NOTA: Gli stampi possono essere utilizzati per 6 mesi e risterilizzati secondo necessità.
- Tagliare gli stampi positivi in lastre utilizzando un punzone per biopsia da 10 mm.
3. Formazione, raccolta e incapsulamento di sferoidi tumorali multicellulari in idrogel
NOTA: Il protocollo descritto in questa sezione è per la linea cellulare di glioblastoma umano U87 (vedere Figura 1 e Figura 2), ma un protocollo simile potrebbe essere utilizzato con altri tipi di cellule tumorali.
- Formazione di sferoidi tumorali multicellulari
- Lavare prima gli stampi per micropozzetti con una soluzione di risciacquo antiaderente aggiungendo 300 μL di soluzione a ciascun pozzetto utilizzando una pipetta da 1000 μL. Quindi, centrifugare a 1620 x g per 3 minuti e aspirare la soluzione utilizzando una pompa a vuoto e una pipetta Pasteur.
NOTA: Eseguire questo passaggio immediatamente prima della semina delle celle. - Esporre le cellule a ~80 μL di tripsina/EDTA allo 0,25% per ogni cm2 di area del pallone di coltura per 5 minuti a 37 °C. Ad esempio, 1 mL di tripsina/EDTA è appropriato per un pallone di coltura cellulare T-25. Neutralizzare la tripsina aggiungendo lo stesso volume di terreno di coltura cellulare completo. Ad esempio, aggiungere 1 mL di terreno completo al pallone di coltura cellulare T-25 contenente tripsina. Raccogliere le cellule dal pallone di coltura tissutale.
- Trasferire 10 μL della sospensione cellulare in ciascuna porta di un emocitometro per la conta cellulare. Utilizzare un microscopio invertito per contare il numero totale di cellule e calcolare la media del conteggio delle cellule da almeno 8 quadranti, assicurandosi che il numero di cellule in ciascun quadrante dell'emocitometro sia 20-50 per ottenere buoni risultati di conteggio delle cellule. Moltiplicare il numero calcolato per 104 per determinare la concentrazione cellulare finale.
- Risospendere le cellule raccolte nel terreno di coltura cellulare RPMI completo integrato con il 10% di siero fetale bovino e l'1% di penicillina/streptomicina alla concentrazione cellulare finale desiderata, a seconda della dimensione dello sferoide desiderata, come mostrato nella Tabella 1.
NOTA: I micropozzetti da 800 μm produrranno ~75 sferoidi in un pozzetto di una piastra a 48 pozzetti e i micropozzetti da 400 μm produrranno ~300 sferoidi in un pozzetto di una piastra a 48 pozzetti. - Posizionare 500 μL di sospensione cellulare alla concentrazione desiderata in micropozzetti e centrifugare la piastra a 1620 x g per 3 minuti. Porre la piastra in un'incubatrice umidificata a 37 °C e 5% di CO2 per 24 ore per consentire la formazione di sferoidi.
NOTA: Se gli sferoidi non si formano, è possibile utilizzare il 2% v/v della matrice di membrana basale combinato con un terreno completo per risospendere le cellule (maggiori dettagli nel passaggio 1.5).
- Lavare prima gli stampi per micropozzetti con una soluzione di risciacquo antiaderente aggiungendo 300 μL di soluzione a ciascun pozzetto utilizzando una pipetta da 1000 μL. Quindi, centrifugare a 1620 x g per 3 minuti e aspirare la soluzione utilizzando una pompa a vuoto e una pipetta Pasteur.
- Raccolta di sferoidi
- Utilizzando una pipetta da 1000 μL, pipettare saldamente 500 μL di terreno completo nel pozzetto. Utilizzando 500 μL di terreno prelevato dal pozzetto, lavare i quattro quadranti del pozzetto (in particolare i quadranti superiore, inferiore, sinistro e destro) pipettando su e giù nei quadranti tre o quattro volte per rimuovere gli sferoidi. Aspirare delicatamente il terreno contenente gli sferoidi (~1000 μL totali) in una provetta per microcentrifuga utilizzando una pipetta da 1000 μL e lasciare che gli sferoidi si depositino sul fondo.
- Rimuovere il surnatante e risospendere gli sferoidi fino alla concentrazione finale desiderata. Ad esempio, per ottenere ~8 sferoidi in un gel da 20 μL dopo l'incapsulamento, risospendere gli sferoidi in 100 μL di terreno, ottenendo una concentrazione di sferoidi di ~75 sferoidi/100 μL nella sospensione sferoidale.
- Incapsulamento degli sferoidi in idrogel, come mostrato nella Figura 2.
- Per creare 100 μL di una soluzione precursore di idrogel PEG al 10% p/v, combinare 50 μL della sospensione sferoidale, seguiti da 30 μL di PEG-Ac a 4 bracci al 20% p/v e infine 20 μL di PEG-diSH al 20% p/v in una provetta per microcentrifuga. In questo modo si otterrà un rapporto molare stechiometrico tra i gruppi acrilato (Ac) e quello tiolico (SH) garantendo una reticolazione ottimale. Miscelare la soluzione di precursore del gel pipettando su e giù ~10 volte.
NOTA: La composizione, il volume e la concertazione del polimero dell'idrogel possono essere modificati secondo necessità. Gli idrogel risultanti saranno lenti a degradazione e non adesivi. Per rendere la cella idrogel adesiva, è possibile aggiungere un legante adesivo come RGDS. Per rendere l'idrogel degradabile enzimaticamente, è possibile aggiungere un reticolante peptidico enzimaticamente degradabile contenente residui di cisteina su entrambe le estremità. Quando si trasferiscono gli sferoidi, pipettare delicatamente la soluzione due volte per rimuovere gli sferoidi e portarli in sospensione per garantire una distribuzione uniforme degli sferoidi. - Pipettare 20 μL della soluzione di precursore del gel tra due vetrini rivestiti di parafilm separati con distanziatori di silicone da 1 mm e posizionare i vetrini con la soluzione di precursore del gel in un incubatore a 37 °C, 5% di CO2 per 15 minuti per consentire la gelificazione.
NOTA: Assicurarsi che i due vetrini siano ricoperti di parafilm per creare una superficie idrofobica che consenta un facile peeling dopo la gelificazione. Al posto del parafilm, è possibile utilizzare una soluzione di rivestimento idrofobico. Un volume di 20 μL di soluzione precursore di idrogel si tradurrà in una lastra di idrogel di ~6 mm di diametro e 1 mm di altezza prima del rigonfiamento. È possibile utilizzare qualsiasi tipo di distanziatore e spessore, ma si raccomanda di mantenere lo spessore del gel pari o inferiore a 1 mm (idrogel più spessi potrebbero limitare la diffusione dell'ossigeno e il trasporto di nutrienti alle cellule) ma maggiore del diametro dello sferoide (in modo che gli sferoidi siano completamente incapsulati nel gel). È possibile utilizzare qualsiasi volume della soluzione precursore dell'idrogel. I gel da 20-30 μL sono adatti per una piastra a 24 pozzetti. - Una volta completata la gelificazione dell'idrogel, separare i due vetrini e staccare delicatamente i gel dalla lastra di vetro utilizzando una spatola. Mettere i gel in una piastra da 24 pozzetti, uno per pozzetto, assicurandosi che la superficie contenente gli sferoidi sia rivolta verso l'alto.
NOTA: Gli sferoidi cadranno sul fondo del gel durante la gelificazione, quindi capovolgendoli per la coltura si assicurerà che gli sferoidi siano vicini alla superficie dell'idrogel per un migliore accesso ai nutrienti e all'ossigeno. La gelificazione può essere monitorata osservando l'eventuale soluzione di precursore dell'idrogel rimasta nella provetta della microcentrifuga e non utilizzata per creare lastre capovolgendo la provetta e annotando il tempo in cui il gel smette di scorrere. - Aggiungere il terreno completo (~500 μL) a ciascun pozzetto e assicurarsi che l'idrogel sia completamente immerso. Porre la piastra multipozzetto in un incubatore umidificato a 37 °C e 5% di CO2 e coltivare le cellule con cambi di terreno ogni 2-3 giorni.
NOTA: Gli idrogel possono essere coltivati per un massimo di 4 settimane o fino a quando gli idrogel non si degradano, cambiando il terreno a giorni alterni.
- Per creare 100 μL di una soluzione precursore di idrogel PEG al 10% p/v, combinare 50 μL della sospensione sferoidale, seguiti da 30 μL di PEG-Ac a 4 bracci al 20% p/v e infine 20 μL di PEG-diSH al 20% p/v in una provetta per microcentrifuga. In questo modo si otterrà un rapporto molare stechiometrico tra i gruppi acrilato (Ac) e quello tiolico (SH) garantendo una reticolazione ottimale. Miscelare la soluzione di precursore del gel pipettando su e giù ~10 volte.
4. Colorazione fluorescente
- Vitalità cellulare
- Utilizzare il colorante ioduro di 3,3'-diexilossacarbocianina (DiOC), che colora i mitocondri e il reticolo endoplasmatico di tutte le cellule, per determinare la vitalità cellulare. Utilizzare DiOC (3 mM) a una concentrazione di 0,02 μg/mL. In particolare, utilizzare una pipetta da 20 μL per aggiungere 2 μL di DiOC per ogni 1000 μL di terreno nel pallone che coltiva le cellule dissociate (almeno 24 ore prima del processo di formazione degli sferoidi nella sezione 3). Attendere 24 ore affinché il DiOC colori le cellule.
- Utilizzare la colorazione nucleare e cromosomica, ioduro di propidio, PI (1,50 mM), che entra solo nelle cellule morte. Per colorare le cellule, aspirare prima tutti i terreni e risciacquare il gel utilizzando una pipetta da 1000 μL per aggiungere 500 μL di PBS 1x in modo che il gel sia completamente immerso.
- Aspirare il PBS e aggiungere 500 μL di terreno fresco, seguiti da 30 μL di soluzione PI a ciascun pozzetto (cioè 6 μL per ogni 100 μL di terreno). Coprire la piastra del pozzetto con un foglio di alluminio per proteggerla dalla luce. Porre la piastra a pozzetti in un'incubatrice a 37 °C e al 5% di CO2 e attendere 30 minuti affinché il PI macchi le cellule morte.
- Rimuovere la pellicola e aspirare il terreno dai pozzetti. Utilizzare una pipetta da 1000 μL per aggiungere 500 μL di PBS 1x per immergere l'idrogel. Aspirare il PBS 1x e ripetere il risciacquo altre due volte. Aggiungere 500 μL di terreno a ciascun pozzetto e visualizzare l'immagine con un microscopio fluorescente invertito o confocale.
- Calcolare la vitalità cellulare confrontando l'area di DiOC (tutte le cellule) con PI (cellule morte), come rappresentato nell'equazione 1, utilizzando immagini z-stack da un microscopio confocale o da un microscopio a fluorescenza invertita.
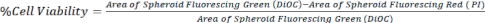 Eq. 1.
Eq. 1.
5. Fissazione dell'immunofluorescenza, colorazione, clearing e imaging di sferoidi incapsulati
- Fissazione e colorazione
- Aspirare i terreni dai pozzetti in cui vengono coltivati gli idrogel e risciacquare gli idrogel pipettando 500 μL di 1x PBS direttamente sugli idrogel. Aspirare delicatamente il PBS 1x.
- Fissare gli sferoidi nella piastra a 24 pozzetti utilizzando una pipetta da 1000 μL per aggiungere 500 μL di soluzione fissativa per pozzetto. Lasciare in ammollo il fissativo per 30 minuti a RT. Rimuovere la soluzione fissativa utilizzando una pipetta da 1000 μL e gettarla in un apposito contenitore per rifiuti.
- Sciacquare gli idrogel aggiungendo 500 μL di 1x PBS a ciascun pozzetto. Aspirare il PBS 1x utilizzando una pipetta da 1000 μL e ripetere il risciacquo PBS altre due volte. Conservare la piastra in 500 μL di 1x PBS per pozzetto a 4 °C per un massimo di 1 settimana o utilizzarla immediatamente.
NOTA: Fare attenzione a non inserire gli idrogel nella pipetta durante l'aspirazione del PBS e della soluzione fissativa. Fallo inclinando la piastra a un angolo di ~45 gradi, che aiuterà a vedere gli idrogel e prevenire l'aspirazione accidentale.
ATTENZIONE: La formaldeide è tossica per inalazione e contatto. Maneggiare con i guanti in una cappa per aspiratori chimici. - Per colorare le cellule, incubare gli sferoidi incapsulati in idrogel con anticorpi primari per Nestin (200 μg/mL) e SOX2 (200 μg/mL) a una diluizione di 1:200 dell'anticorpo: PBS. Utilizzare una pipetta da 1000 μL per aspirare il PBS 1x dai pozzetti. Aggiungere 50 μL dell'anticorpo diluito in ciascun pozzetto. Attendere 24 ore per completare la colorazione. Quindi, rimuovere la soluzione colorante utilizzando una pipetta da 1000 μL e gettare i rifiuti in modo appropriato.
- Utilizzare una pipetta da 1000 μL per aggiungere 500 μL di 1xPBS, sufficienti per immergere l'idrogel. Aspirare il PBS e ripeterlo altre due volte. Conservare immediatamente l'idrogel colorato e sommerso in 1x PBS a 4 °C per un massimo di 2 settimane prima dell'imaging o dell'immagine.
NOTA: Potrebbero essere necessarie piccole ottimizzazioni a seconda dell'anticorpo per garantire una corretta colorazione. La concentrazione (1:200) e il tempo (24 h) sono significativamente più elevati rispetto alla tipica coltura cellulare monostrato 2D perché la colorazione 3D richiede la diffusione attraverso l'idrogel e gli sferoidi.
- Dopo aver colorato gli sferoidi, rimuovere lo sferoide per migliorare la trasparenza per l'imaging sostituendo la PBS con un aumento sequenziale della concentrazione di formamide (opzionale).
- Aspirare il PBS 1x da ciascun pozzetto. Aggiungere 500 μL di formammide al 20% (v/v) in ciascun pozzetto e lasciare incubare l'idrogel per 90 minuti. Aspirare la formammide con una pipetta da 1000 μL e raccogliere i rifiuti in un contenitore per rifiuti.
- Aggiungere 500 μL di formammide al 40% (v/v) nel pozzetto. Lasciare incubare l'idrogel nella soluzione per 90 minuti. Aspirare la formammide e raccogliere i rifiuti nell'apposito contenitore.
- Aggiungere 500 μL di formammide all'80% v/v in ciascun pozzetto e incubare per 90 minuti. Aspirare la formammide e smaltirla nel contenitore dei rifiuti. Aggiungere 500 μL di formammide al 100% (v/v) e attendere 24 ore di incubazione prima dell'imaging. Al termine della bonifica, smaltire correttamente i rifiuti di formammide attraverso i servizi appropriati di un sistema di gestione dei rifiuti di laboratorio.
NOTA: La cancellazione consente l'imaging confocale nel nucleo dello sferoide ed è facoltativa se viene studiata solo la periferia dello sferoide.
- Imaging di sferoidi incapsulati in idrogel mediante microscopia confocale.
NOTA: Qualsiasi microscopio - invertito, fluorescente o confocale - può essere utilizzato per l'imaging cellulare; Tuttavia, il confocale consente l'isolamento di singoli piani.- Posizionare gli idrogel in pozzetti camerati con fondo coprioggetto in vetro e posizionare gli sferoidi il più vicino possibile al vetrino coprioggetto.
NOTA: È possibile utilizzare vetrini coprioggetti o pozzetti camerati con fondo coprioggetti in vetro. È fondamentale mantenere gli idrogel idratati poiché i campioni disidratati si tradurranno in una scarsa qualità dell'imaging. - Visualizzare i campioni con un obiettivo a lunga distanza di lavoro (10x-20x) per consentire l'imaging in profondità nello sferoide utilizzando pile Z per ricostruzioni 3D.
NOTA: Gli obiettivi con ingrandimento più elevato consentono immagini e sezionamento ottico più dettagliati, ma sacrificano la profondità dell'immagine. - Quantificare la quantità di segnale presente nella sezione ottica rispetto all'area totale dello sferoide sia per il segnale cancellato che per quello non cancellato utilizzando l'equazione 2.
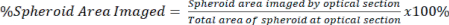 Eq. 2
Eq. 2
- Posizionare gli idrogel in pozzetti camerati con fondo coprioggetto in vetro e posizionare gli sferoidi il più vicino possibile al vetrino coprioggetto.
Risultati
Le piattaforme di screening farmacologico basate su sferoidi per studiare gli effetti chemioterapici sono sempre più ricercate a causa dell'enfasi sulla modulazione del microambiente tumorale sull'incapsulamento dello sferoide in biomateriali che replicano il tessuto nativo. Qui abbiamo sviluppato un metodo per la preparazione di sferoidi tumorali multicellulari e il successivo incapsulamento e imaging in un idrogel 3D. Gli sferoidi vengono preparati in stampi a micropozzetti (Figura 3A,B),...
Discussione
I modelli di sferoidi tumorali multicellulari basati su idrogel sono sempre più sviluppati per far progredire le scoperte terapeutiche del cancro 11,13,29. Sono utili perché emulano i parametri chiave del microambiente tumorale in modo controllato e, nonostante la loro complessità, sono più semplici ed economici da usare rispetto ai modelli in vivo e molti sono compatibili con le tecnologie di screening ad alto rendimento. I...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato da fondi iniziali forniti alla Dott.ssa Silviya P Zustiak dalla Saint Louis University e da una sovvenzione iniziale del Centro Henry e Amelia Nasrallah per le Neuroscienze dell'Università di Saint Louis assegnata alla Dott.ssa Silviya P Zustiak.
Materiali
| Name | Company | Catalog Number | Comments |
| 70% Ethanol | Fisher Scientific | LC22210-4 | |
| 15 mL Conicals | FALCON | 352097 | |
| 24-Well Plate Ultra Low Attachment plates | Fisher Scientific | 07-200-602 | |
| 35 mm Petri Dish | Amazon | 706011 | |
| 4-arm poly(ethylene glycol)-acrylate (4-arm PEG-Ac; 10 kDa) | Laysan Bio | ACRL-PEG-ACRL-10K-5g | |
| 50 mL Conicals | Fisher Scinetific | 3181345107 | |
| 6-well AggreWell 400 | StemCell Technologies, Vancouver, Canada | 34421 | Square pyramidal microwells |
| anti-adherence rinsing solution | StemCell Technologies, Vancouver, Canada | Cat #: 07010 | |
| Aspartic Acid-Arginine-Cysteine-Glycine-Valine-Proline-Methionine-Serine-Methionine-Arginine-Glycine-Cysteine-Arginine- Aspartic Acid (DRCG-VPMSMR-GCRD) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Chemical Fume Hood | KEWAUNEE | 99151 | |
| Corning Matrigel Basement Membrane Matrix, LDEV Free | Corning | 356234 | Basement membrane matrix |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Scientific | 62247 | |
| Detergent - Triton-X | Sigma Aldrich | T8787 | Nonionic surfactant |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | BP231-100 | |
| Disposable Pipettes (1 mL, 2 mL, 5 mL, 10 mL, 25 mL, 50 mL) | Fisher Scinetific | 1 mL: 13-678-11B, 2mL: 05214038, 5mL(FALCON): 357529, 10mL: 13-678-11E, 25mL: 13-678-11, 50mL: 13-678-11F | |
| Fetal Bovine Serum | HyClone | SH30073-03 | |
| Formaldehyde 37% Solution | Sigma Aldrich | F1635 | |
| Glass Plates | Slumpys | GBS4100SFSL | |
| Glass Transfer Pipettes | Fisher Scinetific | 5 3/4": 1367820A, 9":136786B | |
| Glycine-Arginine-Cysteine-Aspartic Acid-Arginine-Glycine-Aspartic Acid-Serine (GRCD-RGDS) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Hemacytometer | Bright-Line | 383684 | |
| Hydrophobic solution - Repel Silane | GE Healthcare Bio-Sciences | 17-1332-01 | |
| Incubator | NUAIRE | NU-8500 | |
| Inverted Microscope (Axiovert 25) | Zeiss | 663526 | |
| Invitrogen DiOC16(3) (3,3'-Dihexadecyloxacarbocyanine Perchlorate) | Fisher Scientific | D1125 | |
| Leica Confocal SP8 | Leica Microsystems Inc. | ||
| Light and Flourescent Microscope (Axiovert 200M) | Zeiss | 3820005619 | |
| Micro centrifuge tubes | Fisher Scientific | 2 mL: 02681258 | |
| Microscope Software | Zeiss | AxioVision Rel. 4.8.2 | |
| Nestin Alexa Fluor 594 | Santa Cruz Biotechnology | sc-23927 | |
| Parafilm | PARAFILM | PM992 | |
| PBS (1x), pH 7.4 | HyClone | SH30256.01 | |
| Penicillin Streptomycin | MP Biomedicals | 1670046 | |
| Pipette Aid | Drummond Scientific Co. | P-76864 | |
| Pipette Tips (1–200 µL, 101–1000 µL) | Fisher Scinetific | 2707509 | |
| Plastic Standard Disposable Transfer Pipettes | Fisher Scientific | 13-711-9D | |
| Plastic Weigh Boats (100 mL) | Amazon | mdo-azoc-1030 | |
| poly(ethylene glycol)-dithiol (PEG-diSH; 3.4 kDa) | Laysan Bio | SH-PEG-SH-3400-5g | |
| Polydimehylsiloxane (PDMS) [Slygard 182 Elastomer Kit] | Elsworth Adhesives | 3097358-1004 | Polydimethylsiloxane |
| Powder Free Examination Gloves | Quest | 92897 | |
| Propidium iodide, 1 mg/mL aqueous soln. | Fisher Scientific | AAJ66584AB | |
| RPMI-1640 Medium (1x) | HyClone | SH30027-02 | |
| Silicone spacers - Silicone sheet, 0.5 mm thick/13 cm x 18 cm | Grace Bio-Labs | JTR-S-0.5 | |
| SOX2 Alexa Fluor 488 | Santa Cruz Biotechnology | sc-365823 | |
| Tissue Culture Hood | NUAIRE | NU-425-600 | |
| Triethanolamine, ≥99.0% (GC) | Sigma Aldrich | 90279 | |
| Trypsin 0.25% (1x) | Sigma Aldrich | SH30042.01 | |
| U-87 MG human glioblastoma cells | American Type Culture Collection | HTB-14 |
Riferimenti
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Costa, E. C., de Melo-Diogo, D., Moreira, A. F., Carvalho, M. P., Correia, I. J. Spheroids formation on non-adhesive surfaces by liquid overlay technique: Considerations and practical approaches. Biotechnology Journal. 13 (1), 1700417 (2018).
- Li, Y., Kumacheva, E. Hydrogel microenvironments for cancer spheroid growth and drug screening. Science Advances. 4 (4), eaas8998 (2018).
- Kamatar, A., Gunay, G., Acar, H. Natural and synthetic biomaterials for engineering multicellular tumor spheroids. Polymers. 12 (11), 2506 (2020).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular Pharmaceutics. 11 (7), 2115-2125 (2014).
- Nakod, P. S., Kim, Y., Rao, S. S. Three-dimensional biomimetic hyaluronic acid hydrogels to investigate glioblastoma stem cell behaviors. Biotechnology and Bioengineering. 117 (2), 511-522 (2020).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85, 128-146 (2020).
- Pedron, S., et al. Hyaluronic acid-functionalized gelatin hydrogels reveal extracellular matrix signals temper the efficacy of erlotinib against patient-derived glioblastoma specimens. Biomaterials. 219, 119371 (2019).
- Hill, L., Bruns, J., Zustiak, S. P. Hydrogel matrix presence and composition influence drug responses of encapsulated glioblastoma spheroids. Acta Biomaterialia. 132, 437-447 (2021).
- Chen, J. -. W. E., et al. Crosstalk between microglia and patient-derived glioblastoma cells inhibit invasion in a three-dimensional gelatin hydrogel model. Journal of Neuroinflammation. 17 (1), 346 (2020).
- Thakuri, P. S., Liu, C., Luker, G. D., Tavana, H. Biomaterials-based approaches to tumor spheroid and organoid modeling. Advanced Healthcare Materials. 7 (6), 1700980 (2018).
- Shin, S., et al. Alginate-marine collagen-agarose composite hydrogels as matrices for biomimetic 3D cell spheroid formation. RSC Advances. 6 (52), 46952-46965 (2016).
- Pradhan, S., Clary, J. M., Seliktar, D., Lipke, E. A. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 115, 141-154 (2017).
- Imaninezhad, M., Hill, L., Kolar, G., Vogt, K., Zustiak, S. P. Templated macroporous polyethylene glycol hydrogels for spheroid and aggregate cell culture. Bioconjugate Chemistry. 30 (1), 34-46 (2018).
- Mirab, F., Kang, Y. J., Majd, S. Preparation and characterization of size-controlled glioma spheroids using agarose hydrogel microwells. PLoS One. 14 (1), e0211078 (2019).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments: JoVE. 81, e50665 (2013).
- Timmins, N. E., Nielsen, L. K., Hauser, H., Fussenegger, M. . Generation of Multicellular Tumor Spheroids by the Hanging-Drop Method. 140, (2007).
- Zhao, L., et al. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Scientific Reports. 9 (1), 19717 (2019).
- Amaral, R. L., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Gencoglu, M. F., et al. Comparative study of multicellular tumor spheroid formation methods and implications for drug screening. ACS Biomaterials Science & Engineering. 4 (2), 410-420 (2018).
- Zhang, C., Liu, C., Zhao, H. Mechanical properties of brain tissue based on microstructure. Journal of the Mechanical Behavior of Biomedical Materials. 126, 104924 (2021).
- Alifieris, C., Trafalis, D. T. Glioblastoma multiforme: Pathogenesis and treatment. Pharmacology & Therapeutics. 152, 63-82 (2015).
- Zustiak, S. P., Leach, J. B. Hydrolytically degradable poly (ethylene glycol) hydrogel scaffolds with tunable degradation and mechanical properties. Biomacromolecules. 11 (5), 1348-1357 (2010).
- Zustiak, S. P., Wei, Y., Leach, J. B. Protein-hydrogel interactions in tissue engineering: Mechanisms and applications. Tissue Engineering Part B: Reviews. 19 (2), 160-171 (2013).
- Kroger, S. M., et al. Design of hydrolytically degradable polyethylene glycol crosslinkers for facile control of hydrogel degradation. Macromolecular Bioscience. 20 (10), 2000085 (2020).
- Raeber, G., Lutolf, M., Hubbell, J. Molecularly engineered PEG hydrogels: a novel model system for proteolytically mediated cell migration. Biophysical Journal. 89 (2), 1374-1388 (2005).
- Bruns, J., Egan, T., Mercier, P., Zustiak, S. P. Glioblastoma spheroid growth and chemotherapeutic responses in single and dual-stiffness hydrogels. Acta Biomaterialia. 163, 400-414 (2023).
- Kuwajima, T., et al. ClearT: a detergent-and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Holt, S. E., Ward, E. S., Ober, R. J., Alge, D. L. Shooting for the moon: using tissue-mimetic hydrogels to gain new insight on cancer biology and screen therapeutics. MRS Communications. 7 (3), 427-441 (2017).
- Jain, E., Scott, K. M., Zustiak, S. P., Sell, S. A. Fabrication of polyethylene glycol-based hydrogel microspheres through electrospraying. Macromolecular Materials and Engineering. 300 (8), 823-835 (2015).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948 (2016).
- Lee, K. -. H., Kim, T. -. H. Recent advances in multicellular tumor spheroid generation for drug screening. Biosensors. 11 (11), 445 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon