Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Fabrication et encapsulation de sphéroïdes tumoraux dans des hydrogels de polyéthylène glycol pour étudier les interactions sphéroïde-matrice
Dans cet article
Résumé
Nous présentons ici un protocole qui permet une fabrication rapide, robuste et peu coûteuse de sphéroïdes tumoraux, suivie d’une encapsulation d’hydrogel. Il est largement applicable car il ne nécessite pas d’équipement spécialisé. Il serait particulièrement utile pour explorer les interactions sphéroïde-matrice et construire des modèles de physiologie tissulaire ou de pathologie in vitro .
Résumé
L’encapsulation tridimensionnelle (3D) des sphéroïdes est cruciale pour reproduire correctement le microenvironnement tumoral pour une croissance cellulaire optimale. Ici, nous avons conçu un modèle de glioblastome 3D in vitro pour l’encapsulation de sphéroïdes afin d’imiter le microenvironnement extracellulaire de la tumeur. Tout d’abord, nous avons formé des moules pyramidaux carrés à micropuits en utilisant du polydiméthylsiloxane. Ces moules à micropuits ont ensuite été utilisés pour fabriquer des sphéroïdes tumoraux avec des tailles étroitement contrôlées de 50 à 500 μm. Une fois les sphéroïdes formés, ils ont été récoltés et encapsulés dans des hydrogels à base de polyéthylène glycol (PEG). Les hydrogels PEG constituent une plate-forme polyvalente pour l’encapsulation de sphéroïdes, car les propriétés de l’hydrogel telles que la rigidité, la dégradabilité et l’adhérence cellulaire peuvent être ajustées indépendamment. Ici, nous avons utilisé un hydrogel souple représentatif (~8 kPa) pour encapsuler les sphéroïdes de glioblastome. Enfin, une méthode de coloration et d’imagerie des sphéroïdes a été développée pour obtenir des images de haute qualité par microscopie confocale. En raison du noyau sphéroïde dense et de la périphérie relativement clairsemée, l’imagerie peut être difficile, mais l’utilisation d’une solution de dégagement et d’un sectionnement optique confocal permet d’atténuer ces difficultés d’imagerie. En résumé, nous montrons une méthode pour fabriquer des sphéroïdes uniformes, les encapsuler dans des hydrogels PEG et effectuer une microscopie confocale sur les sphéroïdes encapsulés pour étudier la croissance des sphéroïdes et diverses interactions cellule-matrice.
Introduction
Les sphéroïdes tumoraux sont apparus comme des outils in vitro utiles dans l’étude de l’étiologie du cancer, de la pathologie et de la réponse aux médicaments1. Traditionnellement, les sphéroïdes ont été cultivés dans des conditions telles que des plaques à faible adhérence ou des bioréacteurs, où l’adhésion cellule-cellule est privilégiée par rapport à l’adhésion cellule-surface2. Cependant, il est maintenant reconnu que pour récapituler plus fidèlement le microenvironnement tumoral, les modèles sphéroïdes in vitro devraient capturer à la fois les interactions cellule-cellule et cellule-matrice. Cela a incité plusieurs groupes à concevoir des échafaudages, tels que des hydrogels, où les sphéroïdes peuvent être encapsulés 3,4. De tels modèles de sphéroïdes à base d’hydrogel permettent d’élucider les interactions cellule-cellule et cellule-matrice sur divers comportements cellulaires, tels que la viabilité, la prolifération, la souche ou la réactivité thérapeutique3.
Ici, nous décrivons un protocole pour l’encapsulation de sphéroïdes de glioblastome dans des hydrogels de polyéthylène glycol (PEG). Il existe de nombreux rapports de littérature sur l’encapsulation de sphéroïdes de cellules de glioblastome dans des hydrogels. Par exemple, les sphéroïdes ont été formés en encapsulant des cellules U87 dans des hydrogels PEG décorés d’un ligand adhésif RGDS et réticulés avec un peptide clivable enzymatiquement pour déterminer l’effet de la rigidité de l’hydrogel sur le comportement cellulaire5. Des cellules U87 ont également été formées dans d’autres hydrogels à base de PEG ou d’acide hyaluronique pour élargir la population de cellules souches cancéreuses6 ou pour explorer les mécanismes de résistance à la chimiothérapiemédiés par la matrice 7,8,9. Les sphéroïdes de glioblastome ont également été encapsulés dans des hydrogels de gélatine pour étudier l’interaction entre la microglie et les cellules cancéreuses et son effet sur l’invasion cellulaire10. Dans l’ensemble, ces études ont démontré l’utilité des modèles in vitro à base d’hydrogel pour comprendre la pathologie du glioblastome et concevoir des traitements.
De plus, il existe différentes méthodes de fabrication de sphéroïdes tumoraux et d’encapsulation d’hydrogel11. Par exemple, les cellules dispersées pourraient être ensemencées dans des hydrogels et autorisées à former des sphéroïdes au fil du temps 5,12. Un inconvénient d’une telle méthode est la polydispersité des sphéroïdes formés, ce qui pourrait conduire à des réponses cellulaires différentielles. Pour produire des sphéroïdes uniformes, les cellules pourraient être encapsulées dans des microgels et cultivées pendant de longues périodes jusqu’à ce qu’elles envahissent et remodèlent le gel13, ou les cellules pourraient être déposées dans des gels matriciels avec des « trous » sphériques et autorisées à s’agréger14. L’inconvénient de ces méthodes est leur relative complexité, la nécessité d’un générateur de gouttelettes ou d’autres moyens pour former des microgels ou des « trous » dans le gel, et le temps nécessaire aux sphéroïdes pour croître et mûrir. Alternativement, les sphéroïdes pourraient être préformés dans des micropuits 9,15,16 ou dans des plaques suspendues 17,18, puis encapsulés dans un hydrogel, similaire à la technique décrite ici. Ces méthodes sont plus simples et peuvent être effectuées à un débit plus élevé. Il est intéressant de noter qu’il a été démontré que la méthode de formation des sphéroïdes peut affecter les comportements des cellules sphéroïdes, tels que l’expression des gènes, la prolifération cellulaire ou la réponse aux médicaments19,20.
Ici, nous nous concentrons sur le glioblastome car il s’agit d’une tumeur solide dont l’environnement natif est la matrice cérébrale molle et nanoporeuse21, qui peut être imitée par un hydrogel mou et nanoporeux. Le glioblastome est également le cancer du cerveau le plus mortel pour lequel il n’existe aucun remède22. Cependant, le protocole décrit ici peut être utilisé pour l’encapsulation de sphéroïdes représentant toute tumeur solide. Nous avons choisi d’utiliser des hydrogels PEG qui sont formés par une réaction d’addition de type Michael23. Le PEG est un hydrogel synthétique, non dégradable et biocompatible qui est inerte et sert d’échafaudage et de support cellulaire physique, mais ne supporte pas la fixation des cellules23. L’adhérence cellulaire peut être ajoutée séparément par attache de protéines entières ou de ligands adhésifs24, et la dégradabilité peut être ajoutée par des modifications chimiques de la chaîne polymère PEG ou des réticulants hydrolytiques ou enzymatiquement dégradables25,26. Cela permet d’ajuster les propriétés biochimiques indépendamment des propriétés mécaniques ou physiques de l’hydrogel, ce qui pourrait être avantageux pour étudier les interactions cellule-matrice. La chimie de gélification de type Michael est sélective et se produit dans des conditions physiologiques ; par conséquent, il permet l’encapsulation des sphéroïdes en mélangeant simplement les sphéroïdes avec la solution de précurseur de l’hydrogel.
Dans l’ensemble, la méthodologie présentée ici présente plusieurs caractéristiques notables. Tout d’abord, la fabrication de sphéroïdes tumoraux dans un assemblage multipuits est efficace, rapide et le coût des matériaux nécessaires est faible. Deuxièmement, les sphéroïdes sont produits en grandes quantités dans une variété de tailles avec une faible polydispersité. Enfin, seuls les matériaux disponibles dans le commerce sont nécessaires. L’utilité de la méthodologie est illustrée par l’exploration de l’effet des propriétés du substrat sur la viabilité, la circularité et la souche cellulaire des cellules sphéroïdes.
Protocole
1. Préparation des solutions
- Préparation d’une solution de précurseur de polydiméthylsiloxane (PDMS)
- Préparez la solution de précurseur PDMS négatif (également utilisée pour la solution de précurseur de colle). Ramassez l’élastomère dans un bateau de pesée à l’aide d’une spatule et pesez-le. Ajouter l’agent de durcissement à la base en élastomère dans un rapport de 1:10. Mélangez doucement et soigneusement le PDMS et le produit de durcissement à l’aide de la spatule dans le bateau de pesée en plastique.
REMARQUE : Cette solution précurseur PDMS est versée dans la plaque pyramidale carrée à micropuits à 6 puits pour former le moule négatif. C’est la même solution que celle utilisée pour la solution de précurseur de colle. - Préparez la solution de précurseur PDMS positif. Placez la base en élastomère dans le bateau de pesée à l’aide d’une spatule et pesez-la. Ajouter l’agent de durcissement à la base en élastomère dans un rapport de 1:9. Mélangez doucement et soigneusement le PDMS et le produit de durcissement à l’aide de la spatule dans le bateau de pesée en plastique.
REMARQUE : Cette solution précurseur PDMS est ensuite versée sur le moule négatif pour former le moule positif.
- Préparez la solution de précurseur PDMS négatif (également utilisée pour la solution de précurseur de colle). Ramassez l’élastomère dans un bateau de pesée à l’aide d’une spatule et pesez-le. Ajouter l’agent de durcissement à la base en élastomère dans un rapport de 1:10. Mélangez doucement et soigneusement le PDMS et le produit de durcissement à l’aide de la spatule dans le bateau de pesée en plastique.
- Préparation d’un tampon de triéthanolamine (TEA) 0,3 M de pH 8
- Pipeter 1 mL de TEA et 9 mL de 1x solution saline tamponnée au phosphate (PBS) dans un cône de 50 mL à l’aide d’un aide-pipette pour créer une solution de TEA de 0,75 M. Titrer la solution à un pH de 8 en utilisant 1 N HCl ou 1 N NaOH. Ensuite, ajoutez suffisamment de PBS pour obtenir un volume final de 25 mL afin d’obtenir une concentration finale de TEA de 0,3 M avec un pH de 8.
ATTENTION : Stockez les solutions de HCl et de NaOH dans une armoire inflammable à température ambiante (RT). Portez un équipement de protection individuelle lors de la manipulation.
- Pipeter 1 mL de TEA et 9 mL de 1x solution saline tamponnée au phosphate (PBS) dans un cône de 50 mL à l’aide d’un aide-pipette pour créer une solution de TEA de 0,75 M. Titrer la solution à un pH de 8 en utilisant 1 N HCl ou 1 N NaOH. Ensuite, ajoutez suffisamment de PBS pour obtenir un volume final de 25 mL afin d’obtenir une concentration finale de TEA de 0,3 M avec un pH de 8.
- Préparation de supports complets
- Pour préparer le milieu complet, ajouter 10 % (p/v) ou 56 mL de sérum fœtal bovin et 1 % (p/v) ou 5,6 mL de pénicilline et de streptomycine à 500 mL de milieu RPMI.
- Placez la solution à 37 °C pendant 10 à 20 minutes ou jusqu’à ce que la solution soit tiède avant utilisation.
- Conservez la solution à 0-4 °C jusqu’à 6 mois.
- Préparation de solutions mères de polyéthylène glycol (PEG) à 20 % (p/v)
REMARQUE : Le calcul est basé sur des solutions de 100 μL qui peuvent être augmentées ou réduites selon les besoins.- Pour préparer une solution mère de 100 μL d’acrylate de PEG-Acrylate à 4 bras à 20 % p/v (PEG-Ac à 4 bras), peser 20 mg de poudre de PEG-Ac à 4 bras dans un tube de microfuge. Ajouter 70 μL de tampon TEA 0,3 M, puis agiter la solution pendant environ 30 s ou jusqu’à dissolution complète. Tenir compte du changement de volume dû à la dissolution de la poudre en ajoutant suffisamment de tampon TEA (~27 μL) pour atteindre un volume de solution final de 100 μL.
- Pour préparer une solution mère de 100 μL de PEG-diSH à 20 % p/v, peser 20 mg de poudre de PEG-diSH dans un tube de microfuge. Ajouter 70 μL de tampon TEA, puis agiter la solution pendant environ 30 secondes ou jusqu’à dissolution complète. Tenir compte du changement de volume dû à la dissolution de la poudre en ajoutant suffisamment de tampon TEA (~27 μL) pour atteindre un volume de solution final de 100 μL.
REMARQUE : La poudre de PEG est très hygroscopique et doit être stockée dans un récipient desséché à -20 °C. A la sortie du congélateur, laissez décongeler la poudre de PEG pendant 10 min avant d’ouvrir le flacon pour peser la poudre. Purgez la bouteille avec un gaz inerte tel que l’azote ou l’argon pour déplacer l’air humide avant de la remettre au congélateur. La solution mère de PEG-Ac à 4 bras peut être conservée à 4 °C jusqu’à 2 semaines avant utilisation. La solution mère de PEG-diSH doit être préparée immédiatement avant utilisation et ne peut pas être stockée car les groupes thiols réagissent les uns avec les autres pour former des liaisons disulfure.
- Préparation d’une solution matricielle de membrane basale à 2 % v/v
- Pour préparer une solution de travail à 2 % v/v de la matrice de la membrane basale, ajouter 20 μL de la matrice de la membrane basale (sans LDV) à 9,98 mL de milieu complet et bien mélanger en pipetant de haut en bas ~10 fois. Préparez la solution à 4 °C (sur de la glace), puis réchauffez-la à 37 °C (dans un four ou un incubateur) et utilisez-la immédiatement.
REMARQUE : La matrice de la membrane basale commencera à former un gel à >10 °C, alors assurez-vous de mélanger la solution de matrice de la membrane basale avec un milieu complet à 2-6 °C. La composition complète du support est décrite à l’étape 1.3.
- Pour préparer une solution de travail à 2 % v/v de la matrice de la membrane basale, ajouter 20 μL de la matrice de la membrane basale (sans LDV) à 9,98 mL de milieu complet et bien mélanger en pipetant de haut en bas ~10 fois. Préparez la solution à 4 °C (sur de la glace), puis réchauffez-la à 37 °C (dans un four ou un incubateur) et utilisez-la immédiatement.
- Préparation de la solution fixatrice cellulaire
- Pour préparer 1 mL de solution fixatrice cellulaire contenant 4 % p/v de paraformaldéhyde et 0,1 % v/v de surfactant non ionique, mélanger d’abord 891 μL de 1x PBS et 108 μL de paraformaldéhyde (concentration de 37 % p/v), puis ajouter 1 μL de surfactant non ionique (concentration de 100 %). Bien mélanger la solution.
REMARQUE : La solution de fixation doit être renouvelée chaque fois que la fixation est effectuée.
ATTENTION : Le paraformaldéhyde est inflammable et peut former des concentrations de poussières combustibles dans l’air. Il provoque une irritation de la peau et de graves lésions oculaires. Évitez d’inspirer car cela peut provoquer une irritation respiratoire. Manipuler le paraformaldéhyde dans une hotte chimique et porter un équipement de protection individuelle. Lavez-vous soigneusement les mains après manipulation. Le tensioactif non ionique provoque une irritation de la peau et de graves lésions oculaires. Portez des gants de protection et des lunettes de protection ou une protection faciale lors de la manipulation. Pour éviter tout rejet dans l’environnement, ouvrez la bouteille dans une hotte chimique. Lavez-vous soigneusement les mains après manipulation.
- Pour préparer 1 mL de solution fixatrice cellulaire contenant 4 % p/v de paraformaldéhyde et 0,1 % v/v de surfactant non ionique, mélanger d’abord 891 μL de 1x PBS et 108 μL de paraformaldéhyde (concentration de 37 % p/v), puis ajouter 1 μL de surfactant non ionique (concentration de 100 %). Bien mélanger la solution.
- Préparation des solutions de coloration
- Pour préparer 3 mM d’iodure de 3,3'-dihexyloxacarbocyanine (DiOC), mélanger 2,65 mg de DiOC dans 1 mL de DMSO.
- Pour préparer 1,5 mM de solution d’iodure de propidium (IP), mélanger 1 mg d’IP dans 1 mL d’eau désionisée.
- Préparation de la solution de clarification des sphéroïdes
- Préparez des solutions d’élimination de 20 %, 40 % et 80 % v/v de formamide dans 1x PBS pour l’élimination des sphéroïdes.
- Pour obtenir 10 mL de formamide à 20 % v/v, mélanger 8 mL de 1x PBS suivi de 2 mL de formamide. Pour obtenir 10 mL de formamide à 40 % v/v, mélanger 6 mL de 1x PBS suivi de 4 mL de formamide. Pour obtenir 10 mL de formamide à 80 % v/v, mélanger 2 mL de 1x PBS suivi de 8 mL de formamide.
- Après avoir combiné le formamide et 1x PBS, mélanger la solution en tourbillonnant pendant environ 30 s.
- Préparez des solutions d’élimination de 20 %, 40 % et 80 % v/v de formamide dans 1x PBS pour l’élimination des sphéroïdes.
2. Fabrication de micropuits pyramidaux carrés
- Fabriquez un moule PDMS négatif de micropuits pyramidaux carrés comme illustré à la figure 1.
- Préparez 2 g (~1 ml) de solution de précurseur négatif de PDMS et versez-la dans un puits d’un moule maître pyramidal carré à 6 puits. Notez que 1 mL recouvre complètement un puits de la plaque. Après avoir recouvert le moule maître de PDMS, dégazer la solution précurseur PDMS pendant 30 min en plaçant la plaque pyramidale carrée à 6 puits dans un dessiccateur sous vide. Ensuite, durcissez le PDMS en plaçant la plaque dans un four à 60 °C pendant 24 h.
REMARQUE : Assurez-vous que le couvercle de la plaque est retiré pour le dégazage et remis en place pour le durcissement. Dégazer la solution dans un dessiccateur sous vide ou par purge avec un gaz inerte tel que l’azote ou l’argon. Si la solution de précurseur de moisissure négative présente encore des bulles après 30 minutes, indiquant un dégazage inadéquat, placez-la dans un dessiccateur sous vide pendant 30 minutes supplémentaires. Utilisez un ou plusieurs puits de plaque simultanément pour préparer un ou plusieurs moules négatifs PDMS. Des micropuits pyramidaux carrés de différentes tailles peuvent être utilisés, tels que des longueurs de côté de 400 et 800 μm, comme le montre le tableau 1. La même quantité de PDMS est utilisée quelles que soient les tailles pyramidales carrées. - Une fois que le PDMS durcit encore chaud, retirez soigneusement le moule négatif du moule principal à l’aide d’une spatule et coupez le moule négatif en une dalle de 35 mm de diamètre à l’aide d’un poinçon de biopsie. Placer dans une boîte de Pétri et couvrir avec le couvercle et laisser durcir RT pendant 24 heures supplémentaires.
REMARQUE : Pour enlever les moules négatifs, utilisez une spatule pour passer entre la plaque de puits et le moule PDMS et tirez doucement le moule négatif du moule maître. Le moule est découpé en plaques de 35 mm pour s’adapter à une boîte de Pétri de 35 mm. Les moules peuvent être fabriqués dans d’autres tailles pour s’adapter à des plaques de différents diamètres. Les dalles de moule négatif de 35 mm peuvent être stockées, protégées de la poussière à RT et réutilisées pendant 6 mois.
- Préparez 2 g (~1 ml) de solution de précurseur négatif de PDMS et versez-la dans un puits d’un moule maître pyramidal carré à 6 puits. Notez que 1 mL recouvre complètement un puits de la plaque. Après avoir recouvert le moule maître de PDMS, dégazer la solution précurseur PDMS pendant 30 min en plaçant la plaque pyramidale carrée à 6 puits dans un dessiccateur sous vide. Ensuite, durcissez le PDMS en plaçant la plaque dans un four à 60 °C pendant 24 h.
- Préparez un moule PDMS positif de micropuits pyramidaux carrés.
- Placez les dalles de 35 mm du moule PDMS négatif dans une boîte de Pétri de 35 mm avec les micropuits texturés vers le haut.
- Préparez 2,5 g (~1,2 ml) de solution de précurseur PDMS positif comme ci-dessus et versez-la sur le moule négatif dans la boîte de Pétri de 35 mm pour recouvrir complètement le moule négatif. Dégazez ensuite la solution de précurseur pendant 30 min comme ci-dessus et placez-la dans un four à 60 °C pendant 3-4 h.
REMARQUE : Parce que le PDMS est visqueux, une bulle peut se former à partir de l’air emprisonné sous le moule négatif. Si une bulle se forme sous le moule négatif, poussez doucement le moule vers le bas à l’aide d’une spatule pour libérer la bulle. S’il reste des bulles d’air, continuez à dégazer pendant 30 minutes, ou prenez une spatule et remuez doucement la solution de moisissure positive jusqu’à ce que les bulles éclatent. - Une fois que le moule PDMS positif durcit, retirez les moules de la boîte de Pétri de 35 mm et décollez immédiatement le moule positif du moule négatif.
REMARQUE : Le timing est important pour réussir le décollement du moule positif. Le retrait est mieux fait en coupant légèrement dans le moule positif à l’aide d’un rasoir pour exposer l’interface entre le moule positif et négatif et en décollant les moules les uns des autres. Décollez ensuite les bords du moule circulaire. Décollez délicatement le moule négatif du moule positif.
- Collez les moules au fond des puits d’une plaque de 48 puits.
REMARQUE : Ici, une plaque de 48 puits est utilisée, mais d’autres plaques peuvent être utilisées tant que les dalles du moule sont coupées dans les bons diamètres (par exemple, 6 mm de diamètre pour une plaque de 96 puits).- Coupez les moules positifs en plaques à l’aide d’un poinçon à biopsie de 10 mm.
REMARQUE : Environ 4 moules (chacun de 10 mm de diamètre) peuvent être découpés dans un moule positif de 35 mm de diamètre. - Pour coller les moules au fond d’une plaque de 48 puits, préparer la solution de précurseur de colle PDMS (~0,5 mL ou 1 g) comme décrit précédemment27. À l’aide d’une pince à épiler, trempez doucement le côté plat (et non le côté avec le motif des micropuits) du moule positif de 10 mm dans la solution de précurseur PDMS. Placez délicatement un moule par puits d’une plaque de 48 puits et appuyez doucement sur chaque moule au fond du puits à l’aide de la pince à épiler. Placez la plaque assemblée dans un four à 60 °C pendant 4 à 24 h pour permettre à la colle PDMS de durcir.
REMARQUE : Si la solution de précurseur de colle PDMS pénètre sur les micropuits de moisissure positifs, elle peut être essuyée à l’aide de papier de soie souple et l’étape peut être répétée. Lors du collage, assurez-vous que la colle ne recouvre pas les micropuits. - Stériliser les moules en ajoutant 300 μL d’éthanol à 70 % dans chaque puits de la plaque de 48 puits à l’aide d’une pipette de 1000 μL. Aspirer l’éthanol à 70 % et placer la plaque de 48 puits découverte dans une hotte de culture tissulaire sous UV (302 nm) pendant 2 h.
REMARQUE : Les moules peuvent être utilisés pendant 6 mois et restérilisés au besoin.
- Coupez les moules positifs en plaques à l’aide d’un poinçon à biopsie de 10 mm.
3. Formation, récolte et encapsulation de sphéroïdes tumoraux multicellulaires dans des hydrogels
REMARQUE : Le protocole décrit dans cette section concerne la lignée cellulaire de glioblastome humain U87 (voir Figure 1 et Figure 2), mais un protocole similaire pourrait être utilisé avec d’autres types de cellules cancéreuses.
- Formation de sphéroïdes tumoraux multicellulaires
- Lavez d’abord les moules à micropuits avec une solution de rinçage anti-adhérence en ajoutant 300 μL de solution dans chaque puits à l’aide d’une pipette de 1000 μL. Ensuite, centrifuger à 1620 x g pendant 3 min et aspirer la solution à l’aide d’une pompe à vide et d’une pipette Pasteur.
REMARQUE : Effectuez cette étape immédiatement avant l’ensemencement des cellules. - Exposer les cellules à ~80 μL de trypsine/EDTA à 0,25 % par cm2 de la surface du ballon de culture pendant 5 min à 37 °C. Par exemple, 1 mL de trypsine/EDTA convient pour une fiole de culture cellulaire T-25. Neutralisez la trypsine en ajoutant le même volume de milieu de culture cellulaire complet. Par exemple, ajouter 1 mL de milieu complet dans la fiole de culture cellulaire T-25 contenant de la trypsine. Prélevez les cellules dans le flacon de culture tissulaire.
- Transférer 10 μL de suspension cellulaire dans chaque orifice d’un hémocytomètre pour le comptage cellulaire. Utilisez un microscope inversé pour compter le nombre total de cellules et faites la moyenne de ce nombre de cellules à partir d’au moins 8 quadrants, en veillant à ce que le nombre de cellules dans chaque quadrant de l’hémocytomètre soit de 20 à 50 pour de bons résultats de numération cellulaire. Multipliez le nombre calculé par 104 pour déterminer la concentration cellulaire finale.
- Remettre en suspension les cellules prélevées dans le milieu de culture cellulaire complet de l’IMRP complété par 10 % de sérum fœtal de bovin et 1 % de pénicilline/streptomycine à la concentration cellulaire finale souhaitée, en fonction de la taille souhaitée du sphéroïde, comme indiqué dans le tableau 1.
REMARQUE : Les micropuits de 800 μm produiront ~75 sphéroïdes dans un puits d’une plaque de 48 puits, et les micropuits de 400 μm produiront ~300 sphéroïdes dans un puits d’une plaque de 48 puits. - Placer 500 μL de suspension cellulaire à la concentration désirée dans des micropuits et centrifuger la plaque à 1620 x g pendant 3 min. Placer la plaque dans un incubateur humidifié à 37 °C et 5 % de CO2 pendant 24 h pour permettre la formation des sphéroïdes.
REMARQUE : Si les sphéroïdes ne se forment pas, 2 % v/v de la matrice de la membrane basale combinée à un milieu complet peuvent être utilisés pour remettre les cellules en suspension (plus de détails à l’étape 1.5).
- Lavez d’abord les moules à micropuits avec une solution de rinçage anti-adhérence en ajoutant 300 μL de solution dans chaque puits à l’aide d’une pipette de 1000 μL. Ensuite, centrifuger à 1620 x g pendant 3 min et aspirer la solution à l’aide d’une pompe à vide et d’une pipette Pasteur.
- Récolte des sphéroïdes
- À l’aide d’une pipette de 1000 μL, pipeter fermement 500 μL de milieu complet dans le puits. À l’aide de 500 μL de milieu provenant du puits, rincer les quatre quadrants du puits (en particulier les quadrants supérieur, inférieur, gauche et droit) en pipetant de haut en bas sur les quadrants trois à quatre fois pour déloger les sphéroïdes. Aspirer délicatement le milieu contenant les sphéroïdes (~1000 μL au total) dans un tube de microcentrifugation à l’aide d’une pipette de 1000 μL et laisser les sphéroïdes se déposer au fond.
- Retirer le surnageant et remettre les sphéroïdes en suspension à la concentration finale désirée. Par exemple, pour obtenir ~8 sphéroïdes dans un gel de 20 μL après encapsulation, remettre les sphéroïdes en suspension dans 100 μL de milieu, ce qui donne une concentration de sphéroïdes de ~75 sphéroïdes/100 μL dans la suspension sphéroïde.
- Encapsulation de sphéroïdes dans des hydrogels, comme le montre la figure 2.
- Pour créer 100 μL d’une solution de précurseur d’hydrogel PEG à 10 % p/v, combiner 50 μL de suspension sphéroïde, suivie de 30 μL de PEG-Ac à 4 bras à 20 % p/v et enfin de 20 μL de PEG-diSH à 20 % p/v dans un tube de microcentrifugation. Cela donnera un rapport molaire stochiométrique des groupes acrylate (Ac) et thiol (SH) assurant une réticulation optimale. Mélanger la solution de précurseur du gel en pipetant de haut en bas ~10 fois.
REMARQUE : La composition, le volume et la concertation des polymères de l’hydrogel peuvent être modifiés selon les besoins. Les hydrogels qui en résultent se dégradent lentement et ne collent pas de cellules. Pour fabriquer l’adhésif cellulaire hydrogel, un ligand adhésif tel que RGDS peut être ajouté. Pour rendre l’hydrogel dégradable enzymatiquement, un réticulant peptidique dégradable enzymatiquement contenant des résidus de cystéine aux deux extrémités pourrait être ajouté. Lors du transfert de sphéroïdes, pipeter doucement la solution deux fois pour déloger les sphéroïdes et les mettre en suspension pour assurer une distribution uniforme des sphéroïdes. - Pipeter 20 μL de la solution de précurseur de gel entre deux lames de verre revêtues de parafilm séparées par des entretoises en silicium de 1 mm, et placer les lames avec la solution de précurseur de gel dans un incubateur à 37 °C à 5 % de CO2 pendant 15 min pour permettre la gélification.
REMARQUE : Assurez-vous que les deux lames de verre sont recouvertes de parafilm pour créer une surface hydrophobe permettant un pelage facile lors de la gélification. Au lieu de parafilm, une solution de revêtement hydrophobe peut être utilisée. Un volume de 20 μL de solution de précurseur d’hydrogel donnera une plaque d’hydrogel de ~6 mm de diamètre et 1 mm de hauteur avant le gonflement. N’importe quel type et épaisseur d’espaceur peut être utilisé, mais il est recommandé de maintenir l’épaisseur du gel à 1 mm ou moins (des hydrogels plus épais pourraient limiter la diffusion de l’oxygène et le transport des nutriments vers les cellules) mais plus grande que le diamètre du sphéroïde (afin que les sphéroïdes soient complètement encapsulés dans le gel). N’importe quel volume de solution de précurseur d’hydrogel peut être utilisé. Les gels de 20-30 μL conviennent à une plaque de 24 puits. - Une fois la gélification de l’hydrogel terminée, séparez les deux lames de verre et décollez délicatement les gels de la plaque de verre à l’aide d’une spatule. Placez les gels dans une plaque de 24 puits, un par puits, en veillant à ce que la surface contenant les sphéroïdes soit tournée vers le haut.
REMARQUE : Les sphéroïdes tomberont au fond du gel pendant la gélification, donc les retourner pour la culture garantira que les sphéroïdes sont près de la surface de l’hydrogel pour un meilleur accès aux nutriments et à l’oxygène. La gélification peut être surveillée en observant toute solution de précurseur d’hydrogel restant dans le tube de microcentrifugation et non utilisée pour créer des dalles en inversant le tube et en notant le moment où le gel cesse de couler. - Ajouter un milieu complet (~500 μL) dans chaque puits et s’assurer que l’hydrogel est complètement immergé. Placer la plaque multipuits dans un incubateur humidifié à 37 °C et 5 % de CO2 et cultiver les cellules avec des changements de milieu tous les 2-3 jours.
REMARQUE : Les hydrogels peuvent être cultivés jusqu’à 4 semaines ou jusqu’à ce qu’ils se dégradent, en changeant de milieu tous les deux jours.
- Pour créer 100 μL d’une solution de précurseur d’hydrogel PEG à 10 % p/v, combiner 50 μL de suspension sphéroïde, suivie de 30 μL de PEG-Ac à 4 bras à 20 % p/v et enfin de 20 μL de PEG-diSH à 20 % p/v dans un tube de microcentrifugation. Cela donnera un rapport molaire stochiométrique des groupes acrylate (Ac) et thiol (SH) assurant une réticulation optimale. Mélanger la solution de précurseur du gel en pipetant de haut en bas ~10 fois.
4. Coloration fluorescente
- Viabilité cellulaire
- Utilisez le colorant 3,3'-dihexyloxacarbocyanine iodure (DiOC), qui colore les mitochondries et le réticulum endoplasmique de toutes les cellules, pour déterminer la viabilité cellulaire. Utiliser du DiOC (3 mM) à une concentration de 0,02 μg/mL. Plus précisément, à l’aide d’une pipette de 20 μL, ajouter 2 μL de DiOC par 1000 μL de milieu dans le flacon de culture des cellules dissociées (au moins 24 h avant le processus de formation des sphéroïdes de la section 3). Attendez 24 h pour que le DiOC colore les cellules.
- Utilisez la coloration nucléaire et chromosomique, l’iodure de propidium, PI (1,50 mM), qui ne pénètre que dans les cellules mortes. Pour colorer les cellules, aspirez d’abord tous les milieux et rincez le gel à l’aide d’une pipette de 1000 μL pour ajouter 500 μL de 1x PBS afin que le gel soit complètement immergé.
- Aspirer le PBS et ajouter 500 μL de milieu frais, suivi de 30 μL de solution PI dans chaque puits (c.-à-d. 6 μL pour 100 μL de milieu). Couvrir la plaque de puits de papier d’aluminium pour la protéger de la lumière. Placer la plaque de puits dans un incubateur à 37 °C et 5 % de CO2 et laisser 30 min à l’IP pour colorer les cellules mortes.
- Retirez le papier d’aluminium et aspirez le média des puits. Utilisez une pipette de 1000 μL pour ajouter 500 μL de 1x PBS pour immerger l’hydrogel. Aspirez le 1x PBS et répétez le rinçage deux fois de plus. Ajouter 500 μL de milieu dans chaque puits et imager sous un microscope fluorescent inversé ou confocal.
- Calculer la viabilité cellulaire en comparant la surface de DiOC (toutes les cellules) à PI (cellules mortes), comme représenté dans l’équation 1, à l’aide d’images de la pile z d’un microscope confocal ou d’un microscope à fluorescence inversée.
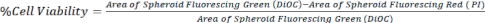 Équation 1.
Équation 1.
5. Fixation, coloration, clarification et imagerie par immunofluorescence de sphéroïdes encapsulés
- Fixation et coloration
- Aspirer le milieu des puits où les hydrogels sont cultivés et rincer les hydrogels en pipetant 500 μL de 1x PBS directement sur les hydrogels. Aspirez doucement le 1x PBS.
- Fixez les sphéroïdes dans la plaque de 24 puits en utilisant une pipette de 1000 μL pour ajouter 500 μL de volume de solution fixatrice par puits. Laisser tremper les gels pendant 30 minutes à RT. Retirer la solution de fixation à l’aide d’une pipette de 1000 μL et la jeter dans un conteneur à déchets désigné.
- Rincez les hydrogels en ajoutant 500 μL de 1x PBS dans chaque puits. Aspirez le 1x PBS à l’aide d’une pipette de 1000 μL et répétez le rinçage PBS deux fois de plus. Conservez la plaque de puits dans 500 μL de 1x PBS par puits à 4 °C jusqu’à 1 semaine ou utilisez-la immédiatement.
REMARQUE : Veillez à ne pas tirer les hydrogels dans la pipette lors de l’aspiration du PBS et de la solution fixatrice. Pour ce faire, inclinez la plaque à un angle de ~45 degrés, ce qui aidera à voir les hydrogels et à prévenir l’aspiration accidentelle.
ATTENTION : Le formaldéhyde est toxique à l’inhalation et au contact. Manipuler avec des gants dans une hotte chimique. - Pour colorer les cellules, incuber les sphéroïdes encapsulés dans de l’hydrogel avec des anticorps primaires pour Nestin (200 μg/mL) et SOX2 (200 μg/mL) à une dilution de 1:200 d’anticorps : PBS. Utilisez une pipette de 1000 μL pour aspirer le 1x PBS des puits. Ajouter 50 μL d’anticorps dilué dans chaque puits. Attendez 24 h pour que la coloration soit terminée. Ensuite, retirez la solution colorante à l’aide d’une pipette de 1000 μL et jetez les déchets de manière appropriée.
- Utilisez une pipette de 1000 μL pour ajouter 500 μL de 1xPBS, ce qui est suffisant pour immerger l’hydrogel. Aspirez le PBS et répétez-le deux fois de plus. Conservez l’hydrogel coloré et immergé dans 1x PBS à 4 °C jusqu’à 2 semaines avant l’imagerie ou l’image immédiatement.
REMARQUE : Des optimisations mineures peuvent être nécessaires en fonction de l’anticorps pour assurer une coloration correcte. La concentration (1:200) et le temps (24 h) sont nettement plus élevés que dans la culture cellulaire monocouche 2D typique car la coloration 3D nécessite une diffusion à travers l’hydrogel et les sphéroïdes.
- Après avoir coloré les sphéroïdes, éliminez le sphéroïde pour améliorer la transparence de l’imagerie en remplaçant le PBS par une augmentation séquentielle de la concentration de formamide (facultatif).
- Aspirer le 1x PBS de chaque puits. Ajouter 500 μL de formamide à 20 % (v/v) dans chaque puits et laisser l’hydrogel incuber pendant 90 min. Aspirer le formamide à l’aide d’une pipette de 1000 μL et recueillir les déchets dans un conteneur à déchets.
- Ajouter 500 μL de formamide à 40 % (v/v) dans le puits. Laisser l’hydrogel incuber dans la solution pendant 90 min. Aspirer le formamide et collecter les déchets dans le conteneur à déchets.
- Ajouter 500 μL de formamide à 80 % v/v dans chaque puits et incuber pendant 90 min. Aspirez le formamide et jetez-le dans le conteneur à déchets. Ajouter 500 μL de 100 % (v/v) de formamide et laisser incuber 24 h avant l’imagerie. Une fois le déblaiement terminé, éliminez correctement les déchets de formamide par les services appropriés d’un système de gestion des déchets de laboratoire.
REMARQUE : Le dégagement permet une imagerie confocale dans le cœur du sphéroïde et est facultatif si seule la périphérie du sphéroïde est étudiée.
- Imagerie de sphéroïdes encapsulés dans de l’hydrogel à l’aide de la microscopie confocale.
REMARQUE : Tout microscope - inversé, fluorescent ou confocal - peut être utilisé pour l’imagerie cellulaire ; cependant, confocal permet d’isoler des plans uniques.- Placez les hydrogels dans des puits à chambre avec des fonds en verre et positionnez les sphéroïdes aussi près que possible de la lamelle.
REMARQUE : Des lamelles en verre ou des puits à chambre avec des fonds en verre peuvent être utilisés. Il est crucial de garder les hydrogels hydratés car les échantillons déshydratés entraîneront une mauvaise qualité d’imagerie. - Imagez les échantillons avec un objectif à longue distance de travail (10x-20x) pour permettre l’imagerie en profondeur dans le sphéroïde à l’aide d’empilements Z pour les reconstructions 3D.
REMARQUE : Les objectifs à grossissement plus élevé permettent une imagerie plus détaillée et une coupe optique, mais sacrifient la profondeur de l’image. - Quantifier la quantité de signal présente dans la section optique par rapport à la surface totale du sphéroïde pour le signal effacé et non effacé à l’aide de l’équation 2.
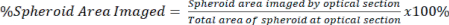 Équation 2
Équation 2
- Placez les hydrogels dans des puits à chambre avec des fonds en verre et positionnez les sphéroïdes aussi près que possible de la lamelle.
Résultats
Les plateformes de criblage de médicaments à base de sphéroïdes pour étudier les effets chimiothérapeutiques sont de plus en plus recherchées en raison de l’accent mis sur la modulation du microenvironnement tumoral lors de l’encapsulation des sphéroïdes dans des biomatériaux répliquant les tissus natifs. Ici, nous avons développé une méthode pour la préparation de sphéroïdes tumoraux multicellulaires et l’encapsulation et l’imagerie ultérieures dans un hydrogel 3D. Les sphéroïdes sont prépar...
Discussion
Des modèles de sphéroïdes tumoraux multicellulaires à base d’hydrogel sont de plus en plus développés pour faire progresser les découvertes thérapeutiques contre le cancer 11,13,29. Ils sont bénéfiques car ils émulent les paramètres clés du microenvironnement tumoral de manière contrôlée et, malgré leur complexité, sont plus simples et moins chers à utiliser que les modèles in vivo, et beaucoup sont compati...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par des fonds de démarrage fournis au Dr Silviya P Zustiak par l’Université de Saint Louis ainsi que par une subvention de démarrage du Henry and Amelia Nasrallah Center for Neuroscience de l’Université de Saint Louis accordée au Dr Silviya P Zustiak.
matériels
| Name | Company | Catalog Number | Comments |
| 70% Ethanol | Fisher Scientific | LC22210-4 | |
| 15 mL Conicals | FALCON | 352097 | |
| 24-Well Plate Ultra Low Attachment plates | Fisher Scientific | 07-200-602 | |
| 35 mm Petri Dish | Amazon | 706011 | |
| 4-arm poly(ethylene glycol)-acrylate (4-arm PEG-Ac; 10 kDa) | Laysan Bio | ACRL-PEG-ACRL-10K-5g | |
| 50 mL Conicals | Fisher Scinetific | 3181345107 | |
| 6-well AggreWell 400 | StemCell Technologies, Vancouver, Canada | 34421 | Square pyramidal microwells |
| anti-adherence rinsing solution | StemCell Technologies, Vancouver, Canada | Cat #: 07010 | |
| Aspartic Acid-Arginine-Cysteine-Glycine-Valine-Proline-Methionine-Serine-Methionine-Arginine-Glycine-Cysteine-Arginine- Aspartic Acid (DRCG-VPMSMR-GCRD) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Chemical Fume Hood | KEWAUNEE | 99151 | |
| Corning Matrigel Basement Membrane Matrix, LDEV Free | Corning | 356234 | Basement membrane matrix |
| Detergent - Triton-X | Sigma Aldrich | T8787 | Nonionic surfactant |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | BP231-100 | |
| Disposable Pipettes (1 mL, 2 mL, 5 mL, 10 mL, 25 mL, 50 mL) | Fisher Scinetific | 1 mL: 13-678-11B, 2mL: 05214038, 5mL(FALCON): 357529, 10mL: 13-678-11E, 25mL: 13-678-11, 50mL: 13-678-11F | |
| Fetal Bovine Serum | HyClone | SH30073-03 | |
| Formaldehyde 37% Solution | Sigma Aldrich | F1635 | |
| Glass Plates | Slumpys | GBS4100SFSL | |
| Glass Transfer Pipettes | Fisher Scinetific | 5 3/4": 1367820A, 9":136786B | |
| Glycine-Arginine-Cysteine-Aspartic Acid-Arginine-Glycine-Aspartic Acid-Serine (GRCD-RGDS) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Hemacytometer | Bright-Line | 383684 | |
| Hydrophobic solution - Repel Silane | GE Healthcare Bio-Sciences | 17-1332-01 | |
| Incubator | NUAIRE | NU-8500 | |
| Inverted Microscope (Axiovert 25) | Zeiss | 663526 | |
| Invitrogen DiOC16(3) (3,3'-Dihexadecyloxacarbocyanine Perchlorate) | Fisher Scientific | D1125 | |
| Leica Confocal SP8 | Leica Microsystems Inc. | ||
| Light and Flourescent Microscope (Axiovert 200M) | Zeiss | 3820005619 | |
| Micro centrifuge tubes | Fisher Scientific | 2 mL: 02681258 | |
| Microscope Software | Zeiss | AxioVision Rel. 4.8.2 | |
| Nestin Alexa Fluor 594 | Santa Cruz Biotechnology | sc-23927 | |
| Parafilm | PARAFILM | PM992 | |
| PBS (1x), pH 7.4 | HyClone | SH30256.01 | |
| Penicillin Streptomycin | MP Biomedicals | 1670046 | |
| Pipette Aid | Drummond Scientific Co. | P-76864 | |
| Pipette Tips (1–200 µL, 101–1000 µL) | Fisher Scinetific | 2707509 | |
| Plastic Standard Disposable Transfer Pipettes | Fisher Scientific | 13-711-9D | |
| Plastic Weigh Boats (100 mL) | Amazon | mdo-azoc-1030 | |
| poly(ethylene glycol)-dithiol (PEG-diSH; 3.4 kDa) | Laysan Bio | SH-PEG-SH-3400-5g | |
| Polydimehylsiloxane (PDMS) [Slygard 182 Elastomer Kit] | Elsworth Adhesives | 3097358-1004 | Polydimethylsiloxane |
| Powder Free Examination Gloves | Quest | 92897 | |
| Propidium iodide, 1 mg/mL aqueous soln. | Fisher Scientific | AAJ66584AB | |
| RPMI-1640 Medium (1x) | HyClone | SH30027-02 | |
| Silicone spacers - Silicone sheet, 0.5 mm thick/13 cm x 18 cm | Grace Bio-Labs | JTR-S-0.5 | |
| SOX2 Alexa Fluor 488 | Santa Cruz Biotechnology | sc-365823 | |
| Tissue Culture Hood | NUAIRE | NU-425-600 | |
| Triethanolamine, ≥99.0% (GC) | Sigma Aldrich | 90279 | |
| U-87 MG human glioblastoma cells | American Type Culture Collection | HTB-14 |
Références
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Costa, E. C., de Melo-Diogo, D., Moreira, A. F., Carvalho, M. P., Correia, I. J. Spheroids formation on non-adhesive surfaces by liquid overlay technique: Considerations and practical approaches. Biotechnology Journal. 13 (1), 1700417 (2018).
- Li, Y., Kumacheva, E. Hydrogel microenvironments for cancer spheroid growth and drug screening. Science Advances. 4 (4), eaas8998 (2018).
- Kamatar, A., Gunay, G., Acar, H. Natural and synthetic biomaterials for engineering multicellular tumor spheroids. Polymers. 12 (11), 2506 (2020).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular Pharmaceutics. 11 (7), 2115-2125 (2014).
- Nakod, P. S., Kim, Y., Rao, S. S. Three-dimensional biomimetic hyaluronic acid hydrogels to investigate glioblastoma stem cell behaviors. Biotechnology and Bioengineering. 117 (2), 511-522 (2020).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85, 128-146 (2020).
- Pedron, S., et al. Hyaluronic acid-functionalized gelatin hydrogels reveal extracellular matrix signals temper the efficacy of erlotinib against patient-derived glioblastoma specimens. Biomaterials. 219, 119371 (2019).
- Hill, L., Bruns, J., Zustiak, S. P. Hydrogel matrix presence and composition influence drug responses of encapsulated glioblastoma spheroids. Acta Biomaterialia. 132, 437-447 (2021).
- Chen, J. -. W. E., et al. Crosstalk between microglia and patient-derived glioblastoma cells inhibit invasion in a three-dimensional gelatin hydrogel model. Journal of Neuroinflammation. 17 (1), 346 (2020).
- Thakuri, P. S., Liu, C., Luker, G. D., Tavana, H. Biomaterials-based approaches to tumor spheroid and organoid modeling. Advanced Healthcare Materials. 7 (6), 1700980 (2018).
- Shin, S., et al. Alginate-marine collagen-agarose composite hydrogels as matrices for biomimetic 3D cell spheroid formation. RSC Advances. 6 (52), 46952-46965 (2016).
- Pradhan, S., Clary, J. M., Seliktar, D., Lipke, E. A. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 115, 141-154 (2017).
- Imaninezhad, M., Hill, L., Kolar, G., Vogt, K., Zustiak, S. P. Templated macroporous polyethylene glycol hydrogels for spheroid and aggregate cell culture. Bioconjugate Chemistry. 30 (1), 34-46 (2018).
- Mirab, F., Kang, Y. J., Majd, S. Preparation and characterization of size-controlled glioma spheroids using agarose hydrogel microwells. PLoS One. 14 (1), e0211078 (2019).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments: JoVE. 81, e50665 (2013).
- Timmins, N. E., Nielsen, L. K., Hauser, H., Fussenegger, M. . Generation of Multicellular Tumor Spheroids by the Hanging-Drop Method. 140, (2007).
- Zhao, L., et al. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Scientific Reports. 9 (1), 19717 (2019).
- Amaral, R. L., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Gencoglu, M. F., et al. Comparative study of multicellular tumor spheroid formation methods and implications for drug screening. ACS Biomaterials Science & Engineering. 4 (2), 410-420 (2018).
- Zhang, C., Liu, C., Zhao, H. Mechanical properties of brain tissue based on microstructure. Journal of the Mechanical Behavior of Biomedical Materials. 126, 104924 (2021).
- Alifieris, C., Trafalis, D. T. Glioblastoma multiforme: Pathogenesis and treatment. Pharmacology & Therapeutics. 152, 63-82 (2015).
- Zustiak, S. P., Leach, J. B. Hydrolytically degradable poly (ethylene glycol) hydrogel scaffolds with tunable degradation and mechanical properties. Biomacromolecules. 11 (5), 1348-1357 (2010).
- Zustiak, S. P., Wei, Y., Leach, J. B. Protein-hydrogel interactions in tissue engineering: Mechanisms and applications. Tissue Engineering Part B: Reviews. 19 (2), 160-171 (2013).
- Kroger, S. M., et al. Design of hydrolytically degradable polyethylene glycol crosslinkers for facile control of hydrogel degradation. Macromolecular Bioscience. 20 (10), 2000085 (2020).
- Raeber, G., Lutolf, M., Hubbell, J. Molecularly engineered PEG hydrogels: a novel model system for proteolytically mediated cell migration. Biophysical Journal. 89 (2), 1374-1388 (2005).
- Bruns, J., Egan, T., Mercier, P., Zustiak, S. P. Glioblastoma spheroid growth and chemotherapeutic responses in single and dual-stiffness hydrogels. Acta Biomaterialia. 163, 400-414 (2023).
- Kuwajima, T., et al. ClearT: a detergent-and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Holt, S. E., Ward, E. S., Ober, R. J., Alge, D. L. Shooting for the moon: using tissue-mimetic hydrogels to gain new insight on cancer biology and screen therapeutics. MRS Communications. 7 (3), 427-441 (2017).
- Jain, E., Scott, K. M., Zustiak, S. P., Sell, S. A. Fabrication of polyethylene glycol-based hydrogel microspheres through electrospraying. Macromolecular Materials and Engineering. 300 (8), 823-835 (2015).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948 (2016).
- Lee, K. -. H., Kim, T. -. H. Recent advances in multicellular tumor spheroid generation for drug screening. Biosensors. 11 (11), 445 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon