Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Fabricación y encapsulación de esferoides tumorales en hidrogeles de polietilenglicol para el estudio de las interacciones esferoide-matriz
En este artículo
Resumen
Aquí, presentamos un protocolo que permite la fabricación rápida, robusta y barata de esferoides tumorales seguida de encapsulación de hidrogel. Es ampliamente aplicable ya que no requiere equipo especializado. Sería particularmente útil para explorar las interacciones esferoides-matrices y construir modelos de fisiología tisular o patología in vitro .
Resumen
La encapsulación tridimensional (3D) de esferoides es crucial para replicar adecuadamente el microambiente tumoral para un crecimiento celular óptimo. Aquí, diseñamos un modelo de glioblastoma 3D in vitro para la encapsulación de esferoides para imitar el microambiente extracelular del tumor. Primero, formamos moldes de micropocillos piramidales cuadrados utilizando polidimetilsiloxano. Estos moldes de micropocillos se utilizaron para fabricar esferoides tumorales con tamaños estrictamente controlados de 50 a 500 μm. Una vez formados los esferoides, se cosecharon y encapsularon en hidrogeles a base de polietilenglicol (PEG). Los hidrogeles PEG son una plataforma versátil para la encapsulación de esferoides, ya que las propiedades del hidrogel, como la rigidez, la degradabilidad y la adhesividad celular, se pueden ajustar de forma independiente. En este caso, utilizamos un hidrogel blando representativo (~8 kPa) para encapsular los esferoides de glioblastoma. Por último, se desarrolló un método para teñir e obtener imágenes de esferoides para obtener imágenes de alta calidad mediante microscopía confocal. Debido al núcleo esferoide denso y a la periferia relativamente escasa, la obtención de imágenes puede ser difícil, pero el uso de una solución de limpieza y el corte óptico confocal ayuda a aliviar estas dificultades de obtención de imágenes. En resumen, mostramos un método para fabricar esferoides uniformes, encapsularlos en hidrogeles PEG y realizar microscopía confocal sobre los esferoides encapsulados para estudiar el crecimiento de esferoides y diversas interacciones célula-matriz.
Introducción
Los esferoides tumorales han surgido como herramientas útiles in vitro en el estudio de la etiología, la patología y la respuesta a los fármacosdel cáncer 1. Tradicionalmente, los esferoides se han cultivado en condiciones tales como placas de baja adherencia o biorreactores, donde la adhesión célula-célula se ve favorecida sobre la adhesión célula-superficie2. Sin embargo, ahora se reconoce que para recapitular el microambiente tumoral de manera más fiel, los modelos esferoides in vitro deben capturar tanto las interacciones célula-célula como las célula-matriz. Esto ha llevado a múltiples grupos a diseñar andamios, como los hidrogeles, donde los esferoides pueden ser encapsulados 3,4. Estos modelos esferoides basados en hidrogeles permiten la elucidación de las interacciones célula-célula y célula-matriz en diversos comportamientos celulares, como la viabilidad, la proliferación, la madre o la capacidad de respuesta a la terapia3.
En este trabajo se describe un protocolo para la encapsulación de esferoides de glioblastoma en hidrogeles de polietilenglicol (PEG). Existen múltiples informes bibliográficos sobre la encapsulación de esferoides de células de glioblastoma en hidrogeles. Por ejemplo, los esferoides se formaron encapsulando células U87 en hidrogeles PEG decorados con un ligando adhesivo RGDS y reticulados con un péptido enzimáticamente escindible para determinar el efecto de la rigidez del hidrogel en el comportamiento celular5. Las células U87 también se han formado en otros hidrogeles basados en PEG o en ácido hialurónico para ampliar la población de células madre cancerosas6 o para explorar los mecanismos de resistencia a la quimioterapia mediados por la matriz 7,8,9. Los esferoides de glioblastoma también se han encapsulado en hidrogeles de gelatina para estudiar la diafonía entre la microglía y las células cancerosas y su efecto sobre la invasión celular10. En general, estos estudios han demostrado la utilidad de los modelos in vitro basados en hidrogel para comprender la patología del glioblastoma y diseñar tratamientos.
Además, existen diferentes métodos para la fabricación de esferoides tumorales y la encapsulación de hidrogeles11. Por ejemplo, las células dispersas podrían sembrarse en hidrogeles y dejar que formen esferoides con el tiempo 5,12. Un inconveniente de este método es la polidispersidad de los esferoides formados, lo que podría dar lugar a respuestas celulares diferenciales. Para producir esferoides uniformes, las células podrían encapsularse en microgeles y cultivarse durante períodos prolongados hasta que invadan y remodelen el gel13, o las células podrían depositarse en geles moldeados con "agujeros" esféricos y permitir que se agreguen14. El inconveniente de estos métodos es su relativa complejidad, la necesidad de un generador de gotas u otros medios para formar microgeles o los "agujeros" en el gel, y el tiempo que tardan los esferoides en crecer y madurar. Alternativamente, los esferoides podrían preformarse en micropocillos 9,15,16 o en placas colgantes17,18 y luego encapsularse en un hidrogel, similar a la técnica descrita aquí. Estos métodos son más simples y se pueden realizar de una manera de mayor rendimiento. Curiosamente, se ha demostrado que el método de formación de esferoides puede afectar el comportamiento de las células esferoides, como la expresión génica, la proliferación celular o la respuesta a los fármacos19,20.
Aquí, nos centramos en el glioblastoma, ya que es un tumor sólido cuyo entorno nativo es la matriz cerebral blanda y nanoporosa21, que puede ser imitada por un hidrogel blando y nanoporoso. El glioblastoma es también el cáncer cerebral más mortal para el que no existe cura22. Sin embargo, el protocolo descrito aquí se puede utilizar para la encapsulación de esferoides que representen cualquier tumor sólido. Elegimos utilizar hidrogeles PEG que se forman a través de una reacción de adición de tipo Michael23. El PEG es un hidrogel sintético, no degradable y biocompatible que es inerte y sirve como andamiaje y soporte físico de las células, pero no soporta la unión celular23. La adhesividad celular se puede agregar por separado mediante el anclaje de proteínas enteras o ligandos adhesivos24, y la degradabilidad se puede agregar a través de modificaciones químicas de la cadena polimérica PEG o reticulantes degradables hidrolítica o enzimáticamente25,26. Esto permite ajustar las propiedades bioquímicas independientemente de las propiedades mecánicas o físicas del hidrogel, lo que podría ser ventajoso en el estudio de las interacciones célula-matriz. La química de gelificación tipo Michael es selectiva y ocurre en condiciones fisiológicas; Por lo tanto, permite la encapsulación de esferoides simplemente mezclando los esferoides con la solución precursora de hidrogel.
En general, la metodología que aquí se presenta tiene varias características notables. En primer lugar, la fabricación de esferoides tumorales en un conjunto de pocillos múltiples es eficiente, rápida y el costo de los materiales necesarios es bajo. En segundo lugar, los esferoides se producen en grandes lotes en una variedad de tamaños con baja polidispersidad. Por último, solo se requieren materiales disponibles en el mercado. La utilidad de la metodología se ilustra explorando el efecto de las propiedades del sustrato en la viabilidad de las células esferoides, la circularidad y la madre celular.
Protocolo
1. Preparación de soluciones
- Preparación de una solución precursora de polidimetilsiloxano (PDMS)
- Prepare la solución precursora negativa de PDMS (también utilizada para la solución precursora de pegamento). Coloque el elastómero en un bote de pesaje con una espátula y péselo. Agregue el agente de curado a la base de elastómero en una proporción de 1:10. Mezcle el PDMS y el agente de curado suave y minuciosamente con la espátula en el bote de pesaje de plástico.
NOTA: Esta solución precursora de PDMS se vierte en la placa piramidal cuadrada de micropocillos de 6 pocillos para formar el molde negativo. Esta es la misma solución que se utiliza para la solución precursora de pegamento. - Prepare la solución precursora positiva de PDMS. Coloque la base de elastómero en el bote de pesaje con una espátula y pésela. Agregue el agente de curado a la base de elastómero en una proporción de 1:9. Mezcle el PDMS y el agente de curado suave y minuciosamente con la espátula en el bote de pesaje de plástico.
NOTA: Esta solución precursora de PDMS se vierte posteriormente sobre el molde negativo para formar el molde positivo.
- Prepare la solución precursora negativa de PDMS (también utilizada para la solución precursora de pegamento). Coloque el elastómero en un bote de pesaje con una espátula y péselo. Agregue el agente de curado a la base de elastómero en una proporción de 1:10. Mezcle el PDMS y el agente de curado suave y minuciosamente con la espátula en el bote de pesaje de plástico.
- Preparación de tampón de trietanolamina (TEA) 0,3 M de pH 8
- Pipetear 1 mL de TEA y 9 mL de solución salina tamponada con fosfato (PBS) 1x en una cónica de 50 mL utilizando un coadyuvante de pipeta para crear una solución de TEA de 0,75 M. Valore la solución a un pH de 8 utilizando 1 N HCl o 1 N NaOH. Luego, agregue suficiente 1x PBS para lograr un volumen final de 25 ml para lograr una concentración final de TEA de 0,3 M con un pH de 8.
PRECAUCIÓN: Guarde las soluciones de HCl y NaOH en un gabinete inflamable a temperatura ambiente (RT). Use equipo de protección personal cuando manipule.
- Pipetear 1 mL de TEA y 9 mL de solución salina tamponada con fosfato (PBS) 1x en una cónica de 50 mL utilizando un coadyuvante de pipeta para crear una solución de TEA de 0,75 M. Valore la solución a un pH de 8 utilizando 1 N HCl o 1 N NaOH. Luego, agregue suficiente 1x PBS para lograr un volumen final de 25 ml para lograr una concentración final de TEA de 0,3 M con un pH de 8.
- Preparación de medios completos
- Para preparar el medio completo, agregue 10% (p/v) o 56 mL de suero fetal bovino y 1% (p/v) o 5.6 mL de penicilina y estreptomicina a 500 mL de medio RPMI.
- Coloque la solución a 37 °C durante 10-20 minutos o hasta que la solución esté tibia antes de usarla.
- Almacenar la solución a 0-4 °C durante un máximo de 6 meses.
- Preparación de soluciones madre de polietilenglicol (PEG) al 20% (p/v)
NOTA: El cálculo se basa en soluciones de 100 μL que pueden ampliarse o reducirse según sea necesario.- Para preparar una solución madre de 100 μL de acrilato PEG-Acrilato de 4 brazos al 20% p/v (PEG-Ac de 4 brazos), pesar 20 mg de polvo de PEG-Ac de 4 brazos en un tubo de microfuga. Añadir 70 μL de tampón TEA 0,3 M y, a continuación, agitar la solución durante unos 30 s o hasta que se disuelva por completo. Tenga en cuenta el cambio de volumen debido a la disolución del polvo agregando suficiente tampón TEA (~ 27 μL) para alcanzar un volumen de solución final de 100 μL.
- Para preparar una solución madre de 100 μL de 20% p/v de PEG-diSH, pesar 20 mg de polvo de PEG-diSH en un tubo de microfuga. Añadir 70 μL de tampón TEA, luego agitar la solución durante unos 30 s o hasta que se disuelva por completo. Tenga en cuenta el cambio de volumen debido a la disolución del polvo agregando suficiente tampón TEA (~ 27 μL) para alcanzar un volumen de solución final de 100 μL.
NOTA: El polvo de PEG es muy higroscópico y debe almacenarse en un recipiente desecado a -20 °C. Al sacarlo del congelador, deje que el polvo PEG se descongele durante 10 minutos antes de abrir la botella para pesar el polvo. Purgue la botella con un gas inerte como nitrógeno o argón para desplazar el aire húmedo antes de devolverla al congelador. La solución madre de PEG-AC de 4 brazos puede almacenarse a 4 °C durante un máximo de 2 semanas antes de su uso. La solución madre de PEG-diSH debe prepararse inmediatamente antes de su uso y no se puede almacenar porque los grupos tiol reaccionan entre sí para formar enlaces disulfuro.
- Preparación de una solución de matriz de membrana basal al 2% v/v
- Para preparar una solución de trabajo de matriz de membrana basal al 2% v/v, agregue 20 μL de la matriz de membrana basal (sin LDEV) a 9,98 ml de medio completo y mezcle bien pipeteando hacia arriba y hacia abajo ~ 10 veces. Preparar la solución a 4 °C (en hielo), calentarla a 37 °C (en horno o incubadora) y utilizarla inmediatamente.
NOTA: La matriz de la membrana basal comenzará a formar un gel a >10 °C, así que asegúrese de mezclar la solución de la matriz de la membrana basal con medios completos a 2-6 °C. La composición completa de los medios se describe en el paso 1.3.
- Para preparar una solución de trabajo de matriz de membrana basal al 2% v/v, agregue 20 μL de la matriz de membrana basal (sin LDEV) a 9,98 ml de medio completo y mezcle bien pipeteando hacia arriba y hacia abajo ~ 10 veces. Preparar la solución a 4 °C (en hielo), calentarla a 37 °C (en horno o incubadora) y utilizarla inmediatamente.
- Preparación de la solución fijadora celular
- Para preparar 1 ml de solución fijadora celular que contenga 4% p/v de paraformaldehído y 0,1% v/v de tensioactivo no iónico, primero mezcle 891 μL de 1x PBS y 108 μL de paraformaldehído (concentración del 37% p/v) y luego agregue 1 μL de tensioactivo no iónico (concentración del 100%). Mezcle bien la solución.
NOTA: La solución fijadora debe hacerse nueva cada vez que se realiza la fijación.
PRECAUCIÓN: El paraformaldehído es inflamable y puede formar concentraciones de polvo combustible en el aire. Causa irritación de la piel y daños oculares graves. Evite inhalar, ya que puede causar irritación respiratoria. Manipule el paraformaldehído en una campana de gases químicos y use equipo de protección personal. Lávese bien las manos después de manipularlas. El tensioactivo no iónico causa irritación de la piel y daños oculares graves. Use guantes protectores y protección para los ojos o la cara cuando manipule. Para evitar la liberación al medio ambiente, abra la botella en una campana de extracción de productos químicos. Lávese bien las manos después de manipularlas.
- Para preparar 1 ml de solución fijadora celular que contenga 4% p/v de paraformaldehído y 0,1% v/v de tensioactivo no iónico, primero mezcle 891 μL de 1x PBS y 108 μL de paraformaldehído (concentración del 37% p/v) y luego agregue 1 μL de tensioactivo no iónico (concentración del 100%). Mezcle bien la solución.
- Preparación de las soluciones de tinción
- Para preparar 3 mM de yoduro de 3,3'-dihexiloxacarbocianina (DiOC), mezcle 2,65 mg de DiOC en 1 mL de DMSO.
- Para preparar 1,5 mM de solución de yoduro de propidio (PI), mezcle 1 mg de PI en 1 mL de agua desionizada.
- Preparación de la solución de eliminación de esferoides
- Prepare soluciones de aclarado de 20%, 40% y 80% v/v de formamida en 1x PBS para el aclarado de esferoides.
- Para hacer 10 ml de formamida al 20% v/v, mezcle 8 ml de 1x PBS seguido de 2 ml de formamida. Para hacer 10 ml de formamida al 40% v/v, mezcle 6 ml de 1x PBS seguido de 4 ml de formamida. Para hacer 10 ml de formamida al 80 % v/v, mezcle 2 ml de 1x PBS seguido de 8 ml de formamida.
- Después de combinar formamida y 1x PBS, mezcle la solución mediante vórtice durante unos 30 s.
- Prepare soluciones de aclarado de 20%, 40% y 80% v/v de formamida en 1x PBS para el aclarado de esferoides.
2. Fabricación de micropocillos piramidales cuadrados
- Fabrica un molde PDMS negativo de micropocillos piramidales cuadrados como se muestra en la Figura 1.
- Prepare 2 g (~1 ml) de solución precursora negativa de PDMS y viértala en un pocillo de un molde maestro piramidal cuadrado de 6 pocillos. Tenga en cuenta que 1 ml cubre completamente un pocillo de la placa. Después de cubrir el molde maestro con PDMS, desgasifique la solución precursora de PDMS durante 30 minutos colocando la placa piramidal cuadrada de 6 pocillos en un desecador al vacío. A continuación, cure el PDMS colocando la placa en un horno a 60 °C durante 24 h.
NOTA: Asegúrese de quitar la tapa de la placa para desgasificarla y volver a colocarla para curarla. Desgasificar la solución en un desecador al vacío o mediante purga con un gas inerte como nitrógeno o argón. Si la solución negativa del precursor del moho todavía tiene burbujas después de 30 minutos, lo que indica una desgasificación inadecuada, colóquela en un desecador al vacío durante 30 minutos más. Utilice uno o varios pocillos de placas simultáneamente para preparar uno o más moldes negativos de PDMS. Se pueden utilizar micropocillos piramidales cuadrados de diferentes tamaños, como longitudes laterales de 400 y 800 μm, como se muestra en la Tabla 1. Se utiliza la misma cantidad de PDMS independientemente de los tamaños piramidales cuadrados. - Una vez que el PDMS se cure mientras aún está caliente, retire con cuidado el molde negativo de PDMS del molde maestro con una espátula y corte el molde negativo en una losa de 35 mm de diámetro con un punzón de biopsia. Coloque en una placa de Petri y cubra con la tapa y deje que el RT continúe curando durante 24 h adicionales.
NOTA: Para eliminar los moldes negativos, use una espátula para colocarse entre la placa del pocillo y el molde PDMS y tire suavemente del molde negativo del molde maestro. El molde se corta en losas de 35 mm para adaptarse a una placa de Petri de 35 mm. Los moldes se pueden hacer en otros tamaños para adaptarse a placas de diferentes diámetros. Las losas de molde negativo de 35 mm se pueden almacenar, proteger del polvo en RT y reutilizar durante 6 meses.
- Prepare 2 g (~1 ml) de solución precursora negativa de PDMS y viértala en un pocillo de un molde maestro piramidal cuadrado de 6 pocillos. Tenga en cuenta que 1 ml cubre completamente un pocillo de la placa. Después de cubrir el molde maestro con PDMS, desgasifique la solución precursora de PDMS durante 30 minutos colocando la placa piramidal cuadrada de 6 pocillos en un desecador al vacío. A continuación, cure el PDMS colocando la placa en un horno a 60 °C durante 24 h.
- Prepare un molde PDMS positivo de micropocillos piramidales cuadrados.
- Coloque las losas de 35 mm del molde negativo de PDMS en una placa de Petri de 35 mm con los micropocillos texturizados hacia arriba.
- Prepare 2,5 g (~1,2 ml) de solución precursora positiva de PDMS como se indicó anteriormente y viértala en el molde negativo en la placa de Petri de 35 mm para cubrir completamente el molde negativo. A continuación, desgasifique la solución precursora durante 30 minutos como se ha indicado anteriormente y colóquela en el horno a 60 °C durante 3-4 h.
NOTA: Debido a que el PDMS es viscoso, se puede formar una burbuja a partir del aire atrapado debajo del molde negativo. Si se forma una burbuja debajo del molde negativo, empuje el molde hacia abajo suavemente con una espátula para liberar la burbuja. Si quedan burbujas de aire, continúe desgasificando durante 30 minutos, o tome una espátula y revuelva suavemente la solución positiva del molde hasta que las burbujas revienten. - Una vez que el molde PDMS positivo se cure, retire los moldes de la placa de Petri de 35 mm e inmediatamente retire el molde positivo del molde negativo.
NOTA: El tiempo es importante para el pelado exitoso del molde positivo. La eliminación se realiza mejor cortando ligeramente el molde positivo con una navaja de afeitar para exponer la interfaz entre el molde positivo y negativo y pelando los moldes entre sí. A continuación, retira los bordes del molde circular. Retire suavemente el molde negativo del molde positivo.
- Pega los moldes al fondo de los pocillos de una placa de 48 pocillos.
NOTA: Aquí, se usa una placa de 48 pocillos, pero se pueden usar otras placas siempre que las losas del molde se corten en los diámetros correctos (por ejemplo, 6 mm de diámetro para una placa de 96 pocillos).- Corte los moldes positivos en losas con un punzón de biopsia de 10 mm.
NOTA: Se pueden cortar aproximadamente 4 moldes (cada uno de 10 mm de diámetro) de un molde positivo de 35 mm de diámetro. - Para pegar los moldes al fondo de una placa de 48 pocillos, prepare la solución precursora de pegamento PDMS (~0,5 ml o 1 g) como se describió anteriormente27. Utilice unas pinzas para sumergir suavemente el lado plano (no el lado con el patrón de micropocillos) del molde positivo de 10 mm en la solución precursora de PDMS. Coloque con cuidado un molde por pocillo de una placa de 48 pocillos y presione suavemente cada molde contra el fondo del pocillo con la pinza. Coloque la placa ensamblada en un horno a 60 °C durante 4-24 h para permitir que el pegamento PDMS se seque.
NOTA: Si la solución precursora de pegamento PDMS entra en contacto con los micropocillos positivos del molde, se puede limpiar con papel de seda suave y se puede repetir el paso. Al pegar, asegúrese de que el pegamento no cubra los micropocillos. - Esterilice los moldes añadiendo 300 μL de etanol al 70% en cada pocillo de la placa de 48 pocillos con una pipeta de 1000 μL. Aspire el etanol al 70% y coloque la placa de 48 pocillos descubierta en una campana de cultivo de tejidos bajo UV (302 nm) durante 2 h.
NOTA: Los moldes se pueden usar durante 6 meses y volver a esterilizar según sea necesario.
- Corte los moldes positivos en losas con un punzón de biopsia de 10 mm.
3. Formación, recolección y encapsulación de esferoides tumorales multicelulares en hidrogeles
NOTA: El protocolo descrito en esta sección es para la línea celular de glioblastoma humano U87 (consulte la Figura 1 y la Figura 2), pero se podría usar un protocolo similar con otros tipos de células cancerosas.
- Formación de esferoides tumorales multicelulares
- Lave primero los moldes de micropocillos con una solución de enjuague antiadherente agregando 300 μL de la solución a cada pocillo con una pipeta de 1000 μL. A continuación, centrifugar a 1620 x g durante 3 min y aspirar la solución con una bomba de vacío y una pipeta Pasteur.
NOTA: Realice este paso inmediatamente antes de la siembra de células. - Exponga las células a ~80 μL de tripsina/EDTA al 0,25% por cadacm2 de área del matraz de cultivo durante 5 min a 37 °C. Por ejemplo, 1 mL de tripsina/EDTA es apropiado para un matraz de cultivo celular T-25. Neutralizar la tripsina añadiendo el mismo volumen de medio de cultivo celular completo. Por ejemplo, agregue 1 ml de medio completo al matraz de cultivo celular T-25 que contiene tripsina. Recoja las células del matraz de cultivo de tejidos.
- Transfiera 10 μL de la suspensión celular a cada puerto de un hemocitómetro para el recuento celular. Use un microscopio invertido para contar el número total de células y promedie ese recuento de células de al menos 8 cuadrantes, asegurándose de que el número de células en cada cuadrante del hemocitómetro sea de 20 a 50 para obtener buenos resultados de recuento de células. Multiplique el número calculado por 104 para determinar la concentración final de la célula.
- Resuspender las células recolectadas en el medio de cultivo celular RPMI completo suplementado con 10% de suero fetal bovino y 1% de penicilina/estreptomicina a la concentración celular final deseada, dependiendo del tamaño de esferoide deseado, como se muestra en la Tabla 1.
NOTA: Los micropocillos de 800 μm producirán ~75 esferoides en un pocillo de una placa de 48 pocillos, y los micropocillos de 400 μm producirán ~300 esferoides en un pocillo de una placa de 48 pocillos. - Colocar 500 μL de suspensión celular a la concentración deseada en micropocillos y centrifugar la placa a 1620 x g durante 3 min. Coloque la placa en una incubadora humidificada a 37 °C y 5% de CO2 durante 24 h para permitir la formación de esferoides.
NOTA: Si no se forman esferoides, se puede utilizar un 2% v/v de la matriz de la membrana basal combinada con medios completos para resuspender las células (más detalles en el paso 1.5).
- Lave primero los moldes de micropocillos con una solución de enjuague antiadherente agregando 300 μL de la solución a cada pocillo con una pipeta de 1000 μL. A continuación, centrifugar a 1620 x g durante 3 min y aspirar la solución con una bomba de vacío y una pipeta Pasteur.
- Recolección de esferoides
- Con una pipeta de 1000 μL, pipetee firmemente 500 μL de medio completo en el pocillo. Usando 500 μL de medio del pocillo, enjuague los cuatro cuadrantes del pocillo (específicamente los cuadrantes superior, inferior, izquierdo y derecho) pipeteando hacia arriba y hacia abajo en los cuadrantes tres o cuatro veces para desalojar los esferoides. Aspire suavemente el medio que contiene los esferoides (~1000 μL en total) en un tubo de microcentrífuga utilizando una pipeta de 1000 μL y deje que los esferoides se depositen en el fondo.
- Retire el sobrenadante y vuelva a suspender los esferoides a la concentración final deseada. Por ejemplo, para lograr ~8 esferoides en un gel de 20 μL después de la encapsulación, vuelva a suspender los esferoides en 100 μL de medio, lo que produce una concentración de esferoides de ~75 esferoides/100 μL en la suspensión de esferoides.
- Encapsulación de esferoides en hidrogeles, como se muestra en la Figura 2.
- Para crear 100 μL de una solución precursora de hidrogel PEG al 10% p/v, combine 50 μL de la suspensión esferoide, seguida de 30 μL de PEG-Ac de 4 brazos al 20% p/v y finalmente 20 μL de PEG-diSH al 20% p/v en un tubo de microcentrífuga. Esto dará una relación molar estequiométrica de grupos acrilato (Ac) a tiol (SH), lo que garantiza una reticulación óptima. Mezcle la solución precursora de gel pipeteando hacia arriba y hacia abajo ~ 10 veces.
NOTA: La composición del hidrogel, el volumen y la concertación del polímero se pueden cambiar según sea necesario. Los hidrogeles resultantes se degradarán lentamente y serán adhesivos no celulares. Para hacer el adhesivo de celda de hidrogel, se puede agregar un ligando adhesivo como RGDS. Para hacer que el hidrogel sea enzimáticamente degradable, se podría agregar un reticulante peptídico enzimáticamente degradable que contenga residuos de cisteína en ambos extremos. Al transferir esferoides, pipetee suavemente la solución dos veces para desalojar los esferoides y ponerlos en suspensión para garantizar una distribución uniforme de los esferoides. - Pipetear 20 μL de la solución precursora de gel entre dos portaobjetos de vidrio revestidos de parafilm separados con espaciadores de silicona de 1 mm, y colocar los portaobjetos con la solución de precursor de gel en una incubadora de 37 °C y 5% de CO2 durante 15 min para permitir la gelificación.
NOTA: Asegúrese de que los dos portaobjetos de vidrio estén cubiertos de parafilm para crear una superficie hidrofóbica que permita un fácil pelado tras la gelificación. En lugar de parafilm, se puede utilizar una solución de recubrimiento hidrofóbico. Un volumen de 20 μL de solución precursora de hidrogel dará como resultado una losa de hidrogel de ~6 mm de diámetro y 1 mm de altura antes de la hinchazón. Se puede utilizar cualquier tipo y grosor de espaciador, pero se recomienda que el espesor del gel se mantenga en o por debajo de 1 mm (los hidrogeles más gruesos podrían limitar la difusión de oxígeno y el transporte de nutrientes a las células) pero mayor que el diámetro del esferoide (para que los esferoides estén completamente encapsulados en el gel). Se puede utilizar cualquier volumen de la solución precursora de hidrogel. Los geles de 20-30 μL son adecuados para una placa de 24 pocillos. - Una vez que se complete la gelificación del hidrogel, separe los dos portaobjetos de vidrio y retire suavemente los geles de la placa de vidrio con una espátula. Coloque los geles en una placa de 24 pocillos, uno por pocillo, asegurándose de que la superficie que contiene los esferoides quede hacia arriba.
NOTA: Los esferoides caerán al fondo del gel durante la gelificación, por lo que invertirlos para el cultivo asegurará que los esferoides estén cerca de la superficie del hidrogel para un mejor acceso a los nutrientes y al oxígeno. La gelificación se puede controlar observando cualquier solución precursora de hidrogel que quede en el tubo de microcentrífuga y no se utilice para crear losas invirtiendo el tubo y anotando el momento en que el gel deja de fluir. - Agregue medio completo (~ 500 μL) a cada pocillo y asegúrese de que el hidrogel esté completamente sumergido. Colocar la placa multipocillo en una incubadora humidificada a 37 °C y 5% de CO2 y cultivar las células con cambios de medio cada 2-3 días.
NOTA: Los hidrogeles se pueden cultivar hasta por 4 semanas o hasta que los hidrogeles se degraden, cambiando el medio cada dos días.
- Para crear 100 μL de una solución precursora de hidrogel PEG al 10% p/v, combine 50 μL de la suspensión esferoide, seguida de 30 μL de PEG-Ac de 4 brazos al 20% p/v y finalmente 20 μL de PEG-diSH al 20% p/v en un tubo de microcentrífuga. Esto dará una relación molar estequiométrica de grupos acrilato (Ac) a tiol (SH), lo que garantiza una reticulación óptima. Mezcle la solución precursora de gel pipeteando hacia arriba y hacia abajo ~ 10 veces.
4. Tinción fluorescente
- Viabilidad celular
- Utilice la tinción yoduro de 3,3'-dihexiloloxacarbocianina (DiOC), que tiñe las mitocondrias y el retículo endoplásmico de todas las células, para determinar la viabilidad celular. Utilizar DiOC (3 mM) a una concentración de 0,02 μg/mL. En concreto, utilice una pipeta de 20 μL para añadir 2 μL de DiOC por cada 1000 μL de medio en el matraz que cultiva las células disociadas (al menos 24 h antes del proceso de formación de esferoides en la sección 3). Espere 24 h para que el DiOC tiña las células.
- Utilice la tinción nuclear y cromosómica, yoduro de propidio, PI (1,50 mM), que solo entra en las células muertas. Para teñir las células, primero aspire todos los medios y enjuague el gel con una pipeta de 1000 μL para agregar 500 μL de 1x PBS para que el gel quede completamente sumergido.
- Aspire el PBS y agregue 500 μL de medio fresco, seguido de 30 μL de la solución PI a cada pocillo (es decir, 6 μL por cada 100 μL de medio). Cubra la placa del pocillo con papel de aluminio para protegerla de la luz. Coloque la placa de pocillos en una incubadora a 37 °C y 5% de CO2 y deje pasar 30 minutos para que el PI tiña las células muertas.
- Retire la lámina y aspire el medio de los pocillos. Utilice una pipeta de 1000 μL para añadir 500 μL de 1x PBS para sumergir el hidrogel. Aspire el 1x PBS y repita el enjuague dos veces más. Agregue 500 μL de medio a cada pocillo y obtenga imágenes bajo un microscopio fluorescente invertido o confocal.
- Calcule la viabilidad celular comparando el área de DiOC (todas las células) con PI (células muertas), como se representa en la ecuación 1, utilizando imágenes de pila z de un microscopio confocal o un microscopio fluorescente invertido.
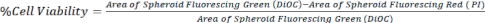 Ec. 1.
Ec. 1.
5. Fijación por inmunofluorescencia, tinción, aclarado e imagen de esferoides encapsulados
- Fijación y tinción
- Aspire los medios de los pocillos donde se cultivan los hidrogeles y enjuague los hidrogeles pipeteando 500 μL de 1x PBS directamente sobre los hidrogeles. Aspire suavemente el 1x PBS.
- Fije los esferoides en la placa de 24 pocillos utilizando una pipeta de 1000 μL para añadir un volumen de 500 μL de solución fijadora por pocillo. Deje que el fijador remoje los geles durante 30 min en RT. Retire la solución fijadora con una pipeta de 1000 μL y deséchela en un contenedor de residuos designado.
- Enjuague los hidrogeles agregando 500 μL de 1x PBS a cada pocillo. Aspire el 1x PBS con una pipeta de 1000 μL y repita el enjuague de PBS dos veces más. Guarde la placa de pocillos en 500 μL de 1x PBS por pocillo a 4 °C durante un máximo de 1 semana o utilícela inmediatamente.
NOTA: Tenga cuidado de no introducir los hidrogeles en la pipeta cuando aspire PBS y solución fijadora. Hágalo inclinando la placa en un ángulo de ~ 45 grados, lo que ayudará a ver los hidrogeles y evitará la aspiración accidental.
PRECAUCIÓN: El formaldehído es tóxico por inhalación y contacto. Manéjelo con guantes en una campana de gases químicos. - Para teñir las células, incubar los esferoides encapsulados en hidrogel con anticuerpos primarios para Nestin (200 μg/mL) y SOX2 (200 μg/mL) a una dilución de 1:200 de anticuerpo: PBS. Utilice una pipeta de 1000 μL para aspirar el PBS 1x de los pocillos. Añadir 50 μL del anticuerpo diluido a cada pocillo. Espere 24 h para que se complete la tinción. A continuación, retire la solución de tinción con una pipeta de 1000 μL y deseche los residuos de forma adecuada.
- Utilice una pipeta de 1000 μL para añadir 500 μL de 1xPBS, que es suficiente para sumergir el hidrogel. Aspire el PBS y repítalo dos veces más. Guarde el hidrogel teñido y sumergido en 1x PBS a 4 °C durante un máximo de 2 semanas antes de la obtención de imágenes o la imagen inmediatamente.
NOTA: Es posible que se necesiten optimizaciones menores dependiendo del anticuerpo para garantizar una tinción adecuada. La concentración (1:200) y el tiempo (24 h) son significativamente más altos que en el cultivo celular monocapa 2D típico porque la tinción 3D requiere difusión a través del hidrogel y los esferoides.
- Después de teñir los esferoides, limpie el esferoide para mejorar la transparencia de las imágenes reemplazando el PBS con un aumento secuencial de la concentración de formamida (opcional).
- Aspire el PBS 1x de cada pocillo. Añadir 500 μL de formamida al 20% (v/v) a cada pocillo y dejar que el hidrogel se incube durante 90 min. Aspirar la formamida con una pipeta de 1000 μL y recoger los residuos en un contenedor de residuos.
- Agregue 500 μL de formamida al 40% (v/v) al pocillo. Deje que el hidrogel se incube en la solución durante 90 minutos. Aspirar la formamida y recoger los residuos en el contenedor de residuos.
- Añadir 500 μL de formamida al 80% v/v a cada pocillo e incubar durante 90 min. Aspirar la formamida y desecharla en el contenedor de residuos. Añadir 500 μL de formamida al 100% (v/v) y dejar reposar 24 h antes de la toma de imágenes. Una vez finalizada la limpieza, elimine adecuadamente los residuos de formamida a través de los servicios adecuados de un sistema de gestión de residuos de laboratorio.
NOTA: El despeje permite obtener imágenes confocales en el núcleo del esferoide y es opcional si solo se está investigando la periferia del esferoide.
- Obtención de imágenes de esferoides encapsulados en hidrogel mediante microscopía confocal.
NOTA: Se puede utilizar cualquier microscopio (invertido, fluorescente o confocal) para la obtención de imágenes celulares; sin embargo, confocal permite el aislamiento de planos individuales.- Coloque los hidrogeles en pocillos con cámaras con fondos de cubreobjetos de vidrio y coloque los esferoides lo más cerca posible del cubreobjetos.
NOTA: Se pueden utilizar cubreobjetos de vidrio o pocillos con cámaras con fondos de cubreobjetos de vidrio. Es crucial mantener los hidrogeles hidratados, ya que las muestras deshidratadas darán lugar a una mala calidad de las imágenes. - Obtenga imágenes de las muestras con un objetivo de larga distancia de trabajo (10x-20x) para permitir la obtención de imágenes profundas en el esferoide utilizando pilas Z para reconstrucciones 3D.
NOTA: Los objetivos de mayor aumento permiten obtener imágenes más detalladas y seccionar ópticamente, pero sacrifican la profundidad de la imagen. - Cuantifique la cantidad de señal presente en la sección óptica en relación con el área total del esferoide para la señal despejada y no despejada utilizando la ecuación 2.
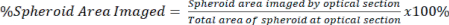 Ec. 2
Ec. 2
- Coloque los hidrogeles en pocillos con cámaras con fondos de cubreobjetos de vidrio y coloque los esferoides lo más cerca posible del cubreobjetos.
Resultados
Las plataformas de cribado de fármacos basadas en esferoides para estudiar los efectos quimioterapéuticos son cada vez más buscadas debido al énfasis en la modulación del microambiente tumoral tras la encapsulación de esferoides en biomateriales que replican tejido nativo. Aquí desarrollamos un método para la preparación de esferoides tumorales multicelulares y su posterior encapsulación e imagen en un hidrogel 3D. Los esferoides se preparan en moldes de micropocillos (Figura 3A,B)...
Discusión
Los modelos de esferoides tumorales multicelulares basados en hidrogel se están desarrollando cada vez más para avanzar en los descubrimientos terapéuticos del cáncer 11,13,29. Son beneficiosos porque emulan parámetros clave del microambiente tumoral de forma controlada y, a pesar de su complejidad, son más sencillos y baratos de usar que los modelos in vivo, y muchos son compatibles con las tecnologías de cribado de alto...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por los fondos iniciales proporcionados a la Dra. Silviya P Zustiak por la Universidad de Saint Louis, así como por una subvención inicial del Centro Henry y Amelia Nasrallah de Neurociencia de la Universidad de Saint Louis otorgada a la Dra. Silviya P Zustiak.
Materiales
| Name | Company | Catalog Number | Comments |
| 70% Ethanol | Fisher Scientific | LC22210-4 | |
| 15 mL Conicals | FALCON | 352097 | |
| 24-Well Plate Ultra Low Attachment plates | Fisher Scientific | 07-200-602 | |
| 35 mm Petri Dish | Amazon | 706011 | |
| 4-arm poly(ethylene glycol)-acrylate (4-arm PEG-Ac; 10 kDa) | Laysan Bio | ACRL-PEG-ACRL-10K-5g | |
| 50 mL Conicals | Fisher Scinetific | 3181345107 | |
| 6-well AggreWell 400 | StemCell Technologies, Vancouver, Canada | 34421 | Square pyramidal microwells |
| anti-adherence rinsing solution | StemCell Technologies, Vancouver, Canada | Cat #: 07010 | |
| Aspartic Acid-Arginine-Cysteine-Glycine-Valine-Proline-Methionine-Serine-Methionine-Arginine-Glycine-Cysteine-Arginine- Aspartic Acid (DRCG-VPMSMR-GCRD) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Chemical Fume Hood | KEWAUNEE | 99151 | |
| Corning Matrigel Basement Membrane Matrix, LDEV Free | Corning | 356234 | Basement membrane matrix |
| Detergent - Triton-X | Sigma Aldrich | T8787 | Nonionic surfactant |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | BP231-100 | |
| Disposable Pipettes (1 mL, 2 mL, 5 mL, 10 mL, 25 mL, 50 mL) | Fisher Scinetific | 1 mL: 13-678-11B, 2mL: 05214038, 5mL(FALCON): 357529, 10mL: 13-678-11E, 25mL: 13-678-11, 50mL: 13-678-11F | |
| Fetal Bovine Serum | HyClone | SH30073-03 | |
| Formaldehyde 37% Solution | Sigma Aldrich | F1635 | |
| Glass Plates | Slumpys | GBS4100SFSL | |
| Glass Transfer Pipettes | Fisher Scinetific | 5 3/4": 1367820A, 9":136786B | |
| Glycine-Arginine-Cysteine-Aspartic Acid-Arginine-Glycine-Aspartic Acid-Serine (GRCD-RGDS) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Hemacytometer | Bright-Line | 383684 | |
| Hydrophobic solution - Repel Silane | GE Healthcare Bio-Sciences | 17-1332-01 | |
| Incubator | NUAIRE | NU-8500 | |
| Inverted Microscope (Axiovert 25) | Zeiss | 663526 | |
| Invitrogen DiOC16(3) (3,3'-Dihexadecyloxacarbocyanine Perchlorate) | Fisher Scientific | D1125 | |
| Leica Confocal SP8 | Leica Microsystems Inc. | ||
| Light and Flourescent Microscope (Axiovert 200M) | Zeiss | 3820005619 | |
| Micro centrifuge tubes | Fisher Scientific | 2 mL: 02681258 | |
| Microscope Software | Zeiss | AxioVision Rel. 4.8.2 | |
| Nestin Alexa Fluor 594 | Santa Cruz Biotechnology | sc-23927 | |
| Parafilm | PARAFILM | PM992 | |
| PBS (1x), pH 7.4 | HyClone | SH30256.01 | |
| Penicillin Streptomycin | MP Biomedicals | 1670046 | |
| Pipette Aid | Drummond Scientific Co. | P-76864 | |
| Pipette Tips (1–200 µL, 101–1000 µL) | Fisher Scinetific | 2707509 | |
| Plastic Standard Disposable Transfer Pipettes | Fisher Scientific | 13-711-9D | |
| Plastic Weigh Boats (100 mL) | Amazon | mdo-azoc-1030 | |
| poly(ethylene glycol)-dithiol (PEG-diSH; 3.4 kDa) | Laysan Bio | SH-PEG-SH-3400-5g | |
| Polydimehylsiloxane (PDMS) [Slygard 182 Elastomer Kit] | Elsworth Adhesives | 3097358-1004 | Polydimethylsiloxane |
| Powder Free Examination Gloves | Quest | 92897 | |
| Propidium iodide, 1 mg/mL aqueous soln. | Fisher Scientific | AAJ66584AB | |
| RPMI-1640 Medium (1x) | HyClone | SH30027-02 | |
| Silicone spacers - Silicone sheet, 0.5 mm thick/13 cm x 18 cm | Grace Bio-Labs | JTR-S-0.5 | |
| SOX2 Alexa Fluor 488 | Santa Cruz Biotechnology | sc-365823 | |
| Tissue Culture Hood | NUAIRE | NU-425-600 | |
| Triethanolamine, ≥99.0% (GC) | Sigma Aldrich | 90279 | |
| U-87 MG human glioblastoma cells | American Type Culture Collection | HTB-14 |
Referencias
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Costa, E. C., de Melo-Diogo, D., Moreira, A. F., Carvalho, M. P., Correia, I. J. Spheroids formation on non-adhesive surfaces by liquid overlay technique: Considerations and practical approaches. Biotechnology Journal. 13 (1), 1700417 (2018).
- Li, Y., Kumacheva, E. Hydrogel microenvironments for cancer spheroid growth and drug screening. Science Advances. 4 (4), eaas8998 (2018).
- Kamatar, A., Gunay, G., Acar, H. Natural and synthetic biomaterials for engineering multicellular tumor spheroids. Polymers. 12 (11), 2506 (2020).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular Pharmaceutics. 11 (7), 2115-2125 (2014).
- Nakod, P. S., Kim, Y., Rao, S. S. Three-dimensional biomimetic hyaluronic acid hydrogels to investigate glioblastoma stem cell behaviors. Biotechnology and Bioengineering. 117 (2), 511-522 (2020).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85, 128-146 (2020).
- Pedron, S., et al. Hyaluronic acid-functionalized gelatin hydrogels reveal extracellular matrix signals temper the efficacy of erlotinib against patient-derived glioblastoma specimens. Biomaterials. 219, 119371 (2019).
- Hill, L., Bruns, J., Zustiak, S. P. Hydrogel matrix presence and composition influence drug responses of encapsulated glioblastoma spheroids. Acta Biomaterialia. 132, 437-447 (2021).
- Chen, J. -. W. E., et al. Crosstalk between microglia and patient-derived glioblastoma cells inhibit invasion in a three-dimensional gelatin hydrogel model. Journal of Neuroinflammation. 17 (1), 346 (2020).
- Thakuri, P. S., Liu, C., Luker, G. D., Tavana, H. Biomaterials-based approaches to tumor spheroid and organoid modeling. Advanced Healthcare Materials. 7 (6), 1700980 (2018).
- Shin, S., et al. Alginate-marine collagen-agarose composite hydrogels as matrices for biomimetic 3D cell spheroid formation. RSC Advances. 6 (52), 46952-46965 (2016).
- Pradhan, S., Clary, J. M., Seliktar, D., Lipke, E. A. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 115, 141-154 (2017).
- Imaninezhad, M., Hill, L., Kolar, G., Vogt, K., Zustiak, S. P. Templated macroporous polyethylene glycol hydrogels for spheroid and aggregate cell culture. Bioconjugate Chemistry. 30 (1), 34-46 (2018).
- Mirab, F., Kang, Y. J., Majd, S. Preparation and characterization of size-controlled glioma spheroids using agarose hydrogel microwells. PLoS One. 14 (1), e0211078 (2019).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments: JoVE. 81, e50665 (2013).
- Timmins, N. E., Nielsen, L. K., Hauser, H., Fussenegger, M. . Generation of Multicellular Tumor Spheroids by the Hanging-Drop Method. 140, (2007).
- Zhao, L., et al. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Scientific Reports. 9 (1), 19717 (2019).
- Amaral, R. L., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Gencoglu, M. F., et al. Comparative study of multicellular tumor spheroid formation methods and implications for drug screening. ACS Biomaterials Science & Engineering. 4 (2), 410-420 (2018).
- Zhang, C., Liu, C., Zhao, H. Mechanical properties of brain tissue based on microstructure. Journal of the Mechanical Behavior of Biomedical Materials. 126, 104924 (2021).
- Alifieris, C., Trafalis, D. T. Glioblastoma multiforme: Pathogenesis and treatment. Pharmacology & Therapeutics. 152, 63-82 (2015).
- Zustiak, S. P., Leach, J. B. Hydrolytically degradable poly (ethylene glycol) hydrogel scaffolds with tunable degradation and mechanical properties. Biomacromolecules. 11 (5), 1348-1357 (2010).
- Zustiak, S. P., Wei, Y., Leach, J. B. Protein-hydrogel interactions in tissue engineering: Mechanisms and applications. Tissue Engineering Part B: Reviews. 19 (2), 160-171 (2013).
- Kroger, S. M., et al. Design of hydrolytically degradable polyethylene glycol crosslinkers for facile control of hydrogel degradation. Macromolecular Bioscience. 20 (10), 2000085 (2020).
- Raeber, G., Lutolf, M., Hubbell, J. Molecularly engineered PEG hydrogels: a novel model system for proteolytically mediated cell migration. Biophysical Journal. 89 (2), 1374-1388 (2005).
- Bruns, J., Egan, T., Mercier, P., Zustiak, S. P. Glioblastoma spheroid growth and chemotherapeutic responses in single and dual-stiffness hydrogels. Acta Biomaterialia. 163, 400-414 (2023).
- Kuwajima, T., et al. ClearT: a detergent-and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Holt, S. E., Ward, E. S., Ober, R. J., Alge, D. L. Shooting for the moon: using tissue-mimetic hydrogels to gain new insight on cancer biology and screen therapeutics. MRS Communications. 7 (3), 427-441 (2017).
- Jain, E., Scott, K. M., Zustiak, S. P., Sell, S. A. Fabrication of polyethylene glycol-based hydrogel microspheres through electrospraying. Macromolecular Materials and Engineering. 300 (8), 823-835 (2015).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948 (2016).
- Lee, K. -. H., Kim, T. -. H. Recent advances in multicellular tumor spheroid generation for drug screening. Biosensors. 11 (11), 445 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados