Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung und Verkapselung von Tumorsphäroiden in Polyethylenglykol-Hydrogelen zur Untersuchung von Sphäroid-Matrix-Wechselwirkungen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, das eine schnelle, robuste und kostengünstige Herstellung von Tumorsphäroiden mit anschließender Hydrogelverkapselung ermöglicht. Es ist weit verbreitet, da es keine spezielle Ausrüstung erfordert. Es wäre besonders nützlich für die Erforschung von Sphäroid-Matrix-Wechselwirkungen und die Erstellung von In-vitro-Gewebephysiologie - oder Pathologiemodellen.
Zusammenfassung
Die dreidimensionale (3D) Verkapselung von Sphäroiden ist entscheidend, um die Tumormikroumgebung für ein optimales Zellwachstum angemessen zu replizieren. Hier haben wir ein In-vitro-3D-Glioblastommodell für die Sphäroidverkapselung entwickelt, um die extrazelluläre Mikroumgebung des Tumors nachzuahmen. Zuerst bildeten wir quadratische pyramidale Mikrotiterformen mit Polydimethylsiloxan. Diese Mikrotiterformen wurden dann zur Herstellung von Tumorsphäroiden mit streng kontrollierten Größen von 50-500 μm verwendet. Sobald sich Sphäroide gebildet hatten, wurden sie geerntet und in Hydrogele auf Polyethylenglykol (PEG)-Basis eingekapselt. PEG-Hydrogele sind eine vielseitige Plattform für die Sphäroidverkapselung, da Hydrogeleigenschaften wie Steifigkeit, Abbaubarkeit und Zelladhäsion unabhängig voneinander eingestellt werden können. Hier verwendeten wir ein repräsentatives weiches (~8 kPa) Hydrogel, um Glioblastom-Sphäroide einzukapseln. Schließlich wurde eine Methode zum Färben und Abbilden von Sphäroiden entwickelt, um mittels konfokaler Mikroskopie qualitativ hochwertige Bilder zu erhalten. Aufgrund des dichten Sphäroidkerns und der relativ spärlichen Peripherie kann die Bildgebung schwierig sein, aber die Verwendung einer Clearing-Lösung und konfokaler optischer Schnitte hilft, diese Bildgebungsschwierigkeiten zu lindern. Zusammenfassend zeigen wir eine Methode zur Herstellung einheitlicher Sphäroide, zur Verkapselung in PEG-Hydrogele und zur Durchführung einer konfokalen Mikroskopie an den verkapselten Sphäroiden, um das Sphäroidwachstum und verschiedene Zell-Matrix-Wechselwirkungen zu untersuchen.
Einleitung
Tumorsphäroide haben sich als nützliche In-vitro-Werkzeuge bei der Untersuchung der Ätiologie, Pathologie und des Ansprechens auf Medikamente bei Krebserwiesen 1. Traditionell wurden Sphäroide unter Bedingungen wie Platten mit geringer Adhäsion oder Bioreaktoren kultiviert, bei denen die Zell-Zell-Adhäsion gegenüber der Zell-Oberflächen-Adhäsion bevorzugt wird2. Es ist jedoch inzwischen anerkannt, dass In-vitro-Sphäroidmodelle sowohl Zell-Zell- als auch Zell-Matrix-Interaktionen erfassen sollten, um die Tumormikroumgebung originalgetreuer zu rekapitulieren. Dies hat mehrere Gruppen dazu veranlasst, Gerüste wie Hydrogele zu entwickeln, in denen Sphäroide eingekapselt werden können 3,4. Solche Hydrogel-basierten Sphäroidmodelle ermöglichen die Aufklärung von Zell-Zell- und Zell-Matrix-Interaktionen auf verschiedene Zellverhaltensweisen, wie z. B. Lebensfähigkeit, Proliferation, Stammzellen oder Therapieansprechen3.
Hier beschreiben wir ein Protokoll für die Verkapselung von Glioblastom-Sphäroiden in Polyethylenglykol (PEG)-Hydrogelen. Es gibt mehrere Literaturberichte über die Verkapselung von Glioblastomzellen mit Sphäroiden in Hydrogelen. Zum Beispiel wurden Sphäroide durch Verkapselung von U87-Zellen in PEG-Hydrogelen gebildet, die mit einem RGDS-Adhäsivliganden dekoriert und mit einem enzymatisch spaltbaren Peptid vernetzt wurden, um die Wirkung der Hydrogelsteifigkeit auf das Zellverhalten zu bestimmen5. U87-Zellen wurden auch in anderen PEG-basierten oder Hyaluronsäure-basierten Hydrogelen gebildet, um die Krebsstammzellpopulationzu erweitern 6 oder um matrixvermittelte Mechanismen der Chemotherapieresistenz zu erforschen 7,8,9. Glioblastom-Sphäroide wurden auch in Gelatine-Hydrogelen eingekapselt, um die Wechselwirkung zwischen Mikroglia und Krebszellen und ihre Wirkung auf die Zellinvasion zu untersuchen10. Insgesamt haben solche Studien den Nutzen von Hydrogel-basierten In-vitro-Modellen für das Verständnis der Glioblastompathologie und die Entwicklung von Behandlungen gezeigt.
Darüber hinaus gibt es verschiedene Verfahren zur Herstellung von Tumorsphäroiden und zur Hydrogelverkapselung11. Zum Beispiel könnten dispergierte Zellen in Hydrogele ausgesät werden und im Laufeder Zeit Sphäroide bilden 5,12. Ein Nachteil einer solchen Methode ist die Polydispersität der gebildeten Sphäroide, die zu unterschiedlichen Zellreaktionen führen könnte. Um einheitliche Sphäroide herzustellen, könnten Zellen in Mikrogele eingekapselt und über längere Zeiträume kultiviert werden, bis sie in das Gel13 eindringen und es umgestalten, oder Zellen könnten in vorgefertigten Gelen mit kugelförmigen "Löchern" abgelagert und aggregiert werden14. Der Nachteil dieser Methoden ist ihre relative Komplexität, die Notwendigkeit eines Tröpfchengenerators oder anderer Mittel, um Mikrogele oder die "Löcher" im Gel zu bilden, und die Zeit, die Sphäroide benötigen, um zu wachsen und zu reifen. Alternativ könnten Sphäroide in Mikrovertiefungen9, 15, 16 oder in hängenden Fallplatten17, 18 vorgeformt und dann in einem Hydrogel eingekapselt werden, ähnlich der hier beschriebenen Technik. Diese Methoden sind einfacher und können mit höherem Durchsatz durchgeführt werden. Interessanterweise wurde gezeigt, dass die Methode der Sphäroidbildung das Verhalten von Sphäroidzellen beeinflussen kann, wie z. B. die Genexpression, die Zellproliferation oder das Ansprechen auf Medikamente19,20.
Hier konzentrieren wir uns auf das Glioblastom, da es sich um einen soliden Tumor handelt, dessen natürliche Umgebung die weiche, nanoporöse Gehirnmatrix21 ist, die von einem weichen, nanoporösen Hydrogel nachgeahmt werden kann. Das Glioblastom ist auch der tödlichste Hirntumor, für den es keine verfügbare Heilung gibt22. Das hier beschriebene Protokoll kann jedoch für die Verkapselung von Sphäroiden verwendet werden, die einen soliden Tumor darstellen. Wir haben uns für die Verwendung von PEG-Hydrogelen entschieden, die durch eine Additionsreaktion vom Michael-Typ gebildet werden23. PEG ist ein synthetisches, nicht abbaubares und biokompatibles Hydrogel, das inert ist und als Gerüst und physikalische Zellunterstützung dient, aber keine Zellanhaftung unterstützt23. Die Zelladhäsion kann separat durch Tethering ganzer Proteine oder adhäsiver Liganden24 hinzugefügt werden, und die Abbaubarkeit kann durch chemische Modifikationen der PEG-Polymerkette oder hydrolytisch oder enzymatisch abbaubare Vernetzer 25,26 hinzugefügt werden. Dadurch können biochemische Eigenschaften unabhängig von mechanischen oder physikalischen Hydrogeleigenschaften eingestellt werden, was bei der Untersuchung von Zell-Matrix-Wechselwirkungen von Vorteil sein könnte. Die Gelierungschemie vom Michael-Typ ist selektiv und findet unter physiologischen Bedingungen statt; Daher ermöglicht es eine Sphäroidverkapselung durch einfaches Mischen der Sphäroide mit der Hydrogel-Vorläuferlösung.
Insgesamt weist die hier vorgestellte Methodik mehrere bemerkenswerte Merkmale auf. Erstens ist die Herstellung von Tumorsphäroiden in einer Multiwell-Baugruppe effizient, schnell und die Kosten für die erforderlichen Materialien sind niedrig. Zweitens werden die Sphäroide in großen Chargen in einer Vielzahl von Größen mit geringer Polydispersität hergestellt. Schließlich werden nur handelsübliche Materialien benötigt. Der Nutzen der Methodik wird durch die Untersuchung der Auswirkungen der Substrateigenschaften auf die Lebensfähigkeit von Sphäroidzellen, die Zirkularität und die Zellstammzellen veranschaulicht.
Protokoll
1. Vorbereitung der Lösungen
- Herstellung von Polydimethylsiloxan (PDMS)-Vorläuferlösung
- Bereiten Sie die negative PDMS-Vorläuferlösung vor (wird auch für die Leimvorläuferlösung verwendet). Schöpfen Sie das Elastomer mit einem Spatel in ein Wägeschiffchen und wiegen Sie es. Geben Sie das Härter im Verhältnis 1:10 auf die Elastomerbasis. Mischen Sie PDMS und Härter vorsichtig und gründlich mit dem Spatel in der Kunststoffwaage.
HINWEIS: Diese PDMS-Vorläuferlösung wird in die quadratische pyramidale 6-Well-Mikrotiterplatte gegossen, um die Negativform zu bilden. Dies ist die gleiche Lösung, die für die Leimvorläuferlösung verwendet wird. - Bereiten Sie die positive PDMS-Vorläuferlösung vor. Schöpfen Sie die Elastomerbasis mit einem Spatel in das Wägeschiffchen und wiegen Sie es. Geben Sie das Härter im Verhältnis 1:9 auf die Elastomerbasis. Mischen Sie PDMS und Härter vorsichtig und gründlich mit dem Spatel in der Kunststoffwaage.
HINWEIS: Diese PDMS-Vorläuferlösung wird später auf die Negativform gegossen, um die Positivform zu bilden.
- Bereiten Sie die negative PDMS-Vorläuferlösung vor (wird auch für die Leimvorläuferlösung verwendet). Schöpfen Sie das Elastomer mit einem Spatel in ein Wägeschiffchen und wiegen Sie es. Geben Sie das Härter im Verhältnis 1:10 auf die Elastomerbasis. Mischen Sie PDMS und Härter vorsichtig und gründlich mit dem Spatel in der Kunststoffwaage.
- Herstellung von 0,3 M Triethanolamin (TEA) Puffer mit pH 8
- Pipettieren Sie 1 ml TEA und 9 ml 1x phosphatgepufferte Kochsalzlösung (PBS) mit einer Pipettenhilfe in eine konische 50-ml-Lösung, um eine 0,75-ml-TEA-Lösung herzustellen. Die Lösung wird mit 1 N HCl oder 1 N NaOH auf einen pH-Wert von 8 titriert. Fügen Sie dann genügend 1x PBS hinzu, um ein Endvolumen von 25 ml zu erreichen, um eine endgültige TEA-Konzentration von 0,3 M bei einem pH-Wert von 8 zu erreichen.
ACHTUNG: Lagern Sie HCl- und NaOH-Lösungen in einem brennbaren Schrank bei Raumtemperatur (RT). Tragen Sie bei der Handhabung persönliche Schutzausrüstung.
- Pipettieren Sie 1 ml TEA und 9 ml 1x phosphatgepufferte Kochsalzlösung (PBS) mit einer Pipettenhilfe in eine konische 50-ml-Lösung, um eine 0,75-ml-TEA-Lösung herzustellen. Die Lösung wird mit 1 N HCl oder 1 N NaOH auf einen pH-Wert von 8 titriert. Fügen Sie dann genügend 1x PBS hinzu, um ein Endvolumen von 25 ml zu erreichen, um eine endgültige TEA-Konzentration von 0,3 M bei einem pH-Wert von 8 zu erreichen.
- Aufbereitung kompletter Medien
- Um das vollständige Medium herzustellen, fügen Sie 10% (w/v) oder 56 ml fötales Kälberserum und 1% (w/v) oder 5,6 ml Penicillin und Streptomycin zu 500 ml RPMI-Medium hinzu.
- Stellen Sie die Lösung vor der Verwendung 10-20 Minuten lang bei 37 °C oder bis die Lösung warm ist.
- Lagern Sie die Lösung bis zu 6 Monate bei 0-4 °C.
- Herstellung von 20%igen (w/v) Polyethylenglykol (PEG)-Stammlösungen
HINWEIS: Die Berechnung basiert auf 100-μl-Lösungen, die je nach Bedarf vergrößert oder verkleinert werden können.- Zur Herstellung einer 100 μl Stammlösung mit 20 % w/v 4-armigem PEG-Acrylat (4-armiges PEG-Ac) werden 20 mg 4-armiges PEG-Ac-Pulver in einem Mikrofugenröhrchen gewogen. Fügen Sie 70 μl 0,3 M TEA-Puffer hinzu und wirbeln Sie die Lösung etwa 30 s lang oder bis sie vollständig aufgelöst ist. Berücksichtigen Sie die Volumenänderung aufgrund der Pulverauflösung, indem Sie genügend TEA-Puffer (~27 μl) hinzufügen, um ein endgültiges Lösungsvolumen von 100 μl zu erreichen.
- Zur Herstellung einer 100 μl Stammlösung mit 20 % w/v PEG-diSH werden 20 mg PEG-diSH-Pulver in einem Mikrofugenröhrchen gewogen. Fügen Sie 70 μl TEA-Puffer hinzu und wirbeln Sie die Lösung etwa 30 s lang oder bis sie vollständig aufgelöst ist. Berücksichtigen Sie die Volumenänderung aufgrund der Pulverauflösung, indem Sie genügend TEA-Puffer (~27 μl) hinzufügen, um ein endgültiges Lösungsvolumen von 100 μl zu erreichen.
HINWEIS: Das PEG-Pulver ist sehr hygroskopisch und muss in einem getrockneten Behälter bei -20 °C gelagert werden. Wenn Sie es aus dem Gefrierschrank nehmen, lassen Sie das PEG-Pulver 10 Minuten auftauen, bevor Sie die Flasche öffnen, um das Pulver zu wiegen. Spülen Sie die Flasche mit einem Inertgas wie Stickstoff oder Argon, um die feuchte Luft zu verdrängen, bevor Sie sie in den Gefrierschrank zurückstellen. Die Stammlösung von 4-armigem PEG-Ac kann vor der Verwendung bis zu 2 Wochen bei 4 °C gelagert werden. Die Stammlösung von PEG-diSH muss unmittelbar vor der Verwendung hergestellt werden und kann nicht gelagert werden, da die Thiolgruppen miteinander reagieren und Disulfidbindungen bilden.
- Herstellung einer 2%igen v/v-Basalmembran-Matrixlösung
- Um eine Arbeitslösung mit 2 % v/v Basalmembranmatrix herzustellen, fügen Sie 20 μl der Basalmembranmatrix (LDEV-frei) zu 9,98 ml vollständigem Medium hinzu und mischen Sie gründlich, indem Sie ~10 Mal auf und ab pipettieren. Die Lösung bei 4 °C (auf Eis) zubereiten, dann auf 37 °C erwärmen (im Ofen oder Inkubator) und sofort verwenden.
HINWEIS: Die Basalmembranmatrix beginnt bei >10 °C ein Gel zu bilden, mischen Sie also unbedingt die Basalmembranmatrixlösung mit dem vollständigen Medium bei 2-6 °C. Die vollständige Medienzusammensetzung wird in Schritt 1.3 beschrieben.
- Um eine Arbeitslösung mit 2 % v/v Basalmembranmatrix herzustellen, fügen Sie 20 μl der Basalmembranmatrix (LDEV-frei) zu 9,98 ml vollständigem Medium hinzu und mischen Sie gründlich, indem Sie ~10 Mal auf und ab pipettieren. Die Lösung bei 4 °C (auf Eis) zubereiten, dann auf 37 °C erwärmen (im Ofen oder Inkubator) und sofort verwenden.
- Herstellung der Zellfixierlösung
- Um 1 ml Zellfixierlösung herzustellen, die 4 % w/v Paraformaldehyd und 0,1 % v/v nichtionisches Tensid enthält, mischen Sie zuerst 891 μl 1x PBS und 108 μl Paraformaldehyd (37% w/v-Konzentration) und fügen Sie dann 1 μl nichtionisches Tensid (100% Konzentration) hinzu. Mischen Sie die Lösung gründlich.
HINWEIS: Die Fixierlösung sollte bei jeder Fixierung frisch zubereitet werden.
ACHTUNG: Paraformaldehyd ist brennbar und kann brennbare Staubkonzentrationen in der Luft bilden. Es verursacht Hautreizungen und schwere Augenschäden. Vermeiden Sie das Einatmen, da dies zu Atemwegsreizungen führen kann. Behandeln Sie Paraformaldehyd in einem chemischen Abzug und tragen Sie persönliche Schutzausrüstung. Waschen Sie sich nach der Handhabung gründlich die Hände. Das nichtionische Tensid verursacht Hautreizungen und schwere Augenschäden. Tragen Sie bei der Handhabung Schutzhandschuhe und Augenschutz oder Gesichtsschutz. Um eine Freisetzung in die Umwelt zu vermeiden, öffnen Sie die Flasche in einem chemischen Abzug. Waschen Sie sich nach der Handhabung gründlich die Hände.
- Um 1 ml Zellfixierlösung herzustellen, die 4 % w/v Paraformaldehyd und 0,1 % v/v nichtionisches Tensid enthält, mischen Sie zuerst 891 μl 1x PBS und 108 μl Paraformaldehyd (37% w/v-Konzentration) und fügen Sie dann 1 μl nichtionisches Tensid (100% Konzentration) hinzu. Mischen Sie die Lösung gründlich.
- Herstellung der Färbelösungen
- Zur Herstellung von 3 mM 3,3'-Dihexyloxacarbocyaniniodid (DiOC) mischen Sie 2,65 mg DiOC in 1 ml DMSO.
- Um 1,5 mM Propidiumiodidlösung (PI) herzustellen, mischen Sie 1 mg PI in 1 ml deionisiertem Wasser.
- Herstellung der Sphäroid-Clearing-Lösung
- Bereiten Sie Clearing-Lösungen mit 20 %, 40 % und 80 % v/v Formamid in 1x PBS für die Sphäroid-Clearing-Lösung vor.
- Um 10 ml Formamid mit 20 % v/v herzustellen, mischen Sie 8 ml 1x PBS gefolgt von 2 ml Formamid. Um 10 ml Formamid mit 40 % v/v herzustellen, mischen Sie 6 ml 1x PBS gefolgt von 4 ml Formamid. Um 10 ml Formamid mit 80 % v/v herzustellen, mischen Sie 2 ml 1x PBS gefolgt von 8 ml Formamid.
- Nach dem Kombinieren von Formamid und 1x PBS die Lösung durch Vortexen für ca. 30 s mischen.
- Bereiten Sie Clearing-Lösungen mit 20 %, 40 % und 80 % v/v Formamid in 1x PBS für die Sphäroid-Clearing-Lösung vor.
2. Herstellung von quadratischen pyramidenförmigen Mikrotöpfen
- Stellen Sie eine negative PDMS-Form von quadratischen pyramidenförmigen Mikrotöpfen her, wie in Abbildung 1 gezeigt.
- Bereiten Sie 2 g (~1 ml) negative PDMS-Vorläuferlösung vor und gießen Sie sie in eine Vertiefung einer quadratischen pyramidenförmigen 6-Well-Urform. Beachten Sie, dass 1 ml eine Vertiefung der Platte vollständig bedeckt. Nachdem Sie die Urform mit PDMS abgedeckt haben, entgasen Sie die PDMS-Vorläuferlösung 30 Minuten lang, indem Sie die quadratische 6-Well-Pyramidenplatte in einen Vakuumexsikkator legen. Anschließend härten Sie das PDMS aus, indem Sie die Platte für 24 h in einen 60 °C-Ofen stellen.
Anmerkungen: Stellen Sie sicher, dass der Plattendeckel zum Entgasen entfernt und zum Aushärten wieder aufgesetzt wird. Entgasen Sie die Lösung in einem Vakuumexsikkator oder durch Spülen mit einem Inertgas wie Stickstoff oder Argon. Wenn die negative Formvorläuferlösung nach 30 Minuten immer noch Blasen aufweist, die auf eine unzureichende Entgasung hinweisen, stellen Sie sie für weitere 30 Minuten in einen Vakuum-Exsikkator. Verwenden Sie eine oder mehrere Plattenvertiefungen gleichzeitig, um eine oder mehrere PDMS-Negativformen vorzubereiten. Es können quadratische pyramidale Mikrovertiefungen unterschiedlicher Größe verwendet werden, z. B. 400 und 800 μm Seitenlängen, wie in Tabelle 1 dargestellt. Die gleiche Menge an PDMS wird unabhängig von den quadratischen Pyramidengrößen verwendet. - Sobald PDMS noch warm ausgehärtet ist, entfernen Sie die negative PDMS-Form vorsichtig mit einem Spatel aus der Urform und schneiden Sie die negative Form mit einem Biopsiestanzer in eine Platte mit einem Durchmesser von 35 mm. In eine Petrischale geben und mit dem Deckel abdecken und RT weitere 24 Stunden aushärten lassen.
Anmerkungen: Um Negativformen zu entfernen, verwenden Sie einen Spatel, um zwischen die Well-Platte und die PDMS-Form zu gelangen, und ziehen Sie die Negativform vorsichtig aus der Urform. Die Form wird in 35-mm-Platten geschnitten, um in eine 35-mm-Petrischale zu passen. Formen können in anderen Größen hergestellt werden, um Platten mit unterschiedlichen Durchmessern zu passen. Die 35 mm Negativplatten können bei RT staubgeschützt gelagert und 6 Monate lang wiederverwendet werden.
- Bereiten Sie 2 g (~1 ml) negative PDMS-Vorläuferlösung vor und gießen Sie sie in eine Vertiefung einer quadratischen pyramidenförmigen 6-Well-Urform. Beachten Sie, dass 1 ml eine Vertiefung der Platte vollständig bedeckt. Nachdem Sie die Urform mit PDMS abgedeckt haben, entgasen Sie die PDMS-Vorläuferlösung 30 Minuten lang, indem Sie die quadratische 6-Well-Pyramidenplatte in einen Vakuumexsikkator legen. Anschließend härten Sie das PDMS aus, indem Sie die Platte für 24 h in einen 60 °C-Ofen stellen.
- Bereiten Sie eine positive PDMS-Form von quadratischen pyramidenförmigen Mikrotöpfen vor.
- Legen Sie die 35-mm-Platten der Negativ-PDMS-Form mit den strukturierten Mikrowells nach oben in eine 35-mm-Petrischale.
- Bereiten Sie 2,5 g (~1,2 ml) positive PDMS-Vorläuferlösung wie oben vor und gießen Sie sie in die Negativform in der 35-mm-Petrischale, um die Negativform vollständig zu bedecken. Anschließend die Vorläuferlösung wie oben beschrieben 30 min entgasen und für 3-4 h in den 60 °C Ofen geben.
HINWEIS: Da PDMS viskos ist, kann sich aus Luft, die unter der Negativform eingeschlossen ist, eine Blase bilden. Wenn sich unter der Negativform eine Blase bildet, drücken Sie die Form vorsichtig mit einem Spatel nach unten, um die Blase zu lösen. Wenn Luftblasen zurückbleiben, entgasen Sie 30 Minuten lang oder nehmen Sie einen Spatel und rühren Sie die positive Formlösung vorsichtig um, bis die Blasen platzen. - Sobald die positive PDMS-Form ausgehärtet ist, entfernen Sie die Formen aus der 35-mm-Petrischale und ziehen Sie die positive Form sofort von der negativen Form ab.
HINWEIS: Das Timing ist wichtig für das erfolgreiche Abschälen der positiven Form. Das Entfernen erfolgt am besten, indem Sie mit einem Rasiermesser leicht in die positive Form schneiden, um die Schnittstelle zwischen der positiven und der negativen Form freizulegen, und die Formen voneinander abziehen. Ziehen Sie dann die Ränder der kreisförmigen Form ab. Ziehen Sie die Negativform vorsichtig von der Positivform ab.
- Kleben Sie die Formen auf den Boden der Vertiefungen einer 48-Well-Platte.
HINWEIS: Hier wird eine 48-Well-Platte verwendet, aber es können auch andere Platten verwendet werden, solange die Formplatten in die richtigen Durchmesser geschnitten werden (z. B. 6 mm Durchmesser für eine 96-Well-Platte).- Schneiden Sie die positiven Formen mit einem 10-mm-Biopsiestempel in Platten.
HINWEIS: Aus einer positiven Form mit 35 mm Durchmesser können ca. 4 Formen (jeweils 10 mm Durchmesser) geschnitten werden. - Um die Formen auf den Boden einer 48-Well-Platte zu kleben, bereiten Sie die PDMS-Klebervorläuferlösung (~0,5 ml oder 1 g) wie zuvor beschriebenvor 27. Tauchen Sie mit einer Pinzette die flache Seite (nicht die Seite mit dem Mikrowell-Muster) der 10-mm-Positivform vorsichtig in die PDMS-Vorläuferlösung. Setzen Sie vorsichtig eine Form pro Vertiefung einer 48-Well-Platte ein und drücken Sie jede Form vorsichtig mit der Pinzette auf den Well-Boden. Legen Sie die zusammengebaute Platte für 4-24 h in einen 60 °C-Ofen, damit der PDMS-Kleber aushärten kann.
HINWEIS: Wenn PDMS-Klebervorläuferlösung auf die Mikrovertiefungen der positiven Form gelangt, kann sie mit weichem Seidenpapier abgewischt und der Schritt wiederholt werden. Achten Sie beim Verkleben darauf, dass der Kleber die Mikrovertiefungen nicht bedeckt. - Sterilisieren Sie Formen, indem Sie mit einer 1000-μl-Pipette 300 μl 70 % Ethanol in jede Vertiefung der 48-Well-Platte geben. Aspirieren Sie das 70%ige Ethanol und legen Sie die 48-Well-Platte unbedeckt in eine Gewebekulturhaube unter UV (302 nm) für 2 h.
HINWEIS: Formen können 6 Monate lang verwendet und bei Bedarf erneut sterilisiert werden.
- Schneiden Sie die positiven Formen mit einem 10-mm-Biopsiestempel in Platten.
3. Bildung, Ernte und Verkapselung von mehrzelligen Tumorsphäroiden in Hydrogelen
HINWEIS: Das in diesem Abschnitt beschriebene Protokoll gilt für die humane U87-Glioblastom-Zelllinie (siehe Abbildung 1 und Abbildung 2), aber ein ähnliches Protokoll könnte auch bei anderen Krebszelltypen verwendet werden.
- Sphäroidbildung von mehrzelligen Tumoren
- Waschen Sie die Mikrotiterformen zuerst mit einer Anti-Adhärenz-Spüllösung, indem Sie 300 μl der Lösung mit einer 1000-μl-Pipette in jede Vertiefung geben. Dann 3 Minuten lang bei 1620 x g zentrifugieren und die Lösung mit einer Vakuumpumpe und einer Pasteurpipette absaugen.
HINWEIS: Führen Sie diesen Schritt unmittelbar vor dem Cell Seeding aus. - Die Zellen werden 5 Minuten lang bei 37 °C ~80 μl 0,25 % Trypsin/EDTA procm2 der Kulturkolbenfläche ausgesetzt. Beispielsweise ist 1 ml Trypsin/EDTA für einen T-25-Zellkulturkolben geeignet. Neutralisieren Sie das Trypsin, indem Sie das gleiche Volumen des vollständigen Zellkulturmediums hinzufügen. Geben Sie beispielsweise 1 ml vollständiges Medium in den trypsinhaltigen T-25-Zellkulturkolben. Sammeln Sie die Zellen aus dem Gewebekulturkolben.
- Übertragen Sie 10 μl der Zellsuspension zur Zellzählung in jeden Anschluss eines Hämozytometers. Verwenden Sie ein inverses Mikroskop, um die Gesamtzahl der Zellen zu zählen, und mitteln Sie diese Zellzahl aus mindestens 8 Quadranten, um sicherzustellen, dass die Zellzahl in jedem Hämozytometerquadranten 20-50 beträgt, um gute Zellzahlergebnisse zu erzielen. Multiplizieren Sie die berechnete Zahl mit 104 , um die endgültige Zellkonzentration zu bestimmen.
- Resuspendieren Sie die gesammelten Zellen in dem vollständigen RPMI-Zellkulturmedium, das mit 10 % fötalem Rinderserum und 1 % Penicillin/Streptomycin in einer gewünschten Endzellkonzentration ergänzt wird, abhängig von der gewünschten Sphäroidgröße, wie in Tabelle 1 dargestellt.
HINWEIS: Die 800-μm-Mikrowells ergeben ~75 Sphäroide in einem Well einer 48-Well-Platte, und die 400-μm-Mikrowells ergeben ~300 Sphäroide in einem Well einer 48-Well-Platte. - 500 μl Zellsuspension in der gewünschten Konzentration in Mikrowells geben und die Platte bei 1620 x g für 3 min zentrifugieren. Die Platte wird 24 h lang bei 37 °C und 5 % CO2 in einen befeuchteten Inkubator gestellt, damit sich Sphäroide bilden können.
HINWEIS: Wenn sich keine Sphäroide bilden, können 2 % v/v der Basalmembranmatrix in Kombination mit vollständigen Medien zur Resuspendierung von Zellen verwendet werden (weitere Details in Schritt 1.5).
- Waschen Sie die Mikrotiterformen zuerst mit einer Anti-Adhärenz-Spüllösung, indem Sie 300 μl der Lösung mit einer 1000-μl-Pipette in jede Vertiefung geben. Dann 3 Minuten lang bei 1620 x g zentrifugieren und die Lösung mit einer Vakuumpumpe und einer Pasteurpipette absaugen.
- Sphäroide Ernte
- Mit einer 1000-μl-Pipette 500 μl des gesamten Mediums fest in die Vertiefung pipettieren. Spülen Sie mit 500 μl Medium aus der Vertiefung die vier Quadranten der Vertiefung (insbesondere den oberen, unteren, linken und rechten Quadranten), indem Sie drei- bis viermal an den Quadranten auf und ab pipettieren, um die Sphäroide zu entfernen. Das Medium, das die Sphäroide enthält (~1000 μl insgesamt), wird mit einer 1000-μl-Pipette vorsichtig in ein Mikrozentrifugenröhrchen abgesaugt und die Sphäroide am Boden abgesetzt.
- Entfernen Sie den Überstand und resuspendieren Sie die Sphäroide auf die gewünschte Endkonzentration. Um beispielsweise nach der Verkapselung ~8 Sphäroide in einem 20-μl-Gel zu erreichen, resuspendieren Sie die Sphäroide in 100 μl Medien, was eine Sphäroidkonzentration von ~75 Sphäroiden/100 μl in der Sphäroidsuspension ergibt.
- Verkapselung von Sphäroiden in Hydrogelen, wie in Abbildung 2 gezeigt.
- Um 100 μl einer 10%igen PEG-Hydrogel-Vorläuferlösung herzustellen, kombinieren Sie 50 μl der Sphäroidsuspension, gefolgt von 30 μl 20% w/v 4-armigem PEG-Ac und schließlich 20 μl 20% w/v PEG-diSH in einem Mikrozentrifugenröhrchen. Dadurch ergibt sich ein stochiometrisches molares Verhältnis von Acrylat- (Ac) zu Thiol- (SH)-Gruppen, das eine optimale Vernetzung gewährleistet. Mischen Sie die Gelvorläuferlösung, indem Sie ~10 Mal auf und ab pipettieren.
HINWEIS: Die Zusammensetzung, das Volumen und die Polymerkonzertierung des Hydrogels können nach Bedarf geändert werden. Die resultierenden Hydrogele werden langsam abgebaut und nicht zelladhäsiv. Um die Hydrogelzelle adhäsiv zu machen, kann ein adhäsiver Ligand wie RGDS hinzugefügt werden. Um das Hydrogel enzymatisch abbaubar zu machen, könnte ein enzymatisch abbaubarer Peptidvernetzer hinzugefügt werden, der an beiden Enden Cysteinreste enthält. Wenn Sie Sphäroide übertragen, pipettieren Sie die Lösung vorsichtig zweimal, um Sphäroide zu entfernen, und bringen Sie sie in Suspension, um eine gleichmäßige Verteilung der Sphäroide zu gewährleisten. - Pipettieren Sie 20 μl der Gel-Vorläuferlösung zwischen zwei mit Parafilm ausgekleideten Glasobjektträgern, die mit 1 mm Silizium-Spacern getrennt sind, und legen Sie die Objektträger mit Gel-Vorläuferlösung 15 Minuten lang in einen 37 °C, 5 % CO2 -Inkubator, um die Gelierung zu ermöglichen.
HINWEIS: Stellen Sie sicher, dass die beiden Glasobjektträger mit Parafilm bedeckt sind, um eine hydrophobe Oberfläche zu schaffen, die ein einfaches Abziehen nach der Gelierung ermöglicht. Anstelle von Parafilm kann eine hydrophobe Beschichtungslösung verwendet werden. Ein Volumen von 20 μl Hydrogel-Vorläuferlösung führt zu einer Hydrogelplatte mit einem Durchmesser von ~6 mm und einer Höhe von 1 mm vor der Schwellung. Es kann jeder Spacer-Typ und jede Dicke verwendet werden, aber es wird empfohlen, die Geldicke bei oder unter 1 mm zu halten (dickere Hydrogele könnten die Sauerstoffdiffusion und den Transport von Nährstoffen zu den Zellen begrenzen), aber größer als der Sphäroiddurchmesser (so dass Sphäroide vollständig im Gel eingekapselt sind). Es kann ein beliebiges Volumen der Hydrogel-Vorläuferlösung verwendet werden. Die 20-30 μl Gele sind für eine 24-Well-Platte geeignet. - Sobald die Hydrogel-Gelierung abgeschlossen ist, trennen Sie die beiden Objektträger und ziehen Sie die Gele vorsichtig mit einem Spatel von der Glasplatte ab. Legen Sie die Gele in eine 24-Well-Platte, eines pro Well, und stellen Sie sicher, dass die Oberfläche mit den Sphäroiden nach oben zeigt.
HINWEIS: Sphäroide fallen während der Gelierung auf den Boden des Gels, so dass das Umdrehen für die Kultivierung sicherstellt, dass sich die Sphäroide in der Nähe der Oberfläche des Hydrogels befinden, um einen besseren Zugang zu Nährstoffen und Sauerstoff zu erhalten. Die Gelierung kann überwacht werden, indem jede Hydrogel-Vorläuferlösung beobachtet wird, die im Mikrozentrifugenröhrchen verbleibt und nicht zur Herstellung von Platten verwendet wird, indem das Röhrchen umgedreht und die Zeit notiert wird, in der das Gel aufhört zu fließen. - Geben Sie das vollständige Medium (~500 μl) in jede Vertiefung und stellen Sie sicher, dass das Hydrogel vollständig eingetaucht ist. Legen Sie die Multiwell-Platte bei 37 °C und 5 % CO2 in einen befeuchteten Inkubator und kultivieren Sie die Zellen alle 2-3 Tage mit dem Mediumwechsel.
HINWEIS: Hydrogele können bis zu 4 Wochen lang kultiviert werden oder bis die Hydrogele abgebaut sind, wobei das Medium jeden zweiten Tag gewechselt wird.
- Um 100 μl einer 10%igen PEG-Hydrogel-Vorläuferlösung herzustellen, kombinieren Sie 50 μl der Sphäroidsuspension, gefolgt von 30 μl 20% w/v 4-armigem PEG-Ac und schließlich 20 μl 20% w/v PEG-diSH in einem Mikrozentrifugenröhrchen. Dadurch ergibt sich ein stochiometrisches molares Verhältnis von Acrylat- (Ac) zu Thiol- (SH)-Gruppen, das eine optimale Vernetzung gewährleistet. Mischen Sie die Gelvorläuferlösung, indem Sie ~10 Mal auf und ab pipettieren.
4. Fluoreszenzfärbung
- Zellviabilität
- Verwenden Sie den Farbstoff 3,3'-Dihexyloxacarbocyaniniodid (DiOC), der die Mitochondrien und das endoplasmatische Retikulum aller Zellen färbt, um die Lebensfähigkeit der Zellen zu bestimmen. Verwenden Sie DiOC (3 mM) in einer Konzentration von 0,02 μg/ml. Insbesondere wird mit einer 20-μl-Pipette 2 μl DiOC pro 1000 μl Medium in den Kolben gegeben, in dem die dissoziierten Zellen kultiviert werden (mindestens 24 Stunden vor dem Bildungsprozess der Sphäroide in Abschnitt 3). Warten Sie 24 Stunden, bis das DiOC die Zellen gefärbt hat.
- Verwenden Sie die Kern- und Chromosomenfärbung Propidiumiodid, PI (1,50 mM), die nur in tote Zellen eindringt. Um die Zellen zu färben, saugen Sie zuerst alle Medien an und spülen Sie das Gel mit einer 1000-μl-Pipette aus, um 500 μl 1x PBS hinzuzufügen, damit das Gel vollständig eingetaucht ist.
- Aspirieren Sie das PBS und fügen Sie 500 μl frisches Medium hinzu, gefolgt von 30 μl der PI-Lösung in jede Vertiefung (d. h. 6 μl pro 100 μl Medien). Decken Sie die Well-Platte mit Alufolie ab, um sie vor Licht zu schützen. Legen Sie die Well-Platte bei 37 °C und 5 % CO2 in einen Inkubator und lassen Sie den PI 30 Minuten lang die abgestorbenen Zellen färben.
- Entfernen Sie die Folie und saugen Sie das Medium aus den Vertiefungen ab. Verwenden Sie eine 1000-μl-Pipette, um 500 μl 1x PBS hinzuzufügen, um das Hydrogel einzutauchen. Saugen Sie das 1x PBS an und wiederholen Sie das Spülen zwei weitere Male. Geben Sie 500 μl Medium in jedes Well und nehmen Sie es unter einem inversen oder konfokalen Fluoreszenzmikroskop auf.
- Berechnen Sie die Zellviabilität, indem Sie die Fläche von DiOC (alle Zellen) mit PI (tote Zellen) vergleichen, wie in Gleichung 1 dargestellt, unter Verwendung von Z-Stapel-Bildern eines konfokalen Mikroskops oder eines inversen Fluoreszenzmikroskops.
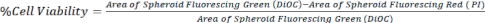 Gl. 1.
Gl. 1.
5. Immunfluoreszenzfixierung, Färbung, Reinigung und Bildgebung von verkapselten Sphäroiden
- Fixierung und Färbung
- Saugen Sie das Medium aus den Vertiefungen an, in denen die Hydrogele kultiviert werden, und spülen Sie die Hydrogele, indem Sie 500 μl 1x PBS direkt auf die Hydrogele pipettieren. Saugen Sie das 1x PBS vorsichtig an.
- Fixieren Sie die Sphäroide in der 24-Well-Platte, indem Sie eine 1000-μl-Pipette verwenden, um 500 μl Volumen Fixierlösung pro Well hinzuzufügen. Lassen Sie das Fixiermittel die Gele 30 Minuten lang bei RT einweichen. Entfernen Sie die Fixierlösung mit einer 1000-μl-Pipette und entsorgen Sie sie in einem dafür vorgesehenen Abfallbehälter.
- Spülen Sie die Hydrogele, indem Sie 500 μl 1x PBS in jede Vertiefung geben. Aspirieren Sie das 1x PBS mit einer 1000-μl-Pipette und wiederholen Sie die PBS-Spülung zwei weitere Male. Lagern Sie die Well-Platte in 500 μl 1x PBS pro Well bei 4 °C für bis zu 1 Woche oder verwenden Sie sie sofort.
HINWEIS: Achten Sie darauf, die Hydrogele nicht in die Pipette zu ziehen, wenn Sie PBS und Fixierlösung absaugen. Kippen Sie dazu die Platte in einen Winkel von ~45 Grad, um die Hydrogele zu sehen und ein versehentliches Ansaugen zu verhindern.
ACHTUNG: Formaldehyd ist giftig beim Einatmen und bei Kontakt. Griff mit Handschuhen in einen chemischen Abzug. - Um die Zellen zu färben, inkubieren Sie die Hydrogel-verkapselten Sphäroide mit Primärantikörpern für Nestin (200 μg/ml) und SOX2 (200 μg/ml) in einer Verdünnung von 1:200 Antikörper: PBS. Verwenden Sie eine 1000-μl-Pipette, um das 1x PBS aus den Wells abzusaugen. Geben Sie 50 μl des verdünnten Antikörpers in jede Vertiefung. Warten Sie 24 Stunden, bis die Färbung abgeschlossen ist. Entfernen Sie dann die Färbelösung mit einer 1000-μl-Pipette und entsorgen Sie den Abfall entsprechend.
- Verwenden Sie eine 1000-μl-Pipette, um 500 μl 1xPBS hinzuzufügen, was ausreicht, um das Hydrogel einzutauchen. Saugen Sie das PBS an und wiederholen Sie es noch zweimal. Lagern Sie das gefärbte und getauchte Hydrogel in 1x PBS bei 4 °C bis zu 2 Wochen vor der Bildgebung oder dem sofortigen Bild.
HINWEIS: Je nach Antikörper können kleinere Optimierungen erforderlich sein, um eine ordnungsgemäße Färbung zu gewährleisten. Die Konzentration (1:200) und die Zeit (24 h) sind deutlich höher als bei typischen 2D-Monolayer-Zellkulturen, da die 3D-Färbung eine Diffusion durch das Hydrogel und die Sphäroide erfordert.
- Reinigen Sie nach dem Färben der Sphäroide das Sphäroid, um die Transparenz für die Bildgebung zu verbessern, indem Sie PBS durch eine sequentielle Konzentrationserhöhung von Formamid ersetzen (optional).
- Saugen Sie die 1x PBS aus jeder Vertiefung an. Geben Sie 500 μl 20% (v/v) Formamid in jede Vertiefung und lassen Sie das Hydrogel 90 Minuten lang inkubieren. Aspirieren Sie das Formamid mit einer 1000-μl-Pipette und sammeln Sie den Abfall in einem Abfallbehälter.
- Geben Sie 500 μl 40% (v/v) Formamid in die Vertiefung. Lassen Sie das Hydrogel 90 Minuten in der Lösung inkubieren. Saugen Sie das Formamid an und sammeln Sie den Abfall im Abfallbehälter.
- Geben Sie 500 μl 80% v/v Formamid in jede Vertiefung und inkubieren Sie 90 Minuten lang. Formamid absaugen und im Abfallbehälter entsorgen. Fügen Sie 500 μl 100% (v/v) Formamid hinzu und lassen Sie eine 24-stündige Inkubation vor der Bildgebung zu. Wenn die Räumung abgeschlossen ist, entsorgen Sie Formamidabfälle ordnungsgemäß über die entsprechenden Dienste eines Laborabfallmanagementsystems.
HINWEIS: Das Clearing ermöglicht eine konfokale Bildgebung in den Kern des Sphäroids und ist optional, wenn nur die Peripherie des Sphäroids untersucht wird.
- Bildgebung von Hydrogel-verkapselten Sphäroiden mittels konfokaler Mikroskopie.
HINWEIS: Jedes Mikroskop - invers, fluoreszierend oder konfokal - kann für die Zellbildgebung verwendet werden. konfokal ermöglicht jedoch die Isolierung einzelner Ebenen.- Legen Sie die Hydrogele in gekammerte Vertiefungen mit Glasdeckglasböden und positionieren Sie die Sphäroide so nah wie möglich am Deckglas.
HINWEIS: Es können Glasdeckgläser oder Kammermulden mit Glasdeckglasböden verwendet werden. Es ist wichtig, Hydrogele hydratisiert zu halten, da dehydrierte Proben zu einer schlechten Bildqualität führen. - Bilden Sie die Proben mit einem Objektiv mit großem Arbeitsabstand (10x-20x) ab, um eine Abbildung tief in das Sphäroid mit Z-Stapeln für 3D-Rekonstruktionen zu ermöglichen.
HINWEIS: Objektive mit höherer Vergrößerung ermöglichen eine detailliertere Bildgebung und optische Schnitte, beeinträchtigen jedoch die Bildtiefe. - Quantifizieren Sie die im optischen Abschnitt vorhandene Signalmenge im Verhältnis zur Gesamtfläche des Sphäroids sowohl für das gelöschte als auch für das nicht gelöschte Signal unter Verwendung von Gleichung 2.
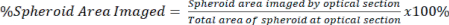 Gl. 2
Gl. 2
- Legen Sie die Hydrogele in gekammerte Vertiefungen mit Glasdeckglasböden und positionieren Sie die Sphäroide so nah wie möglich am Deckglas.
Ergebnisse
Sphäroidbasierte Wirkstoff-Screening-Plattformen zur Untersuchung chemotherapeutischer Wirkungen werden zunehmend nachgefragt, da der Schwerpunkt auf der Modulation der Tumormikroumgebung bei der Sphäroidverkapselung in Biomaterialien liegt, die natives Gewebe replizieren. Hier haben wir eine Methode zur multizellulären Tumorsphäroidpräparation und anschließenden Verkapselung und Bildgebung in einem 3D-Hydrogel entwickelt. Die Sphäroide werden in Mikrotiterformen hergestellt (Abbildung 3A
Diskussion
Hydrogel-basierte multizelluläre Tumor-Sphäroidmodelle werden zunehmend entwickelt, um die Entdeckungen der Krebstherapie voranzutreiben 11,13,29. Sie sind vorteilhaft, weil sie Schlüsselparameter der Tumormikroumgebung auf kontrollierte Weise emulieren und trotz ihrer Komplexität einfacher und kostengünstiger zu verwenden sind als In-vivo-Modelle, und viele sind mit Hochdurchsatz-Screening-Technologien kompatibel. Die Hydr...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch Startkapital finanziert, das Dr. Silviya P. Zustiak von der Saint Louis University zur Verfügung gestellt wurde, sowie durch ein Anschubstipendium des Henry and Amelia Nasrallah Center for Neuroscience an der Saint Louis University, das Dr. Silviya P. Zustiak gewährt wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| 70% Ethanol | Fisher Scientific | LC22210-4 | |
| 15 mL Conicals | FALCON | 352097 | |
| 24-Well Plate Ultra Low Attachment plates | Fisher Scientific | 07-200-602 | |
| 35 mm Petri Dish | Amazon | 706011 | |
| 4-arm poly(ethylene glycol)-acrylate (4-arm PEG-Ac; 10 kDa) | Laysan Bio | ACRL-PEG-ACRL-10K-5g | |
| 50 mL Conicals | Fisher Scinetific | 3181345107 | |
| 6-well AggreWell 400 | StemCell Technologies, Vancouver, Canada | 34421 | Square pyramidal microwells |
| anti-adherence rinsing solution | StemCell Technologies, Vancouver, Canada | Cat #: 07010 | |
| Aspartic Acid-Arginine-Cysteine-Glycine-Valine-Proline-Methionine-Serine-Methionine-Arginine-Glycine-Cysteine-Arginine- Aspartic Acid (DRCG-VPMSMR-GCRD) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Chemical Fume Hood | KEWAUNEE | 99151 | |
| Corning Matrigel Basement Membrane Matrix, LDEV Free | Corning | 356234 | Basement membrane matrix |
| Detergent - Triton-X | Sigma Aldrich | T8787 | Nonionic surfactant |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | BP231-100 | |
| Disposable Pipettes (1 mL, 2 mL, 5 mL, 10 mL, 25 mL, 50 mL) | Fisher Scinetific | 1 mL: 13-678-11B, 2mL: 05214038, 5mL(FALCON): 357529, 10mL: 13-678-11E, 25mL: 13-678-11, 50mL: 13-678-11F | |
| Fetal Bovine Serum | HyClone | SH30073-03 | |
| Formaldehyde 37% Solution | Sigma Aldrich | F1635 | |
| Glass Plates | Slumpys | GBS4100SFSL | |
| Glass Transfer Pipettes | Fisher Scinetific | 5 3/4": 1367820A, 9":136786B | |
| Glycine-Arginine-Cysteine-Aspartic Acid-Arginine-Glycine-Aspartic Acid-Serine (GRCD-RGDS) peptide | Genic Bio, Shanghai, China | n/a | Custom synthesis |
| Hemacytometer | Bright-Line | 383684 | |
| Hydrophobic solution - Repel Silane | GE Healthcare Bio-Sciences | 17-1332-01 | |
| Incubator | NUAIRE | NU-8500 | |
| Inverted Microscope (Axiovert 25) | Zeiss | 663526 | |
| Invitrogen DiOC16(3) (3,3'-Dihexadecyloxacarbocyanine Perchlorate) | Fisher Scientific | D1125 | |
| Leica Confocal SP8 | Leica Microsystems Inc. | ||
| Light and Flourescent Microscope (Axiovert 200M) | Zeiss | 3820005619 | |
| Micro centrifuge tubes | Fisher Scientific | 2 mL: 02681258 | |
| Microscope Software | Zeiss | AxioVision Rel. 4.8.2 | |
| Nestin Alexa Fluor 594 | Santa Cruz Biotechnology | sc-23927 | |
| Parafilm | PARAFILM | PM992 | |
| PBS (1x), pH 7.4 | HyClone | SH30256.01 | |
| Penicillin Streptomycin | MP Biomedicals | 1670046 | |
| Pipette Aid | Drummond Scientific Co. | P-76864 | |
| Pipette Tips (1–200 µL, 101–1000 µL) | Fisher Scinetific | 2707509 | |
| Plastic Standard Disposable Transfer Pipettes | Fisher Scientific | 13-711-9D | |
| Plastic Weigh Boats (100 mL) | Amazon | mdo-azoc-1030 | |
| poly(ethylene glycol)-dithiol (PEG-diSH; 3.4 kDa) | Laysan Bio | SH-PEG-SH-3400-5g | |
| Polydimehylsiloxane (PDMS) [Slygard 182 Elastomer Kit] | Elsworth Adhesives | 3097358-1004 | Polydimethylsiloxane |
| Powder Free Examination Gloves | Quest | 92897 | |
| Propidium iodide, 1 mg/mL aqueous soln. | Fisher Scientific | AAJ66584AB | |
| RPMI-1640 Medium (1x) | HyClone | SH30027-02 | |
| Silicone spacers - Silicone sheet, 0.5 mm thick/13 cm x 18 cm | Grace Bio-Labs | JTR-S-0.5 | |
| SOX2 Alexa Fluor 488 | Santa Cruz Biotechnology | sc-365823 | |
| Tissue Culture Hood | NUAIRE | NU-425-600 | |
| Triethanolamine, ≥99.0% (GC) | Sigma Aldrich | 90279 | |
| U-87 MG human glioblastoma cells | American Type Culture Collection | HTB-14 |
Referenzen
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Costa, E. C., de Melo-Diogo, D., Moreira, A. F., Carvalho, M. P., Correia, I. J. Spheroids formation on non-adhesive surfaces by liquid overlay technique: Considerations and practical approaches. Biotechnology Journal. 13 (1), 1700417 (2018).
- Li, Y., Kumacheva, E. Hydrogel microenvironments for cancer spheroid growth and drug screening. Science Advances. 4 (4), eaas8998 (2018).
- Kamatar, A., Gunay, G., Acar, H. Natural and synthetic biomaterials for engineering multicellular tumor spheroids. Polymers. 12 (11), 2506 (2020).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular Pharmaceutics. 11 (7), 2115-2125 (2014).
- Nakod, P. S., Kim, Y., Rao, S. S. Three-dimensional biomimetic hyaluronic acid hydrogels to investigate glioblastoma stem cell behaviors. Biotechnology and Bioengineering. 117 (2), 511-522 (2020).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85, 128-146 (2020).
- Pedron, S., et al. Hyaluronic acid-functionalized gelatin hydrogels reveal extracellular matrix signals temper the efficacy of erlotinib against patient-derived glioblastoma specimens. Biomaterials. 219, 119371 (2019).
- Hill, L., Bruns, J., Zustiak, S. P. Hydrogel matrix presence and composition influence drug responses of encapsulated glioblastoma spheroids. Acta Biomaterialia. 132, 437-447 (2021).
- Chen, J. -. W. E., et al. Crosstalk between microglia and patient-derived glioblastoma cells inhibit invasion in a three-dimensional gelatin hydrogel model. Journal of Neuroinflammation. 17 (1), 346 (2020).
- Thakuri, P. S., Liu, C., Luker, G. D., Tavana, H. Biomaterials-based approaches to tumor spheroid and organoid modeling. Advanced Healthcare Materials. 7 (6), 1700980 (2018).
- Shin, S., et al. Alginate-marine collagen-agarose composite hydrogels as matrices for biomimetic 3D cell spheroid formation. RSC Advances. 6 (52), 46952-46965 (2016).
- Pradhan, S., Clary, J. M., Seliktar, D., Lipke, E. A. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 115, 141-154 (2017).
- Imaninezhad, M., Hill, L., Kolar, G., Vogt, K., Zustiak, S. P. Templated macroporous polyethylene glycol hydrogels for spheroid and aggregate cell culture. Bioconjugate Chemistry. 30 (1), 34-46 (2018).
- Mirab, F., Kang, Y. J., Majd, S. Preparation and characterization of size-controlled glioma spheroids using agarose hydrogel microwells. PLoS One. 14 (1), e0211078 (2019).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments: JoVE. 81, e50665 (2013).
- Timmins, N. E., Nielsen, L. K., Hauser, H., Fussenegger, M. . Generation of Multicellular Tumor Spheroids by the Hanging-Drop Method. 140, (2007).
- Zhao, L., et al. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Scientific Reports. 9 (1), 19717 (2019).
- Amaral, R. L., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Gencoglu, M. F., et al. Comparative study of multicellular tumor spheroid formation methods and implications for drug screening. ACS Biomaterials Science & Engineering. 4 (2), 410-420 (2018).
- Zhang, C., Liu, C., Zhao, H. Mechanical properties of brain tissue based on microstructure. Journal of the Mechanical Behavior of Biomedical Materials. 126, 104924 (2021).
- Alifieris, C., Trafalis, D. T. Glioblastoma multiforme: Pathogenesis and treatment. Pharmacology & Therapeutics. 152, 63-82 (2015).
- Zustiak, S. P., Leach, J. B. Hydrolytically degradable poly (ethylene glycol) hydrogel scaffolds with tunable degradation and mechanical properties. Biomacromolecules. 11 (5), 1348-1357 (2010).
- Zustiak, S. P., Wei, Y., Leach, J. B. Protein-hydrogel interactions in tissue engineering: Mechanisms and applications. Tissue Engineering Part B: Reviews. 19 (2), 160-171 (2013).
- Kroger, S. M., et al. Design of hydrolytically degradable polyethylene glycol crosslinkers for facile control of hydrogel degradation. Macromolecular Bioscience. 20 (10), 2000085 (2020).
- Raeber, G., Lutolf, M., Hubbell, J. Molecularly engineered PEG hydrogels: a novel model system for proteolytically mediated cell migration. Biophysical Journal. 89 (2), 1374-1388 (2005).
- Bruns, J., Egan, T., Mercier, P., Zustiak, S. P. Glioblastoma spheroid growth and chemotherapeutic responses in single and dual-stiffness hydrogels. Acta Biomaterialia. 163, 400-414 (2023).
- Kuwajima, T., et al. ClearT: a detergent-and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Holt, S. E., Ward, E. S., Ober, R. J., Alge, D. L. Shooting for the moon: using tissue-mimetic hydrogels to gain new insight on cancer biology and screen therapeutics. MRS Communications. 7 (3), 427-441 (2017).
- Jain, E., Scott, K. M., Zustiak, S. P., Sell, S. A. Fabrication of polyethylene glycol-based hydrogel microspheres through electrospraying. Macromolecular Materials and Engineering. 300 (8), 823-835 (2015).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948 (2016).
- Lee, K. -. H., Kim, T. -. H. Recent advances in multicellular tumor spheroid generation for drug screening. Biosensors. 11 (11), 445 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten