需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基于气相色谱-质谱的硬珊瑚样品靶向代谢组学研究
摘要
在这里,我们介绍了从珊瑚全生物中提取和制备极性和半极性代谢物,以及分离的珊瑚宿主组织和共生菌科细胞组分,用于气相色谱-质谱分析。
摘要
基于气相色谱-质谱(GC-MS)的方法已被证明在阐明刺胞动物-甲藻共生的代谢基础以及珊瑚如何对压力做出反应(即在温度诱导的漂白过程中)方面非常有效。珊瑚全息的稳态代谢物分析,包括刺胞动物宿主及其相关微生物(共生菌科和其他原生生物、细菌、古细菌、真菌和病毒),已成功应用于环境和压力条件下,以表征珊瑚的整体代谢状态。
然而,要回答围绕共生相互作用的问题,有必要独立分析珊瑚宿主及其藻类共生体的代谢物谱,这只能通过对组织进行物理分离和分离,然后进行独立的提取和分析来实现。虽然代谢组学的应用在珊瑚领域相对较新,但研究小组的持续努力已经开发出分析珊瑚中代谢物的可靠方法,包括珊瑚宿主组织和藻类共生体的分离。
本文介绍了用于GC-MS分析的全生物分离和代谢物提取的分步指南,包括需要考虑的关键优化步骤。我们证明了,一旦独立分析,两个部分(珊瑚和共生菌科)的组合代谢物谱如何与整体(holobiont)的图谱相似,但通过分离组织,我们还可以获得有关两个伴侣之间的代谢和相互作用的关键信息,这些信息无法单独从整体中获得。
引言
代谢物代表细胞过程的最终产物,代谢组学 - 研究给定生物体或生态系统产生的一系列代谢物 - 可以提供生物体功能的直接测量1.这对于探索生态系统、共生相互作用和恢复工具尤为重要,因为大多数管理战略的目标是保护(或恢复)特定的生态系统服务功能2。珊瑚礁是一种水生生态系统,它证明了代谢组学在阐明共生相互作用以及将珊瑚生理反应与群落水平和生态系统水平影响联系起来方面的潜在价值3.高通量气相色谱-质谱联用 (GC-MS) 的应用尤其受到重视,因为它能够以高选择性和灵敏度同时快速分析多种代谢物类别,在光谱库可用时提供快速化合物鉴定,并提供高水平的重现性和准确性,每个样品的成本相对较低。
珊瑚是由珊瑚动物、光合甲藻内共生体(科:共生虫科4)和复杂的微生物组 5,6 组成的全生物体。总体而言,全息生物的适应性主要通过小分子和元素的交换来维持,以支持每个成员的代谢功能7,8,9,10。代谢组学方法已被证明在阐明共生特异性的代谢基础方面特别有效 9,11、对热应激的漂白反应7、8、12、13、疾病反应 14、污染暴露反应15、光适应 16 和珊瑚中的化学信号传导 17,以及帮助生物标志物发现 18,19.此外,代谢组学可以为从基于DNA和RNA的技术推断的结论提供有价值的确认9,20。因此,使用代谢组学来评估珊瑚礁健康和开发珊瑚礁保护工具具有相当大的潜力3,例如通过检测压力的代谢生物标志物18,19 和研究营养补贴等积极管理策略的潜力21.
分离宿主细胞和共生体细胞并独立分析其代谢物谱,而不是作为全生物一起分析,可以产生更多关于伴侣相互作用、独立生理和代谢状态以及潜在的适应分子机制的信息11,12,22,23,24.如果不分离珊瑚和共生鞭毛虫科,几乎不可能独立阐明珊瑚和/或共生菌科的贡献和代谢,除了复杂的基因组重建和代谢建模25,但这尚未应用于珊瑚-甲藻共生。此外,试图从全生物体的代谢物谱中提取有关宿主或藻类共生体个体代谢的信息可能会导致误解。
例如,直到最近,珊瑚和全生物组织的提取物中存在的 C18:3n-6、C18:4n-3 和 C16 多不饱和脂肪酸被认为是来自藻类共生体,因为珊瑚被认为不具有产生 omega-3 (ω3) 脂肪酸所必需的 ωx 去饱和酶;然而,最近的基因组证据表明,多个刺胞动物有能力从头产生ω3 PUFA,并进一步生物合成ω3长链PUFA26。将 GC-MS 与稳定同位素标记(例如,13C-碳酸氢盐、NaH13CO3)相结合,可用于在控制条件下和响应外部压力源的情况下通过珊瑚全生物代谢网络跟踪光合固定碳的命运27,28。然而,追踪 13C 命运的一个关键步骤是将珊瑚组织与藻类细胞分离——只有这样,珊瑚宿主部分中 13C 标记化合物的存在才能被明确地指定为共生菌科衍生的代谢物易位到珊瑚或易位标记化合物的下游产物。该技术通过挑战长期以来的假设,即甘油是光合作用从共生体转移到宿主的主要形式 29,以及阐明漂白过程中伴侣间营养通量如何变化27,28 和响应不相容的共生菌科物种11,证明了其力量。
虽然分离组织的决定主要由研究问题驱动,但这种方法的实用性、可靠性和潜在的代谢影响是需要考虑的重要因素。在这里,我们提供了详细的、演示的方法,用于从全生物中提取代谢物,以及单独的宿主和共生体部分。我们独立比较宿主和共生体的代谢物谱,以及这些谱与全息代谢物谱的比较。
Access restricted. Please log in or start a trial to view this content.
研究方案
注:实验设计、样品收集和储存已在别处详细描述2,30,31。在收集和实验之前,必须获得收集野生珊瑚的许可批准。这里的样本是从巴达维亚珊瑚养殖场(华盛顿州杰拉尔顿)进口的Montipora mollis(绿色形态)群落中采集的,最初是从阿布罗洛斯群岛(西澳大利亚州;28°52'43.3"S 114°00'17.0"E)附近的一个珊瑚礁中采集的,深度为1米,根据水产养殖许可证AQ1643。在取样之前,将菌落保持在35 PSU的800 L水族箱中,在150 μmol光子·m−2·s−1的蓝光和白光下,在25 °C±0.5 °C下保存3个月。将珊瑚碎片(~5 cm2,N = 6)在液氮中快速冷冻并储存在-80°C直至处理。
1. 提取液和设备的制备
- 至少在去除珊瑚组织前 1 天,准备提取溶液和设备。
- 在4°C的清洁,无洗涤剂的玻璃器皿中预冷超纯水。
- 将 100% LC 级甲醇与终浓度为 10 μg·mL−1 的适当内标(例如 13C6 山梨糖醇)混合。
- 使用一半 100% LC 级甲醇和一半超纯水制备 50% 甲醇萃取溶液。将两种甲醇溶液储存在-20°C。
注意:为了帮助防止代谢物降解,建议一次分批执行五个珊瑚碎片的样品处理步骤,并增加一个生物(仅水)空白(总样品N = 6)。一旦每个珊瑚样品被分成两个部分(珊瑚宿主组织,以下简称"宿主",和微藻细胞,以下简称"共生体"),一个处理批次中的样品总数将为 12 个。
2.珊瑚新陈代谢淬灭
注:实验设计、样品收集和储存已在别处详细描述2,30,31。然而,应该注意的是,淬灭新陈代谢所需的时间(即,珊瑚样本收集和保存之间的时间)对于捕获原始反应30至关重要。收集后尽快保存样品,以防止由于样品降解或非靶标生理反应而导致代谢物组成发生变化32.
- 将珊瑚碎片放入无菌样本收集袋中,并尽可能排出多余的海水。将样品浸入液氮中至少30秒。尽快将样品移至-80°C冰箱中储存。
注意:样品可以在 −80°C 的遮光容器中冷冻,直到处理,避免冻融循环。
3.从骨骼中去除珊瑚组织
注意:样品应始终保持在冰(4°C)上,以确保它们同时处于液体形式,同时防止正在进行的代谢。
- 将一个干净、无菌的样本收集袋放在冰上,使袋子稳定并打开在浅井的冰上,但不要浸入冰中。向袋子中加入10 mL冷(4°C)超纯水。
注意: 这将有助于避免由于冷加压空气和周围冰层而导致珊瑚碎片反复冻融。 - 用灭菌镊子选择珊瑚碎片,并使用无菌巴斯德移液管用冷(4°C)超纯水冲洗,直到没有海水残留物。将冲洗过的珊瑚碎片浸入装有 10 mL 超纯水的袋子中。
注意:这种冲洗对于去除任何会干扰下游分析的残留盐分至关重要。避免通过袋子与水或珊瑚碎片接触,以将样品保持在4°C。 - 用电工胶带将无菌的 1 mL 移液器吸头粘在气枪的末端,将吸头末端切掉 ~5 mm(图 1A)。
- 将气枪对准珊瑚碎片,袋子半密封,气流偏低中,通过鼓励水在珊瑚碎片上打圈运动来轻轻去除组织。
- ~3 分钟后,或当所有组织似乎都已从骨架上移除时,关闭空气,并取出喷枪。完全密封袋子。
- 将所有去除的珊瑚组织挤压到袋子的底角。切掉对面的一角,轻轻地将袋子的内容物倒入冰上的 15 mL 试管中。
4.可选均质化
注意:有些珊瑚物种比其他珊瑚物种更粘稠,这意味着喷枪会以团块而不是泥浆的形式去除组织。如果在喷枪匀浆中可见组织团块,则可以在4°C下为所有样品添加均质化步骤。
- 用4°C,70%甲醇清洁机械锯齿均质器两次,最后用4°C超纯水清洁。
- 将珊瑚样品在 15 mL 试管中匀浆 ~1 分钟,直到样品完全匀浆并且看不到团块。
- 按照步骤4.1在每个样品之间清洁均质器。保持样品间均质化时间一致。
5. 样本采集进行归一化
- 从匀浆组织中收集 1,000 μL 等分试样,用于 Symbiodiniaceae 细胞计数、珊瑚宿主组织蛋白质含量分析和叶绿素 a 估计。储存在-20°C直至准备分析(第10节)。
6.可选珊瑚宿主组织-共生菌科细胞分离
- 使用冷冻离心机在4°C下以2,500× g 离心珊瑚匀浆5分钟。
注意:这种速度是将较重的共生菌科细胞与悬浮在上清液中的宿主组织分离的最佳速度,同时保持其细胞壁完整。 - 取出含有宿主物质的上清液,放入新的 15 mL 试管中。
注意:来自宿主组织的脂质通常在共生体细胞顶部形成狭窄的粉红色/白色层。该层 可以通过移液 与可溶性宿主上清液一起收集(图1B)。 - 剧烈涡旋主机正好1分钟。将藻类颗粒样品和宿主上清液样品保持在冰上。
- 在4°C下向藻类颗粒中加入2mL超纯水。剧烈涡旋2分钟以重悬沉淀。
注:如果未从珊瑚群中收集 1 cm 的单个片段用于 Symbiodiniaceae 基因分型,则可以在此处收集 200 μL 等分试样的 Symbiodiniaceae 细胞悬浮液,保存在优选的 DNA 缓冲溶液中,并按照 Thurber 等人 30 中的描述储存用于 Symbiodiniaceae 基因分型(例如,根据 González-Pech 等人 12)。 - 再次重复步骤 6.1-6.4。
注意:宿主和共生体的可靠分离取决于珊瑚的生物量和物种,因为某些物种可能比其他物种更粘稠。建议至少进行三个洗涤步骤,但根据分离成功程度,可以增加洗涤步骤。重复洗涤步骤4.7-4.9,直到在宿主部分的底部看不到共生菌科细胞,直到共生菌科部分明显不含宿主物质(例如,顶部没有白层)(图1)。 - 取出含有宿主物质的上清液,放入新的 15 mL 试管中。
- 将共生体沉淀保留在 15 mL 管中。
7.样品干燥
- 在-80°C下冷冻holobiont匀浆或分离的宿主和Symbiodiniaceae级分~120分钟。在-85°C下用0.01mbar真空冻干样品过夜。
注意:为避免冻干过程中样品损失,建议使用从另一个无菌管或无菌封口膜上切下的盖子,使用无菌 2 G 针头小心地打入 ~2 mm 孔。 - 干燥时,使用实验室天平称量以下其中一项:1)25mg全息生物;2)共生体部分15mg;或 3) 将每个样品的 30 mg 宿主组织放入单独的 2 mL 不含增塑剂的微量离心管中。
注:关键步骤:优化用于提取的生物质对于确保GC-MS在确保足够信号的同时不会过载至关重要。干燥的珊瑚材料非常静态。为避免样品损失,请使用防静电装置消除样品和称量容器中的静电荷。一种简单且具有成本效益的替代方法是在样品管下方放置一张干衣机床单。干燥的共生体颗粒可以使用无菌刀片切割成所需的重量。
8. 细胞内代谢物提取
- 从冻干全息生物中提取细胞内代谢物:
- 加入 400 μL 100% 冷 (-20 °C) 甲醇,内标 (IS;13C6山梨糖醇和/或13C 5-15N缬氨酸,10μM)到每个管中。
- 向每个样品中加入少量 710-1,180 μm 酸洗玻璃珠 (~10 mg)。置于50Hz的珠磨机中,在预冷(-20°C)的珠磨机插件中3分钟。
- 向每个试管中额外加入600μL含有IS(13°6山梨糖醇和/或13°C5-15N缬氨酸,10μM)的100%冷(-20°C)甲醇。
- 涡旋混合1分钟。置于4°C的烤肉架上30分钟。
- 从分离的冻干共生菌科细胞中提取细胞内代谢物:
- 向干燥的共生菌科材料中加入200μL含有ISs(13C6山梨糖醇和/或13C5-15N缬氨酸,10μM)的100%冷(-20°C)甲醇。
- 加入少量 710-1,180 μm 酸洗玻璃珠 (~10 mg)。置于50Hz的珠磨机中,在预冷(-20°C)的珠磨机插件中3分钟。
- 再加入 800 μL 含 IS 的 100% 冷 (-20 °C) 甲醇,涡旋 30 秒。
- 从分离的冻干宿主组织中提取细胞内代谢物:
- 向干燥的主体材料中加入1mL含有ISs(13C6山梨糖醇和/或13C5-15N缬氨酸,10μM)的100%冷(-20°C)LC级甲醇。
- 涡旋混合20秒。置于浮动管支架中,置于设置在4°C的超声处理浴中30分钟。
9.代谢物提取物纯化
- 将样品(holobiont/宿主/共生体)在4°C下以3,000× g 离心30分钟。
- 将所有上清液转移到新的 2 mL 微量离心管中,注意不要干扰细胞碎片沉淀。
注意:这些是半极提取物。这些可以暂时保存在冰上,但在-80°C的黑暗中长期储存。 - 向剩余的细胞碎片中加入1,000μL的50%冷(-20°C)甲醇。剧烈涡旋 1 分钟以重悬。
- 将样品在4°C下以3,000× g 离心30分钟。
- 收集上清液(极性提取物)并将其与来自同一样品的半极性提取物混合在一起。
注:细胞碎片可以储存在-80°C并用于蛋白质含量归一化(第11节)。 - 将合并的提取物以 16,100 g 离心 15 分钟以除去所有沉淀物,并将上清液移至新的不含增塑剂的微量离心管 (2 mL) 中。
注:样品提取物可在-80°C下避光储存。 - 准备分析时,将 50 μL 每种提取物分装到玻璃插件中。使用真空浓缩器在30°C下浓缩30分钟。再重复四次(250 μL 总干燥提取物)。
注意:干燥的样品可以在干燥剂条件下在室温下储存,直到分析。
10. 代谢物衍生化
注:两步在线衍生化过程用于极性代谢物的甲氧基化和三甲基硅烷化。
- 向每个样品中加入 25 μL 甲氧基胺盐酸盐(30 mg/mL 吡啶溶液)。
- 在37°C下在设定为750rpm的轨道振荡器上搅拌2小时。
- 向每个样品中加入 25 μL N,O-双(三甲基硅基)三氟乙酰胺 + 三甲基氯硅烷。
- 在37°C和750rpm下再次搅拌1小时。
- 让样品在室温下平衡 1 小时,然后以 1:10 的分流比将 1 μL 注入 GC 上。
11. 气相色谱-质谱分析
注意:质谱仪应根据制造商的建议使用三(全氟丁基)胺 (CF43) 进行调整。
- 使用超高纯氦气作为载气,柱流速恒定为1 mL/min。
- 使用膜厚为1 μm、内径为0.25 mm的30 m DB-5色谱柱。
- GC烘箱方案
- 将入口温度设置为 280 °C。
- 从注射开始,烤箱温度为100°C,并保持4分钟。
- 将温度提高10°C / min至320°C,然后保持11分钟。
- 质谱仪参数
- 将MS传输管线设置为280°C,并将离子源调整为200°C。
- 使用氩气作为碰撞池气体,产生多反应监测(MRM)子离子。
- 实现相对于包含 MRM 靶标的时间分段 MRM 文库的代谢物检测。
12. 共生菌科细胞计数、珊瑚宿主组织蛋白质含量分析和叶绿素 a 估计
- 共生菌科细胞计数:
- 取珊瑚组织匀浆的等分试样。
- 将样品以 2,000 × g 离心以沉淀藻类。
- 从藻类沉淀中取出~200μL上清液,并放入新的微量离心管中。
注意:这将是用于归一化数据的蛋白质样本;如有必要,在分析之前将其储存在-20°C。 - 轻轻上下移液,将藻类颗粒重悬于1mL过滤的海水中。如有必要,稀释藻类悬浮液以促进细胞计数。
- 在光学显微镜下使用血细胞计数器进行细胞计数,向其中一个腔室中加入10μL。每个样品完成 8-10 次计数。
注:在可用的情况下,也可以应用用于计数藻细胞的替代方法(例如,流式细胞术,高通量共聚焦显微镜)。 - 计算共生体细胞的浓度(mL −1),同时考虑使用的任何稀释因子。
- 蛋白质含量测定
- 量化样品蛋白质含量(例如,通过Bradford的比色测定法,如Bradford等人最初描述的那样33,或Lowry测定法34,35,其方案已在其他地方描述刺胞动物36)。
- 叶绿素 a 提取
- 使用~200, 000个细胞的细胞沉淀,冷冻或新鲜。
- 将每个藻类沉淀转移到玻璃闪烁瓶中的2mL二甲基甲酰胺(DMF)中,并在4°C的黑暗中孵育48小时。
注意:DMF 具有毒性和致癌性,因此样品制备必须在尽可能黑暗的通风橱和冰上完成。如果有 <200,000 个细胞,则使用较少的 DMF。 - 以16,000× g离心3分钟。
- 将 200 mL 移至 UV-96 孔板中进行光度测量。以DMF为空白,一式三份运行每个样品。
- 测量波长 (E) 663.8 nm、646 nm 和 750 nm 处的吸光度。从其他两个波长的吸光度中减去 750 nm 处的吸光度。
注意:在 750 nm 处测量可校正样品中的任何散射或浑浊。 - 使用公式(1)计算叶绿素a浓度(μg/ mL):
浓度(μg/mL) = (12.00 × E 663.8) - (3.11 × E646.8) (1)
13. 代谢物提取后细胞生物量的定量以进行归一化
注:下面描述的细胞生物量的定量有两种选择:使用改进的布拉德福德比色法定量与生物量相关的蛋白质和细胞碎片干重的测量。这两种方法都适合使用,因为这两种方法都能准确定量细胞生物量。
- 细胞碎片的蛋白质含量
- 用1mL 0.2M NaOH重悬冷冻细胞碎片,并将样品在98°C孵育20分钟。
- 将样品在冰上冷却~10分钟,并在环境温度下以3,000× g 离心5分钟。
- 量化样品蛋白质含量(例如, 通过 Bradford的比色测定法,最初由Bradford等人33 描述,并由Smart等人37修改)。
- 细胞碎片干重的测量
- 将细胞内代谢物提取的细胞碎片重悬于双蒸水(~10mL)中。
- 使用预称重的膜过滤器(0.22μm孔径,47mm)在真空下过滤溶液。
- 用超纯水清洗含有生物质的管子两次,以确保生物质完全转移到膜过滤器。
- 取出含有生物质的膜过滤器,并使用微波炉(低功率;~250 W,持续20分钟)将其干燥。
- 将滤纸存放在干燥器中过夜。记录滤纸的干重,并通过从总重量中减去干膜过滤器的重量(使用与样品过滤器一起干燥的干净干膜过滤器)来计算生物质的干重。
14. 数据分析
- 使用代谢物数据库分析代谢物靶标,其中每个靶标由定量物和限定物 MRM 组成。
- 目视检查检测到的代谢物靶标,并根据需要手动整合它们。
- 使用代谢物峰面积计算每组每个样品的相对丰度。根据Smart等人37,对值进行空白校正和归一化,以取样内标峰面积,然后取样细胞碎片蛋白含量。
- 在所有治疗组中丢弃相对标准偏差大于35%的代谢物(N = 23种代谢物)。
- 转换数据(例如,立方体根),并使它们均值居中;确认方差的正态分布和均匀性。
- 执行数据分析(方差分析和热图构建;例如,使用 https://www.metaboanalyst.ca)38。使用"cluster"、"factoextra"和"klustR"包对样品进行聚类以检查治疗内的变异性。使用 R 中的"clusGap"函数计算间隙统计量(一种确定最佳聚类数39 的方法),并使用 R 包"tidyverse"绘制图。进行 PERMANOVAs 以检查处理代谢物谱(例如,在引物中)之间分离的意义。
Access restricted. Please log in or start a trial to view this content.
结果
这项工作产生的所有数据均可在补充信息中找到。
宿主-共生体分离
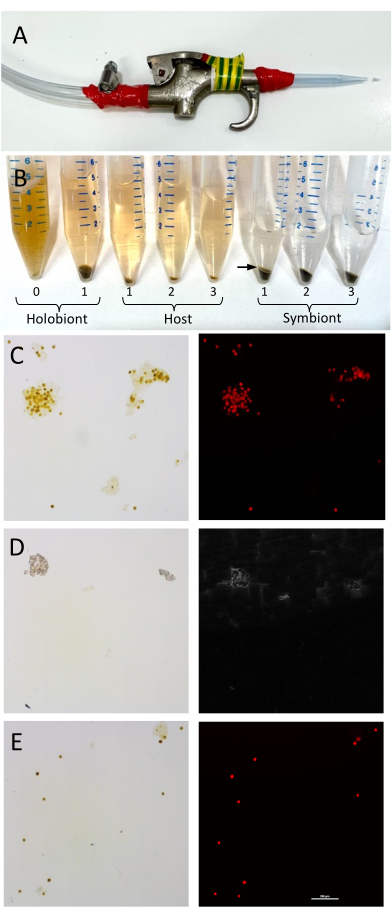
图 1:珊瑚宿主组织和 Symbiodiniaceae 细胞分离的设置和验证。 (A) 用于从珊瑚骨架上去除珊瑚组织的气枪装置。用电工胶带将移液?...
Access restricted. Please log in or start a trial to view this content.
讨论
宿主和共生体的分离可以通过简单的离心轻松快速地实现,这里的结果表明,分离馏分可以提供有价值的信息,表明特定的全生物成员的贡献,这有助于珊瑚健康的功能分析。在成年珊瑚中,脂质合成主要由常驻藻类共生体 40 进行,它提供脂质(例如,三酰基甘油和磷脂)41 和可以促进应激恢复的脂肪酸 11,42。
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有要披露的利益冲突。
致谢
J.L.M. 得到了悉尼科技大学校长研究奖学金的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 100% LC-grade methanol | Merck | 439193 | LC grade essential |
| 2 mL microcentrifuge tubes, PP | Eppendorf | 30121880 | Polypropylene provides high resistance to chemicals, mechanical stress and temperature extremes |
| 2030 Shimadzu gas chromatograph | Shimadzu | GC-2030 | |
| 710-1180 µm acid-washed glass beads | Merck | G1152 | This size is optimal for breaking the Symbiodiniaceae cells |
| AOC-6000 Plus Multifunctional autosampler | Shimadzu | AOC6000 | |
| Bradford reagent | Merck | B6916 | Any protein colourimetric reagent is acceptable |
| Compressed air gun | Ozito | 6270636 | Similar design acceptable. Having a fitting to fit a 1 mL tip over is critical. |
| DB-5 column with 0.25 mm internal diameter column and 1 µm film thickness | Agilent | 122-5013 | |
| DMF | Merck | RTC000098 | |
| D-Sorbitol-6-13C and/or 13C5–15N Valine | Merck | 605514/ 600148 | Either or both internal standards can be added to the methanol. |
| Flat bottom 96-well plate | Merck | CLS3614 | |
| Glass scintillation vials | Merck | V7130 | 20 mL, with non-plastic seal |
| Immunoglogin G | Merck | 56834 | if not availbe, Bovine Serum Albumin is acceptable |
| Primer | v4 | ||
| R | v4.1.2 | ||
| Shimadzu LabSolutions Insight software | v3.6 | ||
| Sodium Hydroxide | Merck | S5881 | Pellets to make 1 M solution |
| tidyverse | v1.3.1 | R package | |
| TissueLyser LT | Qiagen | 85600 | Or similar |
| TQ8050NX triple quadrupole mass spectrometer | Shimadzu | GCMS-TQ8050 NX | |
| UV-96 well plate | Greiner | M3812 | |
| Whirl-Pak sample bag | Merck | WPB01018WA | Sample collection bag; Size: big enough to house a ~5 cm coral fragment, but not too big that the water is too spread |
参考文献
- Bundy, J. G., Davey, M. P., Viant, M. R. Environmental metabolomics: A critical review and future perspectives. Metabolomics. 5 (1), 3-21 (2008).
- Matthews, J. L., et al. The metabolic significance of symbiont community composition in the coral-algal symbiosis. Applied Environmental Metabolomics. Beale, D. J., Hillyer, K. E., Warden, A. C., Jones, O. A. H. , Academic Press. Cambridge, MA. 211-229 (2022).
- Lawson, C. A., et al. Informing coral reef conservation through metabolomic approaches. Coral Reef Conservation and Restoration in the Omics Age. Coral Reefs of the World. van Oppen, M. J. H., Aranda Lastra, M. , Springer. Cham, Switzerland. 179-202 (2022).
- LaJeunesse, T. C., et al. Systematic revision of Symbiodiniaceae highlights the antiquity and diversity of coral endosymbionts. Current Biology. 28 (16), 2570-2580 (2018).
- Rohwer, F., Seguritan, V., Azam, F., Knowlton, N. Diversity and distribution of coral-associated bacteria. Marine Ecology Progress Series. 243, 1-10 (2002).
- Maire, J., et al. Intracellular bacteria are common and taxonomically diverse in cultured and in hospite algal endosymbionts of coral reefs. The ISME Journal. 15 (7), 2028-2042 (2021).
- Hillyer, K. E., et al. Metabolite profiling of symbiont and host during thermal stress and bleaching in the coral Acropora aspera. Coral Reefs. 36, 105-118 (2016).
- Hillyer, K. E., Tumanov, S., Villas-Bôas, S., Davy, S. K. Metabolite profiling of symbiont and host during thermal stress and bleaching in a model cnidarian-dinoflagellate symbiosis. Journal of Experimental Biology. 219 (4), 516-527 (2016).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences of the United States of America. 114 (50), 13194-13199 (2017).
- Rosset, S. L., et al. The molecular language of the cnidarian-dinoflagellate symbiosis. Trends in Microbiology. 29 (4), 320-333 (2020).
- Matthews, J. L., et al. Partner switching and metabolic flux in a model cnidarian-dinoflagellate symbiosis. Royal Society. 285 (1892), 20182336(2018).
- González-Pech, R. A., et al. Physiological factors facilitating the persistence of Pocillopora aliciae and Plesiastrea versipora in temperate reefs of south-eastern Australia under ocean warming. Coral Reefs. 41, 1239-1253 (2022).
- Williams, A., et al. Metabolomic shifts associated with heat stress in coral holobionts. Science Advances. 7 (1), (2021).
- Deutsch, J. M., et al. Metabolomics of healthy and stony coral tissue loss disease affected Montastraea cavernosa corals. Frontiers in Marine Science. 8, 1421(2021).
- Stien, D., et al. A unique approach to monitor stress in coral exposed to emerging pollutants. Scientific Reports. 10 (1), 9601(2020).
- Lohr, K. E., et al. Resolving coral photoacclimation dynamics through coupled photophysiological and metabolomic profiling. Journal of Experimental Biology. 222 (8), (2019).
- Jorissen, H., et al. Coral larval settlement preferences linked to crustose coralline algae with distinct chemical and microbial signatures. Scientific Reports. 11 (1), 14610(2021).
- Roach, T. N., Dilworth, J., Jones, A. D., Quinn, R. A., Drury, C. Metabolomic signatures of coral bleaching history. Nature Ecology & Evolution. 5 (4), 495-503 (2021).
- Parkinson, J. E., et al. Molecular tools for coral reef restoration: Beyond biomarker discovery. Conservation Letters. 13 (1), 12687(2020).
- Jiang, J., et al. How Symbiodiniaceae meets the challenges of life during coral bleaching. Coral Reefs. 40, 1339-1353 (2021).
- Guerra, F. D., Attia, M. F., Whitehead, D. C., Alexis, F. Nanotechnology for environmental remediation: materials and applications. Molecules. 23 (7), 1760(2018).
- Matthews, J. L., et al. Metabolite pools of the reef building coral Montipora capitata are unaffected by Symbiodiniaceae community composition. Coral Reefs. 39, 1727-1737 (2020).
- Papina, M., Meziane, T., van Woesik, R. Symbiotic zooxanthellae provide the host-coral Montipora digitata with polyunsaturated fatty acids. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 135 (3), 533-537 (2003).
- Kellogg, R., Patton, J. Lipid droplets, medium of energy exchange in the symbiotic anemone Condylactis gigantea: A model coral polyp. Marine Biology. 75, 137-149 (1983).
- Ankrah, N. Y., Chouaia, B., Douglas, A. E. The cost of metabolic interactions in symbioses between insects and bacteria with reduced genomes. mBio. 9 (5), e01433(2018).
- Kabeya, N., et al. Genes for de novo biosynthesis of omega-3 polyunsaturated fatty acids are widespread in animals. Science Advances. 4 (5), (2018).
- Hillyer, K. E., Dias, D., Lutz, A., Roessner, U., Davy, S. K. 13C metabolomics reveals widespread change in carbon fate during coral bleaching. Metabolomics. 14 (1), 12(2018).
- Hillyer, K. E., Dias, D. A., Lutz, A., Roessner, U., Davy, S. K. Mapping carbon fate during bleaching in a model cnidarian symbiosis: the application of 13C metabolomics. New Phytologist. 214 (4), 1551-1562 (2017).
- Burriesci, M. S., Raab, T. K., Pringle, J. R. Evidence that glucose is the major transferred metabolite in dinoflagellate-cnidarian symbiosis. Journal of Experimental Biology. 215 (19), 3467-3477 (2012).
- Thurber, R. V., et al. Unified methods in collecting, preserving, and archiving coral bleaching and restoration specimens to increase sample utility and interdisciplinary collaboration. PeerJ. 10, 14176(2022).
- Grottoli, A. G., et al. Increasing comparability among coral bleaching experiments. Ecological Applications. 31 (4), 02262(2020).
- Mushtaq, M. Y., Choi, Y. H., Verpoorte, R., Wilson, E. G. Extraction for metabolomics: access to the metabolome. Phytochemical Analysis. 25 (4), 291-306 (2014).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1), 248-254 (1976).
- Peterson, G. L., et al. A simplification of the protein assay method of Lowry et al. which is more generally applicable. Analytical Biochemistry. 83 (2), 346-356 (1977).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Zamer, W. E., Shick, J. M., Tapley, D. W. Protein measurement and energetic considerations: Comparisons of biochemical and stoichiometric methods using bovine serum albumin and protein isolated from sea anemones. Limnology and Oceanography. 34 (1), 256-263 (1989).
- Smart, K. F., Aggio, R. B., Van Houtte, J. R., Villas-Boas, S. G. Analytical platform for metabolome analysis of microbial cells using methyl chloroformate derivatization followed by gas chromatography-mass spectrometry. Nature Protocols. 5 (10), 1709-1729 (2010).
- Pang, Z., et al. Using MetaboAnalyst 5.0 for LC-HRMS spectra processing, multi-omics integration and covariate adjustment of global metabolomics data. Nature Protocols. 17 (8), 1735-1761 (2022).
- Tibshirani, R., Walther, G., Hastie, T. Estimating the number of clusters in a data set via the gap statistic. Journal of the Royal Statistical Society: Series B (Statistical Methodology). 63 (2), 411-423 (2001).
- Chen, W. -N., et al. Diel rhythmicity of lipid-body formation in a coral-Symbiodinium endosymbiosis). Coral Reefs. 31 (2), 521-534 (2012).
- Imbs, A. Fatty acids and other lipids of corals: composition, distribution, and biosynthesis. Russian Journal of Marine Biology. 39 (3), 153-168 (2013).
- Rosset, S., et al. Lipidome analysis of Symbiodiniaceae reveals possible mechanisms of heat stress tolerance in reef coral symbionts. Coral Reefs. 38 (6), 1241-1253 (2019).
- Carreón-Palau, L., Parrish, C. C., Del Angel-Rodriguez, J. A., Perez-Espana, H. Seasonal shifts in fatty acids and sterols in sponges, corals, and bivalves, in a southern Gulf of Mexico coral reef under river influence. Coral Reefs. 40 (2), 571-593 (2021).
- Imbs, A. B., Dang, L. T. Seasonal dynamics of fatty acid biomarkers in the soft coral Sinularia flexibilis, a common species of Indo-Pacific coral reefs. Biochemical Systematics and Ecology. 96, 104246(2021).
- Oku, H., Yamashiro, H., Onaga, K., Sakai, K., Iwasaki, H. Seasonal changes in the content and composition of lipids in the coral Goniastrea aspera. Coral Reefs. 22 (1), 83-85 (2003).
- Weis, V. M. Cell biology of coral symbiosis: foundational study can inform solutions to the coral reef crisis. Integrative and Comparative Biology. 59 (4), 845-855 (2019).
- Oakley, C., Davy, S. Cell biology of coral bleaching. Coral Bleaching. van Oppen, M., Lough, J. , Springer. Cham, Switzerland. 189-211 (2018).
- Lu, W., et al. Metabolite measurement: Pitfalls to avoid and practices to follow. Annual Review of Biochemistry. 86, 277-304 (2017).
- Lawson, C. A., et al. Heat stress decreases the diversity, abundance and functional potential of coral gas emissions. Global Change Biology. 27 (4), 879-891 (2021).
- Olander, A., et al. Comparative volatilomics of coral endosymbionts from one-and comprehensive two-dimensional gas chromatography approaches. Marine Biology. 168 (5), 76(2021).
- Wuerz, M., et al. Symbiosis induces unique volatile profiles in the model cnidarian Aiptasia. Journal of Experimental Biology. 225 (19), (2022).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。