Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Métabolomique ciblée basée sur la chromatographie en phase gazeuse et la spectrométrie de masse d’échantillons de corail dur
Dans cet article
Résumé
Nous présentons ici l’extraction et la préparation de métabolites polaires et semi-polaires à partir d’un holobionte corallien, ainsi que de tissus coralliens hôtes séparés et de fractions cellulaires de Symbiodiniaceae, pour l’analyse par chromatographie en phase gazeuse et spectrométrie de masse.
Résumé
Les approches basées sur la chromatographie en phase gazeuse et la spectrométrie de masse (GC-MS) se sont avérées puissantes pour élucider la base métabolique de la symbiose cnidaire-dinoflagellé et la façon dont le corail réagit au stress (c’est-à-dire pendant le blanchissement induit par la température). Le profilage des métabolites à l’état d’équilibre de l’holobionte corallien, qui comprend l’hôte cnidaire et ses microbes associés (Symbiodiniaceae et autres protistes, bactéries, archées, champignons et virus), a été appliqué avec succès dans des conditions ambiantes et de stress pour caractériser l’état métabolique holistique du corail.
Cependant, pour répondre aux questions entourant les interactions symbiotiques, il est nécessaire d’analyser les profils de métabolites de l’hôte corallien et de ses symbiotes algales indépendamment, ce qui ne peut être réalisé que par une séparation physique et un isolement des tissus, suivis d’une extraction et d’une analyse indépendantes. Bien que l’application de la métabolomique soit relativement nouvelle dans le domaine corallien, les efforts soutenus des groupes de recherche ont abouti au développement de méthodes robustes pour analyser les métabolites dans les coraux, y compris la séparation du tissu hôte du corail et des symbiotes d’algues.
Cet article présente un guide étape par étape pour la séparation des holobiontes et l’extraction des métabolites pour l’analyse GC-MS, y compris les étapes clés de l’optimisation à prendre en compte. Nous montrons comment, une fois analysé indépendamment, le profil métabolitique combiné des deux fractions (corail et Symbiodiniaceae) est similaire au profil de l’ensemble (holobionte), mais en séparant les tissus, nous pouvons également obtenir des informations clés sur le métabolisme et les interactions entre les deux partenaires qui ne peuvent être obtenues à partir de l’ensemble seul.
Introduction
Les métabolites représentent les produits finaux des processus cellulaires, et la métabolomique - l’étude de l’ensemble des métabolites produits par un organisme ou un écosystème donné - peut fournir une mesure directe du fonctionnement de l’organisme1. Ceci est particulièrement important pour l’exploration des écosystèmes, des interactions symbiotiques et des outils de restauration, car l’objectif de la plupart des stratégies de gestion est de préserver (ou de restaurer) des fonctions de services écosystémiques spécifiques2. Les récifs coralliens sont un écosystème aquatique qui démontre la valeur potentielle de la métabolomique pour élucider les interactions symbiotiques et relier les réponses physiologiques des coraux aux impacts au niveau de la communauté et de l’écosystème3. L’application de la chromatographie en phase gazeuse à haut débit et de la spectrométrie de masse (GC-MS) est particulièrement appréciée en raison de sa capacité à analyser rapidement un large éventail de classes de métabolites simultanément avec une sélectivité et une sensibilité élevées, à fournir une identification rapide des composés lorsque des bibliothèques spectrales sont disponibles et à fournir un haut niveau de reproductibilité et de précision, avec un coût par échantillon relativement faible.
Les coraux sont des holobiontes constitués de l’animal corallien, d’endosymbiontes photosynthétiques dinoflagellés (famille : Symbiodiniaceae4) et d’un microbiome complexe 5,6. Dans l’ensemble, l’aptitude de l’holobionte est maintenue principalement par l’échange de petites molécules et d’éléments pour soutenir le fonctionnement métabolique de chaque membre 7,8,9,10. Les approches métabolomiques se sont avérées particulièrement puissantes pour élucider les bases métaboliques de la spécificité de la symbiose9,11, de la réponse au blanchiment au stress thermique 7,8,12,13, des réponses aux maladies 14, des réponses à l’exposition à la pollution 15, de la photoacclimatation 16 et de la signalisation chimique 17 chez les coraux, ainsi que pour aider à la découverte de biomarqueurs 18,19. De plus, la métabolomique peut fournir une confirmation précieuse des conclusions déduites des techniques basées sur l’ADN et l’ARN 9,20. Il existe donc un potentiel considérable pour l’utilisation de la métabolomique pour évaluer la santé des récifs et développer des outils pour la conservation des récifs3, par exemple par la détection de biomarqueurs métaboliques du stress18,19 et pour examiner le potentiel de stratégies de gestion active telles que les subventions nutritionnelles21.
La séparation des cellules hôtes et symbiotes et l’analyse de leurs profils métabolites indépendamment, plutôt qu’ensemble comme l’holobionte, peuvent fournir plus d’informations sur les interactions des partenaires, les statuts physiologiques et métaboliques indépendants et les mécanismes moléculaires potentiels d’adaptation 11,12,22,23,24. Sans séparer le corail et les Symbiodiniaceae, il est presque impossible d’élucider la contribution et le métabolisme du corail et/ou des Symbiodiniaceae indépendamment, sauf avec la reconstruction complexe du génome et la modélisation métabolique25, mais cela n’a pas encore été appliqué à la symbiose corail-dinoflagellés. De plus, tenter d’extraire des informations sur le métabolisme individuel de l’hôte ou du symbiote algal à partir du profil métabolite de l’holobionte peut conduire à une mauvaise interprétation.
Par exemple, jusqu’à récemment, on pensait que la présence d’acides gras polyinsaturés C18 :3n-6, C18 :4n-3 et C16 dans des extraits de tissus de coraux et d’holobiontes était dérivée du symbiote algal, car on supposait que les coraux ne possédaient pas les ωx désaturases essentielles à la production d’acides gras oméga-3 (ω3) ; cependant, des preuves génomiques récentes suggèrent que plusieurs cnidaires ont la capacité de produire des AGPI ω3 de novo et de biosynthétiser davantage les AGPI26 à longue chaîne ω3. La combinaison de la GC-MS et du marquage isotopique stable (par exemple, 13 C-bicarbonate, NaH 13CO 3) peut être utilisée pour suivre le devenir du carbone fixé photosynthétiquement à travers les réseaux métaboliques holobiontes coralliens dans des conditions de contrôle et en réponse à des facteurs de stress externes27,28. Cependant, une étape critique dans le suivi du devenir du 13C est la séparation du tissu corallien des cellules algales - ce n’est qu’à ce moment-là que la présence d’un composé marqué au 13C dans la fraction de l’hôte corallien peut être attribuée sans équivoque comme un métabolite dérivé de Symbiodiniaceae transloqué au corail ou un produit en aval d’un composé marqué transloqué. Cette technique a démontré sa puissance en remettant en question l’hypothèse de longue date selon laquelle le glycérol est la principale forme dans laquelle la photosynthèse est transloquée du symbiote à l’hôte29, ainsi qu’en élucidant comment le flux nutritionnel inter-partenaires change pendant le blanchiment27,28 et en réponse à des espèces de Symbiodiniaceae incompatibles11.
Bien que la décision de séparer les tissus soit principalement motivée par la question de recherche, il est important de tenir compte de l’aspect pratique, de la fiabilité et des impacts métaboliques potentiels de cette approche. Ici, nous fournissons des méthodes détaillées et démontrées pour l’extraction des métabolites de l’holobionte, ainsi que des fractions séparées de l’hôte et du symbiote. Nous comparons les profils de métabolites de l’hôte et du symbiote indépendamment et comment ces profils se comparent au profil de métabolite de l’holobionte.
Access restricted. Please log in or start a trial to view this content.
Protocole
NOTE : Le plan expérimental, le prélèvement et l’entreposage des échantillons ont été décrits en détail ailleurs 2,30,31. L’autorisation de prélèvement de coraux sauvages doit être obtenue avant la collecte et l’expérimentation. Les échantillons ici ont été prélevés sur des colonies de Montipora mollis (forme de couleur verte) importées de Batavia Coral Farms (Geraldton, WA), prélevées à l’origine sur un récif au large des îles Abrohlos (Australie-Occidentale ; 28°52'43.3"S 114°00'17.0"E) à une profondeur de 1 m en vertu du permis d’aquaculture AQ1643. Avant l’échantillonnage, les colonies ont été maintenues dans un aquarium de 800 L à 35 PSU, sous une lumière bleue et blanche à 150 μmol photons·m−2·s−1, et à 25 °C ± 0,5 °C pendant 3 mois. Les fragments de corail (~5 cm2, N = 6) ont été congelés dans de l’azote liquide et stockés à −80 °C jusqu’à leur traitement.
1. Préparation des solutions et des équipements d’extraction
- Au moins 1 jour avant l’enlèvement des tissus coralliens, préparez les solutions d’extraction et l’équipement.
- Prérefroidir de l’eau ultrapure dans de la verrerie propre et sans détergent à 4 °C.
- Mélanger du méthanol de qualité LC à 100 % avec une concentration finale de 10 μg·mL−1 d’étalon interne approprié (p. ex., 13C6 sorbitol).
- Créez une solution d’extraction à 50 % de méthanol en utilisant la moitié de méthanol de qualité LC à 100 % et l’autre moitié d’eau ultrapure. Conservez les deux solutions de méthanol à −20 °C.
REMARQUE : Pour aider à prévenir la dégradation des métabolites, il est recommandé d’effectuer les étapes de traitement des échantillons par lots de cinq fragments de corail à la fois, avec un blanc biologique supplémentaire (eau seulement) (total des échantillons N = 6). Une fois que chaque échantillon de corail a été séparé en deux fractions (tissu corallien hôte, ci-après « Hôte », et cellules de microalgues, désormais « Symbiote »), le nombre total d’échantillons dans un lot de traitement sera de 12.
2. Trempe du métabolisme des coraux
NOTE : Le plan expérimental, le prélèvement et l’entreposage des échantillons ont été décrits en détail ailleurs 2,30,31. Cependant, il convient de noter que le temps nécessaire pour éteindre le métabolisme (c’est-à-dire le temps entre la collecte et la conservation des échantillons de corail) est essentiel pour capturer la réponse initiale30. Conserver l’échantillon le plus rapidement possible après le prélèvement afin d’éviter toute modification de la composition des métabolites due à la dégradation de l’échantillon ou à des réponses physiologiques non ciblées32.
- Placez le fragment de corail dans un sac de prélèvement d’échantillon stérile et égouttez autant que possible l’excès d’eau de mer. Immergez l’échantillon dans de l’azote liquide pendant au moins 30 s. Déplacer les échantillons dès que possible dans un congélateur à −80 °C pour les stocker.
REMARQUE : Les échantillons peuvent être congelés à −80 °C dans des contenants à lumière bloquée jusqu’au traitement, en évitant les cycles de gel-décongélation.
3. Retrait du tissu corallien du squelette
REMARQUE : Les échantillons doivent être conservés sur de la glace (4 °C) en tout temps pour s’assurer qu’ils sont simultanément sous forme liquide tout en empêchant le métabolisme en cours.
- Placez un sac de prélèvement d’échantillon propre et stérile sur de la glace afin que le sac soit stable et ouvert sur la glace dans un puits peu profond, mais qu’il ne soit pas immergé dans la glace. Ajouter 10 mL d’eau froide (4 °C) ultrapure dans le sac.
REMARQUE : Cela aidera à éviter le gel-dégel répété du fragment de corail en raison de l’air froid sous pression et de la glace environnante. - Prélever un fragment de corail à l’aide d’une pince à épiler stérilisée et rincer à l’eau froide (4 °C) ultrapure à l’aide d’une pipette Pasteur stérile jusqu’à ce qu’il ne reste plus de résidus d’eau de mer. Plongez le fragment de corail rincé dans le sac contenant les 10 mL d’eau ultra-pure.
REMARQUE : Ce rinçage est essentiel pour éliminer les sels résiduels qui interféreraient avec l’analyse en aval. Évitez tout contact des mains avec l’eau ou le fragment de corail à travers le sac pour maintenir l’échantillon à 4 °C. - Collez une pointe de pipette stérile de 1 mL sur l’extrémité d’un pistolet à air comprimé avec du ruban isolant, en coupant l’extrémité de l’embout de ~5 mm (Figure 1A).
- Dirigez le pistolet à air comprimé sur le fragment de corail avec le sac à moitié fermé et le flux d’air à faible et moyen pour retirer doucement le tissu en encourageant un mouvement circulaire de l’eau sur le fragment de corail.
- Après ~3 min, ou lorsque tous les tissus semblent avoir été retirés du squelette, éteignez l’air et retirez l’aérographe. Fermez complètement le sac.
- Pressez tout le tissu corallien retiré dans un coin inférieur du sac. Coupez le coin opposé et versez délicatement le contenu du sac dans un tube de 15 ml sur de la glace.
4. Homogénéisation facultative
REMARQUE : Certaines espèces de coraux sont plus visqueuses que d’autres, ce qui signifie que l’aérographe éliminera les tissus en touffes plutôt que dans une boue. Si des amas de tissu sont visibles dans l’homogénat aérographe, une étape d’homogénéisation à 4 °C peut être ajoutée pour tous les échantillons.
- Nettoyez deux fois un homogénéisateur mécanique en dents de scie avec 4 °C de méthanol à 70 % et enfin avec de l’eau ultrapure à 4 °C.
- Homogénéiser l’échantillon de corail dans un tube de 15 ml pendant ~1 min jusqu’à ce que l’échantillon soit complètement homogénéisé et qu’aucun amas ne soit visible.
- Nettoyez l’homogénéisateur comme à l’étape 4.1 entre chaque échantillon. Maintenez un temps d’homogénéisation cohérent entre les échantillons.
5. Prélèvement d’échantillons pour normalisation
- Prélever une aliquote de 1 000 μL dans le tissu homogénéisé pour le comptage cellulaire des Symbiodiniaceae, l’analyse de la teneur en protéines du tissu hôte du corail et l’estimation de la chlorophylle a . Conserver à −20 °C jusqu’au moment de l’analyse (rubrique 10).
6. Séparation facultative des tissus de l’hôte corallien-Symbiodiniaceae
- Centrifuger l’homogénat de corail à 2 500 × g pendant 5 min à 4 °C à l’aide d’une centrifugeuse réfrigérée.
REMARQUE : Cette vitesse est optimale pour séparer les cellules Symbiodiniaceae plus lourdes, tout en gardant leurs parois cellulaires intactes, du tissu hôte, qui est en suspension dans le surnageant. - Retirez le surnageant contenant le matériau hôte et placez-le dans un nouveau tube de 15 ml.
REMARQUE : Les lipides du tissu hôte forment généralement une étroite couche rose/blanche au-dessus des cellules symbiotiques. Cette couche peut être prélevée avec le surnageant de l’hôte soluble par pipetage (figure 1B). - Agitez vigoureusement l’hôte pendant exactement 1 min. Conservez l’échantillon de pastilles d’algues et l’échantillon de surnageant hôte sur de la glace.
- Ajouter 2 mL d’eau ultrapure à 4 °C à la pastille d’algue. Agitez vigoureusement pendant exactement 2 minutes pour remettre la pastille en suspension.
REMARQUE : Si des fragments individuels de 1 cm n’ont pas été prélevés dans la colonie de coraux pour le génotypage des Symbiodiniaceae, une aliquote de 200 μL de la suspension cellulaire des Symbiodiniaceae peut être prélevée ici, conservée dans la solution tampon d’ADN préférée et stockée comme décrit dans Thurber et al.30 pour le génotypage des Symbiodiniaceae (par exemple, selon González-Pech et al.12). - Répétez les étapes 6.1 à 6.4 une fois de plus.
REMARQUE : La séparation fiable de l’hôte et du symbiote dépend de la biomasse et de l’espèce de corail, car certaines espèces peuvent être plus visqueuses que d’autres. Un minimum de trois étapes de lavage est recommandé, mais cela peut être augmenté en fonction du succès de la séparation. Répétez les étapes de lavage 4.7 à 4.9 jusqu’à ce qu’il n’y ait plus de cellules de Symbiodiniaceae dans la partie inférieure de la fraction hôte et jusqu’à ce que la fraction de Symbiodiniaceae soit visiblement exempte de matière hôte (p. ex., pas de couche blanche sur le dessus) (Figure 1). - Retirez le surnageant contenant le matériau hôte et placez-le dans un nouveau tube de 15 ml.
- Conservez la pastille de symbiote dans le tube de 15 mL.
7. Séchage de l’échantillon
- Congeler soit l’homogénat d’holobionte, soit les fractions de l’hôte séparé et des Symbiodiniaceae, à −80 °C pendant ~120 min. Lyophiliser les échantillons pendant la nuit avec un vide de 0,01 mbar à −85 °C.
REMARQUE : Pour éviter la perte d’échantillon lors de la lyophilisation, il est recommandé d’utiliser un couvercle découpé dans un autre tube stérile, ou un parafilm stérile, avec un trou de ~2 mm percé soigneusement à l’aide d’une aiguille stérile de 25 G. - Lorsqu’il est sec, à l’aide d’une balance de laboratoire, peser l’un des éléments suivants : 1) 25 mg d’holobionte ; 2) 15 mg de la fraction symbiote ; ou 3) 30 mg du tissu hôte de chaque échantillon dans des tubes de microcentrifugation séparés de 2 mL sans plastifiant.
NOTE : Étape critique : L’optimisation de la biomasse pour l’extraction est essentielle pour s’assurer que la GC-MS n’est pas surchargée tout en assurant un signal suffisant. Le matériau du corail séché est très statique. Pour éviter la perte d’échantillons, utilisez des dispositifs antistatiques pour éliminer les charges électrostatiques des échantillons et des récipients de pesée. Une alternative simple et économique consiste à placer une feuille de séchage sous le tube d’échantillonnage. Le granulé de symbiote séché peut être coupé au poids souhaité à l’aide d’une lame stérile.
8. Extractions intracellulaires de métabolites
- Extraction de métabolites intracellulaires à partir d’holobionte lyophilisé :
- Ajouter 400 μL de méthanol à froid à 100 % (−20 °C) avec étalon(s) interne(s) (IS ; 13C6 sorbitol et/ou 13C5-15 N valine, à 10μM) dans chaque tube.
- Ajouter un petit nombre de billes de verre lavées à l’acide de 710 à 1 180 μm (~ 10 mg) à chaque échantillon. Placer dans un broyeur à billes à 50 Hz pendant 3 min dans un insert de broyeur à billes pré-refroidi (−20 °C).
- Ajouter 600 μL supplémentaires de méthanol froid à 100 % (−20 °C) avec IS (13 C6 sorbitol et/ou 13C 5-15 N valine, à 10μM) dans chaque tube.
- Vortex pour mélanger pendant 1 min. Placer sur un shaker à rôtissoire à 4 °C pendant 30 min.
- Extraction de métabolites intracellulaires à partir de cellules Symbiodiniaceae lyophilisées séparées :
- Ajouter 200 μL de méthanol froid à 100 % (−20 °C) avec des IS (13 C6 sorbitol et/ou 13C 5-15 N valine, à 10μM) au matériel séché de Symbiodiniaceae.
- Ajouter un petit nombre de billes de verre lavées à l’acide de 710 à 1 180 μm (~10 mg). Placer dans un broyeur à billes à 50 Hz pendant 3 min dans un insert de broyeur à billes pré-refroidi (−20 °C).
- Ajouter 800 μL supplémentaires de méthanol à 100 % froid (−20 °C) avec des IS, et vortex pendant 30 s.
- Extraction de métabolites intracellulaires à partir de tissus hôtes lyophilisés séparés :
- Ajouter 1 mL de méthanol de qualité LC à 100 % froid (−20 °C) contenant des IS (13 C6 sorbitol et/ou 13C 5-15 N valine, à 10μM) au matériau hôte séché.
- Vortex pour mélanger pendant 20 s. Placer dans un support de tube flottant dans un bain de sonication réglé à 4 °C pendant 30 min.
9. Purification de l’extrait de métabolite
- Centrifuger les échantillons (holobionte/hôte/symbiote) à 3 000 × g pendant 30 min à 4 °C.
- Transférez tout le surnageant dans un nouveau tube de microcentrifugation de 2 mL, en prenant soin de ne pas perturber la pastille de débris cellulaires.
REMARQUE : Ce sont les extraits semi-polaires. Ceux-ci peuvent être conservés temporairement sur la glace, mais stockés à long terme à −80 °C dans l’obscurité. - Ajouter 1 000 μL de méthanol froid (−20 °C) à 50 % aux débris cellulaires restants. Agiter vigoureusement pendant 1 min pour remettre en suspension.
- Centrifuger les échantillons à 3 000 × g pendant 30 min à 4 °C.
- Recueillir et mettre en commun le surnageant (extraits polaires) avec les extraits semi-polaires du même échantillon.
REMARQUE : Les débris cellulaires peuvent être stockés à −80 °C et utilisés pour la normalisation de la teneur en protéines (section 11). - Centrifuger les extraits regroupés à 16 100 g pendant 15 min pour éliminer tous les précipités, puis déplacer le surnageant dans un nouveau tube de microcentrifugation sans plastifiant (2 ml).
REMARQUE : Les extraits d’échantillons peuvent être conservés à −80 °C dans l’obscurité. - Au moment de l’analyse, aliquote 50 μL de chaque extrait dans un insert en verre. Concentrez pendant 30 min à 30 °C à l’aide d’un concentrateur sous vide. Répétez l’opération quatre fois de plus (pour 250 μL d’extrait séché total).
REMARQUE : Les échantillons séchés peuvent être conservés à température ambiante dans des conditions de dessiccation jusqu’à l’analyse.
10. Dérivation des métabolites
NOTE : Un procédé de dérivation en ligne en deux étapes est utilisé pour la méthoxymation et la triméthylsilylation des métabolites polaires.
- Ajouter 25 μL de chlorhydrate de méthoxyamine (30 mg/mL dans la pyridine) à chaque échantillon.
- Agiter à 37 °C sur un agitateur orbital réglé à 750 tr/min pendant 2 h.
- Ajouter 25 μL de N,O-bis (triméthylsilyl)trifluoroacétamide + triméthylchlorosilane à chaque échantillon.
- Agiter à nouveau à 37 °C et 750 tr/min pendant 1 h.
- Laisser les échantillons s’équilibrer à température ambiante pendant 1 h avant d’injecter 1 μL dans un rapport de fractionnement de 1 :10 sur le GC.
11. Analyse par chromatographie en phase gazeuse et spectrométrie de masse
REMARQUE : Le spectromètre de masse doit être réglé selon les recommandations du fabricant à l’aide de tris-(perfluorobutyl)-amine (CF43).
- Utilisez de l’hélium de très haute pureté comme gaz vecteur à un débit de colonne constant de 1 mL/min.
- Utilisez une colonne DB-5 de 30 m avec une épaisseur de film de 1 μm et un diamètre intérieur de 0,25 mm.
- Programme du four GC
- Réglez la température d’entrée à 280 °C.
- Commencer à l’injection avec une température de four de 100 °C et maintenir pendant 4 min.
- Augmentez la température de 10 °C/min à 320 °C, puis maintenez pendant 11 min.
- Paramètres du spectromètre de masse
- Réglez la ligne de transfert MS sur 280 °C et réglez la source d’ions sur 200 °C.
- Utilisez l’argon comme gaz de cellule de collision pour générer l’ion produit de surveillance des réactions multiples (MRM).
- Réalisez la détection des métabolites par rapport à une bibliothèque MRM segmentée dans le temps contenant des cibles MRM.
12. Comptage des cellules Symbiodiniaceae, analyse de la teneur en protéines des tissus de l’hôte corallien et estimation de la chlorophylle a
- Numération cellulaire des Symbiodiniaceae :
- Prenez une aliquote de l’homogénat de tissu corallien.
- Centrifuger les échantillons à 2 000 × g pour granuler les algues.
- Retirez le surnageant de ~200 μL de la pastille d’algues et placez-le dans un nouveau tube de microcentrifugation.
REMARQUE : Il s’agira de l’échantillon de protéines qui sera utilisé pour normaliser les données. Conservez-le à −20 °C avant de l’analyser, si nécessaire. - Remettre en suspension la pastille d’algues dans 1 mL d’eau de mer filtrée en pipetant doucement de haut en bas. Si nécessaire, diluez la suspension d’algues pour faciliter le comptage cellulaire.
- Effectuer une numération cellulaire à l’aide d’un hémocytomètre sous un microscope optique en ajoutant 10 μL dans l’une des chambres. Effectuer 8 à 10 comptages par échantillon.
NOTA : D’autres méthodes de dénombrement des cellules algales peuvent également être appliquées lorsqu’elles sont disponibles (p. ex., cytométrie en flux, microscopie confocale à haut débit). - Calculer la concentration des cellules symbiotes (mL−1), en tenant compte des facteurs de dilution utilisés.
- Dosage de la teneur en protéines
- Quantifier la teneur en protéines de l’échantillon (par exemple, via le test colorimétrique de Bradford, tel que décrit initialement par Bradford et al.33, ou le test de Lowry34,35, dont le protocole a été décrit pour les cnidaires ailleurs 36).
- Extraction de la chlorophylle a
- Utilisez une pastille cellulaire de ~200 000 cellules, congelée ou fraîche.
- Transférer chaque pastille d’algues dans 2 mL de diméthylformamide (DMF) dans un flacon à scintillation en verre et incuber à l’obscurité à 4 °C pendant 48 h.
REMARQUE : Le DMF est toxique et cancérigène, de sorte que la préparation de l’échantillon doit être effectuée sous une hotte aussi sombre que possible et sur de la glace. S’il y a < 200 000 cellules, utilisez moins de DMF. - Centrifuger pendant 3 min à 16 000 × g.
- Transférez 200 ml dans une plaque à puits UV-96 pour les mesures photométriques. Exécutez chaque échantillon en trois exemplaires avec DMF comme blanc.
- Mesurez l’absorbance aux longueurs d’onde (E) 663,8 nm, 646 nm et 750 nm. Soustrayez l’absorbance à 750 nm de l’absorbance aux deux autres longueurs d’onde.
REMARQUE : La mesure à 750 nm corrige toute dispersion ou turbidité dans l’échantillon. - Calculer la concentration en chlorophylle a (μg/mL) à l’aide de l’équation (1) :
Concentration de Chl a (μg/mL) = (12,00 × E 663,8) - (3,11 × E646,8) (1)
13. Quantification de la biomasse cellulaire après extraction de métabolites pour normalisation
NOTA : Il existe deux options pour la quantification de la biomasse cellulaire décrites ci-dessous : la quantification des protéines liées à la biomasse à l’aide d’une méthode colorimétrique Bradford modifiée et la mesure du poids sec des débris cellulaires. L’une ou l’autre méthode est appropriée, car les deux offrent une quantification précise de la biomasse cellulaire.
- Teneur en protéines des débris cellulaires
- Remettre en suspension les débris cellulaires congelés avec 1 mL de NaOH 0,2 M et incuber les échantillons à 98 °C pendant 20 min.
- Refroidir les échantillons sur de la glace pendant ~10 min et centrifuger à 3 000 × g pendant 5 min à température ambiante.
- Quantifier la teneur en protéines de l’échantillon (p. ex., à l’aide du test colorimétrique de Bradford, tel que décrit initialement par Bradford et al.33 et modifié par Smart et al.37).
- Mesure du poids sec des débris cellulaires
- Remettre en suspension les débris cellulaires issus de l’extraction des métabolites intracellulaires dans de l’eau doublement distillée (~10 mL).
- Filtrer la solution sous vide à l’aide d’un filtre à membrane prépesé (pores de 0,22 μm, 47 mm).
- Lavez deux fois les tubes contenant de la biomasse avec de l’eau ultrapure pour assurer le transfert complet de la biomasse vers le filtre à membrane.
- Retirez le filtre à membrane contenant la biomasse et séchez-le à l’aide d’un four à micro-ondes (faible puissance ; ~250 W pendant 20 min).
- Conservez le papier filtre dans un dessiccateur pendant la nuit. Enregistrez le poids sec du papier filtre et calculez le poids sec de la biomasse en soustrayant le poids du filtre à membrane sèche (à l’aide d’un filtre à membrane propre et sec séché à côté du filtre à échantillon) du poids total.
14. Analyse des données
- Analysez les cibles de métabolites à l’aide de bases de données de métabolites où chaque cible est composée d’un quantificateur et d’un qualificateur MRM.
- Inspectez visuellement les cibles de métabolites détectées et intégrez-les manuellement au besoin.
- Utilisez une aire de pic de métabolites pour calculer l’abondance relative de chaque échantillon pour chaque groupe. Les valeurs sont corrigées à blanc et normalisées pour échantillonner la zone de pic standard interne, puis pour échantillonner la teneur en protéines des débris cellulaires conformément à Smart et al.37.
- Éliminer les métabolites dont l’écart-type relatif est supérieur à 35 % dans tous les groupes de traitement (N = 23 métabolites).
- Transformez les données (par exemple, la racine cubique) et centrez-les moyennement ; confirment une distribution normale et une homogénéité de la variance.
- Effectuer l’analyse des données (ANOVA et construction de cartes thermiques, p. ex., à l’aide de https://www.metaboanalyst.ca)38. Regroupez les échantillons pour examiner la variabilité au sein du traitement à l’aide des packages « cluster », « factoextra » et « klustR ». Calculez la statistique d’écart (une méthode pour déterminer le nombre optimal d’agrégats39) à l’aide de la fonction « clusGap » dans R et tracez à l’aide du package R « tidyverse ». Effectuer des PERMANOVAs pour examiner l’importance de la séparation entre les profils de métabolites du traitement (p. ex., dans Primer).
Access restricted. Please log in or start a trial to view this content.
Résultats
Toutes les données produites au cours de ces travaux sont disponibles dans les informations complémentaires.
Séparation hôte-symbiote
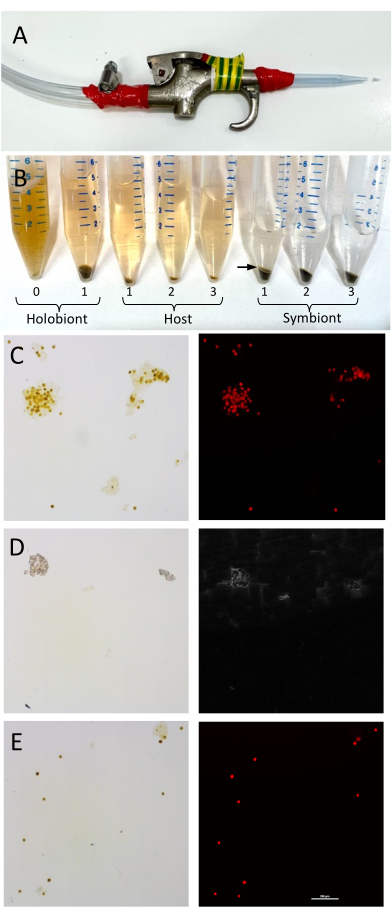
Figure 1 : Mise en place et validation de la séparation des tissus de l’hôte corallien et des cellules de Symbiodiniaceae. (A
Access restricted. Please log in or start a trial to view this content.
Discussion
La séparation de l’hôte et du symbiote est facilement et rapidement réalisable par simple centrifugation, et les résultats montrent ici que la séparation des fractions peut fournir des informations précieuses indiquant des contributions spécifiques des membres de l’holobionte, ce qui peut contribuer à l’analyse fonctionnelle de la santé des coraux. Chez les coraux adultes, la synthèse des lipides est principalement effectuée par le symbiote algalerésident 40, qui fournit...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
J.L.M. a bénéficié d’une bourse de recherche du chancelier de l’UTS.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 100% LC-grade methanol | Merck | 439193 | LC grade essential |
| 2 mL microcentrifuge tubes, PP | Eppendorf | 30121880 | Polypropylene provides high resistance to chemicals, mechanical stress and temperature extremes |
| 2030 Shimadzu gas chromatograph | Shimadzu | GC-2030 | |
| 710-1180 µm acid-washed glass beads | Merck | G1152 | This size is optimal for breaking the Symbiodiniaceae cells |
| AOC-6000 Plus Multifunctional autosampler | Shimadzu | AOC6000 | |
| Bradford reagent | Merck | B6916 | Any protein colourimetric reagent is acceptable |
| Compressed air gun | Ozito | 6270636 | Similar design acceptable. Having a fitting to fit a 1 mL tip over is critical. |
| DB-5 column with 0.25 mm internal diameter column and 1 µm film thickness | Agilent | 122-5013 | |
| DMF | Merck | RTC000098 | |
| D-Sorbitol-6-13C and/or 13C5–15N Valine | Merck | 605514/ 600148 | Either or both internal standards can be added to the methanol. |
| Flat bottom 96-well plate | Merck | CLS3614 | |
| Glass scintillation vials | Merck | V7130 | 20 mL, with non-plastic seal |
| Immunoglogin G | Merck | 56834 | if not availbe, Bovine Serum Albumin is acceptable |
| Primer | v4 | ||
| R | v4.1.2 | ||
| Shimadzu LabSolutions Insight software | v3.6 | ||
| Sodium Hydroxide | Merck | S5881 | Pellets to make 1 M solution |
| tidyverse | v1.3.1 | R package | |
| TissueLyser LT | Qiagen | 85600 | Or similar |
| TQ8050NX triple quadrupole mass spectrometer | Shimadzu | GCMS-TQ8050 NX | |
| UV-96 well plate | Greiner | M3812 | |
| Whirl-Pak sample bag | Merck | WPB01018WA | Sample collection bag; Size: big enough to house a ~5 cm coral fragment, but not too big that the water is too spread |
Références
- Bundy, J. G., Davey, M. P., Viant, M. R. Environmental metabolomics: A critical review and future perspectives. Metabolomics. 5 (1), 3-21 (2008).
- Matthews, J. L., et al. The metabolic significance of symbiont community composition in the coral-algal symbiosis. Applied Environmental Metabolomics. Beale, D. J., Hillyer, K. E., Warden, A. C., Jones, O. A. H. , Academic Press. Cambridge, MA. 211-229 (2022).
- Lawson, C. A., et al. Informing coral reef conservation through metabolomic approaches. Coral Reef Conservation and Restoration in the Omics Age. Coral Reefs of the World. van Oppen, M. J. H., Aranda Lastra, M. , Springer. Cham, Switzerland. 179-202 (2022).
- LaJeunesse, T. C., et al. Systematic revision of Symbiodiniaceae highlights the antiquity and diversity of coral endosymbionts. Current Biology. 28 (16), 2570-2580 (2018).
- Rohwer, F., Seguritan, V., Azam, F., Knowlton, N. Diversity and distribution of coral-associated bacteria. Marine Ecology Progress Series. 243, 1-10 (2002).
- Maire, J., et al. Intracellular bacteria are common and taxonomically diverse in cultured and in hospite algal endosymbionts of coral reefs. The ISME Journal. 15 (7), 2028-2042 (2021).
- Hillyer, K. E., et al. Metabolite profiling of symbiont and host during thermal stress and bleaching in the coral Acropora aspera. Coral Reefs. 36, 105-118 (2016).
- Hillyer, K. E., Tumanov, S., Villas-Bôas, S., Davy, S. K. Metabolite profiling of symbiont and host during thermal stress and bleaching in a model cnidarian-dinoflagellate symbiosis. Journal of Experimental Biology. 219 (4), 516-527 (2016).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences of the United States of America. 114 (50), 13194-13199 (2017).
- Rosset, S. L., et al. The molecular language of the cnidarian-dinoflagellate symbiosis. Trends in Microbiology. 29 (4), 320-333 (2020).
- Matthews, J. L., et al. Partner switching and metabolic flux in a model cnidarian-dinoflagellate symbiosis. Royal Society. 285 (1892), 20182336(2018).
- González-Pech, R. A., et al. Physiological factors facilitating the persistence of Pocillopora aliciae and Plesiastrea versipora in temperate reefs of south-eastern Australia under ocean warming. Coral Reefs. 41, 1239-1253 (2022).
- Williams, A., et al. Metabolomic shifts associated with heat stress in coral holobionts. Science Advances. 7 (1), (2021).
- Deutsch, J. M., et al. Metabolomics of healthy and stony coral tissue loss disease affected Montastraea cavernosa corals. Frontiers in Marine Science. 8, 1421(2021).
- Stien, D., et al. A unique approach to monitor stress in coral exposed to emerging pollutants. Scientific Reports. 10 (1), 9601(2020).
- Lohr, K. E., et al. Resolving coral photoacclimation dynamics through coupled photophysiological and metabolomic profiling. Journal of Experimental Biology. 222 (8), (2019).
- Jorissen, H., et al. Coral larval settlement preferences linked to crustose coralline algae with distinct chemical and microbial signatures. Scientific Reports. 11 (1), 14610(2021).
- Roach, T. N., Dilworth, J., Jones, A. D., Quinn, R. A., Drury, C. Metabolomic signatures of coral bleaching history. Nature Ecology & Evolution. 5 (4), 495-503 (2021).
- Parkinson, J. E., et al. Molecular tools for coral reef restoration: Beyond biomarker discovery. Conservation Letters. 13 (1), 12687(2020).
- Jiang, J., et al. How Symbiodiniaceae meets the challenges of life during coral bleaching. Coral Reefs. 40, 1339-1353 (2021).
- Guerra, F. D., Attia, M. F., Whitehead, D. C., Alexis, F. Nanotechnology for environmental remediation: materials and applications. Molecules. 23 (7), 1760(2018).
- Matthews, J. L., et al. Metabolite pools of the reef building coral Montipora capitata are unaffected by Symbiodiniaceae community composition. Coral Reefs. 39, 1727-1737 (2020).
- Papina, M., Meziane, T., van Woesik, R. Symbiotic zooxanthellae provide the host-coral Montipora digitata with polyunsaturated fatty acids. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 135 (3), 533-537 (2003).
- Kellogg, R., Patton, J. Lipid droplets, medium of energy exchange in the symbiotic anemone Condylactis gigantea: A model coral polyp. Marine Biology. 75, 137-149 (1983).
- Ankrah, N. Y., Chouaia, B., Douglas, A. E. The cost of metabolic interactions in symbioses between insects and bacteria with reduced genomes. mBio. 9 (5), e01433(2018).
- Kabeya, N., et al. Genes for de novo biosynthesis of omega-3 polyunsaturated fatty acids are widespread in animals. Science Advances. 4 (5), (2018).
- Hillyer, K. E., Dias, D., Lutz, A., Roessner, U., Davy, S. K. 13C metabolomics reveals widespread change in carbon fate during coral bleaching. Metabolomics. 14 (1), 12(2018).
- Hillyer, K. E., Dias, D. A., Lutz, A., Roessner, U., Davy, S. K. Mapping carbon fate during bleaching in a model cnidarian symbiosis: the application of 13C metabolomics. New Phytologist. 214 (4), 1551-1562 (2017).
- Burriesci, M. S., Raab, T. K., Pringle, J. R. Evidence that glucose is the major transferred metabolite in dinoflagellate-cnidarian symbiosis. Journal of Experimental Biology. 215 (19), 3467-3477 (2012).
- Thurber, R. V., et al. Unified methods in collecting, preserving, and archiving coral bleaching and restoration specimens to increase sample utility and interdisciplinary collaboration. PeerJ. 10, 14176(2022).
- Grottoli, A. G., et al. Increasing comparability among coral bleaching experiments. Ecological Applications. 31 (4), 02262(2020).
- Mushtaq, M. Y., Choi, Y. H., Verpoorte, R., Wilson, E. G. Extraction for metabolomics: access to the metabolome. Phytochemical Analysis. 25 (4), 291-306 (2014).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1), 248-254 (1976).
- Peterson, G. L., et al. A simplification of the protein assay method of Lowry et al. which is more generally applicable. Analytical Biochemistry. 83 (2), 346-356 (1977).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Zamer, W. E., Shick, J. M., Tapley, D. W. Protein measurement and energetic considerations: Comparisons of biochemical and stoichiometric methods using bovine serum albumin and protein isolated from sea anemones. Limnology and Oceanography. 34 (1), 256-263 (1989).
- Smart, K. F., Aggio, R. B., Van Houtte, J. R., Villas-Boas, S. G. Analytical platform for metabolome analysis of microbial cells using methyl chloroformate derivatization followed by gas chromatography-mass spectrometry. Nature Protocols. 5 (10), 1709-1729 (2010).
- Pang, Z., et al. Using MetaboAnalyst 5.0 for LC-HRMS spectra processing, multi-omics integration and covariate adjustment of global metabolomics data. Nature Protocols. 17 (8), 1735-1761 (2022).
- Tibshirani, R., Walther, G., Hastie, T. Estimating the number of clusters in a data set via the gap statistic. Journal of the Royal Statistical Society: Series B (Statistical Methodology). 63 (2), 411-423 (2001).
- Chen, W. -N., et al. Diel rhythmicity of lipid-body formation in a coral-Symbiodinium endosymbiosis). Coral Reefs. 31 (2), 521-534 (2012).
- Imbs, A. Fatty acids and other lipids of corals: composition, distribution, and biosynthesis. Russian Journal of Marine Biology. 39 (3), 153-168 (2013).
- Rosset, S., et al. Lipidome analysis of Symbiodiniaceae reveals possible mechanisms of heat stress tolerance in reef coral symbionts. Coral Reefs. 38 (6), 1241-1253 (2019).
- Carreón-Palau, L., Parrish, C. C., Del Angel-Rodriguez, J. A., Perez-Espana, H. Seasonal shifts in fatty acids and sterols in sponges, corals, and bivalves, in a southern Gulf of Mexico coral reef under river influence. Coral Reefs. 40 (2), 571-593 (2021).
- Imbs, A. B., Dang, L. T. Seasonal dynamics of fatty acid biomarkers in the soft coral Sinularia flexibilis, a common species of Indo-Pacific coral reefs. Biochemical Systematics and Ecology. 96, 104246(2021).
- Oku, H., Yamashiro, H., Onaga, K., Sakai, K., Iwasaki, H. Seasonal changes in the content and composition of lipids in the coral Goniastrea aspera. Coral Reefs. 22 (1), 83-85 (2003).
- Weis, V. M. Cell biology of coral symbiosis: foundational study can inform solutions to the coral reef crisis. Integrative and Comparative Biology. 59 (4), 845-855 (2019).
- Oakley, C., Davy, S. Cell biology of coral bleaching. Coral Bleaching. van Oppen, M., Lough, J. , Springer. Cham, Switzerland. 189-211 (2018).
- Lu, W., et al. Metabolite measurement: Pitfalls to avoid and practices to follow. Annual Review of Biochemistry. 86, 277-304 (2017).
- Lawson, C. A., et al. Heat stress decreases the diversity, abundance and functional potential of coral gas emissions. Global Change Biology. 27 (4), 879-891 (2021).
- Olander, A., et al. Comparative volatilomics of coral endosymbionts from one-and comprehensive two-dimensional gas chromatography approaches. Marine Biology. 168 (5), 76(2021).
- Wuerz, M., et al. Symbiosis induces unique volatile profiles in the model cnidarian Aiptasia. Journal of Experimental Biology. 225 (19), (2022).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon