Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Gaz Kromatografisi-Kütle Spektrometresi Tabanlı Sert Mercan Örneklerinin Hedefli Metabolomikleri
Bu Makalede
Özet
Burada, gaz kromatografisi-kütle spektrometrisi analizi için bir mercan holobiontundan polar ve yarı polar metabolitlerin yanı sıra ayrılmış mercan konakçı dokusu ve Symbiodiniaceae hücre fraksiyonlarının ekstraksiyonunu ve hazırlanmasını sunuyoruz.
Özet
Gaz kromatografisi-kütle spektrometresi (GC-MS) tabanlı yaklaşımların, cnidarian-dinoflagellat simbiyozunun metabolik temelini ve mercanın strese nasıl tepki verdiğini (yani, sıcaklığa bağlı ağartma sırasında) aydınlatmak için güçlü olduğu kanıtlanmıştır. Cnidarian konakçısını ve onunla ilişkili mikropları (Symbiodiniaceae ve diğer protistler, bakteriler, arkeler, mantarlar ve virüsler) içeren mercan holobiontunun kararlı durum metabolit profili, mercanın bütünsel metabolik durumunu karakterize etmek için ortam ve stres koşulları altında başarıyla uygulanmıştır.
Bununla birlikte, simbiyotik etkileşimleri çevreleyen soruları cevaplamak için, mercan konakçısının ve alg simbiyontlarının metabolit profillerini bağımsız olarak analiz etmek gerekir, bu da yalnızca dokuların fiziksel olarak ayrılması ve izolasyonu ile elde edilebilir, ardından bağımsız ekstraksiyon ve analiz ile elde edilebilir. Metabolomiklerin uygulanması mercan alanı için nispeten yeni olsa da, araştırma gruplarının sürekli çabaları, mercan konakçı dokusunun ve alg simbiyontlarının ayrılması da dahil olmak üzere mercanlardaki metabolitleri analiz etmek için sağlam yöntemlerin geliştirilmesiyle sonuçlanmıştır.
Bu makale, dikkate alınması gereken temel optimizasyon adımları da dahil olmak üzere, GC-MS analizi için holobiont ayrımı ve metabolitlerin ekstraksiyonu için adım adım bir kılavuz sunmaktadır. Bağımsız olarak analiz edildikten sonra, iki fraksiyonun (mercan ve Symbiodiniaceae) birleşik metabolit profilinin bütünün profiline (holobiont) nasıl benzer olduğunu gösteriyoruz, ancak dokuları ayırarak, iki ortağın metabolizması ve etkileşimleri hakkında tek başına bütünden elde edilemeyen önemli bilgiler de elde edebiliriz.
Giriş
Metabolitler, hücresel süreçlerin son ürünlerini temsil eder ve metabolomikler - belirli bir organizma veya ekosistem tarafından üretilen metabolitler paketinin incelenmesi - organizma işleyişinin doğrudan bir ölçüsünü sağlayabilir1. Bu, ekosistemleri, simbiyotik etkileşimleri ve restorasyon araçlarını keşfetmek için özellikle kritiktir, çünkü çoğu yönetim stratejisinin amacı belirli ekosistem hizmet işlevlerini korumak (veya geri yüklemek)2. Mercan resifleri, simbiyotik etkileşimleri aydınlatmak ve mercan fizyolojik tepkilerini topluluk düzeyinde ve ekosistem düzeyinde etkilere bağlamak için metabolomiklerin potansiyel değerini gösteren bir su ekosistemidir3. Yüksek verimli gaz kromatografisi-kütle spektrometrisinin (GC-MS) uygulanması, yüksek seçicilik ve hassasiyetle aynı anda çok çeşitli metabolit sınıflarını hızlı bir şekilde analiz etme, spektral kitaplıklar mevcut olduğunda hızlı bileşik tanımlaması sağlama ve numune başına nispeten düşük bir maliyetle yüksek düzeyde tekrarlanabilirlik ve doğruluk sağlama kapasitesi nedeniyle özellikle değerlidir.
Mercanlar, mercan hayvanı, fotosentetik dinoflagellat endosimbiyontlar (aile: Symbiodiniaceae4) ve karmaşık bir mikrobiyom 5,6'dan oluşan holobiontlardır. Genel olarak, holobiontun uygunluğu, öncelikle her bir üyeninmetabolik işleyişini desteklemek için küçük moleküllerin ve elementlerin değiş tokuşu yoluyla korunur 7,8,9,10. Metabolomik yaklaşımların, simbiyoz özgüllüğününmetabolik temelini aydınlatmak için özellikle güçlü olduğu kanıtlanmıştır 9,11, termal strese ağartma tepkisi 7,8,12,13, hastalık tepkileri 14, kirliliğe maruz kalma tepkileri 15, fotoiklimlendirme 16 ve kimyasal sinyalleşme 17 mercanlarda ve ayrıca biyobelirteç keşfine yardımcı olmak 18,19. Ek olarak, metabolomikler, DNA ve RNA tabanlı tekniklerdençıkarılan sonuçların değerli bir şekilde doğrulanmasını sağlayabilir 9,20. Bu nedenle, resif sağlığını değerlendirmek ve resiflerin korunması için araçlar geliştirmek için metabolomiklerinkullanımı için önemli bir potansiyel vardır 3, örneğin stresin metabolik biyobelirteçlerininsaptanması 18,19 ve beslenme sübvansiyonları gibi aktif yönetim stratejilerinin potansiyelini incelemek için21.
Konakçı ve simbiyont hücreleri ayırmak ve metabolit profillerini holobiont olarak birlikte değil, bağımsız olarak analiz etmek, partner etkileşimleri, bağımsız fizyolojik ve metabolik durumlar ve adaptasyon için potansiyel moleküler mekanizmalar hakkında daha fazla bilgi verebilir 11,12,22,23,24. Mercan ve Symbiodiniaceae'yi ayırmadan, karmaşık genom rekonstrüksiyonu ve metabolik modelleme25 dışında, mercan ve/veya Symbiodiniaceae'nin katkısını ve metabolizmasını bağımsız olarak aydınlatmak neredeyse imkansızdır, ancak bu henüz mercan-dinoflagellat simbiyozuna uygulanmamıştır. Ayrıca, konakçının veya alg simbiyontunun bireysel metabolizması hakkında holobiontun metabolit profilinden bilgi çıkarmaya çalışmak yanlış yorumlamaya yol açabilir.
Örneğin, yakın zamana kadar, mercan ve holobiont dokularından elde edilen ekstraktlarda C18: 3n-6, C18: 4n-3 ve C16 çoklu doymamış yağ asitlerinin varlığının, mercanların omega-3 (ω3) yağ asitlerinin üretimi için gerekli olan ωx desatürazlara sahip olmadığı varsayıldığından, alg simbiyontundan türetildiği düşünülüyordu; bununla birlikte, son genomik kanıtlar, çoklu cnidarian'ın ω3 PUFA de novo üretme ve daha fazla biyosentez yapma yeteneğine sahip olduğunu göstermektedir.3 uzun zincirli PUFA26. GC-MS'nin kararlı izotopik etiketleme (örneğin, 13 C-bikarbonat, NaH 13CO 3) ile birleştirilmesi, hem kontrol koşulları altında hem de dış stres faktörlerine yanıt olarak mercan holobiont metabolik ağları yoluyla fotosentetik olarak sabitlenmiş karbonun kaderini izlemek için kullanılabilir27,28. Bununla birlikte, 13 ° C'nin kaderinin izlenmesinde kritik bir adım, mercan dokusunun alg hücrelerinden ayrılmasıdır - ancak o zaman mercan konakçı fraksiyonunda 13C etiketli bir bileşiğin varlığı, mercana translokasyonlu bir Symbiodiniaceae türevi metabolit veya translokasyonlu etiketli bir bileşiğin aşağı akış ürünü olarak kesin olarak atanabilir. Bu teknik, gliserolün, fotosentezin ortakyaşamdan konakçıya29 yer değiştirdiği birincil form olduğu varsayımına meydan okuyarak ve ayrıca ağartma27,28 sırasında ve uyumsuz Symbiodiniaceae türlerine yanıt olarak eşler arası beslenme akışının nasıl değiştiğini açıklayarak gücünü göstermiştir11.
Dokuları ayırma kararı öncelikle araştırma sorusu tarafından yönlendirilirken, bu yaklaşımın pratikliği, güvenilirliği ve potansiyel metabolik etkilerinin dikkate alınması önemlidir. Burada, holobionttan metabolitlerin yanı sıra ayrı konakçı ve simbiyont fraksiyonlarından ekstraksiyonu için ayrıntılı, kanıtlanmış yöntemler sunuyoruz. Konak ve simbiyotun metabolit profillerini bağımsız olarak karşılaştırıyoruz ve bu profillerin holobiont metabolit profiliyle nasıl karşılaştırıldığını karşılaştırıyoruz.
Access restricted. Please log in or start a trial to view this content.
Protokol
NOT: Deney tasarımı, numune toplama ve saklama 2,30,31 başka bir yerde ayrıntılı olarak açıklanmıştır. Yabani mercanların toplanması için izin onayı, toplama ve deneyden önce alınmalıdır. Buradaki örnekler, Batavia Mercan Çiftlikleri'nden (Geraldton, WA) ithal edilen Montipora mollis (yeşil renk morfu) kolonilerinden toplanmıştır ve orijinal olarak Abrohlos Adaları açıklarındaki bir resiften toplanmıştır (Batı Avustralya; 28°52'43.3"S 114°00'17.0"E) Su Ürünleri Yetiştiriciliği Lisansı AQ1643 kapsamında 1 m derinlikte. Örneklemeden önce, koloniler 35 PSU'da 800 L'lik bir akvaryumda, 150 μmol fotonlarda mavi ve beyaz ışık altında 150 μmol fotonlar · - 2 · s − 1 ve 25 ° C'±de 0.5 ° C'de 3 ay boyunca tutuldu. Mercan parçaları (~5 cm2, N = 6) sıvı nitrojen içinde donduruldu ve işlenene kadar −80 ° C'de saklandı.
1. Ekstraksiyon çözeltilerinin ve ekipmanlarının hazırlanması
- Mercan dokusunun çıkarılmasından en az 1 gün önce, ekstraksiyon solüsyonlarını ve ekipmanını hazırlayın.
- Ultra saf suyu temiz, deterjan içermeyen cam eşyalarda 4 °C'de soğutun.
- %100 LC sınıfı metanolü 10 μg·mL−1 uygun dahili standart(lar)ın nihai konsantrasyonu (örneğin, 13C6 sorbitol) ile karıştırın.
- Yarısı %100 LC sınıfı metanol ve yarısı ultra saf su kullanarak %50 metanol ekstraksiyon solüsyonu oluşturun. Her iki metanol çözeltisini de −20 °C'de saklayın.
NOT: Metabolitlerin bozunmasını önlemeye yardımcı olmak için, numune işleme adımlarının bir seferde beş mercan parçasından oluşan gruplar halinde, bir ek biyolojik (yalnızca su) boş (toplam numune N = 6) ile gerçekleştirilmesi önerilir. Her mercan numunesi iki fraksiyona ayrıldıktan sonra (mercan konakçı dokusu, bundan böyle "Konakçı" ve mikroalg hücreleri, bundan böyle "Simbiyont"), bir işleme partisindeki toplam numune sayısı 12 olacaktır.
2. Mercan metabolizması söndürme
NOT: Deney tasarımı, numune toplama ve saklama 2,30,31 başka bir yerde ayrıntılı olarak açıklanmıştır. Bununla birlikte, metabolizmayı söndürmek için geçen sürenin (yani, mercan örneğinin toplanması ve korunması arasındaki sürenin) orijinal yanıtı yakalamak için kritik olduğuna dikkat edilmelidir30. Numunenin bozulması veya hedef olmayan fizyolojik tepkiler nedeniyle metabolit bileşimindeki değişiklikleri önlemek için numuneyi aldıktan sonra mümkün olduğunca çabuk koruyun32.
- Mercan parçasını steril bir numune toplama torbasına koyun ve fazla deniz suyunu mümkün olduğunca boşaltın. Numuneyi en az 30 saniye boyunca sıvı nitrojene batırın. Numuneleri saklamak için mümkün olan en kısa sürede −80 °C'lik bir dondurucuya taşıyın.
NOT: Numuneler, donma-çözülme döngülerinden kaçınarak, işlenene kadar ışık blokajlı kaplarda −80°C'de dondurulabilir.
3. İskeletten mercan dokusunun çıkarılması
NOT: Numuneler, devam eden metabolizmayı önlerken aynı anda sıvı halde olmalarını sağlamak için her zaman buz (4 °C) üzerinde tutulmalıdır.
- Buzun üzerine temiz, steril bir numune toplama torbası yerleştirin, böylece torba sabit kalır ve sığ bir kuyuda buzun üzerinde açılır, ancak buza batırılmaz. Torbaya 10 mL soğuk (4 °C) ultra saf su ekleyin.
NOT: Bu, soğuk basınçlı hava ve çevredeki buz nedeniyle mercan parçasının tekrar tekrar donarak çözülmesini önlemeye yardımcı olacaktır. - Sterilize edilmiş cımbızla bir mercan parçası seçin ve deniz suyu kalıntısı kalmayana kadar steril bir Pasteur pipeti kullanarak soğuk (4 °C) ultra saf suyla durulayın. Durulanmış mercan parçasını 10 mL ultra saf su içeren torbaya daldırın.
NOT: Bu durulama, aşağı akış analizine müdahale edebilecek kalıntı tuzları gidermek için kritik öneme sahiptir. Numuneyi 4 °C'de tutmak için torbanın içinden su veya mercan parçasıyla elle temasından kaçının. - Steril bir 1 mL pipet ucunu, ucun ucunu ~5 mm kesecek şekilde elektrik bandı ile bir hava tabancasının ucuna bantlayın (Şekil 1A).
- Suyun mercan parçası üzerinde dairesel bir hareketini teşvik ederek dokuyu nazikçe çıkarmak için hava tabancasını torba yarı kapalı ve hava akışı düşük ortamda mercan parçasına doğrultun.
- ~3 dakika sonra veya tüm doku iskeletten çıkarılmış gibi göründüğünde, havayı kapatın ve airbrush'ı çıkarın. Torbayı tamamen kapatın.
- Çıkarılan tüm mercan dokusunu torbanın alt köşesine sıkın. Karşı köşeyi kesin ve torbanın içindekileri buz üzerinde 15 mL'lik bir tüpe yavaşça dökün.
4. Opsiyonel homojenizasyon
NOT: Bazı mercan türleri diğerlerinden daha viskozdur, yani havayla fırçalama, dokuyu bir bulamaç yerine kümeler halinde çıkaracaktır. Havalı fırçalanmış homojenatta doku kümeleri görülüyorsa, tüm numuneler için 4 °C'de bir homojenizasyon adımı eklenebilir.
- Mekanik testere dişli homojenizatörü iki kez 4 °C %70 metanol ve son olarak 4 °C ultra saf su ile temizleyin.
- Mercan numunesini, numune tamamen homojenize olana ve hiçbir topak görünmeyene kadar ~15 mL'lik bir tüpte ~1 dakika homojenize edin.
- Homojenizatörü her numune arasında adım 4.1'deki gibi temizleyin. Homojenizasyon süresini numuneler arasında tutarlı tutun.
5. Normalizasyon için örnek toplama
- Symbiodiniaceae hücre sayımı, mercan konak dokusu protein içeriği analizi ve klorofil tahmini için homojenize dokudan 1.000 μL'lik bir alikot toplayın. Analize hazır olana kadar −20 °C'de saklayın (bölüm 10).
6. İsteğe bağlı mercan konakçı dokusu-Symbiodiniaceae hücre ayrımı
- Mercan homojenatını soğutmalı bir santrifüj kullanarak 2.500 × g'da 4 °C'de 5 dakika santrifüjleyin.
NOT: Bu hız, hücre duvarlarını sağlam tutarken, süpernatantta asılı kalan konakçı dokudan daha ağır Symbiodiniaceae hücrelerini ayırmak için idealdir. - Konakçı materyali içeren süpernatanı çıkarın ve 15 mL'lik yeni bir tüpe yerleştirin.
NOT: Konakçı dokudan gelen lipitler tipik olarak simbiyont hücrelerin üzerinde dar pembe / beyaz bir tabaka oluşturur. Bu katman, pipetleme yoluyla çözünür konakçı süpernatan ile birlikte toplanabilir (Şekil 1B). - Ev sahibini tam olarak 1 dakika boyunca kuvvetlice girdaplayın. Alg pelet örneğini ve konakçı süpernatan örneğini buz üzerinde tutun.
- Alg peletine 4 °C'de 2 mL ultra saf su ekleyin. Tam olarak kuvvetlice girdap 2 peleti yeniden süspanse etmek için dakika.
NOT: Symbiodiniaceae genotiplemesi için mercan kolonisinden 1 cm'lik tek tek parçalar toplanmadıysa, Symbiodiniaceae hücre süspansiyonunun 200 μL'lik bir alikotu burada toplanabilir, tercih edilen DNA tampon çözeltisinde korunabilir ve Symbiodiniaceae genotiplemesi için Thurber ve ark.30'da açıklandığı gibi saklanabilir (örneğin, González-Pech ve ark.12'ye göre). - 6.1-6.4 arasındaki adımları bir kez daha tekrarlayın.
NOT: Konakçı ve simbiyotun güvenilir bir şekilde ayrılması, bazı türler diğerlerinden daha viskoz olabileceğinden, mercan biyokütlesine ve türlerine bağlıdır. En az üç yıkama adımı önerilir, ancak bu, ayırma başarısına bağlı olarak artırılabilir. Konakçı fraksiyonun dibinde hiçbir Symbiodiniaceae hücresi görülmeyene ve Symbiodiniaceae fraksiyonu görünür şekilde konakçı materyalden arınana kadar (örneğin, üstte beyaz tabaka kalmayana) yıkama adımları 4.7-4.9'u tekrarlayın (Şekil 1). - Konakçı materyali içeren süpernatanı çıkarın ve 15 mL'lik yeni bir tüpe yerleştirin.
- Simbiyont peletini 15 mL'lik tüpte tutun.
7. Numune kurutma
- Holobiont homojenatı veya hem ayrılmış konakçıyı hem de Symbiodiniaceae fraksiyonlarını −80 °C'de ~120 dakika dondurun. Numuneleri gece boyunca −85 °C'de 0,01 mbar vakumla liyofilize edin.
NOT: Liyofilizasyon sırasında numune kaybını önlemek için, steril 25 G'lik bir iğne kullanılarak dikkatlice delinmiş ~2 mm'lik bir delik ile başka bir steril tüpten kesilmiş bir kapak veya steril parafilm kullanılması önerilir. - Kuruduğunda, bir laboratuvar terazisi kullanarak aşağıdakilerden birini tartın: 1) 25 mg holobiont; 2) 15 mg simbiyont fraksiyonu; veya 3) her numuneden 30 mg konakçı doku, ayrı 2 mL plastikleştirici içermeyen mikrosantrifüj tüplerine.
NOT: Kritik adım: Biyokütlenin ekstraksiyon için optimizasyonu, yeterli sinyal sağlarken GC-MS'nin aşırı yüklenmemesini sağlamak için gereklidir. Kurutulmuş mercan malzemesi çok statiktir. Numune kaybını önlemek için, numunelerden ve tartım kaplarından gelen elektrostatik yükleri ortadan kaldırmak için antistatik cihazlar kullanın. Basit ve uygun maliyetli bir alternatif, numune tüpünün altına bir çamaşır kurutma kağıdı yerleştirmektir. Kurutulmuş simbiyont peleti, steril bir bıçak kullanılarak istenen ağırlıkta kesilebilir.
8. Hücre içi metabolit ekstraksiyonları
- Liyofilize holobionttan hücre içi metabolit ekstraksiyonu:
- 400 μL %100 soğuk (−20 °C) metanol ekleyin ve dahili standart/lar (IS; 13Her tüpeC6 sorbitol ve/veya 13C5-15 N valin, 10μM'de.
- Her numuneye az sayıda 710-1.180 μm asitle yıkanmış cam boncuk (~10 mg) ekleyin. Önceden soğutulmuş (−20 °C) bir boncuk değirmeni ekinde 50 Hz'de 3 dakika boyunca bir boncuk değirmenine yerleştirin.
- Her tüpe ek olarak 600 μL %100 soğuk (−20 °C) IS'li metanol (13 C6 sorbitol ve/veya 13C 5-15 N valin, 10μM'de) ekleyin.
- 1 dakika karıştırmak için girdap. 4 °C'de 30 dakika boyunca bir döner çalkalayıcı üzerine koyun.
- Ayrılmış liyofilize Symbiodiniaceae hücrelerinden hücre içi metabolit ekstraksiyonu:
- Kurutulmuş Symbiodiniaceae malzemesine IS'li (13 C6 sorbitol ve / veya 13C5-15 N valin, 10 μM'de) 200 μL %100soğuk (−20 ° C) metanol ekleyin.
- Az sayıda 710-1.180 μm asitle yıkanmış cam boncuk (~ 10 mg) ekleyin. Önceden soğutulmuş (−20 °C) bir boncuk değirmeni ekinde 50 Hz'de 3 dakika boyunca bir boncuk değirmenine yerleştirin.
- IS'lerle birlikte 800 μL daha %100 soğuk (−20 °C) metanol ekleyin ve 30 saniye boyunca girdap yapın.
- Ayrılmış liyofilize konakçı dokudan hücre içi metabolit ekstraksiyonu:
- Kurutulmuş konakçı malzemeye 1 mL %100 soğuk (−20 °C) LC sınıfı metanol içeren IS'ler (13C6 sorbitol ve/veya 13C5-15 N valin, 10μM'de) ekleyin.
- 20 saniye boyunca karıştırmak için girdap. 30 dakika boyunca 4 ° C'ye ayarlanmış bir sonikasyon banyosunda yüzen bir tüp tutucuya yerleştirin.
9. Metabolit özü saflaştırması
- Numuneleri (holobiont/konakçı/simbiyont) 3.000 × g'da 4 °C'de 30 dakika santrifüjleyin.
- Tüm süpernatanı yeni bir 2 mL mikrosantrifüj tüpüne aktarın, hücre kalıntısı peletini rahatsız etmemeye dikkat edin.
NOT: Bunlar yarı polar özlerdir. Bunlar geçici olarak buz üzerinde tutulabilir, ancak karanlıkta −80 ° C'de uzun süre saklanabilir. - Kalan hücre kalıntılarına 1.000 μL %50 soğuk (−20 °C) metanol ekleyin. Yeniden askıya almak için 1 dakika kuvvetlice girdap.
- Numuneleri 3.000 × g'da 4 °C'de 30 dakika santrifüjleyin.
- Süpernatanı (polar ekstraktlar) aynı numuneden yarı polar ekstraktlarla toplayın ve bir araya getirin.
NOT: Hücre kalıntıları −80 °C'de saklanabilir ve protein içeriği normalizasyonu için kullanılabilir (bölüm 11). - Tüm çökeltileri gidermek için havuzlanmış ekstraktları 16.100 g'da 15 dakika santrifüjleyin ve süpernatanı plastikleştirici içermeyen yeni bir mikrosantrifüj tüpüne (2 mL) taşıyın.
NOT: Numune ekstraktları karanlıkta −80 °C'de saklanabilir. - Analiz etmeye hazır olduğunda, her ekstraktın 50 μL'sini bir cam parçaya ayırın. Bir vakum yoğunlaştırıcı kullanarak 30 ° C'de 30 dakika konsantre olun. Dört kez daha tekrarlayın (250 μL toplam kurutulmuş ekstrakt için).
NOT: Kurutulmuş numuneler, analize kadar kurutucu koşullar altında oda sıcaklığında saklanabilir.
10. Metabolit türevlendirmesi
NOT : Polar metabolitlerin metoksimasyonu ve trimetilsililasyonu için iki aşamalı bir çevrimiçi türevlendirme işlemi kullanılır.
- Her numuneye 25 μL metoksiyamin hidroklorür (piridin içinde 30 mg/mL) ekleyin.
- 37 saat boyunca 750 rpm'ye ayarlanmış bir orbital çalkalayıcıda 2 °C'de çalkalayın.
- Her numuneye 25 μL N,O-bis (trimetilsilil)trifloroasetamid + trimetilklorosilan ekleyin.
- 37 °C'de ve 750 rpm'de 1 saat boyunca tekrar çalkalayın.
- GC'ye 1:10 bölünmüş oranda 1 μL enjekte etmeden önce numunelerin oda sıcaklığında 1 saat dengelenmesine izin verin.
11. Gaz kromatografisi-kütle spektrometresi analizi
NOT: Kütle spektrometresi, tris-(perflorobutil)-amin (CF43) kullanılarak üreticinin tavsiyelerine göre ayarlanmalıdır.
- 1 mL/dk'lık sabit kolon akış hızında taşıyıcı gaz olarak ultra yüksek saflıkta helyum kullanın.
- 1 μm film kalınlığına ve 0,25 mm iç çapa sahip 30 m'lik bir DB-5 sütunu kullanın.
- GC fırın programı
- Giriş sıcaklığını 280 °C'ye ayarlayın.
- Enjeksiyona 100 °C fırın sıcaklığında başlayın ve 4 dakika bekleyin.
- Sıcaklığı 10 °C/dk artırarak 320 °C'ye yükseltin ve ardından 11 dakika basılı tutun.
- Kütle spektrometresi parametreleri
- MS transfer hattını 280 °C'ye ayarlayın ve iyon kaynağını 200 °C'ye ayarlayın.
- Çoklu reaksiyon izleme (MRM) ürün iyonunu oluşturmak için çarpışma hücresi gazı olarak argon kullanın.
- MRM hedeflerini içeren zaman segmentli bir MRM kitaplığına göre metabolit algılaması elde edin.
12. Symbiodiniaceae hücre sayımı, mercan konak dokusu protein içeriği analizi ve klorofil tahmini
- Symbiodiniaceae hücre sayımı:
- Mercan dokusu homojenatının bir alikotunu alın.
- Algleri peletlemek için numuneleri 2.000 × g'da santrifüjleyin.
- ~200 μL süpernatanı alg peletinden çıkarın ve yeni bir mikrosantrifüj tüpüne yerleştirin.
NOT: Bu, verileri normalleştirmek için kullanılacak protein örneği olacaktır; Gerekirse analiz etmeden önce −20 °C'de saklayın. - Alg peletini 1 mL filtrelenmiş deniz suyunda hafifçe yukarı ve aşağı pipetleyerek yeniden süspanse edin. Gerekirse, hücre sayımını kolaylaştırmak için alg süspansiyonunu seyreltin.
- Odalardan birine 10 μL ekleyerek ışık mikroskobu altında bir hemositometre kullanarak hücre sayımı yapın. Numune başına 8-10 sayım yapın.
NOT: Mümkün olduğunda alg hücrelerini saymak için alternatif yöntemler de uygulanabilir (örneğin, akış sitometrisi, yüksek verimli konfokal mikroskopi). - Kullanılan seyreltme faktörlerini dikkate alarak simbiyont hücrelerin konsantrasyonunu (mL-1) hesaplayın.
- Protein içeriği için test
- Örnek protein içeriğini ölçün (örneğin, başlangıçta Bradford ve ark.33 tarafından tanımlandığı gibi Bradford'un kolorimetrik testi veya protokolü başka yerlerdeki cnidarianlar için tarif edilen Lowry testi 34,35 yoluyla 36).
- Klorofil bir ekstraksiyon
- Dondurulmuş veya taze ~ 200.000 hücrelik bir hücre peleti kullanın.
- Her alg peletini bir cam sintilasyon şişesinde 2 mL dimetilformamid (DMF) içine aktarın ve karanlıkta 4 ° C'de 48 saat inkübe edin.
NOT: DMF toksik ve kanserojendir, bu nedenle numune hazırlama mümkün olduğunca karanlık bir çeker ocak altında ve buz üzerinde tamamlanmalıdır. 200.000'< hücre varsa, daha az DMF kullanın. - 16.000 × g'da 3 dakika santrifüjleyin.
- Fotometrik ölçümler için 200 mL'yi bir UV-96 kuyulu plakaya aktarın. Her örneği boşluk olarak DMF ile üç kopya halinde çalıştırın.
- Absorbansı (E) 663.8 nm, 646 nm ve 750 nm dalga boylarında ölçün. 750 nm'deki absorbansı, diğer dalga boylarının her ikisindeki absorbanstan çıkarın.
NOT: 750 nm'de ölçüm, numunedeki herhangi bir saçılma veya bulanıklığı düzeltir. - Denklem (1)'i kullanarak klorofil a konsantrasyonunu (μg/mL) hesaplayın:
Chl a konsantrasyonu (μg / mL) = (12.00 × E 663.8) - (3.11 × E646.8) (1)
13. Normalizasyon için metabolit ekstraksiyonlarını takiben hücre biyokütlesinin miktar tayini
NOT: Hücre biyokütlesinin miktar tayini için aşağıda açıklanan iki seçenek vardır: modifiye edilmiş bir Bradford kolorimetrik yöntemi kullanılarak biyokütle ile ilgili proteinin miktar tayini ve hücre enkazı kuru ağırlığının ölçümü. Her iki yöntem de hücre biyokütlesinin doğru bir şekilde ölçülmesini sağladığından, her iki yöntemin de kullanımı uygundur.
- Hücre kalıntısının protein içeriği
- Donmuş hücre kalıntılarını 1 mL 0.2 M NaOH ile yeniden süspanse edin ve numuneleri 98 ° C'de 20 dakika inkübe edin.
- Numuneleri buz üzerinde ~10 dakika soğutun ve ortam sıcaklığında 5 dakika boyunca 3.000 × g'da santrifüjleyin.
- Örnek protein içeriğini ölçün (örneğin, başlangıçta Bradford ve ark.33 tarafından tanımlandığı ve Smart ve ark.37 tarafından değiştirildiği gibi Bradford'un kolorimetrik testi yoluyla).
- Hücre döküntüsü kuru ağırlığının ölçülmesi
- Çift damıtılmış suda (~ 10 mL) hücre içi metabolit ekstraksiyonundan hücre kalıntılarını yeniden süspanse edin.
- Önceden tartılmış bir membran filtre (0,22 μm gözenek, 47 mm) kullanarak çözeltiyi vakum altında süzün.
- Biyokütlenin membran filtreye tam olarak aktarılmasını sağlamak için biyokütle içeren tüpleri iki kez ultra saf suyla yıkayın.
- Biyokütle içeren membran filtreyi çıkarın ve bir mikrodalga fırın kullanarak kurutun (düşük güç; 20 dakika boyunca ~250 W).
- Filtre kağıdını gece boyunca bir kurutucuda saklayın. Filtre kağıdının kuru ağırlığını kaydedin ve kuru membran filtrenin ağırlığını (numune filtresinin yanında kurutulmuş temiz bir kuru membran filtre kullanarak) toplam ağırlıktan çıkararak biyokütlenin kuru ağırlığını hesaplayın.
14. Veri analizi
- Her hedefin bir niceleyici ve niteleyici MRM'den oluştuğu metabolit veritabanlarını kullanarak metabolit hedeflerini analiz edin.
- Tespit edilen metabolit hedeflerini görsel olarak inceleyin ve gerektiğinde manuel olarak entegre edin.
- Her grup için her numunenin nispi bolluğunu hesaplamak için bir metabolit tepe alanı kullanın. Değerler, dahili standart tepe alanını örneklemek ve ardından Smart ve ark.37'ye göre hücre kalıntısı protein içeriğini örneklemek için boş düzeltilir ve normalleştirilir.
- Tüm tedavi gruplarında nispi standart sapması% 35'ten fazla olan metabolitleri atın (N = 23 metabolit).
- Verileri dönüştürün (örneğin, küp kökü) ve ortalamalarını ortalayın; Normal bir dağılım ve varyans homojenliğini onaylayın.
- Veri analizini gerçekleştirin (ANOVA ve ısı haritası oluşturma; örneğin, https://www.metaboanalyst.ca kullanarak)38. "cluster", "factoextra" ve "klustR" paketlerini kullanarak tedavi içi değişkenliği incelemek için numuneleri kümeleyin. R'deki "clusGap" fonksiyonunu kullanarak boşluk istatistiğini (en uygun kümesayısını 39 belirleme yöntemi) hesaplayın ve "tidyverse" R paketini kullanarak çizin. Tedavi metabolit profilleri arasındaki ayrımdaki önemi incelemek için PERMANOVA'ları uygulayın (örneğin, Primer'de).
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu çalışma sırasında üretilen tüm veriler ek bilgilerde mevcuttur.
Konak-simbiyont ayrımı
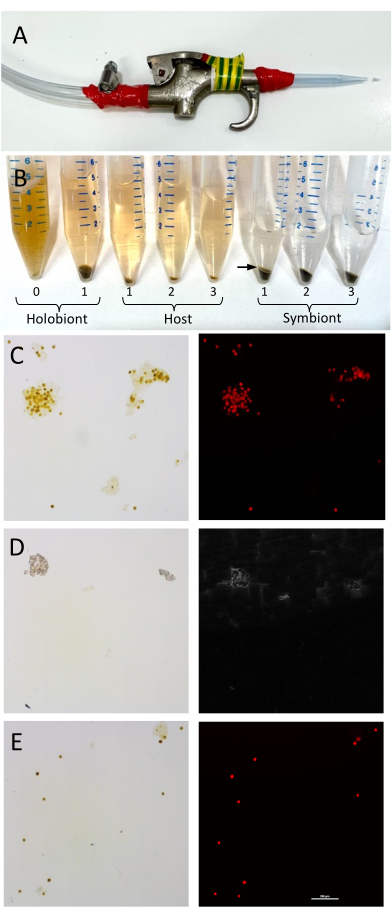
Şekil 1: Mercan konakçı dokularının ve Symbiodiniaceae hücrelerinin ayrılmasının kurulumu ve doğrulanması. (A) Mercan dokusunun mercan iskeletinden ç?...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Konakçı ve simbiyotun ayrılması, basit santrifüjleme yoluyla kolay ve hızlı bir şekilde elde edilebilir ve buradaki sonuçlar, fraksiyonların ayrılmasının, mercan sağlığının fonksiyonel analizine katkıda bulunabilecek spesifik holobiont üye katkılarının göstergesi olan değerli bilgiler sağlayabileceğini göstermektedir. Yetişkin mercanlarda, lipid sentezi esas olarak lipitler (örneğin, triaçilgliserol ve fosfolipitler)41 ve stres iyileşmesini teşvik edebilen yağ asitleri
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
J.L.M., UTS Şansölyesi Araştırma Bursu tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100% LC-grade methanol | Merck | 439193 | LC grade essential |
| 2 mL microcentrifuge tubes, PP | Eppendorf | 30121880 | Polypropylene provides high resistance to chemicals, mechanical stress and temperature extremes |
| 2030 Shimadzu gas chromatograph | Shimadzu | GC-2030 | |
| 710-1180 µm acid-washed glass beads | Merck | G1152 | This size is optimal for breaking the Symbiodiniaceae cells |
| AOC-6000 Plus Multifunctional autosampler | Shimadzu | AOC6000 | |
| Bradford reagent | Merck | B6916 | Any protein colourimetric reagent is acceptable |
| Compressed air gun | Ozito | 6270636 | Similar design acceptable. Having a fitting to fit a 1 mL tip over is critical. |
| DB-5 column with 0.25 mm internal diameter column and 1 µm film thickness | Agilent | 122-5013 | |
| DMF | Merck | RTC000098 | |
| D-Sorbitol-6-13C and/or 13C5–15N Valine | Merck | 605514/ 600148 | Either or both internal standards can be added to the methanol. |
| Flat bottom 96-well plate | Merck | CLS3614 | |
| Glass scintillation vials | Merck | V7130 | 20 mL, with non-plastic seal |
| Immunoglogin G | Merck | 56834 | if not availbe, Bovine Serum Albumin is acceptable |
| Primer | v4 | ||
| R | v4.1.2 | ||
| Shimadzu LabSolutions Insight software | v3.6 | ||
| Sodium Hydroxide | Merck | S5881 | Pellets to make 1 M solution |
| tidyverse | v1.3.1 | R package | |
| TissueLyser LT | Qiagen | 85600 | Or similar |
| TQ8050NX triple quadrupole mass spectrometer | Shimadzu | GCMS-TQ8050 NX | |
| UV-96 well plate | Greiner | M3812 | |
| Whirl-Pak sample bag | Merck | WPB01018WA | Sample collection bag; Size: big enough to house a ~5 cm coral fragment, but not too big that the water is too spread |
Referanslar
- Bundy, J. G., Davey, M. P., Viant, M. R. Environmental metabolomics: A critical review and future perspectives. Metabolomics. 5 (1), 3-21 (2008).
- Matthews, J. L., et al. The metabolic significance of symbiont community composition in the coral-algal symbiosis. Applied Environmental Metabolomics. Beale, D. J., Hillyer, K. E., Warden, A. C., Jones, O. A. H. , Academic Press. Cambridge, MA. 211-229 (2022).
- Lawson, C. A., et al. Informing coral reef conservation through metabolomic approaches. Coral Reef Conservation and Restoration in the Omics Age. Coral Reefs of the World. van Oppen, M. J. H., Aranda Lastra, M. , Springer. Cham, Switzerland. 179-202 (2022).
- LaJeunesse, T. C., et al. Systematic revision of Symbiodiniaceae highlights the antiquity and diversity of coral endosymbionts. Current Biology. 28 (16), 2570-2580 (2018).
- Rohwer, F., Seguritan, V., Azam, F., Knowlton, N. Diversity and distribution of coral-associated bacteria. Marine Ecology Progress Series. 243, 1-10 (2002).
- Maire, J., et al. Intracellular bacteria are common and taxonomically diverse in cultured and in hospite algal endosymbionts of coral reefs. The ISME Journal. 15 (7), 2028-2042 (2021).
- Hillyer, K. E., et al. Metabolite profiling of symbiont and host during thermal stress and bleaching in the coral Acropora aspera. Coral Reefs. 36, 105-118 (2016).
- Hillyer, K. E., Tumanov, S., Villas-Bôas, S., Davy, S. K. Metabolite profiling of symbiont and host during thermal stress and bleaching in a model cnidarian-dinoflagellate symbiosis. Journal of Experimental Biology. 219 (4), 516-527 (2016).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences of the United States of America. 114 (50), 13194-13199 (2017).
- Rosset, S. L., et al. The molecular language of the cnidarian-dinoflagellate symbiosis. Trends in Microbiology. 29 (4), 320-333 (2020).
- Matthews, J. L., et al. Partner switching and metabolic flux in a model cnidarian-dinoflagellate symbiosis. Royal Society. 285 (1892), 20182336(2018).
- González-Pech, R. A., et al. Physiological factors facilitating the persistence of Pocillopora aliciae and Plesiastrea versipora in temperate reefs of south-eastern Australia under ocean warming. Coral Reefs. 41, 1239-1253 (2022).
- Williams, A., et al. Metabolomic shifts associated with heat stress in coral holobionts. Science Advances. 7 (1), (2021).
- Deutsch, J. M., et al. Metabolomics of healthy and stony coral tissue loss disease affected Montastraea cavernosa corals. Frontiers in Marine Science. 8, 1421(2021).
- Stien, D., et al. A unique approach to monitor stress in coral exposed to emerging pollutants. Scientific Reports. 10 (1), 9601(2020).
- Lohr, K. E., et al. Resolving coral photoacclimation dynamics through coupled photophysiological and metabolomic profiling. Journal of Experimental Biology. 222 (8), (2019).
- Jorissen, H., et al. Coral larval settlement preferences linked to crustose coralline algae with distinct chemical and microbial signatures. Scientific Reports. 11 (1), 14610(2021).
- Roach, T. N., Dilworth, J., Jones, A. D., Quinn, R. A., Drury, C. Metabolomic signatures of coral bleaching history. Nature Ecology & Evolution. 5 (4), 495-503 (2021).
- Parkinson, J. E., et al. Molecular tools for coral reef restoration: Beyond biomarker discovery. Conservation Letters. 13 (1), 12687(2020).
- Jiang, J., et al. How Symbiodiniaceae meets the challenges of life during coral bleaching. Coral Reefs. 40, 1339-1353 (2021).
- Guerra, F. D., Attia, M. F., Whitehead, D. C., Alexis, F. Nanotechnology for environmental remediation: materials and applications. Molecules. 23 (7), 1760(2018).
- Matthews, J. L., et al. Metabolite pools of the reef building coral Montipora capitata are unaffected by Symbiodiniaceae community composition. Coral Reefs. 39, 1727-1737 (2020).
- Papina, M., Meziane, T., van Woesik, R. Symbiotic zooxanthellae provide the host-coral Montipora digitata with polyunsaturated fatty acids. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 135 (3), 533-537 (2003).
- Kellogg, R., Patton, J. Lipid droplets, medium of energy exchange in the symbiotic anemone Condylactis gigantea: A model coral polyp. Marine Biology. 75, 137-149 (1983).
- Ankrah, N. Y., Chouaia, B., Douglas, A. E. The cost of metabolic interactions in symbioses between insects and bacteria with reduced genomes. mBio. 9 (5), e01433(2018).
- Kabeya, N., et al. Genes for de novo biosynthesis of omega-3 polyunsaturated fatty acids are widespread in animals. Science Advances. 4 (5), (2018).
- Hillyer, K. E., Dias, D., Lutz, A., Roessner, U., Davy, S. K. 13C metabolomics reveals widespread change in carbon fate during coral bleaching. Metabolomics. 14 (1), 12(2018).
- Hillyer, K. E., Dias, D. A., Lutz, A., Roessner, U., Davy, S. K. Mapping carbon fate during bleaching in a model cnidarian symbiosis: the application of 13C metabolomics. New Phytologist. 214 (4), 1551-1562 (2017).
- Burriesci, M. S., Raab, T. K., Pringle, J. R. Evidence that glucose is the major transferred metabolite in dinoflagellate-cnidarian symbiosis. Journal of Experimental Biology. 215 (19), 3467-3477 (2012).
- Thurber, R. V., et al. Unified methods in collecting, preserving, and archiving coral bleaching and restoration specimens to increase sample utility and interdisciplinary collaboration. PeerJ. 10, 14176(2022).
- Grottoli, A. G., et al. Increasing comparability among coral bleaching experiments. Ecological Applications. 31 (4), 02262(2020).
- Mushtaq, M. Y., Choi, Y. H., Verpoorte, R., Wilson, E. G. Extraction for metabolomics: access to the metabolome. Phytochemical Analysis. 25 (4), 291-306 (2014).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1), 248-254 (1976).
- Peterson, G. L., et al. A simplification of the protein assay method of Lowry et al. which is more generally applicable. Analytical Biochemistry. 83 (2), 346-356 (1977).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Zamer, W. E., Shick, J. M., Tapley, D. W. Protein measurement and energetic considerations: Comparisons of biochemical and stoichiometric methods using bovine serum albumin and protein isolated from sea anemones. Limnology and Oceanography. 34 (1), 256-263 (1989).
- Smart, K. F., Aggio, R. B., Van Houtte, J. R., Villas-Boas, S. G. Analytical platform for metabolome analysis of microbial cells using methyl chloroformate derivatization followed by gas chromatography-mass spectrometry. Nature Protocols. 5 (10), 1709-1729 (2010).
- Pang, Z., et al. Using MetaboAnalyst 5.0 for LC-HRMS spectra processing, multi-omics integration and covariate adjustment of global metabolomics data. Nature Protocols. 17 (8), 1735-1761 (2022).
- Tibshirani, R., Walther, G., Hastie, T. Estimating the number of clusters in a data set via the gap statistic. Journal of the Royal Statistical Society: Series B (Statistical Methodology). 63 (2), 411-423 (2001).
- Chen, W. -N., et al. Diel rhythmicity of lipid-body formation in a coral-Symbiodinium endosymbiosis). Coral Reefs. 31 (2), 521-534 (2012).
- Imbs, A. Fatty acids and other lipids of corals: composition, distribution, and biosynthesis. Russian Journal of Marine Biology. 39 (3), 153-168 (2013).
- Rosset, S., et al. Lipidome analysis of Symbiodiniaceae reveals possible mechanisms of heat stress tolerance in reef coral symbionts. Coral Reefs. 38 (6), 1241-1253 (2019).
- Carreón-Palau, L., Parrish, C. C., Del Angel-Rodriguez, J. A., Perez-Espana, H. Seasonal shifts in fatty acids and sterols in sponges, corals, and bivalves, in a southern Gulf of Mexico coral reef under river influence. Coral Reefs. 40 (2), 571-593 (2021).
- Imbs, A. B., Dang, L. T. Seasonal dynamics of fatty acid biomarkers in the soft coral Sinularia flexibilis, a common species of Indo-Pacific coral reefs. Biochemical Systematics and Ecology. 96, 104246(2021).
- Oku, H., Yamashiro, H., Onaga, K., Sakai, K., Iwasaki, H. Seasonal changes in the content and composition of lipids in the coral Goniastrea aspera. Coral Reefs. 22 (1), 83-85 (2003).
- Weis, V. M. Cell biology of coral symbiosis: foundational study can inform solutions to the coral reef crisis. Integrative and Comparative Biology. 59 (4), 845-855 (2019).
- Oakley, C., Davy, S. Cell biology of coral bleaching. Coral Bleaching. van Oppen, M., Lough, J. , Springer. Cham, Switzerland. 189-211 (2018).
- Lu, W., et al. Metabolite measurement: Pitfalls to avoid and practices to follow. Annual Review of Biochemistry. 86, 277-304 (2017).
- Lawson, C. A., et al. Heat stress decreases the diversity, abundance and functional potential of coral gas emissions. Global Change Biology. 27 (4), 879-891 (2021).
- Olander, A., et al. Comparative volatilomics of coral endosymbionts from one-and comprehensive two-dimensional gas chromatography approaches. Marine Biology. 168 (5), 76(2021).
- Wuerz, M., et al. Symbiosis induces unique volatile profiles in the model cnidarian Aiptasia. Journal of Experimental Biology. 225 (19), (2022).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır