Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Gaschromatographie-Massenspektrometrie-basierte gezielte Metabolomik von Hartkorallenproben
In diesem Artikel
Zusammenfassung
Hier stellen wir die Extraktion und Präparation von polaren und semipolaren Metaboliten aus einem Korallenholobionten, sowie getrenntem Korallenwirtsgewebe und Symbiodiniaceae-Zellfraktionen für die gaschromatographische Massenspektrometrie-Analyse vor.
Zusammenfassung
Auf Gaschromatographie-Massenspektrometrie (GC-MS) basierende Ansätze haben sich als leistungsfähig erwiesen, um die metabolischen Grundlagen der Nesseltier-Dinoflagellaten-Symbiose aufzuklären und wie Korallen auf Stress reagieren (z. B. während der temperaturinduzierten Bleiche). Das Steady-State-Metaboliten-Profiling des Korallen-Holobionten, der den Nesseltierwirt und seine assoziierten Mikroben (Symbiodiniaceae und andere Protisten, Bakterien, Archaeen, Pilze und Viren) umfasst, wurde erfolgreich unter Umgebungs- und Stressbedingungen angewendet, um den ganzheitlichen Stoffwechselstatus der Koralle zu charakterisieren.
Um die Fragen rund um die symbiotischen Interaktionen zu beantworten, ist es jedoch notwendig, die Metabolitenprofile des Korallenwirts und seiner Algensymbionten unabhängig voneinander zu analysieren, was nur durch eine physikalische Trennung und Isolierung der Gewebe erreicht werden kann, gefolgt von einer unabhängigen Extraktion und Analyse. Während die Anwendung der Metabolomik im Korallenbereich relativ neu ist, haben die anhaltenden Bemühungen von Forschungsgruppen zur Entwicklung robuster Methoden zur Analyse von Metaboliten in Korallen geführt, einschließlich der Trennung des Korallenwirtsgewebes und der Algensymbionten.
In diesem Artikel wird eine Schritt-für-Schritt-Anleitung für die Holobiontentrennung und die Extraktion von Metaboliten für die GC-MS-Analyse vorgestellt, einschließlich der wichtigsten Optimierungsschritte, die in Betracht gezogen werden sollten. Wir zeigen, dass das kombinierte Metabolitenprofil der beiden Fraktionen (Koralle und Symbiodiniaceae) nach unabhängiger Analyse dem Profil des Ganzen (Holobiont) ähnelt, aber durch die Trennung der Gewebe können wir auch wichtige Informationen über den Stoffwechsel und die Wechselwirkungen zwischen den beiden Partnern erhalten, die aus dem Ganzen allein nicht gewonnen werden können.
Einleitung
Metaboliten stellen die Endprodukte zellulärer Prozesse dar, und die Metabolomik - die Untersuchung der von einem bestimmten Organismus oder Ökosystem produzierten Metaboliten - kann ein direktes Maß für die Funktionsweise von Organismen liefern1. Dies ist besonders wichtig für die Erforschung von Ökosystemen, symbiotischen Interaktionen und Wiederherstellungswerkzeugen, da das Ziel der meisten Managementstrategien darin besteht, bestimmte Ökosystemdienstleistungen zu erhalten (oder wiederherzustellen)2. Korallenriffe sind ein aquatisches Ökosystem, das den potenziellen Wert der Metabolomik für die Aufklärung symbiotischer Interaktionen und die Verknüpfung von korallenphysiologischen Reaktionen mit Auswirkungen auf Gemeinde- und Ökosystemebene demonstriert3. Die Anwendung der Hochdurchsatz-Gaschromatographie-Massenspektrometrie (GC-MS) wird besonders geschätzt, da sie in der Lage ist, ein breites Spektrum von Metabolitenklassen gleichzeitig mit hoher Selektivität und Empfindlichkeit schnell zu analysieren, eine schnelle Identifizierung von Verbindungen zu ermöglichen, wenn Spektralbibliotheken verfügbar sind, und ein hohes Maß an Reproduzierbarkeit und Genauigkeit bei relativ niedrigen Kosten pro Probe zu bieten.
Korallen sind Holobionten, die aus dem Korallentier, photosynthetischen Dinoflagellaten-Endosymbionten (Familie: Symbiodiniaceae4) und einem komplexen Mikrobiombestehen 5,6. Insgesamt wird die Fitness des Holobionten vor allem durch den Austausch von kleinen Molekülen und Elementen aufrechterhalten, um die Stoffwechselfunktion jedes Mitglieds zu unterstützen 7,8,9,10. Metabolomische Ansätze haben sich als besonders leistungsfähig erwiesen, um die metabolischen Grundlagen der Symbiosespezifität9,11, der Bleichreaktion auf thermischen Stress 7,8,12,13, der Krankheitsreaktionen 14, der Reaktionen auf Umweltverschmutzung 15, der Photoakklimatisierung 16 und der chemischen Signalgebung 17 in Korallen aufzuklären sowie die Entdeckung von Biomarkern zu unterstützen 18,19. Darüber hinaus kann die Metabolomik eine wertvolle Bestätigung für die Schlussfolgerungen liefern, die aus DNA- und RNA-basierten Techniken abgeleitet werden 9,20. Es besteht daher ein erhebliches Potenzial für den Einsatz der Metabolomik zur Bewertung der Gesundheit von Riffen und zur Entwicklung von Instrumenten für den Schutz von Riffen3, z. B. durch den Nachweis metabolischer Biomarker für Stress18,19 und für die Untersuchung des Potenzials aktiver Managementstrategien wie Ernährungssubventionen21.
Die Trennung der Wirts- und Symbiontenzellen und die Analyse ihrer Metabolitenprofile unabhängig voneinander und nicht zusammen wie der Holobiont kann mehr Informationen über die Partnerinteraktionen, den unabhängigen physiologischen und metabolischen Status und die potenziellen molekularen Mechanismen für die Anpassung liefern 11,12,22,23,24. Ohne die Koralle und die Symbiodiniaceae zu trennen, ist es fast unmöglich, den Beitrag und den Stoffwechsel von Korallen und/oder Symbiodiniaceae unabhängig voneinander aufzuklären, außer mit komplexer Genomrekonstruktion und metabolischer Modellierung25, aber dies muss noch auf die Korallen-Dinoflagellaten-Symbiose angewendet werden. Darüber hinaus kann der Versuch, Informationen über den individuellen Stoffwechsel des Wirts oder Algensymbionten aus dem Metabolitenprofil des Holobionten zu extrahieren, zu Fehlinterpretationen führen.
Zum Beispiel wurde bis vor kurzem angenommen, dass das Vorhandensein von mehrfach ungesättigten C18:3n-6-, C18:4n-3- und C16-Fettsäuren in Extrakten aus Korallen- und Holobiongewebe vom Algensymbionten stammt, da man davon ausging, dass Korallen nicht die für die Produktion von Omega-3 (ω3)-Fettsäuren essentiellen ωx-Desaturasen besitzen; Neuere genomische Beweise deuten jedoch darauf hin, dass mehrere Nesseltiere die Fähigkeit haben, ω3-PUFA de novo zu produzieren und ω3-langkettiges PUFA26 weiter zu biosynthetisieren. Die Kombination von GC-MS mit stabiler Isotopenmarkierung (z. B. 13 C-Bicarbonat, NaH13CO 3) kann verwendet werden, um das Schicksal von photosynthetisch fixiertem Kohlenstoff durch holobionte Stoffwechselnetzwerke von Korallen sowohl unter Kontrollbedingungen als auch als Reaktion auf externe Stressoren zu verfolgen27,28. Ein kritischer Schritt bei der Verfolgung des 13-C-Schicksals ist jedoch die Trennung des Korallengewebes von den Algenzellen - nur dann kann das Vorhandensein einer 13-C-markiertenVerbindung in der Korallenwirtsfraktion eindeutig als von Symbiodiniaceae abgeleiteter Metabolit, der in die Koralle transloziert wurde, oder als nachgeschaltetes Produkt einer translozierten markierten Verbindung zugeordnet werden. Diese Technik hat ihre Leistungsfähigkeit unter Beweis gestellt, indem sie die lang gehegte Annahme in Frage stellte, dass Glycerin die primäre Form ist, in der Photosynthese vom Symbionten zum Wirt transloziertwird 29, und indem sie aufklärte, wie sich der Nährstofffluss zwischen den Partnern während des Bleichens27,28 und als Reaktion auf inkompatible Symbiodiniaceae-Arten verändert11.
Während die Entscheidung, Gewebe zu trennen, in erster Linie von der Forschungsfrage bestimmt wird, sind die Praktikabilität, Zuverlässigkeit und potenziellen metabolischen Auswirkungen dieses Ansatzes wichtig zu berücksichtigen. Hier stellen wir detaillierte, demonstrierte Methoden zur Extraktion von Metaboliten aus dem Holobionten, sowie den getrennten Wirts- und Symbiontenfraktionen vor. Wir vergleichen die Metabolitenprofile des Wirts und des Symbionten unabhängig voneinander und wie diese Profile mit dem holobionten Metabolitenprofil verglichen werden.
Access restricted. Please log in or start a trial to view this content.
Protokoll
ANMERKUNG: Der Versuchsaufbau, die Probenentnahme und die Lagerung wurden an anderer Stelle ausführlich beschrieben 2,30,31. Die Genehmigung für das Sammeln von Wildkorallen muss vor dem Sammeln und Experimentieren eingeholt werden. Die Proben hier stammen aus Kolonien von Montipora mollis (grüne Farbmorphe), die von Batavia Coral Farms (Geraldton, WA) importiert wurden und ursprünglich von einem Riff vor den Abrohlos-Inseln (Westaustralien; 28°52'43.3"S 114°00'17.0"E) in einer Tiefe von 1 m unter der Aquakulturlizenz AQ1643 gesammelt wurden. Vor der Probenahme wurden die Kolonien in einem 800-Liter-Aquarium bei 35 PSU, unter blauem und weißem Licht bei 150 μmol Photonen·m−2·s−1 und bei 25 °C ± 0,5 °C für 3 Monate gehalten. Die Korallenfragmente (~5 cm2, N = 6) wurden in flüssigem Stickstoff schockgefroren und bis zur Verarbeitung bei −80 °C gelagert.
1. Vorbereitung der Extraktionslösungen und -geräte
- Bereiten Sie mindestens 1 Tag vor der Entnahme des Korallengewebes die Extraktionslösungen und -geräte vor.
- Reinstwasser in sauberen, reinigungsmittelfreien Gläsern bei 4 °C vorkühlen.
- Mischen Sie 100 % LC-Methanol mit einer Endkonzentration von 10 μg·ml−1 geeigneter interner Standards (z. B. 13C6-Sorbit).
- Stellen Sie eine 50%ige Methanol-Extraktionslösung her, die zur Hälfte zu 100 % aus Methanol in LC-Qualität und zur Hälfte aus Reinstwasser besteht. Beide Methanollösungen werden bei −20 °C gelagert.
HINWEIS: Um den Abbau der Metaboliten zu verhindern, wird empfohlen, die Probenverarbeitungsschritte in Chargen von jeweils fünf Korallenfragmenten durchzuführen, mit einem zusätzlichen biologischen (nur Wasser) Leerproben (Gesamtproben N = 6). Sobald jede Korallenprobe in die beiden Fraktionen (Korallenwirtsgewebe, im Folgenden "Wirt", und Mikroalgenzellen, im Folgenden "Symbiont") getrennt wurde, beträgt die Gesamtzahl der Proben in einer Verarbeitungscharge 12.
2. Abschreckung des Korallenstoffwechsels
ANMERKUNG: Der Versuchsaufbau, die Probenentnahme und die Lagerung wurden an anderer Stelle ausführlich beschrieben 2,30,31. Es sollte jedoch beachtet werden, dass die Zeit, die benötigt wird, um den Stoffwechsel zu unterdrücken (d. h. die Zeit zwischen der Entnahme von Korallenproben und der Konservierung), entscheidend ist, um die ursprüngliche Reaktion zu erfassen30. Die Probe ist so schnell wie möglich nach der Entnahme aufzubewahren, um Veränderungen in der Metabolitenzusammensetzung aufgrund von Probenabbau oder physiologischen Reaktionen zu vermeiden, die nicht dem Ziel entsprechen32.
- Legen Sie Korallenfragmente in einen sterilen Probenentnahmebeutel und lassen Sie überschüssiges Meerwasser so weit wie möglich abtropfen. Die Probe wird mindestens 30 s lang in flüssigen Stickstoff getaucht. Bringen Sie die Proben so schnell wie möglich zur Lagerung in einen Gefrierschrank bei −80 °C.
HINWEIS: Proben können bis zur Verarbeitung bei −80 °C in lichtblockierten Behältern eingefroren werden, wodurch Gefrier-Auftau-Zyklen vermieden werden.
3. Entfernung von Korallengewebe aus dem Skelett
HINWEIS: Die Proben sollten immer auf Eis (4 °C) aufbewahrt werden, um sicherzustellen, dass sie gleichzeitig in flüssiger Form vorliegen und gleichzeitig einen laufenden Stoffwechsel verhindern.
- Legen Sie einen sauberen, sterilen Probenentnahmebeutel auf Eis, so dass der Beutel stabil und offen auf dem Eis in einer flachen Vertiefung liegt, aber nicht in das Eis eingetaucht ist. Geben Sie 10 ml kaltes (4 °C) Reinstwasser in den Beutel.
HINWEIS: Dies hilft, ein wiederholtes Auftauen des Korallenfragments aufgrund der kalten Druckluft und des umgebenden Eises zu vermeiden. - Wählen Sie ein Korallenfragment mit einer sterilisierten Pinzette aus und spülen Sie es mit kaltem (4 °C) Reinstwasser mit einer sterilen Pasteurpipette ab, bis keine Meerwasserrückstände mehr vorhanden sind. Tauchen Sie das abgespülte Korallenfragment in den Beutel mit den 10 ml Reinstwasser.
HINWEIS: Diese Spülung ist wichtig, um alle Restsalze zu entfernen, die die nachgelagerte Analyse beeinträchtigen würden. Vermeiden Sie den Kontakt der Hand mit dem Wasser oder Korallenfragment durch den Beutel, um die Probe bei 4 °C zu halten. - Kleben Sie eine sterile 1-ml-Pipettenspitze mit Isolierband über das Ende einer Luftpistole, wobei ~5 mm das Ende der Spitze abschneiden (Abbildung 1A).
- Richten Sie die Luftpistole auf das Korallenfragment, während der Beutel halb verschlossen ist und der Luftstrom auf niedrigem Medium steht, um das Gewebe vorsichtig zu entfernen, indem Sie eine kreisförmige Bewegung des Wassers über das Korallenfragment fördern.
- Nach ~3 Minuten oder wenn das gesamte Gewebe aus dem Skelett entfernt worden zu sein scheint, schalten Sie die Luft aus und entfernen Sie die Airbrush. Verschließen Sie den Beutel vollständig.
- Drücken Sie das gesamte entfernte Korallengewebe in eine untere Ecke des Beutels. Schneiden Sie die gegenüberliegende Ecke ab und gießen Sie den Inhalt des Beutels vorsichtig in ein 15-ml-Röhrchen auf Eis.
4. Optionale Homogenisierung
HINWEIS: Einige Korallenarten sind zähflüssiger als andere, was bedeutet, dass das Airbrushing das Gewebe in Klumpen und nicht in einer Aufschlämmung entfernt. Sind Gewebeklumpen im Airbrush-Homogenat sichtbar, kann für alle Proben ein Homogenisierungsschritt bei 4 °C hinzugefügt werden.
- Reinigen Sie einen mechanischen Sägezahnhomogenisator zweimal mit 4 °C 70% Methanol und zum Schluss mit 4 °C Reinstwasser.
- Homogenisieren Sie die Korallenprobe in einem 15-ml-Röhrchen für ~1 Minute, bis die Probe vollständig homogenisiert ist und keine Klumpen mehr sichtbar sind.
- Reinigen Sie den Homogenisator wie in Schritt 4.1 zwischen den einzelnen Proben. Halten Sie die Homogenisierungszeit über die Proben hinweg konstant.
5. Probenentnahme zur Normalisierung
- Entnehmen Sie ein 1.000-μl-Aliquot aus dem homogenisierten Gewebe für die Symbiodiniaceae-Zellzahl, die Analyse des Proteingehalts des Korallenwirtsgewebes und die Chlorophyll-A-Schätzung . Bei −20 °C lagern, bis die Analyse erfolgt ist (Abschnitt 10).
6. Optionale Zelltrennung zwischen Korallenwirtsgewebe und Symbiodiniaceae
- Das Korallenhomogenat wird bei 2.500 × g 5 min bei 4 °C mit einer gekühlten Zentrifuge zentrifugiert.
HINWEIS: Diese Geschwindigkeit ist optimal, um die schwereren Symbiodiniaceae-Zellen vom Wirtsgewebe zu trennen, das im Überstand suspendiert ist, während ihre Zellwände intakt bleiben. - Entfernen Sie den Überstand, der das Wirtsmaterial enthält, und geben Sie ihn in ein neues 15-ml-Röhrchen.
HINWEIS: Die Lipide aus dem Wirtsgewebe bilden typischerweise eine schmale rosa/weiße Schicht auf den Symbiontenzellen. Diese Schicht kann zusammen mit dem löslichen Wirtsüberstand durch Pipettieren gesammelt werden (Abbildung 1B). - Den Wirt genau 1 Minute lang kräftig vortexen. Halten Sie die Algenpelletprobe und die Wirtsüberstandsprobe auf Eis.
- 2 ml Reinstwasser bei 4 °C in das Algenpellet geben. Genau 2 Minuten lang kräftig wirbeln, um das Pellet wieder zu suspendieren.
HINWEIS: Wenn für die Symbiodiniaceae-Genotypisierung keine einzelnen Fragmente von 1 cm aus der Korallenkolonie entnommen wurden, kann hier ein 200 μL Aliquot der Symbiodiniaceae-Zellsuspension gesammelt, in der bevorzugten DNA-Pufferlösung konserviert und wie in Thurber et al.30 für die Symbiodiniaceae-Genotypisierung beschrieben gelagert werden (z. B. gemäß González-Pech et al.12). - Wiederholen Sie die Schritte 6.1 bis 6.4 noch einmal.
HINWEIS: Die zuverlässige Trennung von Wirt und Symbiont hängt von der Korallenbiomasse und -art ab, da einige Arten zähflüssiger sein können als andere. Empfohlen werden mindestens drei Waschschritte, die jedoch je nach Abscheideerfolg erhöht werden können. Wiederholen Sie die Waschschritte 4.7-4.9, bis keine Symbiodiniaceae-Zellen mehr im unteren Teil der Wirtsfraktion zu sehen sind und bis die Symbiodiniaceae-Fraktion sichtbar frei von Wirtsmaterial ist (z. B. keine weiße Schicht auf der Oberseite) (Abbildung 1). - Entfernen Sie den Überstand, der das Wirtsmaterial enthält, und geben Sie ihn in ein neues 15-ml-Röhrchen.
- Bewahren Sie das Symbionten-Pellet im 15-ml-Röhrchen auf.
7. Trocknung der Probe
- Frieren Sie entweder das Holobiont-Homogenat oder sowohl die getrennte Wirts- als auch die Symbiodiniaceae-Fraktion bei −80 °C für ~120 Minuten ein. Die Proben werden über Nacht mit einem Vakuum von 0,01 mbar bei −85 °C lyophilisiert.
HINWEIS: Um Probenverluste während der Gefriertrocknung zu vermeiden, wird empfohlen, einen Deckel zu verwenden, der aus einem anderen sterilen Röhrchen oder sterilen Parafilm geschnitten wurde, mit einem ~2 mm großen Loch, das vorsichtig mit einer sterilen 25-G-Nadel durchgestanzt wurde. - Nach dem Trocknen mit einer Laborwaage eines der folgenden Gefäße wiegen: 1) 25 mg des Holobionten; 2) 15 mg der Symbiontenfraktion; oder 3) 30 mg des Wirtsgewebes aus jeder Probe in separate 2 ml weichmacherfreie Mikrozentrifugenröhrchen.
HINWEIS: Kritischer Schritt: Die Optimierung der Biomasse für die Extraktion ist unerlässlich, um sicherzustellen, dass der GC-MS nicht überlastet wird und gleichzeitig ein ausreichendes Signal gewährleistet ist. Das getrocknete Korallenmaterial ist sehr statisch. Um Probenverluste zu vermeiden, verwenden Sie antistatische Vorrichtungen, um elektrostatische Aufladungen aus den Proben und Wägegefäßen zu entfernen. Eine einfache und kostengünstige Alternative besteht darin, ein Wäschetrocknertuch unter das Probenröhrchen zu legen. Das getrocknete Symbionten-Pellet kann mit einer sterilen Klinge auf das gewünschte Gewicht geschnitten werden.
8. Intrazelluläre Metaboliten-Extraktionen
- Intrazelluläre Metabolitenextraktion aus lyophilisiertem Holobiont:
- 400 μl 100 % kaltes (−20 °C) Methanol mit internem Standard/en (IS; Nr. 13C6-Sorbit und/oder 13C5-15 N-Valin, bei 10μM) in jedes Röhrchen.
- Zu jeder Probe wird eine kleine Anzahl von 710-1.180 μm säuregewaschenen Glasperlen (~10 mg) gegeben. In eine Rührwerksmühle bei 50 Hz für 3 min in einen vorgekühlten (−20 °C) Rührwerkseinsatz geben.
- In jedes Röhrchen werden weitere 600 μl 100 % kaltes (−20 °C) Methanol mit ISs (13 C6 Sorbit und/oder 13C5-15 N Valin, bei 10μM) gegeben.
- Vortex 1 Min. lang mischen. Auf einem Drehspieß-Shaker bei 4 °C 30 Min. ruhen lassen.
- Intrazelluläre Metabolitenextraktion aus separierten lyophilisierten Symbiodiniaceae-Zellen:
- 200 μl 100 % kaltes (−20 °C) Methanol mit ISs (13 C6 Sorbit und/oder 13C 5-15 N Valin, bei 10μM) werden zu dem getrockneten Symbiodiniaceae-Material gegeben.
- Fügen Sie eine kleine Anzahl von 710-1.180 μm säuregewaschenen Glasperlen (~10 mg) hinzu. In eine Rührwerksmühle bei 50 Hz für 3 min in einen vorgekühlten (−20 °C) Rührwerkseinsatz geben.
- Weitere 800 μl 100 % kaltes (−20 °C) Methanol mit ISs zugeben und 30 s lang vortexen.
- Intrazelluläre Metabolitenextraktion aus separiertem lyophilisiertem Wirtsgewebe:
- 1 ml 100 % kaltes (−20 °C) LC-Methanol, das ISs (13C6 Sorbit und/oder 13C 5-15 N Valin, bei 10μM) enthält, zum getrockneten Wirtsmaterial geben.
- Vortex 20 s lang mischen. In einem schwimmenden Röhrchenhalter für 30 Minuten in ein Beschallungsbad bei 4 °C stellen.
9. Reinigung von Metabolitenextrakten
- Die Proben (Holobiont/Wirt/Symbiont) werden bei 3.000 × g für 30 min bei 4 °C zentrifugiert.
- Den gesamten Überstand in ein neues 2-ml-Mikrozentrifugenröhrchen überführen, wobei darauf zu achten ist, dass das Zelltrümmerpellet nicht gestört wird.
HINWEIS: Dies sind die semipolaren Extrakte. Diese können vorübergehend auf Eis gelagert werden, aber langfristig bei −80 °C im Dunkeln gelagert werden. - Zu den verbleibenden Zelltrümmern werden 1.000 μl 50 % kaltes (−20 °C) Methanol hinzugefügt. Kräftigen Wirbel für 1 Minute, um zu resuspendieren.
- Die Proben werden bei 3.000 × g für 30 min bei 4 °C zentrifugiert.
- Sammeln und poolen Sie den Überstand (polare Extrakte) mit den semipolaren Extrakten aus derselben Probe.
HINWEIS: Die Zelltrümmer können bei −80 °C gelagert und zur Normalisierung des Proteingehalts verwendet werden (Abschnitt 11). - Zentrifugieren Sie die gepoolten Extrakte 15 Minuten lang bei 16.100 g , um alle Ausfällungen zu entfernen, und bewegen Sie den Überstand in ein neues weichmacherfreies Mikrozentrifugenröhrchen (2 ml).
HINWEIS: Die Probenextrakte können bei −80 °C im Dunkeln gelagert werden. - Wenn Sie zur Analyse bereit sind, aliquoten Sie 50 μl von jedem Extrakt in einen Glaseinsatz. 30 min bei 30 °C mit einem Vakuumkonzentrator konzentrieren. Wiederholen Sie dies viermal (für 250 μl getrockneten Extrakt).
HINWEIS: Die getrockneten Proben können bis zur Analyse bei Raumtemperatur unter Trockenmittelbedingungen gelagert werden.
10. Metaboliten-Derivatisierung
HINWEIS : Ein zweistufiger Online-Derivatisierungsprozess wird für die Methoximierung und Trimethylsilylierung der polaren Metaboliten verwendet.
- Zu jeder Probe werden 25 μl Methoxyaminhydrochlorid (30 mg/ml in Pyridin) gegeben.
- Bei 37 °C auf einem Orbitalschüttler bei 750 U/min für 2 h rühren.
- Zu jeder Probe werden 25 μl N,O-Bis(trimethylsilyl)trifluoracetamid + Trimethylchlorsilan gegeben.
- Nochmals bei 37 °C und 750 U/min 1 h rühren.
- Lassen Sie die Proben bei Raumtemperatur 1 h lang ausbalancieren, bevor Sie 1 μl im Verhältnis 1:10 in den GC injizieren.
11. Gaschromatographie-Massenspektrometrie-Analyse
HINWEIS: Das Massenspektrometer sollte gemäß den Empfehlungen des Herstellers mit Tris-(Perfluorbutyl)-amin (CF43) eingestellt werden.
- Verwenden Sie ultrahochreines Helium als Trägergas mit einer konstanten Säulendurchflussrate von 1 ml/min.
- Verwenden Sie eine 30 m lange DB-5-Säule mit einer Schichtdicke von 1 μm und einem Innendurchmesser von 0,25 mm.
- GC Ofenprogramm
- Stellen Sie die Eingangstemperatur auf 280 °C ein.
- Beginnen Sie mit der Injektion bei einer Ofentemperatur von 100 °C und halten Sie sie 4 Minuten lang.
- Erhöhen Sie die Temperatur um 10 °C/min auf 320 °C und halten Sie sie dann 11 Minuten lang.
- Parameter des Massenspektrometers
- Stellen Sie die MS-Transferleitung auf 280 °C ein und stellen Sie die Ionenquelle auf 200 °C ein.
- Verwenden Sie Argon als Kollisionszellengas, um das MRM-Produkt (Multiple Reaction Monitoring) zu erzeugen.
- Erzielen Sie den Nachweis von Metaboliten relativ zu einer zeitsegmentierten MRM-Bibliothek mit MRM-Zielen.
12. Symbiodiniaceae-Zellzahl, Analyse des Proteingehalts im Korallenwirtsgewebe und Chlorophyll-a-Schätzung
- Anzahl der Symbiodiniaceae-Zellen:
- Nehmen Sie ein Aliquot des Korallengewebe-Homogenats.
- Zentrifugieren Sie die Proben bei 2.000 × g , um die Algen zu pelletieren.
- Entfernen Sie den ~200 μl Überstand aus dem Algenpellet und geben Sie ihn in ein neues Mikrozentrifugenröhrchen.
HINWEIS: Dies ist die Proteinprobe, die zur Normalisierung der Daten verwendet wird. ggf. vor der Analyse bei −20 °C lagern. - Resuspendieren Sie das Algenpellet in 1 ml gefiltertem Meerwasser, indem Sie vorsichtig auf und ab pipettieren. Falls erforderlich, verdünnen Sie die Algensuspension, um die Zellzählung zu erleichtern.
- Führen Sie eine Zellzählung mit einem Hämozytometer unter einem Lichtmikroskop durch, indem Sie 10 μl in eine der Kammern geben. Führen Sie 8-10 Zählungen pro Probe durch.
HINWEIS: Wo verfügbar, können auch alternative Methoden zur Zählung der Algenzellen angewendet werden (z. B. Durchflusszytometrie, konfokale Hochdurchsatzmikroskopie). - Berechnen Sie die Konzentration der Symbiontenzellen (ml−1) unter Berücksichtigung der verwendeten Verdünnungsfaktoren.
- Assay für den Proteingehalt
- Quantifizierung des Proteingehalts der Probe (z. B. über den kolorimetrischen Assay von Bradford, wie er ursprünglich von Bradford et al.33 beschrieben wurde, oder den Lowry-Assay34,35, dessen Protokoll für Nesseltiere an anderer Stelle beschrieben wurde 36).
- Chlorophyll eine Extraktion
- Verwenden Sie ein Zellpellet von ~200.000 Zellen, gefroren oder frisch.
- Jedes Algenpellet wird in 2 ml Dimethylformamid (DMF) in einem Glasszintillationsfläschchen überführt und 48 Stunden lang im Dunkeln bei 4 °C inkubiert.
HINWEIS: DMF ist giftig und krebserregend, daher muss die Probenvorbereitung unter einem möglichst dunklen Abzug und auf Eis erfolgen. Wenn <200.000 Zellen vorhanden sind, verwenden Sie weniger DMF. - 3 min bei 16.000 × g zentrifugieren.
- Übertragen Sie 200 ml in eine UV-96-Well-Platte für photometrische Messungen. Führen Sie jede Probe dreifach mit DMF als Rohling aus.
- Messen Sie die Absorption bei den Wellenlängen (E) 663,8 nm, 646 nm und 750 nm. Subtrahieren Sie die Absorption bei 750 nm von der Absorption bei den beiden anderen Wellenlängen.
HINWEIS: Die Messung bei 750 nm korrigiert jegliche Streuung oder Trübung in der Probe. - Berechnen Sie die Chlorophyll-a-Konzentration (μg/ml) mit Gleichung (1):
Chl a-Konzentration (μg/ml) = (12,00 × E 663,8) - (3,11 × E646,8) (1)
13. Quantifizierung der Zellbiomasse nach Metabolitenextraktionen zur Normalisierung
ANMERKUNG: Es gibt zwei Optionen für die Quantifizierung der Zellbiomasse, die im Folgenden beschrieben werden: die Quantifizierung von Proteinen, die sich auf die Biomasse beziehen, mit einer modifizierten kolorimetrischen Bradford-Methode und die Messung des Trockengewichts der Zelltrümmer. Beide Methoden sind geeignet, da beide eine genaue Quantifizierung der Zellbiomasse ermöglichen.
- Proteingehalt der Zelltrümmer
- Die gefrorenen Zelltrümmer werden mit 1 ml 0,2 M NaOH resuspendiert und die Proben 20 Minuten lang bei 98 °C inkubiert.
- Kühlen Sie die Proben ~10 Minuten lang auf Eis ab und zentrifugieren Sie sie bei 3.000 × g für 5 Minuten bei Raumtemperatur.
- Quantifizierung des Proteingehalts der Probe (z. B. mit dem kolorimetrischen Assay von Bradford, wie ursprünglich von Bradford et al.33 beschrieben und von Smart et al.37 modifiziert).
- Messung des Trockengewichts von Zelltrümmern
- Resuspendieren Sie die Zelltrümmer aus der intrazellulären Metabolitenextraktion in doppelt destilliertem Wasser (~10 ml).
- Die Lösung wird unter Vakuum mit einem vorgewogenen Membranfilter (0,22 μm Pore, 47 mm) filtriert.
- Waschen Sie die Rohre, die Biomasse enthalten, zweimal mit Reinstwasser, um die vollständige Übertragung der Biomasse auf den Membranfilter zu gewährleisten.
- Entfernen Sie den Membranfilter, der die Biomasse enthält, und trocknen Sie ihn mit einem Mikrowellenherd (geringe Leistung; ~250 W für 20 min).
- Bewahren Sie das Filterpapier über Nacht in einem Exsikkator auf. Erfassen Sie das Trockengewicht des Filterpapiers und berechnen Sie das Trockengewicht der Biomasse, indem Sie das Gewicht des trockenen Membranfilters (unter Verwendung eines sauberen trockenen Membranfilters, der neben dem Probenfilter getrocknet wird) vom Gesamtgewicht abziehen.
14. Datenanalyse
- Analysieren Sie Metabolitenziele mithilfe von Metabolitendatenbanken, wobei jedes Ziel aus einem Quantifizierer und einem Qualifizierer-MRM besteht.
- Prüfen Sie die erkannten Metabolitenziele visuell und integrieren Sie sie bei Bedarf manuell.
- Verwenden Sie eine Metaboliten-Peakfläche, um die relative Häufigkeit jeder Probe für jede Gruppe zu berechnen. Die Werte werden leerkorrigiert und normalisiert, um die interne Standard-Peakfläche zu untersuchen und dann den Zelltrümmerproteingehalt gemäß Smart et al.37 zu beproben.
- Verwerfen Sie Metaboliten mit einer relativen Standardabweichung von mehr als 35 % in allen Behandlungsgruppen (N = 23 Metaboliten).
- Transformieren Sie die Daten (z. B. Kubikwurzel) und zentrieren Sie sie im Mittelwert. bestätigen eine Normalverteilung und Homogenität der Varianz.
- Führen Sie die Datenanalyse durch (ANOVA- und Heatmap-Erstellung; z. B. mit https://www.metaboanalyst.ca)38. Clustern Sie die Proben, um die Variabilität innerhalb der Behandlung mit den Paketen "cluster", "factoextra" und "klustR" zu untersuchen. Berechnen Sie die Gap-Statistik (eine Methode zur Bestimmung der optimalen Anzahl von Clustern39) mit der Funktion "clusGap" in R und stellen Sie sie mit dem R-Paket "tidyverse" dar. Führen Sie PERMANOVAs durch, um die Signifikanz in der Trennung zwischen den Metabolitenprofilen der Behandlung (z. B. in Primer) zu untersuchen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Alle Daten, die während dieser Arbeit erstellt wurden, sind in den Zusatzinformationen verfügbar.
Wirt-Symbionten-Trennung
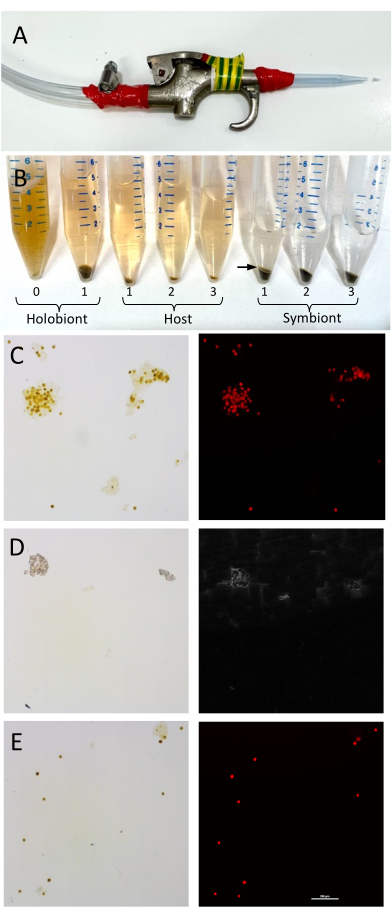
Abbildung 1: Aufbau und Validierung der Trennung von Korallenwirtsgewebe und Symbiodiniaceae-Zellen. (A) Der Luftpistolenaufbau zur Entn...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Trennung von Wirt und Symbiont ist durch einfache Zentrifugation leicht und schnell zu erreichen, und die Ergebnisse hier zeigen, dass die Trennung der Fraktionen wertvolle Informationen liefern kann, die auf spezifische Beiträge von Holobiontenmitgliedern hinweisen, die zur funktionellen Analyse der Korallengesundheit beitragen können. In erwachsenen Korallen wird die Lipidsynthese hauptsächlich vom ansässigen Algensymbionten 40 durchgeführt, der Lipide (z. B. Triacylglycerin und Phospholipide)41 und F...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keinen Interessenkonflikt offenzulegen.
Danksagungen
J.L.M. wurde durch ein Forschungsstipendium des UTS-Kanzlers unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 100% LC-grade methanol | Merck | 439193 | LC grade essential |
| 2 mL microcentrifuge tubes, PP | Eppendorf | 30121880 | Polypropylene provides high resistance to chemicals, mechanical stress and temperature extremes |
| 2030 Shimadzu gas chromatograph | Shimadzu | GC-2030 | |
| 710-1180 µm acid-washed glass beads | Merck | G1152 | This size is optimal for breaking the Symbiodiniaceae cells |
| AOC-6000 Plus Multifunctional autosampler | Shimadzu | AOC6000 | |
| Bradford reagent | Merck | B6916 | Any protein colourimetric reagent is acceptable |
| Compressed air gun | Ozito | 6270636 | Similar design acceptable. Having a fitting to fit a 1 mL tip over is critical. |
| DB-5 column with 0.25 mm internal diameter column and 1 µm film thickness | Agilent | 122-5013 | |
| DMF | Merck | RTC000098 | |
| D-Sorbitol-6-13C and/or 13C5–15N Valine | Merck | 605514/ 600148 | Either or both internal standards can be added to the methanol. |
| Flat bottom 96-well plate | Merck | CLS3614 | |
| Glass scintillation vials | Merck | V7130 | 20 mL, with non-plastic seal |
| Immunoglogin G | Merck | 56834 | if not availbe, Bovine Serum Albumin is acceptable |
| Primer | v4 | ||
| R | v4.1.2 | ||
| Shimadzu LabSolutions Insight software | v3.6 | ||
| Sodium Hydroxide | Merck | S5881 | Pellets to make 1 M solution |
| tidyverse | v1.3.1 | R package | |
| TissueLyser LT | Qiagen | 85600 | Or similar |
| TQ8050NX triple quadrupole mass spectrometer | Shimadzu | GCMS-TQ8050 NX | |
| UV-96 well plate | Greiner | M3812 | |
| Whirl-Pak sample bag | Merck | WPB01018WA | Sample collection bag; Size: big enough to house a ~5 cm coral fragment, but not too big that the water is too spread |
Referenzen
- Bundy, J. G., Davey, M. P., Viant, M. R. Environmental metabolomics: A critical review and future perspectives. Metabolomics. 5 (1), 3-21 (2008).
- Matthews, J. L., et al. The metabolic significance of symbiont community composition in the coral-algal symbiosis. Applied Environmental Metabolomics. Beale, D. J., Hillyer, K. E., Warden, A. C., Jones, O. A. H. , Academic Press. Cambridge, MA. 211-229 (2022).
- Lawson, C. A., et al. Informing coral reef conservation through metabolomic approaches. Coral Reef Conservation and Restoration in the Omics Age. Coral Reefs of the World. van Oppen, M. J. H., Aranda Lastra, M. , Springer. Cham, Switzerland. 179-202 (2022).
- LaJeunesse, T. C., et al. Systematic revision of Symbiodiniaceae highlights the antiquity and diversity of coral endosymbionts. Current Biology. 28 (16), 2570-2580 (2018).
- Rohwer, F., Seguritan, V., Azam, F., Knowlton, N. Diversity and distribution of coral-associated bacteria. Marine Ecology Progress Series. 243, 1-10 (2002).
- Maire, J., et al. Intracellular bacteria are common and taxonomically diverse in cultured and in hospite algal endosymbionts of coral reefs. The ISME Journal. 15 (7), 2028-2042 (2021).
- Hillyer, K. E., et al. Metabolite profiling of symbiont and host during thermal stress and bleaching in the coral Acropora aspera. Coral Reefs. 36, 105-118 (2016).
- Hillyer, K. E., Tumanov, S., Villas-Bôas, S., Davy, S. K. Metabolite profiling of symbiont and host during thermal stress and bleaching in a model cnidarian-dinoflagellate symbiosis. Journal of Experimental Biology. 219 (4), 516-527 (2016).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences of the United States of America. 114 (50), 13194-13199 (2017).
- Rosset, S. L., et al. The molecular language of the cnidarian-dinoflagellate symbiosis. Trends in Microbiology. 29 (4), 320-333 (2020).
- Matthews, J. L., et al. Partner switching and metabolic flux in a model cnidarian-dinoflagellate symbiosis. Royal Society. 285 (1892), 20182336(2018).
- González-Pech, R. A., et al. Physiological factors facilitating the persistence of Pocillopora aliciae and Plesiastrea versipora in temperate reefs of south-eastern Australia under ocean warming. Coral Reefs. 41, 1239-1253 (2022).
- Williams, A., et al. Metabolomic shifts associated with heat stress in coral holobionts. Science Advances. 7 (1), (2021).
- Deutsch, J. M., et al. Metabolomics of healthy and stony coral tissue loss disease affected Montastraea cavernosa corals. Frontiers in Marine Science. 8, 1421(2021).
- Stien, D., et al. A unique approach to monitor stress in coral exposed to emerging pollutants. Scientific Reports. 10 (1), 9601(2020).
- Lohr, K. E., et al. Resolving coral photoacclimation dynamics through coupled photophysiological and metabolomic profiling. Journal of Experimental Biology. 222 (8), (2019).
- Jorissen, H., et al. Coral larval settlement preferences linked to crustose coralline algae with distinct chemical and microbial signatures. Scientific Reports. 11 (1), 14610(2021).
- Roach, T. N., Dilworth, J., Jones, A. D., Quinn, R. A., Drury, C. Metabolomic signatures of coral bleaching history. Nature Ecology & Evolution. 5 (4), 495-503 (2021).
- Parkinson, J. E., et al. Molecular tools for coral reef restoration: Beyond biomarker discovery. Conservation Letters. 13 (1), 12687(2020).
- Jiang, J., et al. How Symbiodiniaceae meets the challenges of life during coral bleaching. Coral Reefs. 40, 1339-1353 (2021).
- Guerra, F. D., Attia, M. F., Whitehead, D. C., Alexis, F. Nanotechnology for environmental remediation: materials and applications. Molecules. 23 (7), 1760(2018).
- Matthews, J. L., et al. Metabolite pools of the reef building coral Montipora capitata are unaffected by Symbiodiniaceae community composition. Coral Reefs. 39, 1727-1737 (2020).
- Papina, M., Meziane, T., van Woesik, R. Symbiotic zooxanthellae provide the host-coral Montipora digitata with polyunsaturated fatty acids. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 135 (3), 533-537 (2003).
- Kellogg, R., Patton, J. Lipid droplets, medium of energy exchange in the symbiotic anemone Condylactis gigantea: A model coral polyp. Marine Biology. 75, 137-149 (1983).
- Ankrah, N. Y., Chouaia, B., Douglas, A. E. The cost of metabolic interactions in symbioses between insects and bacteria with reduced genomes. mBio. 9 (5), e01433(2018).
- Kabeya, N., et al. Genes for de novo biosynthesis of omega-3 polyunsaturated fatty acids are widespread in animals. Science Advances. 4 (5), (2018).
- Hillyer, K. E., Dias, D., Lutz, A., Roessner, U., Davy, S. K. 13C metabolomics reveals widespread change in carbon fate during coral bleaching. Metabolomics. 14 (1), 12(2018).
- Hillyer, K. E., Dias, D. A., Lutz, A., Roessner, U., Davy, S. K. Mapping carbon fate during bleaching in a model cnidarian symbiosis: the application of 13C metabolomics. New Phytologist. 214 (4), 1551-1562 (2017).
- Burriesci, M. S., Raab, T. K., Pringle, J. R. Evidence that glucose is the major transferred metabolite in dinoflagellate-cnidarian symbiosis. Journal of Experimental Biology. 215 (19), 3467-3477 (2012).
- Thurber, R. V., et al. Unified methods in collecting, preserving, and archiving coral bleaching and restoration specimens to increase sample utility and interdisciplinary collaboration. PeerJ. 10, 14176(2022).
- Grottoli, A. G., et al. Increasing comparability among coral bleaching experiments. Ecological Applications. 31 (4), 02262(2020).
- Mushtaq, M. Y., Choi, Y. H., Verpoorte, R., Wilson, E. G. Extraction for metabolomics: access to the metabolome. Phytochemical Analysis. 25 (4), 291-306 (2014).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1), 248-254 (1976).
- Peterson, G. L., et al. A simplification of the protein assay method of Lowry et al. which is more generally applicable. Analytical Biochemistry. 83 (2), 346-356 (1977).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Zamer, W. E., Shick, J. M., Tapley, D. W. Protein measurement and energetic considerations: Comparisons of biochemical and stoichiometric methods using bovine serum albumin and protein isolated from sea anemones. Limnology and Oceanography. 34 (1), 256-263 (1989).
- Smart, K. F., Aggio, R. B., Van Houtte, J. R., Villas-Boas, S. G. Analytical platform for metabolome analysis of microbial cells using methyl chloroformate derivatization followed by gas chromatography-mass spectrometry. Nature Protocols. 5 (10), 1709-1729 (2010).
- Pang, Z., et al. Using MetaboAnalyst 5.0 for LC-HRMS spectra processing, multi-omics integration and covariate adjustment of global metabolomics data. Nature Protocols. 17 (8), 1735-1761 (2022).
- Tibshirani, R., Walther, G., Hastie, T. Estimating the number of clusters in a data set via the gap statistic. Journal of the Royal Statistical Society: Series B (Statistical Methodology). 63 (2), 411-423 (2001).
- Chen, W. -N., et al. Diel rhythmicity of lipid-body formation in a coral-Symbiodinium endosymbiosis). Coral Reefs. 31 (2), 521-534 (2012).
- Imbs, A. Fatty acids and other lipids of corals: composition, distribution, and biosynthesis. Russian Journal of Marine Biology. 39 (3), 153-168 (2013).
- Rosset, S., et al. Lipidome analysis of Symbiodiniaceae reveals possible mechanisms of heat stress tolerance in reef coral symbionts. Coral Reefs. 38 (6), 1241-1253 (2019).
- Carreón-Palau, L., Parrish, C. C., Del Angel-Rodriguez, J. A., Perez-Espana, H. Seasonal shifts in fatty acids and sterols in sponges, corals, and bivalves, in a southern Gulf of Mexico coral reef under river influence. Coral Reefs. 40 (2), 571-593 (2021).
- Imbs, A. B., Dang, L. T. Seasonal dynamics of fatty acid biomarkers in the soft coral Sinularia flexibilis, a common species of Indo-Pacific coral reefs. Biochemical Systematics and Ecology. 96, 104246(2021).
- Oku, H., Yamashiro, H., Onaga, K., Sakai, K., Iwasaki, H. Seasonal changes in the content and composition of lipids in the coral Goniastrea aspera. Coral Reefs. 22 (1), 83-85 (2003).
- Weis, V. M. Cell biology of coral symbiosis: foundational study can inform solutions to the coral reef crisis. Integrative and Comparative Biology. 59 (4), 845-855 (2019).
- Oakley, C., Davy, S. Cell biology of coral bleaching. Coral Bleaching. van Oppen, M., Lough, J. , Springer. Cham, Switzerland. 189-211 (2018).
- Lu, W., et al. Metabolite measurement: Pitfalls to avoid and practices to follow. Annual Review of Biochemistry. 86, 277-304 (2017).
- Lawson, C. A., et al. Heat stress decreases the diversity, abundance and functional potential of coral gas emissions. Global Change Biology. 27 (4), 879-891 (2021).
- Olander, A., et al. Comparative volatilomics of coral endosymbionts from one-and comprehensive two-dimensional gas chromatography approaches. Marine Biology. 168 (5), 76(2021).
- Wuerz, M., et al. Symbiosis induces unique volatile profiles in the model cnidarian Aiptasia. Journal of Experimental Biology. 225 (19), (2022).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten