Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Газовая хромато-масс-спектрометрия на основе таргетной метаболомики образцов твердых кораллов
В этой статье
Резюме
Здесь мы представляем экстракцию и подготовку полярных и полуполярных метаболитов из голобионта коралла, а также разделенной ткани хозяина коралла и клеточных фракций Symbiodiniaceae для анализа газовой хромато-масс-спектрометрии.
Аннотация
Подходы, основанные на газовой хромато-масс-спектрометрии (ГХ-МС), оказались эффективными для выяснения метаболической основы симбиоза книдарии и динофлагеллятов и того, как кораллы реагируют на стресс (например, во время температурно-индуцированного обесцвечивания). Стационарное профилирование метаболитов кораллового голобионта, который включает в себя книдарийного хозяина и связанные с ним микробы (Symbiodiniaceae и другие протисты, бактерии, археи, грибы и вирусы), было успешно применено в условиях окружающей среды и стресса для характеристики целостного метаболического статуса коралла.
Однако, чтобы ответить на вопросы, связанные с симбиотическими взаимодействиями, необходимо проанализировать профили метаболитов коралла-хозяина и его водорослевых симбионтов независимо друг от друга, что может быть достигнуто только путем физического разделения и изоляции тканей с последующим независимым извлечением и анализом. Несмотря на то, что применение метаболомики является относительно новым для коралловой области, постоянные усилия исследовательских групп привели к разработке надежных методов анализа метаболитов в кораллах, включая разделение тканей коралла-хозяина и симбионтов водорослей.
В данной работе представлено пошаговое руководство по разделению голобионтов и экстракции метаболитов для анализа ГХ-МС, включая основные шаги оптимизации для рассмотрения. Мы демонстрируем, что при независимом анализе комбинированный профиль метаболитов двух фракций (коралловые и Symbiodiniaceae) похож на профиль целого (голобионт), но, разделяя ткани, мы также можем получить ключевую информацию о метаболизме и взаимодействиях между двумя партнерами, которая не может быть получена только из целого.
Введение
Метаболиты представляют собой конечные продукты клеточных процессов, а метаболомика – изучение набора метаболитов, продуцируемых данным организмом или экосистемой – может обеспечить прямую меруфункционирования организма. Это особенно важно для изучения экосистем, симбиотических взаимодействий и инструментов восстановления, поскольку целью большинства стратегий управления является сохранение (или восстановление) конкретных функций экосистемныхуслуг2. Коралловые рифы представляют собой одну из водных экосистем, которая демонстрирует потенциальную ценность метаболомики для выяснения симбиотических взаимодействий и увязки физиологических реакций кораллов с воздействием на уровне общин и экосистем3. Применение высокопроизводительной газовой хромато-масс-спектрометрии (ГХ-МС) особенно ценится из-за ее способности быстро анализировать широкий спектр классов метаболитов одновременно с высокой селективностью и чувствительностью, обеспечивать быструю идентификацию соединений при наличии спектральных библиотек и обеспечивать высокий уровень воспроизводимости и точности при относительно низкой стоимости образца.
Кораллы являются голобионтами, состоящими из кораллового животного, фотосинтезирующих динофлагеллятных эндосимбионтов (семейство: Symbiodiniaceae4) и сложного микробиома 5,6. В целом, приспособленность голобионта поддерживается в основном за счет обмена малыми молекулами и элементами для поддержки метаболического функционирования каждого члена 7,8,9,10. Метаболомные подходы оказались особенно эффективными для выяснения метаболических основ специфичности симбиоза9,11, реакции обесцвечивания на термический стресс 7,8,12,13, реакции на болезнь 14, реакции на воздействие загрязнения 15, фотоакклиматизации16 и химической сигнализации 17 у кораллов, а также помощи в обнаружении биомаркеров 18С. 19. Кроме того, метаболомика может дать ценное подтверждение выводов, сделанных на основе методов на основе ДНК и РНК 9,20. Таким образом, существует значительный потенциал для использования метаболомики для оценки состояния рифов и разработки инструментов для ихсохранения3, например, путем выявления метаболических биомаркеров стресса18,19 и для изучения потенциала стратегий активного управления, таких как субсидии на питание21.
Разделение клеток хозяина и симбионта и анализ их метаболитных профилей независимо друг от друга, а не вместе, как голобионт, может дать больше информации о взаимодействиях партнеров, независимых физиологических и метаболических статусах, а также потенциальных молекулярных механизмах адаптации 11,12,22,23,24. Без разделения кораллов и Symbiodiniaceae практически невозможно пролить свет на вклад и метаболизм кораллов и/или Symbiodiniaceae независимо друг от друга, за исключением сложной реконструкции генома и метаболического моделирования25, но это еще предстоит применить к симбиозу кораллов и динофлагеллятов. Кроме того, попытка извлечь информацию об индивидуальном метаболизме хозяина или водорослевого симбионта из метаболитного профиля голобионта может привести к неправильной интерпретации.
Например, до недавнего времени считалось, что присутствие полиненасыщенных жирных кислот C18:3n-6, C18:4n-3 и C16 в экстрактах тканей кораллов и голобионтов происходит от водорослей-симбионтов, поскольку считалось, что кораллы не обладают ωx-десатуразами, необходимыми для производства омега-3 (ω3) жирных кислот; однако недавние геномные данные свидетельствуют о том, что многие книдарии обладают способностью продуцировать ω3 ПНЖК de novo и далее биосинтезировать ω3 длинноцепочечный ПНЖК26. Сочетание ГХ-МС со стабильным изотопным мечением (например, 13 С-бикарбонат, 13CO 3) может быть использовано для отслеживания судьбы фотосинтетически фиксированного углерода через метаболические сети голобионтов кораллов как в контрольных условиях, так и в ответ на внешние стрессоры27,28. Тем не менее, критическим этапом в отслеживании судьбы 13С является отделение ткани коралла от клеток водорослей - только в этом случае присутствие меченого 13С соединения во фракции хозяина коралла может быть однозначно отнесено к метаболиту, полученному из Symbiodiniaceae, транслоцированному в коралл, или как последующий продукт транслоцированного меченого соединения. Этот метод продемонстрировал свою силу, бросив вызов давнему предположению о том, что глицерин является основной формой, в которой фотосинтезат перемещается от симбионта к хозяину29, а также прояснив, как изменяется поток питательных веществ между партнерами во время обесцвечивания27,28 и в ответ на несовместимые виды Symbiodiniaceae11.
В то время как решение о разделении тканей в первую очередь обусловлено исследовательским вопросом, важно учитывать практичность, надежность и потенциальное метаболическое воздействие этого подхода. Здесь мы приводим подробные, продемонстрированные методы извлечения метаболитов из голобионта, а также отдельных фракций хозяина и симбионта. Мы сравниваем профили метаболитов хозяина и симбионта независимо друг от друга и сравниваем эти профили с профилем метаболита голобионта.
Access restricted. Please log in or start a trial to view this content.
протокол
ПРИМЕЧАНИЕ: План эксперимента, сбор и хранение образцов были подробно описаны в других статьях 2,30,31. Разрешение на сбор диких кораллов должно быть получено до начала сбора и проведения экспериментов. Образцы были взяты из колоний Montipora mollis (морфа зеленого цвета), импортированных с коралловых ферм Батавии (Джералдтон, штат Вашингтон), первоначально собранных с рифа у островов Абролос (Западная Австралия; 28°52'43.3"S 114°00'17.0"E) на глубине 1 м в соответствии с лицензией на аквакультуру AQ1643. Перед отбором проб колонии содержались в аквариуме объемом 800 л при температуре 35 ПСУ, под синим и белым светом при концентрации фотонов 150 мкмоль·м−2·с−1 и при температуре 25 °C ± 0,5 °C в течение 3 месяцев. Фрагменты кораллов (~5 см2 , N = 6) замораживали в жидком азоте и хранили при температуре −80 °C до переработки.
1. Приготовление экстракционных растворов и оборудования
- По крайней мере, за 1 день до удаления коралловой ткани подготовьте растворы для экстракции и оборудование.
- Предварительно охладите сверхчистую воду в чистой, не содержащей моющих средств стеклянной посуде при температуре 4 °C.
- Смешайте 100% метанол марки LC с конечной концентрацией 10 мкг·мл−1 соответствующего внутреннего стандарта (стандартов) (например, сорбита 13°C6 ).
- Создайте решение для экстракции 50% метанола, используя половину 100% метанола класса LC и половину сверхчистой воды. Храните оба раствора метанола при температуре −20 °C.
ПРИМЕЧАНИЕ: Чтобы предотвратить деградацию метаболитов, рекомендуется выполнять этапы обработки образцов партиями по пять фрагментов кораллов за один раз, с одной дополнительной биологической (только водной) заготовкой (всего образцов N = 6). После того, как каждый образец коралла будет разделен на две фракции (ткань коралла-хозяина, далее «хозяин», и клетки микроводорослей, далее «симбионт»), общее количество образцов в одной технологической партии составит 12.
2. Подавление метаболизма кораллов
ПРИМЕЧАНИЕ: План эксперимента, сбор и хранение образцов были подробно описаны в других статьях 2,30,31. Тем не менее, следует отметить, что время, необходимое для подавления метаболизма (т.е. время между сбором образцов кораллов и сохранением), имеет решающее значение для получения первоначальной реакции30. Сохраняйте пробу как можно быстрее после отбора, чтобы предотвратить изменения в составе метаболитов из-за деградации образца или нецелевых физиологических реакций32.
- Поместите фрагмент коралла в стерильный пакет для сбора проб и слейте лишнюю морскую воду, насколько это возможно. Погрузите образец в жидкий азот минимум на 30 с. Как можно скорее переместите образцы в морозильную камеру с температурой −80 °C для хранения.
ПРИМЕЧАНИЕ: Образцы можно замораживать при температуре −80 °C в контейнерах с блокировкой света до обработки, избегая циклов замораживания-оттаивания.
3. Удаление коралловой ткани из скелета
ПРИМЕЧАНИЕ: Образцы следует постоянно держать на льду (4 °C), чтобы убедиться, что они одновременно находятся в жидкой форме и предотвращают непрерывный метаболизм.
- Поместите чистый стерильный пакет для сбора проб на лед так, чтобы он был устойчивым и открытым поверх льда в неглубоком колодце, но не был погружен в лед. Добавьте в пакет 10 мл холодной (4 °C) сверхчистой воды.
ПРИМЕЧАНИЕ: Это поможет избежать повторного замораживания-оттаивания фрагмента коралла из-за холодного сжатого воздуха и окружающего льда. - Отобрать фрагмент коралла стерилизованным пинцетом и промыть холодной (4 °C) сверхчистой водой стерильной пипеткой Пастера до тех пор, пока не останется остатков морской воды. Погрузите промытый фрагмент коралла в пакет, содержащий 10 мл сверхчистой воды.
ПРИМЕЧАНИЕ: Эта промывка имеет решающее значение для удаления любых остаточных солей, которые могут помешать последующему анализу. Избегайте контакта рук с водой или фрагментом коралла через мешок, чтобы поддерживать температуру образца при температуре 4 °C. - Обмотайте стерильный наконечник пипетки объемом 1 мл на конец пневматического пистолета изолентой, отрезав конец наконечника ~5 мм (Рисунок 1А).
- Направьте пневматический пистолет на фрагмент коралла с наполовину запечатанным пакетом и потоком воздуха на слабом и среднем уровне, чтобы осторожно удалить ткань, стимулируя круговое движение воды над фрагментом коралла.
- Через ~3 минуты или когда кажется, что вся ткань удалена из скелета, выключите воздух и снимите аэрограф. Полностью запечатайте пакет.
- Сожмите всю удаленную коралловую ткань в нижний угол пакета. Отрежьте противоположный уголок и аккуратно вылейте содержимое пакетика в пробирку объемом 15 мл на лед.
4. Опциональная гомогенизация
ПРИМЕЧАНИЕ: Некоторые виды кораллов более вязкие, чем другие, что означает, что аэрография удалит ткань в комках, а не в виде суспензии. Если в гомогенате, обработанном аэрографом, видны комки ткани, для всех образцов можно добавить этап гомогенизации при 4 °C.
- Дважды очистите механический гомогенизатор с пильными зубьями 70% метанолом с температурой 4 °C и, наконец, сверхчистой водой с температурой 4 °C.
- Гомогенизируйте образец коралла в пробирке объемом 15 мл в течение ~1 минуты до тех пор, пока образец не станет полностью гомогенизированным и не будет видно комков.
- Очищайте гомогенизатор, как описано в шаге 4.1, между каждым образцом. Обеспечьте одинаковое время гомогенизации для всех образцов.
5. Отбор проб для нормализации
- Соберите 1 000 мкл аликвоты из гомогенизированной ткани для подсчета клеток Symbiodiniaceae, анализа содержания белка в тканях коралла и оценки хлорофилла. Хранить при температуре −20 °C до готовности к анализу (раздел 10).
6. Дополнительная ткань коралла-хозяина - разделение клеток Symbiodiniaceae
- Центрифугируют гомогенат кораллов при 2 500 × г в течение 5 мин при 4 °C с помощью центрифуги с охлаждением.
ПРИМЕЧАНИЕ: Такая скорость оптимальна для отделения более тяжелых клеток Symbiodiniaceae, сохраняя при этом их клеточные стенки нетронутыми, от ткани хозяина, которая находится во взвешенном состоянии в надосадочной жидкости. - Удалите надосадочную жидкость, содержащую материал хозяина, и поместите в новую пробирку объемом 15 мл.
Примечание: Липиды из ткани хозяина обычно образуют узкий розово-белый слой поверх клеток симбионта. Этот слой может быть собран вместе с растворимым надосадочной жидкостью хозяина с помощью пипетирования (рис. 1B). - Энергично встряхивайте хозяина ровно 1 мин. Храните образец гранул водорослей и образец надосадочной жидкости хозяина на льду.
- Добавьте 2 мл сверхчистой воды с температурой 4 °C в гранулу водоросля. Энергично встряхните ровно 2 минуты, чтобы повторно взвесить гранулу.
ПРИМЕЧАНИЕ: Если отдельные фрагменты размером 1 см не были собраны из колонии кораллов для генотипирования Symbiodiniaceae, 200 мкл аликвоты клеточной суспензии Symbiodiniaceae могут быть собраны здесь, сохранены в предпочтительном буферном растворе ДНК и сохранены, как описано в Thurber et al.30 для генотипирования Symbiodiniaceae (например, согласно González-Pech et al.12). - Повторите шаги 6.1-6.4 еще раз.
ПРИМЕЧАНИЕ: Надежное разделение хозяина и симбионта зависит от биомассы коралла и вида, так как некоторые виды могут быть более вязкими, чем другие. Рекомендуется минимум три этапа промывки, но этот срок может быть увеличен в зависимости от успешности сепарации. Повторяйте шаги промывки 4.7-4.9 до тех пор, пока в нижней части фракции хозяина не будут видны клетки Symbiodiniaceae и пока фракция Symbiodiniaceae не будет заметно свободна от материала хозяина (например, сверху не будет белого слоя) (Рисунок 1). - Удалите надосадочную жидкость, содержащую материал хозяина, и поместите в новую пробирку объемом 15 мл.
- Удерживайте гранулу симбионта в пробирке объемом 15 мл.
7. Сушка образца
- Замораживают либо гомогенат голобионта, либо обе разделенные фракции хозяина и Symbiodiniaceae при −80 °C в течение ~120 мин. Лиофилизируйте образцы в течение ночи в вакууме 0,01 мбар при −85 °C.
ПРИМЕЧАНИЕ: Чтобы избежать потери образца во время лиофилизации, рекомендуется использовать крышку, вырезанную из другой стерильной пробирки, или стерильную парапленку, с отверстием ~2 мм, тщательно пробитым стерильной иглой 25 G. - В сухом виде с помощью лабораторных весов взвесьте один из следующих вариантов: 1) 25 мг голобионта; 2) 15 мг фракции симбионта; или 3) 30 мг ткани хозяина из каждого образца в отдельные пробирки для микроцентрифуг по 2 мл без пластификатора.
ПРИМЕЧАНИЕ: Критический шаг: Оптимизация биомассы для экстракции необходима для обеспечения того, чтобы ГХ-МС не был перегружен при обеспечении достаточного сигнала. Высушенный коралловый материал очень статичен. Чтобы избежать потери пробы, используйте антистатические устройства для устранения электростатических зарядов из образцов и сосудов для взвешивания. Простой и экономичной альтернативой является помещение сушильного листа для белья под пробирку для образца. Высушенные гранулы симбионта можно разрезать до нужного веса с помощью стерильного лезвия.
8. Экстракция внутриклеточных метаболитов
- Внутриклеточная экстракция метаболитов из лиофилизированного голобионта:
- Добавьте 400 мкл 100% холодного (−20 °C) метанола с внутренним стандартом (IS; 13 См.С6 сорбит и/или 13С 5-15 Н валин (по 10мкМ) в каждую пробирку.
- Добавьте небольшое количество стеклянных шариков размером 710-1,180 мкм, промытых кислотой (~10 мг) к каждому образцу. Поместите в бисерную мельницу при частоте 50 Гц на 3 минуты в предварительно охлажденную (−20 °C) пластину бисерной мельницы.
- Добавьте дополнительно 600 мкл 100% холодного (−20 °C) метанола с ISs (13 C6 сорбита и/или 13C5-15 Н валина при 10мкМ) в каждую пробирку.
- Вихрь перемешивать в течение 1 мин. Поместите на шейкер-гриль при температуре 4 °C на 30 минут.
- Внутриклеточная экстракция метаболитов из разделенных лиофилизированных клеток Symbiodiniaceae:
- Добавьте 200 мкл 100% холодного (−20 °C) метанола с ISs (13 C6 сорбита и/или 13C 5-15 Н валина при 10мкМ) к высушенному материалу Symbiodiniaceae.
- Добавьте небольшое количество стеклянных шариков размером 710-1,180 мкм, промытых кислотой (~10 мг). Поместите в бисерную мельницу при частоте 50 Гц на 3 минуты в предварительно охлажденную (−20 °C) пластину бисерной мельницы.
- Добавьте еще 800 мкл 100% холодного (−20 °C) метанола с ISs и вихрь в течение 30 секунд.
- Внутриклеточная экстракция метаболитов из разделенной лиофилизированной ткани хозяина:
- Добавьте 1 мл 100% холодного (−20 °C) метанола LC-класса, содержащего ISs (13 C6 сорбита и/или 13C 5-15 N валина, при 10мкМ) к высушенному основному материалу.
- Вихрь перемешивать в течение 20 с. Поместите в плавающий держатель пробирки в ультразвуковую ванну, установленную при температуре 4 °C, на 30 минут.
9. Очистка экстракта метаболитов
- Центрифугируют образцы (голобионт/хозяин/симбионт) при 3 000 × г в течение 30 мин при 4 °C.
- Перелейте всю надосадочную жидкость в новую микроцентрифужную пробирку объемом 2 мл, стараясь не повредить гранулы клеточного мусора.
ПРИМЕЧАНИЕ: Это полуполярные экстракты. Их можно временно держать на льду, но долго хранить при температуре −80 °C в темноте. - К оставшемуся клеточному остатку добавьте 1 000 мкл 50% холодного (−20 °C) метанола. Энергично встряхните в течение 1 мин для ресуспензии.
- Центрифугируют образцы при 3 000 × г в течение 30 мин при 4 °C.
- Соберите и объедините надосадочную жидкость (полярные экстракты) с полуполярными экстрактами из того же образца.
ПРИМЕЧАНИЕ: Клеточный мусор можно хранить при температуре −80 °C и использовать для нормализации содержания белка (раздел 11). - Центрифугируют объединенные экстракты при 16 100 г в течение 15 мин, чтобы удалить все осадки, и перемещают надосадочную жидкость в новую микроцентрифужную пробирку без пластификаторов (2 мл).
ПРИМЕЧАНИЕ: Экстракты образцов можно хранить при температуре −80 °C в темноте. - Когда все будет готово к анализу, добавьте 50 мкл каждого экстракта в стеклянную вставку. Концентрируйте в течение 30 мин при 30 °C с помощью вакуумного концентратора. Повторите еще четыре раза (для 250 мкл общего сухого экстракта).
ПРИМЕЧАНИЕ: Высушенные образцы можно хранить при комнатной температуре в условиях адсорбции до проведения анализа.
10. Дериватизация метаболитов
ПРИМЕЧАНИЕ: Двухступенчатый процесс дериватизации используется для метоксимации и триметилсилилирования полярных метаболитов.
- Добавьте 25 мкл метоксиамина гидрохлорида (30 мг/мл в пиридине) в каждый образец.
- Взбалтывайте при 37 °C на орбитальном встряхивателе, установленном при 750 об/мин, в течение 2 часов.
- Добавьте в каждый образец 25 мкл N,O-bis (триметилсилил)трифторацетамида + триметилхлорсилана.
- Снова взбалтывайте при 37 °C и 750 об/мин в течение 1 часа.
- Дайте образцам уравновеситься при комнатной температуре в течение 1 ч, прежде чем вводить 1 мкл в соотношении 1:10 на ГХ.
11. Газовый хромато-масс-спектрометрический анализ
ПРИМЕЧАНИЕ: Масс-спектрометр должен быть настроен в соответствии с рекомендациями производителя с использованием трис-(перфторбутил)-амина (CF43).
- Используйте гелий сверхвысокой чистоты в качестве газа-носителя при постоянном расходе колонны 1 мл/мин.
- Используйте колонну DB-5 длиной 30 м с толщиной пленки 1 мкм и внутренним диаметром 0,25 мм.
- Программа печи GC
- Установите температуру на входе 280 °C.
- Начните с впрыска при температуре духовки 100 °C и подержите 4 минуты.
- Увеличьте температуру на 10 °С/мин до 320 °С, а затем подержите 11 мин.
- Параметры масс-спектрометра
- Установите линию переноса MS на 280 °C, а источник ионов — на 200 °C.
- Используйте аргон в качестве газа ячейки столкновения для генерации иона продукта множественного мониторинга реакций (MRM).
- Обнаружение метаболитов относительно сегментированной по времени библиотеки управления записями сообщений, содержащей целевые объекты управления записями сообщений.
12. Подсчет клеток Symbiodiniaceae, анализ содержания белка в тканях коралла и оценка хлорофилла
- Количество клеток Symbiodiniaceae:
- Возьмите аликвоту гомогената коралловой ткани.
- Центрифугируйте образцы при 2 000 × г , чтобы гранулировать водоросли.
- Извлеките ~200 мкл надосадочной жидкости из гранулы водорослей и поместите в новую пробирку для микроцентрифуги.
ПРИМЕЧАНИЕ: Это будет образец белка, который будет использоваться для нормализации данных; При необходимости храните его при температуре −20 °C перед анализом. - Повторно суспендируйте гранулы водорослей в 1 мл фильтрованной морской воды, осторожно пипетируя вверх и вниз. При необходимости разбавьте суспензию водорослей, чтобы облегчить подсчет клеток.
- Проведите подсчет клеток с помощью гемоцитометра под световым микроскопом, добавив 10 мкл в одну из камер. Выполните от 8 до 10 подсчетов на образец.
ПРИМЕЧАНИЕ: Альтернативные методы подсчета клеток водорослей также могут быть применены там, где это возможно (например, проточная цитометрия, высокопроизводительная конфокальная микроскопия). - Рассчитайте концентрацию клеток-симбионтов (мл−1) с учетом любых используемых коэффициентов разведения.
- Анализ на содержание белка
- Количественная оценка содержания белка в образце (например, с помощью колориметрического анализа Брэдфорда, первоначально описанного Bradford et al.33, или с помощью анализа Лоури34,35, протокол которого был описан для книдарий в другом месте 36).
- Экстракция хлорофиллом
- Используйте гранулы из ~200 000 клеток, замороженные или свежие.
- Переложите каждую гранулу водоросли в 2 мл диметилформамида (ДМФА) в стеклянном сцинтилляционном флаконе и инкубируйте в темноте при 4 °C в течение 48 ч.
ПРИМЕЧАНИЕ: ДМФА токсичен и канцерогенен, поэтому подготовка образца должна проводиться в как можно более темном вытяжном шкафу и на льду. Если имеется <200 000 ячеек, используйте меньше DMF. - Центрифуга в течение 3 мин при 16 000 × г.
- Перенесите 200 мл в луночный планшет UV-96 для фотометрических измерений. Запустите каждый образец в трех экземплярах с DMF в качестве заготовки.
- Измерьте поглощение на длинах волн (E) 663,8 нм, 646 нм и 750 нм. Вычтите поглощение на длине волны 750 нм из поглощения на обеих других длинах волн.
ПРИМЕЧАНИЕ: Измерение на длине волны 750 нм корректирует любое рассеяние или мутность в образце. - Рассчитайте концентрацию хлорофилла а (мкг/мл) по уравнению (1):
Концентрация Chl a (мкг/мл) = (12,00 × E 663,8) - (3,11 × E646,8) (1)
13. Количественная оценка биомассы клеток после экстракции метаболитов для нормализации
ПРИМЕЧАНИЕ: Существует два варианта количественного определения клеточной биомассы, описанных ниже: количественное определение белка, относящегося к биомассе, с использованием модифицированного колориметрического метода Брэдфорда и измерение сухого веса клеточного остатка. Оба метода подходят для использования, так как оба предлагают точную количественную оценку биомассы клеток.
- Содержание белка в клеточном мусоре
- Ресуспендант замороженных клеточных остатков с 1 мл 0,2 М NaOH и инкубируют образцы при 98 °C в течение 20 мин.
- Образцы охлаждают на льду в течение ~10 мин и центрифугируют при температуре 3 000 × г в течение 5 мин при температуре окружающей среды.
- Количественная оценка содержания белка в образце (например, с помощью колориметрического анализа Брэдфорда, первоначально описанного Bradford et al.33 и модифицированного Smart et al.37).
- Измерение сухого веса клеточного мусора
- Ресуспендировать клеточный мусор от внутриклеточной экстракции метаболитов в воде двойной дистилляции (~10 мл).
- Отфильтруйте раствор под вакуумом с помощью предварительно взвешенного мембранного фильтра (поры 0,22 мкм, 47 мм).
- Промойте пробирки с биомассой дважды сверхчистой водой, чтобы обеспечить полную передачу биомассы в мембранный фильтр.
- Снимите мембранный фильтр, содержащий биомассу, и высушите его в микроволновой печи (малая мощность; ~250 Вт в течение 20 мин).
- Храните фильтровальную бумагу в эксикаторе на ночь. Запишите сухой вес фильтровальной бумаги и рассчитайте сухой вес биомассы, вычитая вес сухого мембранного фильтра (с использованием чистого сухого мембранного фильтра, высушенного вместе с фильтром образца) из общего веса.
14. Анализ данных
- Анализируйте мишени метаболитов с помощью баз данных метаболитов, где каждая цель состоит из квантификатора и классификатора MRM.
- Визуально осматривайте обнаруженные мишени метаболитов и при необходимости интегрируйте их вручную.
- Используйте область пика метаболитов для вычисления относительного содержания каждого образца для каждой группы. Значения корректируются и нормализуются для выборки внутренней стандартной площади пика, а затем для отбора проб содержания белка в клеточном остатке в соответствии со Smart et al.37.
- Отбрасывают метаболиты с относительным стандартным отклонением более 35% во всех группах лечения (N = 23 метаболита).
- Преобразуйте данные (например, кубический корень) и центрируйте их по центру; подтверждают нормальное распределение и однородность дисперсии.
- Выполните анализ данных (ANOVA и построение тепловых карт, например, с использованием https://www.metaboanalyst.ca)38. Кластеризуйте образцы для изучения вариабельности в рамках лечения с помощью пакетов "cluster", "factoextra" и "klustR". Вычислите статистику разрыва (метод определения оптимального числа кластеров39) с помощью функции "clusGap" в R и графики с помощью пакета R "tidyverse". Выполните PERMANOVA, чтобы изучить значимость разделения между профилями метаболитов для лечения (например, в Primer).
Access restricted. Please log in or start a trial to view this content.
Результаты
Все данные, полученные в ходе этой работы, доступны в дополнительной информации.
Разделение симбионтов хозяина и симбионта
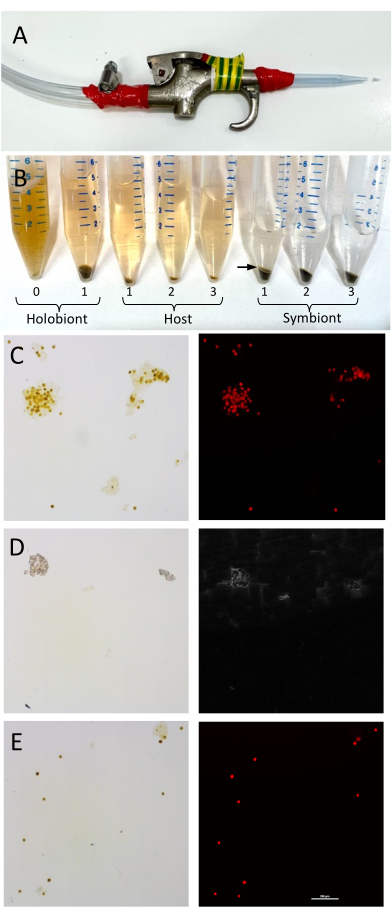
Рисунок 1: Настройка и валидация ?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Разделение хозяина и симбионта легко и быстро достигается с помощью простого центрифугирования, и результаты показывают, что разделение фракций может предоставить ценную информацию, указывающую на специфический вклад голобионтов, что может способствовать функциональному анали...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, который они могли бы раскрыть.
Благодарности
J.L.M. был поддержан исследовательской стипендией UTS Chancellor's Research Fellowship.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 100% LC-grade methanol | Merck | 439193 | LC grade essential |
| 2 mL microcentrifuge tubes, PP | Eppendorf | 30121880 | Polypropylene provides high resistance to chemicals, mechanical stress and temperature extremes |
| 2030 Shimadzu gas chromatograph | Shimadzu | GC-2030 | |
| 710-1180 µm acid-washed glass beads | Merck | G1152 | This size is optimal for breaking the Symbiodiniaceae cells |
| AOC-6000 Plus Multifunctional autosampler | Shimadzu | AOC6000 | |
| Bradford reagent | Merck | B6916 | Any protein colourimetric reagent is acceptable |
| Compressed air gun | Ozito | 6270636 | Similar design acceptable. Having a fitting to fit a 1 mL tip over is critical. |
| DB-5 column with 0.25 mm internal diameter column and 1 µm film thickness | Agilent | 122-5013 | |
| DMF | Merck | RTC000098 | |
| D-Sorbitol-6-13C and/or 13C5–15N Valine | Merck | 605514/ 600148 | Either or both internal standards can be added to the methanol. |
| Flat bottom 96-well plate | Merck | CLS3614 | |
| Glass scintillation vials | Merck | V7130 | 20 mL, with non-plastic seal |
| Immunoglogin G | Merck | 56834 | if not availbe, Bovine Serum Albumin is acceptable |
| Primer | v4 | ||
| R | v4.1.2 | ||
| Shimadzu LabSolutions Insight software | v3.6 | ||
| Sodium Hydroxide | Merck | S5881 | Pellets to make 1 M solution |
| tidyverse | v1.3.1 | R package | |
| TissueLyser LT | Qiagen | 85600 | Or similar |
| TQ8050NX triple quadrupole mass spectrometer | Shimadzu | GCMS-TQ8050 NX | |
| UV-96 well plate | Greiner | M3812 | |
| Whirl-Pak sample bag | Merck | WPB01018WA | Sample collection bag; Size: big enough to house a ~5 cm coral fragment, but not too big that the water is too spread |
Ссылки
- Bundy, J. G., Davey, M. P., Viant, M. R. Environmental metabolomics: A critical review and future perspectives. Metabolomics. 5 (1), 3-21 (2008).
- Matthews, J. L., et al. The metabolic significance of symbiont community composition in the coral-algal symbiosis. Applied Environmental Metabolomics. Beale, D. J., Hillyer, K. E., Warden, A. C., Jones, O. A. H. , Academic Press. Cambridge, MA. 211-229 (2022).
- Lawson, C. A., et al. Informing coral reef conservation through metabolomic approaches. Coral Reef Conservation and Restoration in the Omics Age. Coral Reefs of the World. van Oppen, M. J. H., Aranda Lastra, M. , Springer. Cham, Switzerland. 179-202 (2022).
- LaJeunesse, T. C., et al. Systematic revision of Symbiodiniaceae highlights the antiquity and diversity of coral endosymbionts. Current Biology. 28 (16), 2570-2580 (2018).
- Rohwer, F., Seguritan, V., Azam, F., Knowlton, N. Diversity and distribution of coral-associated bacteria. Marine Ecology Progress Series. 243, 1-10 (2002).
- Maire, J., et al. Intracellular bacteria are common and taxonomically diverse in cultured and in hospite algal endosymbionts of coral reefs. The ISME Journal. 15 (7), 2028-2042 (2021).
- Hillyer, K. E., et al. Metabolite profiling of symbiont and host during thermal stress and bleaching in the coral Acropora aspera. Coral Reefs. 36, 105-118 (2016).
- Hillyer, K. E., Tumanov, S., Villas-Bôas, S., Davy, S. K. Metabolite profiling of symbiont and host during thermal stress and bleaching in a model cnidarian-dinoflagellate symbiosis. Journal of Experimental Biology. 219 (4), 516-527 (2016).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences of the United States of America. 114 (50), 13194-13199 (2017).
- Rosset, S. L., et al. The molecular language of the cnidarian-dinoflagellate symbiosis. Trends in Microbiology. 29 (4), 320-333 (2020).
- Matthews, J. L., et al. Partner switching and metabolic flux in a model cnidarian-dinoflagellate symbiosis. Royal Society. 285 (1892), 20182336(2018).
- González-Pech, R. A., et al. Physiological factors facilitating the persistence of Pocillopora aliciae and Plesiastrea versipora in temperate reefs of south-eastern Australia under ocean warming. Coral Reefs. 41, 1239-1253 (2022).
- Williams, A., et al. Metabolomic shifts associated with heat stress in coral holobionts. Science Advances. 7 (1), (2021).
- Deutsch, J. M., et al. Metabolomics of healthy and stony coral tissue loss disease affected Montastraea cavernosa corals. Frontiers in Marine Science. 8, 1421(2021).
- Stien, D., et al. A unique approach to monitor stress in coral exposed to emerging pollutants. Scientific Reports. 10 (1), 9601(2020).
- Lohr, K. E., et al. Resolving coral photoacclimation dynamics through coupled photophysiological and metabolomic profiling. Journal of Experimental Biology. 222 (8), (2019).
- Jorissen, H., et al. Coral larval settlement preferences linked to crustose coralline algae with distinct chemical and microbial signatures. Scientific Reports. 11 (1), 14610(2021).
- Roach, T. N., Dilworth, J., Jones, A. D., Quinn, R. A., Drury, C. Metabolomic signatures of coral bleaching history. Nature Ecology & Evolution. 5 (4), 495-503 (2021).
- Parkinson, J. E., et al. Molecular tools for coral reef restoration: Beyond biomarker discovery. Conservation Letters. 13 (1), 12687(2020).
- Jiang, J., et al. How Symbiodiniaceae meets the challenges of life during coral bleaching. Coral Reefs. 40, 1339-1353 (2021).
- Guerra, F. D., Attia, M. F., Whitehead, D. C., Alexis, F. Nanotechnology for environmental remediation: materials and applications. Molecules. 23 (7), 1760(2018).
- Matthews, J. L., et al. Metabolite pools of the reef building coral Montipora capitata are unaffected by Symbiodiniaceae community composition. Coral Reefs. 39, 1727-1737 (2020).
- Papina, M., Meziane, T., van Woesik, R. Symbiotic zooxanthellae provide the host-coral Montipora digitata with polyunsaturated fatty acids. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 135 (3), 533-537 (2003).
- Kellogg, R., Patton, J. Lipid droplets, medium of energy exchange in the symbiotic anemone Condylactis gigantea: A model coral polyp. Marine Biology. 75, 137-149 (1983).
- Ankrah, N. Y., Chouaia, B., Douglas, A. E. The cost of metabolic interactions in symbioses between insects and bacteria with reduced genomes. mBio. 9 (5), e01433(2018).
- Kabeya, N., et al. Genes for de novo biosynthesis of omega-3 polyunsaturated fatty acids are widespread in animals. Science Advances. 4 (5), (2018).
- Hillyer, K. E., Dias, D., Lutz, A., Roessner, U., Davy, S. K. 13C metabolomics reveals widespread change in carbon fate during coral bleaching. Metabolomics. 14 (1), 12(2018).
- Hillyer, K. E., Dias, D. A., Lutz, A., Roessner, U., Davy, S. K. Mapping carbon fate during bleaching in a model cnidarian symbiosis: the application of 13C metabolomics. New Phytologist. 214 (4), 1551-1562 (2017).
- Burriesci, M. S., Raab, T. K., Pringle, J. R. Evidence that glucose is the major transferred metabolite in dinoflagellate-cnidarian symbiosis. Journal of Experimental Biology. 215 (19), 3467-3477 (2012).
- Thurber, R. V., et al. Unified methods in collecting, preserving, and archiving coral bleaching and restoration specimens to increase sample utility and interdisciplinary collaboration. PeerJ. 10, 14176(2022).
- Grottoli, A. G., et al. Increasing comparability among coral bleaching experiments. Ecological Applications. 31 (4), 02262(2020).
- Mushtaq, M. Y., Choi, Y. H., Verpoorte, R., Wilson, E. G. Extraction for metabolomics: access to the metabolome. Phytochemical Analysis. 25 (4), 291-306 (2014).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1), 248-254 (1976).
- Peterson, G. L., et al. A simplification of the protein assay method of Lowry et al. which is more generally applicable. Analytical Biochemistry. 83 (2), 346-356 (1977).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Zamer, W. E., Shick, J. M., Tapley, D. W. Protein measurement and energetic considerations: Comparisons of biochemical and stoichiometric methods using bovine serum albumin and protein isolated from sea anemones. Limnology and Oceanography. 34 (1), 256-263 (1989).
- Smart, K. F., Aggio, R. B., Van Houtte, J. R., Villas-Boas, S. G. Analytical platform for metabolome analysis of microbial cells using methyl chloroformate derivatization followed by gas chromatography-mass spectrometry. Nature Protocols. 5 (10), 1709-1729 (2010).
- Pang, Z., et al. Using MetaboAnalyst 5.0 for LC-HRMS spectra processing, multi-omics integration and covariate adjustment of global metabolomics data. Nature Protocols. 17 (8), 1735-1761 (2022).
- Tibshirani, R., Walther, G., Hastie, T. Estimating the number of clusters in a data set via the gap statistic. Journal of the Royal Statistical Society: Series B (Statistical Methodology). 63 (2), 411-423 (2001).
- Chen, W. -N., et al. Diel rhythmicity of lipid-body formation in a coral-Symbiodinium endosymbiosis). Coral Reefs. 31 (2), 521-534 (2012).
- Imbs, A. Fatty acids and other lipids of corals: composition, distribution, and biosynthesis. Russian Journal of Marine Biology. 39 (3), 153-168 (2013).
- Rosset, S., et al. Lipidome analysis of Symbiodiniaceae reveals possible mechanisms of heat stress tolerance in reef coral symbionts. Coral Reefs. 38 (6), 1241-1253 (2019).
- Carreón-Palau, L., Parrish, C. C., Del Angel-Rodriguez, J. A., Perez-Espana, H. Seasonal shifts in fatty acids and sterols in sponges, corals, and bivalves, in a southern Gulf of Mexico coral reef under river influence. Coral Reefs. 40 (2), 571-593 (2021).
- Imbs, A. B., Dang, L. T. Seasonal dynamics of fatty acid biomarkers in the soft coral Sinularia flexibilis, a common species of Indo-Pacific coral reefs. Biochemical Systematics and Ecology. 96, 104246(2021).
- Oku, H., Yamashiro, H., Onaga, K., Sakai, K., Iwasaki, H. Seasonal changes in the content and composition of lipids in the coral Goniastrea aspera. Coral Reefs. 22 (1), 83-85 (2003).
- Weis, V. M. Cell biology of coral symbiosis: foundational study can inform solutions to the coral reef crisis. Integrative and Comparative Biology. 59 (4), 845-855 (2019).
- Oakley, C., Davy, S. Cell biology of coral bleaching. Coral Bleaching. van Oppen, M., Lough, J. , Springer. Cham, Switzerland. 189-211 (2018).
- Lu, W., et al. Metabolite measurement: Pitfalls to avoid and practices to follow. Annual Review of Biochemistry. 86, 277-304 (2017).
- Lawson, C. A., et al. Heat stress decreases the diversity, abundance and functional potential of coral gas emissions. Global Change Biology. 27 (4), 879-891 (2021).
- Olander, A., et al. Comparative volatilomics of coral endosymbionts from one-and comprehensive two-dimensional gas chromatography approaches. Marine Biology. 168 (5), 76(2021).
- Wuerz, M., et al. Symbiosis induces unique volatile profiles in the model cnidarian Aiptasia. Journal of Experimental Biology. 225 (19), (2022).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены