需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠后肢外植体研究跟腱撞击力学生物学的模型
摘要
我们提出了一个定制的实验平台和组织培养方案,该方案以持续的细胞活力再现了由小鼠后肢外植体中跟腱插入撞击驱动的纤维软骨变化,提供了一个适合探索肌腱撞击的机制生物学的模型。
摘要
肌腱撞击骨骼会产生多轴机械应变环境,横向压缩应变明显升高,从而引发局部纤维软骨表型,其特征是富含糖胺聚糖 (GAG) 的基质积累和胶原网络的重塑。虽然纤维软骨是健康肌腱撞击区域的正常特征,但过多的 GAG 沉积和胶原网络紊乱是肌腱病的标志性特征。因此,撞击在临床上被认为是肌腱病发生和发展的重要外在因素。然而,肌腱撞击背后的机制生物学研究仍未得到充分研究。先前阐明细胞对肌腱撞击反应的努力已经对细胞施加了单轴压缩,并在 体外切除了肌腱外植体。然而,分离的细胞缺乏对机械反应至关重要的三维细胞外环境,并且 体外 和切除的外植体研究都无法概括 体内肌腱撞击产生的多轴应变环境,这取决于撞击区域的解剖学特征。此外, 肌 腱撞击的体内模型缺乏对机械应变环境的控制。为了克服这些局限性,我们提出了一种适用于研究跟腱撞击机制生物学的新型小鼠后肢外植体模型。该模型将跟腱保持在 原位 以保持局部解剖结构,并再现了在被动应用踝关节背屈期间跟腱插入跟骨上产生的多轴应变环境,同时将细胞保留在其原生环境中。我们描述了该模型不可或缺的组织培养方案,并提供了在 7 天内建立持续外植体活力的数据。代表性结果表明,组织学 GAG 染色增强,继发于撞击的胶原纤维排列减少,表明纤维软骨形成增加。该模型可以很容易地适应研究不同的机械负荷方案,并允许操纵感兴趣的分子途径,以确定介导跟腱表型变化响应撞击的机制。
引言
许多肌腱,包括跟腱和肩袖肌腱,由于正常的解剖定位而经历骨撞击1,2,3,4.肌腱撞击产生横向指向纵向纤维轴的压缩应变5,6,7.肌腱撞击区域表现出独特的纤维软骨表型,其中收缩的圆形细胞(纤维软骨细胞)嵌入无组织的胶原网络中,糖胺聚糖 (GAG) 含量显着增加2,3,4,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24.先前的研究表明,肌腱撞击产生的不同机械环境通过驱动大型聚集蛋白聚糖(尤其是聚集聚糖)的沉积来维持这种富含GAG的基质,尽管其潜在机制尚不清楚1,3,12,13,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39.虽然纤维软骨是健康肌腱撞击区域的正常特征,但与纤维软骨形成过度相关的异常蛋白多糖代谢是肌腱病的标志特征,肌腱病是一种常见且使人衰弱的疾病,不成比例地出现在慢性撞击肌腱中1,40,41,42,43,44,45,46,47,48,49.因此,肌腱撞击在临床上被认为是驱动几种最常见的肌腱病的重要外在因素,包括肩袖疾病和插入性跟腱病 (IAT)50,51,52.目前,肌腱病的治疗效率低下。例如,大约 47% 的 IAT 患者在保守治疗失败后需要手术干预,术后结局各不相同53,54,55,56.尽管撞击和肌腱病之间存在明显的关系,但撞击肌腱细胞感知和响应其机械环境的机械生物学机制描述甚少,这模糊了对肌腱病发病机制的理解并导致治疗不充分。
外植体模型是肌腱机械生物学研究的有用工具57,58。作为了解肌腱撞击机制生物学的第一步,一些先前的研究已经探索了对细胞或切除的肌腱外植体应用简单单轴压缩后的细胞反应 27,29,30,31,32,33,34,39。然而,体外细胞缺乏细胞外和细胞周基质,这些基质可促进菌株转移,隔离机械变形释放的重要生长因子和细胞因子,并为在机械转导中发挥作用的粘着斑复合物提供底物57,59。此外,体外和切除的外植体研究都无法概括体内肌腱撞击产生的多轴机械应变环境,这取决于撞击区域的解剖学特征 5,6。在跟腱插入受撞击的情况下,这包括周围组织,例如跟骨后滑囊和 Kager 的脂肪垫 60,61,62,63。相反,肌腱撞击的体内模型 25,28,36,37,38,64,65,66 允许对直接施加到肌腱的载荷的大小和频率进行最小的控制,这是研究肌腱机械生物学的体内模型的一个公认的局限性 57,58,67,68,69,70.鉴于在体内测量肌腱应变的挑战,这些模型中产生的内部应变环境通常表征不佳。
在这篇手稿中,我们提出了一个定制的实验平台,该平台在整个小鼠后肢外植体中重建了跟骨上的跟腱插入的冲击,当与这种组织培养方案配对时,在外植体培养中保持活力超过 7 天,并允许研究肌腱撞击的生物学后遗症。该平台建立在 3D 打印的聚乳酸 (PLA) 基座上,为夹具和 3D 打印 PLA 减容插件的连接奠定了基础。握把用于将大腿和膝盖夹紧在跟腱肌腱交界处的近端,后肢的尾侧朝上,允许使用超声探头或倒置显微镜从上方对跟腱进行成像(图1A)。减容插入物沿着底座上的轨道滑动,并减少所需的组织培养基体积。缠绕在后爪上的编织线利用基础设计和 3D 打印的 PLA 夹从平台中布线。通过拉动绳子,后爪背屈,跟腱插入物撞击跟骨,导致横向压缩应变升高 5,6(图 1A)。该平台包含在丙烯酸浴中,该浴将后肢外植体浸没在组织培养基中。用胶带将绷紧的绳子固定在浴缸的外面,可以保持脚踝背屈,从而对跟腱插入产生静电冲击。3D 打印组件的 CAD 文件以多种格式提供(补充文件 1),允许导入到一系列商业和免费的开源 CAD 软件中进行修改以满足实验需求。如果无法使用 3D 打印机进行制造,则可以将 CAD 文件提供给在线 3D 打印服务,这些服务将以低成本打印和运输零件。
重要的是,肱三头肌-跟腱肌腱复合体横跨膝关节和踝关节 71,72,73。因此,跟腱的拉伸拉伤受膝关节屈曲的影响。膝关节伸展使跟腱处于紧张状态,而膝关节屈曲可降低张力。通过首先伸展膝盖,然后被动地背屈踝关节,撞击插入处的压缩应变可以叠加在拉伸应变上。相反,通过在膝关节屈曲的情况下被动地背屈踝关节,拉伸应变会减少,并且压缩应变仍然存在。目前的协议探讨了三种这样的条件。1) 对于静态撞击,足背弯曲相对于胫骨 < 110° 以撞击插入物,膝盖弯曲以减少张力。2) 对于基线张力组,踝关节伸展至背屈 145° 以上,膝关节伸展,在插入处产生主要拉伸应变。3)对于卸载组,在没有外部施加负荷的情况下,将外植体培养在培养皿中,膝盖和脚踝处于中立位置。上述角度是相对于坐标系进行照相测量的,其中足部和胫骨以 180° 的角度平行,以 90° 的角度垂直。
该方案的关键步骤包括 1) 解剖后肢外植体并小心切除皮肤和足底肌腱;2)地塞米松预处理48小时后的外植体培养;3)组织切片和组织学染色;4)彩色图像分析以评估纤维软骨的形成。解剖后,将每个后肢外植体在补充有地塞米松74的培养基中预处理48小时。将每只小鼠的对侧肢体分配到单独的实验组进行成对比较,这有助于控制生物学变异性。预处理后,将外植体如上所述放置在平台中并再培养7天(图1B)。与预处理组(第 0 天)进行额外的比较,其中在预处理 48 小时后立即去除外植体。
外植体培养后,修剪后肢,将福尔马林固定,脱钙并包埋在石蜡中。矢状面方向的连续切片提供了从肌腱交界处到跟骨插入处的跟腱的可视化,同时允许通过整个肌腱跟踪切片深度。末端脱氧核苷酸转移酶 (TdT) 介导的 dUTP X-nick 标记 (TUNEL) 用于可视化继发于细胞凋亡的 DNA 损伤并评估活力。进行甲苯胺蓝组织学和定制彩色图像分析以量化 GAG 染色的变化。然后将甲苯胺蓝染色的组织切片用于SHG成像,以表征胶原纤维组织的改变(图1B)。
提供的代表性结果表明,富含GAG的基质的组织学染色改变,模型内7天的静态撞击产生的细胞外胶原网络紊乱。该模型可用于探索撞击驱动的纤维软骨变化的分子机制。
研究方案
所有动物工作均由罗切斯特大学动物资源委员会批准。
1.组织培养基的制备
- 在37°C和5%CO2的培养箱中,在Dulbecco改良的Eagle培养基(1x DMEM)中培养所有外植体,其中含有1%v / v青霉素 - 链霉素和200μM L-抗坏血酸。对于最初的 48 小时预处理,在补充有 100 nM 地塞米松74 的 70 mL 培养基中培养每个外植体。预处理后,在没有地塞米松的情况下再培养肢体7天,每48-72小时更换一次培养基。
注:不建议将血清(如胎牛血清)添加到培养基中,这与 Wunderli、Blache 和 Snedeker 提供的建议一致57。简而言之,无血清条件更能代表 体内存在的无血管、营养不良的肌腱微环境。此外,在某些培养条件下,血清补充剂可以促进组织降解75 ,并刺激细胞增殖和从组织中迁移,这两者都是肌腱病理学的特征57。 - 对于未上样的组,在 70 mL 培养基中培养每个外植体。对于基线张力组和静态撞击组,每个平台需要大约 125 mL 的培养基来保持肢体浸没。该体积可能因大腿在握把中的位置和 3D 打印参数(主要是填充密度)而异。
2.外植体解剖和地塞米松预处理
- 通过吸入 CO2 和继发性颈椎脱位或根据机构指南对小鼠实施安乐死。该方案利用小于1岁的C57BL / 6小鼠。后肢的大小会随着年龄的增长而增加,并且可能变得难以适应握把。
- 在解剖之前,将70mL预热(37°C)培养基转移到无菌生物安全柜(BSC)中的100mm(直径)x 25mm(高度)培养皿中。加入地塞米松以达到 100 nM 工作浓度。
- 解剖可以使用吸收性底垫在工作台上进行,在将后肢外植体转移到 BSC 之前迅速完成解剖。组装解剖所需的手术工具,包括光滑、笔直、细尖镊子;笔直、细尖的镊子,带有锯齿状;和直的、锋利的、细的剪刀。
- 对于后肢外植体的解剖,将小鼠置于仰卧位并识别髋关节。使用细剪刀,在大腿近端和前部(颅面)的皮肤上做一个小切口(5-10 毫米)。
- 将切口拉开以扩大,用手指捏住裸露的大腿,然后小心地将皮肤向远端拉动,使后肢脱屑至脚踝水平。沿着脚背轻轻地将一把剪刀刀片插入皮肤下,并切开一个延伸到脚趾的切口。继续向远端拉扯皮肤以完全去除。
- 放置鼠标以可视化跟腱插入跟骨的后(尾)侧,靠近脚踝。足底肌腱位于跟腱插入的近端,紧邻跟腱的内侧缘,向足底远端延伸,越过跟骨后侧。
- 要去除足底肌腱,请小心地将光滑、细尖钳的尖端插入两个肌腱之间,并将尖端向内侧延伸,穿过足底肌腱下方。将尖端向近端拉出并撕裂足底肌肉。使用细尖锯齿状镊子,抓住足底肌腱分离的近端并向远端拉动以将其移除。
- 在髋关节处,用细剪刀切开骨盆,隔离后肢。用剪刀撬开剩余的骨盆,露出股骨头。
- 将后肢外植体转移到 BSC 中,并转移到含有地塞米松的细胞培养基的培养皿中。将培养皿移入培养箱并预处理48小时。
3. 外植体培养和装载平台
- 随着48小时预处理的结束,预热足够体积的培养基(第1节)。从现在开始,地塞米松不会添加到培养基中。此时,可以将预处理组(第 0 天)的肢体固定、脱钙并包埋在石蜡中,以便将来进行切片、染色和分析。
- 对于未加载的组,吸出预处理培养基并将外植体转移到新鲜的培养皿中,每个加入 70 mL 培养基,然后返回培养箱。
- 对于基线张力组和静态冲击组,准备外植体平台。切割大小与握把压板相似的砂纸片。对于静电冲击组,将编织线剪成约 18 英寸长的碎片,并沿线长度的一半预打一个松散的反手结。撕下铝箔片以覆盖每个丙烯酸浴,并喷洒 70% 乙醇 (EtOH)。将准备工作转移到平衡计分卡。
- 每个平台都包括一个亚克力浴缸、底座、减容插件、夹子和把手。每个夹具包括两个压板和三种不同类型的螺钉,包括一个 M5 x 0.8 mm 螺纹 x 10 mm 长的螺钉,用于将夹具连接到底座;两个 M6 x 1 mm 螺纹 x 20 mm 长的螺钉,可延伸压板以夹紧夹具;以及四个 M3 x 0.5 mm 螺纹 x 14 mm 长的螺钉,这些螺钉与四个压缩弹簧相结合,可缩回压板以打开夹具。
- 将所有组分放入能够在发生泄漏时捕获所有培养基的二级容器中。浸入≥10%漂白剂溶液中并浸泡至少1小时。用自来水冲洗漂白剂溶液(根据需要使用高压灭菌器)并进入 BSC。
注意: 为了排除污染,请考虑对所有自来水进行高压灭菌或使用纯净水。有关解决污染问题的其他提示,请参阅 讨论 。 - 使用 M3 螺钉和压缩弹簧将压板连接到夹具上,使用 M5 螺钉将夹具固定到底座上,然后插入 M6 螺钉,直到它们与压板啮合。使用双面胶带将砂纸粘在压板上,然后关闭把手以促进砂纸与压板的粘合。对所有平台重复上述步骤。
- 当准备加载平台时,完全打开把手并使用镊子,将大腿和膝盖放在压板之间,跟腱的表面朝上(图1A)。松散地关闭把手以轻轻固定到位。
- 使用镊子抓住暴露的股骨头或股骨头,并操纵膝关节屈曲角度,同时逐渐合上把手以固定到位。对于基线张力组,如前所述伸展膝关节。当握把随着膝盖伸展而收紧时,脚踝应该自然伸展。对于静态撞击组,如前所述,在握把之间弯曲膝关节。
- 对于静态撞击组,将绳子的反手结放在远端爪子周围并收紧。将绳子穿过位于外植体下方的底座上的槽并穿过夹孔。将底座放入亚克力浴中,并将夹子固定在浴槽的顶部边缘(图1A)。
- 拉动绳子,使脚相对于胫骨至少 110°,并在绳子离开夹子时使用永久性记号笔标记绳子。在这个位置拍摄外植体的照片,以量化背屈角(图1A)。
- 取下底座并沿底座上的轨道滑动以连接减容插件。将底座(现在连接到减容插件)放回亚克力浴中,并将夹子重新定位在顶部边缘。以标记的绳子为引导,拉动绳子以返回原来的背屈角度,并用胶带将绳子固定在浴缸的外面,以保持静态的背屈。
- 对于基线张力组,只需将外植体定位在握把之间后,将带有体积减小插件的底座放入亚克力浴中,并拍照以量化背屈角。
- 向每个平台中加入 125 mL 预热 (37 °C) 培养基以浸没外植体。用铝箔盖住浴槽的顶部,放入辅助容器中,然后进入培养箱。培养7天,每48-72小时更换培养基。
注意: 在浴缸顶部放置胶带可以防止 PLA 部件漂浮。
4.固定、脱钙和石蜡包埋
- 外植体培养后,用剪刀修剪脚趾甲/远端脚趾,并切掉跟腱肌腱交界处近端的大腿。将每个修剪过的踝关节放入衬有泡沫活检垫的加工盒中。将脚踝推入盒角,使脚踝处于大约 90° 的背屈位置,然后关闭盒以保持到位。
- 在 10% 中性缓冲福尔马林 (NBF) 中固定 3 天,并在溶解在蒸馏水 (diH2O) 中的 14% 乙二苯四乙酸 (EDTA) 中脱钙 2 周,pH 值用冰醋酸调节至 7.4-7.6。
- 为了去除盐分,在 1x 磷酸盐缓冲盐水 (PBS) 中彻底冲洗样品 3 次,然后用 diH2O 彻底冲洗,每次 5 分钟。对石蜡组织学进行常规样品处理:通过一系列分级的 EtOH 脱水,在二甲苯中清除,然后用石蜡浸润。将样品定向并嵌入石蜡中,以通过跟腱获得矢状组织切片,如下文第5节所述(图1B)。
5. 组织切片
- 使用切片机,小心地修剪到样品中,直到切片平行于块面。从关节的内侧粗略地修剪到脚踝,在到达跟腱插入的内侧边界之前停止。
- 将样品转移到冰块中以调节温度和水合作用,并更换刀片(或转移到当前刀片的新鲜部分)。继续以 10 μm 厚度切片样品,并用明场显微镜仔细识别跟腱插入的入口。一旦确定,通过整个跟腱插入进行连续切片跟踪切片编号(即组织深度)。
6. 脱蜡/补水和玻片选择
- 对于下面的每个测定,从每对对侧肢体中选择水平匹配的组织切片。染色前,放在载玻片架上,经过 3 次二甲苯更换、2 次更换 100% EtOH、2 次更换 95% EtOH 和 1 次更换 70% EtOH,每次 5 分钟。在 diH2O 中完成补水。
7. TUNEL 评估跟腱活力
- 对于TUNEL标签,请根据制造商的方案进行染色。在室温下在20μg/ mL蛋白酶K中孵育20分钟,并在diH2O中冲洗。 在diH2O.中冲洗,用含有DAPI和盖玻片的抗淬灭试剂安装。
- 使用带有 4 倍物镜的荧光显微镜对跟腱插入进行成像。包括一个DAPI通道(激发/发射波长= 360/460 nm)以可视化所有细胞核,一个TUNEL(TMR红色)通道(激发/发射波长= 540/580 nm)以可视化凋亡细胞核,如果可能的话,还包括一个明场通道。
- 对于图像分析,将图像导入适用于基于 ROI 的处理的图像分析软件,例如 FIJI/ImageJ 或 MATLAB。定义一个感兴趣的区域(ROI),勾勒出整个跟腱(图2A),排除表腱中的细胞,这些细胞在被放入培养物中时极易因夹层和环境条件的突然变化而死亡。
- 为此,请在 MATLAB 中通过导入明场图像并使用 drawpolygon() 函数跟踪和包围肌腱的边界来执行 ROI 选择。MATLAB 为 ROI 创建一个 Polygon 对象,然后可以将其应用于 DAPI 和 TUNEL 通道图像,以使用 createMask() 屏蔽 ROI 之外的像素强度数据,以便仅分析跟腱内的细胞核。
- 导入 DAPI 和 TUNEL 通道图像,并通过归一化到非活组织(如骨骼、肌肉或脂肪)中凋亡核的最大荧光强度来确定用于定义凋亡 (TUNEL+) 细胞核的荧光强度阈值,这些组织在组织切片中偶然捕获。图像被遮蔽后,计算跟腱内凋亡核(TUNEL+核/DAPI核)的比例。
8. 甲苯胺蓝组织学表征纤维软骨形成
- 一旦再水化(第 6 节),将具有水平匹配组织切片的载玻片架从对侧外植体对转移到 0.4% w/v 甲苯胺蓝 O 的 0.1 M 醋酸钠缓冲液中,使用 glacial 乙酸调节 pH 至 4.0。在室温下孵育10分钟,然后在diH2O中冲洗3次,每次30秒。
- 通过三次更换 95% EtOH 和两次更换 100% EtOH 脱水,每次 30 秒。通过三次更换二甲苯清除,每次 1 分钟。盖玻片与二甲苯基封固剂。
- 获取跟腱插入的 24 位红蓝绿 (RGB) 彩色图像。例如,对于此协议,使用适配器将数码彩色相机连接到具有 4 倍物镜的简单明场显微镜的目镜。
- 为了量化跟腱插入处受压肌腱纤维软骨(CTF)16内甲苯胺蓝染色的差异(图3A,B),将RGB图像导入能够定义和管理多个ROI的图像分析软件中。选项包括 FIJI/ImageJ 中的选择和 ROI 管理器工具或 MATLAB 中的图像处理工具箱。首先设置像素/长度比例。
注意:软件选择由研究人员自行决定,当然不限于 MATLAB 或 FIJI/ImageJ。作者提供了 MATLAB 代码(补充文件 2)、描述实现的文档(补充文件 3)和示例图像(补充文件 4)。我们鼓励研究人员根据需要或首选将此代码翻译成其他编程语言,以便在其他软件中使用。 - 通过所选软件中显示的图像,确定深肌腱边界与跟骨的交点。从这里开始,沿着深肌腱边界近端追踪 800 μm,以建立 CTF 的深边界。例如,使用 MATLAB 中的 drawpolyline() 函数以交互方式在 RGB 图像上绘制多段线。MATLAB 创建一个包含线顶点的折线对象,该对象可以处理并修剪为 800 μm 的长度。
- 从该位置,通过绘制一条连接到垂直于局部纤维方向的浅表肌腱边界的线段来创建 CTF 的近端边界。
- 回到深肌腱边界和跟骨的交点,并通过沿着将 CTF 与附着区纤维软骨 (AZF) 分开的明显潮标绘制一条连接到浅表肌腱边界的线段来定义 CTF 的远端边界16(图 3A,B)。最后,通过追踪要封闭的浅表肌腱边界来生成 CTF 的浅表边界。
- 为了描述插入处GAG染色的空间变化,将总CTF分为4个象限(图3A,B)。将深部和浅表 CTF 边界的中点与线段连接起来,以创建远端/近端边界。穿过该边界的中点,沿纤维方向连接远端和近端 CTF 边界的中点,以创建浅层/深层边界。
- 这 6 个边界提供了可用于定义代表整个 CTF 的 ROI 的信息,以及细分 CTF 的 4 个象限。例如,在 MATLAB 中,将定义每个单独 ROI(CTF,象限 1-4)边界的顶点编译为向量,并使用 images.roi.Polygon() 为每个 ROI 生成封闭的 Polygon 对象。
- 定义 ROI 后,使用 FIJI 中的颜色转换器插件、MATLAB 中的 rgb2hsv() 函数或其他应用适当变换方程的软件将 RGB 像素数据转换为色相饱和值 (HSV) 颜色空间76。然后,HSV数据可以投射到2D色相饱和空间中,其中色相和饱和度的每个组合都编码了一种独特的颜色(图3C)。
- 在每个 ROI 中,计算描述 ROI 中平均染色颜色的平均色调和饱和度。例如,这可以在 MATLAB 中实现,通过使用定义每个 ROI 的 Polygon 对象来使用 createMask() 遮罩图像,以便专门分析每个 ROI 中的色调饱和度像素数据。
- 在骨膜纤维软骨(PF)16内定义另一个小的ROI(图3A,B)并计算平均色调和饱和度。然后,计算将 CTF 的每个 ROI 中的平均颜色与 PF 的平均颜色分开的欧几里得距离(图 3C)。
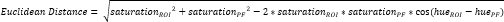
注意:欧几里得距离计算描述了 ROI 的平均颜色与 PF(一种典型的纤维软骨组织 16,17,77)的平均颜色之间的相似程度。较小的欧几里得距离表示外观上更像纤维软骨的 ROI 颜色。 - 使用此距离计算纤维软骨分数,如果 ROI 颜色与 PF 颜色相同,则假设最大值为 1,如果 ROI 和 PF 颜色在色调饱和度颜色空间内达到最大分离度,则最小值为 -1。
- 每个肢体组织切片中每个 ROI 内的色调、饱和度和纤维软骨评分的平均数据。对侧肢体组之间进行配对统计比较。
9. SHG成像研究胶原网络组织的变化
- 使用带有 20 倍物镜的功能强大的显微镜系统对甲苯胺蓝染色切片进行 SHG 成像。通过截面厚度获取 z 堆栈,并根据需要执行瓷砖扫描以完全捕获跟腱插入。
- 将SHG图像导入首选图像分析软件,并定义ROI,包括和细分跟腱插入处的CTF,如第8节中甲苯胺蓝图像分析所述(图4A,B)。
- 如果将SHG图像导入MATLAB,请使用在MATLAB中定义CTF ROI的方法,如第8节所述。定义 ROI 后,通过将 MATLAB 中的 ROI 顶点导出为 .txt 文件并使用 文件>导入 XY 坐标导入 FIJI,将 ROI 坐标传输到 FIJI>。覆盖选择并发送给 ROI 管理器进行分析。
- 要量化胶原蛋白的组织,请使用 FIJI 中的 Directionality 插件,该插件执行傅里叶谱分析以计算跨越 ROI 的小窗口中纤维取向的分布。这种分布的扩散称为色散,与光纤排列成反比。
注意:由于肌腱的粗大弯曲而不是缺乏对齐/组织,胶原纤维可能会在 CTF 的不同窗口中呈现出可变的方向。为了更好地区分胶原组织的变化与插入时肌腱的总弯曲,有必要定义较小的 ROI。 - 将 SHG 图像导入 FIJI 并设置像素/长度比例。将最大像素强度数据投影到 2D 合成图像中,并将 ROI 添加到 ROI 管理器中。按顺序将每个 CTF ROI 叠加到图像上,并在 ROI 中绘制 10 个大小一致的小子 ROI,将子 ROI 添加到 ROI 管理器中。
- 在每个子 ROI 中,运行 FIJI 中的方向性插件以计算光纤色散。每个 CTF ROI 内子 ROI 的平均离散数据,以及每个外植体各部分的每个 CTF ROI 中的平均离散数据。对侧肢体组之间进行配对统计比较。
结果
TUNEL染色组织切片的代表性图像显示,在实验组的外植体培养7天后,跟腱体内的凋亡核最小(图2A)。这些图像的定量提供了证据,证明在外植体培养 7 天后,组织培养方案在不同负载条件下的外植体培养 7 天后,在跟腱内平均保持高达 78% 的活力(图 2B)。
定性地,与未加载的对照组相比,在静电冲击 7 天后,增强的甲苯胺蓝染?...
讨论
实验性小鼠后肢外植体平台与本研究中描述的组织培养方案相结合,为研究跟腱插入处撞击驱动的纤维软骨形成的机制生物学提供了合适的模型。代表性结果证明了该外植体模型的实用性,该结果表明,在静态撞击 7 天后,甲苯胺蓝染色的显着和空间异质性变化同时维持了细胞活力。这些发现表明继发于机械撞击的富含GAG的基质分子的代谢改变,与其他模型和临床研究一致
披露声明
作者没有什么可透露的。
致谢
作者感谢罗切斯特大学肌肉骨骼研究中心组织学、生物化学和分子成像 (HBMI) 核心的 Jeff Fox 和 Vidya Venkatramani 提供的支持和帮助,部分资金来自 P30AR06965。此外,作者要感谢罗切斯特大学医学中心的光学显微镜和纳米镜中心(CALMN)在多光子显微镜方面的帮助。这项研究由 R01 AR070765 和 R01 AR070765-04S1 以及 1R35GM147054 和 1R01AR082349 资助。
材料
| Name | Company | Catalog Number | Comments |
| Absorbent underpads | VWR | 82020-845 | For benchtop dissection |
| Acrylic bath | Source One | X001G46CB1 | Contains the explant platform submerged in culture media |
| Autoclave bin | Thermo Scientific | 13-361-20 | Used as secondary containment, holds two platforms |
| Base | - | - | 3D printed from CAD files provided as Supplementary Files |
| Braided line | KastKing | 30lb test | Used to wrap around paw and apply ankle dorsiflexion |
| Clip | - | - | 3D printed from CAD files provided as Supplementary Files |
| Cover glass | Fisherbrand | 12-541-034 | Rectangular, No. 2, 50 mm x 24 mm |
| Cytoseal XYL | VWR | 8312-4 | Xylene-based mounting media for coverslipping Toluidine blue stained tissue sections |
| Dexamethasone | MP Biomedical LLC | 194561 | CAS#50-02-2 |
| Dimethyl sulfoxide (DMSO), anhydrous | Invitrogen by ThermoFisher | D12345 | CAS#67-68-5, use to solubilize dexamethasone into concentrated stock solutions |
| Double-sided tape | Scotch Brand | 34-8724-5195-9 | To attach sandpaper to Grip platens |
| Dulbecco's Modified Eagle Medium (1X DMEM) | Gibco by ThermoFisher | 11965092 | high glucose, (-) pyruvate, (+) glutamine |
| EDTA tetrasodium salt dihydrate | Thermo Scientific Chemicals | J15700.A1 | CAS#10378-23-1, used to make 14% EDTA solution for sample decalcifcation |
| Ethanol, 200 proof | Thermo Scientific | T038181000 | CAS#64-17-5, 1 L supply |
| Foam biopsy pads | Leica | 3801000 | Used with processing cassettes, help hold ankle joints in desired position during fixation and decalcification |
| Forceps, #SS Standard Inox | Dumont | 11203-23 | Straight, smooth, fine tips |
| Forceps, Micro-Adson 4.75" | Fisherbrand | 13-820-073 | Straight, fine tips with serrated teeth |
| Garnet Sandpaper, 50-D Grit | Norton | M600060 01518 | Or other coarse grit sandpaper |
| Glacial acetic acid | Fisher Chemical | A38S-500 | CAS#64-19-7, for adjusting pH of sodium acetate buffer used for Toluidine blue histology, as well as 14% EDTA decalcification solution |
| Grips | ADMET | GV-100NT-A4 | Stainless steel vice grips, screws and springs described in the protocol are included |
| Histobond Adhesive Microscope Slides | VWR | 16005-108 | Sagittal sections of hind limbs explants reliably adhere to these slides through all staining protocols |
| In situ Cell Death Detection Kit, TMR Red | Roche | 12156792910 | TUNEL assay |
| Labeling tape | Fisherbrand | 15-959 | Or any other labeling tape of preference |
| L-ascorbic acid | Sigma-Aldrich | A4544-100G | CAS#50-81-7, for culture media formulation |
| Neutral buffered formalin, 10% | Leica | 3800600 | For sample fixation, 5 gallon supply |
| Nunc petri dishes | Sigma-Aldrich | P7741-1CS | 100 mm diameter x 25 mm height, maintain explants submerged in 70 mL of culture media as described in protocol |
| Penicillin-streptomycin (100X) | Gibco by ThermoFisher | 15140122 | Add 5 mL to 500 mL 1X DMEM for 1% v/v (1X) working concentration |
| Polylactic acid (PLA) 1.75 mm filament | Hatchbox | - | Choose filament diameter compatible with your 3D printer extruder, in color of choice. |
| Processing cassettes | Leica | 3802631 | For fixation, decalcification and paraffin embedding |
| Prolong Gold Antifade Reagent with DAPI | Invitrogen by ThermoFisher | P36931 | Mounting media for coverslipping tissue sections after TUNEL |
| Proteinase K | Fisher BioReagents | BP1700-50 | CAS#39450-01-6, used for antigen retrieval in TUNEL protocol |
| Scissors, Fine | FST | 14094-11 | Straight, sharp |
| Slide Staining Set, 12-place | Mercedes Scientific | MER 1011 | Rack with 12 stain dishes and slide dippers for Toluidine blue histology |
| Sodium acetate, anhydrous | Thermo Scientific Chemicals | A1318430 | CAS#127-09-3, used to make buffer for Toluidine blue histology |
| Tissue-Tek Accu-Edge Low Profile Microtome Blades | VWR | 25608-964 | For paraffin sectioning |
| Toluidine Blue O | Thermo Scientific Chemicals | 348601000 | CAS#92-31-9 |
| Volume Reduction Insert | - | - | 3D printed from CAD files provided as Supplementary Files |
| Xylenes | Leica | 3803665 | 4 gallon supply for histological staining |
参考文献
- Cook, J. L., Purdam, C. Is compressive load a factor in the development of tendinopathy. Br J Sports Med. 46 (3), 163-168 (2012).
- Benjamin, M., Qin, S., Ralphs, J. R. Fibrocartilage associated with human tendons and their pulleys. J Anat. 187 (Pt 3), 625-633 (1995).
- Benjamin, M., Ralphs, J. R. Fibrocartilage in tendons and ligaments - an adaptation to compressive load. J Anat. 193 (4), 481-494 (1998).
- Benjamin, M., Theobald, P., Suzuki, D., Toumi, H. The anatomy of the Achilles tendon. The Achilles Tendon. 3, 5-16 (2007).
- Chimenti, R. L., et al. Insertional achilles tendinopathy associated with altered transverse compressive and axial tensile strain during ankle dorsiflexion. J Orthop Res. 35 (4), 910-915 (2017).
- Mora, K. E., et al. Ultrasound strain mapping of the mouse Achilles tendon during passive dorsiflexion. J Biomech. 132, 110920 (2022).
- Pringels, L., et al. Intratendinous pressure changes in the Achilles tendon during stretching and eccentric loading: Implications for Achilles tendinopathy. Scand J Med Sci Sports. 33 (5), 619-630 (2023).
- Koob, T. J., Vogel, K. G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. J Orthop Res. 5 (3), 414-424 (1987).
- Vogel, K. G., Koob, T. J. Structural specialization in tendons under compression. Int Rev Cytol. 115, 267-293 (1989).
- Vogel, K. G., Ordög, A., Pogány, G., Oláh, J. Proteoglycans in the compressed region of human tibialis posterior tendon and in ligaments. J Orthop Res. 11 (1), 68-77 (1993).
- Vogel, K. G., Sandy, J. D., Pogány, G., Robbins, J. R. Aggrecan in bovine tendon. Matrix Biol. 14 (2), 171-179 (1994).
- Robbins, J. R., Vogel, K. G. Regional expression of mRNA for proteoglycans and collagen in tendon. Eur J Cell Biol. 64 (2), 264-270 (1994).
- Vogel, K., Gordon, S. I., Blair, S. J., Fine, L. J. . Repetitive motion disorders of the upper extremity. , (1995).
- Benjamin, M., Tyers, R. N., Ralphs, J. R. Age-related changes in tendon fibrocartilage. J Anat. 179, 127-136 (1991).
- Ralphs, J. R., Benjamin, M., Thornett, A. Cell and matrix biology of the suprapatella in the rat: a structural and immunocytochemical study of fibrocartilage in a tendon subject to compression. Anat Rec. 231 (2), 167-177 (1991).
- Rufai, A., Benjamin, M., Ralphs, J. R. Development and ageing of phenotypically distinct fibrocartilages associated with the rat Achilles tendon. Anat Embryol (Berl). 186 (6), 611-618 (1992).
- Rufai, A., Ralphs, J. R., Benjamin, M. Ultrastructure of fibrocartilages at the insertion of the rat Achilles tendon. J Anat. 189 (Pt 1), 185-191 (1996).
- Waggett, A. D., Ralphs, J. R., Kwan, A. P. L., Woodnutt, D., Benjamin, M. Characterization of collagens and proteoglycans at the insertion of the human achilles tendon. Matrix Biol. 16 (8), 457-470 (1998).
- Ralphs, J., et al. Regional differences in cell shape and gap junction expression in rat Achilles tendon: relation to fibrocartilage differentiation. J Anat. 193 (pt 2), 215-222 (1998).
- Milz, S., et al. Three-dimensional reconstructions of the Achilles tendon insertion in man. J Anat. 200 (Pt 2), 145-152 (2002).
- Tischer, T., Milz, S., Maier, M., Schieker, M., Benjamin, M. An immunohistochemical study of the rabbit suprapatella, a sesamoid fibrocartilage in the quadriceps tendon containing aggrecan. J Histochem Cytochem. 50 (7), 955-960 (2002).
- Esquisatto, M. A., Joazeiro, P. P., Pimentel, E. R., Gomes, L. The effect of age on the structure and composition of rat tendon fibrocartilage. Cell Biol Int. 31 (6), 570-577 (2007).
- Matuszewski, P. E., et al. Regional variation in human supraspinatus tendon proteoglycans: Decorin, biglycan, and aggrecan. Connect Tissue Res. 53 (5), 343-348 (2012).
- Buckley, M. R., Huffman, G. R., Iozzo, R. V., Birk, D. E., Soslowsky, L. J. The location-specific role of proteoglycans in the flexor carpi ulnaris tendon. Connect Tissue Res. 54 (6), 367-373 (2013).
- Gillard, G. C., Reilly, H. C., Bell-Booth, P. G., Flint, M. H. The influence of mechanical forces on the glycosaminoglycan content of the rabbit flexor digitorum profundus tendon. Connect Tissue Res. 7 (1), 37-46 (1979).
- Giori, N. J., Beaupre, G. S., Carter, D. R. Cellular shape and pressure may mediate mechanical control of tissue composition in tendons. J Orthop Res. 11 (4), 581-591 (1993).
- Wren, T. A., Beaupré, G. S., Carter, D. R. Mechanobiology of tendon adaptation to compressive loading through fibrocartilaginous metaplasia. J Rehabil Res Dev. 37 (2), 135-143 (2000).
- Malaviya, P., et al. An in vivo model for load-modulated remodeling in the rabbit flexor tendon. J Orthop Res. 18 (1), 116-125 (2000).
- Shim, J. W., Elder, S. H. Influence of Cyclic Hydrostatic Pressure on Fibrocartilaginous Metaplasia of Achilles Tendon Fibroblasts. Biomech Model Mechanobiol. 5 (4), 247-252 (2006).
- Koob, T. J., Clark, P. E., Hernandez, D. J., Thurmond, F. A., Vogel, K. G. Compression loading in vitro regulates proteoglycan synthesis by tendon fibrocartilage. Arch Biochem Biophys. 298 (1), 303-312 (1992).
- Evanko, S. P., Vogel, K. G. Proteoglycan Synthesis in Fetal Tendon Is Differentially Regulated by Cyclic Compression in Vitro. Arch Biochem Biophys. 307 (1), 153-164 (1993).
- Vogel, K. G. The effect of compressive loading on proteoglycan turnover in cultured fetal tendon. Connect Tissue Res. 34 (3), 227-237 (1996).
- Thornton, G. M., et al. Changes in mechanical loading lead to tendon specific alterations in MMP and TIMP expression: influence of stress deprivation and intermittent cyclic hydrostatic compression on rat supraspinatus and Achilles tendons. Br J Sports Med. 44 (10), 698-703 (2010).
- Robbins, J. R., Evanko, S. P., Vogel, K. G. Mechanical Loading and TGF-β Regulate Proteoglycan Synthesis in Tendon. Arch Biochem Biophys. 342 (2), 203-211 (1997).
- Docking, S., Samiric, T., Scase, E., Purdam, C., Cook, J. Relationship between compressive loading and ECM changes in tendons. Muscles Ligaments Tendons J. 3 (1), 7-11 (2013).
- Wang, X., et al. Aberrant TGF-β activation in bone tendon insertion induces enthesopathy-like disease. J Clin Invest. 128 (2), 846-860 (2018).
- Cong, G. T., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: Development and analysis of a novel murine model. J Orthop Res. 36 (10), 2780-2788 (2018).
- Liu, Y., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: development and analysis of a novel rat model. J Shoulder Elbow Surg. 31 (9), 1898-1908 (2022).
- Majima, T., et al. Compressive compared with tensile loading of medial collateral ligament scar in vitro uniquely influences mRNA levels for aggrecan, collagen type II, and collagenase. J Orthop Res. 18 (4), 524-531 (2000).
- Hopkins, C., et al. Critical review on the socio-economic impact of tendinopathy. Asia Pac J Sports Med, Arthrosc, Rehabil Technol. 4, 9-20 (2016).
- Scott, A., Ashe, M. C. Common tendinopathies in the upper and lower extremities. Curr Sports Med Rep. 5 (5), 233-241 (2006).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin Sports Med. 22 (4), 675-692 (2003).
- Bah, I., et al. Tensile mechanical changes in the Achilles tendon due to Insertional Achilles tendinopathy. J Mech Behav Biomed Mater. 112, 104031 (2020).
- Maffulli, N., Reaper, J., Ewen, S. W. B., Waterston, S. W., Barrass, V. Chondral Metaplasia in Calcific Insertional Tendinopathy of the Achilles Tendon. Clin J Sport Med. 16 (4), 329-334 (2006).
- Corps, A. N., et al. Increased expression of aggrecan and biglycan mRNA in Achilles tendinopathy. Rheumatology (Oxford). 45 (3), 291-294 (2006).
- Scott, A., et al. Increased versican content is associated with tendinosis pathology in the patellar tendon of athletes with jumper's knee. Scand J Med Sci Sports. 18 (4), 427-435 (2008).
- Attia, M., et al. Greater glycosaminoglycan content in human patellar tendon biopsies is associated with more pain and a lower VISA score. Br J Sports Med. 48 (6), 469-475 (2014).
- Kujala, U. M., Sarna, S., Kaprio, J. Cumulative Incidence of Achilles Tendon Rupture and Tendinopathy in Male Former Elite Athletes. Clin J Sport Med. 15 (3), 133-135 (2005).
- Corps, A. N., et al. Changes in matrix protein biochemistry and the expression of mRNA encoding matrix proteins and metalloproteinases in posterior tibialis tendinopathy. Ann Rheum Dis. 71 (5), 746-752 (2012).
- Neer, C. S. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 54 (1), 41-50 (1972).
- Bigliani, L. U., Ticker, J. B., Flatow, E. L., Soslowsky, L. J., Mow, V. C. The relationship of acromial architecture to rotator cuff disease. Clin Sports Med. 10 (4), 823-838 (1991).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current Concepts Review Update Insertional Achilles Tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Nicholson, C. W., Berlet, G. C., Lee, T. H. Prediction of the Success of Nonoperative Treatment of Insertional Achilles Tendinosis Based on MRI. Foot Ankle Int. 28 (4), 472-477 (2007).
- Lohrer, H., David, S., Nauck, T. Surgical treatment for achilles tendinopathy - a systematic review. BMC musculoskelet disord. 17 (1), 207 (2016).
- McGarvey, W. C., Palumbo, R. C., Baxter, D. E., Leibman, B. D. Insertional Achilles Tendinosis: Surgical Treatment Through a Central Tendon Splitting Approach. Foot Ankle Int. 23 (1), 19-25 (2002).
- Maffulli, N., et al. Surgery for chronic Achilles tendinopathy produces worse results in women. Disabil Rehabil. 30 (20-22), 1714-1720 (1714).
- Wunderli, S. L., Blache, U., Snedeker, J. G. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connect Tissue Res. 61 (3-4), 262-277 (2020).
- Dyment, N. A., et al. A brief history of tendon and ligament bioreactors: Impact and future prospects. J Orthop Res. 38 (11), 2318-2330 (2020).
- Screen, H. R. C., Berk, D. E., Kadler, K. E., Ramirez, F., Young, M. F. Tendon Functional Extracellular Matrix. J Orthop Res. 33 (6), 793-799 (2015).
- Theobald, P., et al. The functional anatomy of Kager's fat pad in relation to retrocalcaneal problems and other hindfoot disorders. J Anat. 208 (1), 91-97 (2006).
- Ghazzawi, A., Theobald, P., Pugh, N., Byrne, C., Nokes, L. Quantifying the motion of Kager's fat pad. J Orthop Res. 27 (11), 1457-1460 (2009).
- Malagelada, F., et al. Pressure changes in the Kager fat pad at the extremes of ankle motion suggest a potential role in Achilles tendinopathy. Knee Surg Sports Traumatol Arthrosc. 28 (1), 148-154 (2020).
- Shaw, H. M., Benjamin, M. Structure-function relationships of entheses in relation to mechanical load and exercise. Scand J Med Sci Sports. 17 (4), 303-315 (2007).
- Soslowsky, L. J., et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 30 (8), 1057-1063 (2002).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. J Shoulder Elbow Surg. 7 (4), 375-380 (1998).
- Croen, B. J., et al. Chronic subacromial impingement leads to supraspinatus muscle functional and morphological changes: Evaluation in a murine model. J Orthop Res. 39 (10), 2243-2251 (2021).
- Andarawis-Puri, N., Flatow, E. L. Tendon fatigue in response to mechanical loading. J Musculoskelet Neuronal Interact. 11 (2), 106-114 (2011).
- Gains, C. C., Giannapoulos, A., Zamboulis, D. E., Lopez-Tremoleda, J., Screen, H. R. C. Development and application of a novel in vivo overload model of the Achilles tendon in rat. J Biomech. 151, 111546 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Pedaprolu, K., Szczesny, S. E. A Novel, Open-Source, Low-Cost Bioreactor for Load-Controlled Cyclic Loading of Tendon Explants. J Biomech Eng. 144 (8), 084505 (2022).
- Orishimo, K. F., et al. Effect of Knee Flexion Angle on Achilles Tendon Force and Ankle Joint Plantarflexion Moment During Passive Dorsiflexion. J Foot Ankle Surg. 47 (1), 34-39 (2008).
- Liu, C. L., et al. Influence of different knee and ankle ranges of motion on the elasticity of triceps surae muscles, Achilles tendon, and plantar fascia. Sci Rep. 10 (1), 6643 (2020).
- Cruz-Montecinos, C., et al. Soleus muscle and Achilles tendon compressive stiffness is related to knee and ankle positioning. J Electromyogr Kinesiol. 66, 102698 (2022).
- Connizzo, B. K., Grodzinsky, A. J. Lose-dose administration of dexamethasone is beneficial in preventing secondary tendon damage in a stress-deprived joint injury explant model. J Orthop Res. 38 (1), 139-149 (2020).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biol. 89, 11-26 (2020).
- Yabusaki, K., et al. A Novel Quantitative Approach for Eliminating Sample-To-Sample Variation Using a Hue Saturation Value Analysis Program. PloS one. 9 (3), e89627 (2014).
- Gao, J., Messner, K., Ralphs, J. R., Benjamin, M. An immunohistochemical study of enthesis development in the medial collateral ligament of the rat knee joint. Anat Embryol. 194 (4), 399-406 (1996).
- Han, S. K., Wouters, W. A. J., Clark, A., Herzog, W. Mechanically induced calcium signaling in chondrocytes in situ. J Orthop Res. 30 (3), 475-481 (2012).
- Han, W., et al. Impact of cellular microenvironment and mechanical perturbation on calcium signalling in meniscus fibrochondrocytes. Eur Cell Mater. 27, 321-331 (2014).
- Rossetti, L., et al. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 16 (6), 664-670 (2017).
- Sartori, J., Köhring, S., Witte, H., Fischer, M. S., Löffler, M. Three-dimensional imaging of the fibrous microstructure of Achilles tendon entheses in Mus musculus. J Anat. 233 (3), 370-380 (2018).
- Eliasberg, C. D., et al. Identification of Inflammatory Mediators in Tendinopathy Using a Murine Subacromial Impingement Model. J Orthop Res. 37 (12), 2575-2582 (2019).
- Zhang, Y., et al. Expression of alarmins in a murine rotator cuff tendinopathy model. J Orthop Res. 38 (11), 2513-2520 (2020).
- Zhang, X., et al. Assessment of Mitochondrial Dysfunction in a Murine Model of Supraspinatus Tendinopathy. J Bone Joint Surg. Am. 103 (2), 174-183 (2021).
- Liu, Y., et al. The role of Indian Hedgehog Signaling in tendon response to subacromial impingement: evaluation using a mouse model. Am J Sports Med. 50 (2), 362-370 (2022).
- Wang, T., et al. Load-induced regulation of tendon homeostasis by SPARC, a genetic predisposition factor for tendon and ligament injuries. Sci Transl Med. 13 (582), eabe5738 (2021).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nat Biomed Eng. 5 (12), 1457-1471 (2021).
- Jones, D. L., et al. Mechanoepigenetic regulation of extracellular matrix homeostasis via Yap and Taz. Proc Natl Acad Sci U S A. 120 (22), e2211947120 (2023).
- Connizzo, B. K., Grodzinsky, A. J. Release of pro-inflammatory cytokines from muscle and bone causes tenocyte death in a novel rotator cuff in vitro explant culture model. Connect Tissue Res. 59 (5), 423-436 (2018).
- Rees, S. G., et al. Catabolism of aggrecan, decorin and biglycan in tendon. Biochem J. 350 (Pt 1), 181-188 (2000).
- Samiric, T., Ilic, M. Z., Handley, C. J. Large aggregating and small leucine-rich proteoglycans are degraded by different pathways and at different rates in tendon. Eur J Biochem. 271 (17), 3612-3620 (2004).
- Rees, S. G., Curtis, C. L., Dent, C. M., Caterson, B. Catabolism of aggrecan proteoglycan aggregate components in short-term explant cultures of tendon. Matrix Biol. 24 (3), 219-231 (2005).
- Taye, N., Karoulias, S. Z., Hubmacher, D. The "other" 15-40%: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon. J Orthop Res. 38 (1), 23-35 (2020).
- Carvalho, H. F., Felisbino, S. L. The development of the pressure-bearing tendon of the bullfrog, Rana catesbeiana. Anat Embryol. 200 (1), 55-64 (1999).
- Carvalho, H. F., Felisbino, S. L., Covizi, D. Z., Della Colleta, H. H., Gomes, L. Structure and proteoglycan composition of specialized regions of the elastic tendon of the chicken wing. Cell Tissue Res. 300 (3), 435-446 (2000).
- van Sterkenburg, M. N., Kerkhoffs, G. M., Kleipool, R. P., Niek van Dijk, C. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study. J Anat. 218 (3), 336-341 (2011).
- Lee, A. H., Elliott, D. M. Comparative multi-scale hierarchical structure of the tail, plantaris, and Achilles tendons in the rat. J Anat. 234 (2), 252-262 (2019).
- Lee, A. H., Elliott, D. M. Multi-Scale Loading and Damage Mechanisms of Plantaris and Rat Tail Tendons. J Orthop Res. 37 (8), 1827-1837 (2019).
- Fan, H. M., Shrestha, L., Guo, Y., Tao, H. R., Sun, Y. L. The twisted structure of the rat Achilles tendon. J Anat. 239 (5), 1134-1140 (2021).
- Cutlip, R. G., Stauber, W. T., Willison, R. H., McIntosh, T. A., Means, K. H. Dynamometer for rat plantar flexor muscles in vivo. Med Biol Eng Comput. 35 (5), 540-543 (1997).
- Rijkelijkhuizen, J. M., Baan, G. C., de Haan, A., de Ruiter, C. J., Huijing, P. A. Extramuscular myofascial force transmission for in situ rat medial gastrocnemius and plantaris muscles in progressive stages of dissection. J Exp Biol. 208 (Pt 1), 129-140 (2005).
- Saxena, A., Bareither, D. Magnetic Resonance and Cadaveric Findings of the Incidence of Plantaris Tendon. Foot Ankle Int. 21 (7), 570-572 (2000).
- dos Santos, M. A., Bertelli, J. A., Kechele, P. R., Duarte, H. Anatomical study of the plantaris tendon: reliability as a tendo-osseous graft. Surg Radiol Anat. 31 (1), 59-61 (2009).
- Sartori, J., Köhring, S., Bruns, S., Moosmann, J., Hammel, J. U. Gaining Insight into the Deformation of Achilles Tendon Entheses in Mice. Adv Eng Mater. 23 (11), 2100085 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。