É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo de Explante de Membro Posterior Murino para Estudo da Mecanobiologia do Impacto do Tendão de Aquiles
Neste Artigo
Resumo
Apresentamos uma plataforma experimental personalizada e um protocolo de cultura de tecidos que recria a alteração fibrocartilaginosa impulsionada pelo impacto da inserção do tendão de Aquiles em explantes murinos de membros posteriores com viabilidade celular sustentada, fornecendo um modelo adequado para explorar a mecanobiologia do impacto tendíneo.
Resumo
O impacto tendíneo sobre o osso gera um ambiente de deformação mecânica multiaxial com tensão compressiva transversal acentuadamente elevada, que provoca um fenótipo de fibrocartilagem localizada caracterizado pelo acúmulo de matriz rica em glicosaminoglicanos (GAG) e remodelamento da rede de colágeno. Enquanto a fibrocartilagem é uma característica normal em regiões impactadas de tendões saudáveis, a deposição excessiva de GAG e a desorganização da rede de colágeno são características marcantes da tendinopatia. Assim, o impacto é reconhecido clinicamente como um importante fator extrínseco no início e progressão da tendinopatia. No entanto, a mecanobiologia subjacente ao impacto tendíneo permanece pouco estudada. Esforços anteriores para elucidar a resposta celular ao impacto tendíneo aplicaram compressão uniaxial às células e excisaram explantes tendinosos in vitro. No entanto, as células isoladas carecem de um ambiente extracelular tridimensional crucial para a mecanorresposta, e tanto os estudos de explantes in vitro quanto os excisados não conseguem recapitular o ambiente de deformação multiaxial gerado pelo impacto tendíneo in vivo, que depende das características anatômicas da região impactada. Além disso, os modelos in vivo de impacto tendíneo carecem de controle sobre o ambiente de deformação mecânica. Para superar essas limitações, apresentamos um novo modelo de explante de membro posterior murino adequado para o estudo da mecanobiologia do impacto do tendão de Aquiles. Este modelo mantém o tendão de Aquiles in situ para preservar a anatomia local e reproduz o ambiente de deformação multiaxial gerado pelo impacto da inserção do tendão de Aquiles sobre o calcâneo durante a dorsiflexão do tornozelo aplicada passivamente, retendo as células em seu ambiente nativo. Descrevemos um protocolo de cultura de tecidos integrado a este modelo e apresentamos dados que estabelecem a viabilidade sustentada do explante ao longo de 7 dias. Os resultados representativos demonstram aumento da coloração histológica de GAG e diminuição do alinhamento das fibras colágenas secundárias ao impacto, sugerindo elevada formação de fibrocartilagem. Este modelo pode ser facilmente adaptado para investigar diferentes regimes de carregamento mecânico e permite a manipulação de vias moleculares de interesse para identificar mecanismos mediadores de alterações fenotípicas no tendão de Aquiles em resposta ao impacto.
Introdução
Uma infinidade de tendões, incluindo o tendão de Aquiles e os tendões do manguito rotador, experimentam impacto ósseo devido ao posicionamento anatômico normal1,2,3,4. O impacto tendíneo gera deformação compressiva direcionada transversalmente ao eixo longitudinal das fibras5,6,7. Regiões de impacto tendíneo demonstram um fenótipo único de fibrocartilagem no qual células arredondadas e encolhidas (fibrocondrócitos) estão embutidas em uma rede de colágeno desorganizada com conteúdo de glicosaminoglicanos (GAG) acentuadamente aumentado2,3,4,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24. Estudos anteriores sugerem que o ambiente mecânico díspar produzido pelo impacto tendíneo sustenta essa matriz rica em GAG impulsionando a deposição de grandes proteoglicanos agregadores, mais notavelmente agrecan, embora os mecanismos subjacentes não sejam claros1,3,12,13,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39. Enquanto a fibrocartilagem é uma característica normal em regiões impactadas de tendões saudáveis, o metabolismo aberrante de proteoglicanos associado à formação excessiva de fibrocartilagem é uma característica marcante da tendinopatia, uma doença comum e debilitante que surge desproporcionalmente em tendões cronicamente impactados1,40,41,42,43,44,45,46,47,48,49. Assim, o impacto tendíneo é reconhecido clinicamente como um importante fator extrínseco que conduz várias das tendinopatias mais comuns, incluindo a doença do manguito rotador e a tendinopatia de Aquiles insercional (TIA)50,51,52. Atualmente, o tratamento da tendinopatia é ineficiente. Por exemplo, aproximadamente 47% dos pacientes com IAT necessitam de intervenção cirúrgica após falha no manejo conservador, com resultados pós-operatórios variáveis53,54,55,56. Apesar da aparente relação entre impacto e tendinopatia, os mecanismos mecanobiológicos pelos quais as células do tendão impactado sentem e respondem ao seu ambiente mecânico são pouco descritos, o que obscurece o entendimento da patogênese da tendinopatia e resulta em tratamento inadequado.
Modelos de explantes são ferramentas úteis no estudo da mecanobiologia tendínea57,58. Como primeiro passo para o entendimento da mecanobiologia do impacto tendíneo, vários estudos prévios exploraram a resposta celular após a aplicação de compressão uniaxial simples em células ou explantes tendinosos excisados27,29,30,31,32,33,34,39. Entretanto, as células in vitro carecem de matrizes extracelulares e pericelulares que facilitem a transferência de deformação, sequestrem importantes fatores de crescimento e citocinas liberadas por deformação mecânica e forneçam substrato para complexos de adesão focal que desempenham um papel na mecanotransdução57,59. Além disso, tanto os estudos in vitro quanto os excisantes excisados não conseguem recapitular o ambiente de deformação mecânica multiaxial gerado pelo impacto tendíneo in vivo, que depende das características anatômicas da região impactada5,6. No contexto da inserção do tendão de Aquiles impactado, isso inclui tecidos circunvizinhos, como a bursa retrocalcânea e o coxim gorduroso de Kager 60,61,62,63. Por outro lado, modelos in vivo de impacto tendíneo25,28,36,37,38,64,65,66 permitem controle mínimo sobre a magnitude e frequência da carga aplicada diretamente ao tendão, o que é uma limitação bem reconhecida dos modelos in vivo para o estudo da mecanobiologia tendínea57,58 67,68,69,70. Diante dos desafios na mensuração in vivo da deformação tendínea, o ambiente interno de deformação gerado nesses modelos é frequentemente pouco caracterizado.
Neste manuscrito, apresentamos uma plataforma experimental personalizada que recria o impacto da inserção do tendão de Aquiles sobre o calcâneo dentro de explantes de membros posteriores murinos inteiros que, quando pareados com este protocolo de cultura de tecidos, mantém a viabilidade por 7 dias em cultura de explantes e permite o estudo das sequelas biológicas do impacto tendíneo. A plataforma é construída sobre uma base de ácido polilático (PLA) impressa em 3D que fornece a base para a fixação das alças e inserção de redução de volume PLA impressa em 3D. As pegas são usadas para pinçar a perna e o joelho proximal à junção miotendínea de Aquiles com a face caudal do membro posterior voltada para cima, permitindo que o tendão de Aquiles seja visualizado de cima usando uma sonda de ultrassom ou microscópio invertido (Figura 1A). A inserção de redução de volume desliza ao longo de uma trilha na base e reduz o volume necessário de meios de cultura de tecidos. Uma linha trançada enrolada ao redor da pata traseira é roteada para fora da plataforma utilizando o design de base e um clipe PLA impresso em 3D. Ao puxar a corda, a pata traseira é dorsiflexionada e a inserção do tendão de Aquiles é impingida contra o calcâneo, resultando em elevada deformação compressiva transversa 5,6 (Figura 1A). A plataforma está contida dentro de um banho de acrílico que mantém os explantes do membro posterior submersos em meios de cultura de tecidos. A fixação da corda tensa na parte externa do banho com fita adesiva mantém a dorsiflexão do tornozelo para produzir impacto estático da inserção do tendão de Aquiles. Os arquivos CAD para componentes impressos em 3D são fornecidos em vários formatos (Arquivo Suplementar 1), permitindo a importação para uma variedade de softwares CAD comerciais e gratuitos de código aberto para modificação para atender às necessidades experimentais. Se o acesso a impressoras 3D não estiver disponível para fabricação, os arquivos CAD podem ser fornecidos aos serviços de impressão 3D on-line que imprimirão e enviarão as peças a baixo custo.
É importante ressaltar que o complexo músculo-tenculotendíneo tríceps sural abrange as articulações do joelho e tornozelo 71,72,73. Consequentemente, o estiramento tênsil no tendão de Aquiles é influenciado pela flexão do joelho. A extensão do joelho coloca o tendão de Aquiles sob tensão, enquanto a flexão do joelho reduz a tensão. Estendendo primeiro o joelho e, em seguida, dorsiflexando passivamente o tornozelo, as tensões compressivas na inserção impactada podem ser sobrepostas às tensões de tração. Por outro lado, ao dorsiflexar passivamente o tornozelo com o joelho flexionado, a tensão de tração é reduzida e a tensão compressiva permanece. O protocolo atual explora três dessas condições. 1) Para impacto estático, o pé é dorsiflexionado a < 110° em relação à tíbia para impactar a inserção, com o joelho fletido para reduzir a tensão. 2) Para o grupo tensão basal, o tornozelo é estendido acima de 145° de dorsiflexão com o joelho estendido, gerando tensão tracional predominante na inserção. 3) Para o grupo descarregado, os explantes são cultivados em placa de Petri com joelho e tornozelo em posição neutra na ausência de carga aplicada externamente. Os ângulos acima referidos são medidos fotograficamente em relação a um sistema de coordenadas onde o pé e a tíbia são paralelos num ângulo de 180° e perpendiculares num ângulo de 90°.
As principais etapas do protocolo incluem: 1) dissecção dos explantes dos membros posteriores e remoção cuidadosa da pele e do tendão plantar; 2) cultura de explantes após pré-tratamento com dexametasona 48 h; 3) corte tecidual e coloração histológica; e 4) análise de imagens coloridas para avaliar a formação de fibrocartilagem. Após a dissecção, cada explante de membro posterior é pré-tratado por 48 h em meios de cultura suplementados com dexametasona74. Os membros contralaterais de cada camundongo são alocados em grupos experimentais separados para comparação pareada, o que ajuda a controlar a variabilidade biológica. Após o pré-tratamento, os explantes são posicionados em plataformas como descrito acima e cultivados por mais 7 dias (Figura 1B). Comparações adicionais são feitas com um grupo pré-tratado (dia 0) no qual os explantes são removidos imediatamente após o pré-tratamento de 48 h.
Após a cultura do explante, os membros posteriores são aparados, fixados em formalina, descalcificados e incluídos em parafina. A secção seriada em orientação sagital proporciona a visualização do tendão de Aquiles desde a junção miotendínea até a inserção do calcâneo, permitindo que a profundidade da secção seja rastreada através de todo o tendão. A marcação dUTP X-nick mediada pela desoxinucleotidiltransferase terminal (TdT) (TUNEL) é usada para visualizar danos ao DNA secundários à apoptose e avaliar a viabilidade. A histologia do azul de toluidina e a análise de imagens coloridas personalizadas são realizadas para quantificar as alterações na coloração GAG. Cortes de tecido corados com azul de toluidina são então usados para imagens de SHG para caracterizar alterações na organização das fibras de colagem (Figura 1B).
Os resultados representativos fornecidos sugerem coloração histológica alterada da matriz rica em GAG e desorganização da rede de colágeno extracelular gerada por 7 dias de impacto estático dentro do modelo. Este modelo pode ser utilizado para explorar mecanismos moleculares subjacentes à alteração fibrocartilaginosa impulsionada pelo impacto.
Protocolo
Todo o trabalho com animais foi aprovado pelo Comitê de Recursos Animais da Universidade de Rochester.
1. Preparo dos meios de cultura de tecidos
- Cultivar todos os explantes em meio Dulbecco's Modified Eagle (1x DMEM) com 1% v/v de penicilina-estreptomicina e 200 μM de ácido L-ascórbico em estufa a 37 °C e 5% de CO2. Para o pré-tratamento inicial de 48 h, cada explante foi cultivado em 70 mL de meio de cultura suplementado com 100 nM de dexametasona74. Após o pré-tratamento, cultivar os membros por mais 7 dias sem dexametasona, trocando de meio a cada 48-72 h.
NOTA: A adição de soro, como o soro fetal bovino, aos meios de cultura não é recomendada de acordo com as recomendações de Wunderli, Blache e Snedeker57. Em resumo, as condições livres de soro representam melhor o microambiente tendíneo avascular, pobre em nutrientes, existente in vivo. Além disso, a suplementação sérica pode promover degradação tecidual em determinadas condições de cultura75 e estimular a proliferação e migração celular para fora do tecido, ambas características da patologia tendínea57. - Para o grupo descarregado, cultivar cada explante em 70 mL de meio. Para os grupos tensão basal e impacto estático, cada plataforma requer aproximadamente 125 mL de meios de cultura para manter o membro submerso. Esse volume pode variar dependendo do posicionamento da perna superior nas alças e dos parâmetros de impressão 3D, principalmente a densidade de preenchimento.
2. Dissecção de explantes e pré-tratamento com dexametasona
- Eutanásia de camundongos via inalação de CO2 e luxação cervical secundária, ou de acordo com diretrizes institucionais. Este protocolo utiliza camundongos C57BL/6 com menos de 1 ano de idade. O tamanho dos membros posteriores aumentará com a idade e pode se tornar difícil de encaixar dentro das pegadas.
- Antes da dissecção, transferir 70 mL de meio de cultura pré-aquecido (37 °C) para uma placa de Petri de 100 mm (diâmetro) x 25 mm (altura) em uma cabine de segurança biológica estéril (BSC). Adicione dexametasona para atingir 100 nM de concentração de trabalho.
- As dissecções podem ser realizadas na bancada com o uso de absorventes inferiores, trabalhando rapidamente através da dissecção antes de transferir os explantes dos membros posteriores para o BSC. Montar as ferramentas cirúrgicas necessárias para esta dissecção, que incluem pinças lisas, retas e de ponta fina; pinças de ponta reta e fina com dentes serrilhados; e tesoura reta, afiada e fina.
- Para dissecção dos explantes dos membros posteriores, coloque o camundongo em decúbito dorsal e identifique a articulação do quadril. Usando uma tesoura fina, faça uma pequena incisão (5-10 mm) através da pele sobrepondo o aspecto proximal e anterior (cranial) da parte superior da perna.
- Puxe a incisão para expandir, aperte a perna exposta usando os dedos e puxe cuidadosamente a pele distalmente para desenluvar o membro posterior até o nível do tornozelo. Insira suavemente uma lâmina tesoura sob a pele ao longo da face dorsal do pé e faça uma incisão estendendo-se até os dedos dos pés. Continue a puxar a pele distalmente para remover completamente.
- Posicione o mouse para visualizar a inserção do tendão de Aquiles na face posterior (caudal) do calcâneo, próximo ao tornozelo. Proximal à inserção do tendão de Aquiles, o tendão plantar encontra-se diretamente adjacente à borda medial do tendão de Aquiles e estende-se distalmente em direção à face plantar do pé, passando sobre a face posterior do calcâneo.
- Para remover o tendão plantar, insira cuidadosamente uma ponta da pinça de ponta lisa e fina entre os dois tendões e estenda a ponta medialmente passando por baixo do tendão plantar. Desenhe a ponta proximalmente e rasgue o músculo plantar. Usando pinça fina e serrilhada, agarre a extremidade proximal descolada do tendão plantar e puxe distalmente para remover.
- Na articulação do quadril, use uma tesoura fina para cortar a pelve e isolar o membro posterior. Use a tesoura para arrancar a pelve restante e expor a cabeça femoral.
- Transferir o explante do membro posterior para o BSC e para a placa contendo meios de cultura celular com dexametasona. Mova o prato para a incubadora e faça o pré-tratamento por 48 h.
3. Plataformas de cultura e carregamento de explantes
- À medida que o pré-tratamento de 48 h termina, pré-aquecer volumes suficientes de meios de cultura (secção 1). A partir deste ponto, nenhuma dexametasona será adicionada aos meios de cultura. Nesse momento, os membros do grupo pré-tratado (dia 0) podem ser fixados, descalcificados e incluídos em parafina para posterior secção, coloração e análise.
- Para o grupo descarregado, aspirar o meio de pré-tratamento e transferir os explantes para placas de Petri frescas, adicionar 70 mL de meios de cultura cada e retornar à incubadora.
- Para os grupos de tensão basal e impacto estático, preparar plataformas de explante. Corte pedaços de lixa de tamanho semelhante às placas de aderência. Para o grupo de impacto estático, corte pedaços de linha trançada de aproximadamente 18 polegadas de comprimento e pré-amarre um nó overhand solto no meio do comprimento da linha. Rasgue pedaços de papel alumínio para cobrir cada banho de acrílico e borrife com etanol 70% (EtOH). Transferir os preparativos para o BSC.
- Cada plataforma inclui um banho de acrílico, base, inserto de redução de volume, clipe e pegas. Cada pega inclui duas placas e três tipos diferentes de parafusos, incluindo uma rosca M5 x 0,8 mm x parafuso de 10 mm de comprimento que prende as alças à base; duas roscas M6 x 1 mm x parafusos de 20 mm de comprimento que estendem as placas para prender as alças; e quatro parafusos M3 x 0,5 mm rosca x 14 mm de comprimento que, em combinação com quatro molas de compressão, retraem as placas para abrir as alças.
- Coloque todos os componentes em recipientes secundários capazes de capturar todos os meios de cultura em caso de vazamento. Submergir em solução de água sanitária a 10% ≥ e deixar de molho por pelo menos 1 h. Enxágue a solução de água sanitária com água da torneira (autoclave conforme necessário) e passe para o BSC.
NOTA: Para solucionar problemas de contaminação, considere autoclavar toda a água da torneira ou usar água purificada. Consulte a Discussão para obter dicas adicionais ao lidar com a contaminação. - Use os parafusos M3 e as molas de compressão para prender as placas às alças, fixe as alças à base usando o parafuso M5 e insira os parafusos M6 até que eles engatem as placas. Use fita dupla face para fixar a lixa às placas e, em seguida, feche as alças para promover a adesão da lixa às placas. Repita para todas as plataformas.
- Quando estiver pronto para carregar uma plataforma, abra totalmente as alças e, com pinças, coloque a perna e o joelho entre as placas, com a superfície superficial do tendão de Aquiles voltada para cima (Figura 1A). Feche frouxamente as alças para segurar suavemente no lugar.
- Use pinças para agarrar a cabeça ou o pé femoral exposto e manipular o ângulo de flexão do joelho à medida que você fecha gradualmente as alças para se fixar no lugar. Para o grupo de tensão basal, estenda a articulação do joelho conforme descrito anteriormente. Como as pegas apertam com o joelho estendido, o tornozelo deve se estender naturalmente. Para o grupo de impacto estático, flexione a articulação do joelho entre as pegas, conforme descrito anteriormente.
- Para o grupo de impacto estático, coloque o nó overhand da corda ao redor da pata distal e aperte. Encaminhe a corda através de um slot na base localizado abaixo do explante e através do orifício do clipe. Coloque a base no banho de acrílico e prenda o clipe na borda superior do banho (Figura 1A).
- Puxe a corda para dorsiflexar o pé a pelo menos 110° em relação à tíbia e use um marcador permanente para marcar a corda ao sair do clipe. Fotografar o explante nessa posição para posteriormente quantificar o ângulo de dorsiflexão (Figura 1A).
- Remova a base e fixe a pastilha de redução de volume deslizando ao longo de uma esteira na base. Coloque a base (agora presa à inserção de redução de volume) de volta no banho de acrílico e reposicione o clipe na borda superior. Puxe a corda para retornar ao ângulo de dorsiflexão original usando a corda marcada como guia e prenda a corda para a parte externa do banho com fita adesiva para manter a dorsiflexão estática.
- Para o grupo de tensão basal, basta colocar a base com inserção de redução de volume no banho de acrílico assim que o explante estiver posicionado entre as alças e tirar uma fotografia para quantificação do ângulo de dorsiflexão.
- Adicionar 125 mL de meio de cultura pré-aquecido (37 °C) a cada plataforma para submergir os explantes. Cubra a parte superior do banho com papel alumínio, coloque em um recipiente secundário e mova para a incubadora. Cultura por 7 dias adicionais, trocando de mídia a cada 48-72 h.
NOTA: A fita colocada na parte superior do banho pode impedir que as peças de PLA flutuem.
4. Fixação, descalcificação e inclusão em parafina
- Após a cultura do explante, usar tesoura para aparar as unhas dos pés/dedos distais e cortar a parte superior da perna proximal à junção miotendínea de Aquiles. Coloque cada articulação do tornozelo aparada em um de processamento forrado com almofadas de biópsia de espuma. Empurre o tornozelo para o canto do para posicionar o tornozelo a aproximadamente 90° de dorsiflexão e feche o para mantê-lo no lugar.
- Fixar por 3 dias em formalina tamponada neutra (FBN) a 10% e descalcificar por 2 semanas em ácido etilenodiamenetetracético (EDTA) a 14% dissolvido em água destilada (diH2O) com pH ajustado para 7,4-7,6 com ácido acético glacial.
- Para remover os sais, enxágue cuidadosamente as amostras três vezes em solução salina tamponada com fosfato (PBS) 1x seguida de diH2O, 5 minutos cada. Realizar processamento rotineiro de amostras para histologia de parafina: desidratar através de uma série graduada de EtOH, limpar em xileno e infiltrar-se com cera de parafina. Orientar e incorporar amostras em parafina para obter cortes de tecido sagital através do tendão de Aquiles em progressão medial para lateral, conforme descrito na seção 5 abaixo (Figura 1B).
5. Secção tecidual
- Com um micrótomo, corte cuidadosamente na amostra até que as seções fiquem paralelas à face do bloco. Aparar grosseiramente o tornozelo a partir da face medial da articulação, parando antes de atingir a borda medial da inserção do tendão de Aquiles.
- Transfira a amostra para um bloco de gelo para ajustar a temperatura e a hidratação e troque as lâminas (ou mude para uma nova seção da lâmina atual). Continue seccionando na amostra com 10 μm de espessura e identifique cuidadosamente a entrada na inserção do tendão de Aquiles com um microscópio de campo claro. Uma vez identificado, execute o corte seriado rastreando o número da seção (ou seja, a profundidade do tecido) através de toda a inserção do tendão de Aquiles.
6. Desparafinização/reidratação e seleção de lâminas
- Para cada ensaio abaixo, selecione cortes de tecido compatíveis com o nível de cada par de membros contralaterais. Antes da coloração, coloque em um rack deslizante e passe por 3 trocas de xileno, 2 trocas de 100% de EtOH, 2 trocas de 95% de EtOH e 1 mudança de 70% de EtOH, 5 min cada. Finalize a reidratação em diH2O.
7. TUNEL para avaliar a viabilidade do tendão de Aquiles
- Para rotulagem TUNEL, corar de acordo com o protocolo do fabricante. Incubar em 20 μg/mL de proteinase K por 20 min à temperatura ambiente e enxaguar em diH2O. Incubar em 50 μL de solução corante TUNEL (5 μL de solução enzimática, 45 μL de solução rotulada) por 1 h a 37 °C. Enxaguar em diH2O. Monte com reagente antifade contendo DAPI e lamínula.
- Imagem da inserção do tendão de Aquiles usando um microscópio de fluorescência com uma lente objetiva 4x. Incluir um canal DAPI (comprimentos de onda de excitação/emissão = 360/460 nm) para visualizar todos os núcleos, um canal TUNEL (TMR Red) (comprimentos de onda de excitação/emissão = 540/580 nm) para visualizar núcleos apoptóticos e, se possível, um canal de campo brilhante.
- Para análise de imagens, importe imagens para um software de análise de imagem adequado para processamento baseado em ROI, como FIJI/ImageJ ou MATLAB. Definir uma região de interesse (ROI) delineando todo o tendão de Aquiles em vista (Figura 2A), excluindo as células do epitenon que são altamente suscetíveis à morte induzida por dissecção e mudança súbita nas condições ambientais quando colocadas em cultura.
- Para fazer isso, execute a seleção de ROI no MATLAB importando a imagem de campo brilhante e usando a função drawpolygon() para rastrear e delimitar os limites do tendão. O MATLAB cria um objeto Polygon para a ROI, que pode então ser aplicado às imagens de canal DAPI e TUNEL para mascarar dados de intensidade de pixel fora da ROI usando createMask() para analisar apenas núcleos dentro do tendão de Aquiles.
- Importe as imagens dos canais DAPI e TUNEL e identifique um limiar de intensidade de fluorescência para definir núcleos apoptóticos (TUNEL+) normalizando para a intensidade máxima de fluorescência de núcleos apoptóticos em tecidos não viáveis, como osso, músculo ou gordura, que são capturados incidentalmente na seção de tecido. Uma vez mascaradas as imagens, calcule a fração de núcleos apoptóticos (núcleos TUNEL+/núcleos DAPI) dentro do tendão de Aquiles.
8. Histologia do azul de toluidina para caracterizar a formação de fibrocartilagem
- Uma vez reidratada (Seção 6), transferir a cremalheira deslizante com cortes de tecido compatíveis com o nível de pares de explantes contralaterais para 0,4% p/v de azul de toluidina O em tampão acetato de sódio 0,1 M com pH ajustado para 4,0 usando ácido acético glacial. Incubar por 10 min à temperatura ambiente, depois enxaguar 3x em diH2O por 30 s cada.
- Desidratar através de três trocas de EtOH 95% e duas trocas de EtOH 100%, 30 s cada. Limpar através de três trocas de xileno, 1 min cada. Tampa com meio de montagem à base de xileno.
- Obtenha imagens coloridas de 24 bits Vermelho-Azul-Verde (RGB) da inserção do tendão de Aquiles. Por exemplo, para este protocolo use um adaptador para fazer a interface de uma câmera digital colorida com a ocular de um microscópio de campo brilhante simples com uma objetiva de 4x.
- Para quantificar as diferenças na coloração com azul de toluidina dentro da fibrocartilagem compressiva do tendão (CTF)16 na inserção do tendão de Aquiles (Figura 3A,B), importe imagens RGB para um software de análise de imagens capaz de definir e gerenciar múltiplas ROIs. As opções incluem as seleções e as ferramentas de gerenciador de ROI no FIJI/ImageJ ou a caixa de ferramentas de processamento de imagem no MATLAB. Comece definindo a escala de pixel/comprimento.
NOTA: A escolha do software é deixada a critério do pesquisador e certamente não se limita ao MATLAB ou FIJI/ImageJ. Os autores forneceram código MATLAB (Arquivo Suplementar 2), documentação descrevendo a implementação (Arquivo Suplementar 3) e uma imagem de exemplo (Arquivo Suplementar 4). Encorajamos os pesquisadores a traduzir esse código para linguagens de programação alternativas para uso em outros softwares, conforme necessário ou preferido. - Com a imagem exibida no software de escolha, identifique a intersecção da borda profunda do tendão com o calcâneo. A partir daqui, traçar proximalmente 800 μm ao longo da borda tendínea profunda para estabelecer o limite profundo da CTF. Por exemplo, use a função drawpolyline() no MATLAB para desenhar interativamente uma polilinha sobre a imagem RGB. O MATLAB cria um objeto Polyline contendo os vértices da linha, que pode ser processado e cortado para um comprimento de 800 μm.
- A partir dessa posição, crie o limite proximal do CTF desenhando um segmento de reta conectando-se à borda superficial do tendão que é perpendicular à orientação da fibra local.
- Voltar à intersecção da borda profunda do tendão e do calcâneo e definir o limite distal da FTC desenhando um segmento de linha conectando-se à borda superficial do tendão ao longo da maré distinta que separa a FTC da fibrocartilagem da zona de inserção (AZF)16 (Figura 3A,B). Por fim, gerar o limite superficial do CTF traçando a borda superficial do tendão para encerrá-lo.
- Para descrever as variações espaciais na coloração de GAG ao longo da inserção, divida o CTF total em 4 quadrantes (Figura 3A,B). Conecte o ponto médio dos limites profundos e superficiais do CTF com um segmento de reta para criar um limite distal/proximal. Passando pelo ponto médio dessa fronteira, conecte os pontos médios dos limites distais e proximais da CTF ao longo da orientação da fibra para criar um limite superficial/profundo.
- Esses 6 limites fornecem informações que podem ser usadas para definir a ROI representando todo o CTF, mas também 4 quadrantes subdividindo o CTF. No MATLAB, por exemplo, compile vértices definindo os limites de cada ROI individual (CTF, quadrantes 1-4) em vetores e use images.roi.Polygon() para gerar objetos Polygon fechados para cada ROI.
- Com ROIs definidos, transforme os dados de pixel RGB no espaço de cores Hue-Saturation-Value (HSV) usando o plug-in de transformador de cores no FIJI, a função rgb2hsv() no MATLAB ou outro software que aplique as equações de transformação apropriadas76. Os dados do HSV podem então ser projetados no espaço de saturação de matiz 2D, onde cada combinação de matiz e saturação codifica uma cor única (Figura 3C).
- Dentro de cada ROI, calcule a tonalidade e a saturação médias que descrevem a cor média da mancha na ROI. Isso pode ser alcançado no MATLAB, por exemplo, usando os objetos Polygon que definem cada ROI para mascarar a imagem usando createMask() para analisar dados de pixel de saturação de matiz especificamente dentro de cada ROI.
- Definir outra pequena ROI dentro da fibrocartilagem periosteal (FP)16 (Figura 3A, B) e calcular a tonalidade e saturação médias. Em seguida, calcule a distância euclidiana separando a cor média em cada ROI do CTF com a do LP (Figura 3C).
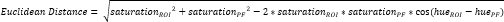
OBS: O cálculo da distância euclidiana descreve o grau de semelhança entre a cor média da ROI com a do LP, um tecido fibrocartilaginoso por excelência16,17,77. Uma distância euclidiana menor indica uma cor de ROI que é mais fibrocartilaginosa na aparência. - Use essa distância para calcular o escore de fibrocartilagem, que assume um valor máximo de 1 se a cor da ROI for idêntica à cor do PF e um valor mínimo de -1 se a cor da ROI e do PF atingirem a separação máxima dentro do espaço de cores de saturação de matiz.
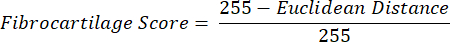
- Dados médios de matiz, saturação e escore de fibrocartilagem dentro de cada ROI em seções de tecido de cada membro. Realizar comparações estatísticas pareadas entre grupos de membros contralaterais.
9. Imagem por SHG para investigar mudanças na organização da rede de colágeno
- Realizar imagens SHG das seções coradas com azul de Toluidina usando um sistema de microscópio capaz com uma lente de objeto de 20x. Adquira z-stacks através da espessura da seção e execute a varredura de blocos conforme necessário para capturar totalmente a inserção do tendão de Aquiles.
- Importar imagens SHG para um software de análise de imagem preferido e definir ROIs englobando e subdividindo o CTF na inserção do tendão de Aquiles, conforme descrito para a análise de imagem azul de Toluidina na seção 8 (Figura 4A,B).
- Se as imagens SHG forem importadas para o MATLAB, use a abordagem para definir ROIs CTF no MATLAB, conforme descrito na seção 8 . Depois de definir ROIs, transfira as coordenadas de ROI para o FIJI exportando vértices de ROI do MATLAB como arquivos .txt e importando para o FIJI usando as coordenadas File > Import > XY. Sobreponha a seleção e envie para o gerente de ROI para análise.
- Para quantificar a organização do colágeno, use o plug-in Directionality no FIJI, que realiza a análise do espectro de Fourier para calcular distribuições de orientações de fibras em pequenas janelas que abrangem um ROI. A dispersão dessa distribuição, conhecida como dispersão, está inversamente relacionada ao alinhamento das fibras.
NOTA: As fibras colágenas podem assumir orientações variáveis em diferentes janelas através do CTF devido à curvatura grosseira do tendão em vez da ausência de alinhamento/organização. Para melhor distinguir as alterações na organização do colágeno da curvatura grosseira do tendão na inserção, é necessário definir ROIs menores. - Importe imagens SHG para FIJI e defina a escala de pixel/comprimento. Projete dados de intensidade máxima de pixels em uma imagem composta 2D e adicione ROIs ao ROI Manager. Sobreponha sequencialmente cada ROI do CTF na imagem e desenhe 10 pequenas sub-ROIs de tamanho consistente dentro da ROI, adicionando as sub-ROIs ao gerenciador de ROI.
- Dentro de cada sub-ROI, execute o plugin de direcionalidade no FIJI para calcular a dispersão da fibra. Dados médios de dispersão entre sub-ROIs dentro de cada ROI de CTF e dados de dispersão média dentro de cada ROI de CTF em seções de cada explante. Realizar comparações estatísticas pareadas entre grupos de membros contralaterais.
Resultados
Imagens representativas de cortes de tecido corados com TUNEL demonstram núcleos apoptóticos mínimos dentro do corpo do tendão de Aquiles após 7 dias de cultura de explantes em todos os grupos experimentais (Figura 2A). A quantificação dessas imagens fornece evidências de que o protocolo de cultura de tecidos mantém até 78% de viabilidade em média dentro do tendão de Aquiles após 7 dias de cultura de explantes em condições de carregamento (Figura 2B
Discussão
A plataforma experimental de explante de membro posterior murino pareada com o protocolo de cultura de tecidos descrito neste estudo fornece um modelo adequado para o estudo da mecanobiologia da formação de fibrocartilagem impulsionada pelo impacto na inserção do tendão de Aquiles. A utilidade deste modelo de explante é demonstrada pelos resultados representativos, que indicam manutenção da viabilidade celular concomitante com mudança significativa e espacialmente heterogênea na coloração com azul de toluidin...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem o apoio e a assistência fornecidos por Jeff Fox e Vidya Venkatramani do Núcleo de Histologia, Bioquímica e Imagem Molecular (HBMI) do Centro de Pesquisa Musculoesquelética da Universidade de Rochester, financiado em parte pela P30AR06965. Além disso, os autores gostariam de agradecer ao Center for Light Microscopy and Nanoscopy (CALMN) do University of Rochester Medical Center pelo auxílio com microscopia multifóton. O presente estudo foi financiado por R01 AR070765 e R01 AR070765-04S1, bem como 1R35GM147054 e 1R01AR082349.
Materiais
| Name | Company | Catalog Number | Comments |
| Absorbent underpads | VWR | 82020-845 | For benchtop dissection |
| Acrylic bath | Source One | X001G46CB1 | Contains the explant platform submerged in culture media |
| Autoclave bin | Thermo Scientific | 13-361-20 | Used as secondary containment, holds two platforms |
| Base | - | - | 3D printed from CAD files provided as Supplementary Files |
| Braided line | KastKing | 30lb test | Used to wrap around paw and apply ankle dorsiflexion |
| Clip | - | - | 3D printed from CAD files provided as Supplementary Files |
| Cover glass | Fisherbrand | 12-541-034 | Rectangular, No. 2, 50 mm x 24 mm |
| Cytoseal XYL | VWR | 8312-4 | Xylene-based mounting media for coverslipping Toluidine blue stained tissue sections |
| Dexamethasone | MP Biomedical LLC | 194561 | CAS#50-02-2 |
| Dimethyl sulfoxide (DMSO), anhydrous | Invitrogen by ThermoFisher | D12345 | CAS#67-68-5, use to solubilize dexamethasone into concentrated stock solutions |
| Double-sided tape | Scotch Brand | 34-8724-5195-9 | To attach sandpaper to Grip platens |
| Dulbecco's Modified Eagle Medium (1X DMEM) | Gibco by ThermoFisher | 11965092 | high glucose, (-) pyruvate, (+) glutamine |
| EDTA tetrasodium salt dihydrate | Thermo Scientific Chemicals | J15700.A1 | CAS#10378-23-1, used to make 14% EDTA solution for sample decalcifcation |
| Ethanol, 200 proof | Thermo Scientific | T038181000 | CAS#64-17-5, 1 L supply |
| Foam biopsy pads | Leica | 3801000 | Used with processing cassettes, help hold ankle joints in desired position during fixation and decalcification |
| Forceps, #SS Standard Inox | Dumont | 11203-23 | Straight, smooth, fine tips |
| Forceps, Micro-Adson 4.75" | Fisherbrand | 13-820-073 | Straight, fine tips with serrated teeth |
| Garnet Sandpaper, 50-D Grit | Norton | M600060 01518 | Or other coarse grit sandpaper |
| Glacial acetic acid | Fisher Chemical | A38S-500 | CAS#64-19-7, for adjusting pH of sodium acetate buffer used for Toluidine blue histology, as well as 14% EDTA decalcification solution |
| Grips | ADMET | GV-100NT-A4 | Stainless steel vice grips, screws and springs described in the protocol are included |
| Histobond Adhesive Microscope Slides | VWR | 16005-108 | Sagittal sections of hind limbs explants reliably adhere to these slides through all staining protocols |
| In situ Cell Death Detection Kit, TMR Red | Roche | 12156792910 | TUNEL assay |
| Labeling tape | Fisherbrand | 15-959 | Or any other labeling tape of preference |
| L-ascorbic acid | Sigma-Aldrich | A4544-100G | CAS#50-81-7, for culture media formulation |
| Neutral buffered formalin, 10% | Leica | 3800600 | For sample fixation, 5 gallon supply |
| Nunc petri dishes | Sigma-Aldrich | P7741-1CS | 100 mm diameter x 25 mm height, maintain explants submerged in 70 mL of culture media as described in protocol |
| Penicillin-streptomycin (100X) | Gibco by ThermoFisher | 15140122 | Add 5 mL to 500 mL 1X DMEM for 1% v/v (1X) working concentration |
| Polylactic acid (PLA) 1.75 mm filament | Hatchbox | - | Choose filament diameter compatible with your 3D printer extruder, in color of choice. |
| Processing cassettes | Leica | 3802631 | For fixation, decalcification and paraffin embedding |
| Prolong Gold Antifade Reagent with DAPI | Invitrogen by ThermoFisher | P36931 | Mounting media for coverslipping tissue sections after TUNEL |
| Proteinase K | Fisher BioReagents | BP1700-50 | CAS#39450-01-6, used for antigen retrieval in TUNEL protocol |
| Scissors, Fine | FST | 14094-11 | Straight, sharp |
| Slide Staining Set, 12-place | Mercedes Scientific | MER 1011 | Rack with 12 stain dishes and slide dippers for Toluidine blue histology |
| Sodium acetate, anhydrous | Thermo Scientific Chemicals | A1318430 | CAS#127-09-3, used to make buffer for Toluidine blue histology |
| Tissue-Tek Accu-Edge Low Profile Microtome Blades | VWR | 25608-964 | For paraffin sectioning |
| Toluidine Blue O | Thermo Scientific Chemicals | 348601000 | CAS#92-31-9 |
| Volume Reduction Insert | - | - | 3D printed from CAD files provided as Supplementary Files |
| Xylenes | Leica | 3803665 | 4 gallon supply for histological staining |
Referências
- Cook, J. L., Purdam, C. Is compressive load a factor in the development of tendinopathy. Br J Sports Med. 46 (3), 163-168 (2012).
- Benjamin, M., Qin, S., Ralphs, J. R. Fibrocartilage associated with human tendons and their pulleys. J Anat. 187 (Pt 3), 625-633 (1995).
- Benjamin, M., Ralphs, J. R. Fibrocartilage in tendons and ligaments - an adaptation to compressive load. J Anat. 193 (4), 481-494 (1998).
- Benjamin, M., Theobald, P., Suzuki, D., Toumi, H. The anatomy of the Achilles tendon. The Achilles Tendon. 3, 5-16 (2007).
- Chimenti, R. L., et al. Insertional achilles tendinopathy associated with altered transverse compressive and axial tensile strain during ankle dorsiflexion. J Orthop Res. 35 (4), 910-915 (2017).
- Mora, K. E., et al. Ultrasound strain mapping of the mouse Achilles tendon during passive dorsiflexion. J Biomech. 132, 110920 (2022).
- Pringels, L., et al. Intratendinous pressure changes in the Achilles tendon during stretching and eccentric loading: Implications for Achilles tendinopathy. Scand J Med Sci Sports. 33 (5), 619-630 (2023).
- Koob, T. J., Vogel, K. G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. J Orthop Res. 5 (3), 414-424 (1987).
- Vogel, K. G., Koob, T. J. Structural specialization in tendons under compression. Int Rev Cytol. 115, 267-293 (1989).
- Vogel, K. G., Ordög, A., Pogány, G., Oláh, J. Proteoglycans in the compressed region of human tibialis posterior tendon and in ligaments. J Orthop Res. 11 (1), 68-77 (1993).
- Vogel, K. G., Sandy, J. D., Pogány, G., Robbins, J. R. Aggrecan in bovine tendon. Matrix Biol. 14 (2), 171-179 (1994).
- Robbins, J. R., Vogel, K. G. Regional expression of mRNA for proteoglycans and collagen in tendon. Eur J Cell Biol. 64 (2), 264-270 (1994).
- Vogel, K., Gordon, S. I., Blair, S. J., Fine, L. J. . Repetitive motion disorders of the upper extremity. , (1995).
- Benjamin, M., Tyers, R. N., Ralphs, J. R. Age-related changes in tendon fibrocartilage. J Anat. 179, 127-136 (1991).
- Ralphs, J. R., Benjamin, M., Thornett, A. Cell and matrix biology of the suprapatella in the rat: a structural and immunocytochemical study of fibrocartilage in a tendon subject to compression. Anat Rec. 231 (2), 167-177 (1991).
- Rufai, A., Benjamin, M., Ralphs, J. R. Development and ageing of phenotypically distinct fibrocartilages associated with the rat Achilles tendon. Anat Embryol (Berl). 186 (6), 611-618 (1992).
- Rufai, A., Ralphs, J. R., Benjamin, M. Ultrastructure of fibrocartilages at the insertion of the rat Achilles tendon. J Anat. 189 (Pt 1), 185-191 (1996).
- Waggett, A. D., Ralphs, J. R., Kwan, A. P. L., Woodnutt, D., Benjamin, M. Characterization of collagens and proteoglycans at the insertion of the human achilles tendon. Matrix Biol. 16 (8), 457-470 (1998).
- Ralphs, J., et al. Regional differences in cell shape and gap junction expression in rat Achilles tendon: relation to fibrocartilage differentiation. J Anat. 193 (pt 2), 215-222 (1998).
- Milz, S., et al. Three-dimensional reconstructions of the Achilles tendon insertion in man. J Anat. 200 (Pt 2), 145-152 (2002).
- Tischer, T., Milz, S., Maier, M., Schieker, M., Benjamin, M. An immunohistochemical study of the rabbit suprapatella, a sesamoid fibrocartilage in the quadriceps tendon containing aggrecan. J Histochem Cytochem. 50 (7), 955-960 (2002).
- Esquisatto, M. A., Joazeiro, P. P., Pimentel, E. R., Gomes, L. The effect of age on the structure and composition of rat tendon fibrocartilage. Cell Biol Int. 31 (6), 570-577 (2007).
- Matuszewski, P. E., et al. Regional variation in human supraspinatus tendon proteoglycans: Decorin, biglycan, and aggrecan. Connect Tissue Res. 53 (5), 343-348 (2012).
- Buckley, M. R., Huffman, G. R., Iozzo, R. V., Birk, D. E., Soslowsky, L. J. The location-specific role of proteoglycans in the flexor carpi ulnaris tendon. Connect Tissue Res. 54 (6), 367-373 (2013).
- Gillard, G. C., Reilly, H. C., Bell-Booth, P. G., Flint, M. H. The influence of mechanical forces on the glycosaminoglycan content of the rabbit flexor digitorum profundus tendon. Connect Tissue Res. 7 (1), 37-46 (1979).
- Giori, N. J., Beaupre, G. S., Carter, D. R. Cellular shape and pressure may mediate mechanical control of tissue composition in tendons. J Orthop Res. 11 (4), 581-591 (1993).
- Wren, T. A., Beaupré, G. S., Carter, D. R. Mechanobiology of tendon adaptation to compressive loading through fibrocartilaginous metaplasia. J Rehabil Res Dev. 37 (2), 135-143 (2000).
- Malaviya, P., et al. An in vivo model for load-modulated remodeling in the rabbit flexor tendon. J Orthop Res. 18 (1), 116-125 (2000).
- Shim, J. W., Elder, S. H. Influence of Cyclic Hydrostatic Pressure on Fibrocartilaginous Metaplasia of Achilles Tendon Fibroblasts. Biomech Model Mechanobiol. 5 (4), 247-252 (2006).
- Koob, T. J., Clark, P. E., Hernandez, D. J., Thurmond, F. A., Vogel, K. G. Compression loading in vitro regulates proteoglycan synthesis by tendon fibrocartilage. Arch Biochem Biophys. 298 (1), 303-312 (1992).
- Evanko, S. P., Vogel, K. G. Proteoglycan Synthesis in Fetal Tendon Is Differentially Regulated by Cyclic Compression in Vitro. Arch Biochem Biophys. 307 (1), 153-164 (1993).
- Vogel, K. G. The effect of compressive loading on proteoglycan turnover in cultured fetal tendon. Connect Tissue Res. 34 (3), 227-237 (1996).
- Thornton, G. M., et al. Changes in mechanical loading lead to tendon specific alterations in MMP and TIMP expression: influence of stress deprivation and intermittent cyclic hydrostatic compression on rat supraspinatus and Achilles tendons. Br J Sports Med. 44 (10), 698-703 (2010).
- Robbins, J. R., Evanko, S. P., Vogel, K. G. Mechanical Loading and TGF-β Regulate Proteoglycan Synthesis in Tendon. Arch Biochem Biophys. 342 (2), 203-211 (1997).
- Docking, S., Samiric, T., Scase, E., Purdam, C., Cook, J. Relationship between compressive loading and ECM changes in tendons. Muscles Ligaments Tendons J. 3 (1), 7-11 (2013).
- Wang, X., et al. Aberrant TGF-β activation in bone tendon insertion induces enthesopathy-like disease. J Clin Invest. 128 (2), 846-860 (2018).
- Cong, G. T., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: Development and analysis of a novel murine model. J Orthop Res. 36 (10), 2780-2788 (2018).
- Liu, Y., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: development and analysis of a novel rat model. J Shoulder Elbow Surg. 31 (9), 1898-1908 (2022).
- Majima, T., et al. Compressive compared with tensile loading of medial collateral ligament scar in vitro uniquely influences mRNA levels for aggrecan, collagen type II, and collagenase. J Orthop Res. 18 (4), 524-531 (2000).
- Hopkins, C., et al. Critical review on the socio-economic impact of tendinopathy. Asia Pac J Sports Med, Arthrosc, Rehabil Technol. 4, 9-20 (2016).
- Scott, A., Ashe, M. C. Common tendinopathies in the upper and lower extremities. Curr Sports Med Rep. 5 (5), 233-241 (2006).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin Sports Med. 22 (4), 675-692 (2003).
- Bah, I., et al. Tensile mechanical changes in the Achilles tendon due to Insertional Achilles tendinopathy. J Mech Behav Biomed Mater. 112, 104031 (2020).
- Maffulli, N., Reaper, J., Ewen, S. W. B., Waterston, S. W., Barrass, V. Chondral Metaplasia in Calcific Insertional Tendinopathy of the Achilles Tendon. Clin J Sport Med. 16 (4), 329-334 (2006).
- Corps, A. N., et al. Increased expression of aggrecan and biglycan mRNA in Achilles tendinopathy. Rheumatology (Oxford). 45 (3), 291-294 (2006).
- Scott, A., et al. Increased versican content is associated with tendinosis pathology in the patellar tendon of athletes with jumper's knee. Scand J Med Sci Sports. 18 (4), 427-435 (2008).
- Attia, M., et al. Greater glycosaminoglycan content in human patellar tendon biopsies is associated with more pain and a lower VISA score. Br J Sports Med. 48 (6), 469-475 (2014).
- Kujala, U. M., Sarna, S., Kaprio, J. Cumulative Incidence of Achilles Tendon Rupture and Tendinopathy in Male Former Elite Athletes. Clin J Sport Med. 15 (3), 133-135 (2005).
- Corps, A. N., et al. Changes in matrix protein biochemistry and the expression of mRNA encoding matrix proteins and metalloproteinases in posterior tibialis tendinopathy. Ann Rheum Dis. 71 (5), 746-752 (2012).
- Neer, C. S. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 54 (1), 41-50 (1972).
- Bigliani, L. U., Ticker, J. B., Flatow, E. L., Soslowsky, L. J., Mow, V. C. The relationship of acromial architecture to rotator cuff disease. Clin Sports Med. 10 (4), 823-838 (1991).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current Concepts Review Update Insertional Achilles Tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Nicholson, C. W., Berlet, G. C., Lee, T. H. Prediction of the Success of Nonoperative Treatment of Insertional Achilles Tendinosis Based on MRI. Foot Ankle Int. 28 (4), 472-477 (2007).
- Lohrer, H., David, S., Nauck, T. Surgical treatment for achilles tendinopathy - a systematic review. BMC musculoskelet disord. 17 (1), 207 (2016).
- McGarvey, W. C., Palumbo, R. C., Baxter, D. E., Leibman, B. D. Insertional Achilles Tendinosis: Surgical Treatment Through a Central Tendon Splitting Approach. Foot Ankle Int. 23 (1), 19-25 (2002).
- Maffulli, N., et al. Surgery for chronic Achilles tendinopathy produces worse results in women. Disabil Rehabil. 30 (20-22), 1714-1720 (1714).
- Wunderli, S. L., Blache, U., Snedeker, J. G. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connect Tissue Res. 61 (3-4), 262-277 (2020).
- Dyment, N. A., et al. A brief history of tendon and ligament bioreactors: Impact and future prospects. J Orthop Res. 38 (11), 2318-2330 (2020).
- Screen, H. R. C., Berk, D. E., Kadler, K. E., Ramirez, F., Young, M. F. Tendon Functional Extracellular Matrix. J Orthop Res. 33 (6), 793-799 (2015).
- Theobald, P., et al. The functional anatomy of Kager's fat pad in relation to retrocalcaneal problems and other hindfoot disorders. J Anat. 208 (1), 91-97 (2006).
- Ghazzawi, A., Theobald, P., Pugh, N., Byrne, C., Nokes, L. Quantifying the motion of Kager's fat pad. J Orthop Res. 27 (11), 1457-1460 (2009).
- Malagelada, F., et al. Pressure changes in the Kager fat pad at the extremes of ankle motion suggest a potential role in Achilles tendinopathy. Knee Surg Sports Traumatol Arthrosc. 28 (1), 148-154 (2020).
- Shaw, H. M., Benjamin, M. Structure-function relationships of entheses in relation to mechanical load and exercise. Scand J Med Sci Sports. 17 (4), 303-315 (2007).
- Soslowsky, L. J., et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 30 (8), 1057-1063 (2002).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. J Shoulder Elbow Surg. 7 (4), 375-380 (1998).
- Croen, B. J., et al. Chronic subacromial impingement leads to supraspinatus muscle functional and morphological changes: Evaluation in a murine model. J Orthop Res. 39 (10), 2243-2251 (2021).
- Andarawis-Puri, N., Flatow, E. L. Tendon fatigue in response to mechanical loading. J Musculoskelet Neuronal Interact. 11 (2), 106-114 (2011).
- Gains, C. C., Giannapoulos, A., Zamboulis, D. E., Lopez-Tremoleda, J., Screen, H. R. C. Development and application of a novel in vivo overload model of the Achilles tendon in rat. J Biomech. 151, 111546 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Pedaprolu, K., Szczesny, S. E. A Novel, Open-Source, Low-Cost Bioreactor for Load-Controlled Cyclic Loading of Tendon Explants. J Biomech Eng. 144 (8), 084505 (2022).
- Orishimo, K. F., et al. Effect of Knee Flexion Angle on Achilles Tendon Force and Ankle Joint Plantarflexion Moment During Passive Dorsiflexion. J Foot Ankle Surg. 47 (1), 34-39 (2008).
- Liu, C. L., et al. Influence of different knee and ankle ranges of motion on the elasticity of triceps surae muscles, Achilles tendon, and plantar fascia. Sci Rep. 10 (1), 6643 (2020).
- Cruz-Montecinos, C., et al. Soleus muscle and Achilles tendon compressive stiffness is related to knee and ankle positioning. J Electromyogr Kinesiol. 66, 102698 (2022).
- Connizzo, B. K., Grodzinsky, A. J. Lose-dose administration of dexamethasone is beneficial in preventing secondary tendon damage in a stress-deprived joint injury explant model. J Orthop Res. 38 (1), 139-149 (2020).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biol. 89, 11-26 (2020).
- Yabusaki, K., et al. A Novel Quantitative Approach for Eliminating Sample-To-Sample Variation Using a Hue Saturation Value Analysis Program. PloS one. 9 (3), e89627 (2014).
- Gao, J., Messner, K., Ralphs, J. R., Benjamin, M. An immunohistochemical study of enthesis development in the medial collateral ligament of the rat knee joint. Anat Embryol. 194 (4), 399-406 (1996).
- Han, S. K., Wouters, W. A. J., Clark, A., Herzog, W. Mechanically induced calcium signaling in chondrocytes in situ. J Orthop Res. 30 (3), 475-481 (2012).
- Han, W., et al. Impact of cellular microenvironment and mechanical perturbation on calcium signalling in meniscus fibrochondrocytes. Eur Cell Mater. 27, 321-331 (2014).
- Rossetti, L., et al. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 16 (6), 664-670 (2017).
- Sartori, J., Köhring, S., Witte, H., Fischer, M. S., Löffler, M. Three-dimensional imaging of the fibrous microstructure of Achilles tendon entheses in Mus musculus. J Anat. 233 (3), 370-380 (2018).
- Eliasberg, C. D., et al. Identification of Inflammatory Mediators in Tendinopathy Using a Murine Subacromial Impingement Model. J Orthop Res. 37 (12), 2575-2582 (2019).
- Zhang, Y., et al. Expression of alarmins in a murine rotator cuff tendinopathy model. J Orthop Res. 38 (11), 2513-2520 (2020).
- Zhang, X., et al. Assessment of Mitochondrial Dysfunction in a Murine Model of Supraspinatus Tendinopathy. J Bone Joint Surg. Am. 103 (2), 174-183 (2021).
- Liu, Y., et al. The role of Indian Hedgehog Signaling in tendon response to subacromial impingement: evaluation using a mouse model. Am J Sports Med. 50 (2), 362-370 (2022).
- Wang, T., et al. Load-induced regulation of tendon homeostasis by SPARC, a genetic predisposition factor for tendon and ligament injuries. Sci Transl Med. 13 (582), eabe5738 (2021).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nat Biomed Eng. 5 (12), 1457-1471 (2021).
- Jones, D. L., et al. Mechanoepigenetic regulation of extracellular matrix homeostasis via Yap and Taz. Proc Natl Acad Sci U S A. 120 (22), e2211947120 (2023).
- Connizzo, B. K., Grodzinsky, A. J. Release of pro-inflammatory cytokines from muscle and bone causes tenocyte death in a novel rotator cuff in vitro explant culture model. Connect Tissue Res. 59 (5), 423-436 (2018).
- Rees, S. G., et al. Catabolism of aggrecan, decorin and biglycan in tendon. Biochem J. 350 (Pt 1), 181-188 (2000).
- Samiric, T., Ilic, M. Z., Handley, C. J. Large aggregating and small leucine-rich proteoglycans are degraded by different pathways and at different rates in tendon. Eur J Biochem. 271 (17), 3612-3620 (2004).
- Rees, S. G., Curtis, C. L., Dent, C. M., Caterson, B. Catabolism of aggrecan proteoglycan aggregate components in short-term explant cultures of tendon. Matrix Biol. 24 (3), 219-231 (2005).
- Taye, N., Karoulias, S. Z., Hubmacher, D. The "other" 15-40%: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon. J Orthop Res. 38 (1), 23-35 (2020).
- Carvalho, H. F., Felisbino, S. L. The development of the pressure-bearing tendon of the bullfrog, Rana catesbeiana. Anat Embryol. 200 (1), 55-64 (1999).
- Carvalho, H. F., Felisbino, S. L., Covizi, D. Z., Della Colleta, H. H., Gomes, L. Structure and proteoglycan composition of specialized regions of the elastic tendon of the chicken wing. Cell Tissue Res. 300 (3), 435-446 (2000).
- van Sterkenburg, M. N., Kerkhoffs, G. M., Kleipool, R. P., Niek van Dijk, C. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study. J Anat. 218 (3), 336-341 (2011).
- Lee, A. H., Elliott, D. M. Comparative multi-scale hierarchical structure of the tail, plantaris, and Achilles tendons in the rat. J Anat. 234 (2), 252-262 (2019).
- Lee, A. H., Elliott, D. M. Multi-Scale Loading and Damage Mechanisms of Plantaris and Rat Tail Tendons. J Orthop Res. 37 (8), 1827-1837 (2019).
- Fan, H. M., Shrestha, L., Guo, Y., Tao, H. R., Sun, Y. L. The twisted structure of the rat Achilles tendon. J Anat. 239 (5), 1134-1140 (2021).
- Cutlip, R. G., Stauber, W. T., Willison, R. H., McIntosh, T. A., Means, K. H. Dynamometer for rat plantar flexor muscles in vivo. Med Biol Eng Comput. 35 (5), 540-543 (1997).
- Rijkelijkhuizen, J. M., Baan, G. C., de Haan, A., de Ruiter, C. J., Huijing, P. A. Extramuscular myofascial force transmission for in situ rat medial gastrocnemius and plantaris muscles in progressive stages of dissection. J Exp Biol. 208 (Pt 1), 129-140 (2005).
- Saxena, A., Bareither, D. Magnetic Resonance and Cadaveric Findings of the Incidence of Plantaris Tendon. Foot Ankle Int. 21 (7), 570-572 (2000).
- dos Santos, M. A., Bertelli, J. A., Kechele, P. R., Duarte, H. Anatomical study of the plantaris tendon: reliability as a tendo-osseous graft. Surg Radiol Anat. 31 (1), 59-61 (2009).
- Sartori, J., Köhring, S., Bruns, S., Moosmann, J., Hammel, J. U. Gaining Insight into the Deformation of Achilles Tendon Entheses in Mice. Adv Eng Mater. 23 (11), 2100085 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados