Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Maus-Hintergliedmaßen-Explantatmodell zur Untersuchung der Mechanobiologie des Achillessehnen-Impingements
In diesem Artikel
Zusammenfassung
Wir stellen eine maßgeschneiderte experimentelle Plattform und ein Gewebekulturprotokoll vor, das fibroknorpelige Veränderungen nachbildet, die durch das Impingement der Achillessehneninsertion in murinen Hintergliedmaßenexplantaten mit anhaltender Zelllebensfähigkeit verursacht werden, und so ein Modell für die Erforschung der Mechanobiologie des Sehnenimpingements bietet.
Zusammenfassung
Das Auftreffen der Sehne auf den Knochen erzeugt eine multiaxiale mechanische Dehnungsumgebung mit deutlich erhöhter transversaler Kompressionsdehnung, die einen lokalisierten Faserknorpelphänotyp hervorruft, der durch die Akkumulation von Glykosaminoglykan (GAG)-reicher Matrix und den Umbau des Kollagennetzwerks gekennzeichnet ist. Während Faserknorpel ein normales Merkmal in eingedrückten Regionen gesunder Sehnen ist, sind übermäßige GAG-Ablagerungen und Desorganisation des Kollagennetzwerks charakteristische Merkmale der Tendinopathie. Dementsprechend ist das Impingement klinisch als wichtiger extrinsischer Faktor bei der Initiierung und dem Fortschreiten der Tendinopathie anerkannt. Dennoch ist die Mechanobiologie, die dem Sehnenimpingement zugrunde liegt, noch wenig erforscht. Frühere Bemühungen, die zelluläre Reaktion auf Sehnenimpingement aufzuklären, haben die Zellen einachsig komprimiert und Sehnenexplantaten in vitro exzidiert. Isolierten Zellen fehlt jedoch eine dreidimensionale extrazelluläre Umgebung, die für die Mechanoreaktion entscheidend ist, und sowohl in vitro als auch in exzidierten Explantatsstudien ist es nicht möglich, die multiaxiale Belastungsumgebung zu rekapitulieren, die durch das Sehnenimpingement in vivo erzeugt wird, was von den anatomischen Merkmalen der impingierten Region abhängt. Darüber hinaus fehlt in vivo Modellen des Sehnenimpingements die Kontrolle über die mechanische Dehnungsumgebung. Um diese Einschränkungen zu überwinden, stellen wir ein neuartiges Maus-Explantatmodell der Hintergliedmaßen vor, das für die Untersuchung der Mechanobiologie des Achillessehnenimpingements geeignet ist. Dieses Modell hält die Achillessehne in situ , um die lokale Anatomie zu erhalten, und reproduziert die multiaxiale Belastungsumgebung, die durch das Auftreffen des Achillessehnenansatzes auf das Fersenbein während der passiv angelegten Knöcheldorsalflexion erzeugt wird, während die Zellen in ihrer natürlichen Umgebung erhalten bleiben. Wir beschreiben ein Gewebekulturprotokoll, das integraler Bestandteil dieses Modells ist, und präsentieren Daten, die eine anhaltende Explantatlebensfähigkeit über 7 Tage belegen. Die repräsentativen Ergebnisse zeigen eine verstärkte histologische GAG-Färbung und eine verminderte Kollagenfaserausrichtung als Folge des Impingements, was auf eine erhöhte Faserknorpelbildung hindeutet. Dieses Modell kann leicht angepasst werden, um verschiedene mechanische Belastungsregime zu untersuchen, und ermöglicht die Manipulation molekularer Signalwege von Interesse, um Mechanismen zu identifizieren, die phänotypische Veränderungen in der Achillessehne als Reaktion auf ein Impingement vermitteln.
Einleitung
Eine Vielzahl von Sehnen, darunter die Achillessehne und die Sehnen der Rotatorenmanschette, erleiden aufgrund der normalen anatomischen Positionierung ein knöchernes Impingement1,2,3,4. Das Sehnenauftreffen erzeugt eine Druckdehnung, die quer zur Faserlängsachse gerichtet ist5,6,7. Die Regionen des Sehnenimpingements zeigen einen einzigartigen Faserknorpel-Phänotyp, bei dem geschrumpfte, runde Zellen (Fibrochondrozyten) in ein desorganisiertes Kollagennetzwerk mit deutlich erhöhtem Glykosaminoglykan-Gehalt (GAG) eingebettet sind2,3,4,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24. Frühere Studien deuten darauf hin, dass die unterschiedliche mechanische Umgebung, die durch das Aufprallen der Sehne erzeugt wird, diese GAG-reiche Matrix aufrechterhält, indem sie die Ablagerung großer aggregierender Proteoglykane, vor allem Aggrecan, antreibt, obwohl die zugrunde liegenden Mechanismen unklar sind1,3,12,13,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39. Während Faserknorpel ein normales Merkmal in eingeklemmten Regionen gesunder Sehnen ist, ist ein aberranter Proteoglykanstoffwechsel, der mit einer übermäßigen Bildung von Faserknorpel einhergeht, ein charakteristisches Merkmal der Tendinopathie, einer häufigen und schwächenden Erkrankung, die überproportional häufig bei chronisch eingedrückten Sehnen auftritt1,40,41,42,43,44,45,46,47,48,49. Dementsprechend ist das Sehnenimpingement klinisch als wichtiger extrinsischer Faktor anerkannt, der mehrere der häufigsten Tendinopathien antreibt, darunter die Rotatorenmanschettenerkrankung und die insertionelle Achillessehnen-Tendinopathie (IAT)50,51,52. Derzeit ist die Behandlung der Tendinopathie ineffizient. Zum Beispiel benötigen etwa 47 % der Patienten mit IAT einen chirurgischen Eingriff nach einer fehlgeschlagenen konservativen Behandlung mit unterschiedlichen postoperativen Ergebnissen53,54,55,56. Trotz des offensichtlichen Zusammenhangs zwischen Impingement und Tendinopathie sind die mechanobiologischen Mechanismen, mit denen Zellen in eingeklemmten Sehnen ihre mechanische Umgebung wahrnehmen und darauf reagieren, nur unzureichend beschrieben, was das Verständnis der Pathogenese der Tendinopathie verdunkelt und zu einer unzureichenden Behandlung führt.
Explantatmodelle sind nützliche Werkzeuge bei der Untersuchung der Sehnenmechanobiologie 57,58. Als ersten Schritt zum Verständnis der Mechanobiologie des Sehnenimpingements haben mehrere frühere Studien die zelluläre Reaktion nach der Anwendung einer einfachen einachsigen Kompression auf Zellen oder exzidierten Sehnenexplantaten untersucht 27,29,30,31,32,33,34,39. In vitro fehlen den Zellen jedoch extrazelluläre und perizelluläre Matrizen, die den Stammtransfer erleichtern, wichtige Wachstumsfaktoren und Zytokine sequestrieren, die durch mechanische Verformung freigesetzt werden, und Substrat für fokale Adhäsionskomplexe liefern, die eine Rolle bei der Mechanotransduktion spielen57,59. Darüber hinaus ist es sowohl in vitro als auch in exzidierten Explantatsstudien nicht möglich, die multiaxiale mechanische Belastungsumgebung zu rekapitulieren, die durch das Sehnenimpingement in vivo erzeugt wird und von den anatomischen Merkmalen der impingierten Region abhängt 5,6. Im Zusammenhang mit dem eingeklemmten Achillessehnenansatz umfasst dies umliegende Gewebe wie den Schleimbeutel retrocalcaneus und das Kager'sche Fettpolster 60,61,62,63. Umgekehrt erlauben In-vivo-Modelle des Sehnenimpingements 25,28,36,37,38,64,65,66 eine minimale Kontrolle über das Ausmaß und die Häufigkeit der direkt auf die Sehne aufgebrachten Belastung, was eine anerkannte Einschränkung von In-vivo-Modellen zur Untersuchung der Sehnenmechanobiologie darstellt57,58,67,68,69,70. Angesichts der Herausforderungen bei der Messung der Sehnendehnung in vivo ist die in diesen Modellen erzeugte interne Dehnungsumgebung oft schlecht charakterisiert.
In diesem Manuskript stellen wir eine maßgeschneiderte experimentelle Plattform vor, die das Impingement des Ansatzes der Achillessehne auf das Fersenbein innerhalb ganzer muriner Hintergliedmaßen-Explantate nachbildet, die, wenn sie mit diesem Gewebekulturprotokoll gepaart wird, die Lebensfähigkeit über 7 Tage in Explantatskultur aufrechterhält und die Untersuchung der biologischen Folgen des Sehnenimpingements ermöglicht. Die Plattform basiert auf einer 3D-gedruckten Basis aus Polymilchsäure (PLA), die die Grundlage für die Befestigung der Griffe und des 3D-gedruckten PLA-Volumenreduzierungseinsatzes bildet. Die Griffe werden verwendet, um den Oberschenkel und das Knie proximal des myotendinösen Übergangs der Achillessehne mit dem kaudalen Aspekt der Hinterextremität nach oben zu klemmen, so dass die Achillessehne von oben mit einer Ultraschallsonde oder einem inversen Mikroskop abgebildet werden kann (Abbildung 1A). Der Volumenreduzierungseinsatz gleitet entlang einer Schiene auf der Basis und reduziert das benötigte Volumen der Gewebekulturmedien. Eine geflochtene Schnur, die um die Hinterpfote gewickelt ist, wird unter Verwendung des Basisdesigns und eines 3D-gedruckten PLA-Clips aus der Plattform geführt. Durch das Ziehen an der Sehne wird die Hinterpfote dorsalflexiert und der Achillessehnenansatz gegen das Fersenbein gedrückt, was zu einer erhöhten Querdruckbelastungführt 5,6 (Abbildung 1A). Die Plattform befindet sich in einem Acrylbad, das die Explantaten der Hintergliedmaßen in Gewebekulturmedien untergetaucht hält. Durch die Befestigung der gespannten Schnur an der Außenseite des Bades mit Klebeband wird die Dorsalflexion des Knöchels aufrechterhalten, um ein statisches Auftreffen des Achillessehnenansatzes zu erzeugen. CAD-Dateien für 3D-gedruckte Komponenten werden in mehreren Formaten zur Verfügung gestellt (Ergänzungsdatei 1), die den Import in eine Reihe von kommerzieller und kostenloser Open-Source-CAD-Software ermöglichen, um sie an experimentelle Anforderungen anzupassen. Wenn der Zugang zu 3D-Druckern für die Fertigung nicht verfügbar ist, können CAD-Dateien an Online-3D-Druckdienste weitergegeben werden, die die Teile kostengünstig drucken und versenden.
Wichtig ist, dass der Trizeps-Surae-Achilles-Muskelkomplex sowohl das Knie- als auch das Sprunggelenk umfasst 71,72,73. Folglich wird die Zugbelastung in der Achillessehne durch die Kniebeugung beeinflusst. Die Kniestreckung setzt die Achillessehne unter Spannung, während die Kniebeugung die Spannung reduziert. Durch die Streckung des Knies und die anschließende passive Dorsalflexion des Sprunggelenks können die Zugbelastungen am auftreffenden Ansatz mit den Zugbelastungen überlagert werden. Umgekehrt wird durch passives Dorsalflexieren des Knöchels mit gebeugtem Knie die Zugbelastung reduziert und die Druckbelastung bleibt bestehen. Das derzeitige Protokoll untersucht drei solcher Bedingungen. 1) Für ein statisches Impingement wird der Fuß auf < 110° in Bezug auf das Schienbein dorsalflexiert, um den Ansatz zu berühren, wobei das Knie gebeugt wird, um die Spannung zu reduzieren. 2) Bei der Baseline-Spannungsgruppe wird der Knöchel bei gestrecktem Knie über 145° Dorsalflexion gestreckt, wodurch beim Einsetzen überwiegend Zugdehnung erzeugt wird. 3) Für die unbelastete Gruppe werden die Explantate in einer Petrischale kultiviert, wobei sich Knie und Knöchel in neutraler Position befinden, ohne dass eine von außen aufgebrachte Last erfolgt. Die oben genannten Winkel werden fotografisch relativ zu einem Koordinatensystem gemessen, in dem Fuß und Schienbein in einem Winkel von 180° parallel und in einem Winkel von 90° senkrecht stehen.
Zu den wichtigsten Schritten des Protokolls gehören: 1) die Präparation der Explantaten der Hintergliedmaßen und die sorgfältige Entfernung der Haut und der Plantarissehne; 2) Explantatkultur nach einer 48-stündigen Dexamethason-Vorbehandlung; 3) Gewebeschnitt und histologische Färbung; und 4) Farbbildanalyse zur Beurteilung der Faserknorpelbildung. Nach der Sektion wird jedes Explantat der Hintergliedmaßen für 48 Stunden in Nährmedien vorbehandelt, die mit Dexamethason74 ergänzt wurden. Die kontralateralen Gliedmaßen jeder Maus werden für den paarweisen Vergleich in separate Versuchsgruppen eingeteilt, was zur Kontrolle der biologischen Variabilität beiträgt. Nach der Vorbehandlung werden die Explantaten wie oben beschrieben in Plattformen positioniert und für weitere 7 Tage kultiviert (Abbildung 1B). Zusätzliche Vergleiche werden mit einer vorbehandelten Gruppe (Tag 0) angestellt, in der die Explantaten unmittelbar nach der 48-stündigen Vorbehandlung entfernt werden.
Nach der Explantatkultur werden die Hintergliedmaßen beschnitten, Formalin fixiert, entkalkt und in Paraffin eingebettet. Der serielle Schnitt in sagittaler Ausrichtung ermöglicht die Visualisierung der Achillessehne vom myotendinösen Übergang bis zum Fersenbeinansatz und ermöglicht die Verfolgung der Schnitttiefe durch die gesamte Sehne. Die terminale Desoxynukleotidyltransferase (TdT)-vermittelte dUTP-X-Nick-Markierung (TUNEL) wird verwendet, um DNA-Schäden als Folge der Apoptose sichtbar zu machen und die Lebensfähigkeit zu beurteilen. Toluidinblau-Histologie und benutzerdefinierte Farbbildanalyse werden durchgeführt, um Veränderungen in der GAG-Färbung zu quantifizieren. Toluidinblau gefärbte Gewebeschnitte werden dann für die SHG-Bildgebung verwendet, um Veränderungen in der Organisation der Kollagenfasern zu charakterisieren (Abbildung 1B).
Die vorgelegten repräsentativen Ergebnisse deuten auf eine veränderte histologische Färbung der GAG-reichen Matrix und eine Desorganisation des extrazellulären Kollagennetzwerks hin, die durch 7-tägiges statisches Impingement innerhalb des Modells erzeugt wurde. Dieses Modell kann verwendet werden, um molekulare Mechanismen zu untersuchen, die der Impingement-getriebenen fibroknorpeligen Veränderung zugrunde liegen.
Protokoll
Alle Tierarbeiten wurden vom Komitee für Tierressourcen der Universität Rochester genehmigt.
1. Herstellung von Gewebekulturmedien
- Kultivieren Sie alle Explantate in Dulbecco's Modified Eagle Medium (1x DMEM) mit 1 % v/v Penicillin-Streptomycin und 200 μM L-Ascorbinsäure in einem Inkubator bei 37 °C und 5 %CO2. Für die anfängliche 48-stündige Vorbehandlung wird jedes Explantat in 70 ml Nährmedien kultiviert, die mit 100 nM Dexamethason74 ergänzt wurden. Nach der Vorbehandlung werden die Gliedmaßen für weitere 7 Tage ohne Dexamethason kultiviert, wobei das Medium alle 48-72 Stunden gewechselt wird.
HINWEIS: Die Zugabe von Serum, wie z. B. fötalem Rinderserum, zu den Nährmedien wird in Übereinstimmung mit den Empfehlungen von Wunderli, Blache und Snedeker57 nicht empfohlen. Kurz gesagt, serumfreie Bedingungen repräsentieren besser die avaskuläre, nährstoffarme Sehnenmikroumgebung, die in vivo existiert. Darüber hinaus kann eine Serumsupplementierung den Gewebeabbau unter bestimmten Kulturbedingungen fördern75 und die Zellproliferation und -migration aus dem Gewebe stimulieren, beides Merkmale der Sehnenpathologie57. - Für die unbelastete Gruppe wird jedes Explantat in 70 ml Medien kultiviert. Für die Basislinien-Spannungs- und statischen Impingement-Gruppen benötigt jede Plattform etwa 125 ml Nährmedien, um die Gliedmaße unter Wasser zu halten. Dieses Volumen kann je nach Positionierung des Oberschenkels in den Griffen und 3D-Druckparametern, vor allem der Fülldichte, variieren.
2. Explantat-Dissektion und Dexamethason-Vorbehandlung
- Euthanasie von Mäusen durch CO2 - Inhalation und sekundäre Zervixluxation oder gemäß den institutionellen Richtlinien. Dieses Protokoll verwendet C57BL/6-Mäuse, die weniger als 1 Jahr alt sind. Die Größe der hinteren Gliedmaßen nimmt mit zunehmendem Alter zu und es kann schwierig werden, in die Griffe zu passen.
- Vor der Präparation werden 70 ml vorgewärmtes (37 °C) Nährmedium in eine Petrischale mit 100 mm (Durchmesser) x 25 mm (Höhe) in eine sterile biologische Sicherheitswerkbank (BSC) überführt. Fügen Sie Dexamethason hinzu, um eine Arbeitskonzentration von 100 nM zu erreichen.
- Die Dissektionen können auf dem Labortisch mit saugfähigen Unterlagen durchgeführt werden, wobei die Dissektion zügig durchlaufen wird, bevor die Explantaten der Hintergliedmaßen in die BSC übertragen werden. Stellen Sie die chirurgischen Instrumente zusammen, die für diese Sektion erforderlich sind, darunter eine glatte, gerade Pinzette mit feiner Spitze; gerade, feine Pinzette mit gezackten Zähnen; und eine gerade, scharfe, feine Schere.
- Für die Dissektion der Explantaten der Hintergliedmaßen wird die Maus in Rückenlage gelegt und das Hüftgelenk identifiziert. Machen Sie mit einer feinen Schere einen kleinen (5-10 mm) Schnitt durch die Haut, der den proximalen und vorderen (kranialen) Aspekt des Oberschenkels überlagert.
- Ziehen Sie den Schnitt auseinander, um sich auszudehnen, kneifen Sie den freiliegenden Oberschenkel mit den Fingern zusammen und ziehen Sie die Haut vorsichtig nach distal, um die Hintergliedmaße auf Höhe des Knöchels zu enthandschuhen. Führen Sie vorsichtig ein Scherenblatt entlang der dorsalen Seite des Fußes unter die Haut ein und machen Sie einen Schnitt, der sich bis zu den Zehen erstreckt. Ziehen Sie die Haut weiter distal, um sie vollständig zu entfernen.
- Positionieren Sie die Maus, um den Ansatz der Achillessehne auf der hinteren (kaudalen) Seite des Fersenbeins in der Nähe des Knöchels zu visualisieren. Proximal des Ansatzes der Achillessehne liegt die Plantarissehne direkt neben dem medialen Rand der Achillessehne und erstreckt sich distal in Richtung der plantaren Seite des Fußes, über die hintere Seite des Fersenbeins.
- Um die Plantarissehne zu entfernen, führen Sie vorsichtig eine Spitze der glatten, feinen Spitzenzange zwischen die beiden Sehnen ein und verlängern Sie die Spitze medial unter der Plantarissehne. Ziehen Sie die Spitze proximal und reißen Sie den Plantaris-Muskel durch. Greifen Sie mit einer feinen Spitze, gezackten Pinzette, greifen Sie das abgetrennte proximale Ende der Plantarissehne und ziehen Sie distal, um es zu entfernen.
- Am Hüftgelenk schneidest du mit einer feinen Schere durch das Becken und isolierst die Hintergliedmaße. Heble mit der Schere das verbleibende Becken ab und lege den Hüftkopf frei.
- Die Explantation der Hintergliedmaßen wird in die BSC und in die Schale mit den Zellkulturmedien mit Dexamethason überführt. Schieben Sie die Schale in den Inkubator und behandeln Sie sie für 48 Stunden.
3. Explantatkultur und Verladeplattformen
- Nach Abschluss der 48-stündigen Vorbehandlung ausreichende Mengen an Nährmedien vorwärmen (Abschnitt 1). Ab diesem Zeitpunkt wird den Nährmedien kein Dexamethason mehr zugesetzt. Zu diesem Zeitpunkt können Gliedmaßen aus der vorbehandelten Gruppe (Tag 0) fixiert, entkalkt und in Paraffin eingebettet werden, um sie später zu schneiden, zu färben und zu analysieren.
- Für die entladene Gruppe wird das Vorbehandlungsmedium abgesaugt und die Explantaten in frische Petrischalen übertragen, jeweils 70 ml Nährmedien hinzugefügt und in den Inkubator zurückgeführt.
- Für die Basislinien-Spannungs- und statischen Impingement-Gruppen sind Explantatsplattformen vorzubereiten. Schneiden Sie Schleifpapierstücke in ähnlicher Größe wie die Griffplatten zu. Schneiden Sie für die statische Aufprallgruppe Stücke einer geflochtenen Schnur mit einer Länge von etwa 18 Zoll ab und binden Sie einen losen Überhandknoten auf halber Höhe der Schnurlänge vor. Reißen Sie Stücke der Aluminiumfolie ab, um jedes Acrylbad abzudecken, und besprühen Sie es mit 70% Ethanol (EtOH). Übertragen Sie die Vorbereitungen auf die BSC.
- Jede Plattform enthält ein Acrylbad, einen Sockel, einen Einsatz zur Volumenreduzierung, einen Clip und Griffe. Jeder Griff enthält zwei Platten und drei verschiedene Arten von Schrauben, darunter eine M5 x 0,8 mm Gewinde x 10 mm lange Schraube, die die Griffe an der Basis befestigt; zwei M6 x 1 mm Gewinde x 20 mm lange Schrauben, die die Platten verlängern, um die Griffe zu klemmen; und vier M3 x 0,5 mm Gewinde x 14 mm lange Schrauben, die in Kombination mit vier Druckfedern die Platten zurückziehen, um die Griffe zu öffnen.
- Legen Sie alle Komponenten in sekundäre Behälter, die im Falle eines Lecks alle Nährmedien auffangen können. In ≥ 10%ige Bleichlösung eintauchen und mindestens 1 Stunde einweichen. Spülen Sie die Bleichlösung mit Leitungswasser ab (bei Bedarf autoklavieren) und begeben Sie sich in die BSC.
HINWEIS: Um Kontaminationen zu beheben, sollten Sie das gesamte Leitungswasser autoklavieren oder gereinigtes Wasser verwenden. In der Diskussion finden Sie weitere Tipps zum Umgang mit Kontaminationen. - Verwenden Sie die M3-Schrauben und Druckfedern, um die Platten an den Griffen zu befestigen, befestigen Sie die Griffe mit der M5-Schraube an der Basis und setzen Sie die M6-Schrauben ein, bis sie in die Platten eingreifen. Verwenden Sie doppelseitiges Klebeband, um Schleifpapier auf den Platten zu befestigen, und schließen Sie dann die Griffe, um die Haftung des Schleifpapiers auf den Platten zu fördern. Wiederholen Sie den Vorgang für alle Plattformen.
- Wenn Sie bereit sind, eine Plattform zu laden, öffnen Sie die Griffe vollständig und legen Sie mit einer Pinzette den Oberschenkel und das Knie zwischen die Platten, wobei die oberflächliche Oberfläche der Achillessehne nach oben zeigt (Abbildung 1A). Schließen Sie die Griffe locker, um sie vorsichtig an Ort und Stelle zu halten.
- Verwende eine Pinzette, um den freiliegenden Hüftkopf oder -fuß zu greifen, und manipuliere den Kniebeugewinkel, während du die Griffe allmählich schließt, um sie zu fixieren. Für die Basislinien-Spannungsgruppe dehnen Sie das Kniegelenk wie zuvor beschrieben. Wenn sich die Griffe bei gestrecktem Knie straffen, sollte sich der Knöchel auf natürliche Weise strecken. Für die statische Impingementgruppe beugen Sie das Kniegelenk zwischen den Griffen wie zuvor beschrieben.
- Für die statische Impingementgruppe legen Sie den Überhandknoten der Schnur um die distale Pfote und ziehen ihn fest. Führen Sie die Schnur durch einen Schlitz in der Basis, der sich unter dem Explantat befindet, und durch das Cliploch. Setzen Sie den Sockel in die Acrylwanne ein und befestigen Sie den Clip an der Oberkante der Badewanne (Abbildung 1A).
- Ziehen Sie die Schnur, um den Fuß auf mindestens 110° in Bezug auf das Schienbein zu beugen, und markieren Sie die Schnur mit einem Permanentmarker, wenn sie aus dem Clip austritt. Machen Sie ein Foto des Explantats in dieser Position, um später den Dorsalflexionswinkel zu quantifizieren (Abbildung 1A).
- Entfernen Sie den Sockel und befestigen Sie den Volumenreduzierungseinsatz, indem Sie entlang einer Schiene auf dem Sockel schieben. Setzen Sie den Sockel (jetzt am Volumenreduziereinsatz befestigt) wieder in das Acrylbad ein und positionieren Sie den Clip wieder an der oberen Kante. Ziehen Sie an der Schnur, um zum ursprünglichen Dorsalflexionswinkel zurückzukehren, indem Sie die markierte Schnur als Führung verwenden, und befestigen Sie die Schnur mit Klebeband an der Außenseite der Wanne, um die statische Dorsalflexion aufrechtzuerhalten.
- Für die Basislinien-Spannungsgruppe legen Sie einfach die Basis mit dem Volumenreduzierungseinsatz in das Acrylbad, sobald das Explantat zwischen den Griffen positioniert ist, und machen Sie ein Foto zur Quantifizierung des Dorsalflexionswinkels.
- Geben Sie 125 ml vorgewärmte (37 °C) Nährmedien zu jeder Plattform, um Explantaten einzutauchen. Decken Sie die Oberseite des Bades mit Aluminiumfolie ab, legen Sie sie in einen sekundären Behälter und gehen Sie in den Inkubator. Kultur für 7 zusätzliche Tage, Medienwechsel alle 48-72 h.
HINWEIS: Klebeband, das über die Oberseite der Badewanne gelegt wird, kann verhindern, dass PLA-Teile schwimmen.
4. Fixierung, Entkalkung und Paraffineinbettung
- Im Anschluss an die Explantatskultur werden die Zehennägel/distalen Zehen mit einer Schere gekürzt und der Oberschenkel proximal des myotendinösen Übergangs der Achillessehne abgeschnitten. Legen Sie jedes getrimmte Sprunggelenk in eine Verarbeitungskassette, die mit Schaumstoff-Biopsiepads ausgekleidet ist. Drücken Sie den Knöchel in die Kassettenecke, um den Knöchel in einem Winkel von ca. 90° Dorsalflexion zu positionieren, und schließen Sie die Kassette, um sie an Ort und Stelle zu halten.
- 3 Tage lang in 10 % neutralem gepuffertem Formalin (NBF) fixieren und 2 Wochen lang in 14%iger Ethylendiamentetraessigsäure (EDTA) entkalken, gelöst in destilliertem Wasser (diH2O) mit pH-Wert von 7,4-7,6 mit Eisessig.
- Um Salze zu entfernen, spülen Sie die Proben dreimal gründlich in 1x phosphatgepufferter Kochsalzlösung (PBS), gefolgt von diH2O, jeweils 5 Minuten. Führen Sie eine routinemäßige Probenverarbeitung für die Paraffinhistologie durch: Dehydrieren Sie durch eine abgestufte Reihe von EtOH, klären Sie es in Xylol und infiltrieren Sie es mit Paraffinwachs. Orientieren und betten Sie die Proben in Paraffin ein, um sagittale Gewebeschnitte durch die Achillessehne bei medialer zu lateraler Progression zu erhalten, wie in Abschnitt 5 unten beschrieben (Abbildung 1B).
5. Gewebe schneiden
- Schneiden Sie mit einem Mikrotom vorsichtig in die Probe ein, bis die Abschnitte parallel zur Blockfläche verlaufen. Schneiden Sie den Knöchel von der medialen Seite des Gelenks aus grob ab und stoppen Sie, bevor Sie die mediale Grenze des Achillessehnenansatzes erreichen.
- Übertragen Sie die Probe auf einen Eisblock, um Temperatur und Hydratation anzupassen, und wechseln Sie die Klingen (oder wechseln Sie zu einem neuen Abschnitt der aktuellen Klinge). Fahren Sie mit dem Schnitt in die Probe mit einer Dicke von 10 μm fort und identifizieren Sie vorsichtig den Eintritt in den Achillessehnenansatz mit einem Hellfeldmikroskop. Nach der Identifizierung führen Sie eine serielle Schnittverfolgung durch, die die Abschnittsnummer (d. h. die Gewebetiefe) durch den gesamten Achillessehnenansatz verfolgt.
6. Entparaffinierung/Rehydrierung und Objektträgerauswahl
- Wählen Sie für jeden der folgenden Assays Gewebeschnitte aus jedem Paar kontralateraler Gliedmaßen aus. Vor dem Färben auf ein Objektträgergestell legen und jeweils 5 Minuten durch 3 Wechsel von Xylol, 2 Wechsel von 100 % EtOH, 2 Wechsel von 95 % EtOH und 1 Wechsel von 70 % EtOH führen. Beenden Sie die Rehydrierung in diH2O.
7. TUNEL zur Beurteilung der Lebensfähigkeit der Achillessehne
- Für die TUNEL-Etikettierung nach dem Protokoll des Herstellers beizen. In 20 μg/ml Proteinase K für 20 min bei Raumtemperatur inkubieren und indiH2O spülen. In 50 μl TUNEL-Färbelösung (5 μl Enzymlösung, 45 μl Markierungslösung) für 1 h bei 37 °C inkubieren. Spülen Sie in diH2O. Montieren Sie es mit einem Antifade-Reagenz, das DAPI und Deckglas enthält.
- Fotografieren Sie den Achillessehnenansatz mit einem Fluoreszenzmikroskop mit einer 4-fach-Objektivlinse. Fügen Sie einen DAPI-Kanal (Anregungs-/Emissionswellenlängen = 360/460 nm) zur Visualisierung aller Kerne, einen TUNEL-Kanal (TMR Red) (Anregungs-/Emissionswellenlängen = 540/580 nm) zur Visualisierung apoptotischer Kerne und, wenn möglich, einen Hellfeldkanal hinzu.
- Importieren Sie Bilder für die Bildanalyse in eine Bildanalysesoftware, die für die ROI-basierte Verarbeitung geeignet ist, z. B. FIJI/ImageJ oder MATLAB. Definieren Sie eine Region of Interest (ROI), die die gesamte Achillessehne in der Ansicht umreißt (Abbildung 2A), wobei Zellen im Epitenon ausgeschlossen werden, die sehr anfällig für den Tod sind, der durch Dissektion und plötzliche Änderung der Umweltbedingungen verursacht wird, wenn sie in Kultur gegeben werden.
- Führen Sie dazu eine ROI-Auswahl in MATLAB durch, indem Sie das Hellfeldbild importieren und die Funktion drawpolygon() verwenden, um die Grenzen des Spannglieds zu verfolgen und einzuschließen. MATLAB erstellt ein Polygon-Objekt für den ROI, das dann auf die DAPI- und TUNEL-Kanalbilder angewendet werden kann, um Pixelintensitätsdaten außerhalb des ROI mit createMask() auszublenden, um nur Kerne innerhalb der Achillessehne zu analysieren.
- Importieren Sie die DAPI- und TUNEL-Kanalbilder und identifizieren Sie eine Fluoreszenzintensitätsschwelle für die Definition von apoptotischen (TUNEL+) Kernen, indem Sie auf die maximale Fluoreszenzintensität apoptotischer Kerne in nicht lebensfähigen Geweben wie Knochen, Muskeln oder Fett normalisieren, die zufällig im Gewebeschnitt erfasst werden. Sobald die Bilder maskiert sind, berechnen Sie den Anteil der apoptotischen Kerne (TUNEL+-Kerne/DAPI-Kerne) innerhalb der Achillessehne.
8. Toluidinblau-Histologie zur Charakterisierung der Faserknorpelbildung
- Nach der Rehydrierung (Abschnitt 6) wird das Objektträgergestell mit den auf das Niveau abgestimmten Gewebeschnitten von kontralateralen Explantagenpaaren auf 0,4 Gew.-% Toluidinblau O in 0,1 M Natriumacetatpuffer mit pH-Wert von 4,0 unter Verwendung von Eisessig übertragen. 10 min bei Raumtemperatur inkubieren, dann 3x in diH2O für jeweils 30 s spülen.
- Dehydrieren Sie durch drei Wechsel von 95 % EtOH und zwei Wechsel von 100 % EtOH, jeweils 30 s. Klären Sie durch drei Wechsel von Xylol, jeweils 1 Minute. Deckglas mit Eindeckmedium auf Xylolbasis.
- Erhalten Sie 24-Bit-RGB-Farbbilder (Rot-Blau-Grün) des Achillessehnenansatzes. Verwenden Sie für dieses Protokoll beispielsweise einen Adapter, um eine digitale Farbkamera an das Okular eines einfachen Hellfeldmikroskops mit einem 4-fach-Objektiv anzuschließen.
- Um Unterschiede in der Toluidinblau-Färbung innerhalb des kompressiven Sehnenfaserknorpels (CTF)16 am Achillessehnenansatz zu quantifizieren (Abbildung 3A,B), importieren Sie RGB-Bilder in eine Bildanalysesoftware, die in der Lage ist, mehrere ROIs zu definieren und zu verwalten. Zu den Optionen gehören die Auswahl- und ROI-Manager-Tools in FIJI/ImageJ oder die Bildverarbeitungs-Toolbox in MATLAB. Beginnen Sie mit dem Festlegen der Pixel-/Längenskala.
HINWEIS: Die Wahl der Software liegt im Ermessen des Forschers und ist sicherlich nicht auf MATLAB oder FIJI/ImageJ beschränkt. Die Autoren haben MATLAB-Code (Ergänzungsdatei 2), eine Dokumentation zur Beschreibung der Implementierung (Ergänzungsdatei 3) und ein Beispielbild (Ergänzungsdatei 4) bereitgestellt. Wir ermutigen Forscher, diesen Code in alternative Programmiersprachen zu übersetzen, um ihn bei Bedarf oder bevorzugt in anderer Software zu verwenden. - Identifizieren Sie anhand des Bildes, das in der Software Ihrer Wahl angezeigt wird, den Schnittpunkt der tiefen Sehnengrenze mit dem Fersenbein. Von hier aus wird proximal 800 μm entlang der tiefen Sehnengrenze nachgezogen, um die tiefe Grenze der CTF zu ermitteln. Verwenden Sie beispielsweise die Funktion drawpolyline() in MATLAB, um interaktiv eine Polylinie über das RGB-Bild zu zeichnen. MATLAB erstellt ein Polylinienobjekt, das die Scheitelpunkte der Linie enthält, die verarbeitet und auf eine Länge von 800 μm getrimmt werden können.
- Erstellen Sie von dieser Position aus die proximale Begrenzung der CTF, indem Sie ein Liniensegment zeichnen, das mit der oberflächlichen Sehnengrenze verbunden ist, die senkrecht zur lokalen Faserausrichtung verläuft.
- Gehen Sie zurück zum Schnittpunkt der tiefen Sehnengrenze und des Fersenbeins und definieren Sie die distale Grenze der CTF, indem Sie ein Liniensegment zeichnen, das mit der oberflächlichen Sehnengrenze entlang der deutlichen Gezeitenmarke, die die CTF von der Ansatzzone Faserknorpel (AZF) trennt, verbunden ist (Abbildung 3A,B). Generieren Sie schließlich die oberflächliche Begrenzung des CTF, indem Sie die oberflächliche Sehnengrenze nachzeichnen, um sie einzuschließen.
- Um räumliche Variationen in der GAG-Färbung über die Insertion hinweg zu beschreiben, unterteilen Sie die gesamte CTF in 4 Quadranten (Abbildung 3A,B). Verbinden Sie den Mittelpunkt der tiefen und oberflächlichen CTF-Grenzen mit einem Liniensegment, um eine distale/proximale Begrenzung zu erstellen. Verbinden Sie durch den Mittelpunkt dieser Begrenzung die Mittelpunkte der distalen und proximalen CTF-Grenzen entlang der Faserorientierung, um eine oberflächliche/tiefe Grenze zu erstellen.
- Diese 6 Grenzen liefern Informationen, die verwendet werden können, um den ROI zu definieren, der den gesamten CTF darstellt, aber auch 4 Quadranten, die den CTF unterteilen. Kompilieren Sie z. B. in MATLAB Scheitelpunkte, die die Grenzen jedes einzelnen ROI (CTF, Quadranten 1-4) definieren, in Vektoren und verwenden Sie images.roi.Polygon(), um eingeschlossene Polygonobjekte für jeden ROI zu generieren.
- Wenn die ROIs definiert sind, transformieren Sie RGB-Pixeldaten in den Farbraum Hue-Saturation-Value (HSV) mit dem Farbtransformer-Plugin in FIJI, der Funktion rgb2hsv() in MATLAB oder einer anderen Software, die die entsprechenden Transformationsgleichungenanwendet 76. HSV-Daten können dann in den 2D-Farbtonsättigungsraum projiziert werden, wobei jede Kombination aus Farbton und Sättigung eine eindeutige Farbe kodiert (Abbildung 3C).
- Berechnen Sie innerhalb jedes ROI den durchschnittlichen Farbton und die Sättigung, die die durchschnittliche Farbe der Beize im ROI beschreiben. Dies kann z. B. in MATLAB erreicht werden, indem die Polygon-Objekte, die jede ROI definieren, verwendet werden, um das Bild mit createMask() zu maskieren, um Farbtonsättigungspixeldaten speziell innerhalb jeder ROI zu analysieren.
- Definieren Sie einen weiteren kleinen ROI innerhalb des periostalen Faserknorpels (PF)16 (Abbildung 3A, B) und berechnen Sie den durchschnittlichen Farbton und die Sättigung. Berechnen Sie dann den euklidischen Abstand, der die durchschnittliche Farbe in jedem ROI des CTF mit der des PF trennt (Abbildung 3C).
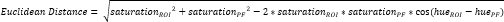
ANMERKUNG: Die euklidische Abstandsberechnung beschreibt den Grad der Ähnlichkeit zwischen der durchschnittlichen Farbe des ROI und der des PF, einem typischen faserknorpeligen Gewebe 16,17,77. Ein kleinerer euklidischer Abstand weist auf eine ROI-Farbe hin, die faserknorpeliger aussieht. - Verwenden Sie diesen Abstand, um den Faserknorpel-Score zu berechnen, der von einem Maximalwert von 1 ausgeht, wenn die ROI-Farbe mit der PF-Farbe identisch ist, und einem Minimalwert von -1, wenn ROI und PF-Farbe die maximale Trennung innerhalb des Farbraums mit Farbtonsättigung erreichen.
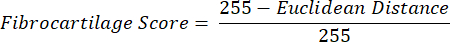
- Durchschnittliche Daten für Farbton, Sättigung und Faserknorpel-Score innerhalb jedes ROI über Gewebeschnitte von jeder Gliedmaße. Führen Sie paarweise statistische Vergleiche zwischen Gruppen kontralateraler Gliedmaßen durch.
9. SHG-Bildgebung zur Untersuchung der Veränderung der Kollagennetzwerkorganisation
- Führen Sie eine SHG-Bildgebung der mit Toluidinblau gefärbten Abschnitte mit einem leistungsfähigen Mikroskopsystem mit einer 20-fachen Objektlinse durch. Erfassen Sie Z-Stapel über die Querschnittsdicke und führen Sie bei Bedarf Kachelscans durch, um den Achillessehnenansatz vollständig zu erfassen.
- Importieren Sie SHG-Bilder in eine bevorzugte Bildanalysesoftware und definieren Sie ROIs, die die CTF am Achillessehnenansatz umfassen und unterteilen, wie für die Toluidinblau-Bildanalyse in Abschnitt 8 beschrieben (Abbildung 4A,B).
- Wenn SHG-Bilder in MATLAB importiert werden, verwenden Sie den in Abschnitt 8 beschriebenen Ansatz zum Definieren von CTF-ROIs in MATLAB. Nachdem Sie ROIs definiert haben, übertragen Sie ROI-Koordinaten in Fidschi, indem Sie ROI-Scheitelpunkte aus MATLAB als .txt-Dateien exportieren und mithilfe von File > Import > XY-Koordinaten in FIJI importieren. Überlagern Sie die Auswahl und senden Sie sie zur Analyse an den ROI-Manager.
- Um die Kollagenorganisation zu quantifizieren, verwenden Sie das Direktionalitäts-Plugin in FIJI, das eine Fourier-Spektrum-Analyse durchführt, um Verteilungen der Faserorientierungen über kleine Fenster zu berechnen, die einen ROI umfassen. Die Ausbreitung dieser Verteilung, die als Dispersion bezeichnet wird, steht in umgekehrtem Verhältnis zur Faserausrichtung.
HINWEIS: Kollagenfasern können in verschiedenen Fenstern im CTF aufgrund der groben Krümmung der Sehne und nicht aufgrund des Fehlens einer Ausrichtung/Organisation unterschiedliche Orientierungen annehmen. Um Veränderungen in der Kollagenorganisation besser von der groben Krümmung der Sehne am Ansatz unterscheiden zu können, ist es notwendig, kleinere ROIs zu definieren. - Importieren Sie SHG-Bilder in FIJI und legen Sie die Pixel-/Längenskala fest. Projizieren Sie Daten mit maximaler Pixelintensität in ein 2D-Composite-Bild und fügen Sie dem ROI-Manager ROIs hinzu. Überlagern Sie nacheinander jeden CTF-ROI mit dem Bild und zeichnen Sie 10 kleine Sub-ROIs von konsistenter Größe innerhalb des ROI, indem Sie die Sub-ROIs zum ROI-Manager hinzufügen.
- Führen Sie innerhalb jedes Sub-ROI das Direktionalitäts-Plugin in FIJI aus, um die Faserdispersion zu berechnen. Durchschnittliche Dispersionsdaten über Sub-ROIs innerhalb jedes CTF-ROI und durchschnittliche Dispersionsdaten innerhalb jedes CTF-ROI über Abschnitte aus jedem Explantat. Führen Sie paarweise statistische Vergleiche zwischen Gruppen kontralateraler Gliedmaßen durch.
Ergebnisse
Repräsentative Bilder von TUNEL-gefärbten Gewebeschnitten zeigen minimale apoptotische Kerne im Körper der Achillessehne nach 7 Tagen Explantatskultur in verschiedenen Experimentalgruppen (Abbildung 2A). Die Quantifizierung dieser Bilder liefert Hinweise darauf, dass das Gewebekulturprotokoll nach 7 Tagen Explantatskultur unter allen Belastungsbedingungen eine durchschnittliche Lebensfähigkeit von bis zu 78 % in der Achillessehne aufrechterhält (Abbildung 2B
Diskussion
Die experimentelle Explantatplattform der Hintergliedmaßen der Maus gepaart mit dem in dieser Studie beschriebenen Gewebekulturprotokoll stellt ein geeignetes Modell dar, um die Mechanobiologie der impingement-getriebenen Faserknorpelbildung am Achillessehnenansatz zu untersuchen. Die Nützlichkeit dieses Explantatmodells wird durch die repräsentativen Ergebnisse demonstriert, die auf eine Aufrechterhaltung der Zellviabilität bei gleichzeitiger signifikanter und räumlich heterogener Veränderung der Toluidinblau-Fär...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren sind dankbar für die Unterstützung und Hilfe von Jeff Fox und Vidya Venkatramani vom Center for Musculoskeletal Research's Histology, Biochemistry, and Molecular Imaging (HBMI) Core, der teilweise von P30AR06965 finanziert wird. Darüber hinaus danken die Autoren dem Center for Light Microscopy and Nanoscopy (CALMN) am University of Rochester Medical Center für die Unterstützung bei der Multiphotonenmikroskopie. Diese Studie wurde durch R01 AR070765 und R01 AR070765-04S1 sowie 1R35GM147054 und 1R01AR082349 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Absorbent underpads | VWR | 82020-845 | For benchtop dissection |
| Acrylic bath | Source One | X001G46CB1 | Contains the explant platform submerged in culture media |
| Autoclave bin | Thermo Scientific | 13-361-20 | Used as secondary containment, holds two platforms |
| Base | - | - | 3D printed from CAD files provided as Supplementary Files |
| Braided line | KastKing | 30lb test | Used to wrap around paw and apply ankle dorsiflexion |
| Clip | - | - | 3D printed from CAD files provided as Supplementary Files |
| Cover glass | Fisherbrand | 12-541-034 | Rectangular, No. 2, 50 mm x 24 mm |
| Cytoseal XYL | VWR | 8312-4 | Xylene-based mounting media for coverslipping Toluidine blue stained tissue sections |
| Dexamethasone | MP Biomedical LLC | 194561 | CAS#50-02-2 |
| Dimethyl sulfoxide (DMSO), anhydrous | Invitrogen by ThermoFisher | D12345 | CAS#67-68-5, use to solubilize dexamethasone into concentrated stock solutions |
| Double-sided tape | Scotch Brand | 34-8724-5195-9 | To attach sandpaper to Grip platens |
| Dulbecco's Modified Eagle Medium (1X DMEM) | Gibco by ThermoFisher | 11965092 | high glucose, (-) pyruvate, (+) glutamine |
| EDTA tetrasodium salt dihydrate | Thermo Scientific Chemicals | J15700.A1 | CAS#10378-23-1, used to make 14% EDTA solution for sample decalcifcation |
| Ethanol, 200 proof | Thermo Scientific | T038181000 | CAS#64-17-5, 1 L supply |
| Foam biopsy pads | Leica | 3801000 | Used with processing cassettes, help hold ankle joints in desired position during fixation and decalcification |
| Forceps, #SS Standard Inox | Dumont | 11203-23 | Straight, smooth, fine tips |
| Forceps, Micro-Adson 4.75" | Fisherbrand | 13-820-073 | Straight, fine tips with serrated teeth |
| Garnet Sandpaper, 50-D Grit | Norton | M600060 01518 | Or other coarse grit sandpaper |
| Glacial acetic acid | Fisher Chemical | A38S-500 | CAS#64-19-7, for adjusting pH of sodium acetate buffer used for Toluidine blue histology, as well as 14% EDTA decalcification solution |
| Grips | ADMET | GV-100NT-A4 | Stainless steel vice grips, screws and springs described in the protocol are included |
| Histobond Adhesive Microscope Slides | VWR | 16005-108 | Sagittal sections of hind limbs explants reliably adhere to these slides through all staining protocols |
| In situ Cell Death Detection Kit, TMR Red | Roche | 12156792910 | TUNEL assay |
| Labeling tape | Fisherbrand | 15-959 | Or any other labeling tape of preference |
| L-ascorbic acid | Sigma-Aldrich | A4544-100G | CAS#50-81-7, for culture media formulation |
| Neutral buffered formalin, 10% | Leica | 3800600 | For sample fixation, 5 gallon supply |
| Nunc petri dishes | Sigma-Aldrich | P7741-1CS | 100 mm diameter x 25 mm height, maintain explants submerged in 70 mL of culture media as described in protocol |
| Penicillin-streptomycin (100X) | Gibco by ThermoFisher | 15140122 | Add 5 mL to 500 mL 1X DMEM for 1% v/v (1X) working concentration |
| Polylactic acid (PLA) 1.75 mm filament | Hatchbox | - | Choose filament diameter compatible with your 3D printer extruder, in color of choice. |
| Processing cassettes | Leica | 3802631 | For fixation, decalcification and paraffin embedding |
| Prolong Gold Antifade Reagent with DAPI | Invitrogen by ThermoFisher | P36931 | Mounting media for coverslipping tissue sections after TUNEL |
| Proteinase K | Fisher BioReagents | BP1700-50 | CAS#39450-01-6, used for antigen retrieval in TUNEL protocol |
| Scissors, Fine | FST | 14094-11 | Straight, sharp |
| Slide Staining Set, 12-place | Mercedes Scientific | MER 1011 | Rack with 12 stain dishes and slide dippers for Toluidine blue histology |
| Sodium acetate, anhydrous | Thermo Scientific Chemicals | A1318430 | CAS#127-09-3, used to make buffer for Toluidine blue histology |
| Tissue-Tek Accu-Edge Low Profile Microtome Blades | VWR | 25608-964 | For paraffin sectioning |
| Toluidine Blue O | Thermo Scientific Chemicals | 348601000 | CAS#92-31-9 |
| Volume Reduction Insert | - | - | 3D printed from CAD files provided as Supplementary Files |
| Xylenes | Leica | 3803665 | 4 gallon supply for histological staining |
Referenzen
- Cook, J. L., Purdam, C. Is compressive load a factor in the development of tendinopathy. Br J Sports Med. 46 (3), 163-168 (2012).
- Benjamin, M., Qin, S., Ralphs, J. R. Fibrocartilage associated with human tendons and their pulleys. J Anat. 187 (Pt 3), 625-633 (1995).
- Benjamin, M., Ralphs, J. R. Fibrocartilage in tendons and ligaments - an adaptation to compressive load. J Anat. 193 (4), 481-494 (1998).
- Benjamin, M., Theobald, P., Suzuki, D., Toumi, H. The anatomy of the Achilles tendon. The Achilles Tendon. 3, 5-16 (2007).
- Chimenti, R. L., et al. Insertional achilles tendinopathy associated with altered transverse compressive and axial tensile strain during ankle dorsiflexion. J Orthop Res. 35 (4), 910-915 (2017).
- Mora, K. E., et al. Ultrasound strain mapping of the mouse Achilles tendon during passive dorsiflexion. J Biomech. 132, 110920 (2022).
- Pringels, L., et al. Intratendinous pressure changes in the Achilles tendon during stretching and eccentric loading: Implications for Achilles tendinopathy. Scand J Med Sci Sports. 33 (5), 619-630 (2023).
- Koob, T. J., Vogel, K. G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. J Orthop Res. 5 (3), 414-424 (1987).
- Vogel, K. G., Koob, T. J. Structural specialization in tendons under compression. Int Rev Cytol. 115, 267-293 (1989).
- Vogel, K. G., Ordög, A., Pogány, G., Oláh, J. Proteoglycans in the compressed region of human tibialis posterior tendon and in ligaments. J Orthop Res. 11 (1), 68-77 (1993).
- Vogel, K. G., Sandy, J. D., Pogány, G., Robbins, J. R. Aggrecan in bovine tendon. Matrix Biol. 14 (2), 171-179 (1994).
- Robbins, J. R., Vogel, K. G. Regional expression of mRNA for proteoglycans and collagen in tendon. Eur J Cell Biol. 64 (2), 264-270 (1994).
- Vogel, K., Gordon, S. I., Blair, S. J., Fine, L. J. . Repetitive motion disorders of the upper extremity. , (1995).
- Benjamin, M., Tyers, R. N., Ralphs, J. R. Age-related changes in tendon fibrocartilage. J Anat. 179, 127-136 (1991).
- Ralphs, J. R., Benjamin, M., Thornett, A. Cell and matrix biology of the suprapatella in the rat: a structural and immunocytochemical study of fibrocartilage in a tendon subject to compression. Anat Rec. 231 (2), 167-177 (1991).
- Rufai, A., Benjamin, M., Ralphs, J. R. Development and ageing of phenotypically distinct fibrocartilages associated with the rat Achilles tendon. Anat Embryol (Berl). 186 (6), 611-618 (1992).
- Rufai, A., Ralphs, J. R., Benjamin, M. Ultrastructure of fibrocartilages at the insertion of the rat Achilles tendon. J Anat. 189 (Pt 1), 185-191 (1996).
- Waggett, A. D., Ralphs, J. R., Kwan, A. P. L., Woodnutt, D., Benjamin, M. Characterization of collagens and proteoglycans at the insertion of the human achilles tendon. Matrix Biol. 16 (8), 457-470 (1998).
- Ralphs, J., et al. Regional differences in cell shape and gap junction expression in rat Achilles tendon: relation to fibrocartilage differentiation. J Anat. 193 (pt 2), 215-222 (1998).
- Milz, S., et al. Three-dimensional reconstructions of the Achilles tendon insertion in man. J Anat. 200 (Pt 2), 145-152 (2002).
- Tischer, T., Milz, S., Maier, M., Schieker, M., Benjamin, M. An immunohistochemical study of the rabbit suprapatella, a sesamoid fibrocartilage in the quadriceps tendon containing aggrecan. J Histochem Cytochem. 50 (7), 955-960 (2002).
- Esquisatto, M. A., Joazeiro, P. P., Pimentel, E. R., Gomes, L. The effect of age on the structure and composition of rat tendon fibrocartilage. Cell Biol Int. 31 (6), 570-577 (2007).
- Matuszewski, P. E., et al. Regional variation in human supraspinatus tendon proteoglycans: Decorin, biglycan, and aggrecan. Connect Tissue Res. 53 (5), 343-348 (2012).
- Buckley, M. R., Huffman, G. R., Iozzo, R. V., Birk, D. E., Soslowsky, L. J. The location-specific role of proteoglycans in the flexor carpi ulnaris tendon. Connect Tissue Res. 54 (6), 367-373 (2013).
- Gillard, G. C., Reilly, H. C., Bell-Booth, P. G., Flint, M. H. The influence of mechanical forces on the glycosaminoglycan content of the rabbit flexor digitorum profundus tendon. Connect Tissue Res. 7 (1), 37-46 (1979).
- Giori, N. J., Beaupre, G. S., Carter, D. R. Cellular shape and pressure may mediate mechanical control of tissue composition in tendons. J Orthop Res. 11 (4), 581-591 (1993).
- Wren, T. A., Beaupré, G. S., Carter, D. R. Mechanobiology of tendon adaptation to compressive loading through fibrocartilaginous metaplasia. J Rehabil Res Dev. 37 (2), 135-143 (2000).
- Malaviya, P., et al. An in vivo model for load-modulated remodeling in the rabbit flexor tendon. J Orthop Res. 18 (1), 116-125 (2000).
- Shim, J. W., Elder, S. H. Influence of Cyclic Hydrostatic Pressure on Fibrocartilaginous Metaplasia of Achilles Tendon Fibroblasts. Biomech Model Mechanobiol. 5 (4), 247-252 (2006).
- Koob, T. J., Clark, P. E., Hernandez, D. J., Thurmond, F. A., Vogel, K. G. Compression loading in vitro regulates proteoglycan synthesis by tendon fibrocartilage. Arch Biochem Biophys. 298 (1), 303-312 (1992).
- Evanko, S. P., Vogel, K. G. Proteoglycan Synthesis in Fetal Tendon Is Differentially Regulated by Cyclic Compression in Vitro. Arch Biochem Biophys. 307 (1), 153-164 (1993).
- Vogel, K. G. The effect of compressive loading on proteoglycan turnover in cultured fetal tendon. Connect Tissue Res. 34 (3), 227-237 (1996).
- Thornton, G. M., et al. Changes in mechanical loading lead to tendon specific alterations in MMP and TIMP expression: influence of stress deprivation and intermittent cyclic hydrostatic compression on rat supraspinatus and Achilles tendons. Br J Sports Med. 44 (10), 698-703 (2010).
- Robbins, J. R., Evanko, S. P., Vogel, K. G. Mechanical Loading and TGF-β Regulate Proteoglycan Synthesis in Tendon. Arch Biochem Biophys. 342 (2), 203-211 (1997).
- Docking, S., Samiric, T., Scase, E., Purdam, C., Cook, J. Relationship between compressive loading and ECM changes in tendons. Muscles Ligaments Tendons J. 3 (1), 7-11 (2013).
- Wang, X., et al. Aberrant TGF-β activation in bone tendon insertion induces enthesopathy-like disease. J Clin Invest. 128 (2), 846-860 (2018).
- Cong, G. T., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: Development and analysis of a novel murine model. J Orthop Res. 36 (10), 2780-2788 (2018).
- Liu, Y., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: development and analysis of a novel rat model. J Shoulder Elbow Surg. 31 (9), 1898-1908 (2022).
- Majima, T., et al. Compressive compared with tensile loading of medial collateral ligament scar in vitro uniquely influences mRNA levels for aggrecan, collagen type II, and collagenase. J Orthop Res. 18 (4), 524-531 (2000).
- Hopkins, C., et al. Critical review on the socio-economic impact of tendinopathy. Asia Pac J Sports Med, Arthrosc, Rehabil Technol. 4, 9-20 (2016).
- Scott, A., Ashe, M. C. Common tendinopathies in the upper and lower extremities. Curr Sports Med Rep. 5 (5), 233-241 (2006).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin Sports Med. 22 (4), 675-692 (2003).
- Bah, I., et al. Tensile mechanical changes in the Achilles tendon due to Insertional Achilles tendinopathy. J Mech Behav Biomed Mater. 112, 104031 (2020).
- Maffulli, N., Reaper, J., Ewen, S. W. B., Waterston, S. W., Barrass, V. Chondral Metaplasia in Calcific Insertional Tendinopathy of the Achilles Tendon. Clin J Sport Med. 16 (4), 329-334 (2006).
- Corps, A. N., et al. Increased expression of aggrecan and biglycan mRNA in Achilles tendinopathy. Rheumatology (Oxford). 45 (3), 291-294 (2006).
- Scott, A., et al. Increased versican content is associated with tendinosis pathology in the patellar tendon of athletes with jumper's knee. Scand J Med Sci Sports. 18 (4), 427-435 (2008).
- Attia, M., et al. Greater glycosaminoglycan content in human patellar tendon biopsies is associated with more pain and a lower VISA score. Br J Sports Med. 48 (6), 469-475 (2014).
- Kujala, U. M., Sarna, S., Kaprio, J. Cumulative Incidence of Achilles Tendon Rupture and Tendinopathy in Male Former Elite Athletes. Clin J Sport Med. 15 (3), 133-135 (2005).
- Corps, A. N., et al. Changes in matrix protein biochemistry and the expression of mRNA encoding matrix proteins and metalloproteinases in posterior tibialis tendinopathy. Ann Rheum Dis. 71 (5), 746-752 (2012).
- Neer, C. S. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 54 (1), 41-50 (1972).
- Bigliani, L. U., Ticker, J. B., Flatow, E. L., Soslowsky, L. J., Mow, V. C. The relationship of acromial architecture to rotator cuff disease. Clin Sports Med. 10 (4), 823-838 (1991).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current Concepts Review Update Insertional Achilles Tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Nicholson, C. W., Berlet, G. C., Lee, T. H. Prediction of the Success of Nonoperative Treatment of Insertional Achilles Tendinosis Based on MRI. Foot Ankle Int. 28 (4), 472-477 (2007).
- Lohrer, H., David, S., Nauck, T. Surgical treatment for achilles tendinopathy - a systematic review. BMC musculoskelet disord. 17 (1), 207 (2016).
- McGarvey, W. C., Palumbo, R. C., Baxter, D. E., Leibman, B. D. Insertional Achilles Tendinosis: Surgical Treatment Through a Central Tendon Splitting Approach. Foot Ankle Int. 23 (1), 19-25 (2002).
- Maffulli, N., et al. Surgery for chronic Achilles tendinopathy produces worse results in women. Disabil Rehabil. 30 (20-22), 1714-1720 (1714).
- Wunderli, S. L., Blache, U., Snedeker, J. G. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connect Tissue Res. 61 (3-4), 262-277 (2020).
- Dyment, N. A., et al. A brief history of tendon and ligament bioreactors: Impact and future prospects. J Orthop Res. 38 (11), 2318-2330 (2020).
- Screen, H. R. C., Berk, D. E., Kadler, K. E., Ramirez, F., Young, M. F. Tendon Functional Extracellular Matrix. J Orthop Res. 33 (6), 793-799 (2015).
- Theobald, P., et al. The functional anatomy of Kager's fat pad in relation to retrocalcaneal problems and other hindfoot disorders. J Anat. 208 (1), 91-97 (2006).
- Ghazzawi, A., Theobald, P., Pugh, N., Byrne, C., Nokes, L. Quantifying the motion of Kager's fat pad. J Orthop Res. 27 (11), 1457-1460 (2009).
- Malagelada, F., et al. Pressure changes in the Kager fat pad at the extremes of ankle motion suggest a potential role in Achilles tendinopathy. Knee Surg Sports Traumatol Arthrosc. 28 (1), 148-154 (2020).
- Shaw, H. M., Benjamin, M. Structure-function relationships of entheses in relation to mechanical load and exercise. Scand J Med Sci Sports. 17 (4), 303-315 (2007).
- Soslowsky, L. J., et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 30 (8), 1057-1063 (2002).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. J Shoulder Elbow Surg. 7 (4), 375-380 (1998).
- Croen, B. J., et al. Chronic subacromial impingement leads to supraspinatus muscle functional and morphological changes: Evaluation in a murine model. J Orthop Res. 39 (10), 2243-2251 (2021).
- Andarawis-Puri, N., Flatow, E. L. Tendon fatigue in response to mechanical loading. J Musculoskelet Neuronal Interact. 11 (2), 106-114 (2011).
- Gains, C. C., Giannapoulos, A., Zamboulis, D. E., Lopez-Tremoleda, J., Screen, H. R. C. Development and application of a novel in vivo overload model of the Achilles tendon in rat. J Biomech. 151, 111546 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Pedaprolu, K., Szczesny, S. E. A Novel, Open-Source, Low-Cost Bioreactor for Load-Controlled Cyclic Loading of Tendon Explants. J Biomech Eng. 144 (8), 084505 (2022).
- Orishimo, K. F., et al. Effect of Knee Flexion Angle on Achilles Tendon Force and Ankle Joint Plantarflexion Moment During Passive Dorsiflexion. J Foot Ankle Surg. 47 (1), 34-39 (2008).
- Liu, C. L., et al. Influence of different knee and ankle ranges of motion on the elasticity of triceps surae muscles, Achilles tendon, and plantar fascia. Sci Rep. 10 (1), 6643 (2020).
- Cruz-Montecinos, C., et al. Soleus muscle and Achilles tendon compressive stiffness is related to knee and ankle positioning. J Electromyogr Kinesiol. 66, 102698 (2022).
- Connizzo, B. K., Grodzinsky, A. J. Lose-dose administration of dexamethasone is beneficial in preventing secondary tendon damage in a stress-deprived joint injury explant model. J Orthop Res. 38 (1), 139-149 (2020).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biol. 89, 11-26 (2020).
- Yabusaki, K., et al. A Novel Quantitative Approach for Eliminating Sample-To-Sample Variation Using a Hue Saturation Value Analysis Program. PloS one. 9 (3), e89627 (2014).
- Gao, J., Messner, K., Ralphs, J. R., Benjamin, M. An immunohistochemical study of enthesis development in the medial collateral ligament of the rat knee joint. Anat Embryol. 194 (4), 399-406 (1996).
- Han, S. K., Wouters, W. A. J., Clark, A., Herzog, W. Mechanically induced calcium signaling in chondrocytes in situ. J Orthop Res. 30 (3), 475-481 (2012).
- Han, W., et al. Impact of cellular microenvironment and mechanical perturbation on calcium signalling in meniscus fibrochondrocytes. Eur Cell Mater. 27, 321-331 (2014).
- Rossetti, L., et al. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 16 (6), 664-670 (2017).
- Sartori, J., Köhring, S., Witte, H., Fischer, M. S., Löffler, M. Three-dimensional imaging of the fibrous microstructure of Achilles tendon entheses in Mus musculus. J Anat. 233 (3), 370-380 (2018).
- Eliasberg, C. D., et al. Identification of Inflammatory Mediators in Tendinopathy Using a Murine Subacromial Impingement Model. J Orthop Res. 37 (12), 2575-2582 (2019).
- Zhang, Y., et al. Expression of alarmins in a murine rotator cuff tendinopathy model. J Orthop Res. 38 (11), 2513-2520 (2020).
- Zhang, X., et al. Assessment of Mitochondrial Dysfunction in a Murine Model of Supraspinatus Tendinopathy. J Bone Joint Surg. Am. 103 (2), 174-183 (2021).
- Liu, Y., et al. The role of Indian Hedgehog Signaling in tendon response to subacromial impingement: evaluation using a mouse model. Am J Sports Med. 50 (2), 362-370 (2022).
- Wang, T., et al. Load-induced regulation of tendon homeostasis by SPARC, a genetic predisposition factor for tendon and ligament injuries. Sci Transl Med. 13 (582), eabe5738 (2021).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nat Biomed Eng. 5 (12), 1457-1471 (2021).
- Jones, D. L., et al. Mechanoepigenetic regulation of extracellular matrix homeostasis via Yap and Taz. Proc Natl Acad Sci U S A. 120 (22), e2211947120 (2023).
- Connizzo, B. K., Grodzinsky, A. J. Release of pro-inflammatory cytokines from muscle and bone causes tenocyte death in a novel rotator cuff in vitro explant culture model. Connect Tissue Res. 59 (5), 423-436 (2018).
- Rees, S. G., et al. Catabolism of aggrecan, decorin and biglycan in tendon. Biochem J. 350 (Pt 1), 181-188 (2000).
- Samiric, T., Ilic, M. Z., Handley, C. J. Large aggregating and small leucine-rich proteoglycans are degraded by different pathways and at different rates in tendon. Eur J Biochem. 271 (17), 3612-3620 (2004).
- Rees, S. G., Curtis, C. L., Dent, C. M., Caterson, B. Catabolism of aggrecan proteoglycan aggregate components in short-term explant cultures of tendon. Matrix Biol. 24 (3), 219-231 (2005).
- Taye, N., Karoulias, S. Z., Hubmacher, D. The "other" 15-40%: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon. J Orthop Res. 38 (1), 23-35 (2020).
- Carvalho, H. F., Felisbino, S. L. The development of the pressure-bearing tendon of the bullfrog, Rana catesbeiana. Anat Embryol. 200 (1), 55-64 (1999).
- Carvalho, H. F., Felisbino, S. L., Covizi, D. Z., Della Colleta, H. H., Gomes, L. Structure and proteoglycan composition of specialized regions of the elastic tendon of the chicken wing. Cell Tissue Res. 300 (3), 435-446 (2000).
- van Sterkenburg, M. N., Kerkhoffs, G. M., Kleipool, R. P., Niek van Dijk, C. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study. J Anat. 218 (3), 336-341 (2011).
- Lee, A. H., Elliott, D. M. Comparative multi-scale hierarchical structure of the tail, plantaris, and Achilles tendons in the rat. J Anat. 234 (2), 252-262 (2019).
- Lee, A. H., Elliott, D. M. Multi-Scale Loading and Damage Mechanisms of Plantaris and Rat Tail Tendons. J Orthop Res. 37 (8), 1827-1837 (2019).
- Fan, H. M., Shrestha, L., Guo, Y., Tao, H. R., Sun, Y. L. The twisted structure of the rat Achilles tendon. J Anat. 239 (5), 1134-1140 (2021).
- Cutlip, R. G., Stauber, W. T., Willison, R. H., McIntosh, T. A., Means, K. H. Dynamometer for rat plantar flexor muscles in vivo. Med Biol Eng Comput. 35 (5), 540-543 (1997).
- Rijkelijkhuizen, J. M., Baan, G. C., de Haan, A., de Ruiter, C. J., Huijing, P. A. Extramuscular myofascial force transmission for in situ rat medial gastrocnemius and plantaris muscles in progressive stages of dissection. J Exp Biol. 208 (Pt 1), 129-140 (2005).
- Saxena, A., Bareither, D. Magnetic Resonance and Cadaveric Findings of the Incidence of Plantaris Tendon. Foot Ankle Int. 21 (7), 570-572 (2000).
- dos Santos, M. A., Bertelli, J. A., Kechele, P. R., Duarte, H. Anatomical study of the plantaris tendon: reliability as a tendo-osseous graft. Surg Radiol Anat. 31 (1), 59-61 (2009).
- Sartori, J., Köhring, S., Bruns, S., Moosmann, J., Hammel, J. U. Gaining Insight into the Deformation of Achilles Tendon Entheses in Mice. Adv Eng Mater. 23 (11), 2100085 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten