Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de explante de extremidad posterior murina para el estudio de la mecanobiología del pinzamiento del tendón de Aquiles
En este artículo
Resumen
Presentamos una plataforma experimental personalizada y un protocolo de cultivo de tejidos que recrea el cambio fibrocartilaginoso impulsado por el pinzamiento de la inserción del tendón de Aquiles en explantes de extremidades posteriores murinas con viabilidad celular sostenida, proporcionando un modelo adecuado para explorar la mecanobiología del pinzamiento tendinoso.
Resumen
El pinzamiento tendinoso sobre el hueso genera un ambiente de deformación mecánica multiaxial con una deformación compresiva transversal marcadamente elevada, que provoca un fenotipo de fibrocartílago localizado caracterizado por la acumulación de matriz rica en glicosaminoglicanos (GAG) y la remodelación de la red de colágeno. Si bien el fibrocartílago es una característica normal en las regiones afectadas de tendones sanos, el exceso de depósito de GAG y la desorganización de la red de colágeno son características distintivas de la tendinopatía. En consecuencia, el pinzamiento se reconoce clínicamente como un factor extrínseco importante en el inicio y la progresión de la tendinopatía. Sin embargo, la mecanobiología que subyace al pinzamiento del tendón sigue siendo poco estudiada. Los esfuerzos anteriores para dilucidar la respuesta celular al pinzamiento del tendón han aplicado compresión uniaxial a las células y extirpado explantes de tendones in vitro. Sin embargo, las células aisladas carecen de un entorno extracelular tridimensional crucial para la mecanorespuesta, y tanto los estudios in vitro como los de explantes extirpados no logran recapitular el entorno de deformación multiaxial generado por el pinzamiento del tendón in vivo, que depende de las características anatómicas de la región afectada. Además, los modelos in vivo de pinzamiento tendinoso carecen de control sobre el entorno de deformación mecánica. Para superar estas limitaciones, presentamos un novedoso modelo de explante murino de extremidad posterior adecuado para estudiar la mecanobiología del pinzamiento del tendón de Aquiles. Este modelo mantiene el tendón de Aquiles in situ para preservar la anatomía local y reproduce el entorno de tensión multiaxial generado por el pinzamiento de la inserción del tendón de Aquiles sobre el calcáneo durante la dorsiflexión del tobillo aplicada pasivamente, al tiempo que retiene las células dentro de su entorno nativo. Describimos un protocolo de cultivo de tejidos integral para este modelo y presentamos datos que establecen la viabilidad sostenida del explante durante 7 días. Los resultados representativos demuestran un aumento de la tinción histológica de GAG y una disminución de la alineación de las fibras de colágeno secundaria al pinzamiento, lo que sugiere una formación elevada de fibrocartílago. Este modelo se puede adaptar fácilmente para investigar diferentes regímenes de carga mecánica y permite la manipulación de vías moleculares de interés para identificar mecanismos que median el cambio fenotípico en el tendón de Aquiles en respuesta al pinzamiento.
Introducción
Una multitud de tendones, incluidos el tendón de Aquiles y los tendones del manguito rotador, experimentan pinzamiento óseo debido a la posición anatómica normal1,2,3,4. El pinzamiento del tendón genera una tensión compresiva dirigida transversalmente al eje longitudinal de la fibra5,6,7. Las regiones de pinzamiento del tendón demuestran un fenotipo único de fibrocartílago en el que las células redondas y encogidas (fibrocondrocitos) están incrustadas dentro de una red de colágeno desorganizada con un contenido marcadamente mayor de glicosaminoglicanos (GAG)2,3,4,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24. Estudios anteriores sugieren que el entorno mecánico dispar producido por el pinzamiento del tendón sostiene esta matriz rica en GAG al impulsar la deposición de grandes proteoglicanos agregantes, sobre todo agrecano, aunque los mecanismos subyacentes no están claros1,3,12,13,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39. Si bien el fibrocartílago es una característica normal en las regiones afectadas de tendones sanos, el metabolismo aberrante de los proteoglicanos asociado con la formación excesiva de fibrocartílago es una característica distintiva de la tendinopatía, una enfermedad común y debilitante que surge de manera desproporcionada en los tendones con afectación crónica1,40,41,42,43,44,45,46,47,48,49. En consecuencia, el pinzamiento del tendón se reconoce clínicamente como un factor extrínseco importante que impulsa varias de las tendinopatías más comunes, incluida la enfermedad del manguito rotador y la tendinopatía insercional del tendón de Aquiles (IAT)50,51,52. En la actualidad, el tratamiento de la tendinopatía es ineficiente. Por ejemplo, aproximadamente el 47% de los pacientes con TAI requieren intervención quirúrgica después de un tratamiento conservador fallido, con resultados postoperatorios variables53,54,55,56. A pesar de la aparente relación entre el pinzamiento y la tendinopatía, los mecanismos mecanobiológicos por los cuales las células del tendón pinzado sienten y responden a su entorno mecánico están mal descritos, lo que oscurece la comprensión de la patogénesis de la tendinopatía y da lugar a un tratamiento inadecuado.
Los modelos de explantes son herramientas útiles en el estudio de la mecanobiología tendinosa57,58. Como primer paso hacia la comprensión de la mecanobiología del pinzamiento tendinoso, varios estudios previos han explorado la respuesta celular tras la aplicación de la compresión uniaxial simple a las células o explantes tendinosos extirpados 27,29,30,31,32,33,34,39. Sin embargo, las células in vitro carecen de matrices extracelulares y pericelulares que faciliten la transferencia de cepas, secuestren importantes factores de crecimiento y citocinas liberadas por deformación mecánica, y proporcionen sustrato para complejos de adhesión focal que desempeñan un papel en la mecanotransducción57,59. Además, tanto los estudios in vitro como los de explantes extirpados no logran recapitular el ambiente de deformación mecánica multiaxial generado por el pinzamiento tendinoso in vivo, que depende de las características anatómicas de la región afectada 5,6. En el contexto de la inserción del tendón de Aquiles afectado, esto incluye los tejidos circundantes como la bolsa retrocalcánea y la almohadilla de grasa de Kager 60,61,62,63. Por el contrario, los modelos in vivo de pinzamiento tendinoso 25,28,36,37,38,64,65,66 permiten un control mínimo sobre la magnitud y frecuencia de la carga aplicada directamente al tendón, lo cual es una limitación bien reconocida de los modelos in vivo para el estudio de la mecanobiología del tendón 57,58,67,68,69,70. Dados los desafíos en la medición de la deformación tendinosa in vivo, el entorno de deformación interna generado dentro de estos modelos a menudo está mal caracterizado.
En este manuscrito, presentamos una plataforma experimental personalizada que recrea el pinzamiento de la inserción del tendón de Aquiles sobre el calcáneo dentro de explantes de extremidades posteriores murinas enteras que, cuando se combina con este protocolo de cultivo de tejidos, mantiene la viabilidad durante 7 días en cultivo de explantes y permite el estudio de las secuelas biológicas del pinzamiento del tendón. La plataforma está construida sobre una base de ácido poliláctico (PLA) impresa en 3D que proporciona la base para la fijación de las empuñaduras y el inserto de reducción de volumen de PLA impreso en 3D. Las empuñaduras se utilizan para sujetar la parte superior de la pierna y la rodilla proximales a la unión miotendinosa del tendón de Aquiles con la cara caudal de la extremidad posterior hacia arriba, lo que permite obtener imágenes del tendón de Aquiles desde arriba utilizando una sonda de ultrasonido o un microscopio invertido (Figura 1A). El inserto de reducción de volumen se desliza a lo largo de una pista en la base y reduce el volumen requerido de medios de cultivo de tejidos. Una línea trenzada envuelta alrededor de la pata trasera se enruta fuera de la plataforma utilizando el diseño de la base y un clip de PLA impreso en 3D. Al tirar de la cuerda, la pata trasera se flexiona dorsal y la inserción del tendón de Aquiles se incita contra el calcáneo, lo que resulta en una tensión compresiva transversal elevada 5,6 (Figura 1A). La plataforma está contenida dentro de un baño acrílico que mantiene los explantes de la extremidad posterior sumergidos en medios de cultivo de tejidos. Asegurar la cuerda tensa al exterior de la bañera con cinta adhesiva mantiene la dorsiflexión del tobillo para producir un pinzamiento estático de la inserción del tendón de Aquiles. Los archivos CAD para componentes impresos en 3D se proporcionan en múltiples formatos (Archivo complementario 1), lo que permite la importación a una gama de software CAD comercial y gratuito de código abierto para su modificación y adaptación a las necesidades experimentales. Si el acceso a las impresoras 3D no está disponible para la fabricación, se pueden proporcionar archivos CAD a los servicios de impresión 3D en línea que imprimirán y enviarán las piezas a bajo costo.
Es importante destacar que el complejo musculotendinoso tríceps sura-tendón de Aquiles abarca las articulaciones de la rodilla y el tobillo 71,72,73. En consecuencia, la tensión de tracción en el tendón de Aquiles se ve influenciada por la flexión de la rodilla. La extensión de la rodilla pone el tendón de Aquiles bajo tensión, mientras que la flexión de la rodilla reduce la tensión. Al extender primero la rodilla y luego dorsiflexionar pasivamente el tobillo, las tensiones de compresión en la inserción impactada se pueden superponer a las tensiones de tracción. Por el contrario, al flexionar pasivamente el tobillo con la rodilla flexionada, se reduce la tensión de tracción y queda la tensión de compresión. El protocolo actual explora tres de esas condiciones. 1) Para el pinzamiento estático, el pie se flexiona dorsal a < 110° con respecto a la tibia para incidir la inserción, con la rodilla flexionada para reducir la tensión. 2) Para el grupo de tensión basal, el tobillo se extiende por encima de los 145° de dorsiflexión con la rodilla extendida, generando predominantemente tensión de tracción en la inserción. 3) Para el grupo descargado, los explantes se cultivan en una placa de Petri con la rodilla y el tobillo en posiciones neutras en ausencia de carga aplicada externamente. Los ángulos mencionados anteriormente se miden fotográficamente en relación con un sistema de coordenadas en el que el pie y la tibia son paralelos en un ángulo de 180° y perpendiculares en un ángulo de 90°.
Los pasos clave del protocolo incluyen: 1) la disección de los explantes de las extremidades posteriores y la extracción cuidadosa de la piel y el tendón plantar; 2) cultivo de explantes después de un pretratamiento de 48 h con dexametasona; 3) corte de tejido y tinción histológica; y 4) análisis de imágenes en color para evaluar la formación de fibrocartílago. Después de la disección, cada explante de extremidad posterior se pretrata durante 48 h en medios de cultivo suplementados con dexametasona74. Las extremidades contralaterales de cada ratón se asignan a grupos experimentales separados para su comparación por pares, lo que ayuda a controlar la variabilidad biológica. Después del pretratamiento, los explantes se colocan en plataformas como se describió anteriormente y se cultivan durante 7 días más (Figura 1B). Se realizan comparaciones adicionales con un grupo pretratado (día 0) en el que los explantes se retiran inmediatamente después del pretratamiento de 48 h.
Después del cultivo del explante, las extremidades posteriores se recortan, se fijan en formol, se descalcifican y se incrustan en parafina. El corte en serie en orientación sagital proporciona una visualización del tendón de Aquiles desde la unión miotendinosa hasta la inserción del calcáneo, al tiempo que permite realizar un seguimiento de la profundidad de la sección a través de todo el tendón. El marcaje X-nick de dUTP mediado por desoxinucleotidil transferasa terminal (TdT) (TUNEL) se utiliza para visualizar el daño en el ADN secundario a la apoptosis y evaluar la viabilidad. La histología del azul de toluidina y el análisis de imágenes en color personalizadas se realizan para cuantificar los cambios en la tinción de GAG. A continuación, se utilizan secciones de tejido teñidas con azul de toluidina para la obtención de imágenes de SHG con el fin de caracterizar las alteraciones en la organización de las fibras del collage (Figura 1B).
Los resultados representativos proporcionados sugieren una tinción histológica alterada de la matriz rica en GAG y una desorganización de la red de colágeno extracelular generada por 7 días de pinzamiento estático dentro del modelo. Este modelo se puede utilizar para explorar los mecanismos moleculares que subyacen al cambio fibrocartilaginoso impulsado por el pinzamiento.
Protocolo
Todo el trabajo con animales fue aprobado por el Comité de Recursos Animales de la Universidad de Rochester.
1. Preparación de medios de cultivo de tejidos
- Cultivar todos los explantes en el Medio Eagle Modificado de Dulbecco (1x DMEM) con 1% v/v de penicilina-estreptomicina y 200 μM de ácido L-ascórbico en una incubadora a 37 °C y 5% de CO2. Para el pretratamiento inicial de 48 h, se cultivó cada explante en 70 mL de medio de cultivo suplementado con dexametasona 100 nM74. Después del pretratamiento, cultivar las extremidades durante 7 días más sin dexametasona, cambiando de medio cada 48-72 h.
NOTA: No se recomienda la adición de suero, como suero fetal bovino, a los medios de cultivo de acuerdo con las recomendaciones proporcionadas por Wunderli, Blache y Snedeker57. En resumen, las condiciones sin suero representan mejor el microambiente tendinoso avascular y pobre en nutrientes que existe in vivo. Además, la suplementación con suero puede promover la degradación de los tejidos en determinadas condiciones de cultivo75 y estimular la proliferación celular y la migración fuera de los tejidos, ambas características de la patología tendinosa57. - Para el grupo descargado, cultivar cada explante en 70 mL de medio. Para los grupos de tensión basal y de pinzamiento estático, cada plataforma requiere aproximadamente 125 ml de medio de cultivo para mantener la extremidad sumergida. Este volumen puede variar en función de la posición de la parte superior de la pierna en las empuñaduras y de los parámetros de impresión 3D, principalmente de la densidad del relleno.
2. Disección del explante y pretratamiento con dexametasona
- Sacrificar ratones mediante inhalación de CO2 y luxación cervical secundaria, o de acuerdo con las pautas institucionales. Este protocolo utiliza ratones C57BL/6 de menos de 1 año de edad. El tamaño de las extremidades traseras aumentará con la edad y puede resultar difícil de encajar en las empuñaduras.
- Antes de la disección, transfiera 70 ml de medio de cultivo precalentado (37 °C) a una placa de Petri de 100 mm (diámetro) x 25 mm (altura) en una cabina de seguridad biológica (BSC) estéril. Agregue dexametasona para lograr una concentración de trabajo de 100 nM.
- Las disecciones se pueden llevar a cabo en la mesa de trabajo utilizando almohadillas absorbentes, trabajando rápidamente a través de la disección antes de transferir los explantes de las extremidades posteriores al BSC. Reúna las herramientas quirúrgicas necesarias para esta disección, que incluyen pinzas lisas, rectas y de punta fina; pinzas rectas de punta fina con dientes dentados; y tijeras rectas, afiladas y finas.
- Para la disección de los explantes de las extremidades traseras, coloque al ratón en posición supina e identifique la articulación de la cadera. Con unas tijeras finas, haga una pequeña incisión (5-10 mm) a través de la piel que se superponga a la cara proximal y anterior (craneal) de la parte superior de la pierna.
- Separe la incisión para expandirla, pellizque la parte superior de la pierna expuesta con los dedos y tire con cuidado de la piel distalmente para depurar la extremidad posterior hasta el nivel del tobillo. Inserte suavemente una hoja de tijera debajo de la piel a lo largo de la cara dorsal del pie y haga una incisión que se extienda hasta los dedos de los pies. Continúe tirando de la piel distalmente para eliminarla por completo.
- Coloque el ratón para visualizar la inserción del tendón de Aquiles en la cara posterior (caudal) del calcáneo, cerca del tobillo. Proximal a la inserción del tendón de Aquiles, el tendón plantar se encuentra directamente adyacente al borde medial del tendón de Aquiles y se extiende distalmente hacia la cara plantar del pie, pasando por encima de la cara posterior del calcáneo.
- Para extraer el tendón plantar, inserte con cuidado una punta de las pinzas de punta fina y lisa entre los dos tendones y extienda la punta medialmente pasando por debajo del tendón plantar. Dibuja la punta proximalmente y desgarra el músculo plantar. Con pinzas dentadas de punta fina, agarre el extremo proximal separado del tendón plantar y tire distalmente para retirarlo.
- En la articulación de la cadera, use unas tijeras finas para cortar la pelvis y aislar la extremidad posterior. Usa las tijeras para sacar la pelvis restante y exponer la cabeza femoral.
- Transfiera el explante de la extremidad posterior al BSC y a la placa que contiene los medios de cultivo celular con dexametasona. Coloque el plato en la incubadora y pretrátelo durante 48 h.
3. Cultivo de explantes y plataformas de carga
- Al concluir el pretratamiento de 48 h, precalentar volúmenes suficientes de medios de cultivo (sección 1). A partir de este momento, no se añadirá dexametasona a los medios de cultivo. En este momento, las extremidades del grupo pretratado (día 0) se pueden fijar, descalcificar e incrustar en parafina para futuras secciones, tinciones y análisis.
- Para el grupo descargado, aspire los medios de pretratamiento y transfiera los explantes a placas de Petri frescas, agregue 70 ml de medios de cultivo cada uno y regrese a la incubadora.
- Para los grupos de tensión de referencia y de impacto estático, prepare las plataformas de explante. Corta pedazos de papel de lija de tamaño similar a los platos de agarre. Para el grupo de impacto estático, corte trozos de línea trenzada de aproximadamente 18 pulgadas de largo y haga previamente un nudo simple suelto a la mitad a lo largo de la línea. Rasga trozos de papel de aluminio para cubrir cada baño acrílico y rocía con etanol al 70% (EtOH). Transfiera los preparativos al BSC.
- Cada plataforma incluye un baño acrílico, una base, un inserto de reducción de volumen, un clip y agarres. Cada empuñadura incluye dos platinas y tres tipos diferentes de tornillos, incluido un tornillo M5 x 0,8 mm de rosca x 10 mm de largo que une las mordazas a la base; dos tornillos M6 x 1 mm de rosca x 20 mm de largo que prolongan las platinas para sujetar las empuñaduras; y cuatro tornillos M3 x 0,5 mm de rosca x 14 mm de longitud que, en combinación con cuatro muelles de compresión, retraen las platinas para abrir las empuñaduras.
- Coloque todos los componentes en contenedores secundarios capaces de capturar todos los medios de cultivo en caso de fuga. Sumergir en ≥ solución de lejía al 10% y dejar en remojo durante al menos 1 h. Enjuague la solución de lejía con agua del grifo (autoclave según sea necesario) y muévase al BSC.
NOTA: Para solucionar problemas de contaminación, considere esterilizar en autoclave toda el agua del grifo o usar agua purificada. Consulte la Discusión para obtener consejos adicionales sobre cómo abordar la contaminación. - Utilice los tornillos M3 y los resortes de compresión para fijar las platinas a las mordazas, asegure las mordazas a la base con el tornillo M5 e inserte los tornillos M6 hasta que encajen en las placas. Use cinta adhesiva de doble cara para sujetar el papel de lija a los platos, luego cierre las empuñaduras para promover la adhesión del papel de lija a los platos. Repita el procedimiento para todas las plataformas.
- Cuando esté listo para cargar una plataforma, abra completamente las empuñaduras y, con unas pinzas, coloque la parte superior de la pierna y la rodilla entre las platinas con la superficie superficial del tendón de Aquiles hacia arriba (Figura 1A). Cierre las empuñaduras sin apretar para mantenerlas suavemente en su lugar.
- Use fórceps para agarrar la cabeza o el pie femoral expuesto y manipule el ángulo de flexión de la rodilla a medida que cierra gradualmente las empuñaduras para asegurarlas en su lugar. Para el grupo de tensión basal, extienda la articulación de la rodilla como se describió anteriormente. A medida que los agarres se aprietan con la rodilla extendida, el tobillo debe extenderse naturalmente. Para el grupo de impacto estático, flexione la articulación de la rodilla entre las empuñaduras como se describió anteriormente.
- Para el grupo de impacto estático, coloque el nudo simple de la cuerda alrededor de la pata distal y apriete. Pase la cuerda a través de una ranura en la base ubicada debajo del explante y a través del orificio del clip. Coloque la base en el baño acrílico y asegure el clip al borde superior del baño (Figura 1A).
- Tire de la cuerda para dorsiflexionar el pie al menos 110° con respecto a la tibia y use un marcador permanente para marcar la cuerda a medida que sale del clip. Tome una fotografía del explante en esta posición para luego cuantificar el ángulo de dorsiflexión (Figura 1A).
- Retire la base y coloque el inserto de reducción de volumen deslizándolo a lo largo de un riel en la base. Vuelva a colocar la base (ahora unida al inserto de reducción de volumen) en el baño acrílico y vuelva a colocar el clip en el borde superior. Tire de la cuerda para volver al ángulo de dorsiflexión original usando la cuerda marcada como guía y asegure la cuerda al exterior de la bañera con cinta adhesiva para mantener la dorsiflexión estática.
- Para el grupo de tensión de referencia, simplemente coloque la base con el inserto de reducción de volumen en el baño acrílico una vez que el explante esté colocado entre las mordazas y tome una fotografía para cuantificar el ángulo de dorsiflexión.
- Agregue 125 mL de medio de cultivo precalentado (37 °C) a cada plataforma para sumergir los explantes. Cubra la parte superior del baño con papel de aluminio, colóquelo en un recipiente secundario y muévalo a la incubadora. Cultivo durante 7 días adicionales, cambiando de medio cada 48-72 h.
NOTA: La cinta adhesiva colocada en la parte superior del baño puede evitar que las piezas de PLA floten.
4. Fijación, descalcificación e inclusión en parafina
- Después del cultivo del explante, use unas tijeras para cortar las uñas de los pies o los dedos distales y corte la parte superior de la pierna proximal a la unión miotendinosa del tendón de Aquiles. Coloque cada articulación del tobillo recortada en un casete de procesamiento forrado con almohadillas de biopsia de espuma. Empuje el tobillo en la esquina del cassette para colocar el tobillo en una dorsiflexión de aproximadamente 90° y cierre el cassette para mantenerlo en su lugar.
- Fijar durante 3 días en formalina tamponada neutra (NBF) al 10% y descalcificar durante 2 semanas en ácido etilendiamenetetraacético (EDTA) al 14% disuelto en agua destilada (diH2O) con pH ajustado a 7,4-7,6 con ácido acético glacial.
- Para eliminar las sales, enjuague bien las muestras tres veces en solución salina tamponada con fosfato (PBS) 1x seguida de diH2O, 5 minutos cada una. Realice el procesamiento rutinario de muestras para la histología de la parafina: deshidrate a través de una serie graduada de EtOH, se aclare en xileno e infílese con cera de parafina. Oriente e incruste las muestras en parafina para obtener secciones de tejido sagital a través del tendón de Aquiles en progresión medial a lateral, como se describe en la sección 5 a continuación (Figura 1B).
5. Seccionamiento de tejidos
- Con un micrótomo, recorte con cuidado la muestra hasta que las secciones queden paralelas a la cara del bloque. Recorte macroscópicamente en el tobillo desde la cara medial de la articulación, deteniéndose antes de llegar al borde medial de la inserción del tendón de Aquiles.
- Transfiera la muestra a un bloque de hielo para ajustar la temperatura y la hidratación, y cambie las cuchillas (o cambie a una sección nueva de la cuchilla actual). Continúe seccionando la muestra con un espesor de 10 μm e identifique cuidadosamente la entrada en la inserción del tendón de Aquiles con un microscopio de campo claro. Una vez identificado, realice un corte en serie con el número de sección de seguimiento (es decir, la profundidad del tejido) a través de toda la inserción del tendón de Aquiles.
6. Desparafinación/rehidratación y selección de portaobjetos
- Para cada ensayo que se indica a continuación, seleccione secciones de tejido de cada par de extremidades contralaterales que coincidan con el nivel. Antes de la tinción, colóquelo en una rejilla de portaobjetos y muévase a través de 3 cambios de xileno, 2 cambios de 100% de EtOH, 2 cambios de 95% de EtOH y 1 cambio de 70% de EtOH, 5 min cada uno. Terminar de rehidratar en diH2O.
7. TUNEL para evaluar la viabilidad del tendón de Aquiles
- Para el etiquetado TUNEL, tiñe según el protocolo del fabricante. Incubar en 20 μg/ml de proteinasa K durante 20 min a temperatura ambiente y enjuagar en diH2O. Incubar en 50 μl de solución de tinción TUNEL (5 μl de solución enzimática, 45 μl de solución de etiqueta) durante 1 h a 37 °C. Enjuague en diH2O. Monte con reactivo antidecoloración que contenga DAPI y cubreobjetos.
- Imagine la inserción del tendón de Aquiles utilizando un microscopio de fluorescencia con una lente de objetivo de 4x. Incluya un canal DAPI (longitudes de onda de excitación/emisión = 360/460 nm) para visualizar todos los núcleos, un canal TUNEL (TMR Red) (longitudes de onda de excitación/emisión = 540/580 nm) para visualizar núcleos apoptóticos y, si es posible, un canal de campo claro.
- Para el análisis de imágenes, importe imágenes a un software de análisis de imágenes adecuado para el procesamiento basado en el ROI, como FIJI/ImageJ o MATLAB. Defina una región de interés (ROI) que describa todo el tendón de Aquiles a la vista (Figura 2A), excluyendo las células del epitenón que son altamente susceptibles a la muerte inducida por disección y cambio repentino en las condiciones ambientales cuando se colocan en cultivo.
- Para ello, realice la selección del ROI en MATLAB importando la imagen de campo claro y utilizando la función drawpolygon() para trazar y delimitar los límites del tendón. MATLAB crea un objeto Polygon para el ROI, que luego se puede aplicar a las imágenes de canal DAPI y TUNEL para enmascarar los datos de intensidad de píxeles fuera del ROI mediante createMask() para analizar solo los núcleos dentro del tendón de Aquiles.
- Importe las imágenes de los canales DAPI y TUNEL e identifique un umbral de intensidad de fluorescencia para definir núcleos apoptóticos (TUNEL+) normalizando a la intensidad de fluorescencia máxima de los núcleos apoptóticos en tejidos no viables como hueso, músculo o grasa que se capturan incidentalmente en la sección de tejido. Una vez enmascaradas las imágenes, calcule la fracción de núcleos apoptóticos (núcleos TUNEL+/núcleos DAPI) dentro del tendón de Aquiles.
8. Histología del azul de toluidina para caracterizar la formación de fibrocartílago
- Una vez rehidratado (Sección 6), transfiera la rejilla de portaobjetos con secciones de tejido niveladas de pares contralaterales de explantes a 0,4% p/v de azul de toluidina O en tampón de acetato de sodio 0,1 M con pH ajustado a 4,0 utilizando ácido acético glacial. Incubar durante 10 minutos a temperatura ambiente, luego enjuagar 3 veces en diH2O durante 30 s cada uno.
- Deshidratar a través de tres cambios de 95% de EtOH y dos cambios de 100% de EtOH, 30 s cada uno. Aclarar a través de tres cambios de xileno, 1 min cada uno. Cubreobjetos con medio de montaje a base de xileno.
- Obtenga imágenes en color rojo-azul-verde (RGB) de 24 bits de la inserción del tendón de Aquiles. Por ejemplo, para este protocolo, utilice un adaptador para conectar una cámara digital a color con el ocular de un microscopio de campo claro simple con un objetivo 4x.
- Para cuantificar las diferencias en la tinción con azul de toluidina dentro del fibrocartílago tendinoso compresivo (CTF)16 en la inserción del tendón de Aquiles (Figura 3A, B), importe imágenes RGB a un software de análisis de imágenes capaz de definir y gestionar múltiples ROI. Las opciones incluyen las selecciones y las herramientas de gestión de ROI en FIJI/ImageJ o la caja de herramientas de procesamiento de imágenes en MATLAB. Comience configurando la escala de píxeles/longitud.
NOTA: La elección del software se deja a discreción del investigador y, desde luego, no se limita a MATLAB o FIJI/ImageJ. Los autores han proporcionado código de MATLAB (Archivo complementario 2), documentación que describe la implementación (archivo complementario 3) y una imagen de muestra (Archivo complementario 4). Alentamos a los investigadores a traducir este código a lenguajes de programación alternativos para su uso en otro software según sea necesario o preferido. - Con la imagen mostrada en el software de su elección, identifique la intersección del borde profundo del tendón con el calcáneo. A partir de aquí, trace proximalmente 800 μm a lo largo del borde profundo del tendón para establecer el límite profundo del CTF. Por ejemplo, utilice la función drawpolyline() en MATLAB para dibujar de forma interactiva una polilínea sobre la imagen RGB. MATLAB crea un objeto Polyline que contiene los vértices de la línea, que se puede procesar y recortar hasta una longitud de 800 μm.
- Desde esta posición, cree el límite proximal del CTF dibujando un segmento de línea que se conecte con el borde del tendón superficial que sea perpendicular a la orientación de la fibra local.
- Retroceda a la intersección del borde tendinoso profundo y el calcáneo y defina el límite distal del CTF dibujando un segmento de línea que se conecte con el borde tendinoso superficial a lo largo de la marca de marea distintiva que separa el CTF del fibrocartílago de la zona de unión (AZF)16 (Figura 3A, B). Por último, genere el límite superficial del CTF trazando el borde tendinoso superficial que se va a encerrar.
- Para describir las variaciones espaciales en la tinción de GAG a lo largo de la inserción, divida el CTF total en 4 cuadrantes (Figura 3A, B). Conecte el punto medio de los límites CTF profundos y superficiales con un segmento de línea para crear un límite distal/proximal. Pasando por el punto medio de este límite, conecte los puntos medios de los límites CTF distal y proximal a lo largo de la orientación de la fibra para crear un límite superficial/profundo.
- Estos 6 límites proporcionan información que se puede utilizar para definir el ROI que representa todo el CTF, pero también 4 cuadrantes que subdividen el CTF. En MATLAB, por ejemplo, compile vértices que definan los límites de cada ROI individual (CTF, cuadrantes 1-4) en vectores y utilice images.roi.Polygon() para generar objetos Polygon cerrados para cada ROI.
- Con los ROI definidos, transforme los datos de píxeles RGB en el espacio de color Hue-Saturation-Value (HSV) utilizando el complemento de transformador de color en FIJI, la función rgb2hsv() en MATLAB u otro software que aplique las ecuaciones de transformación adecuadas76. Los datos HSV se pueden proyectar en el espacio de tono-saturación 2D, donde cada combinación de tono y saturación codifica un color único (Figura 3C).
- Dentro de cada ROI, calcule el tono y la saturación promedio que describen el color promedio de la mancha en el ROI. Esto se puede lograr en MATLAB, por ejemplo, utilizando los objetos Polygon que definen cada ROI para enmascarar la imagen mediante createMask() con el fin de analizar los datos de píxeles de saturación de tono específicamente dentro de cada ROI.
- Defina otro pequeño ROI dentro del fibrocartílago perióstico (PF)16 (Figura 3A, B) y calcule el tono y la saturación promedio. A continuación, calcule la distancia euclidiana que separa el color medio de cada ROI del CTF al del PF (Figura 3C).
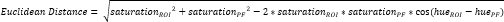
NOTA: El cálculo de la distancia euclidiana describe el grado de similitud entre el color promedio del ROI y el del PF, un tejido fibrocartilaginoso por excelencia 16,17,77. Una distancia euclidiana más pequeña indica un color ROI que es más fibrocartilaginoso en apariencia. - Utilice esta distancia para calcular la puntuación del fibrocartílago, que supone un valor máximo de 1 si el color del ROI es idéntico al color PF y un valor mínimo de -1 si el color ROI y el color PF alcanzan la separación máxima dentro del espacio de color de saturación de tono.
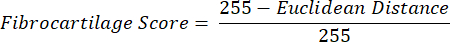
- Los datos promedio para el tono, la saturación y la puntuación del fibrocartílago dentro de cada ROI en las secciones de tejido de cada extremidad. Realizar comparaciones estadísticas pareadas entre grupos de extremidades contralaterales.
9. Imágenes SHG para investigar el cambio en la organización de la red de colágeno
- Realice imágenes SHG de las secciones teñidas con azul de toluidina utilizando un sistema de microscopio capaz con una lente de objeto de 20x. Adquiera pilas z a través del grosor de la sección y realice el escaneo de baldosas según sea necesario para capturar completamente la inserción del tendón de Aquiles.
- Importe imágenes SHG a un software de análisis de imágenes preferido y defina ROI que abarquen y subdividan el CTF en la inserción del tendón de Aquiles, como se describe para el análisis de imágenes de azul de toluidina en la sección 8 (Figura 4A, B).
- Si se importan imágenes SHG a MATLAB, utilice el enfoque para definir el ROI de CTF en MATLAB, tal y como se describe en la sección 8. Después de definir las ROI, transfiera las coordenadas de ROI a FIJI exportando los vértices de ROI de MATLAB como archivos .txt e importándolos a FIJI mediante File > Import > XY Coordinates. Superponga la selección y envíela al administrador de ROI para su análisis.
- Para cuantificar la organización del colágeno, utilice el complemento Directionality en FIJI, que realiza un análisis del espectro de Fourier para calcular las distribuciones de las orientaciones de las fibras en ventanas pequeñas que abarcan un ROI. La dispersión de esta distribución, denominada dispersión, está inversamente relacionada con la alineación de las fibras.
NOTA: Las fibras de colágeno pueden asumir orientaciones variables en diferentes ventanas a lo largo del CTF debido a la curvatura macroscópica del tendón en lugar de la ausencia de alineación/organización. Para distinguir mejor los cambios en la organización del colágeno de la curvatura macroscópica del tendón en la inserción, es necesario definir ROI más pequeños. - Importe imágenes SHG en FIJI y establezca la escala de píxeles/longitud. Proyecte datos de intensidad de píxeles máximos en una imagen compuesta 2D y agregue ROI al Administrador de ROI. Superponga secuencialmente cada ROI de CTF en la imagen y dibuje 10 pequeños sub-ROI de tamaño consistente dentro del ROI, agregando los sub-ROI al administrador de ROI.
- Dentro de cada sub-ROI, ejecute el complemento de direccionalidad en FIJI para calcular la dispersión de la fibra. Datos de dispersión promedio a través de sub-ROI dentro de cada ROI de CTF, y datos de dispersión promedio dentro de cada ROI de CTF en las secciones de cada explante. Realizar comparaciones estadísticas pareadas entre grupos de extremidades contralaterales.
Resultados
Las imágenes representativas de las secciones de tejido teñidas con TUNEL demuestran núcleos apoptóticos mínimos dentro del cuerpo del tendón de Aquiles después de 7 días de cultivo de explantes en grupos experimentales (Figura 2A). La cuantificación de estas imágenes proporciona evidencia de que el protocolo de cultivo de tejidos mantiene hasta un 78% de viabilidad en promedio dentro del tendón de Aquiles después de 7 días de cultivo de explantes en condiciones de carga (
Discusión
La plataforma experimental de explante de extremidades posteriores murinas, junto con el protocolo de cultivo de tejidos descrito en este estudio, proporciona un modelo adecuado para estudiar la mecanobiología de la formación de fibrocartílago impulsada por el pinzamiento en la inserción del tendón de Aquiles. La utilidad de este modelo de explante queda demostrada por los resultados representativos, que indican el mantenimiento de la viabilidad celular concomitante con un cambio significativo y espacialmente hetero...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen el apoyo y la asistencia brindados por Jeff Fox y Vidya Venkatramani del Centro de Investigación Musculoesquelética de la Universidad de Rochester, financiado en parte por P30AR06965. Además, los autores desean agradecer al Centro de Microscopía Óptica y Nanoscopía (CALMN) del Centro Médico de la Universidad de Rochester por su ayuda con la microscopía multifotónica. Este estudio fue financiado por R01 AR070765 y R01 AR070765-04S1, así como por 1R35GM147054 y 1R01AR082349.
Materiales
| Name | Company | Catalog Number | Comments |
| Absorbent underpads | VWR | 82020-845 | For benchtop dissection |
| Acrylic bath | Source One | X001G46CB1 | Contains the explant platform submerged in culture media |
| Autoclave bin | Thermo Scientific | 13-361-20 | Used as secondary containment, holds two platforms |
| Base | - | - | 3D printed from CAD files provided as Supplementary Files |
| Braided line | KastKing | 30lb test | Used to wrap around paw and apply ankle dorsiflexion |
| Clip | - | - | 3D printed from CAD files provided as Supplementary Files |
| Cover glass | Fisherbrand | 12-541-034 | Rectangular, No. 2, 50 mm x 24 mm |
| Cytoseal XYL | VWR | 8312-4 | Xylene-based mounting media for coverslipping Toluidine blue stained tissue sections |
| Dexamethasone | MP Biomedical LLC | 194561 | CAS#50-02-2 |
| Dimethyl sulfoxide (DMSO), anhydrous | Invitrogen by ThermoFisher | D12345 | CAS#67-68-5, use to solubilize dexamethasone into concentrated stock solutions |
| Double-sided tape | Scotch Brand | 34-8724-5195-9 | To attach sandpaper to Grip platens |
| Dulbecco's Modified Eagle Medium (1X DMEM) | Gibco by ThermoFisher | 11965092 | high glucose, (-) pyruvate, (+) glutamine |
| EDTA tetrasodium salt dihydrate | Thermo Scientific Chemicals | J15700.A1 | CAS#10378-23-1, used to make 14% EDTA solution for sample decalcifcation |
| Ethanol, 200 proof | Thermo Scientific | T038181000 | CAS#64-17-5, 1 L supply |
| Foam biopsy pads | Leica | 3801000 | Used with processing cassettes, help hold ankle joints in desired position during fixation and decalcification |
| Forceps, #SS Standard Inox | Dumont | 11203-23 | Straight, smooth, fine tips |
| Forceps, Micro-Adson 4.75" | Fisherbrand | 13-820-073 | Straight, fine tips with serrated teeth |
| Garnet Sandpaper, 50-D Grit | Norton | M600060 01518 | Or other coarse grit sandpaper |
| Glacial acetic acid | Fisher Chemical | A38S-500 | CAS#64-19-7, for adjusting pH of sodium acetate buffer used for Toluidine blue histology, as well as 14% EDTA decalcification solution |
| Grips | ADMET | GV-100NT-A4 | Stainless steel vice grips, screws and springs described in the protocol are included |
| Histobond Adhesive Microscope Slides | VWR | 16005-108 | Sagittal sections of hind limbs explants reliably adhere to these slides through all staining protocols |
| In situ Cell Death Detection Kit, TMR Red | Roche | 12156792910 | TUNEL assay |
| Labeling tape | Fisherbrand | 15-959 | Or any other labeling tape of preference |
| L-ascorbic acid | Sigma-Aldrich | A4544-100G | CAS#50-81-7, for culture media formulation |
| Neutral buffered formalin, 10% | Leica | 3800600 | For sample fixation, 5 gallon supply |
| Nunc petri dishes | Sigma-Aldrich | P7741-1CS | 100 mm diameter x 25 mm height, maintain explants submerged in 70 mL of culture media as described in protocol |
| Penicillin-streptomycin (100X) | Gibco by ThermoFisher | 15140122 | Add 5 mL to 500 mL 1X DMEM for 1% v/v (1X) working concentration |
| Polylactic acid (PLA) 1.75 mm filament | Hatchbox | - | Choose filament diameter compatible with your 3D printer extruder, in color of choice. |
| Processing cassettes | Leica | 3802631 | For fixation, decalcification and paraffin embedding |
| Prolong Gold Antifade Reagent with DAPI | Invitrogen by ThermoFisher | P36931 | Mounting media for coverslipping tissue sections after TUNEL |
| Proteinase K | Fisher BioReagents | BP1700-50 | CAS#39450-01-6, used for antigen retrieval in TUNEL protocol |
| Scissors, Fine | FST | 14094-11 | Straight, sharp |
| Slide Staining Set, 12-place | Mercedes Scientific | MER 1011 | Rack with 12 stain dishes and slide dippers for Toluidine blue histology |
| Sodium acetate, anhydrous | Thermo Scientific Chemicals | A1318430 | CAS#127-09-3, used to make buffer for Toluidine blue histology |
| Tissue-Tek Accu-Edge Low Profile Microtome Blades | VWR | 25608-964 | For paraffin sectioning |
| Toluidine Blue O | Thermo Scientific Chemicals | 348601000 | CAS#92-31-9 |
| Volume Reduction Insert | - | - | 3D printed from CAD files provided as Supplementary Files |
| Xylenes | Leica | 3803665 | 4 gallon supply for histological staining |
Referencias
- Cook, J. L., Purdam, C. Is compressive load a factor in the development of tendinopathy. Br J Sports Med. 46 (3), 163-168 (2012).
- Benjamin, M., Qin, S., Ralphs, J. R. Fibrocartilage associated with human tendons and their pulleys. J Anat. 187 (Pt 3), 625-633 (1995).
- Benjamin, M., Ralphs, J. R. Fibrocartilage in tendons and ligaments - an adaptation to compressive load. J Anat. 193 (4), 481-494 (1998).
- Benjamin, M., Theobald, P., Suzuki, D., Toumi, H. The anatomy of the Achilles tendon. The Achilles Tendon. 3, 5-16 (2007).
- Chimenti, R. L., et al. Insertional achilles tendinopathy associated with altered transverse compressive and axial tensile strain during ankle dorsiflexion. J Orthop Res. 35 (4), 910-915 (2017).
- Mora, K. E., et al. Ultrasound strain mapping of the mouse Achilles tendon during passive dorsiflexion. J Biomech. 132, 110920 (2022).
- Pringels, L., et al. Intratendinous pressure changes in the Achilles tendon during stretching and eccentric loading: Implications for Achilles tendinopathy. Scand J Med Sci Sports. 33 (5), 619-630 (2023).
- Koob, T. J., Vogel, K. G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. J Orthop Res. 5 (3), 414-424 (1987).
- Vogel, K. G., Koob, T. J. Structural specialization in tendons under compression. Int Rev Cytol. 115, 267-293 (1989).
- Vogel, K. G., Ordög, A., Pogány, G., Oláh, J. Proteoglycans in the compressed region of human tibialis posterior tendon and in ligaments. J Orthop Res. 11 (1), 68-77 (1993).
- Vogel, K. G., Sandy, J. D., Pogány, G., Robbins, J. R. Aggrecan in bovine tendon. Matrix Biol. 14 (2), 171-179 (1994).
- Robbins, J. R., Vogel, K. G. Regional expression of mRNA for proteoglycans and collagen in tendon. Eur J Cell Biol. 64 (2), 264-270 (1994).
- Vogel, K., Gordon, S. I., Blair, S. J., Fine, L. J. . Repetitive motion disorders of the upper extremity. , (1995).
- Benjamin, M., Tyers, R. N., Ralphs, J. R. Age-related changes in tendon fibrocartilage. J Anat. 179, 127-136 (1991).
- Ralphs, J. R., Benjamin, M., Thornett, A. Cell and matrix biology of the suprapatella in the rat: a structural and immunocytochemical study of fibrocartilage in a tendon subject to compression. Anat Rec. 231 (2), 167-177 (1991).
- Rufai, A., Benjamin, M., Ralphs, J. R. Development and ageing of phenotypically distinct fibrocartilages associated with the rat Achilles tendon. Anat Embryol (Berl). 186 (6), 611-618 (1992).
- Rufai, A., Ralphs, J. R., Benjamin, M. Ultrastructure of fibrocartilages at the insertion of the rat Achilles tendon. J Anat. 189 (Pt 1), 185-191 (1996).
- Waggett, A. D., Ralphs, J. R., Kwan, A. P. L., Woodnutt, D., Benjamin, M. Characterization of collagens and proteoglycans at the insertion of the human achilles tendon. Matrix Biol. 16 (8), 457-470 (1998).
- Ralphs, J., et al. Regional differences in cell shape and gap junction expression in rat Achilles tendon: relation to fibrocartilage differentiation. J Anat. 193 (pt 2), 215-222 (1998).
- Milz, S., et al. Three-dimensional reconstructions of the Achilles tendon insertion in man. J Anat. 200 (Pt 2), 145-152 (2002).
- Tischer, T., Milz, S., Maier, M., Schieker, M., Benjamin, M. An immunohistochemical study of the rabbit suprapatella, a sesamoid fibrocartilage in the quadriceps tendon containing aggrecan. J Histochem Cytochem. 50 (7), 955-960 (2002).
- Esquisatto, M. A., Joazeiro, P. P., Pimentel, E. R., Gomes, L. The effect of age on the structure and composition of rat tendon fibrocartilage. Cell Biol Int. 31 (6), 570-577 (2007).
- Matuszewski, P. E., et al. Regional variation in human supraspinatus tendon proteoglycans: Decorin, biglycan, and aggrecan. Connect Tissue Res. 53 (5), 343-348 (2012).
- Buckley, M. R., Huffman, G. R., Iozzo, R. V., Birk, D. E., Soslowsky, L. J. The location-specific role of proteoglycans in the flexor carpi ulnaris tendon. Connect Tissue Res. 54 (6), 367-373 (2013).
- Gillard, G. C., Reilly, H. C., Bell-Booth, P. G., Flint, M. H. The influence of mechanical forces on the glycosaminoglycan content of the rabbit flexor digitorum profundus tendon. Connect Tissue Res. 7 (1), 37-46 (1979).
- Giori, N. J., Beaupre, G. S., Carter, D. R. Cellular shape and pressure may mediate mechanical control of tissue composition in tendons. J Orthop Res. 11 (4), 581-591 (1993).
- Wren, T. A., Beaupré, G. S., Carter, D. R. Mechanobiology of tendon adaptation to compressive loading through fibrocartilaginous metaplasia. J Rehabil Res Dev. 37 (2), 135-143 (2000).
- Malaviya, P., et al. An in vivo model for load-modulated remodeling in the rabbit flexor tendon. J Orthop Res. 18 (1), 116-125 (2000).
- Shim, J. W., Elder, S. H. Influence of Cyclic Hydrostatic Pressure on Fibrocartilaginous Metaplasia of Achilles Tendon Fibroblasts. Biomech Model Mechanobiol. 5 (4), 247-252 (2006).
- Koob, T. J., Clark, P. E., Hernandez, D. J., Thurmond, F. A., Vogel, K. G. Compression loading in vitro regulates proteoglycan synthesis by tendon fibrocartilage. Arch Biochem Biophys. 298 (1), 303-312 (1992).
- Evanko, S. P., Vogel, K. G. Proteoglycan Synthesis in Fetal Tendon Is Differentially Regulated by Cyclic Compression in Vitro. Arch Biochem Biophys. 307 (1), 153-164 (1993).
- Vogel, K. G. The effect of compressive loading on proteoglycan turnover in cultured fetal tendon. Connect Tissue Res. 34 (3), 227-237 (1996).
- Thornton, G. M., et al. Changes in mechanical loading lead to tendon specific alterations in MMP and TIMP expression: influence of stress deprivation and intermittent cyclic hydrostatic compression on rat supraspinatus and Achilles tendons. Br J Sports Med. 44 (10), 698-703 (2010).
- Robbins, J. R., Evanko, S. P., Vogel, K. G. Mechanical Loading and TGF-β Regulate Proteoglycan Synthesis in Tendon. Arch Biochem Biophys. 342 (2), 203-211 (1997).
- Docking, S., Samiric, T., Scase, E., Purdam, C., Cook, J. Relationship between compressive loading and ECM changes in tendons. Muscles Ligaments Tendons J. 3 (1), 7-11 (2013).
- Wang, X., et al. Aberrant TGF-β activation in bone tendon insertion induces enthesopathy-like disease. J Clin Invest. 128 (2), 846-860 (2018).
- Cong, G. T., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: Development and analysis of a novel murine model. J Orthop Res. 36 (10), 2780-2788 (2018).
- Liu, Y., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: development and analysis of a novel rat model. J Shoulder Elbow Surg. 31 (9), 1898-1908 (2022).
- Majima, T., et al. Compressive compared with tensile loading of medial collateral ligament scar in vitro uniquely influences mRNA levels for aggrecan, collagen type II, and collagenase. J Orthop Res. 18 (4), 524-531 (2000).
- Hopkins, C., et al. Critical review on the socio-economic impact of tendinopathy. Asia Pac J Sports Med, Arthrosc, Rehabil Technol. 4, 9-20 (2016).
- Scott, A., Ashe, M. C. Common tendinopathies in the upper and lower extremities. Curr Sports Med Rep. 5 (5), 233-241 (2006).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin Sports Med. 22 (4), 675-692 (2003).
- Bah, I., et al. Tensile mechanical changes in the Achilles tendon due to Insertional Achilles tendinopathy. J Mech Behav Biomed Mater. 112, 104031 (2020).
- Maffulli, N., Reaper, J., Ewen, S. W. B., Waterston, S. W., Barrass, V. Chondral Metaplasia in Calcific Insertional Tendinopathy of the Achilles Tendon. Clin J Sport Med. 16 (4), 329-334 (2006).
- Corps, A. N., et al. Increased expression of aggrecan and biglycan mRNA in Achilles tendinopathy. Rheumatology (Oxford). 45 (3), 291-294 (2006).
- Scott, A., et al. Increased versican content is associated with tendinosis pathology in the patellar tendon of athletes with jumper's knee. Scand J Med Sci Sports. 18 (4), 427-435 (2008).
- Attia, M., et al. Greater glycosaminoglycan content in human patellar tendon biopsies is associated with more pain and a lower VISA score. Br J Sports Med. 48 (6), 469-475 (2014).
- Kujala, U. M., Sarna, S., Kaprio, J. Cumulative Incidence of Achilles Tendon Rupture and Tendinopathy in Male Former Elite Athletes. Clin J Sport Med. 15 (3), 133-135 (2005).
- Corps, A. N., et al. Changes in matrix protein biochemistry and the expression of mRNA encoding matrix proteins and metalloproteinases in posterior tibialis tendinopathy. Ann Rheum Dis. 71 (5), 746-752 (2012).
- Neer, C. S. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 54 (1), 41-50 (1972).
- Bigliani, L. U., Ticker, J. B., Flatow, E. L., Soslowsky, L. J., Mow, V. C. The relationship of acromial architecture to rotator cuff disease. Clin Sports Med. 10 (4), 823-838 (1991).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current Concepts Review Update Insertional Achilles Tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Nicholson, C. W., Berlet, G. C., Lee, T. H. Prediction of the Success of Nonoperative Treatment of Insertional Achilles Tendinosis Based on MRI. Foot Ankle Int. 28 (4), 472-477 (2007).
- Lohrer, H., David, S., Nauck, T. Surgical treatment for achilles tendinopathy - a systematic review. BMC musculoskelet disord. 17 (1), 207 (2016).
- McGarvey, W. C., Palumbo, R. C., Baxter, D. E., Leibman, B. D. Insertional Achilles Tendinosis: Surgical Treatment Through a Central Tendon Splitting Approach. Foot Ankle Int. 23 (1), 19-25 (2002).
- Maffulli, N., et al. Surgery for chronic Achilles tendinopathy produces worse results in women. Disabil Rehabil. 30 (20-22), 1714-1720 (1714).
- Wunderli, S. L., Blache, U., Snedeker, J. G. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connect Tissue Res. 61 (3-4), 262-277 (2020).
- Dyment, N. A., et al. A brief history of tendon and ligament bioreactors: Impact and future prospects. J Orthop Res. 38 (11), 2318-2330 (2020).
- Screen, H. R. C., Berk, D. E., Kadler, K. E., Ramirez, F., Young, M. F. Tendon Functional Extracellular Matrix. J Orthop Res. 33 (6), 793-799 (2015).
- Theobald, P., et al. The functional anatomy of Kager's fat pad in relation to retrocalcaneal problems and other hindfoot disorders. J Anat. 208 (1), 91-97 (2006).
- Ghazzawi, A., Theobald, P., Pugh, N., Byrne, C., Nokes, L. Quantifying the motion of Kager's fat pad. J Orthop Res. 27 (11), 1457-1460 (2009).
- Malagelada, F., et al. Pressure changes in the Kager fat pad at the extremes of ankle motion suggest a potential role in Achilles tendinopathy. Knee Surg Sports Traumatol Arthrosc. 28 (1), 148-154 (2020).
- Shaw, H. M., Benjamin, M. Structure-function relationships of entheses in relation to mechanical load and exercise. Scand J Med Sci Sports. 17 (4), 303-315 (2007).
- Soslowsky, L. J., et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 30 (8), 1057-1063 (2002).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. J Shoulder Elbow Surg. 7 (4), 375-380 (1998).
- Croen, B. J., et al. Chronic subacromial impingement leads to supraspinatus muscle functional and morphological changes: Evaluation in a murine model. J Orthop Res. 39 (10), 2243-2251 (2021).
- Andarawis-Puri, N., Flatow, E. L. Tendon fatigue in response to mechanical loading. J Musculoskelet Neuronal Interact. 11 (2), 106-114 (2011).
- Gains, C. C., Giannapoulos, A., Zamboulis, D. E., Lopez-Tremoleda, J., Screen, H. R. C. Development and application of a novel in vivo overload model of the Achilles tendon in rat. J Biomech. 151, 111546 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Pedaprolu, K., Szczesny, S. E. A Novel, Open-Source, Low-Cost Bioreactor for Load-Controlled Cyclic Loading of Tendon Explants. J Biomech Eng. 144 (8), 084505 (2022).
- Orishimo, K. F., et al. Effect of Knee Flexion Angle on Achilles Tendon Force and Ankle Joint Plantarflexion Moment During Passive Dorsiflexion. J Foot Ankle Surg. 47 (1), 34-39 (2008).
- Liu, C. L., et al. Influence of different knee and ankle ranges of motion on the elasticity of triceps surae muscles, Achilles tendon, and plantar fascia. Sci Rep. 10 (1), 6643 (2020).
- Cruz-Montecinos, C., et al. Soleus muscle and Achilles tendon compressive stiffness is related to knee and ankle positioning. J Electromyogr Kinesiol. 66, 102698 (2022).
- Connizzo, B. K., Grodzinsky, A. J. Lose-dose administration of dexamethasone is beneficial in preventing secondary tendon damage in a stress-deprived joint injury explant model. J Orthop Res. 38 (1), 139-149 (2020).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biol. 89, 11-26 (2020).
- Yabusaki, K., et al. A Novel Quantitative Approach for Eliminating Sample-To-Sample Variation Using a Hue Saturation Value Analysis Program. PloS one. 9 (3), e89627 (2014).
- Gao, J., Messner, K., Ralphs, J. R., Benjamin, M. An immunohistochemical study of enthesis development in the medial collateral ligament of the rat knee joint. Anat Embryol. 194 (4), 399-406 (1996).
- Han, S. K., Wouters, W. A. J., Clark, A., Herzog, W. Mechanically induced calcium signaling in chondrocytes in situ. J Orthop Res. 30 (3), 475-481 (2012).
- Han, W., et al. Impact of cellular microenvironment and mechanical perturbation on calcium signalling in meniscus fibrochondrocytes. Eur Cell Mater. 27, 321-331 (2014).
- Rossetti, L., et al. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 16 (6), 664-670 (2017).
- Sartori, J., Köhring, S., Witte, H., Fischer, M. S., Löffler, M. Three-dimensional imaging of the fibrous microstructure of Achilles tendon entheses in Mus musculus. J Anat. 233 (3), 370-380 (2018).
- Eliasberg, C. D., et al. Identification of Inflammatory Mediators in Tendinopathy Using a Murine Subacromial Impingement Model. J Orthop Res. 37 (12), 2575-2582 (2019).
- Zhang, Y., et al. Expression of alarmins in a murine rotator cuff tendinopathy model. J Orthop Res. 38 (11), 2513-2520 (2020).
- Zhang, X., et al. Assessment of Mitochondrial Dysfunction in a Murine Model of Supraspinatus Tendinopathy. J Bone Joint Surg. Am. 103 (2), 174-183 (2021).
- Liu, Y., et al. The role of Indian Hedgehog Signaling in tendon response to subacromial impingement: evaluation using a mouse model. Am J Sports Med. 50 (2), 362-370 (2022).
- Wang, T., et al. Load-induced regulation of tendon homeostasis by SPARC, a genetic predisposition factor for tendon and ligament injuries. Sci Transl Med. 13 (582), eabe5738 (2021).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nat Biomed Eng. 5 (12), 1457-1471 (2021).
- Jones, D. L., et al. Mechanoepigenetic regulation of extracellular matrix homeostasis via Yap and Taz. Proc Natl Acad Sci U S A. 120 (22), e2211947120 (2023).
- Connizzo, B. K., Grodzinsky, A. J. Release of pro-inflammatory cytokines from muscle and bone causes tenocyte death in a novel rotator cuff in vitro explant culture model. Connect Tissue Res. 59 (5), 423-436 (2018).
- Rees, S. G., et al. Catabolism of aggrecan, decorin and biglycan in tendon. Biochem J. 350 (Pt 1), 181-188 (2000).
- Samiric, T., Ilic, M. Z., Handley, C. J. Large aggregating and small leucine-rich proteoglycans are degraded by different pathways and at different rates in tendon. Eur J Biochem. 271 (17), 3612-3620 (2004).
- Rees, S. G., Curtis, C. L., Dent, C. M., Caterson, B. Catabolism of aggrecan proteoglycan aggregate components in short-term explant cultures of tendon. Matrix Biol. 24 (3), 219-231 (2005).
- Taye, N., Karoulias, S. Z., Hubmacher, D. The "other" 15-40%: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon. J Orthop Res. 38 (1), 23-35 (2020).
- Carvalho, H. F., Felisbino, S. L. The development of the pressure-bearing tendon of the bullfrog, Rana catesbeiana. Anat Embryol. 200 (1), 55-64 (1999).
- Carvalho, H. F., Felisbino, S. L., Covizi, D. Z., Della Colleta, H. H., Gomes, L. Structure and proteoglycan composition of specialized regions of the elastic tendon of the chicken wing. Cell Tissue Res. 300 (3), 435-446 (2000).
- van Sterkenburg, M. N., Kerkhoffs, G. M., Kleipool, R. P., Niek van Dijk, C. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study. J Anat. 218 (3), 336-341 (2011).
- Lee, A. H., Elliott, D. M. Comparative multi-scale hierarchical structure of the tail, plantaris, and Achilles tendons in the rat. J Anat. 234 (2), 252-262 (2019).
- Lee, A. H., Elliott, D. M. Multi-Scale Loading and Damage Mechanisms of Plantaris and Rat Tail Tendons. J Orthop Res. 37 (8), 1827-1837 (2019).
- Fan, H. M., Shrestha, L., Guo, Y., Tao, H. R., Sun, Y. L. The twisted structure of the rat Achilles tendon. J Anat. 239 (5), 1134-1140 (2021).
- Cutlip, R. G., Stauber, W. T., Willison, R. H., McIntosh, T. A., Means, K. H. Dynamometer for rat plantar flexor muscles in vivo. Med Biol Eng Comput. 35 (5), 540-543 (1997).
- Rijkelijkhuizen, J. M., Baan, G. C., de Haan, A., de Ruiter, C. J., Huijing, P. A. Extramuscular myofascial force transmission for in situ rat medial gastrocnemius and plantaris muscles in progressive stages of dissection. J Exp Biol. 208 (Pt 1), 129-140 (2005).
- Saxena, A., Bareither, D. Magnetic Resonance and Cadaveric Findings of the Incidence of Plantaris Tendon. Foot Ankle Int. 21 (7), 570-572 (2000).
- dos Santos, M. A., Bertelli, J. A., Kechele, P. R., Duarte, H. Anatomical study of the plantaris tendon: reliability as a tendo-osseous graft. Surg Radiol Anat. 31 (1), 59-61 (2009).
- Sartori, J., Köhring, S., Bruns, S., Moosmann, J., Hammel, J. U. Gaining Insight into the Deformation of Achilles Tendon Entheses in Mice. Adv Eng Mater. 23 (11), 2100085 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados