A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מודל צמח הגפיים האחוריות של מורין לחקר המכנוביולוגיה של פגיעה בגיד אכילס
In This Article
Summary
אנו מציגים פלטפורמה ניסיונית מותאמת אישית ופרוטוקול תרבית רקמה המשחזר שינוי פיברוקרטילגיני המונע על ידי פגיעה בהחדרת גיד אכילס בצמחי גפיים אחוריות מורין עם כדאיות תאים מתמשכת, ומספק מודל מתאים לחקר המכנוביולוגיה של פגיעה בגידים.
Abstract
פגיעה בגידים בעצם יוצרת סביבת מאמץ מכנית רב-צירית עם מתח דחיסה רוחבי מוגבר במידה ניכרת, המעורר פנוטיפ פיברו-סחוס מקומי המאופיין בהצטברות מטריצה עשירה בגליקוזאמינוגליקן (GAG) ועיצוב מחדש של רשת הקולגן. בעוד שסחוס פיברוקרטי הוא תכונה נורמלית באזורים פגועים של גידים בריאים, שקיעת GAG עודפת וחוסר ארגון של רשת הקולגן הם המאפיינים הבולטים של טנדינופתיה. בהתאם לכך, פגיעה מוכרת קלינית כגורם חיצוני חשוב בייזום והתקדמות של גידים. אף על פי כן, המכנוביולוגיה העומדת בבסיס הפגיעה בגידים עדיין לא נחקרה. מאמצים קודמים להבהיר את התגובה התאית לפגיעה בגידים החילו דחיסה חד-צירית על תאים וכריתת צמחי גידים במבחנה. עם זאת, תאים מבודדים חסרים סביבה חוץ-תאית תלת-ממדית החיונית לתגובת מכנו, והן מחקרי מבחנה והן מחקרי explant שנכרתו אינם מצליחים לשחזר את סביבת המאמץ הרב-צירית הנוצרת על ידי פגיעה בגידים in vivo, התלויה במאפיינים אנטומיים של האזור הפגוע. יתר על כן, מודלים in vivo של פגיעה בגידים חסרים שליטה על סביבת המאמץ המכאני. כדי להתגבר על מגבלות אלה, אנו מציגים מודל חדשני של צמח גפיים אחוריות של מורין המתאים לחקר המכנוביולוגיה של פגיעה בגיד אכילס. מודל זה שומר על גיד אכילס באתרו כדי לשמר אנטומיה מקומית ומשחזר את סביבת המאמץ הרב-צירית הנוצרת על ידי פגיעה בהחדרת גיד אכילס על הקלקניוס במהלך דורסיפלקסיה פסיבית של הקרסול תוך שמירה על תאים בסביבתם הטבעית. אנו מתארים פרוטוקול תרבית רקמה אינטגרלי למודל זה ומציגים נתונים המבססים כדאיות מתמשכת של צמחים במשך 7 ימים. התוצאות המייצגות הדגימו צביעת GAG היסטולוגית מוגברת וירידה ביישור סיבי הקולגן משני לפגיעה, מה שמרמז על היווצרות מוגברת של סחוס פיברו-סחוס. מודל זה ניתן להתאמה בקלות לחקר משטרי העמסה מכניים שונים ומאפשר מניפולציה של מסלולים מולקולריים בעלי עניין לזיהוי מנגנונים המתווכים שינוי פנוטיפי בגיד אכילס בתגובה לפגיעה.
Introduction
מספר רב של גידים, כולל גיד אכילס וגידי השרוול המסובב, חווים פגיעה גרמית עקב מיקום אנטומי תקין1,2,3,4. פגיעה בגידים יוצרת מתח דחיסה המופנה באופן רוחבי לציר הסיבים האורכי5,6,7. אזורים של פגיעה בגידים מדגימים פנוטיפ פיברוקרסחוס ייחודי שבו תאים עגולים מכווצים (פיברוכונדרוציטים) מוטמעים בתוך רשת קולגן לא מאורגנת עם תכולת גליקוזאמינוגליקן (GAG) מוגברת במידה ניכרת2,3,4,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24. מחקרים קודמים מצביעים על כך שהסביבה המכנית השונה הנוצרת על ידי פגיעה בגידים מקיימת מטריצה עשירה זו ב- GAG על ידי הנעת שקיעת פרוטאוגליקנים מצטברים גדולים, בעיקר אגרקנים, אם כי המנגנונים הבסיסיים אינם ברורים1,3,12,13,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39. בעוד שסחוס פיברוקרטי הוא תכונה נורמלית באזורים פגועים של גידים בריאים, מטבוליזם פרוטאוגליקני חריג הקשור להיווצרות יתר של פיברו-סחוס הוא מאפיין מובהק של גידים, מחלה נפוצה ומתישה המופיעה באופן לא פרופורציונלי בגידים פגועים כרוניים1,40,41,42,43,44,45,46,47,48,49. בהתאם לכך, פגיעה בגידים מוכרת קלינית כגורם חיצוני חשוב המניע כמה מהגידים הנפוצים ביותר, כולל מחלת השרוול המסובב וגיד אכילס החדרתי (IAT)50,51,52. נכון לעכשיו, הטיפול בגידים אינו יעיל. לדוגמה, כ -47% מהמטופלים עם IAT זקוקים להתערבות כירורגית לאחר ניהול שמרני כושל, עם תוצאות משתנות לאחר הניתוח53,54,55,56. למרות הקשר לכאורה בין פגיעה לגידים, המנגנונים המכנוביולוגיים שבאמצעותם תאים בחוש הגידים הפגוע מגיבים לסביבתם המכנית מתוארים בצורה גרועה, מה שמטשטש את ההבנה של פתוגנזה של טנדינופתיה ומביא לטיפול לקוי.
מודלים של Explant הם כלים שימושיים בחקר מכנוביולוגיה של גידים57,58. כצעד ראשון לקראת הבנת המכנוביולוגיה של פגיעה בגידים, מספר מחקרים קודמים בחנו את התגובה התאית בעקבות יישום דחיסה חד-צירית פשוטה על תאים או צמחים בגידים שנכרתו 27,29,30,31,32,33,34,39. עם זאת, תאים במבחנה חסרים מטריצות חוץ-תאיות ופרי-תאיות המאפשרות העברת זנים, משחררות גורמי גדילה חשובים וציטוקינים המשתחררים על ידי דפורמציה מכנית, ומספקות מצע למתחמי הידבקות מוקדית הממלאים תפקיד במכנוטרנסדוקציה 57,59. בנוסף, מחקרי explant במבחנה וכריתה אינם מצליחים לשחזר את סביבת המאמץ המכנית הרב-צירית הנוצרת על ידי פגיעה בגידים in vivo, התלויה בתכונות אנטומיות של האזור הפגוע 5,6. בהקשר של החדרת גיד אכילס פגוע, זה כולל רקמות מסביב כגון בורסה retrocalcaneal וכרית שומן של Kager 60,61,62,63. לעומת זאת, מודלים in vivo של פגיעה בגידים 25,28,36,37,38,64,65,66 מאפשרים שליטה מינימלית על גודל ותדירות העומס המופעל ישירות על הגיד, שהיא מגבלה מוכרת היטב של מודלים in vivo לחקר מכנוביולוגיה של גידים57,58,67,68,69,70. בהתחשב באתגרים במדידת מתח הגידים in vivo, סביבת המאמץ הפנימית הנוצרת במודלים אלה מאופיינת לעתים קרובות בצורה גרועה.
בכתב יד זה, אנו מציגים פלטפורמה ניסיונית מותאמת אישית המשחזרת פגיעה בהחדרת גיד אכילס על הקלקניוס בתוך צמחי גפיים אחוריות שלמות, אשר בשילוב עם פרוטוקול תרבית רקמה זה, שומרת על כדאיות במשך 7 ימים בתרבית explant ומאפשרת לחקור את sequelae הביולוגי של פגיעה בגידים. הפלטפורמה בנויה על בסיס חומצה פולילקטית מודפסת בתלת ממד (PLA) המספקת את הבסיס לחיבור ידיות האחיזה ותוספת הפחתת נפח PLA מודפסת בתלת מימד. ידיות האחיזה משמשות להידוק הרגל העליונה והברך פרוקסימלית לצומת אכילס מיוטנדי כאשר האספקט הקאודלי של הגפה האחורית פונה כלפי מעלה, מה שמאפשר לצלם את גיד אכילס מלמעלה באמצעות בדיקת אולטרסאונד או מיקרוסקופ הפוך (איור 1A). הפחתת עוצמת הקול מוסיפה שקופיות לאורך מסילה בבסיס ומפחיתה את הנפח הנדרש של מדיית תרבית רקמות. קו קלוע הכרוך סביב הכף האחורית מנותב אל מחוץ לפלטפורמה תוך שימוש בעיצוב הבסיס ובקליפ PLA מודפס בתלת מימד. על-ידי משיכת החוט, הכף האחורית היא דורסיפלקסית, והחדרת גיד אכילס נפגעת כנגד הקלקנאוס, וכתוצאה מכך מתח דחיסה רוחבי מוגבר 5,6 (איור 1A). הפלטפורמה כלולה בתוך אמבט אקרילי השומר על חצילי הגפה האחורית השקועים במצע תרבית רקמות. הצמדת החוט המתוח לחלק החיצוני של האמבטיה באמצעות סרט הדבקה שומרת על דורסיפלקסיה של הקרסול כדי לייצר פגיעה סטטית בהחדרת גיד אכילס. קובצי CAD עבור רכיבים מודפסים בתלת-ממד מסופקים בפורמטים מרובים (קובץ משלים 1), המאפשרים ייבוא למגוון תוכנות CAD מסחריות וחינמיות בקוד פתוח לשינוי בהתאם לצרכים ניסיוניים. אם הגישה למדפסות תלת-ממד אינה זמינה לייצור, ניתן לספק קובצי CAD לשירותי הדפסה תלת-ממדית מקוונים שידפיסו וישלחו את החלקים בעלות נמוכה.
חשוב לציין, קומפלקס השרירים triceps surae-Achilles משתרע הן על מפרקי הברך והן על מפרקי הקרסול 71,72,73. כתוצאה מכך, מתח מתיחה בגיד אכילס מושפע מכיפוף הברך. הארכת הברך מכניסה את גיד אכילס למתח, ואילו כיפוף הברך מפחית מתח. על ידי הארכה ראשונה של הברך ולאחר מכן באופן פסיבי דורסיפלקס של הקרסול, מתחים דחוסים בהחדרה הפוגענית יכולים להיות מופעלים על מתח מתיחה. לעומת זאת, על ידי דורסיפלקס פסיבי של הקרסול עם הברך מכופפת, מתח המתיחה מופחת, ומתח דחיסה נשאר. הפרוטוקול הנוכחי בוחן שלושה תנאים כאלה. 1) עבור פגיעה סטטית, כף הרגל היא dorsiflexed ל < 110° ביחס לטיביה כדי לפגוע בהחדרה, עם הברך מכופפת כדי להפחית את המתח. 2) עבור קבוצת המתח הבסיסית, הקרסול מוארך מעל 145° של dorsiflexion עם הברך מורחבת, מה שיוצר בעיקר מתח מתיחה בהחדרה. 3) עבור הקבוצה הפרוקה מתורבתים בצלחת פטרי כאשר הברך והקרסול בתנוחות ניטרליות בהיעדר עומס חיצוני. הזוויות הנזכרות לעיל נמדדות בצילום ביחס למערכת קואורדינטות שבה כף הרגל והשוקה מקבילות בזווית של 180° ובניצב בזווית של 90°.
השלבים העיקריים של הפרוטוקול כוללים: 1) דיסקציה של עציצים בגפיים האחוריות והסרה זהירה של העור וגיד הפלנטריס; 2) תרבית צמחים לאחר טיפול מקדים dexamethasone 48 שעות; 3) חתך רקמות וצביעה היסטולוגית; ו-4) ניתוח תמונת צבע להערכת היווצרות פיברו-סחוס. לאחר נתיחה, כל חציל גפיים אחוריות מטופל במשך 48 שעות במדיה תרבית בתוספת dexamethasone74. גפיים נגדיות מכל עכבר מוקצות לקבוצות ניסוי נפרדות להשוואה זוגית, המסייעת לשלוט בשונות הביולוגית. לאחר טיפול מקדים, צמחים ממוקמים בפלטפורמות כפי שתואר לעיל ומתורבתים במשך 7 ימים נוספים (איור 1B). השוואות נוספות נעשות לקבוצה שטופלה מראש (יום 0) שבה מוציאים צמחים מיד לאחר הטיפול המקדים של 48 שעות.
לאחר תרבית explant, הגפיים האחוריות נחתכות כלפי מטה, פורמלין קבוע, מסויד ומשובץ בפרפין. חתך טורי בכיוון סגיטלי מספק הדמיה של גיד אכילס מהצומת המיוטנדי ועד החדרת הקלקניאל תוך שהוא מאפשר מעקב אחר עומק החתך לאורך הגיד כולו. תיוג dUTP X-nick (TUNEL) בתיווך dUTP X-nick (TUNEL) משמש להמחשת נזק לדנ"א משני לאפופטוזיס ולהערכת כדאיות. היסטולוגיה כחולה של Toluidine וניתוח תמונות צבע מותאמות אישית מבוצעים כדי לכמת שינויים בצביעת GAG. לאחר מכן מקטעי רקמה מוכתמים בצבע כחול טולוידין משמשים להדמיית SHG כדי לאפיין שינויים בארגון סיבי הקולאז' (איור 1B).
התוצאות המייצגות שסופקו מצביעות על שינוי בצביעה היסטולוגית של מטריצה עשירה ב- GAG וחוסר ארגון של רשת הקולגן החוץ תאי שנוצר על ידי 7 ימים של פגיעה סטטית בתוך המודל. מודל זה יכול לשמש לחקר מנגנונים מולקולריים העומדים בבסיס שינוי פיברוקרטילגיני מונע פגיעה.
Protocol
כל עבודת בעלי החיים אושרה על ידי הוועדה למשאבי בעלי חיים של אוניברסיטת רוצ'סטר.
1. הכנת מדיה של תרבית רקמות
- תרבית כל הצמחים במדיום הנשר המעובד של דולבקו (1x DMEM) עם 1% v/v פניצילין-סטרפטומיצין ו-200 מיקרומטר חומצה L-אסקורבית באינקובטור ב-37°C ו-5% CO2. עבור הטיפול המקדים הראשוני של 48 שעות, תרבית כל צמח ב 70 מ"ל של מדיה תרבותית בתוספת 100 ננומטר dexamethasone74. לאחר טיפול מקדים, תרבית גפיים במשך 7 ימים נוספים ללא dexamethasone, החלפת מדיה כל 48-72 שעות.
הערה: הוספת סרום, כגון נסיוב בקר עוברי, לתקשורת התרבית אינה מומלצת בהתאם להמלצות שסופקו על ידי Wunderli, Blache ו- Snedeker57. בקצרה, תנאים נטולי סרום מייצגים טוב יותר את המיקרו-סביבה האווסקולרית והדלה בחומרים מזינים בגידים הקיימת in vivo. יתר על כן, תוספת סרום יכולה לקדם השפלה של רקמות בתנאי תרבית מסוימים75 ולעורר שגשוג תאים ונדידה אל מחוץ לרקמה, שני מאפיינים של פתולוגיה של גידים57. - עבור הקבוצה שנפרקה, תרבית כל צמח ב 70 מ"ל של מדיה. עבור קבוצות המתח הבסיסי והפגיעה הסטטית, כל פלטפורמה דורשת כ-125 מ"ל של מדיה תרבותית כדי לשמור על הגפה שקועה במים. נפח זה יכול להשתנות בהתאם למיקום הרגל העליונה בידיות האחיזה ובפרמטרים של הדפסה תלת-ממדית, בעיקר צפיפות המילוי.
2. דיסקציה של צמחים וטיפול מקדים בדקסמטזון
- יש להרדים עכברים באמצעות שאיפתCO2 ונקע משני של צוואר הרחם, או בהתאם להנחיות המוסדיות. פרוטוקול זה משתמש בעכברי C57BL/6 בני פחות משנה. גודל הגפיים האחוריות יגדל עם הגיל ועשוי להיות מאתגר להתאים לאחיזות.
- לפני הנתיחה, יש להעביר 70 מ"ל של תרבית מחוממת מראש (37°C) לצלחת פטרי בגודל 100 מ"מ (קוטר) x 25 מ"מ (גובה) בארון בטיחות ביולוגי סטרילי (BSC). הוסף dexamethasone כדי להשיג ריכוז עבודה 100 ננומטר.
- ניתן לבצע דיסקציות על הספסל באמצעות רפידות תחתונות סופגות, לעבוד במהירות דרך הדיסקציה לפני העברת צמחים בגפיים האחוריות לתוך BSC. להרכיב את הכלים הכירורגיים הדרושים לדיסקציה זו הכוללים מלקחיים חלקים, ישרים ועדינים; מלקחיים ישרים, עדינים עם שיניים משוננות; ומספריים ישרים, חדים ועדינים.
- לדיסקציה של עציצים בגפה האחורית, הניחו את העכבר במצב שכיבה וזהו את מפרק הירך. בעזרת מספריים עדינים, בצע חתך קטן (5-10 מ"מ) דרך העור המכסה את האספקט הפרוקסימלי והקדמי (גולגולתי) של הרגל העליונה.
- פרקו את החתך כדי להתרחב, צבטו את הרגל העליונה החשופה באמצעות אצבעות, ומשכו בזהירות את העור כדי להוריד את הגפה האחורית לגובה הקרסול. מכניסים בעדינות להב מספריים אחד מתחת לעור לאורך האספקט הגבי של כף הרגל ומבצעים חתך הנמשך עד אצבעות הרגליים. המשך למשוך את העור באופן מרוחק כדי להסיר לחלוטין.
- מקם את העכבר כדי להמחיש את החדרת גיד אכילס על האספקט האחורי (קאודלי) של הקלקנאוס, ליד הקרסול. פרוקסימלי להחדרת גיד אכילס, גיד הפלנטריס צמוד ישירות לגבול המדיאלי של גיד אכילס ומשתרע באופן מרוחק לכיוון האספקט הפלנטרי של כף הרגל, עובר מעל האספקט האחורי של הקלקניאוס.
- כדי להסיר את גיד הפלנטריס יש להכניס בזהירות קצה אחד של המלקחיים החלקים והעדינים בין שני הגידים ולהאריך את הקצה העובר מדיאלית מתחת לגיד הפלנטרי. ציירו את הקצה בסמיכות וקרעו דרך שריר הפלנטריס. בעזרת קצה דק, מלקחיים משוננים, תופסים את הקצה הפרוקסימלי המנותק של גיד הפלנטריס ומושכים בצורה דיסטריאלית להסרה.
- במפרק הירך, השתמש במספריים עדינים כדי לחתוך דרך האגן ולבודד את הגפה האחורית. השתמש במספריים כדי לחטט באגן שנותר ולחשוף את ראש עצם הירך.
- מעבירים את החציל של הגפה האחורית ל-BSC ולצלחת המכילה מדיה של תרבית תאים עם דקסמתזון. מעבירים את המנה לאינקובטור ומטפלים במשך 48 שעות.
3. תרבית Explant ופלטפורמות טעינה
- כפי שמסתיים הטיפול המקדים של 48 שעות, מחממים מראש נפחים מספיקים של מדיה תרבותית (סעיף 1). מכאן ואילך לא יתווסף דקסמתזון לתקשורת התרבות. בשלב זה, ניתן לתקן, לפרק ולהטמיע גפיים מהקבוצה שטופלה מראש (יום 0) בפרפין לצורך חתך, צביעה וניתוח עתידיים.
- עבור הקבוצה שנפרקה, שאפו מדיה טרום טיפול והעבירו עציצים לצלחות פטרי טריות, הוסיפו 70 מ"ל של מדיה תרבותית כל אחת, וחזרו לחממה.
- עבור קבוצות המתח הבסיסי והפגיעה הסטטית, הכינו פלטפורמות explant. חתכו חתיכות נייר זכוכית הדומות בגודלן ללוחות האחיזה. עבור קבוצת הפגיעה הסטטית, חתכו חתיכות של קו קלוע באורך של כ -18 אינץ 'וקשרו מראש קשר רופף באמצע הדרך לאורך הקו. קרעו חתיכות של רדיד אלומיניום כדי לכסות כל אמבטיה אקרילית ורססו באתנול 70% (EtOH). העברת ההכנות ל- BSC.
- כל פלטפורמה כוללת אמבטיה אקרילית, בסיס, תוספת הפחתת נפח, תפס וידיות. כל ידית אחיזה כוללת שתי פלטות ושלושה סוגים שונים של ברגים, כולל בורג אחד M5 x 0.8 מ"מ x בורג באורך 10 מ"מ המחבר את ידיות האחיזה לבסיס; שני ברגים באורך M6 x 1 מ"מ x 20 מ"מ המאריכים את הצלחות כדי להדק את האחיזות; וארבעה ברגי חוט M3 x 0.5 מ"מ x 14 מ"מ אורך, אשר בשילוב עם ארבעה קפיצי דחיסה, מושכים את הלוחות כדי לפתוח את ידיות האחיזה.
- מקם את כל הרכיבים במיכלים משניים המסוגלים ללכוד את כל מדיה תרבותית במקרה של דליפה. יש לטבול בתמיסת אקונומיקה 10% ≥ ולהשרות למשך שעה לפחות. יש לשטוף את תמיסת האקונומיקה במי ברז (אוטוקלאבה לפי הצורך) ולעבור ל-BSC.
הערה: לפתרון בעיות זיהום, שקול לבצע אוטוקלאבינג של כל מי הברז או להשתמש במים מטוהרים. עיין בדיון לקבלת טיפים נוספים לטיפול בזיהום. - השתמש בברגי M3 ובקפיצי דחיסה כדי לחבר פלטות לידיות האחיזה, חבר את ידיות האחיזה לבסיס באמצעות בורג M5, והכנס את ברגי M6 עד שהם מתחברים לפלטות. השתמש בסרט דו-צדדי כדי להצמיד נייר זכוכית ללוחות, ולאחר מכן סגור את ידיות האחיזה כדי לקדם הדבקה של נייר הזכוכית ללוחות. חזור על הפעולה עבור כל הפלטפורמות.
- כאשר אתם מוכנים להעמיס פלטפורמה, פתחו את ידיות האחיזה במלואן והשתמשו במלקחיים, הניחו את הרגל העליונה והברך בין הפלטות כאשר המשטח השטחי של גיד אכילס פונה כלפי מעלה (איור 1A). סגור באופן רופף את ידיות האחיזה כדי להחזיק בעדינות במקומן.
- השתמש במלקחיים כדי לתפוס את ראש הירך החשוף או כף הרגל ולתפעל את זווית כיפוף הברך כשאתה סוגר בהדרגה את האחיזות כדי להבטיח את מקומן. עבור קבוצת המתח הבסיסית, האריכו את מפרק הברך כפי שתואר קודם לכן. כאשר האחיזות מתהדקות עם הברך מורחבת, הקרסול אמור להתרחב באופן טבעי. עבור קבוצת הפגיעה הסטטית, כופפו את מפרק הברך בין האחיזות כפי שתואר קודם לכן.
- עבור קבוצת הפגיעה הסטטית, מניחים את הקשר העילי של המיתר סביב הכף הדיסטלית ומהדקים. מנתבים את החוט דרך חריץ בבסיס הממוקם מתחת לאקספלנט ודרך חור הקליפ. הניחו את הבסיס לתוך האמבטיה האקרילית והדקו את האטב לקצה העליון של האמבטיה (איור 1A).
- משוך את החוט כדי לסמן את כף הרגל ל-110° לפחות ביחס לשוקה, והשתמש בטוש קבוע כדי לסמן את המיתר כשהוא יוצא מהקליפס. צלמו את האקספלנט במיקום הזה כדי לכמת מאוחר יותר את זווית הדורסיפלקסיה (איור 1A).
- הסר את הבסיס וחבר את תוספת הפחתת עוצמת הקול על-ידי החלקה לאורך מסילה בבסיס. החזירו את הבסיס (המחובר כעת לתוספת הפחתת הנפח) לאמבטיה האקרילית ומקמו מחדש את האטב בקצה העליון. משוך את החוט כדי לחזור לזווית הדורסיפלקסיה המקורית באמצעות המיתר המסומן כקו מנחה וחבר את החוט לחלק החיצוני של האמבטיה באמצעות סרט דבק כדי לשמור על דורסיפלקסיה סטטית.
- עבור קבוצת המתח הבסיסית, פשוט מקם את הבסיס עם הכנסת הפחתת נפח לתוך האמבטיה האקרילית ברגע שהחציל ממוקם בין ידיות האחיזה וצלם תמונה לכימות זווית הדורסיפלקסיה.
- הוסף 125 מ"ל של מדיה תרבית מחוממת מראש (37 ° C) לכל פלטפורמה כדי לטבול explant. מכסים את החלק העליון של האמבטיה ברדיד אלומיניום, מניחים במיכל משני ועוברים לאינקובטור. תרבות במשך 7 ימים נוספים, החלפת מדיה כל 48-72 שעות.
הערה: סרט הדבקה המונח לאורך החלק העליון של האמבטיה יכול למנוע מחלקי PLA לצוף.
4. קיבוע, הסתיידות והטבעה פרפין
- לאחר תרבית אקספלנט, השתמשו במספריים כדי לקצץ ציפורניים / בהונות דיסטליות ולחתוך את הרגל העליונה פרוקסימלית לצומת אכילס מיוטנידי. הכניסו כל מפרק קרסול גזוז לקסטת עיבוד מרופדת ברפידות ביופסיה מוקצפות. דחפו את הקרסול לפינת הקלטת כדי למקם את הקרסול בטמפרטורה של כ-90° dorsiflexion וסגרו את הקלטת כדי להישאר במקומה.
- יש לתקן למשך 3 ימים ב-10% פורמלין חוצץ נייטרלי (NBF) ולהסתייד למשך שבועיים בחומצה אתילאנדימנטטראאצטית (EDTA) המומסת במים מזוקקים (diH2O) עם pH מותאם ל-7.4-7.6 עם חומצה אצטית קרחונית.
- כדי להסיר מלחים, יש לשטוף ביסודיות את הדגימות שלוש פעמים במי מלח חוצצים פוספט 1x (PBS) ולאחר מכן diH2O, 5 דקות כל אחת. בצע עיבוד דגימה שגרתי עבור היסטולוגיה פרפין: להתייבש באמצעות סדרה מדורגת של EtOH, ברור ב xylene, לחדור עם שעוות פרפין. לכוון ולהטמיע דגימות בפרפין כדי לקבל קטעי רקמת קשת דרך גיד אכילס בהתקדמות מדיאלית לצדדית כמתואר בסעיף 5 להלן (איור 1B).
5. חתך רקמות
- בעזרת מיקרוטום, חותכים בזהירות לתוך הדגימה עד שמקטעים מקבילים לפני הבלוק. חיתוך גס לתוך הקרסול מהאספקט המדיאלי של המפרק, עצירה לפני הגעה לגבול המדיאלי של החדרת גיד אכילס.
- העבירו את הדגימה לגוש קרח כדי להתאים את הטמפרטורה וההידרציה, והחליפו להבים (או העבירו לחלק חדש של הלהב הנוכחי). המשך חתך לתוך הדגימה בעובי 10 מיקרומטר וזהה בזהירות כניסה להחדרת גיד אכילס במיקרוסקופ שדה בהיר. לאחר הזיהוי, בצע חתך טורי מעקב אחר מספר המקטע (כלומר, עומק הרקמה) דרך כל החדרת גיד אכילס.
6. דה-פרפיניזציה/התייבשות ובחירת שקופיות
- עבור כל בדיקה להלן, בחר קטעי רקמה תואמים ברמה מכל זוג גפיים נגדיות. לפני הצביעה, הניחו על מדף שקופיות ועברו 3 שינויים של קסילן, 2 שינויים של 100% EtOH, 2 שינויים של 95% EtOH ושינוי אחד של 70% EtOH, 5 דקות כל אחד. סיים את ההתייבשות ב- diH2O.
7. TUNEL להערכת כדאיות גיד אכילס
- לסימון TUNEL, יש לצבוע בהתאם לפרוטוקול היצרן. יש לדגור בפרוטאינאז K של 20 מיקרוגרם/מ"ל למשך 20 דקות בטמפרטורת החדר ולשטוף ב-diH2O. לדגור ב-50 מיקרוליטר של תמיסת כתמים TUNEL (תמיסת אנזים 5 μL, תמיסת תווית 45 μL) למשך שעה אחת ב-37°C. יש לשטוף ב-diH2O. Mount עם מגיב נוגד דהייה המכיל DAPI ו-coverslip.
- דמיינו את החדרת גיד אכילס באמצעות מיקרוסקופ פלואורסצנטי עם עדשה אובייקטיבית 4x. כלול ערוץ DAPI (אורכי גל עירור/פליטה = 360/460 ננומטר) כדי להמחיש את כל הגרעינים, ערוץ TUNEL (TMR Red) (אורכי גל עירור/פליטה = 540/580 ננומטר) כדי להמחיש גרעינים אפופטוטיים, ואם אפשר, ערוץ שדה בהיר.
- לניתוח תמונות, יש לייבא תמונות לתוכנת ניתוח תמונות המתאימה לעיבוד מבוסס ROI, כגון FIJI/ImageJ או MATLAB. הגדירו אזור מעניין (ROI) המתאר את כל גיד אכילס (איור 2A), למעט תאים באפיטנון שרגישים מאוד למוות שנגרם על-ידי דיסקציה ושינוי פתאומי בתנאי הסביבה כאשר הם מוכנסים לתרבית.
- לשם כך, בצעו בחירת ROI ב- MATLAB על ידי ייבוא תמונת שדה הבהירות ושימוש בפונקציה drawpolygon() כדי לעקוב אחר גבולות הגיד ולהקיף אותם. MATLAB יוצרת אובייקט מצולע עבור החזר ההשקעה, אותו ניתן להחיל לאחר מכן על תמונות בערוצי DAPI ו-TUNEL כדי להסוות נתוני עוצמת פיקסלים מחוץ ל-ROI באמצעות createMask() כדי לנתח רק גרעינים בתוך גיד אכילס.
- ייבא את תמונות ערוצי DAPI ו- TUNEL וזהה סף עוצמת פלואורסצנטיות להגדרת גרעינים אפופטוטיים (TUNEL+) על ידי נרמול לעוצמה הפלואורסצנטית המרבית של גרעינים אפופטוטיים ברקמות שאינן בנות קיימא כגון עצם, שריר או שומן שנלכדות במקרה באזור הרקמה. לאחר מיסוך התמונות, חשבו את שבר הגרעינים האפופטוטיים (גרעיני TUNEL+/DAPI) בתוך גיד אכילס.
8. היסטולוגיה כחולה טולוידין לאפיון היווצרות סחוס פיברוקרטי
- לאחר התייבשות מחדש (סעיף 6), העבר את מדף השקופיות עם קטעי רקמות תואמים ברמה מזוגות נגדיים של חצילים ל- 0.4% w / v Toluidine כחול O במאגר נתרן אצטט 0.1 M עם pH מותאם ל 4.0 באמצעות חומצה אצטית קרחונית. יש לדגור במשך 10 דקות בטמפרטורת החדר, ולאחר מכן לשטוף 3x ב diH2O במשך 30 שניות כל אחד.
- התייבש באמצעות שלושה שינויים של 95% EtOH ושני שינויים של 100% EtOH, 30 שניות כל אחד. נקה באמצעות שלושה שינויים של xylene, 1 דקה כל אחד. כיסויים עם אמצעי הרכבה מבוססי קסילן.
- קבל תמונות צבע אדום-כחול-ירוק (RGB) של 24 סיביות של החדרת גיד אכילס. לדוגמה, עבור פרוטוקול זה השתמש במתאם כדי לממשק מצלמה צבעונית דיגיטלית לעינית של מיקרוסקופ שדה בהיר פשוט עם מטרה 4x.
- כדי לכמת את ההבדלים בצביעה הכחולה של טולוידין בתוך הסחוס הפיברוקרטי של הגיד הדחוס (CTF)16 בהחדרת גיד אכילס (איור 3A,B), ייבאו תמונות RGB לתוכנת ניתוח תמונות המסוגלת להגדיר ולנהל ROI מרובים. האפשרויות כוללות את הבחירות וכלי ניהול החזר ההשקעה ב-FIJI/ImageJ או את ארגז הכלים לעיבוד תמונה ב-MATLAB. התחל בהגדרת קנה המידה של הפיקסל/אורך.
הערה: בחירת התוכנה נתונה לשיקול דעתו של החוקר ובוודאי שאינה מוגבלת ל-MATLAB או FIJI/ImageJ. המחברים סיפקו קוד MATLAB (קובץ משלים 2), תיעוד המתאר את היישום (קובץ משלים 3) ותמונה לדוגמה (קובץ משלים 4). אנו מעודדים חוקרים לתרגם קוד זה לשפות תכנות חלופיות לשימוש בתוכנות אחרות לפי הצורך או העדפה. - עם התמונה המוצגת בתוכנה הנבחרת, זהה את ההצטלבות של גבול הגיד העמוק עם הקלקניאוס. מכאן, עקבו בסמיכות 800 מיקרומטר לאורך גבול הגיד העמוק כדי לקבוע את הגבול העמוק של CTF. לדוגמה, השתמשו בפונקציה drawpolyline() ב- MATLAB כדי לצייר קו פוליליין באופן אינטראקטיבי על תמונת RGB. MATLAB יוצרת אובייקט פוליליין המכיל את קודקודי הקו, אותו ניתן לעבד ולקצץ לאורך של 800 מיקרומטר.
- ממיקום זה, צור את הגבול הפרוקסימלי של CTF על ידי שרטוט קטע קו המתחבר לגבול הגיד השטחי המאונך לכיוון הסיב המקומי.
- חזרו להצטלבות גבול הגיד העמוק והקלקניוס והגדירו את הגבול הדיסטלי של ה-CTF על ידי שרטוט קטע קו המתחבר לגבול הגיד השטחי לאורך סימן הגאות המובהק המפריד בין ה-CTF לבין אזור החיבור פיברו-סחוס (AZF)16 (איור 3A,B). לבסוף, צור את הגבול השטחי של CTF על ידי מעקב אחר גבול הגיד השטחי כדי להקיף.
- כדי לתאר שינויים מרחביים בצביעת GAG לאורך ההחדרה, חלקו את ה-CTF הכולל ל-4 רבעים (איור 3A,B). חבר את נקודת האמצע של גבולות CTF העמוקים והשטחיים עם קטע קו ליצירת גבול דיסטלי/פרוקסימלי. עוברים דרך נקודת האמצע של גבול זה, מחברים את נקודות האמצע של גבולות CTF הדיסטליים והפרוקסימליים לאורך כיוון הסיב כדי ליצור גבול שטחי/עמוק.
- 6 גבולות אלה מספקים מידע שניתן להשתמש בו כדי להגדיר את החזר ההשקעה המייצג את CTF כולו, אך גם 4 רבעים המחלקים את CTF. ב- MATLAB, לדוגמה, הידור קודקודים המגדירים את הגבולות של כל ROI בודד (CTF, רבעים 1-4) לווקטורים והשתמש ב- images.roi.Polygon() כדי ליצור אובייקטי מצולע סגורים עבור כל החזר השקעה.
- לאחר הגדרת החזר השקעה, המירו נתוני פיקסלים RGB למרחב הצבעים גוון-רוויה-ערך (HSV) באמצעות תוסף שנאי הצבעים בפיג'י, הפונקציה rgb2hsv() ב- MATLAB או תוכנה אחרת המחילה את משוואות ההמרה המתאימות76. לאחר מכן ניתן להקרין נתוני HSV לתוך מרחב רוויית הגוון הדו-ממדי, שבו כל שילוב של גוון ורוויה מקודד צבע ייחודי (איור 3C).
- בתוך כל החזר השקעה, חשב את הגוון הממוצע והרוויה המתארים את צבע הכתם הממוצע בהחזר ההשקעה. ניתן להשיג זאת ב- MATLAB, לדוגמה, על ידי שימוש באובייקטי מצולע המגדירים כל החזר השקעה כדי להסוות את התמונה באמצעות createMask() על מנת לנתח נתוני פיקסלים רוויי גוון באופן ספציפי בתוך כל החזר השקעה.
- הגדירו החזר השקעה קטן נוסף בתוך הסחוס הפיברוקרטלי הפריאוסטאלי (PF)16 (איור 3A, B) וחשבו את הגוון והרוויה הממוצעים. לאחר מכן, חשבו את המרחק האוקלידי המפריד בין הצבע הממוצע בכל החזר השקעה של CTF לזה של PF (איור 3C).
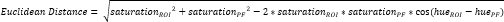
הערה: חישוב המרחק האוקלידי מתאר את מידת הדמיון בין הצבע הממוצע של החזר ההשקעה לזה של ה- PF, רקמה פיברוקרטילגית מובהקת 16,17,77. מרחק אוקלידי קטן יותר מציין צבע ROI שהוא פיברוקרטילגיני יותר במראה. - השתמש במרחק זה כדי לחשב את הניקוד של פיברו-סחוס, המניח ערך מרבי של 1 אם צבע החזר ההשקעה זהה לצבע PF וערך מינימלי של -1 אם צבע החזר ההשקעה וצבע PF מגיעים להפרדה מרבית בתוך מרחב הצבעים של רוויית הגוון.
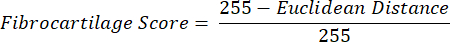
- נתונים ממוצעים עבור גוון, רוויה וציון פיברו-סחוס בתוך כל החזר השקעה על פני חלקי רקמה מכל גפה. בצע השוואות סטטיסטיות זוגיות בין קבוצות של גפיים נגדיות.
9. הדמיית SHG לחקר שינוי בארגון רשת הקולגן
- בצע הדמיית SHG של החלקים המוכתמים בכחול טולוידין באמצעות מערכת מיקרוסקופ בעלת יכולת עם עדשת אובייקט 20x. רכשו ערימות z דרך עובי החתך ובצעו סריקת אריחים לפי הצורך כדי ללכוד באופן מלא את החדרת גיד אכילס.
- ייבא תמונות SHG לתוכנת ניתוח תמונה מועדפת והגדר החזר השקעה המקיף ומחלק את ה- CTF בהחדרת גיד אכילס כמתואר בניתוח התמונה הכחולה של טולוידין בסעיף 8 (איור 4A,B).
- אם תמונות SHG מיובאות ל- MATLAB, השתמשו בגישה להגדרת החזר השקעה של CTF ב- MATLAB כמתואר בסעיף 8. לאחר הגדרת החזר השקעה, העבר קואורדינטות ROI לפיג'י על ידי ייצוא קודקודי ROI מ- MATLAB כקבצי .txt וייבוא ל- FIJI באמצעות קואורדינטות File > Import >- XY. שכבת על הבחירה ושלח למנהל החזר ההשקעה לניתוח.
- כדי לכמת את ארגון הקולגן, השתמשו בתוסף Directionality בפיג'י, המבצע ניתוח ספקטרום פורייה כדי לחשב התפלגות כיווני סיבים על פני חלונות קטנים המשתרעים על החזר השקעה. ההתפשטות של התפלגות זו, המכונה פיזור, קשורה ביחס הפוך ליישור סיבים.
הערה: סיבי קולגן עשויים להניח כיוונים משתנים בחלונות שונים על פני CTF עקב עקמומיות גסה של הגיד ולא היעדר יישור/ארגון. כדי להבחין טוב יותר בין שינויים בארגון הקולגן לבין עקמומיות גסה של הגיד בעת החדרתו, יש צורך להגדיר ROI קטנים יותר. - ייבאו תמונות SHG לפיג'י והגדירו את קנה המידה של הפיקסלים/אורך. הקרן נתונים בעוצמה מרבית של פיקסלים בתמונה דו-ממדית ללא הפרדות צבע והוסף ROI למנהל החזר ההשקעה. שכב ברצף כל החזר השקעה של CTF על התמונה וצייר 10 תת-ROI קטנים בגודל עקבי בתוך החזר ההשקעה, תוך הוספת החזר ההשקעה למנהל החזר ההשקעה.
- בתוך כל תת-החזר השקעה, הפעל את תוסף הכיווניות בפיג'י כדי לחשב פיזור סיבים. נתוני פיזור ממוצעים בין תת-ROI בתוך כל החזר השקעה של CTF, ונתוני פיזור ממוצעים בתוך כל החזר השקעה של CTF על פני מקטעים מכל explant. בצע השוואות סטטיסטיות זוגיות בין קבוצות של גפיים נגדיות.
תוצאות
תמונות מייצגות של קטעי רקמה מוכתמים בטונל מדגימות גרעינים אפופטוטיים מינימליים בגוף גיד אכילס לאחר 7 ימים של תרבית צמחים בקבוצות ניסוי (איור 2A). כימות התמונות האלה מספק ראיות לכך שפרוטוקול תרבית הרקמה שומר על כדאיות של עד 78% בממוצע בתוך גיד אכילס לאחר 7 ימים של תרבית חצילים ?...
Discussion
פלטפורמת ההשתלה הניסיונית של הגפיים האחוריות בשילוב עם פרוטוקול תרבית הרקמה המתואר במחקר זה מספקים מודל מתאים לחקר המכנוביולוגיה של היווצרות פיברו-סחוס מונע פגיעה בהחדרת גיד אכילס. התועלת של מודל explant זה מודגמת על ידי התוצאות המייצגות, המצביעות על שמירה על כדאיות התא במקביל לשינוי משמעו?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים אסירי תודה על התמיכה והסיוע שניתנו על ידי ג'ף פוקס ווידיה ונקטריני ממרכז רוצ'סטר לחקר השלד והשרירים של אוניברסיטת רוצ'סטר, הממומן בחלקו על ידי P30AR06965. בנוסף, המחברים רוצים להודות למרכז למיקרוסקופ אור וננוסקופיה (CALMN) במרכז הרפואי של אוניברסיטת רוצ'סטר על הסיוע במיקרוסקופ מולטיפוטונים. מחקר זה מומן על ידי R01 AR070765 ו- R01 AR070765-04S1, כמו גם 1R35GM147054 ו- 1R01AR082349.
Materials
| Name | Company | Catalog Number | Comments |
| Absorbent underpads | VWR | 82020-845 | For benchtop dissection |
| Acrylic bath | Source One | X001G46CB1 | Contains the explant platform submerged in culture media |
| Autoclave bin | Thermo Scientific | 13-361-20 | Used as secondary containment, holds two platforms |
| Base | - | - | 3D printed from CAD files provided as Supplementary Files |
| Braided line | KastKing | 30lb test | Used to wrap around paw and apply ankle dorsiflexion |
| Clip | - | - | 3D printed from CAD files provided as Supplementary Files |
| Cover glass | Fisherbrand | 12-541-034 | Rectangular, No. 2, 50 mm x 24 mm |
| Cytoseal XYL | VWR | 8312-4 | Xylene-based mounting media for coverslipping Toluidine blue stained tissue sections |
| Dexamethasone | MP Biomedical LLC | 194561 | CAS#50-02-2 |
| Dimethyl sulfoxide (DMSO), anhydrous | Invitrogen by ThermoFisher | D12345 | CAS#67-68-5, use to solubilize dexamethasone into concentrated stock solutions |
| Double-sided tape | Scotch Brand | 34-8724-5195-9 | To attach sandpaper to Grip platens |
| Dulbecco's Modified Eagle Medium (1X DMEM) | Gibco by ThermoFisher | 11965092 | high glucose, (-) pyruvate, (+) glutamine |
| EDTA tetrasodium salt dihydrate | Thermo Scientific Chemicals | J15700.A1 | CAS#10378-23-1, used to make 14% EDTA solution for sample decalcifcation |
| Ethanol, 200 proof | Thermo Scientific | T038181000 | CAS#64-17-5, 1 L supply |
| Foam biopsy pads | Leica | 3801000 | Used with processing cassettes, help hold ankle joints in desired position during fixation and decalcification |
| Forceps, #SS Standard Inox | Dumont | 11203-23 | Straight, smooth, fine tips |
| Forceps, Micro-Adson 4.75" | Fisherbrand | 13-820-073 | Straight, fine tips with serrated teeth |
| Garnet Sandpaper, 50-D Grit | Norton | M600060 01518 | Or other coarse grit sandpaper |
| Glacial acetic acid | Fisher Chemical | A38S-500 | CAS#64-19-7, for adjusting pH of sodium acetate buffer used for Toluidine blue histology, as well as 14% EDTA decalcification solution |
| Grips | ADMET | GV-100NT-A4 | Stainless steel vice grips, screws and springs described in the protocol are included |
| Histobond Adhesive Microscope Slides | VWR | 16005-108 | Sagittal sections of hind limbs explants reliably adhere to these slides through all staining protocols |
| In situ Cell Death Detection Kit, TMR Red | Roche | 12156792910 | TUNEL assay |
| Labeling tape | Fisherbrand | 15-959 | Or any other labeling tape of preference |
| L-ascorbic acid | Sigma-Aldrich | A4544-100G | CAS#50-81-7, for culture media formulation |
| Neutral buffered formalin, 10% | Leica | 3800600 | For sample fixation, 5 gallon supply |
| Nunc petri dishes | Sigma-Aldrich | P7741-1CS | 100 mm diameter x 25 mm height, maintain explants submerged in 70 mL of culture media as described in protocol |
| Penicillin-streptomycin (100X) | Gibco by ThermoFisher | 15140122 | Add 5 mL to 500 mL 1X DMEM for 1% v/v (1X) working concentration |
| Polylactic acid (PLA) 1.75 mm filament | Hatchbox | - | Choose filament diameter compatible with your 3D printer extruder, in color of choice. |
| Processing cassettes | Leica | 3802631 | For fixation, decalcification and paraffin embedding |
| Prolong Gold Antifade Reagent with DAPI | Invitrogen by ThermoFisher | P36931 | Mounting media for coverslipping tissue sections after TUNEL |
| Proteinase K | Fisher BioReagents | BP1700-50 | CAS#39450-01-6, used for antigen retrieval in TUNEL protocol |
| Scissors, Fine | FST | 14094-11 | Straight, sharp |
| Slide Staining Set, 12-place | Mercedes Scientific | MER 1011 | Rack with 12 stain dishes and slide dippers for Toluidine blue histology |
| Sodium acetate, anhydrous | Thermo Scientific Chemicals | A1318430 | CAS#127-09-3, used to make buffer for Toluidine blue histology |
| Tissue-Tek Accu-Edge Low Profile Microtome Blades | VWR | 25608-964 | For paraffin sectioning |
| Toluidine Blue O | Thermo Scientific Chemicals | 348601000 | CAS#92-31-9 |
| Volume Reduction Insert | - | - | 3D printed from CAD files provided as Supplementary Files |
| Xylenes | Leica | 3803665 | 4 gallon supply for histological staining |
References
- Cook, J. L., Purdam, C. Is compressive load a factor in the development of tendinopathy. Br J Sports Med. 46 (3), 163-168 (2012).
- Benjamin, M., Qin, S., Ralphs, J. R. Fibrocartilage associated with human tendons and their pulleys. J Anat. 187 (Pt 3), 625-633 (1995).
- Benjamin, M., Ralphs, J. R. Fibrocartilage in tendons and ligaments - an adaptation to compressive load. J Anat. 193 (4), 481-494 (1998).
- Benjamin, M., Theobald, P., Suzuki, D., Toumi, H. The anatomy of the Achilles tendon. The Achilles Tendon. 3, 5-16 (2007).
- Chimenti, R. L., et al. Insertional achilles tendinopathy associated with altered transverse compressive and axial tensile strain during ankle dorsiflexion. J Orthop Res. 35 (4), 910-915 (2017).
- Mora, K. E., et al. Ultrasound strain mapping of the mouse Achilles tendon during passive dorsiflexion. J Biomech. 132, 110920 (2022).
- Pringels, L., et al. Intratendinous pressure changes in the Achilles tendon during stretching and eccentric loading: Implications for Achilles tendinopathy. Scand J Med Sci Sports. 33 (5), 619-630 (2023).
- Koob, T. J., Vogel, K. G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. J Orthop Res. 5 (3), 414-424 (1987).
- Vogel, K. G., Koob, T. J. Structural specialization in tendons under compression. Int Rev Cytol. 115, 267-293 (1989).
- Vogel, K. G., Ordög, A., Pogány, G., Oláh, J. Proteoglycans in the compressed region of human tibialis posterior tendon and in ligaments. J Orthop Res. 11 (1), 68-77 (1993).
- Vogel, K. G., Sandy, J. D., Pogány, G., Robbins, J. R. Aggrecan in bovine tendon. Matrix Biol. 14 (2), 171-179 (1994).
- Robbins, J. R., Vogel, K. G. Regional expression of mRNA for proteoglycans and collagen in tendon. Eur J Cell Biol. 64 (2), 264-270 (1994).
- Vogel, K., Gordon, S. I., Blair, S. J., Fine, L. J. . Repetitive motion disorders of the upper extremity. , (1995).
- Benjamin, M., Tyers, R. N., Ralphs, J. R. Age-related changes in tendon fibrocartilage. J Anat. 179, 127-136 (1991).
- Ralphs, J. R., Benjamin, M., Thornett, A. Cell and matrix biology of the suprapatella in the rat: a structural and immunocytochemical study of fibrocartilage in a tendon subject to compression. Anat Rec. 231 (2), 167-177 (1991).
- Rufai, A., Benjamin, M., Ralphs, J. R. Development and ageing of phenotypically distinct fibrocartilages associated with the rat Achilles tendon. Anat Embryol (Berl). 186 (6), 611-618 (1992).
- Rufai, A., Ralphs, J. R., Benjamin, M. Ultrastructure of fibrocartilages at the insertion of the rat Achilles tendon. J Anat. 189 (Pt 1), 185-191 (1996).
- Waggett, A. D., Ralphs, J. R., Kwan, A. P. L., Woodnutt, D., Benjamin, M. Characterization of collagens and proteoglycans at the insertion of the human achilles tendon. Matrix Biol. 16 (8), 457-470 (1998).
- Ralphs, J., et al. Regional differences in cell shape and gap junction expression in rat Achilles tendon: relation to fibrocartilage differentiation. J Anat. 193 (pt 2), 215-222 (1998).
- Milz, S., et al. Three-dimensional reconstructions of the Achilles tendon insertion in man. J Anat. 200 (Pt 2), 145-152 (2002).
- Tischer, T., Milz, S., Maier, M., Schieker, M., Benjamin, M. An immunohistochemical study of the rabbit suprapatella, a sesamoid fibrocartilage in the quadriceps tendon containing aggrecan. J Histochem Cytochem. 50 (7), 955-960 (2002).
- Esquisatto, M. A., Joazeiro, P. P., Pimentel, E. R., Gomes, L. The effect of age on the structure and composition of rat tendon fibrocartilage. Cell Biol Int. 31 (6), 570-577 (2007).
- Matuszewski, P. E., et al. Regional variation in human supraspinatus tendon proteoglycans: Decorin, biglycan, and aggrecan. Connect Tissue Res. 53 (5), 343-348 (2012).
- Buckley, M. R., Huffman, G. R., Iozzo, R. V., Birk, D. E., Soslowsky, L. J. The location-specific role of proteoglycans in the flexor carpi ulnaris tendon. Connect Tissue Res. 54 (6), 367-373 (2013).
- Gillard, G. C., Reilly, H. C., Bell-Booth, P. G., Flint, M. H. The influence of mechanical forces on the glycosaminoglycan content of the rabbit flexor digitorum profundus tendon. Connect Tissue Res. 7 (1), 37-46 (1979).
- Giori, N. J., Beaupre, G. S., Carter, D. R. Cellular shape and pressure may mediate mechanical control of tissue composition in tendons. J Orthop Res. 11 (4), 581-591 (1993).
- Wren, T. A., Beaupré, G. S., Carter, D. R. Mechanobiology of tendon adaptation to compressive loading through fibrocartilaginous metaplasia. J Rehabil Res Dev. 37 (2), 135-143 (2000).
- Malaviya, P., et al. An in vivo model for load-modulated remodeling in the rabbit flexor tendon. J Orthop Res. 18 (1), 116-125 (2000).
- Shim, J. W., Elder, S. H. Influence of Cyclic Hydrostatic Pressure on Fibrocartilaginous Metaplasia of Achilles Tendon Fibroblasts. Biomech Model Mechanobiol. 5 (4), 247-252 (2006).
- Koob, T. J., Clark, P. E., Hernandez, D. J., Thurmond, F. A., Vogel, K. G. Compression loading in vitro regulates proteoglycan synthesis by tendon fibrocartilage. Arch Biochem Biophys. 298 (1), 303-312 (1992).
- Evanko, S. P., Vogel, K. G. Proteoglycan Synthesis in Fetal Tendon Is Differentially Regulated by Cyclic Compression in Vitro. Arch Biochem Biophys. 307 (1), 153-164 (1993).
- Vogel, K. G. The effect of compressive loading on proteoglycan turnover in cultured fetal tendon. Connect Tissue Res. 34 (3), 227-237 (1996).
- Thornton, G. M., et al. Changes in mechanical loading lead to tendon specific alterations in MMP and TIMP expression: influence of stress deprivation and intermittent cyclic hydrostatic compression on rat supraspinatus and Achilles tendons. Br J Sports Med. 44 (10), 698-703 (2010).
- Robbins, J. R., Evanko, S. P., Vogel, K. G. Mechanical Loading and TGF-β Regulate Proteoglycan Synthesis in Tendon. Arch Biochem Biophys. 342 (2), 203-211 (1997).
- Docking, S., Samiric, T., Scase, E., Purdam, C., Cook, J. Relationship between compressive loading and ECM changes in tendons. Muscles Ligaments Tendons J. 3 (1), 7-11 (2013).
- Wang, X., et al. Aberrant TGF-β activation in bone tendon insertion induces enthesopathy-like disease. J Clin Invest. 128 (2), 846-860 (2018).
- Cong, G. T., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: Development and analysis of a novel murine model. J Orthop Res. 36 (10), 2780-2788 (2018).
- Liu, Y., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: development and analysis of a novel rat model. J Shoulder Elbow Surg. 31 (9), 1898-1908 (2022).
- Majima, T., et al. Compressive compared with tensile loading of medial collateral ligament scar in vitro uniquely influences mRNA levels for aggrecan, collagen type II, and collagenase. J Orthop Res. 18 (4), 524-531 (2000).
- Hopkins, C., et al. Critical review on the socio-economic impact of tendinopathy. Asia Pac J Sports Med, Arthrosc, Rehabil Technol. 4, 9-20 (2016).
- Scott, A., Ashe, M. C. Common tendinopathies in the upper and lower extremities. Curr Sports Med Rep. 5 (5), 233-241 (2006).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin Sports Med. 22 (4), 675-692 (2003).
- Bah, I., et al. Tensile mechanical changes in the Achilles tendon due to Insertional Achilles tendinopathy. J Mech Behav Biomed Mater. 112, 104031 (2020).
- Maffulli, N., Reaper, J., Ewen, S. W. B., Waterston, S. W., Barrass, V. Chondral Metaplasia in Calcific Insertional Tendinopathy of the Achilles Tendon. Clin J Sport Med. 16 (4), 329-334 (2006).
- Corps, A. N., et al. Increased expression of aggrecan and biglycan mRNA in Achilles tendinopathy. Rheumatology (Oxford). 45 (3), 291-294 (2006).
- Scott, A., et al. Increased versican content is associated with tendinosis pathology in the patellar tendon of athletes with jumper's knee. Scand J Med Sci Sports. 18 (4), 427-435 (2008).
- Attia, M., et al. Greater glycosaminoglycan content in human patellar tendon biopsies is associated with more pain and a lower VISA score. Br J Sports Med. 48 (6), 469-475 (2014).
- Kujala, U. M., Sarna, S., Kaprio, J. Cumulative Incidence of Achilles Tendon Rupture and Tendinopathy in Male Former Elite Athletes. Clin J Sport Med. 15 (3), 133-135 (2005).
- Corps, A. N., et al. Changes in matrix protein biochemistry and the expression of mRNA encoding matrix proteins and metalloproteinases in posterior tibialis tendinopathy. Ann Rheum Dis. 71 (5), 746-752 (2012).
- Neer, C. S. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 54 (1), 41-50 (1972).
- Bigliani, L. U., Ticker, J. B., Flatow, E. L., Soslowsky, L. J., Mow, V. C. The relationship of acromial architecture to rotator cuff disease. Clin Sports Med. 10 (4), 823-838 (1991).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current Concepts Review Update Insertional Achilles Tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Nicholson, C. W., Berlet, G. C., Lee, T. H. Prediction of the Success of Nonoperative Treatment of Insertional Achilles Tendinosis Based on MRI. Foot Ankle Int. 28 (4), 472-477 (2007).
- Lohrer, H., David, S., Nauck, T. Surgical treatment for achilles tendinopathy - a systematic review. BMC musculoskelet disord. 17 (1), 207 (2016).
- McGarvey, W. C., Palumbo, R. C., Baxter, D. E., Leibman, B. D. Insertional Achilles Tendinosis: Surgical Treatment Through a Central Tendon Splitting Approach. Foot Ankle Int. 23 (1), 19-25 (2002).
- Maffulli, N., et al. Surgery for chronic Achilles tendinopathy produces worse results in women. Disabil Rehabil. 30 (20-22), 1714-1720 (1714).
- Wunderli, S. L., Blache, U., Snedeker, J. G. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connect Tissue Res. 61 (3-4), 262-277 (2020).
- Dyment, N. A., et al. A brief history of tendon and ligament bioreactors: Impact and future prospects. J Orthop Res. 38 (11), 2318-2330 (2020).
- Screen, H. R. C., Berk, D. E., Kadler, K. E., Ramirez, F., Young, M. F. Tendon Functional Extracellular Matrix. J Orthop Res. 33 (6), 793-799 (2015).
- Theobald, P., et al. The functional anatomy of Kager's fat pad in relation to retrocalcaneal problems and other hindfoot disorders. J Anat. 208 (1), 91-97 (2006).
- Ghazzawi, A., Theobald, P., Pugh, N., Byrne, C., Nokes, L. Quantifying the motion of Kager's fat pad. J Orthop Res. 27 (11), 1457-1460 (2009).
- Malagelada, F., et al. Pressure changes in the Kager fat pad at the extremes of ankle motion suggest a potential role in Achilles tendinopathy. Knee Surg Sports Traumatol Arthrosc. 28 (1), 148-154 (2020).
- Shaw, H. M., Benjamin, M. Structure-function relationships of entheses in relation to mechanical load and exercise. Scand J Med Sci Sports. 17 (4), 303-315 (2007).
- Soslowsky, L. J., et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 30 (8), 1057-1063 (2002).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. J Shoulder Elbow Surg. 7 (4), 375-380 (1998).
- Croen, B. J., et al. Chronic subacromial impingement leads to supraspinatus muscle functional and morphological changes: Evaluation in a murine model. J Orthop Res. 39 (10), 2243-2251 (2021).
- Andarawis-Puri, N., Flatow, E. L. Tendon fatigue in response to mechanical loading. J Musculoskelet Neuronal Interact. 11 (2), 106-114 (2011).
- Gains, C. C., Giannapoulos, A., Zamboulis, D. E., Lopez-Tremoleda, J., Screen, H. R. C. Development and application of a novel in vivo overload model of the Achilles tendon in rat. J Biomech. 151, 111546 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Pedaprolu, K., Szczesny, S. E. A Novel, Open-Source, Low-Cost Bioreactor for Load-Controlled Cyclic Loading of Tendon Explants. J Biomech Eng. 144 (8), 084505 (2022).
- Orishimo, K. F., et al. Effect of Knee Flexion Angle on Achilles Tendon Force and Ankle Joint Plantarflexion Moment During Passive Dorsiflexion. J Foot Ankle Surg. 47 (1), 34-39 (2008).
- Liu, C. L., et al. Influence of different knee and ankle ranges of motion on the elasticity of triceps surae muscles, Achilles tendon, and plantar fascia. Sci Rep. 10 (1), 6643 (2020).
- Cruz-Montecinos, C., et al. Soleus muscle and Achilles tendon compressive stiffness is related to knee and ankle positioning. J Electromyogr Kinesiol. 66, 102698 (2022).
- Connizzo, B. K., Grodzinsky, A. J. Lose-dose administration of dexamethasone is beneficial in preventing secondary tendon damage in a stress-deprived joint injury explant model. J Orthop Res. 38 (1), 139-149 (2020).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biol. 89, 11-26 (2020).
- Yabusaki, K., et al. A Novel Quantitative Approach for Eliminating Sample-To-Sample Variation Using a Hue Saturation Value Analysis Program. PloS one. 9 (3), e89627 (2014).
- Gao, J., Messner, K., Ralphs, J. R., Benjamin, M. An immunohistochemical study of enthesis development in the medial collateral ligament of the rat knee joint. Anat Embryol. 194 (4), 399-406 (1996).
- Han, S. K., Wouters, W. A. J., Clark, A., Herzog, W. Mechanically induced calcium signaling in chondrocytes in situ. J Orthop Res. 30 (3), 475-481 (2012).
- Han, W., et al. Impact of cellular microenvironment and mechanical perturbation on calcium signalling in meniscus fibrochondrocytes. Eur Cell Mater. 27, 321-331 (2014).
- Rossetti, L., et al. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 16 (6), 664-670 (2017).
- Sartori, J., Köhring, S., Witte, H., Fischer, M. S., Löffler, M. Three-dimensional imaging of the fibrous microstructure of Achilles tendon entheses in Mus musculus. J Anat. 233 (3), 370-380 (2018).
- Eliasberg, C. D., et al. Identification of Inflammatory Mediators in Tendinopathy Using a Murine Subacromial Impingement Model. J Orthop Res. 37 (12), 2575-2582 (2019).
- Zhang, Y., et al. Expression of alarmins in a murine rotator cuff tendinopathy model. J Orthop Res. 38 (11), 2513-2520 (2020).
- Zhang, X., et al. Assessment of Mitochondrial Dysfunction in a Murine Model of Supraspinatus Tendinopathy. J Bone Joint Surg. Am. 103 (2), 174-183 (2021).
- Liu, Y., et al. The role of Indian Hedgehog Signaling in tendon response to subacromial impingement: evaluation using a mouse model. Am J Sports Med. 50 (2), 362-370 (2022).
- Wang, T., et al. Load-induced regulation of tendon homeostasis by SPARC, a genetic predisposition factor for tendon and ligament injuries. Sci Transl Med. 13 (582), eabe5738 (2021).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nat Biomed Eng. 5 (12), 1457-1471 (2021).
- Jones, D. L., et al. Mechanoepigenetic regulation of extracellular matrix homeostasis via Yap and Taz. Proc Natl Acad Sci U S A. 120 (22), e2211947120 (2023).
- Connizzo, B. K., Grodzinsky, A. J. Release of pro-inflammatory cytokines from muscle and bone causes tenocyte death in a novel rotator cuff in vitro explant culture model. Connect Tissue Res. 59 (5), 423-436 (2018).
- Rees, S. G., et al. Catabolism of aggrecan, decorin and biglycan in tendon. Biochem J. 350 (Pt 1), 181-188 (2000).
- Samiric, T., Ilic, M. Z., Handley, C. J. Large aggregating and small leucine-rich proteoglycans are degraded by different pathways and at different rates in tendon. Eur J Biochem. 271 (17), 3612-3620 (2004).
- Rees, S. G., Curtis, C. L., Dent, C. M., Caterson, B. Catabolism of aggrecan proteoglycan aggregate components in short-term explant cultures of tendon. Matrix Biol. 24 (3), 219-231 (2005).
- Taye, N., Karoulias, S. Z., Hubmacher, D. The "other" 15-40%: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon. J Orthop Res. 38 (1), 23-35 (2020).
- Carvalho, H. F., Felisbino, S. L. The development of the pressure-bearing tendon of the bullfrog, Rana catesbeiana. Anat Embryol. 200 (1), 55-64 (1999).
- Carvalho, H. F., Felisbino, S. L., Covizi, D. Z., Della Colleta, H. H., Gomes, L. Structure and proteoglycan composition of specialized regions of the elastic tendon of the chicken wing. Cell Tissue Res. 300 (3), 435-446 (2000).
- van Sterkenburg, M. N., Kerkhoffs, G. M., Kleipool, R. P., Niek van Dijk, C. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study. J Anat. 218 (3), 336-341 (2011).
- Lee, A. H., Elliott, D. M. Comparative multi-scale hierarchical structure of the tail, plantaris, and Achilles tendons in the rat. J Anat. 234 (2), 252-262 (2019).
- Lee, A. H., Elliott, D. M. Multi-Scale Loading and Damage Mechanisms of Plantaris and Rat Tail Tendons. J Orthop Res. 37 (8), 1827-1837 (2019).
- Fan, H. M., Shrestha, L., Guo, Y., Tao, H. R., Sun, Y. L. The twisted structure of the rat Achilles tendon. J Anat. 239 (5), 1134-1140 (2021).
- Cutlip, R. G., Stauber, W. T., Willison, R. H., McIntosh, T. A., Means, K. H. Dynamometer for rat plantar flexor muscles in vivo. Med Biol Eng Comput. 35 (5), 540-543 (1997).
- Rijkelijkhuizen, J. M., Baan, G. C., de Haan, A., de Ruiter, C. J., Huijing, P. A. Extramuscular myofascial force transmission for in situ rat medial gastrocnemius and plantaris muscles in progressive stages of dissection. J Exp Biol. 208 (Pt 1), 129-140 (2005).
- Saxena, A., Bareither, D. Magnetic Resonance and Cadaveric Findings of the Incidence of Plantaris Tendon. Foot Ankle Int. 21 (7), 570-572 (2000).
- dos Santos, M. A., Bertelli, J. A., Kechele, P. R., Duarte, H. Anatomical study of the plantaris tendon: reliability as a tendo-osseous graft. Surg Radiol Anat. 31 (1), 59-61 (2009).
- Sartori, J., Köhring, S., Bruns, S., Moosmann, J., Hammel, J. U. Gaining Insight into the Deformation of Achilles Tendon Entheses in Mice. Adv Eng Mater. 23 (11), 2100085 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved