Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle d’explant murin d’un membre postérieur pour l’étude de la mécanobiologie du conflit du tendon d’Achille
Dans cet article
Résumé
Nous présentons une plate-forme expérimentale personnalisée et un protocole de culture tissulaire qui recrée le changement fibrocartilagineux induit par le conflit de l’insertion du tendon d’Achille dans les explants murins des membres postérieurs avec une viabilité cellulaire soutenue, fournissant un modèle adapté à l’exploration de la mécanobiologie du conflit tendonineux.
Résumé
L’impact tendineux sur l’os génère un environnement de déformation mécanique multiaxiale avec une déformation de compression transversale nettement élevée, ce qui provoque un phénotype de fibrocartilage localisé caractérisé par l’accumulation d’une matrice riche en glycosaminoglycanes (GAG) et le remodelage du réseau de collagène. Alors que le fibrocartilage est une caractéristique normale dans les régions touchées des tendons sains, le dépôt excessif de GAG et la désorganisation du réseau de collagène sont des caractéristiques caractéristiques de la tendinopathie. En conséquence, le conflit est cliniquement reconnu comme un facteur extrinsèque important dans l’initiation et la progression de la tendinopathie. Néanmoins, la mécanobiologie sous-jacente au conflit tendineux reste peu étudiée. Des efforts antérieurs pour élucider la réponse cellulaire au conflit tendineux ont appliqué une compression uniaxiale aux cellules et excisé des explants tendineux in vitro. Cependant, les cellules isolées n’ont pas d’environnement extracellulaire tridimensionnel crucial pour la mécanoréponse, et les études in vitro et les études d’explants excisés ne parviennent pas à récapituler l’environnement de déformation multiaxiale généré par le conflit tendineux in vivo, qui dépend des caractéristiques anatomiques de la région touchée. De plus, les modèles in vivo de conflit tendineux manquent de contrôle sur l’environnement de déformation mécanique. Pour pallier ces limitations, nous présentons un nouveau modèle d’explant de membre postérieur murin adapté à l’étude de la mécanobiologie du conflit du tendon d’Achille. Ce modèle maintient le tendon d’Achille in situ pour préserver l’anatomie locale et reproduit l’environnement de déformation multiaxiale généré par l’impact de l’insertion du tendon d’Achille sur le calcanéum lors d’une dorsiflexion passive de la cheville tout en conservant les cellules dans leur environnement d’origine. Nous décrivons un protocole de culture tissulaire faisant partie intégrante de ce modèle et présentons des données établissant la viabilité durable de l’explant sur 7 jours. Les résultats représentatifs démontrent une amélioration de la coloration histologique des GAG et une diminution de l’alignement des fibres de collagène secondaire au conflit, suggérant une formation élevée de fibrocartilage. Ce modèle peut facilement être adapté pour étudier différents régimes de charge mécanique et permet la manipulation de voies moléculaires d’intérêt pour identifier les mécanismes médiant le changement phénotypique dans le tendon d’Achille en réponse au conflit.
Introduction
Une multitude de tendons, y compris le tendon d’Achille et les tendons de la coiffe des rotateurs, subissent un conflit osseux dû à un positionnement anatomique normal1,2,3,4. Le conflit tendineux génère une contrainte de compression dirigée transversalement à l’axe longitudinal de la fibre5,6,7. Les régions de conflit tendineux présentent un phénotype de fibrocartilage unique dans lequel des cellules rondes rétrécies (fibrochondrocytes) sont intégrées dans un réseau de collagène désorganisé avec une teneur en glycosaminoglycane (GAG) nettement accrue2,3,4,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24. Des études antérieures suggèrent que l’environnement mécanique disparate produit par le conflit tendineux soutient cette matrice riche en GAG en conduisant au dépôt de protéoglycanes agrégeants de grande taille, notamment l’aggrécan, bien que les mécanismes sous-jacents ne soient pas clairs1,3,12,13,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39. Alors que le fibrocartilage est une caractéristique normale dans les régions touchées des tendons sains, le métabolisme aberrant des protéoglycanes associé à une formation excessive de fibrocartilage est une caractéristique caractéristique de la tendinopathie, une maladie courante et débilitante qui émerge de manière disproportionnée dans les tendons chroniquement touchés1,40,41,42,43,44,45,46,47,48,49. En conséquence, le conflit tendineux est cliniquement reconnu comme un facteur extrinsèque important à l’origine de plusieurs des tendinopathies les plus courantes, notamment la maladie de la coiffe des rotateurs et la tendinopathie d’Achille insertionnelle (IAT)50,51,52. À l’heure actuelle, le traitement de la tendinopathie est inefficace. Par exemple, environ 47 % des patients atteints d’IAT nécessitent une intervention chirurgicale après l’échec d’une prise en charge conservatrice, avec des résultats postopératoires variables53,54,55,56. Malgré la relation apparente entre le conflit et la tendinopathie, les mécanismes mécanobiologiques par lesquels les cellules du tendon touché perçoivent et réagissent à leur environnement mécanique sont mal décrits, ce qui obscurcit la compréhension de la pathogenèse de la tendinopathie et entraîne un traitement inadéquat.
Les modèles d’explants sont des outils utiles dans l’étude de la mécanobiologie tendineuse57,58. Comme première étape vers la compréhension de la mécanobiologie du conflit tendonin, plusieurs études antérieures ont exploré la réponse cellulaire suite à l’application d’une compression uniaxiale simple à des cellules ou d’explants tendineux excisés 27,29,30,31,32,33,34,39. Cependant, les cellules in vitro manquent de matrices extracellulaires et péricellulaires qui facilitent le transfert de souches, séquestrent d’importants facteurs de croissance et cytokines libérés par la déformation mécanique, et fournissent un substrat pour les complexes d’adhésion focaux qui jouent un rôle dans la mécanotransduction57,59. De plus, les études in vitro et excisées ne parviennent pas à récapituler l’environnement de déformation mécanique multiaxiale généré par le conflit tendineux in vivo, qui dépend des caractéristiques anatomiques de la région touchée 5,6. Dans le contexte de l’insertion du tendon d’Achille touché, cela inclut les tissus environnants tels que la bourse rétrocalcanéenne et le coussinet adipeux de Kager 60,61,62,63. À l’inverse, les modèles in vivo de conflit tendineux 25,28,36,37,38,64,65,66 permettent un contrôle minimal de l’amplitude et de la fréquence de la charge appliquée directement au tendon, ce qui est une limitation bien connue des modèles in vivo pour l’étude de la mécanobiologie tendineuse57,58,67,68,69,70. Compte tenu des difficultés rencontrées dans la mesure de la déformation des tendons in vivo, l’environnement de déformation interne généré dans ces modèles est souvent mal caractérisé.
Dans ce manuscrit, nous présentons une plate-forme expérimentale personnalisée qui recrée l’empiètement de l’insertion du tendon d’Achille sur le calcanéum dans des explants entiers de membres postérieurs murins qui, lorsqu’elle est associée à ce protocole de culture tissulaire, maintient la viabilité pendant 7 jours en culture d’explants et permet d’étudier les séquelles biologiques du conflit tendineux. La plate-forme est construite sur une base d’acide polylactique (PLA) imprimée en 3D qui constitue la base de la fixation des poignées et de l’insert de réduction de volume PLA imprimé en 3D. Les poignées sont utilisées pour serrer la partie supérieure de la jambe et du genou à proximité de la jonction myotendineuse d’Achille avec la face caudale du membre postérieur tournée vers le haut, ce qui permet d’imager le tendon d’Achille d’en haut à l’aide d’une sonde à ultrasons ou d’un microscope inversé (Figure 1A). L’insert de réduction de volume glisse le long d’un rail sur la base et réduit le volume requis de milieux de culture tissulaire. Une ligne tressée enroulée autour de la patte arrière est acheminée hors de la plate-forme à l’aide de la conception de base et d’un clip PLA imprimé en 3D. En tirant sur la corde, la patte arrière est fléchie dorsalement et l’insertion du tendon d’Achille est heurtée contre le calcanéum, ce qui entraîne une contrainte de compression transversale élevée 5,6 (Figure 1A). La plate-forme est contenue dans un bain acrylique qui maintient les explants des membres postérieurs immergés dans des milieux de culture tissulaire. La fixation de la corde tendue à l’extérieur de la baignoire avec du ruban adhésif maintient la dorsiflexion de la cheville pour produire un conflit statique de l’insertion du tendon d’Achille. Les fichiers CAO pour les composants imprimés en 3D sont fournis en plusieurs formats (fichier supplémentaire 1), ce qui permet de les importer dans une gamme de logiciels de CAO commerciaux et gratuits, open-source, pour les modifier en fonction des besoins expérimentaux. Si l’accès aux imprimantes 3D n’est pas disponible pour la fabrication, les fichiers CAO peuvent être fournis aux services d’impression 3D en ligne qui imprimeront et expédieront les pièces à faible coût.
Il est important de noter que le complexe musculo-tendineux triceps surae-Achille s’étend à la fois sur les articulations du genou et de la cheville 71,72,73. Par conséquent, la tension de traction dans le tendon d’Achille est influencée par la flexion du genou. L’extension du genou met le tendon d’Achille sous tension, tandis que la flexion du genou réduit la tension. En étendant d’abord le genou, puis en fléchissant passivement la cheville, les contraintes de compression au niveau de l’insertion heurtée peuvent être superposées aux contraintes de traction. Inversement, en fléchissant passivement la cheville avec le genou fléchi, la tension de traction est réduite et la contrainte de compression persiste. Le protocole actuel explore trois de ces conditions. 1) Pour les conflits statiques, le pied est fléchi dorsivement à < 110° par rapport au tibia pour empiéter sur l’insertion, le genou fléchi pour réduire la tension. 2) Pour le groupe de tension de base, la cheville est étendue au-dessus de 145° de dorsiflexion avec le genou étendu, générant principalement une contrainte de traction à l’insertion. 3) Pour le groupe non chargé, les explants sont cultivés dans une boîte de Pétri avec le genou et la cheville en position neutre en l’absence de charge appliquée à l’extérieur. Les angles mentionnés ci-dessus sont mesurés photographiquement par rapport à un système de coordonnées où le pied et le tibia sont parallèles à un angle de 180° et perpendiculaires à un angle de 90°.
Les étapes clés du protocole comprennent 1) la dissection des explants des membres postérieurs et l’ablation soigneuse de la peau et du tendon plantaire ; 2) culture d’explants après un prétraitement à la dexaméthasone de 48 h ; 3) la coupe des tissus et la coloration histologique ; et 4) l’analyse d’images en couleur pour évaluer la formation du fibrocartilage. Après dissection, chaque explant de membre postérieur est prétraité pendant 48 h dans un milieu de culture complété par de la dexaméthasone74. Les membres controlatéraux de chaque souris sont assignés à des groupes expérimentaux distincts pour une comparaison par paires, ce qui aide à contrôler la variabilité biologique. Après le prétraitement, les explants sont positionnés dans des plates-formes comme décrit ci-dessus et cultivés pendant 7 jours supplémentaires (Figure 1B). Des comparaisons supplémentaires sont faites avec un groupe prétraité (jour 0) dans lequel les explants sont retirés immédiatement après le prétraitement de 48 h.
Après la culture de l’explantation, les membres postérieurs sont coupés, le formol fixé, décalcifié et noyé dans de la paraffine. La coupe en série en orientation sagittale permet de visualiser le tendon d’Achille de la jonction myotendineuse à l’insertion calcanéenne tout en permettant de suivre la profondeur de la section à travers l’ensemble du tendon. Le marquage dUTP X-nick médié par la désoxynucléotidyl transférase terminale (TdT) est utilisé pour visualiser les dommages à l’ADN secondaires à l’apoptose et évaluer la viabilité. L’histologie du bleu de toluidine et l’analyse personnalisée de l’image couleur sont effectuées pour quantifier les changements dans la coloration GAG. Des coupes de tissus colorés au bleu de toluidine sont ensuite utilisées pour l’imagerie SHG afin de caractériser les altérations de l’organisation des fibres de collage (Figure 1B).
Les résultats représentatifs fournis suggèrent une altération de la coloration histologique de la matrice riche en GAG et une désorganisation du réseau de collagène extracellulaire générée par 7 jours de conflit statique dans le modèle. Ce modèle peut être utilisé pour explorer les mécanismes moléculaires sous-jacents au changement fibrocartilagineux induit par l’impact.
Protocole
Tous les travaux sur les animaux ont été approuvés par le Comité des ressources animales de l’Université de Rochester.
1. Préparation des milieux de culture tissulaire
- Cultivez tous les explants dans le milieu Eagle modifié de Dulbecco (1x DMEM) avec 1 % v/v de pénicilline-streptomycine et 200 μM d’acide L-ascorbique dans un incubateur à 37 °C et 5 % de CO2. Pour le prétraitement initial de 48 h, cultiver chaque explant dans 70 mL de milieu de culture complété par 100 nM de dexaméthasone74. Après le prétraitement, cultivez les membres pendant 7 jours supplémentaires sans dexaméthasone, en changeant de milieu toutes les 48 à 72 h.
REMARQUE : L’ajout de sérum, tel que le sérum de veau fœtal, aux milieux de culture n’est pas recommandé, conformément aux recommandations fournies par Wunderli, Blache et Snedeker57. En bref, les conditions sans sérum représentent mieux le microenvironnement tendineux avasculaire et pauvre en nutriments qui existe in vivo. De plus, la supplémentation sérique peut favoriser la dégradation des tissus dans certaines conditions de culture75 et stimuler la prolifération et la migration des cellules hors des tissus, deux caractéristiques de la pathologie tendineuse57. - Pour le groupe déchargé, cultiver chaque explant dans 70 mL de milieu. Pour les groupes de tension de base et de conflit statique, chaque plate-forme nécessite environ 125 mL de milieu de culture pour maintenir le membre immergé. Ce volume peut varier en fonction du positionnement de la partie supérieure de la jambe dans les poignées et des paramètres d’impression 3D, principalement la densité de remplissage.
2. Dissection d’explants et prétraitement à la dexaméthasone
- Euthanasier les souris par inhalation de CO2 et luxation cervicale secondaire, ou selon les directives de l’établissement. Ce protocole utilise des souris C57BL/6 de moins de 1 an. La taille des membres postérieurs augmente avec l’âge et peut devenir difficile à insérer dans les poignées.
- Avant la dissection, transférer 70 mL de milieux de culture préchauffés (37 °C) dans une boîte de Pétri de 100 mm (diamètre) x 25 mm (hauteur) dans une enceinte de sécurité biologique stérile (ESB). Ajoutez de la dexaméthasone pour atteindre une concentration de travail de 100 nM.
- Les dissections peuvent être effectuées sur la paillasse à l’aide de coussinets absorbants, en travaillant rapidement à travers la dissection avant de transférer les explants des membres postérieurs dans la BSC. Assemblez les outils chirurgicaux nécessaires à cette dissection, notamment des pinces lisses, droites et à pointe fine ; pince droite à pointe fine avec dents dentelées ; et des ciseaux droits, tranchants et fins.
- Pour la dissection des explants des membres postérieurs, placez la souris en décubitus dorsal et identifiez l’articulation de la hanche. À l’aide de ciseaux fins, faites une petite incision (5 à 10 mm) à travers la peau en recouvrant la face proximale et antérieure (crânienne) de la partie supérieure de la jambe.
- Écartez l’incision pour l’élargir, pincez la partie supérieure de la jambe exposée à l’aide des doigts et tirez soigneusement la peau distalement pour ganter le membre postérieur au niveau de la cheville. Insérez délicatement une lame de ciseaux sous la peau le long de la face dorsale du pied et faites une incision s’étendant jusqu’aux orteils. Continuez à tirer la peau distalement pour l’enlever complètement.
- Positionnez la souris pour visualiser l’insertion du tendon d’Achille sur la face postérieure (caudale) du calcanéum, près de la cheville. Proximal à l’insertion du tendon d’Achille, le tendon plantaire est directement adjacent au bord médial du tendon d’Achille et s’étend distalement vers la face plantaire du pied, passant au-dessus de la face postérieure du calcanéum.
- Pour retirer le tendon plantaire, insérez délicatement une pointe de la pince lisse et fine entre les deux tendons et étendez la pointe médialement en passant sous le tendon plantaire. Tirez la pointe proximale et déchirez le muscle plantaire. À l’aide d’une pince dentelée à pointe fine, saisissez l’extrémité proximale détachée du tendon plantaire et tirez distalement pour la retirer.
- Au niveau de l’articulation de la hanche, utilisez des ciseaux fins pour couper le bassin et isoler le membre postérieur. Utilisez les ciseaux pour soulever le bassin restant et exposer la tête fémorale.
- Transférer l’explant du membre postérieur dans la BSC et dans la boîte contenant le milieu de culture cellulaire contenant de la dexaméthasone. Déplacez le plat dans l’incubateur et prétraitez pendant 48 h.
3. Culture d’explants et plates-formes de chargement
- À la fin du prétraitement de 48 h, préchauffer des volumes suffisants de milieux de culture (section 1). À partir de ce moment, aucune dexaméthasone ne sera ajoutée aux milieux de culture. À ce stade, les membres du groupe prétraité (jour 0) peuvent être fixés, décalcifiés et enrobés dans de la paraffine pour une section, une coloration et une analyse futures.
- Pour le groupe déchargé, aspirer les milieux de prétraitement et transférer les explants dans des boîtes de Pétri fraîches, ajouter 70 mL de milieux de culture chacun et retourner dans l’incubateur.
- Pour les groupes de tension de base et d’impact statique, préparez les plates-formes d’explantation. Découpez des morceaux de papier de verre de taille similaire à celle des plateaux de préhension. Pour le groupe d’impact statique, coupez des morceaux de fil tressé d’environ 18 pouces de longueur et faites un nœud plat lâche à mi-chemin sur toute la longueur du fil. Déchirez des morceaux de papier d’aluminium pour couvrir chaque bain d’acrylique et vaporisez de l’éthanol à 70 % (EtOH). Transférer les préparatifs à la BSC.
- Chaque plate-forme comprend une baignoire en acrylique, une base, un insert de réduction de volume, un clip et des poignées. Chaque poignée comprend deux plateaux et trois types de vis différents, dont une vis M5 x 0,8 mm x 10 mm de long qui fixe les poignées à la base ; deux vis M6 x 1 mm filetage x 20 mm de long qui prolongent les plateaux pour serrer les poignées ; et quatre vis M3 x 0,5 mm x 14 mm de long qui, en combinaison avec quatre ressorts de compression, rétractent les plateaux pour ouvrir les poignées.
- Placez tous les composants dans des récipients secondaires capables de capter tous les milieux de culture en cas de fuite. Plongez-les dans ≥ solution d’eau de Javel à 10 % et faites-les tremper pendant au moins 1 h. Rincez la solution d’eau de Javel à l’eau du robinet (autoclave au besoin) et passez dans le BSC.
REMARQUE : Pour le dépannage de la contamination, envisagez d’autoclaver toute l’eau du robinet ou d’utiliser de l’eau purifiée. Consultez la discussion pour obtenir des conseils supplémentaires sur la gestion de la contamination. - Utilisez les vis M3 et les ressorts de compression pour fixer les plateaux aux poignées, fixez les poignées à la base à l’aide de la vis M5 et insérez les vis M6 jusqu’à ce qu’elles s’engagent dans les plateaux. Utilisez du ruban adhésif double face pour fixer le papier de verre aux plateaux, puis fermez les poignées pour favoriser l’adhérence du papier de verre aux plateaux. Répétez l’opération pour toutes les plateformes.
- Lorsque vous êtes prêt à charger une plate-forme, ouvrez complètement les poignées et, à l’aide d’une pince, placez le haut de la jambe et le genou entre les plateaux avec la surface superficielle du tendon d’Achille vers le haut (Figure 1A). Fermez les poignées sans serrer pour les maintenir doucement en place.
- Utilisez des pinces pour saisir la tête ou le pied fémoral exposé et manipulez l’angle de flexion du genou pendant que vous fermez progressivement les poignées pour les fixer en place. Pour le groupe de tension de base, étendez l’articulation du genou comme décrit précédemment. Au fur et à mesure que les poignées se resserrent avec le genou tendu, la cheville doit naturellement s’étendre. Pour le groupe d’impact statique, fléchissez l’articulation du genou entre les poignées comme décrit précédemment.
- Pour le groupe d’impact statique, placez le nœud plat de la ficelle autour de la patte distale et serrez. Acheminez la ficelle à travers une fente dans la base située sous l’explant et à travers le trou de l’attache. Placez la base dans la baignoire en acrylique et fixez le clip au bord supérieur de la baignoire (Figure 1A).
- Tirez sur la corde pour fléchir le pied à au moins 110° par rapport au tibia et utilisez un marqueur permanent pour marquer la corde à la sortie du clip. Prenez une photo de l’explant dans cette position pour quantifier plus tard l’angle de dorsiflexion (Figure 1A).
- Retirez la base et fixez l’insert de réduction de volume en glissant le long d’un rail sur la base. Replacez la base (maintenant fixée à l’insert de réduction de volume) dans le bain acrylique et repositionnez le clip sur le bord supérieur. Tirez sur la corde pour revenir à l’angle de dorsiflexion d’origine en utilisant la corde marquée comme guide et fixez la corde à l’extérieur de la baignoire avec du ruban adhésif pour maintenir la dorsiflexion statique.
- Pour le groupe de tension de base, il suffit de placer la base avec insert de réduction de volume dans le bain acrylique une fois l’explant positionné entre les poignées et de prendre une photo pour quantifier l’angle de dorsiflexion.
- Ajouter 125 mL de milieu de culture préchauffé (37 °C) à chaque plate-forme pour immerger les explants. Couvrez le haut de la baignoire avec du papier d’aluminium, placez-le dans un récipient secondaire et déplacez-le dans l’incubateur. Culture pendant 7 jours supplémentaires, en changeant de milieu toutes les 48-72 h.
REMARQUE : Le ruban adhésif placé sur le dessus de la baignoire peut empêcher les pièces en PLA de flotter.
4. Fixation, décalcification et enrobage de paraffine
- Après la culture de l’explantation, utilisez des ciseaux pour couper les ongles des orteils/orteils distaux et coupez la partie supérieure de la jambe proximale de la jonction myotendineuse du tendon d’Achille. Placez chaque articulation de la cheville coupée dans une cassette de traitement tapissée de tampons de biopsie en mousse. Poussez la cheville dans le coin de la cassette pour positionner la cheville à environ 90° de dorsiflexion et fermez la cassette pour la maintenir en place.
- Fixer pendant 3 jours dans du formol tamponné neutre à 10 % (NBF) et décalcifier pendant 2 semaines dans de l’acide éthylènediènetétraacétique (EDTA) à 14 % dissous dans de l’eau distillée (diH2O) avec un pH ajusté à 7,4-7,6 avec de l’acide acétique glacial.
- Pour éliminer les sels, rincez abondamment les échantillons trois fois dans une solution saline tamponnée au phosphate (PBS) 1x, suivie de diH2O, 5 minutes chacune. Effectuer le traitement de routine des échantillons pour l’histologie de la paraffine : déshydrater à travers une série graduée d’EtOH, clair dans le xylène, et infiltrer avec de la cire de paraffine. Orientez et enrobez les échantillons dans de la paraffine pour obtenir des coupes de tissu sagittal à travers le tendon d’Achille dans une progression médiale à latérale comme décrit dans la section 5 ci-dessous (Figure 1B).
5. Coupe de tissu
- À l’aide d’un microtome, coupez soigneusement dans l’échantillon jusqu’à ce que les sections soient parallèles à la face du bloc. Coupez grossièrement dans la cheville à partir de la face médiale de l’articulation, en vous arrêtant avant d’atteindre le bord médial de l’insertion du tendon d’Achille.
- Transférez l’échantillon sur un bloc de glace pour ajuster la température et l’hydratation, puis changez de lame (ou passez à une nouvelle section de la lame actuelle). Continuez à sectionner dans l’échantillon à 10 μm d’épaisseur et identifiez soigneusement l’entrée dans l’insertion du tendon d’Achille avec un microscope à fond clair. Une fois identifié, effectuez une coupe en série en suivant le numéro de section (c’est-à-dire la profondeur des tissus) tout au long de l’insertion du tendon d’Achille.
6. Déparaffinisation/réhydratation et sélection des lames
- Pour chaque test ci-dessous, sélectionnez des coupes de tissu appariées de niveau de chaque paire de membres controlatéraux. Avant la coloration, placez-les sur une grille à lames et procédez à 3 changements de xylène, 2 changements d’EtOH à 100 %, 2 changements d’EtOH à 95 % et 1 changement d’EtOH à 70 %, 5 min chacun. Terminer la réhydratation en diH2O.
7. TUNEL pour évaluer la viabilité du tendon d’Achille
- Pour l’étiquetage TUNEL, colorer selon le protocole du fabricant. Incuber dans 20 μg/mL de protéinase K pendant 20 min à température ambiante et rincer à diH2O. Incuber dans 50 μL de solution de coloration TUNEL (solution enzymatique 5 μL, solution d’étiquette 45 μL) pendant 1 h à 37 °C. Rincer au diH2O. Monter avec un réactif anti-décoloration contenant du DAPI et une lamelle.
- Imagez l’insertion du tendon d’Achille à l’aide d’un microscope à fluorescence avec une lentille d’objectif 4x. Inclure un canal DAPI (longueurs d’onde d’excitation/émission = 360/460 nm) pour visualiser tous les noyaux, un canal TUNEL (TMR Red) (longueurs d’onde d’excitation/émission = 540/580 nm) pour visualiser les noyaux apoptotiques, et si possible, un canal à fond clair.
- Pour l’analyse d’images, importez des images dans un logiciel d’analyse d’images adapté au traitement basé sur le retour sur investissement, tel que FIJI/ImageJ ou MATLAB. Définir une région d’intérêt (ROI) décrivant l’ensemble du tendon d’Achille en vue (Figure 2A), à l’exclusion des cellules de l’épiténon qui sont très sensibles à la mort induite par la dissection et le changement soudain des conditions environnementales lorsqu’elles sont mises en culture.
- Pour ce faire, effectuez la sélection du retour sur investissement dans MATLAB en important l’image en fond clair et en utilisant la fonction drawpolygon() pour tracer et entourer les limites du tendon. MATLAB crée un objet Polygon pour le ROI, qui peut ensuite être appliqué aux images des canaux DAPI et TUNEL pour masquer les données d’intensité des pixels en dehors du ROI à l’aide de createMask() afin d’analyser uniquement les noyaux du tendon d’Achille.
- Importez les images des canaux DAPI et TUNEL et identifiez un seuil d’intensité de fluorescence pour définir les noyaux apoptotiques (TUNEL+) en normalisant à l’intensité de fluorescence maximale des noyaux apoptotiques dans les tissus non viables tels que les os, les muscles ou la graisse qui sont accidentellement capturés dans la coupe de tissu. Une fois les images masquées, calculez la fraction des noyaux apoptotiques (noyaux TUNEL+/noyaux DAPI) dans le tendon d’Achille.
8. Histologie du bleu de toluidine pour caractériser la formation du fibrocartilage
- Une fois réhydratés (section 6), transférer le support de lames avec des coupes de tissu de niveau apparié à partir de paires d’explants controlatéraux à 0,4 % p/v de bleu de toluidine O dans un tampon d’acétate de sodium de 0,1 M avec un pH ajusté à 4,0 à l’aide d’acide acétique glacial. Incuber 10 min à température ambiante, puis rincer 3x en diH2O pendant 30 s chacun.
- Déshydrater en effectuant trois changements d’EtOH à 95 % et deux changements d’EtOH à 100 %, 30 s chacun. Éliminez trois changements de xylène de 1 min chacun. Lamelle avec support de montage à base de xylène.
- Obtenez des images couleur rouge-bleu-vert (RVB) 24 bits de l’insertion du tendon d’Achille. Par exemple, pour ce protocole, utilisez un adaptateur pour interfacer une caméra couleur numérique à l’oculaire d’un simple microscope à fond clair avec un objectif 4x.
- Pour quantifier les différences de coloration au bleu de Toluidine dans le fibrocartilage du tendon compressif (CTF)16 lors de l’insertion du tendon d’Achille (Figure 3A,B), importez des images RVB dans un logiciel d’analyse d’images capable de définir et de gérer plusieurs ROI. Les options incluent les outils de gestion des sélections et du retour sur investissement de FIJI/ImageJ ou la boîte à outils de traitement d’image de MATLAB. Commencez par définir l’échelle de pixels/longueurs.
NOTE : Le choix du logiciel est laissé à la discrétion du chercheur et n’est certainement pas limité à MATLAB ou FIJI/ImageJ. Les auteurs ont fourni du code MATLAB (Fichier supplémentaire 2), de la documentation décrivant l’implémentation (Fichier supplémentaire 3) et un exemple d’image (Fichier supplémentaire 4). Nous encourageons les chercheurs à traduire ce code dans d’autres langages de programmation pour l’utiliser dans d’autres logiciels selon les besoins ou les préférences. - À l’aide de l’image affichée dans le logiciel de votre choix, identifiez l’intersection de la bordure tendineuse profonde avec le calcanéum. À partir de là, tracez proximalement 800 μm le long de la bordure profonde du tendon pour établir la limite profonde du CTF. Par exemple, utilisez la fonction drawpolyline() de MATLAB pour dessiner de manière interactive une polyligne sur l’image RVB. MATLAB crée un objet Polyligne contenant les sommets de la ligne, qui peut être traité et ajusté à une longueur de 800 μm.
- À partir de cette position, créez la limite proximale du CTF en traçant un segment de ligne se connectant au bord du tendon superficiel qui est perpendiculaire à l’orientation locale de la fibre.
- Revenez à l’intersection du bord du tendon profond et du calcanéum et définissez la limite distale du CTF en traçant un segment de ligne reliant le bord superficiel du tendon le long de la ligne de marée distincte séparant le CTF de la zone d’attache fibrocartilage (AZF)16 (Figure 3A,B). Enfin, générez la limite superficielle du CTF en traçant le bord superficiel du tendon à enfermer.
- Pour décrire les variations spatiales de la coloration GAG à travers l’insertion, divisez le CTF total en 4 quadrants (Figure 3A,B). Reliez le point médian des limites CTF profondes et superficielles avec un segment de ligne pour créer une limite distale/proximale. En passant par le milieu de cette limite, connectez les milieux des limites CTF distales et proximales le long de l’orientation de la fibre pour créer une limite superficielle/profonde.
- Ces 6 limites fournissent des informations qui peuvent être utilisées pour définir le ROI représentant l’ensemble du CTF, mais aussi 4 quadrants subdivisant le CTF. Dans MATLAB, par exemple, compilez les sommets définissant les limites de chaque retour sur investissement individuel (CTF, quadrants 1 à 4) en vecteurs et utilisez images.roi.Polygon() pour générer des objets polygonaux fermés pour chaque retour sur investissement.
- Une fois les ROI définis, transformez les données de pixels RVB dans l’espace colorimétrique Hue-Saturation-Value (HSV) à l’aide du plug-in Color Transformer de FIJI, de la fonction rgb2hsv() de MATLAB ou d’un autre logiciel appliquant les équations de transformation appropriées76. Les données HSV peuvent ensuite être projetées dans l’espace de saturation des teintes 2D, où chaque combinaison de teinte et de saturation encode une couleur unique (Figure 3C).
- Dans chaque ROI, calculez la teinte et la saturation moyennes qui décrivent la couleur moyenne de la tache dans le ROI. Cela peut être réalisé dans MATLAB, par exemple, en utilisant les objets Polygon définissant chaque ROI pour masquer l’image à l’aide de createMask() afin d’analyser les données de pixels de teinte-saturation spécifiquement dans chaque ROI.
- Définissez un autre petit ROI dans le fibrocartilage périosté (PF)16 (Figure 3A, B) et calculez la teinte et la saturation moyennes. Ensuite, calculez la distance euclidienne séparant la couleur moyenne de chaque ROI du CTF à celle du PF (Figure 3C).
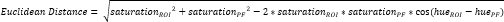
REMARQUE : Le calcul de la distance euclidienne décrit le degré de similitude entre la couleur moyenne du ROI et celle du PF, un tissu fibrocartilagineux par excellence 16,17,77. Une distance euclidienne plus petite indique une couleur ROI d’apparence plus fibrocartilagineuse. - Utilisez cette distance pour calculer le score de fibrocartilage, qui suppose une valeur maximale de 1 si la couleur ROI est identique à la couleur PF et une valeur minimale de -1 si la couleur ROI et la couleur PF atteignent une séparation maximale dans l’espace colorimétrique teinte-saturation.
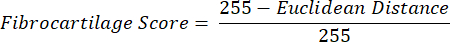
- Données moyennes pour la teinte, la saturation et le score de fibrocartilage dans chaque ROI à travers les coupes de tissu de chaque membre. Effectuer des comparaisons statistiques appariées entre des groupes de membres controlatéraux.
9. Imagerie SHG pour étudier le changement dans l’organisation du réseau de collagène
- Effectuez une imagerie SHG des coupes colorées en bleu Toluidine à l’aide d’un système de microscope performant avec une lentille d’objet 20x. Acquérez des piles en Z à travers l’épaisseur de la section et effectuez un balayage des tuiles au besoin pour capturer complètement l’insertion du tendon d’Achille.
- Importer des images SHG dans un logiciel d’analyse d’images préféré et définir les ROI englobant et subdivisant le CTF à l’insertion du tendon d’Achille, comme décrit pour l’analyse d’image bleue de Toluidine dans la section 8 (Figure 4A,B).
- Si des images SHG sont importées dans MATLAB, utilisez l’approche de définition des ROI CTF dans MATLAB, comme indiqué dans la section 8 . Après avoir défini les ROI, transférez les coordonnées du retour sur investissement dans les FIDJI en exportant les sommets du retour sur investissement de MATLAB sous forme de fichiers .txt et en les important dans les FIDJI à l’aide de l’option Importer > coordonnées XY de File >. Superposez la sélection et envoyez-la au gestionnaire de retour sur investissement pour analyse.
- Pour quantifier l’organisation du collagène, utilisez le plug-in Directionality de FIJI, qui effectue une analyse spectrale de Fourier pour calculer les distributions des orientations des fibres sur de petites fenêtres couvrant un retour sur investissement. L’étalement de cette distribution, appelé dispersion, est inversement proportionnel à l’alignement des fibres.
REMARQUE : Les fibres de collagène peuvent prendre des orientations variables dans différentes fenêtres à travers le CTF en raison de la courbure grossière du tendon plutôt que de l’absence d’alignement/organisation. Pour mieux distinguer les changements dans l’organisation du collagène de la courbure macroscopique du tendon à l’insertion, il est nécessaire de définir des ROI plus petits. - Importez des images SHG dans FIJI et définissez l’échelle de pixels/longueurs. Projetez des données d’intensité maximale de pixels dans une image composite 2D et ajoutez des retours sur investissement au gestionnaire de retour sur investissement. Superposez séquentiellement chaque retour sur investissement CTF sur l’image et dessinez 10 petits sous-ROI de taille cohérente dans le ROI, en ajoutant les sous-ROI au gestionnaire de retour sur investissement.
- Dans chaque sous-ROI, exécutez le plug-in de directionnalité dans FIJI pour calculer la dispersion des fibres. Données de dispersion moyenne entre les sous-ROI de chaque ROI CTF, et données de dispersion moyenne dans chaque ROI CTF entre les sections de chaque explant. Effectuer des comparaisons statistiques appariées entre des groupes de membres controlatéraux.
Résultats
Des images représentatives de coupes de tissus colorés par TUNEL montrent des noyaux apoptotiques minimes dans le corps du tendon d’Achille après 7 jours de culture d’explants dans des groupes expérimentaux (Figure 2A). La quantification de ces images fournit des preuves que le protocole de culture tissulaire maintient jusqu’à 78 % de viabilité en moyenne dans le tendon d’Achille après 7 jours de culture d’explant dans des conditions de charge (Figure 2B...
Discussion
La plate-forme expérimentale d’explants de membres postérieurs murins associée au protocole de culture tissulaire décrit dans cette étude fournit un modèle approprié pour étudier la mécanobiologie de la formation de fibrocartilage induite par le conflit à l’insertion du tendon d’Achille. L’utilité de ce modèle d’explant est démontrée par les résultats représentatifs, qui indiquent un maintien de la viabilité cellulaire concomitant à un changement significatif et spatialement hétérogène de l...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs sont reconnaissants du soutien et de l’aide fournis par Jeff Fox et Vidya Venkatramani du centre d’histologie, de biochimie et d’imagerie moléculaire (HBMI) du Centre de recherche musculo-squelettique de l’Université de Rochester, financé en partie par P30AR06965. De plus, les auteurs tiennent à remercier le Centre de microscopie optique et de nanoscopie (CALMN) du Centre médical de l’Université de Rochester pour son aide en matière de microscopie multiphotonique. Cette étude a été financée par R01 AR070765 et R01 AR070765-04S1, ainsi que par 1R35GM147054 et 1R01AR082349.
matériels
| Name | Company | Catalog Number | Comments |
| Absorbent underpads | VWR | 82020-845 | For benchtop dissection |
| Acrylic bath | Source One | X001G46CB1 | Contains the explant platform submerged in culture media |
| Autoclave bin | Thermo Scientific | 13-361-20 | Used as secondary containment, holds two platforms |
| Base | - | - | 3D printed from CAD files provided as Supplementary Files |
| Braided line | KastKing | 30lb test | Used to wrap around paw and apply ankle dorsiflexion |
| Clip | - | - | 3D printed from CAD files provided as Supplementary Files |
| Cover glass | Fisherbrand | 12-541-034 | Rectangular, No. 2, 50 mm x 24 mm |
| Cytoseal XYL | VWR | 8312-4 | Xylene-based mounting media for coverslipping Toluidine blue stained tissue sections |
| Dexamethasone | MP Biomedical LLC | 194561 | CAS#50-02-2 |
| Dimethyl sulfoxide (DMSO), anhydrous | Invitrogen by ThermoFisher | D12345 | CAS#67-68-5, use to solubilize dexamethasone into concentrated stock solutions |
| Double-sided tape | Scotch Brand | 34-8724-5195-9 | To attach sandpaper to Grip platens |
| Dulbecco's Modified Eagle Medium (1X DMEM) | Gibco by ThermoFisher | 11965092 | high glucose, (-) pyruvate, (+) glutamine |
| EDTA tetrasodium salt dihydrate | Thermo Scientific Chemicals | J15700.A1 | CAS#10378-23-1, used to make 14% EDTA solution for sample decalcifcation |
| Ethanol, 200 proof | Thermo Scientific | T038181000 | CAS#64-17-5, 1 L supply |
| Foam biopsy pads | Leica | 3801000 | Used with processing cassettes, help hold ankle joints in desired position during fixation and decalcification |
| Forceps, #SS Standard Inox | Dumont | 11203-23 | Straight, smooth, fine tips |
| Forceps, Micro-Adson 4.75" | Fisherbrand | 13-820-073 | Straight, fine tips with serrated teeth |
| Garnet Sandpaper, 50-D Grit | Norton | M600060 01518 | Or other coarse grit sandpaper |
| Glacial acetic acid | Fisher Chemical | A38S-500 | CAS#64-19-7, for adjusting pH of sodium acetate buffer used for Toluidine blue histology, as well as 14% EDTA decalcification solution |
| Grips | ADMET | GV-100NT-A4 | Stainless steel vice grips, screws and springs described in the protocol are included |
| Histobond Adhesive Microscope Slides | VWR | 16005-108 | Sagittal sections of hind limbs explants reliably adhere to these slides through all staining protocols |
| In situ Cell Death Detection Kit, TMR Red | Roche | 12156792910 | TUNEL assay |
| Labeling tape | Fisherbrand | 15-959 | Or any other labeling tape of preference |
| L-ascorbic acid | Sigma-Aldrich | A4544-100G | CAS#50-81-7, for culture media formulation |
| Neutral buffered formalin, 10% | Leica | 3800600 | For sample fixation, 5 gallon supply |
| Nunc petri dishes | Sigma-Aldrich | P7741-1CS | 100 mm diameter x 25 mm height, maintain explants submerged in 70 mL of culture media as described in protocol |
| Penicillin-streptomycin (100X) | Gibco by ThermoFisher | 15140122 | Add 5 mL to 500 mL 1X DMEM for 1% v/v (1X) working concentration |
| Polylactic acid (PLA) 1.75 mm filament | Hatchbox | - | Choose filament diameter compatible with your 3D printer extruder, in color of choice. |
| Processing cassettes | Leica | 3802631 | For fixation, decalcification and paraffin embedding |
| Prolong Gold Antifade Reagent with DAPI | Invitrogen by ThermoFisher | P36931 | Mounting media for coverslipping tissue sections after TUNEL |
| Proteinase K | Fisher BioReagents | BP1700-50 | CAS#39450-01-6, used for antigen retrieval in TUNEL protocol |
| Scissors, Fine | FST | 14094-11 | Straight, sharp |
| Slide Staining Set, 12-place | Mercedes Scientific | MER 1011 | Rack with 12 stain dishes and slide dippers for Toluidine blue histology |
| Sodium acetate, anhydrous | Thermo Scientific Chemicals | A1318430 | CAS#127-09-3, used to make buffer for Toluidine blue histology |
| Tissue-Tek Accu-Edge Low Profile Microtome Blades | VWR | 25608-964 | For paraffin sectioning |
| Toluidine Blue O | Thermo Scientific Chemicals | 348601000 | CAS#92-31-9 |
| Volume Reduction Insert | - | - | 3D printed from CAD files provided as Supplementary Files |
| Xylenes | Leica | 3803665 | 4 gallon supply for histological staining |
Références
- Cook, J. L., Purdam, C. Is compressive load a factor in the development of tendinopathy. Br J Sports Med. 46 (3), 163-168 (2012).
- Benjamin, M., Qin, S., Ralphs, J. R. Fibrocartilage associated with human tendons and their pulleys. J Anat. 187 (Pt 3), 625-633 (1995).
- Benjamin, M., Ralphs, J. R. Fibrocartilage in tendons and ligaments - an adaptation to compressive load. J Anat. 193 (4), 481-494 (1998).
- Benjamin, M., Theobald, P., Suzuki, D., Toumi, H. The anatomy of the Achilles tendon. The Achilles Tendon. 3, 5-16 (2007).
- Chimenti, R. L., et al. Insertional achilles tendinopathy associated with altered transverse compressive and axial tensile strain during ankle dorsiflexion. J Orthop Res. 35 (4), 910-915 (2017).
- Mora, K. E., et al. Ultrasound strain mapping of the mouse Achilles tendon during passive dorsiflexion. J Biomech. 132, 110920 (2022).
- Pringels, L., et al. Intratendinous pressure changes in the Achilles tendon during stretching and eccentric loading: Implications for Achilles tendinopathy. Scand J Med Sci Sports. 33 (5), 619-630 (2023).
- Koob, T. J., Vogel, K. G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. J Orthop Res. 5 (3), 414-424 (1987).
- Vogel, K. G., Koob, T. J. Structural specialization in tendons under compression. Int Rev Cytol. 115, 267-293 (1989).
- Vogel, K. G., Ordög, A., Pogány, G., Oláh, J. Proteoglycans in the compressed region of human tibialis posterior tendon and in ligaments. J Orthop Res. 11 (1), 68-77 (1993).
- Vogel, K. G., Sandy, J. D., Pogány, G., Robbins, J. R. Aggrecan in bovine tendon. Matrix Biol. 14 (2), 171-179 (1994).
- Robbins, J. R., Vogel, K. G. Regional expression of mRNA for proteoglycans and collagen in tendon. Eur J Cell Biol. 64 (2), 264-270 (1994).
- Vogel, K., Gordon, S. I., Blair, S. J., Fine, L. J. . Repetitive motion disorders of the upper extremity. , (1995).
- Benjamin, M., Tyers, R. N., Ralphs, J. R. Age-related changes in tendon fibrocartilage. J Anat. 179, 127-136 (1991).
- Ralphs, J. R., Benjamin, M., Thornett, A. Cell and matrix biology of the suprapatella in the rat: a structural and immunocytochemical study of fibrocartilage in a tendon subject to compression. Anat Rec. 231 (2), 167-177 (1991).
- Rufai, A., Benjamin, M., Ralphs, J. R. Development and ageing of phenotypically distinct fibrocartilages associated with the rat Achilles tendon. Anat Embryol (Berl). 186 (6), 611-618 (1992).
- Rufai, A., Ralphs, J. R., Benjamin, M. Ultrastructure of fibrocartilages at the insertion of the rat Achilles tendon. J Anat. 189 (Pt 1), 185-191 (1996).
- Waggett, A. D., Ralphs, J. R., Kwan, A. P. L., Woodnutt, D., Benjamin, M. Characterization of collagens and proteoglycans at the insertion of the human achilles tendon. Matrix Biol. 16 (8), 457-470 (1998).
- Ralphs, J., et al. Regional differences in cell shape and gap junction expression in rat Achilles tendon: relation to fibrocartilage differentiation. J Anat. 193 (pt 2), 215-222 (1998).
- Milz, S., et al. Three-dimensional reconstructions of the Achilles tendon insertion in man. J Anat. 200 (Pt 2), 145-152 (2002).
- Tischer, T., Milz, S., Maier, M., Schieker, M., Benjamin, M. An immunohistochemical study of the rabbit suprapatella, a sesamoid fibrocartilage in the quadriceps tendon containing aggrecan. J Histochem Cytochem. 50 (7), 955-960 (2002).
- Esquisatto, M. A., Joazeiro, P. P., Pimentel, E. R., Gomes, L. The effect of age on the structure and composition of rat tendon fibrocartilage. Cell Biol Int. 31 (6), 570-577 (2007).
- Matuszewski, P. E., et al. Regional variation in human supraspinatus tendon proteoglycans: Decorin, biglycan, and aggrecan. Connect Tissue Res. 53 (5), 343-348 (2012).
- Buckley, M. R., Huffman, G. R., Iozzo, R. V., Birk, D. E., Soslowsky, L. J. The location-specific role of proteoglycans in the flexor carpi ulnaris tendon. Connect Tissue Res. 54 (6), 367-373 (2013).
- Gillard, G. C., Reilly, H. C., Bell-Booth, P. G., Flint, M. H. The influence of mechanical forces on the glycosaminoglycan content of the rabbit flexor digitorum profundus tendon. Connect Tissue Res. 7 (1), 37-46 (1979).
- Giori, N. J., Beaupre, G. S., Carter, D. R. Cellular shape and pressure may mediate mechanical control of tissue composition in tendons. J Orthop Res. 11 (4), 581-591 (1993).
- Wren, T. A., Beaupré, G. S., Carter, D. R. Mechanobiology of tendon adaptation to compressive loading through fibrocartilaginous metaplasia. J Rehabil Res Dev. 37 (2), 135-143 (2000).
- Malaviya, P., et al. An in vivo model for load-modulated remodeling in the rabbit flexor tendon. J Orthop Res. 18 (1), 116-125 (2000).
- Shim, J. W., Elder, S. H. Influence of Cyclic Hydrostatic Pressure on Fibrocartilaginous Metaplasia of Achilles Tendon Fibroblasts. Biomech Model Mechanobiol. 5 (4), 247-252 (2006).
- Koob, T. J., Clark, P. E., Hernandez, D. J., Thurmond, F. A., Vogel, K. G. Compression loading in vitro regulates proteoglycan synthesis by tendon fibrocartilage. Arch Biochem Biophys. 298 (1), 303-312 (1992).
- Evanko, S. P., Vogel, K. G. Proteoglycan Synthesis in Fetal Tendon Is Differentially Regulated by Cyclic Compression in Vitro. Arch Biochem Biophys. 307 (1), 153-164 (1993).
- Vogel, K. G. The effect of compressive loading on proteoglycan turnover in cultured fetal tendon. Connect Tissue Res. 34 (3), 227-237 (1996).
- Thornton, G. M., et al. Changes in mechanical loading lead to tendon specific alterations in MMP and TIMP expression: influence of stress deprivation and intermittent cyclic hydrostatic compression on rat supraspinatus and Achilles tendons. Br J Sports Med. 44 (10), 698-703 (2010).
- Robbins, J. R., Evanko, S. P., Vogel, K. G. Mechanical Loading and TGF-β Regulate Proteoglycan Synthesis in Tendon. Arch Biochem Biophys. 342 (2), 203-211 (1997).
- Docking, S., Samiric, T., Scase, E., Purdam, C., Cook, J. Relationship between compressive loading and ECM changes in tendons. Muscles Ligaments Tendons J. 3 (1), 7-11 (2013).
- Wang, X., et al. Aberrant TGF-β activation in bone tendon insertion induces enthesopathy-like disease. J Clin Invest. 128 (2), 846-860 (2018).
- Cong, G. T., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: Development and analysis of a novel murine model. J Orthop Res. 36 (10), 2780-2788 (2018).
- Liu, Y., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: development and analysis of a novel rat model. J Shoulder Elbow Surg. 31 (9), 1898-1908 (2022).
- Majima, T., et al. Compressive compared with tensile loading of medial collateral ligament scar in vitro uniquely influences mRNA levels for aggrecan, collagen type II, and collagenase. J Orthop Res. 18 (4), 524-531 (2000).
- Hopkins, C., et al. Critical review on the socio-economic impact of tendinopathy. Asia Pac J Sports Med, Arthrosc, Rehabil Technol. 4, 9-20 (2016).
- Scott, A., Ashe, M. C. Common tendinopathies in the upper and lower extremities. Curr Sports Med Rep. 5 (5), 233-241 (2006).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin Sports Med. 22 (4), 675-692 (2003).
- Bah, I., et al. Tensile mechanical changes in the Achilles tendon due to Insertional Achilles tendinopathy. J Mech Behav Biomed Mater. 112, 104031 (2020).
- Maffulli, N., Reaper, J., Ewen, S. W. B., Waterston, S. W., Barrass, V. Chondral Metaplasia in Calcific Insertional Tendinopathy of the Achilles Tendon. Clin J Sport Med. 16 (4), 329-334 (2006).
- Corps, A. N., et al. Increased expression of aggrecan and biglycan mRNA in Achilles tendinopathy. Rheumatology (Oxford). 45 (3), 291-294 (2006).
- Scott, A., et al. Increased versican content is associated with tendinosis pathology in the patellar tendon of athletes with jumper's knee. Scand J Med Sci Sports. 18 (4), 427-435 (2008).
- Attia, M., et al. Greater glycosaminoglycan content in human patellar tendon biopsies is associated with more pain and a lower VISA score. Br J Sports Med. 48 (6), 469-475 (2014).
- Kujala, U. M., Sarna, S., Kaprio, J. Cumulative Incidence of Achilles Tendon Rupture and Tendinopathy in Male Former Elite Athletes. Clin J Sport Med. 15 (3), 133-135 (2005).
- Corps, A. N., et al. Changes in matrix protein biochemistry and the expression of mRNA encoding matrix proteins and metalloproteinases in posterior tibialis tendinopathy. Ann Rheum Dis. 71 (5), 746-752 (2012).
- Neer, C. S. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 54 (1), 41-50 (1972).
- Bigliani, L. U., Ticker, J. B., Flatow, E. L., Soslowsky, L. J., Mow, V. C. The relationship of acromial architecture to rotator cuff disease. Clin Sports Med. 10 (4), 823-838 (1991).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current Concepts Review Update Insertional Achilles Tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Nicholson, C. W., Berlet, G. C., Lee, T. H. Prediction of the Success of Nonoperative Treatment of Insertional Achilles Tendinosis Based on MRI. Foot Ankle Int. 28 (4), 472-477 (2007).
- Lohrer, H., David, S., Nauck, T. Surgical treatment for achilles tendinopathy - a systematic review. BMC musculoskelet disord. 17 (1), 207 (2016).
- McGarvey, W. C., Palumbo, R. C., Baxter, D. E., Leibman, B. D. Insertional Achilles Tendinosis: Surgical Treatment Through a Central Tendon Splitting Approach. Foot Ankle Int. 23 (1), 19-25 (2002).
- Maffulli, N., et al. Surgery for chronic Achilles tendinopathy produces worse results in women. Disabil Rehabil. 30 (20-22), 1714-1720 (1714).
- Wunderli, S. L., Blache, U., Snedeker, J. G. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connect Tissue Res. 61 (3-4), 262-277 (2020).
- Dyment, N. A., et al. A brief history of tendon and ligament bioreactors: Impact and future prospects. J Orthop Res. 38 (11), 2318-2330 (2020).
- Screen, H. R. C., Berk, D. E., Kadler, K. E., Ramirez, F., Young, M. F. Tendon Functional Extracellular Matrix. J Orthop Res. 33 (6), 793-799 (2015).
- Theobald, P., et al. The functional anatomy of Kager's fat pad in relation to retrocalcaneal problems and other hindfoot disorders. J Anat. 208 (1), 91-97 (2006).
- Ghazzawi, A., Theobald, P., Pugh, N., Byrne, C., Nokes, L. Quantifying the motion of Kager's fat pad. J Orthop Res. 27 (11), 1457-1460 (2009).
- Malagelada, F., et al. Pressure changes in the Kager fat pad at the extremes of ankle motion suggest a potential role in Achilles tendinopathy. Knee Surg Sports Traumatol Arthrosc. 28 (1), 148-154 (2020).
- Shaw, H. M., Benjamin, M. Structure-function relationships of entheses in relation to mechanical load and exercise. Scand J Med Sci Sports. 17 (4), 303-315 (2007).
- Soslowsky, L. J., et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 30 (8), 1057-1063 (2002).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. J Shoulder Elbow Surg. 7 (4), 375-380 (1998).
- Croen, B. J., et al. Chronic subacromial impingement leads to supraspinatus muscle functional and morphological changes: Evaluation in a murine model. J Orthop Res. 39 (10), 2243-2251 (2021).
- Andarawis-Puri, N., Flatow, E. L. Tendon fatigue in response to mechanical loading. J Musculoskelet Neuronal Interact. 11 (2), 106-114 (2011).
- Gains, C. C., Giannapoulos, A., Zamboulis, D. E., Lopez-Tremoleda, J., Screen, H. R. C. Development and application of a novel in vivo overload model of the Achilles tendon in rat. J Biomech. 151, 111546 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Pedaprolu, K., Szczesny, S. E. A Novel, Open-Source, Low-Cost Bioreactor for Load-Controlled Cyclic Loading of Tendon Explants. J Biomech Eng. 144 (8), 084505 (2022).
- Orishimo, K. F., et al. Effect of Knee Flexion Angle on Achilles Tendon Force and Ankle Joint Plantarflexion Moment During Passive Dorsiflexion. J Foot Ankle Surg. 47 (1), 34-39 (2008).
- Liu, C. L., et al. Influence of different knee and ankle ranges of motion on the elasticity of triceps surae muscles, Achilles tendon, and plantar fascia. Sci Rep. 10 (1), 6643 (2020).
- Cruz-Montecinos, C., et al. Soleus muscle and Achilles tendon compressive stiffness is related to knee and ankle positioning. J Electromyogr Kinesiol. 66, 102698 (2022).
- Connizzo, B. K., Grodzinsky, A. J. Lose-dose administration of dexamethasone is beneficial in preventing secondary tendon damage in a stress-deprived joint injury explant model. J Orthop Res. 38 (1), 139-149 (2020).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biol. 89, 11-26 (2020).
- Yabusaki, K., et al. A Novel Quantitative Approach for Eliminating Sample-To-Sample Variation Using a Hue Saturation Value Analysis Program. PloS one. 9 (3), e89627 (2014).
- Gao, J., Messner, K., Ralphs, J. R., Benjamin, M. An immunohistochemical study of enthesis development in the medial collateral ligament of the rat knee joint. Anat Embryol. 194 (4), 399-406 (1996).
- Han, S. K., Wouters, W. A. J., Clark, A., Herzog, W. Mechanically induced calcium signaling in chondrocytes in situ. J Orthop Res. 30 (3), 475-481 (2012).
- Han, W., et al. Impact of cellular microenvironment and mechanical perturbation on calcium signalling in meniscus fibrochondrocytes. Eur Cell Mater. 27, 321-331 (2014).
- Rossetti, L., et al. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 16 (6), 664-670 (2017).
- Sartori, J., Köhring, S., Witte, H., Fischer, M. S., Löffler, M. Three-dimensional imaging of the fibrous microstructure of Achilles tendon entheses in Mus musculus. J Anat. 233 (3), 370-380 (2018).
- Eliasberg, C. D., et al. Identification of Inflammatory Mediators in Tendinopathy Using a Murine Subacromial Impingement Model. J Orthop Res. 37 (12), 2575-2582 (2019).
- Zhang, Y., et al. Expression of alarmins in a murine rotator cuff tendinopathy model. J Orthop Res. 38 (11), 2513-2520 (2020).
- Zhang, X., et al. Assessment of Mitochondrial Dysfunction in a Murine Model of Supraspinatus Tendinopathy. J Bone Joint Surg. Am. 103 (2), 174-183 (2021).
- Liu, Y., et al. The role of Indian Hedgehog Signaling in tendon response to subacromial impingement: evaluation using a mouse model. Am J Sports Med. 50 (2), 362-370 (2022).
- Wang, T., et al. Load-induced regulation of tendon homeostasis by SPARC, a genetic predisposition factor for tendon and ligament injuries. Sci Transl Med. 13 (582), eabe5738 (2021).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nat Biomed Eng. 5 (12), 1457-1471 (2021).
- Jones, D. L., et al. Mechanoepigenetic regulation of extracellular matrix homeostasis via Yap and Taz. Proc Natl Acad Sci U S A. 120 (22), e2211947120 (2023).
- Connizzo, B. K., Grodzinsky, A. J. Release of pro-inflammatory cytokines from muscle and bone causes tenocyte death in a novel rotator cuff in vitro explant culture model. Connect Tissue Res. 59 (5), 423-436 (2018).
- Rees, S. G., et al. Catabolism of aggrecan, decorin and biglycan in tendon. Biochem J. 350 (Pt 1), 181-188 (2000).
- Samiric, T., Ilic, M. Z., Handley, C. J. Large aggregating and small leucine-rich proteoglycans are degraded by different pathways and at different rates in tendon. Eur J Biochem. 271 (17), 3612-3620 (2004).
- Rees, S. G., Curtis, C. L., Dent, C. M., Caterson, B. Catabolism of aggrecan proteoglycan aggregate components in short-term explant cultures of tendon. Matrix Biol. 24 (3), 219-231 (2005).
- Taye, N., Karoulias, S. Z., Hubmacher, D. The "other" 15-40%: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon. J Orthop Res. 38 (1), 23-35 (2020).
- Carvalho, H. F., Felisbino, S. L. The development of the pressure-bearing tendon of the bullfrog, Rana catesbeiana. Anat Embryol. 200 (1), 55-64 (1999).
- Carvalho, H. F., Felisbino, S. L., Covizi, D. Z., Della Colleta, H. H., Gomes, L. Structure and proteoglycan composition of specialized regions of the elastic tendon of the chicken wing. Cell Tissue Res. 300 (3), 435-446 (2000).
- van Sterkenburg, M. N., Kerkhoffs, G. M., Kleipool, R. P., Niek van Dijk, C. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study. J Anat. 218 (3), 336-341 (2011).
- Lee, A. H., Elliott, D. M. Comparative multi-scale hierarchical structure of the tail, plantaris, and Achilles tendons in the rat. J Anat. 234 (2), 252-262 (2019).
- Lee, A. H., Elliott, D. M. Multi-Scale Loading and Damage Mechanisms of Plantaris and Rat Tail Tendons. J Orthop Res. 37 (8), 1827-1837 (2019).
- Fan, H. M., Shrestha, L., Guo, Y., Tao, H. R., Sun, Y. L. The twisted structure of the rat Achilles tendon. J Anat. 239 (5), 1134-1140 (2021).
- Cutlip, R. G., Stauber, W. T., Willison, R. H., McIntosh, T. A., Means, K. H. Dynamometer for rat plantar flexor muscles in vivo. Med Biol Eng Comput. 35 (5), 540-543 (1997).
- Rijkelijkhuizen, J. M., Baan, G. C., de Haan, A., de Ruiter, C. J., Huijing, P. A. Extramuscular myofascial force transmission for in situ rat medial gastrocnemius and plantaris muscles in progressive stages of dissection. J Exp Biol. 208 (Pt 1), 129-140 (2005).
- Saxena, A., Bareither, D. Magnetic Resonance and Cadaveric Findings of the Incidence of Plantaris Tendon. Foot Ankle Int. 21 (7), 570-572 (2000).
- dos Santos, M. A., Bertelli, J. A., Kechele, P. R., Duarte, H. Anatomical study of the plantaris tendon: reliability as a tendo-osseous graft. Surg Radiol Anat. 31 (1), 59-61 (2009).
- Sartori, J., Köhring, S., Bruns, S., Moosmann, J., Hammel, J. U. Gaining Insight into the Deformation of Achilles Tendon Entheses in Mice. Adv Eng Mater. 23 (11), 2100085 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon