需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过酶解离小鼠六块后肢肌肉获得的完整短、中和长骨骼肌纤维:超越趾短屈肌
摘要
我们描述了一种从成年小鼠的六块肌肉中获得不同长度和类型的酶解离纤维的方案:其中三个已经描述(趾短屈肌,趾长伸肌,比目鱼肌),其中三个首次成功解离(拇长伸肌,腓骨长肌,腓骨趾四分)。
摘要
通过小鼠肌肉酶解离获得的骨骼肌纤维是生理实验的有用模型。然而,大多数论文都涉及趾短屈肌(FDB)的短纤维,这限制了处理纤维类型的结果范围,限制了可用的生物材料的数量,并阻碍了细胞生理现象与先前在其他肌肉中获得的生化和动力学知识之间的明确联系。
本文描述了如何从具有不同纤维类型轮廓和长度的六块肌肉中获得完整的纤维。使用 C57BL/6 成年小鼠,我们展示了肌肉解剖和纤维分离方案,并证明了纤维对 Ca2+ 瞬时研究及其形态学表征的适用性。还介绍了肌肉的纤维类型组成。解离时,所有肌肉都变得完整,活纤维快速收缩超过 24 小时。 FDB 提供短 (<1 mm),腓骨趾四分 (PDQA) 和腓骨长肌 (PL) 提供中间 (1-3 mm),而趾长伸肌 (EDL)、幻觉长伸肌 (EHL) 和比目鱼肌释放长 (3-6 mm) 纤维。
当用快速染料 Mag-Fluo-4 记录时,PDQA、PL 和 EHL 纤维的 Ca2+ 瞬变显示出快速、窄的动力学,让人联想到形态 II (MT-II),已知对应于 IIX 型和 IIB 型纤维。这与以下事实一致:与FDB(~80%)和比目鱼肌(~65%)相比,这些肌有超过90%的II型纤维。除了FDB,我们首次展示了几块肌肉的解离,这些肌肉使纤维的长度范围在1到6毫米之间。这些纤维是可行的,并产生快速的 Ca2+ 瞬变,表明 MT-II 可以推广到 IIX 和 IIB 快速纤维,无论它们的肌肉来源如何。这些结果增加了成熟骨骼肌研究模型的可用性。
引言
哺乳动物的成熟骨骼肌是一种多功能组织。它严重调节新陈代谢,是产生热量的主要来源,其动力学特性使其在呼吸、身体节段的运动或从一个点到另一个点的位移中起着关键作用 1,2,3。骨骼肌还与许多疾病的病理生理学有关,包括遗传和慢性疾病,如肌病、营养不良或肌肉减少症,以及许多非肌肉慢性疾病,如心脏代谢疾病 3,4,5,6,7,8。
在健康和疾病背景下对成熟骨骼肌的结构和功能特性的离体研究主要通过两种实验模型成为可能:全肌和分离纤维。在 20世纪,研究人员利用不同小物种的整体完整趾长伸肌 (EDL)、比目鱼肌、胫骨前肌和腓肠肌的特性作为关键模型来了解运动单位、纤维类型和动态特性,例如收缩和松弛的力和动力学 9,10,11,12,13,14,15,16. 然而,更精细的细胞生物学研究的出现将该领域推向了单肌纤维的研究。然后,开创性的工作能够通过酶解分离出大鼠的完整趾短屈肌(FDB)纤维,用于随后的表征17,18,19。虽然FDB纤维也可以通过手动解剖20获得,但小鼠肌肉酶解离的易用性和高通量,除了适用于各种实验方法外,还使后一种模型在过去二十年中得到广泛使用。
短FDB纤维适用于电生理学和其他生物物理研究、生化、代谢和药理学分析、电子和荧光显微镜实验、细胞生物学方法的转染,或作为肌发生研究中干细胞的来源5,21,22,23,24,25,26,27,28, 29,30,31,32.然而,在肌肉实验中仅使用FDB纤维缩小了处理纤维类型的研究范围,并限制了可用于某些方法学技术或从一只动物获得更多信息的生物材料的数量。这些局限性阻碍了细胞生理现象与先前在不同的完整肌肉(例如EDL,比目鱼肌,腓骨)中进行的生化和动力学研究的明确相关性。
克服了这些局限性,一些小组成功地分离了较长的EDL和比目鱼肌24,33,34,35,36,37,38,39,40,为进一步将该方法扩展到其他相关肌肉打开了大门。然而,EDL和比目鱼肌纤维的使用仍然很少,这可能是由于缺乏将它们作为完整纤维的方法学细节。在这里,我们详细描述了如何从六块肌肉中分离出不同长度和类型的纤维:其中三块已经描述过(FDB、EDL 和比目鱼肌),其中三块首次成功解离(拇长伸肌 [EHL]、腓骨长肌 [PL] 和腓骨趾四分肌 [PDQA])。本工作的结果证实,酶解离纤维的模型适用于广泛的研究,并且与先前发表的数据具有未来的相关性,从而增加了成熟骨骼肌研究模型的可用性。
研究方案
根据 1989 年第 84 号法律和 1993 年第 8430 号决议,所有程序均由安蒂奥基亚大学动物实验伦理委员会 (UdeA) 批准(2016 年 6 月 21 日第 104 分钟和 2021 年 4 月 15 日 005 分钟),并按照动物研究进行和报告: 报告体内实验 (ARRIVE) 指南41.这里介绍的所有结果均来自健康的7-13周龄,20-26克,C57BL / 6雄性小鼠。图 1 显示了本研究的总体设计和程序顺序。所有试剂、材料和设备详细信息都列在材料表中。
1. 动物
- 在受控温度(21±2°C)和光:暗(12:12小时)循环的条件下,每个亚克力,透明,矩形笼子最多容纳六只小鼠,带有木材衍生的垫料。
- 在不富集环境的特定无病原体动物设施中为动物免费提供食物和自来水。
2. 解剖
- 溶液、材料和试剂
- 制备并过滤(0.22μm)具有以下成分的工作溶液(所有浓度均为mM):
- 酪状物:5.4 KCl、1 MgCl2、140 NaCl、0.33 NaH2PO4、2 CaCl2、10 葡萄糖、10 HEPES,pH 7.3
- 解离:2.7 KCl,1.2 KH2PO 4,0.5 MgCl 2,138 NaCl,0.1 Na2HPO4,1 CaCl2,pH 7.4
- 磷酸盐缓冲盐水 (PBS):137 NaCl、8.6 Na2HPO4、2.8 KH2PO4、pH 7.34
- 准备两个解剖室;立体镜;操作剪刀;细剪刀;细镊子;干净、透明、非圆锥形、1-1.5 cm 宽、总体积为 3-4 mL 的带盖玻璃样品瓶。安排一个用于电刺激解剖室肌肉的系统。
- 准备不同宽度吸头的火抛光巴斯德玻璃移液器:5、4、3、2 和 1 mm。
- 将水浴设置为37°C。 称取 3 mg 2 型胶原酶的等分试样。
- 制备并过滤(0.22μm)具有以下成分的工作溶液(所有浓度均为mM):
- 程序
- 使用当地伦理委员会批准的方法牺牲老鼠。建议进行颈椎脱位,因为它速度快,压力小,并且避免接触可能影响肌肉组织的药物(如 CO2 或某些麻醉剂)。立即开始解剖以获得更好的结果。
- 将鼠标放在泡沫表面上,用胶带或别针固定前肢。用手术剪刀将两个后肢切到膝盖上,将它们转移到单独的解剖室中,并加入冷(10-20°C)Tyrode以覆盖组织。
注意:每个后肢将按以下顺序提供六种不同的肌肉:FDB、比目鱼肌、EDL、EHL、PL 和 PDQA。 图 2 和其他地方给出了详细的解剖学参考资料,用于解剖从肌腱到肌腱的六块完整的肌肉42。 - 将第一后肢固定在腿后表面可见的位置解剖室。在放大镜下去除皮肤;然后暴露并移除 FDB(图 2)。将其储存在一个装有 1 mL Tyrode 溶液的标记玻璃瓶中。
注意: 需要适当的放大倍率和先前的训练,以避免肌肉组织中出现任何不希望的割伤。 - 暴露,取出并储存比目鱼肉,并用1mL酪氨酸储存在单独的小瓶中。使用细剪刀先分离腓肠肌,然后取出比目鱼肌,如 图 2 所示。
- 暴露腿部前脸,去除皮肤,并识别胫骨前肌的远端肌腱和踝关节的EDL肌肉。去除并丢弃胫骨;然后切断EDL的远端肌腱(图2)。继续解剖直至去除 EDL,并将其放入装有 1 mL 酪氨酸的单独玻璃瓶中。
- 移除位于 EDL 后方和内侧的 EHL 肌肉。通过识别肌腱并跟随肌腱到第 1 位数字开始解剖,如 图 2 的相应面板所示。将肌肉保存在装有 1 mL Tyrode 的单独玻璃瓶中。
- 识别并遵循腓骨最外侧的肌腱将其切割并去除 PL 肌肉(图 2)。将肌肉放入装有 1 mL Tyrode 的单独玻璃瓶中。
- 识别并跟随肌腱到第 4 位数字;切开它并去除PDQA肌肉(图2)。将其放入装有 1 mL 酪氨酸的单独玻璃瓶中。
- 用第二后肢重复该过程。
- 将相同类型的两块肌肉聚集在一个标记的玻璃瓶或装有Tyrode溶液的小培养皿中。
注意:如果计划在工作会议期间解剖两对以上的肌肉,请招募两名研究人员进行解剖程序。
3. 肌纤维分离方案
- 在解剖室中更新Tyrode溶液以去除碎屑和小鼠皮毛。将FDB肌肉倒入一个解剖室中,验证其完整性,然后将它们转移到装有1mL解离溶液的新玻璃瓶中。用 EHL、PL 和 PDQA 肌肉重复此过程。
注意:如果肌肉看起来过度收缩、切割或对电刺激无反应,请不要继续下一个方案步骤。相反,通过验证溶液的质量(pH值、污染、渗透压)和获得更多的解剖技能来优化解剖方案(图1C 和 补充视频S1)。 - 按照纤维的方向,对比目鱼肌和EDL肌肉进行纵向或对角线切割(图2)。对于比目鱼肌,沿着中央肌腱,切割其长度的 ~80%。对于 EDL,只需沿着一根或两条肌腱,并切割与比目鱼肌大致相同的长度。将每对肌肉放入装有 1 mL 解离溶液的玻璃瓶中。
注意:此过程使EDL和比目鱼肌变小,并允许胶原酶更好地进入组织。必须有足够的放大倍率(40-50倍),以及细剪刀和镊子。在继续解离方案的下一步之前,请务必通过目视检查和电刺激检查样品的完整性。 - 将 3 mg 2 型胶原酶(活性为 250-300 U/mg)加入每个含有 1 mL 解离溶液和一对肌肉的小瓶中。通过考虑所用酶批次的活性来标准化胶原酶的确切量。
- 在36.8-37°C下,在水浴中孵育肌肉对65-90分钟,轻轻摇动。
注意: 严格控制温度。标准化程序,使肌肉不会在胶原酶中停留超过100分钟,以避免损伤。 - 孵育第 65分钟后每5分钟在立体镜放大下检查小瓶。当肌肉看起来略有波纹、破烂和松弛时,轻轻摇晃小瓶并验证某些纤维是否开始容易脱落。如果是这种情况,请在室温下用Tyrode清洗肌肉以灭活并去除胶原酶。
注意: 清洗必须小心,不要用移液管接触肌肉。首先加入 0.8 mL Tyrode,然后除去 0.8 mL 溶液。重复此过程 4-5 次,并验证溶液是否完全透明。 - 在一套经过火抛光的巴斯德移液器的帮助下,在Tyrode中非常温和地研磨,从大部分肌肉中分离出更多的纤维。首先用最宽的移液管(5 mm 尖端)搅动肌肉周围的溶液,然后轻轻地将肌肉拉入和拉出移液器 3-4 次。当肌肉开始释放纤维并变薄时,使用下一个移液器(4 mm 吸头)重复该过程。
注意:通过此程序呈现的纤维保持可兴奋性并快速收缩超过 24 小时,如 补充视频 S2、补充视频 S3、补充视频 S4 和 补充视频 S5 中使用 PL、EDL、EHL 和比目鱼肌纤维为例。
4.实验程序
注意:分离的纤维用于肌浆 Ca2+ 浓度估计、形态测量和肌球蛋白重链 (MHC) 表达研究。
- 肌浆钙的测量2+ 抽搐时的注意力
- 在实验浴室上安装一个干净的玻璃载玻片。在载玻片上涂上 2-3 μL 层粘连蛋白,使其干燥 30 秒,然后将 ~400 μL 纤维悬浮液倒入载玻片上。让纤维在室温下粘附在层粘连蛋白上10-15分钟。
- 将实验室安装到配备落射荧光的倒置显微镜的载物台上(图3A)。
- 通过沿实验室两侧放置的两个铂电极施加矩形电流脉冲(0.8-1.2 ms),唤起单次抽搐以验证光纤的活力。即使附着在层粘连蛋白上,纤维的收缩仍然主要在极端可见。
- 在Tyrode溶液中用3.5-4.5μM的快速Ca2 + 染料Mag-Fluo-4,AM加载纤维4-5分钟。之后,用Tyrode轻轻洗涤以去除细胞外染料。让细胞内染料在黑暗条件下脱酯~15-20分钟。始终将温度保持在22°C以下,以避免染料区隔。
注意:仅准备二甲基亚砜(DMSO)中的Mag-Fluo-4,AM储备液,使DMSO在加载Tyrode溶液中的最终浓度小于0.5%。 - 使用白色发光二极管 (LED) 和具有以下波长的滤光片组照亮光纤,用于激发/二向色/发射:450-490/510/515 nm(图 3A)。
注意:替代激发源包括汞和氙荧光灯。使用尽可能低的激发点强度和大小,以避免染料光漂白和细胞损伤。 - 通过在20-22°C下通过放置在实验室两侧的两个铂电极施加矩形电流脉冲(0.8-1.2ms)来唤起光纤的Ca2 + 响应(肌浆Ca2 + 瞬变)。
- 使用适用于荧光的油浸式 40 倍远距离物镜和连接到数字化仪的光电倍增管 (PMT) 收集和保存光信号(图 3A 和 补充视频 S6)。确保采集软件中的刻度为 0-200 任意单位 (AU),并通过调制激发点的大小和 PMT 的增益,将实验的静息荧光(F静息) 设置为该刻度上的 10 AU。一旦程序标准化,保持从一个实验到另一个实验的增益不变,并且仅通过对光斑大小的微小调整来设置刻度。
注意:如果出现运动伪影,请在Tyrode溶液中使用20-30μM N-苄基对甲苯磺酰胺(BTS)。 - 按如下方式分析和校准信号:
- 低通滤波器以1 kHz对整个走线进行滤波。
- 计算迹线 1 秒内 的 F静止 ,将 F静止 调整为 0,并测量峰肌浆 Ca2+ 瞬变幅度(F峰值)。如等式(1)所示表示振幅:
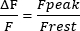 (一)
(一) - 使用公式(2)26和以下参数计算峰Ca2+浓度([Ca2+],μM):原位解离常数(Kd)= 1.65×105μM 2,最大荧光(F最大值)为150.9AU,最小荧光(F分钟)为0.14AU,Mag-Fluo-4浓度[D]T为229.1μM26。在步骤4.1.8.2中已经获得了F峰。
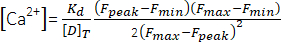 (2)
(2) - 测量从振幅的 10% 到 90% 的上升时间(RT,ms)、半最大值的持续时间(HW,ms)和从振幅的 90% 到 10% 的衰减时间(DT,ms)。然后,根据与双指数函数的拟合估计衰减动力学(等式 3):
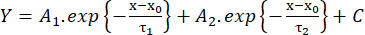 (3)
(3) - 保存衰减 τ1 和 τ2 (ms) 的时间常数值以及振幅 A1 和 A226。
- 形态测量
- 在实验浴室上安装一个干净的玻璃载玻片。在载玻片上涂上 2-3 μL 层粘连蛋白,使其干燥 30 秒,然后将 ~400 μL 纤维悬浮液倒入载玻片上。让纤维在室温下粘附在层粘连蛋白上10-15分钟。
- 通过沿实验室两侧放置的两个铂电极施加矩形电流脉冲(0.8-1.2 ms),唤起单次抽搐以验证光纤的活力。即使附着在层粘连蛋白上,纤维的收缩仍然主要在极端可见。
- 使用10倍和20倍物镜以及安装在倒置荧光显微镜上的至少500万像素的相机获取活体纤维的图像。将图像存储在 .用于离线分析的 TIFF 格式。
注意:可能需要一组 ~2-6 张图像才能完全捕获长光纤。 - 在相同放大倍率下对显微镜千分尺校准标尺进行成像。将图像存储在 .用于离线分析的 TIFF 格式。
- 使用免费软件的校准工具测量纤维的长度和直径,进行图像分析,如下所示:
- 借助显微镜千分尺校准尺,使用“ 分析/设置比例尺 ”工具,在图像中的像素和已知距离(μm)之间建立关系,如 补充图S1所示。
- 测量一次从纤维的一个尖端到另一个尖端的长度,以及沿光纤 2-6 个不同位置的直径(每张图像 1-2 次测量,取决于其长度),如 补充图 S1 所示。
- 报告每根光纤的长度值(μm 或 mm)和所有直径的平均值 (μm)。
- 肌球蛋白重链表达研究
注:有关通过免疫荧光43 和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 33、44、45、46 在全肌肉中测定 MHC 的详细信息,请参阅 补充文件 1。通过免疫荧光测定 FDB 分离纤维悬浮液中 MHC 进行纤维分型的方案如下:- 用 2-3 μL 层粘连蛋白涂覆五个干净的载玻片,使其干燥 30 秒,然后将 ~300 μL 纤维悬浮液倒入每个载玻片上。让纤维在室温下粘附在层粘连蛋白上4小时。
- 在室温下用冷冻冷却的丙酮固定制剂30分钟。
- 用 PBS 轻轻清洗 3 次。
- 在室温下用补充有0.7%Triton X-100的PBS透化细胞膜15分钟。
- 用补充有0.2%牛血清白蛋白(BSA)和0.04%Triton X-100的PBS轻轻洗涤3次,随后用含有2%BSA,2%山羊血清和0.4%Triton X-100的PBS在室温下封闭30分钟。
- 用补充有 0.2% BSA 和 0.04% Triton X-100 的 PBS 轻轻洗涤 3 次,并与一抗一起孵育,如下所示:
- 用 1% BSA 和 0.04% Triton X-100 在 PBS 中的单独小瓶中稀释每种抗 MHC 一抗:抗 I (1:1,500)、抗 II (1:600)、抗 IIA(使用来自杂交瘤的整个条件培养基)和抗 IIB (1:500)。
- 将每张载玻片与一种抗体一起孵育,其余载玻片用PBS作为对照在4°C下孵育12-16小时。
注意:在该协议中,IIX型纤维在所有样品中均未标记。
- 用PBS轻轻洗涤3次,并在室温下将所有载玻片与二抗(1:800)偶联到荧光绿色分子中孵育1-2小时。
- 用 1 μg/mL Hoechst 染色细胞核 15 分钟。
- 用 PBS 轻轻洗涤 3 次,小心加入 20-40 μL 封固剂,然后放置盖玻片。
注意:温和的溶液交换和洗涤确保数十根纤维保持附着在载玻片上,使实验在统计学上是合理的。 - 使用适用于荧光的 10 倍物镜和具有以下波长的激发/二向色/发射滤光片组可视化每张载玻片:450-490/510/515 nm,并计数所有正极和负极光纤。或者,使用相同的技术条件和安装在倒置荧光显微镜上的至少500万像素的相机获取荧光图像,并将它们存储在 .用于离线分析的 TIFF 格式。
- 在数据库中记录每张载玻片的正负纤维,并根据相应载玻片中存在的纤维总数计算正 I、IIA、IIB 和总 II 纤维的百分比。通过从总 II 光纤的百分比中减去 IIA+IIB 的总和来计算 IIX 光纤的百分比。通过从 100% 的值中减去 I+II 的总和来估计混合 I/IIA 光纤的百分比。最后,从 I 型和 II 型的总和中减去杂交电池的百分比,得到纯 I 型和 II 型纤维。
注意:在MHC组成研究中,纤维类型由大写字母表示,而亚型由小写字母46表示。
- 苏木精和伊红染色
- 在干净的载玻片上涂上 2-3 μL 层粘连蛋白,使其干燥 30 秒,然后将 ~300 μL 纤维悬浮液倒入载玻片上。让纤维在室温下粘附在层粘连蛋白上4小时。
- 用Carnoy溶液(60%无水乙醇,30%氯仿,10%乙酸)在室温下固定制剂5分钟。
- 与苏木精孵育 90 秒。
- 用自来水轻轻清洗 3 次。
- 与在70%乙醇中制备的1%曙红Y孵育30秒。
- 用自来水轻轻清洗 3 次。
- 将 3x 浸入无水乙醇中。
- 在木二甲酚中孵育 60 秒。
- 加入 20-40 μL 的封固剂并用常规显微镜观察。使用至少 5 MP 的彩色相机以所需的放大倍率获取图像。
5. 统计分析和制图
注意:实验单元是肌肉纤维。
- 将结果表示为平均值±标准差,并计算某些分析的置信区间 95% (CI95%)。
- 为了比较组间的长度、直径和 Ca2+ 瞬变动力学,使用 Bonferroni 校正进行方差分析 (ANOVA) 和事后检验。
- 分别使用 Shapiro-Wilk 检验和 Leven 检验评估正态性和方差相等性。
- 当 p < 0.05 时,考虑显著的差异。
结果
抽搐期间肌浆 Ca2+ 浓度
为了证明在一组解离纤维中进行生理实验的可行性,并扩展我们之前关于激发-收缩耦合 (ECC) 和纤维类型的发现,在所有肌肉的纤维中获得了 Ca2+ 瞬变。首先,FDB (n = 5) 和 EDL (n = 7) 显示出称为形态学 II 型 (MT-II) 的 Ca2+ 动力学。这些是快速、尖锐的信号,其 RT 持续 ~1 毫秒;它的衰变阶段可以用双指数函数拟合,第一分量(A<...
讨论
为了补充可用于研究成熟骨骼肌生物学的模型,我们在这里展示了一系列具有短纤维、中纤维和长纤维的小鼠肌肉的成功酶解离。这些纤维可以证明骨骼肌中 Ca2+ 瞬变的 MT-II 动力学的普遍性。此外,对完整、完整的肌肉中的纤维类型进行了分类。鉴于FDB是生理实验中最常用的肌肉,因此评估了解离后细胞悬液中存在的纤维类型。
用于肌肉生物学研究的短纤维、...
披露声明
提交人声明他们没有利益冲突。
致谢
作者感谢 UdeA 的 Robinson Ramírez 教授在动物和一些照片方面的帮助,并感谢 Carolina Palacios 的技术支持。来自 Kaika 的 Johan Pineda 帮助我们设置了彩色和荧光相机。昆士兰大学的Shyuan Ngo对手稿进行了校对。这项研究由 CODI-UdeA(2021 年 2 月 22 日的 2020-34909 和 2022 年 3 月 31 日的 2021-40170,SIU)和哥伦比亚麦德林的规划办公室-UdeA(E01708-K 和 ES03180101)资助给 JCC。资助者没有参与数据收集和分析、手稿撰写或提交。
材料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Absolute ethanol | Sigma Aldrich | 32221 | |
| Acetone | Merck | 179124 | |
| Acrylamide | Gibco BRL | 15512-015 | |
| Ammonium persulfate | Panreac | 141138.1610 | |
| Anti myosin I antibody | Sigma Aldrich | M4276 | Primary antibody |
| Anti myosin II antibody | Sigma Aldrich | M8421 | Primary antibody |
| Anti myosin IIA antibody | American Type Culture Collection | SC-71 | Primary antibody. Derived from HB-277 hybridoma |
| Anti myosin IIB antibody | Developmental Studies Hybridoma Bank | BF-F3-c | Primary antibody |
| Bis-acrylamide | AMRESCO | 0172 | |
| Bovine serum albumin | Thermo Scientific | B14 | |
| Bradford reagent | Merck | 1.10306.0500 | |
| Bromophenol blue | Carlo Erba | 428658 | |
| Calcium carbonate | Merck | 102066 | |
| Calcium dichloride (CaCl2) | Merck | 2389 | |
| Chloroform | Sigma Aldrich | 319988 | |
| Collagenase type 2 | Worthington | CLS-2/LS004176 | |
| Consul-Mount | Thermo Scientific | 9990440 | |
| Coomassie Brilliant blue R 250 | Merck | 112553 | |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Dithiothreitol (DTT) | AMRESCO | 0281 | |
| Edetic acid (EDTA | AMRESCO | 0322 | |
| Eosin Y | Sigma Aldrich | E4009 | |
| Glycerol | Panreac | 1423291211 | |
| Glycine | Panreac | 151340.1067 | |
| Goat serum | Sigma Aldrich | G9023 | |
| Hematoxylin | Thermo Scientific | 6765015 | |
| HEPES | AMRESCO | 0511 | |
| Hoechst 33258 | Sigma Aldrich | 861405 | |
| Imidazole | AMRESCO | M136 | |
| Isopentane | Sigma Aldrich | M32631 | |
| Laminin | Sigma Aldrich | L2020 | |
| Mag-Fluo-4, AM | Invitrogen | M14206 | Prepared only in DMSO. Pluronic acid is not required and should not be used to avoid fiber deterioration. |
| Mercaptoethanol | Applichem | A11080100 | |
| Methanol | Protokimica | MP10043 | |
| Mice | Several | Several | For this manuscript, we only used C57BL/6 mice. However, some preliminary results have shown that the protocol works well for Swiss Webster mice of the same age and weight. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | |
| N,N,N',N'-tetramethylethane-1,2-diamine (TEMED) | Promega | V3161 | |
| N-benzyl-p-toluene sulphonamide (BTS) | Tocris | 1870 | |
| Optimal cutting compound (OCT) | Thermo Scientific | 6769006 | |
| Secondary antibody | Thermo Scientific | A-11001 | Goat anti-mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 |
| Sodium dodecil sulfate | Panreac | 1323631209 | |
| TRIS 0.5 M, pH 6.8 | AMRESCO | J832 | |
| Tris(Hydroxymethyl)aminomethane | AMRESCO | M151 | |
| Triton X-100 | AMRESCO | M143 | |
| Materials | |||
| Dissection chamber | Custom-made | ||
| Charged slides | Erie Scientific | 5951PLUS | |
| Experimental bath chamber | Warner Instruments | RC-27NE2 | Narrow Bath Chamber with Field Stimulation, ensembled on a heated platform PH-6 |
| Fine forceps | World Precision Instruments | 500338, 500230 | |
| Fine scissors | World Precision Instruments | Vannas Scissors 501778 | |
| Glass Pasteur pipettes | Several | Fire-polished tips | |
| Glass vials with cap | Several | 2-3 mL volumen | |
| Operating scissors | World Precision Instruments | 501223-G | |
| Equipment | |||
| Centrifuge | Thermo Scientific | SL 8R | |
| Confocal microscope | Olympus | FV1000 | |
| Cryostat | Leica | CM1850 | |
| Digital camera | Zeiss | Erc 5s and Axio 305 | Axio 305, coupled to the Stemi 508 stereoscope, was used to take pictures during dissection; while Erc 5s or Axio 208, coupled to the Axio Observer A1 microscope, were used to take images of the isolated fibers and the immunofluorescence assays |
| Digitizer | Molecular Devices | 1550A Digidata | |
| Electrophoresis chamber | Bio Rad | Mini-Protean IV | |
| Inverted microscope coupled to fluorescence | Zeiss | Axio Observer A1 | Coupled to an appropriate light source, filters and objectives for fluorescence |
| Photomultiplier | Horiba | R928 tube, Hamamatsu, in a D104 photometer, Horiba | Coupled to the lateral port of the fluorescence microscope |
| Stereoscope | Zeiss | Stemi 508 | |
| Stimulator | Grass Instruments | S6 | |
| Water bath | Memmert | WNE-22 | |
| Xilol | Sigma Aldrich | 808691 | |
| Software | |||
| Free software for electrophoreses analyses | University of Kentucky | GelBandFitter v1.7 | http://www.gelbandfitter.org |
| Free software for image analysis and morphometry | National Institutes of Health | ImageJ v1.54 | https://imagej.nih.gov/ij/index.html |
| Licensed software for Ca2+ signals acquisition and analyses | Molecular Devices | pCLAMP v10.05 | https://www.moleculardevices.com |
| Licensed software for statistical analyses and graphing | OriginLab | OriginPro 2019 | https://www.originlab.com/ |
参考文献
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int. 96 (3), 183-195 (2015).
- Barclay, C., Launikonis, B. Components of activation heat in skeletal muscle. J Muscle Res Cell Motil. 42 (1), 1-16 (2021).
- Gallo-Villegas, J. A., Calderón, J. C. Epidemiological, mechanistic, and practical bases for assessment of cardiorespiratory fitness and muscle status in adults in healthcare settings. Eur J Appl Physiol. 123 (5), 945-964 (2023).
- Cardamone, M., Darras, B. T., Ryan, M. M. Inherited myopathies and muscular dystrophies. Semin Neurol. 28 (2), 250-259 (2008).
- Sánchez-Aguilera, P., et al. Role of ABCA1 on membrane cholesterol content, insulin-dependent Akt phosphorylation and glucose uptake in adult skeletal muscle fibers from mice. Biochim Biophys Acta. 1863 (12), 1469-1477 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 48 (1), 16-31 (2019).
- Narvaez-Sanchez, R., Calderón, J. C., Vega, G., Trillos, M. C., Ospina, S. Skeletal muscle as a protagonist in the pregnancy metabolic syndrome. Med Hypotheses. 126, 26-37 (2019).
- Gallo-Villegas, J., et al. Efficacy of high-intensity interval- or continuous aerobic-training on insulin resistance and muscle function in adults with metabolic syndrome: a clinical trial. Eur J Appl Physiol. 122 (2), 331-344 (2022).
- Close, R. Properties of motor units in fast and slow skeletal muscles of the rat. J Physiol. 193 (1), 45-55 (1967).
- Barnard, R. J., Edgerton, V. R., Furukawa, T., Peter, J. B. Histochemical, biochemical, and contractile properties of red, white, and intermediate fibers. Am J Physiol. 220, 410-414 (1971).
- Bär, A., Pette, D. Three fast myosin heavy chains in adult rat skeletal muscle. FEBS letters. 235 (1-2), 153-155 (1988).
- Schiaffino, S., et al. Myosin heavy chain isoforms and velocity of shortening of type 2 skeletal muscle fibres. Acta Physiol Scand. 134 (4), 575-576 (1988).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. J Muscle Res Cell Motil. 10 (3), 197-205 (1989).
- Ranatunga, K., Thomas, P. Correlation between shortening velocity, force-velocity relation and histochemical fibre-type composition in rat muscles. J Muscle Res Cell Motil. 11 (3), 240-250 (1990).
- Hämäläinen, N., Pette, D. The histochemical profiles of fast fiber types IIB, IID, and IIA in skeletal muscles of mouse, rat, and rabbit. J Histochem Cytochem. 41 (5), 733-743 (1993).
- Agbulut, O., Li, Z., Mouly, V., Butler-Browne, G. S. Analysis of skeletal and cardiac muscle from desmin knock-out and normal mice by high resolution separation of myosin heavy-chain isoforms. Biol Cell. 88 (3), 131-135 (1996).
- Bekoff, A., Betz, W. Properties of isolated adult rat muscle fibres maintained in tissue culture. J Physiol. 271 (2), 537-547 (1977).
- Bekoff, A., Betz, W. Physiological properties of dissociated muscle fibres obtained from innervated and denervated adult rat muscle. J Physiol. 271 (1), 25-40 (1977).
- Schuetze, S. M. The acetylcholine channel open time in chick muscle is not decreased following innervation. J Physiol. 303, 111-124 (1980).
- Youhanna, S., Bruton, J., Jardemark, K., Westerblad, H., Lauschke, V. M. Calcium measurements in enzymatically dissociated or mechanically microdissected mouse primary skeletal muscle fibers. STAR Protoc. 4 (2), 102260 (2023).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem Cell Biol. 83 (5), 674-676 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single muscle-fiber isolation and culture for cellular, molecular, pharmacological, and evolutionary studies. Methods Mol Biol. 798, 85-102 (2012).
- Bolaños, P., Guillen, A., Gámez, A., Caputo, C. Quantifying SOCE fluorescence measurements in mammalian muscle fibres. The effects of ryanodine and osmotic shocks. J Muscle Res Cell Motil. 34 (5-6), 379-393 (2013).
- Lopez, R., et al. Raptor ablation in skeletal muscle decreases Cav1.1 expression and affects the function of the excitation-contraction coupling supramolecular complex. Biochem J. 466 (1), 123-135 (2015).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skelet Muscle. 8 (1), 14 (2018).
- Milán, A. F., et al. Calibration of mammalian skeletal muscle Ca2+ transients recorded with the fast Ca2+ dye Mag-Fluo-4. Biochim Biophys Acta. 1865 (9), 129939 (2021).
- Park, K. H., et al. Assessment of calcium sparks in intact skeletal muscle fibers. J Vis Exp. (84), e50898 (2014).
- Wei-LaPierre, L., Groom, L., Dirksen, R. T. Acute exposure to extracellular BTP2 does not inhibit Ca2+ release during EC coupling in intact skeletal muscle fibers. J Gen Physiol. 154 (9), 202112976 (2022).
- Banks, Q., et al. Voltage sensor movements of Ca(V)1.1 during an action potential in skeletal muscle fibers. Proc Natl Acad Sci U S A. 118 (40), 2026116118 (2021).
- Jaque-Fernandez, F., et al. Preserved Ca2+ handling and excitation-contraction coupling in muscle fibres from diet-induced obese mice. Diabetologia. 63 (11), 2471-2481 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--a more mature muscle culture system. Cell Motil Cytoskeleton. 64 (10), 727-738 (2007).
- Leduc-Gaudet, J. -. P., et al. MYTHO is a novel regulator of skeletal muscle autophagy and integrity. Nat Commun. 14 (1), 1199 (2023).
- Calderón, J. C., Bolaños, P., Caputo, C. Myosin heavy chain isoform composition and Ca2+ transients in fibres from enzymatically dissociated murine soleus and extensor digitorum longus muscles. J Physiol. 588 (1), 267-279 (2010).
- Calderón, J. C., Bolaños, P., Caputo, C. Kinetic changes in tetanic Ca2+ transients in enzymatically dissociated muscle fibres under repetitive stimulation. J Physiol. 589 (21), 5269-5283 (2011).
- Calderón, J. C., Bolaños, P., Caputo, C. Tetanic Ca2+ transient differences between slow- and fast-twitch mouse skeletal muscle fibres: a comprehensive experimental approach. J Muscle Res Cell Motil. 35 (5-6), 279-293 (2014).
- Li, R., et al. Development of a high-throughput method for real-time assessment of cellular metabolism in intact long skeletal muscle fibre bundles. J Physiol. 594 (24), 7197-7213 (2016).
- Chemello, F., et al. Microgenomic analysis in skeletal muscle: expression signatures of individual fast and slow myofibers. PloS One. 6 (2), 16807 (2011).
- Williams, D. A., Head, S. I., Bakker, A. J., Stephenson, D. G. Resting calcium concentrations in isolated skeletal muscle fibres of dystrophic mice. J Physiol. 428 (1), 243-256 (1990).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. J Vis Exp. (73), e50074 (2013).
- Brun, C. E., et al. GLI3 regulates muscle stem cell entry into G(Alert) and self-renewal. Nat Commun. 13 (1), 3961 (2022).
- Percie du Sert, N., et al. The ARRIVE guidelines 2.0: updated guidelines for reporting animal research. J Physiol. 598 (18), 3793-3801 (2020).
- Charles, J. P., Cappellari, O., Spence, A. J., Hutchinson, J. R., Wells, D. J. Musculoskeletal geometry, muscle architecture and functional specialisations of the mouse hindlimb. PLoS One. 11 (4), 0147669 (2016).
- Enríquez, V., Granados, S., Arias, M. P., Calderón, J. C. Muscle fiber types of gluteus medius in the Colombian creole horse. J Equine Vet Sci. 35 (6), 524-530 (2015).
- Sartorius, C. A., et al. Myosin heavy chains IIa and IId are functionally distinct in the mouse. J Cell Biol. 141 (4), 943-953 (1998).
- Talmadge, R. J., Roy, R. R. Electrophoretic separation of rat skeletal muscle myosin heavy-chain isoforms. J Appl Physiol. 75 (5), 2337-2340 (1993).
- Hämäläinen, N., Pette, D. Patterns of myosin isoforms in mammalian skeletal muscle fibres. Microsc Res Tech. 30 (5), 381-389 (1995).
- Bolaños, P., Calderón, J. C. Excitation-contraction coupling in mammalian skeletal muscle: Blending old and last-decade research. Front Physiol. 13, 989796 (2022).
- Gineste, C., et al. Enzymatically dissociated muscle fibers display rapid dedifferentiation and impaired mitochondrial calcium control. iScience. 25 (12), 105654 (2022).
- Calderón, J. C., Bolaños, P., Caputo, C. The excitation-contraction coupling mechanism in skeletal muscle. Biophys Rev. 6 (1), 133-160 (2014).
- Lainé, J., Skoglund, G., Fournier, E., Tabti, N. Development of the excitation-contraction coupling machinery and its relation to myofibrillogenesis in human iPSC-derived skeletal myocytes. Skelet Muscle. 8 (1), (2018).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nat Commun. 9 (1), 126 (2018).
- Cea, L. A., et al. The absence of dysferlin induces the expression of functional connexin-based hemichannels in human myotubes. BMC Cell Biology. 17 (15), 127-136 (2016).
- Nakada, T., et al. Physical interaction of junctophilin and the Ca(V)1.1 C terminus is crucial for skeletal muscle contraction. Proc Natl Acad Sci U S A. 115 (17), 4507-4512 (2018).
- Cully, T. R., Edwards, J. N., Murphy, R. M., Launikonis, B. S. A quantitative description of tubular system Ca2+ handling in fast- and slow-twitch muscle fibres. J Physiol. 594 (11), 2795-2810 (2016).
- Lim, J. -. Y., Frontera, W. R. Single skeletal muscle fiber mechanical properties: a muscle quality biomarker of human aging. Eur J Appl Physiol. 122 (6), 1383-1395 (2022).
- Gonzalez, E., Messi, M. L., Zheng, Z., Delbono, O. Insulin-like growth factor-1 prevents age-related decrease in specific force and intracellular Ca2+ in single intact muscle fibres from transgenic mice. J Physiol. 552, 833-844 (2003).
- Luedeke, J. D., McCall, R. D., Dillaman, R. M., Kinsey, S. T. Properties of slow- and fast-twitch skeletal muscle from mice with an inherited capacity for hypoxic exercise. Comp Biochem Physiol A Mol Integr Physiol. 138 (3), 373-382 (2004).
- Asmussen, G., Schmalbruch, I., Soukup, T., Pette, D. Contractile properties, fiber types, and myosin isoforms in fast and slow muscles of hyperactive Japanese waltzing mice. Exp Neurol. 184 (2), 758-766 (2003).
- Augusto, V., Padovani, C. R., Campos, G. E. R. Skeletal muscle fiber types in C57BL6J mice. Braz J Morphol Sci. 21 (2), 89-94 (2004).
- Wang, L. C., Kernell, D. Fibre type regionalisation in lower hindlimb muscles of rabbit, rat and mouse: a comparative study. J Anat. 199, 631-643 (2001).
- Abbassi-Daloii, T., et al. Quantitative analysis of myofiber type composition in human and mouse skeletal muscles. STAR Protoc. 4 (1), 102075 (2023).
- Tulloch, L. K., Perkins, J. D., Piercy, R. J. Multiple immunofluorescence labelling enables simultaneous identification of all mature fibre types in a single equine skeletal muscle cryosection. Equine Vet J. 43 (4), 500-503 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。