このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスの6つの後肢筋の酵素的解離によって得られた無傷の短、中、および長の骨格筋線維:指屈筋を超えて
要約
我々は、成体マウスの6つの筋肉から異なる長さとタイプの酵素的に解離した線維を得るためのプロトコルを記述する:そのうちの3つ(屈筋指筋ブレビス、長指伸筋、ヒラメ筋)と3つは初めて正常に解離した(長反母腓骨伸筋、長腓骨筋、指腓骨筋)。
要約
マウスの筋肉を酵素解離させて得られた骨格筋線維は、生理学的実験に有用なモデルです。しかし、ほとんどの論文は指屈筋(FDB)の短線維を扱っており、線維の種類を扱う結果の範囲を制限し、利用可能な生物学的物質の量を制限し、細胞の生理学的現象と他の筋肉で得られた以前の生化学的および力学的知識との明確なつながりを妨げています。
この論文では、繊維の種類と長さの異なる6つの筋肉から無傷の繊維を得る方法について説明します。C57BL/6成体マウスを用いて、筋肉解剖と線維分離のプロトコルを示し、Ca2+ 一過性研究とその形態特性評価に対する線維の適合性を実証しました。筋肉の繊維タイプの組成も提示されます。解離すると、すべての筋肉は無傷になり、24時間以上活発に収縮する生きた線維が形成され、FDBは短(<1mm)、指腓骨筋(PDQA)および長腓骨筋(PL)は中間(1-3mm)を与え、長指伸筋(EDL)、長母趾伸筋(EHL)、およびヒラメ筋は長い(3-6mm)線維を放出した。
高速色素Mag-Fluo-4で記録したところ、PDQA、PL、およびEHLファイバーのCa2+ トランジェントは、IIX型およびIIB型ファイバーに対応することが知られている形態タイプII(MT-II)を連想させる高速で狭い速度論を示しました。これは、これらの筋肉がFDB(~80%)やヒラメ筋(~65%)と比較して、II型線維の90%以上を持っているという事実と一致しています。FDBを超えて、1〜6mmの長さの範囲にわたる繊維をレンダリングするいくつかの筋肉の解離を初めて実証しました。これらの線維は生存可能であり、高速のCa2+ トランジェントを与え、MT-IIが筋肉源に関係なくIIXおよびIIB高速線維に一般化できることを示しています。これらの結果により、成熟した骨格筋研究のためのモデルの利用可能性が高まります。
概要
哺乳類の成熟した骨格筋は多機能組織です。それは代謝を高度に調節し、熱産生の主な源であり、その動的特性はそれに呼吸、体節の移動、またはある点から別の点への変位に重要な役割を果たします1,2,3。骨格筋は、ミオパチー、ジストロフィー、サルコペニアなどの遺伝性および慢性疾患、および心血管代謝性疾患などの多くの非筋肉慢性疾患を含む多くの疾患の病態生理にも関連しています3,4,5,6,7,8。
健康と病気の文脈における成熟した骨格筋の構造的および機能的特性のex vivo研究は、主に2つの実験モデル、つまり全筋肉と孤立した繊維によって可能になりました。20世紀には、研究者は、運動単位、繊維の種類、および収縮と弛緩の力と動力学などの動的特性について学ぶために、さまざまな小さな種の無傷の長指伸筋(EDL)、ヒラメ筋、前脛骨筋、および腓腹筋全体の特性を利用して、運動単位、繊維の種類、および収縮と弛緩の力と動力学などの動的特性について学びました9,10,11,12,13,14,15、16.しかし、より洗練された細胞生物学研究の出現により、この分野は単一の筋線維の研究へと移行しました。その後、先駆的な研究により、ラットの無傷の指屈筋(FDB)線維を酵素解離によって単離し、その後の特性評価に役立てることが可能になりました17,18,19。FDB繊維は、手作業による解剖20によっても得ることができるが、マウスの筋肉の酵素的解離の容易さと高スループットは、様々な実験的アプローチへの適合性に加えて、後者のモデルを過去20年間に広く使用してきた。
短いFDB繊維は、電気生理学的およびその他の生物物理学的研究、生化学的、代謝的、および薬理学的分析、電子および蛍光顕微鏡実験、細胞生物学アプローチのためのトランスフェクション、または筋形成研究における幹細胞の供給源として適しています5,21,22,23,24,25,26,27,28、29、30、31、32。しかし、筋肉実験でFDB線維のみを使用すると、線維の種類を扱う研究の範囲が狭くなり、一部の方法論的手法や1匹の動物からより多くの情報を得るために利用できる生物学的物質の量が制限されます。これらの制限は、細胞生理学的現象と、異なる全身の無傷の筋肉(EDL、ヒラメ筋、ペロネイなど)で行われた以前の生化学的および動的研究との明確な相関関係を妨げます。
これらの限界を克服し、いくつかのグループは、より長いEDLとヒラメ筋24,33,34,35,36,37,38,39,40を解離することに成功し、他の関連する筋肉にこの方法をさらに拡張するための扉を開きました。しかし、EDLとヒラメ筋繊維の使用はまだ少なく、おそらくそれらを無傷の繊維として得るための方法論的な詳細が不足しているためです。ここでは、6つの筋肉から長さと種類の異なる線維を分離する方法を詳細に説明します:すでに説明した3つの筋肉(FDB、EDL、およびヒラメ筋)と、初めて解離に成功した3つの筋肉(長母腓骨伸筋[EHL]、長腓骨筋[PL]、および指腓骨筋[PDQA])。本研究の結果は、酵素的に解離した線維のモデルが幅広い研究に適しており、以前に発表されたデータとの将来の相関関係があることを裏付けており、したがって、成熟した骨格筋研究のためのモデルの利用可能性を高めます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての手順は、コロンビア政府が発行した1989年の法律84および1993年の決議8430に従って、アンティオキア大学(UdeA)の動物実験倫理委員会(2016年6月21日の議事録104、および2021年4月15日の005)によって承認され、動物実験に準拠して実行および報告されました。 In Vivo Experiments (ARRIVE) ガイドラインの報告41.ここで紹介するすべての結果は、健康な7-13週齢、20-26g、C57BL/6雄マウスからのものです。図1は、この研究の一般的なデザインと手順の順序を示しています。すべての試薬、材料、および機器の詳細は、材料表に記載されています。
1.動物
- アクリル製の透明な長方形のケージにつき最大6匹のマウスを飼育し、木材由来の寝具を使用し、温度管理(21±〜2°C)と明暗(12:12時間)のサイクルで飼育します。
- 環境を豊かにすることなく、特定の病原体のない動物施設で動物に餌と水道水を自由に利用できるようにします。
2.解剖
- 溶液、材料、試薬
- 以下の組成(すべての濃度はmM)で作業溶液を調製し、ろ過します(0.22 μm)。
- チロード:5.4 KCl、1 MgCl2、140 NaCl、0.33 NaH2 PO4、2 CaCl2、10 グルコース、10 HEPES、pH 7.3
- 解離:2.7 KCl、1.2 KH2PO4、0.5 MgCl2、138 NaCl、0.1 Na2HPO4、1 CaCl2、pH 7.4
- リン酸緩衝生理食塩水(PBS):137 NaCl、8.6 Na2HPO4、2.8 KH2PO4、pH 7.34
- 2つの解剖室を準備します。実体鏡;はさみを操作する。細かいはさみ;細かい鉗子;清潔で透明、非円錐形、幅1〜1.5 cm、キャップ付きの総容量3〜4 mLのガラスバイアル。解剖室の筋肉を電気的に刺激するシステムを配置します。
- 5mm、4mm、3mm、2mm、1mmの異なる幅のファイヤーポリッシュされたパスツールガラスピペットを準備します。
- ウォーターバスを37°Cに設定します。 3 mgのコラゲナーゼタイプ2のアリコートを秤量します。
- 以下の組成(すべての濃度はmM)で作業溶液を調製し、ろ過します(0.22 μm)。
- プロシージャ
- 地元の倫理委員会によって承認された方法を使用してマウスを生け贄に捧げます。子宮頸部脱臼は、迅速でストレスが少なく、筋肉組織に影響を与える可能性のある薬物(CO2 や一部の麻酔薬など)への曝露を避けるため、推奨されます。より良い結果を得るために、すぐに解剖を開始してください。
- マウスを発泡スチロールの表面に置き、前肢をテープで固定または固定します。手術用ハサミで両後肢を膝の上で切断し、それぞれを別々の解剖室に移し、組織を覆うために冷たい(10〜20°C)チローデを追加します。
注:各後肢は、FDB、ヒラメ筋、EDL、EHL、PL、およびPDQAの順序で6つの異なる筋肉を提供します。腱から腱まで無傷の6つの筋肉を解剖するための詳細な解剖学的参考文献は、 図2 および他の場所42に示されている。 - 第1後肢を、脚の後面が見える位置で解剖室に固定します。拡大して皮膚を取り除きます。次に、FDBを露出させて取り外します(図2)。1 mLのチローデ溶液を入れたラベル付きガラスバイアル1本に保管してください。
注意: 筋肉組織の望ましくない切り傷を避けるために、適切な拡大と事前のトレーニングが必要です。 - ヒラメ筋を曝露し、取り出し、1 mLのTyrodeを含む別のバイアルに保管します。. 図2に示すように、細いハサミを使用して最初に腓腹筋を分離し、次にヒラメ筋を取り除きます。
- 脚の前面を露出させ、皮膚を取り除き、前脛骨筋の遠位腱と足首のEDL筋を特定します。脛骨筋を取り除き、廃棄します。次に、EDLの遠位腱を切断します(図2)。EDLが除去されるまで解剖を続け、1 mLのTyrodeが入った別のガラスバイアルに入れます。
- EDLのすぐ後方と内側にあるEHL筋を取り除きます。図2の対応するパネルに示されているように、腱を特定して1桁目までたどることから解剖を開始します。筋肉を1 mLのTyrodeが入った別のガラスバイアルに保管してください。
- 腿骨の最も外側の腱を特定してたどり、それを切断し、PL筋を取り除きます(図2)。筋肉を1 mLのTyrodeが入った別のガラスバイアルに入れます。
- 腱を特定して4桁目 までたどります。それを切断し、PDQA筋を取り除きます(図2)。1 mLのTyrodeが入った別のガラスバイアルに入れます。
- 2番目の後肢で手順を繰り返します。
- 同じタイプの両方の筋肉を、ラベル付きのガラスバイアルまたはチローデ溶液を入れた小さなペトリ皿に集めます。
注:作業セッション中に2対以上の筋肉を解剖する予定がある場合は、解剖手順のために2人の研究者を募集します。
3.筋線維分離プロトコル
- 解剖チャンバー内のチローデ溶液を更新して、破片やマウスの毛皮を取り除きます。FDB筋肉を1つの解剖チャンバーに注ぎ、その完全性を確認し、1 mLの解離溶液を入れた新しいガラスバイアルに移します。EHL、PL、PDQAの筋肉でこの手順を繰り返します。
注意: 筋肉が過収縮したり、切断されたり、電気刺激に反応しなくなったりする場合は、次のプロトコルステップに進まないでください。代わりに、溶液の品質(pH、汚染、浸透圧)を検証し、解剖スキルを高めることで、解剖プロトコルを最適化します(図1C および 補足ビデオS1)。 - 繊維の配向に従って、ヒラメ筋とEDL筋を縦方向または斜めに切断します(図2)。ヒラメ筋の場合は、中央の腱に沿って、その長さの~80%を切ります。EDLの場合は、1つまたは2つの腱をたどり、ヒラメ筋とほぼ同じ長さにカットします。筋肉の各ペアを、1 mLの解離溶液を入れたガラスバイアルに入れます。
注:この手順により、EDLとヒラメ筋が小さくなり、コラゲナーゼが組織に入りやすくなります。十分な倍率(40〜50倍)、および細かいハサミと鉗子が必須です。解離プロトコルの次のステップに進む前に、必ず目視検査と電気刺激によってサンプルの完全性を確認してください。 - 3 mgのコラゲナーゼ2型(活性250〜300 U / mg)を、1 mLの解離溶液と一対の筋肉を含む各バイアルに加えます。使用する酵素バッチの活性を考慮して、コラゲナーゼの正確な量を標準化します。
- 一対の筋肉をウォーターバス中で36.8〜37°Cで65〜90分間、穏やかに振とうしながらインキュベートします。
注意: 温度管理は厳重に行ってください。損傷を避けるために、筋肉がコラゲナーゼに100分以上とどまらないように手順を標準化します。 - インキュベーションの65分 後、5分ごとにステレオスコープ倍率でバイアルを確認します。.筋肉がわずかに波打ったり、不規則になったり、緩んだりしているように見える場合は、バイアルを静かに振って、一部の繊維が簡単に剥がれ始めるかどうかを確認します。その場合は、室温でチロデで筋肉を洗浄し、コラゲナーゼを不活性化して除去します。
注意: 洗浄は、ピペットで筋肉に触れないように慎重に行う必要があります。まず、0.8 mLのチローデを添加し、次に0.8 mLの溶液を除去します。この手順を4〜5回繰り返して、溶液が完全に透明になることを確認します。 - 火で磨かれたパスツールピペットのセットの助けを借りて、Tyrodeでの非常に穏やかなトリチュレーションで筋肉の大部分からより多くの繊維を分離します。最も幅の広いピペット(先端5mm)で筋肉の周りの溶液を攪拌することから始め、次に筋肉をピペットに3〜4回静かに引き上げます。筋肉が繊維を放出し始め、細くなったら、次のピペット(先端4mm)で手順を繰り返します。
注:この手順でレンダリングされた繊維は、 補足ビデオS2、補足ビデオS2、補足ビデオS3、および補足ビデオS4、 および 補足ビデオS5のPL、EDL、EHL、およびヒラメ筋繊維を使用して例示されているように、興奮性のままで、24時間以上活発に収縮します。
4. 実験手順
注:単離されたファイバーは、筋質Ca2+ 濃度の推定、形態測定、およびミオシン重鎖(MHC)発現の研究に使用されました。
- 筋質Caの測定2+ けいれん中の集中力
- 実験用の浴室に清潔なスライドガラスを取り付けます。スライドを2〜3μLのラミニンでコーティングし、30秒間乾燥させてから、~400μLの繊維懸濁液をスライドに注ぎます。繊維を室温で10〜15分間ラミニンに付着させます。
- 落射蛍光用の倒立顕微鏡のステージに実験チャンバーを取り付けます(図3A)。
- 実験チャンバーの両側に沿って配置された2つの白金電極に矩形電流パルス(0.8〜1.2 ms)を印加することにより、単一のけいれんを誘発してファイバーの生存率を確認します。ラミニンに付着した場合でも、繊維の収縮は主に極端に見られます。
- 3.5〜4.5μMの高速Ca2+ 色素Mag-Fluo-4、AMをチローデ溶液に4〜5分間ロードします。この後、Tyrodeでやさしく洗い、細胞外色素を取り除きます。細胞内色素を暗所で15~20分間脱エステル化します。染料の区画化を避けるために、常に温度を22°C未満に保ってください。
注:ジメチルスルホキシド(DMSO)中の Mag-Fluo-4, AM のストック液のみを調製し、ローディング チロード溶液中の DMSO の最終濃度が 0.5% 未満になるようにします。 - 白色発光ダイオード(LED)と、励起/ダイクロイック/発光用の波長450-490/510/515 nmのフィルターセットでファイバーを照らします(図3A)。
注:励起の代替源には、水銀およびキセノン蛍光ランプが含まれます。色素の光退色や細胞への損傷を避けるために、励起スポットの強度とサイズを可能な限り低くします。 - 20〜22°Cで実験チャンバーの両側に沿って配置された2つの白金電極に矩形電流パルス(0.8〜1.2 ms)を印加することにより、ファイバーのCa2+ 応答(筋形質Ca2+ 過渡現象)を誘発します。
- 蛍光に適したオイル浸漬40倍長距離対物レンズと、デジタイザーに接続された光電子増倍管(PMT)を使用して、光信号を収集して保存します(図3A および 補足ビデオS6)。0〜200の任意の単位(AU)のスケールをアクイジションソフトウェアで確保し、励起スポットのサイズとPMTのゲインを調節することにより、実験の静止蛍光(Frest) をそのスケールで10 AUに設定します。手順が標準化されたら、1つの実験から別の実験にゲインを変更せず、スポットサイズを少し調整するだけでスケールを設定します。
注:動きアーチファクトが発生した場合は、チローデ溶液に20〜30μMの N-ベンジル-p-トルエンスルホンアミド(BTS)を使用してください。 - 次のように信号を解析し、較正します。
- トレース全体を1kHzでローパス・フィルタします。
- トレースの1秒で Fレスト を計算し、 Fレスト を0に調整し、筋小細胞Ca2+ トランジェントの振幅(Fピーク)のピークを測定します。振幅を式 (1) のように表します。
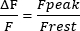 (1)
(1) - 式(2)26および以下のパラメータを用いて、ピークCa2+濃度([Ca2+]、μM)を計算する:in situ解離定数(Kd)= 1.65 × 105μM 2、最大蛍光(Fmax)150.9 AU、最小蛍光(Fmin)0.14 AU、Mag-Fluo-4濃度[D]T 229.1 μM26。Fピークはステップ4.1.8.2で既に得ている。
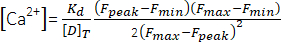 (2)
(2) - 振幅の10%から90%までの立ち上がり時間(RT、ms)、半値での持続時間(HW、ms)、振幅の90%から10%までの減衰時間(DT、ms)を測定します。次に、双指数関数 (式 3) の近似に従って減衰速度論を推定します。
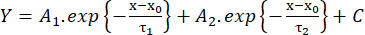 (3)
(3) - 減衰τ1とτ2(ms)と振幅A1とA2の時定数26の値を保存する。
- 形態測定
- 実験用の浴室に清潔なスライドガラスを取り付けます。スライドを2〜3μLのラミニンでコーティングし、30秒間乾燥させてから、~400μLの繊維懸濁液をスライドに注ぎます。繊維を室温で10〜15分間ラミニンに付着させます。
- 実験チャンバーの両側に沿って配置された2つの白金電極に矩形電流パルス(0.8〜1.2 ms)を印加することにより、単一のけいれんを誘発してファイバーの生存率を確認します。ラミニンに付着した場合でも、繊維の収縮は主に極端に見られます。
- 10倍および20倍の対物レンズと、倒立蛍光顕微鏡に取り付けられた少なくとも5メガピクセルのカメラを使用して、生きている繊維の画像を取得します。イメージを に保存します。オフライン解析用のTIFF形式。
注:長いファイバーを完全にキャプチャするには、2~6枚の画像が必要になる場合があります。 - 顕微鏡のマイクロメータ校正定規を同じ倍率で画像化します。イメージを に保存します。オフライン解析用のTIFF形式。
- 画像解析用のフリーソフトウェアのキャリブレーションツールを使用して、繊維の長さと直径を次のように測定します。
- 補足図S1に示すように、顕微鏡マイクロメータキャリブレーションルーラーを使用して、スケールの分析/設定ツールを使用して、ピクセルと画像内の既知の距離(μm)の関係を確立します。
- 補足図S1のように、繊維の一方の先端から他方の先端までの長さと、繊維に沿った2〜6の異なる場所で直径を測定します(長さに応じて、画像ごとに1〜2回の測定)。
- 繊維ごとに測定された長さ(μmまたはmm)とすべての直径の平均(μm)の値を報告します。
- ミオシン重鎖発現試験
注:全筋肉における免疫蛍光法43およびドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動(SDS-PAGE)33,44,45,46によるMHCの測定の詳細については、補足ファイル1を参照してください。FDB単離繊維の懸濁液中のMHCの免疫蛍光測定による繊維タイピングのプロトコルは次のとおりです。- 5枚の清潔なスライドガラスのそれぞれを2〜3μLのラミニンでコーティングし、30秒間乾燥させてから、~300μLの繊維懸濁液を各スライドに注ぎます。繊維を室温で4時間ラミニンに付着させます。
- 冷凍庫で冷却したアセトンで室温で30分間準備を固定します。
- PBSで3回やさしく洗います。
- 0.7% Triton X-100を添加したPBSで細胞膜を室温で15分間透過処理します。
- 0.2%ウシ血清アルブミン(BSA)と0.04%Triton X-100を添加したPBSで3回穏やかに洗浄し、続いて2%BSA、2%ヤギ血清、0.4%Triton X-100を含むPBSで室温で30分間ブロックします。
- 0.2% BSAおよび0.04% Triton X-100を添加したPBSで3回穏やかに洗浄し、以下のように一次抗体とインキュベートします。
- 各抗MHC一次抗体をPBSの別々のバイアルで1%BSAおよび0.04%Triton X-100で希釈します:抗I(1:1,500)、抗II(1:600)、抗IIA(ハイブリドーマからの馴化培地全体を使用)、および抗IIB(1:500)。
- 各スライドを1つの抗体とインキュベートし、残りのスライドをPBSとコントロールとして4°Cで12〜16時間インキュベートします。
注:このプロトコルでは、ファイバータイプIIXはすべてのサンプルで標識されていないままでした。
- PBSで3回穏やかに洗浄し、すべてのスライドを二次抗体(1:800)と蛍光緑色分子と結合させて室温で1〜2時間インキュベートします。
- 核を 1 μg/mL の Hoechst で 15 分間染色します。
- PBSで3回やさしく洗浄し、20〜40μLの封入剤を慎重に加え、カバーガラスを置きます。
注:穏やかな溶液交換と洗浄により、数十本の繊維がスライドに付着したままになり、実験が統計的に健全になります。 - 蛍光に適した10倍の対物レンズと、励起/ダイクロイック/発光の波長が450-490/510/515 nmのフィルターセットを使用して各スライドを可視化し、すべてのポジティブおよびネガティブファイバーをカウントします。あるいは、同じ技術条件と倒立蛍光顕微鏡に取り付けられた少なくとも5メガピクセルのカメラを使用して蛍光画像を取得し、それらを保存します。オフライン解析用のTIFF形式。
- 各スライドのポジティブおよびネガティブファイバーをデータベースに記録し、対応するスライドに存在するファイバーの総数に基づいて、ポジティブI、IIA、IIB、およびトータルIIファイバーの割合を計算します。IIXファイバーのパーセンテージは、IIA+IIBの合計を合計IIファイバーの割合から差し引いて計算します。100% の値から I+II の合計を差し引いて、ハイブリッド I/IIA ファイバーの割合を推定します。最後に、IとIIの合計からハイブリッドセルの割合を差し引いて、純粋なI型とII型の繊維を持ちます。
注:MHC組成研究では、ファイバータイプは大文字で示され、アイソフォームは小文字46で示されます。
- ヘマトキシリンおよびエオシン染色
- 清潔なスライドガラスを2〜3μLのラミニンでコーティングし、30秒間乾燥させてから、~300μLの繊維懸濁液をスライドに注ぎます。繊維を室温で4時間ラミニンに付着させます。
- 調製物をCarnoyの溶液(60%無水エタノール、30%クロロホルム、10%酢酸)で室温で5分間固定します。
- ヘマトキシリンと90秒間インキュベートします。
- 水道水で3回やさしく洗います。
- 70%エタノール中で調製した1%エオシンYと30秒間インキュベートします。
- 水道水で3回やさしく洗います。
- 無水エタノールに3倍浸します。
- キシロール中で60秒間インキュベートします。
- 20〜40μLの封入剤を加え、従来の顕微鏡で可視化します。少なくとも5メガピクセルのカラーカメラを使用して、目的の倍率で画像を取得します。
5. 統計分析とグラフ作成
注:実験ユニットは筋線維です。
- 結果を平均±標準偏差として表し、一部の分析では信頼区間95%(CI95%)を計算します。
- グループ間で長さ、直径、Ca2+ トランジェントの動力学を比較するには、分散分析(ANOVA)とボンフェローニの補正による事後検定を実行します。
- 正規性と分散の等価性を、それぞれShapiro-Wilk検定とLevene検定を使用して評価します。
- p が 0.05 の場合の有意な差<考えます。
Access restricted. Please log in or start a trial to view this content.
結果
けいれん中の筋質Ca2+ 濃度
解離した線維のセットにおける生理学的実験の実現可能性を実証し、励起収縮カップリング(ECC)と線維タイプに関する以前の知見を拡張するために、すべての筋肉の線維でCa2+トランジェントを取得しました。まず、FDB(n=5)およびEDL(n=7)は、形態タイプII(MT-II)として知られるCa2+速度論を示した。これらは高速でスパイク状の信号...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
成熟した骨格筋生物学の研究に利用できるモデルを補完するために、ここでは、短繊維、中線維、長線維を持つさまざまなマウスの筋肉の酵素解離の成功を実証します。これらの繊維は、骨格筋におけるCa2+ トランジェントのMT-II動態の一般化可能性の実証を可能にする。また、インタクト中の繊維の種類は、筋肉全体を分類した。FDBが生理学的実験に最も使用される筋肉であること?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、利益相反がないことを宣言します。
謝辞
著者らは、動物と写真の助けをしてくれたUdeAのRobinson Ramírez教授と、技術サポートをしてくれたCarolina Palaciosに感謝の意を表します。KaikaのJohan Pinedaは、カラーカメラと蛍光カメラのセットアップを手伝ってくれました。クイーンズランド大学のShyuan Ngoさんが原稿の校正をしてくれました。この研究は、CODI-UdeA(2021年2月22日から2020-34909、2022年3月31日から2021-40170、SIU)およびコロンビアのメデジンにあるPlanning Office-UdeA(E01708-KおよびES03180101)からJCCに資金提供されました。資金提供者は、データの収集と分析、原稿の執筆または提出には参加しませんでした。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Absolute ethanol | Sigma Aldrich | 32221 | |
| Acetone | Merck | 179124 | |
| Acrylamide | Gibco BRL | 15512-015 | |
| Ammonium persulfate | Panreac | 141138.1610 | |
| Anti myosin I antibody | Sigma Aldrich | M4276 | Primary antibody |
| Anti myosin II antibody | Sigma Aldrich | M8421 | Primary antibody |
| Anti myosin IIA antibody | American Type Culture Collection | SC-71 | Primary antibody. Derived from HB-277 hybridoma |
| Anti myosin IIB antibody | Developmental Studies Hybridoma Bank | BF-F3-c | Primary antibody |
| Bis-acrylamide | AMRESCO | 0172 | |
| Bovine serum albumin | Thermo Scientific | B14 | |
| Bradford reagent | Merck | 1.10306.0500 | |
| Bromophenol blue | Carlo Erba | 428658 | |
| Calcium carbonate | Merck | 102066 | |
| Calcium dichloride (CaCl2) | Merck | 2389 | |
| Chloroform | Sigma Aldrich | 319988 | |
| Collagenase type 2 | Worthington | CLS-2/LS004176 | |
| Consul-Mount | Thermo Scientific | 9990440 | |
| Coomassie Brilliant blue R 250 | Merck | 112553 | |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Dithiothreitol (DTT) | AMRESCO | 0281 | |
| Edetic acid (EDTA | AMRESCO | 0322 | |
| Eosin Y | Sigma Aldrich | E4009 | |
| Glycerol | Panreac | 1423291211 | |
| Glycine | Panreac | 151340.1067 | |
| Goat serum | Sigma Aldrich | G9023 | |
| Hematoxylin | Thermo Scientific | 6765015 | |
| HEPES | AMRESCO | 0511 | |
| Hoechst 33258 | Sigma Aldrich | 861405 | |
| Imidazole | AMRESCO | M136 | |
| Isopentane | Sigma Aldrich | M32631 | |
| Laminin | Sigma Aldrich | L2020 | |
| Mag-Fluo-4, AM | Invitrogen | M14206 | Prepared only in DMSO. Pluronic acid is not required and should not be used to avoid fiber deterioration. |
| Mercaptoethanol | Applichem | A11080100 | |
| Methanol | Protokimica | MP10043 | |
| Mice | Several | Several | For this manuscript, we only used C57BL/6 mice. However, some preliminary results have shown that the protocol works well for Swiss Webster mice of the same age and weight. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | |
| N,N,N',N'-tetramethylethane-1,2-diamine (TEMED) | Promega | V3161 | |
| N-benzyl-p-toluene sulphonamide (BTS) | Tocris | 1870 | |
| Optimal cutting compound (OCT) | Thermo Scientific | 6769006 | |
| Secondary antibody | Thermo Scientific | A-11001 | Goat anti-mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 |
| Sodium dodecil sulfate | Panreac | 1323631209 | |
| TRIS 0.5 M, pH 6.8 | AMRESCO | J832 | |
| Tris(Hydroxymethyl)aminomethane | AMRESCO | M151 | |
| Triton X-100 | AMRESCO | M143 | |
| Materials | |||
| Dissection chamber | Custom-made | ||
| Charged slides | Erie Scientific | 5951PLUS | |
| Experimental bath chamber | Warner Instruments | RC-27NE2 | Narrow Bath Chamber with Field Stimulation, ensembled on a heated platform PH-6 |
| Fine forceps | World Precision Instruments | 500338, 500230 | |
| Fine scissors | World Precision Instruments | Vannas Scissors 501778 | |
| Glass Pasteur pipettes | Several | Fire-polished tips | |
| Glass vials with cap | Several | 2-3 mL volumen | |
| Operating scissors | World Precision Instruments | 501223-G | |
| Equipment | |||
| Centrifuge | Thermo Scientific | SL 8R | |
| Confocal microscope | Olympus | FV1000 | |
| Cryostat | Leica | CM1850 | |
| Digital camera | Zeiss | Erc 5s and Axio 305 | Axio 305, coupled to the Stemi 508 stereoscope, was used to take pictures during dissection; while Erc 5s or Axio 208, coupled to the Axio Observer A1 microscope, were used to take images of the isolated fibers and the immunofluorescence assays |
| Digitizer | Molecular Devices | 1550A Digidata | |
| Electrophoresis chamber | Bio Rad | Mini-Protean IV | |
| Inverted microscope coupled to fluorescence | Zeiss | Axio Observer A1 | Coupled to an appropriate light source, filters and objectives for fluorescence |
| Photomultiplier | Horiba | R928 tube, Hamamatsu, in a D104 photometer, Horiba | Coupled to the lateral port of the fluorescence microscope |
| Stereoscope | Zeiss | Stemi 508 | |
| Stimulator | Grass Instruments | S6 | |
| Water bath | Memmert | WNE-22 | |
| Xilol | Sigma Aldrich | 808691 | |
| Software | |||
| Free software for electrophoreses analyses | University of Kentucky | GelBandFitter v1.7 | http://www.gelbandfitter.org |
| Free software for image analysis and morphometry | National Institutes of Health | ImageJ v1.54 | https://imagej.nih.gov/ij/index.html |
| Licensed software for Ca2+ signals acquisition and analyses | Molecular Devices | pCLAMP v10.05 | https://www.moleculardevices.com |
| Licensed software for statistical analyses and graphing | OriginLab | OriginPro 2019 | https://www.originlab.com/ |
参考文献
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int. 96 (3), 183-195 (2015).
- Barclay, C., Launikonis, B. Components of activation heat in skeletal muscle. J Muscle Res Cell Motil. 42 (1), 1-16 (2021).
- Gallo-Villegas, J. A., Calderón, J. C. Epidemiological, mechanistic, and practical bases for assessment of cardiorespiratory fitness and muscle status in adults in healthcare settings. Eur J Appl Physiol. 123 (5), 945-964 (2023).
- Cardamone, M., Darras, B. T., Ryan, M. M. Inherited myopathies and muscular dystrophies. Semin Neurol. 28 (2), 250-259 (2008).
- Sánchez-Aguilera, P., et al. Role of ABCA1 on membrane cholesterol content, insulin-dependent Akt phosphorylation and glucose uptake in adult skeletal muscle fibers from mice. Biochim Biophys Acta. 1863 (12), 1469-1477 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 48 (1), 16-31 (2019).
- Narvaez-Sanchez, R., Calderón, J. C., Vega, G., Trillos, M. C., Ospina, S. Skeletal muscle as a protagonist in the pregnancy metabolic syndrome. Med Hypotheses. 126, 26-37 (2019).
- Gallo-Villegas, J., et al. Efficacy of high-intensity interval- or continuous aerobic-training on insulin resistance and muscle function in adults with metabolic syndrome: a clinical trial. Eur J Appl Physiol. 122 (2), 331-344 (2022).
- Close, R. Properties of motor units in fast and slow skeletal muscles of the rat. J Physiol. 193 (1), 45-55 (1967).
- Barnard, R. J., Edgerton, V. R., Furukawa, T., Peter, J. B. Histochemical, biochemical, and contractile properties of red, white, and intermediate fibers. Am J Physiol. 220, 410-414 (1971).
- Bär, A., Pette, D. Three fast myosin heavy chains in adult rat skeletal muscle. FEBS letters. 235 (1-2), 153-155 (1988).
- Schiaffino, S., et al. Myosin heavy chain isoforms and velocity of shortening of type 2 skeletal muscle fibres. Acta Physiol Scand. 134 (4), 575-576 (1988).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. J Muscle Res Cell Motil. 10 (3), 197-205 (1989).
- Ranatunga, K., Thomas, P. Correlation between shortening velocity, force-velocity relation and histochemical fibre-type composition in rat muscles. J Muscle Res Cell Motil. 11 (3), 240-250 (1990).
- Hämäläinen, N., Pette, D. The histochemical profiles of fast fiber types IIB, IID, and IIA in skeletal muscles of mouse, rat, and rabbit. J Histochem Cytochem. 41 (5), 733-743 (1993).
- Agbulut, O., Li, Z., Mouly, V., Butler-Browne, G. S. Analysis of skeletal and cardiac muscle from desmin knock-out and normal mice by high resolution separation of myosin heavy-chain isoforms. Biol Cell. 88 (3), 131-135 (1996).
- Bekoff, A., Betz, W. Properties of isolated adult rat muscle fibres maintained in tissue culture. J Physiol. 271 (2), 537-547 (1977).
- Bekoff, A., Betz, W. Physiological properties of dissociated muscle fibres obtained from innervated and denervated adult rat muscle. J Physiol. 271 (1), 25-40 (1977).
- Schuetze, S. M. The acetylcholine channel open time in chick muscle is not decreased following innervation. J Physiol. 303, 111-124 (1980).
- Youhanna, S., Bruton, J., Jardemark, K., Westerblad, H., Lauschke, V. M. Calcium measurements in enzymatically dissociated or mechanically microdissected mouse primary skeletal muscle fibers. STAR Protoc. 4 (2), 102260(2023).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem Cell Biol. 83 (5), 674-676 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single muscle-fiber isolation and culture for cellular, molecular, pharmacological, and evolutionary studies. Methods Mol Biol. 798, 85-102 (2012).
- Bolaños, P., Guillen, A., Gámez, A., Caputo, C. Quantifying SOCE fluorescence measurements in mammalian muscle fibres. The effects of ryanodine and osmotic shocks. J Muscle Res Cell Motil. 34 (5-6), 379-393 (2013).
- Lopez, R., et al. Raptor ablation in skeletal muscle decreases Cav1.1 expression and affects the function of the excitation-contraction coupling supramolecular complex. Biochem J. 466 (1), 123-135 (2015).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skelet Muscle. 8 (1), 14(2018).
- Milán, A. F., et al. Calibration of mammalian skeletal muscle Ca2+ transients recorded with the fast Ca2+ dye Mag-Fluo-4. Biochim Biophys Acta. 1865 (9), 129939(2021).
- Park, K. H., et al. Assessment of calcium sparks in intact skeletal muscle fibers. J Vis Exp. (84), e50898(2014).
- Wei-LaPierre, L., Groom, L., Dirksen, R. T. Acute exposure to extracellular BTP2 does not inhibit Ca2+ release during EC coupling in intact skeletal muscle fibers. J Gen Physiol. 154 (9), 202112976(2022).
- Banks, Q., et al. Voltage sensor movements of Ca(V)1.1 during an action potential in skeletal muscle fibers. Proc Natl Acad Sci U S A. 118 (40), 2026116118(2021).
- Jaque-Fernandez, F., et al. Preserved Ca2+ handling and excitation-contraction coupling in muscle fibres from diet-induced obese mice. Diabetologia. 63 (11), 2471-2481 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--a more mature muscle culture system. Cell Motil Cytoskeleton. 64 (10), 727-738 (2007).
- Leduc-Gaudet, J. -P., et al. MYTHO is a novel regulator of skeletal muscle autophagy and integrity. Nat Commun. 14 (1), 1199(2023).
- Calderón, J. C., Bolaños, P., Caputo, C. Myosin heavy chain isoform composition and Ca2+ transients in fibres from enzymatically dissociated murine soleus and extensor digitorum longus muscles. J Physiol. 588 (1), 267-279 (2010).
- Calderón, J. C., Bolaños, P., Caputo, C. Kinetic changes in tetanic Ca2+ transients in enzymatically dissociated muscle fibres under repetitive stimulation. J Physiol. 589 (21), 5269-5283 (2011).
- Calderón, J. C., Bolaños, P., Caputo, C. Tetanic Ca2+ transient differences between slow- and fast-twitch mouse skeletal muscle fibres: a comprehensive experimental approach. J Muscle Res Cell Motil. 35 (5-6), 279-293 (2014).
- Li, R., et al. Development of a high-throughput method for real-time assessment of cellular metabolism in intact long skeletal muscle fibre bundles. J Physiol. 594 (24), 7197-7213 (2016).
- Chemello, F., et al. Microgenomic analysis in skeletal muscle: expression signatures of individual fast and slow myofibers. PloS One. 6 (2), 16807(2011).
- Williams, D. A., Head, S. I., Bakker, A. J., Stephenson, D. G. Resting calcium concentrations in isolated skeletal muscle fibres of dystrophic mice. J Physiol. 428 (1), 243-256 (1990).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. J Vis Exp. (73), e50074(2013).
- Brun, C. E., et al. GLI3 regulates muscle stem cell entry into G(Alert) and self-renewal. Nat Commun. 13 (1), 3961(2022).
- Percie du Sert, N., et al. The ARRIVE guidelines 2.0: updated guidelines for reporting animal research. J Physiol. 598 (18), 3793-3801 (2020).
- Charles, J. P., Cappellari, O., Spence, A. J., Hutchinson, J. R., Wells, D. J. Musculoskeletal geometry, muscle architecture and functional specialisations of the mouse hindlimb. PLoS One. 11 (4), 0147669(2016).
- Enríquez, V., Granados, S., Arias, M. P., Calderón, J. C. Muscle fiber types of gluteus medius in the Colombian creole horse. J Equine Vet Sci. 35 (6), 524-530 (2015).
- Sartorius, C. A., et al. Myosin heavy chains IIa and IId are functionally distinct in the mouse. J Cell Biol. 141 (4), 943-953 (1998).
- Talmadge, R. J., Roy, R. R. Electrophoretic separation of rat skeletal muscle myosin heavy-chain isoforms. J Appl Physiol. 75 (5), 2337-2340 (1993).
- Hämäläinen, N., Pette, D. Patterns of myosin isoforms in mammalian skeletal muscle fibres. Microsc Res Tech. 30 (5), 381-389 (1995).
- Bolaños, P., Calderón, J. C. Excitation-contraction coupling in mammalian skeletal muscle: Blending old and last-decade research. Front Physiol. 13, 989796(2022).
- Gineste, C., et al. Enzymatically dissociated muscle fibers display rapid dedifferentiation and impaired mitochondrial calcium control. iScience. 25 (12), 105654(2022).
- Calderón, J. C., Bolaños, P., Caputo, C. The excitation-contraction coupling mechanism in skeletal muscle. Biophys Rev. 6 (1), 133-160 (2014).
- Lainé, J., Skoglund, G., Fournier, E., Tabti, N. Development of the excitation-contraction coupling machinery and its relation to myofibrillogenesis in human iPSC-derived skeletal myocytes. Skelet Muscle. 8 (1), (2018).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nat Commun. 9 (1), 126(2018).
- Cea, L. A., et al. The absence of dysferlin induces the expression of functional connexin-based hemichannels in human myotubes. BMC Cell Biology. 17 (15), 127-136 (2016).
- Nakada, T., et al. Physical interaction of junctophilin and the Ca(V)1.1 C terminus is crucial for skeletal muscle contraction. Proc Natl Acad Sci U S A. 115 (17), 4507-4512 (2018).
- Cully, T. R., Edwards, J. N., Murphy, R. M., Launikonis, B. S. A quantitative description of tubular system Ca2+ handling in fast- and slow-twitch muscle fibres. J Physiol. 594 (11), 2795-2810 (2016).
- Lim, J. -Y., Frontera, W. R. Single skeletal muscle fiber mechanical properties: a muscle quality biomarker of human aging. Eur J Appl Physiol. 122 (6), 1383-1395 (2022).
- Gonzalez, E., Messi, M. L., Zheng, Z., Delbono, O. Insulin-like growth factor-1 prevents age-related decrease in specific force and intracellular Ca2+ in single intact muscle fibres from transgenic mice. J Physiol. 552, 833-844 (2003).
- Luedeke, J. D., McCall, R. D., Dillaman, R. M., Kinsey, S. T. Properties of slow- and fast-twitch skeletal muscle from mice with an inherited capacity for hypoxic exercise. Comp Biochem Physiol A Mol Integr Physiol. 138 (3), 373-382 (2004).
- Asmussen, G., Schmalbruch, I., Soukup, T., Pette, D. Contractile properties, fiber types, and myosin isoforms in fast and slow muscles of hyperactive Japanese waltzing mice. Exp Neurol. 184 (2), 758-766 (2003).
- Augusto, V., Padovani, C. R., Campos, G. E. R. Skeletal muscle fiber types in C57BL6J mice. Braz J Morphol Sci. 21 (2), 89-94 (2004).
- Wang, L. C., Kernell, D. Fibre type regionalisation in lower hindlimb muscles of rabbit, rat and mouse: a comparative study. J Anat. 199, 631-643 (2001).
- Abbassi-Daloii, T., et al. Quantitative analysis of myofiber type composition in human and mouse skeletal muscles. STAR Protoc. 4 (1), 102075(2023).
- Tulloch, L. K., Perkins, J. D., Piercy, R. J. Multiple immunofluorescence labelling enables simultaneous identification of all mature fibre types in a single equine skeletal muscle cryosection. Equine Vet J. 43 (4), 500-503 (2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved