É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fibras musculares esqueléticas curtas, intermediárias e longas intactas obtidas por dissociação enzimática de seis músculos dos membros posteriores de camundongos: além do flexor curto dos dedos
Neste Artigo
Resumo
Descrevemos um protocolo para obtenção de fibras enzimaticamente dissociadas de diferentes comprimentos e tipos de seis músculos de camundongos adultos: três deles já descritos (flexor curto dos dedos, extensor longo dos dedos, sóleo) e três deles dissociados com sucesso pela primeira vez (extensor longo do hálux, fibular longo, fibular dos dígitos).
Resumo
Fibras musculares esqueléticas obtidas por dissociação enzimática de músculos de camundongos são um modelo útil para experimentos fisiológicos. No entanto, a maioria dos trabalhos trata das fibras curtas do flexor curto dos dedos (FDB), o que restringe o escopo de resultados que tratam dos tipos de fibras, limita a quantidade de material biológico disponível e impede uma clara conexão entre fenômenos fisiológicos celulares e conhecimentos bioquímicos e dinâmicos prévios obtidos em outros músculos.
Este trabalho descreve como obter fibras intactas de seis músculos com diferentes perfis e comprimentos de tipos de fibras. Usando camundongos adultos C57BL/6, mostramos o protocolo de dissecção muscular e isolamento de fibras e demonstramos a adequação das fibras para estudos transitórios de Ca2+ e sua caracterização morfométrica. A composição do tipo de fibras dos músculos também é apresentada. Quando dissociados, todos os músculos ficaram intactos, fibras vivas que se contraem rapidamente por mais de 24 h. FDB deu curto (<1 mm), fibular dos dedos (PDQA) e fibular longo (PL) deu intermediário (1-3 mm), enquanto extensor longo dos dedos (EDL), extensor longo do hálux (EHL) e músculos sóleo liberaram fibras longas (3-6 mm).
Quando registrados com o corante rápido Mag-Fluo-4, os transientes de Ca2+ das fibras PDQA, PL e EHL mostraram a cinética rápida e estreita que lembra a morfologia tipo II (MT-II), conhecida por corresponder às fibras tipo IIX e IIB. Isso é consistente com o fato de que esses músculos têm mais de 90% de fibras do tipo II em comparação com FDB (~80%) e sóleo (~65%). Indo além do FDB, demonstramos pela primeira vez a dissociação de vários músculos, que tornam fibras que abrangem uma faixa de comprimentos entre 1 e 6 mm. Essas fibras são viáveis e dão rápidos transientes de Ca2+ , indicando que a MT-II pode ser generalizada para fibras rápidas IIX e IIB, independentemente de sua fonte muscular. Esses resultados aumentam a disponibilidade de modelos para estudos do músculo esquelético maduro.
Introdução
O músculo esquelético maduro de mamíferos é um tecido multifuncional. Regula fortemente o metabolismo, é a principal fonte de produção de calor e suas propriedades dinâmicas lhe conferem papel fundamental na respiração, movimentação de segmentos corporais ou deslocamento de um ponto a outro 1,2,3. O músculo esquelético também é relevante para a fisiopatologia de muitas doenças, incluindo condições hereditárias e crônicas, como miopatias, distrofias ou sarcopenia, bem como muitas condições crônicas não musculares, como doenças cardiometabólicas 3,4,5,6,7,8.
O estudo ex vivo das propriedades estruturais e funcionais do músculo esquelético maduro no contexto da saúde e da doença tem sido possível principalmente através de dois modelos experimentais: músculo inteiro e fibras isoladas. Noséculo 20, pesquisadores exploraram as propriedades dos músculos extensor longo dos dedos (EDL), sóleo, tibial anterior e gastrocnêmio de diferentes espécies pequenas como modelos fundamentais para aprender sobre unidades motoras, tipos de fibras e propriedades dinâmicas, como força e cinética de contração e relaxamento 9,10,11,12,13,14,15,16. No entanto, o advento de estudos mais refinados de biologia celular direcionou a área para o estudo das fibras musculares únicas. Trabalhos pioneiros possibilitaram, então, o isolamento de fibras flexoras curtas dos dedos intactas (FDB) de ratos por dissociação enzimática para posterior caracterização17,18,19. Embora as fibras FDB também possam ser obtidas por dissecção manual20, a facilidade e o alto rendimento de dissociação enzimática dos músculos murinos, além de sua adequação a uma variedade de abordagens experimentais, tornaram este último modelo amplamente utilizado nas últimas duas décadas.
As fibras curtas de FDB são adequadas para estudos eletrofisiológicos e outros estudos biofísicos, análises bioquímicas, metabólicas e farmacológicas, experimentos de microscopia eletrônica e de fluorescência, transfecção para abordagens de biologia celular, ou como fonte de células-tronco em estudos de miogênese 5,21,22,23,24,25,26,27,28, 29,30,31,32. No entanto, o uso apenas de fibras FDB em experimentos musculares estreita o escopo de pesquisas que lidam com tipos de fibras e limita a quantidade de material biológico disponível para algumas técnicas metodológicas ou para obter mais informações de um animal. Essas limitações impedem uma clara correlação dos fenômenos fisiológicos celulares com estudos bioquímicos e dinâmicos prévios realizados em diferentes músculos inteiros e intactos (por exemplo, EDL, sóleo, fibular).
Superando essas limitações, alguns grupos conseguiram dissociar os músculos EDL e sóleo mais longos 24,33,34,35,36,37,38,39,40, abrindo a porta para estender ainda mais o método para outros músculos relevantes. No entanto, o uso de EDL e fibras sóleos ainda é escasso, provavelmente devido à falta de detalhes metodológicos para obtê-las como fibras intactas. Aqui, descrevemos detalhadamente como isolar fibras de diferentes comprimentos e tipos de seis músculos: três deles já descritos (FDB, EDL e sóleo) e três deles dissociados com sucesso pela primeira vez (extensor longo do hálux [EHL], fibular longo [PL] e fibular dos dedos [PDQA]). Os resultados do presente trabalho confirmam que o modelo de fibras enzimaticamente dissociadas é adequado para uma ampla gama de estudos e futuras correlações com dados previamente publicados, aumentando assim a disponibilidade de modelos para estudos de músculo esquelético maduro.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos foram aprovados pelo Comitê de Ética em Experimentos com animais da Universidade de Antioquia (UdeA) (atas 104 de 21 de junho de 2016 e 005 de 15 de abril de 2021), de acordo com a Lei 84 de 1989 e a Resolução 8430 de 1993 emitida pelo Governo Colombiano e foram realizados e relatados em conformidade com a Pesquisa Animal: Diretrizes de relatórios de experimentos in vivo (ARRIVE)41. Todos os resultados aqui apresentados provêm de camundongos machos saudáveis, com 7-13 semanas de idade, 20-26 g, C57BL/6. A Figura 1 mostra o desenho geral deste estudo e a ordem dos procedimentos. Todos os reagentes, materiais e detalhes do equipamento estão listados na Tabela de Materiais.
1. Animais
- Abrigar um máximo de seis ratos por gaiola acrílica, transparente, retangular, com cama derivada de madeira, em condições controladas de temperatura (21 ± 2 °C) e ciclos luz:escuridão (12:12 h).
- Dar aos animais livre acesso a alimentos e água da torneira em instalações específicas livres de patógenos sem enriquecimento ambiental.
2. Dissecção
- Soluções, materiais e reagentes
- Preparar e filtrar (0,22 μm) as soluções de trabalho com a seguinte composição (todas as concentrações em mM):
- Tyrode: 5,4 KCl, 1 MgCl2, 140 NaCl, 0,33 NaH2PO4, 2 CaCl2, 10 glicose, 10 HEPES, pH 7,3
- Dissociação: 2,7 KCl, 1,2 KH2PO4, 0,5 MgCl2, 138 NaCl, 0,1 Na2HPO4, 1 CaCl2, pH 7,4
- Solução salina tamponada com fosfato (PBS): 137 NaCl, 8,6 Na2HPO4, 2,8 KH2PO4, pH 7,34
- Preparar duas câmaras de dissecção; estereoscópio; tesoura de operação; tesoura fina; pinça fina; e frascos de vidro limpos, transparentes, não cônicos, com 1-1,5 cm de largura, de 3-4 mL de volume total com tampas. Dispor um sistema para estimular eletricamente os músculos nas câmaras de dissecção.
- Prepare pipetas de vidro Pasteur polidas a fogo de diferentes pontas de largura: 5, 4, 3, 2 e 1 mm.
- Ajuste o banho-maria a 37 °C. Pesar alíquotas de 3 mg de colagenase tipo 2.
- Preparar e filtrar (0,22 μm) as soluções de trabalho com a seguinte composição (todas as concentrações em mM):
- Procedimento
- Sacrifique o rato usando métodos aprovados pelo Comitê de Ética local. A luxação cervical é recomendada por ser rápida, menos estressante e evitar a exposição a medicamentos, que podem afetar o tecido muscular (como CO2 ou alguns anestésicos). Iniciar a dissecção imediatamente para obter melhores resultados.
- Coloque o mouse sobre uma superfície de espuma e tape ou fixe os membros anteriores. Corte ambos os membros posteriores sobre os joelhos com a tesoura de operação, transfira cada um deles para uma câmara de dissecção separada e adicione Tyrode frio (10-20 °C) para cobrir o tecido.
NOTA: Cada membro posterior dará seis músculos diferentes na seguinte ordem: FDB, sóleo, EDL, EHL, PL e PDQA. Referências anatômicas detalhadas para dissecar os seis músculos íntegros de tendão a tendão são dadas na Figura 2 e em outros artigos42. - Fixar o primeiro membro posterior à câmara de dissecção em uma posição em que a face posterior das pernas seja visível. Remover a pele sob aumento; em seguida, expor e remover o FDB (Figura 2). Conservar num frasco para injetáveis de vidro rotulado com 1 ml de solução de Tyrode.
NOTA: Ampliação adequada e treinamento prévio são necessários para evitar qualquer corte indesejado no tecido muscular. - Expor, remover e armazenar o sóleo num frasco para injetáveis separado com 1 ml de Tyrode. Use uma tesoura fina para separar primeiro o gastrocnêmio e depois remover o sóleo, como indicado na Figura 2.
- Expor a face anterior da perna, remover a pele e identificar os tendões distais do tibial anterior e os músculos EDL no tornozelo. Retirar e descartar a tíbia; em seguida, cortar os tendões distais do EDL (Figura 2). Continue a dissecção até remover o EDL e coloque-o num frasco para injetáveis de vidro separado com 1 ml de Tyrode.
- Remova o músculo EHL, que fica logo posterior e medial ao EDL. Iniciar dissecção identificando e acompanhando o tendão até o1º dígito, conforme indicado no painel correspondente da Figura 2. Mantenha o músculo num frasco para injetáveis de vidro separado com 1 ml de Tyrode.
- Identificar e acompanhar o tendão mais externo do fibular para cortá-lo e remover o músculo PL (Figura 2). Coloque o músculo num frasco para injetáveis de vidro separado com 1 ml de Tyrode.
- Identificar e acompanhar o tendão até o4º dígito; cortá-lo e retirar o músculo PDQA (Figura 2). Colocá-lo num frasco para injetáveis de vidro separado com 1 ml de Tyrode.
- Repita o procedimento com o segundo membro pélvico.
- Reúna ambos os músculos do mesmo tipo num frasco para injetáveis de vidro rotulado ou numa pequena placa de Petri com solução de Tyrode.
NOTA: Se mais de dois pares de músculos forem planejados para serem dissecados durante uma sessão de trabalho, recrute dois pesquisadores para o procedimento de dissecção.
3. Protocolo de isolamento das fibras musculares
- Renove a solução de Tyrode nas câmaras de dissecção para remover detritos e pelos de rato. Despeje os músculos FDB em uma câmara de dissecção, verifique sua integridade e transfira-os para um novo frasco de vidro com 1 mL de solução de dissociação. Repita esse procedimento com os músculos EHL, PL e PDQA.
NOTA: Se um músculo parecer hipercontraído, cortado ou não responder à estimulação elétrica, não continue para a próxima etapa do protocolo. Em vez disso, otimize o protocolo de dissecção, verificando a qualidade das soluções (pH, contaminação, osmolaridade) e ganhando mais habilidades de dissecção (Figura 1C e Vídeo Suplementar S1). - Realizar cortes longitudinais ou diagonais nos músculos sóleo e EDL, seguindo a orientação das fibras (Figura 2). Para o sóleo, siga o tendão central, cortando ~80% de seu comprimento. Para EDL, basta seguir um ou dois tendões e cortar aproximadamente o mesmo comprimento que para o sóleo. Coloque cada par de músculos em frascos para injetáveis de vidro com 1 ml de solução de dissociação.
OBS: Este procedimento torna o EDL e o sóleo menores e permite que a colagenase entre melhor no tecido. Ampliação suficiente (40-50x), bem como tesouras finas e pinças, são obrigatórias. Sempre verifique a integridade da amostra por inspeção visual e estimulação elétrica antes de prosseguir para a próxima etapa do protocolo de dissociação. - Adicionar 3 mg de colagenase tipo 2 (com uma atividade de 250-300 U/mg) a cada frasco para injetáveis contendo 1 ml de solução de dissociação e um par de músculos. Padronizar a quantidade exata de colagenase considerando a atividade do lote enzimático utilizado.
- Incubar os pares de músculos em banho-maria por 65-90 min a 36,8-37 °C, com agitação suave.
OBS: Seja rigoroso com o controle de temperatura. Padronize o procedimento para que os músculos não permaneçam na colagenase por mais de 100 min para evitar danos. - Verifique os frascos para injetáveis sob ampliação do estereoscópio a cada 5 min após o65º min de incubação. Quando os músculos parecerem ligeiramente ondulados, esfarrapados e soltos, agite suavemente o frasco para injetáveis e verifique se algumas fibras começam a se desprender prontamente. Se este for o caso, lave os músculos com Tyrode à temperatura ambiente para inativar e remover a colagenase.
OBS: A lavagem deve ser feita com cuidado, sem tocar os músculos com as pipetas. Comece por adicionar 0,8 ml de Tyrode e, em seguida, remova 0,8 ml da solução. Repita esse procedimento de 4 a 5 vezes e verifique se a solução se torna totalmente transparente. - Separe mais fibras da maior parte dos músculos com trituração muito suave em Tyrode com a ajuda do conjunto de pipetas Pasteur polidas a fogo. Comece agitando a solução ao redor do músculo com a pipeta mais larga (ponta de 5 mm) e, em seguida, puxe suavemente os músculos para dentro e para fora da pipeta 3-4x. Quando o músculo começar a liberar fibras e ficar mais fino, repita o procedimento com a próxima pipeta (ponta de 4 mm).
NOTA: As fibras renderizadas por meio deste procedimento permanecem excitáveis e se contraem rapidamente por mais de 24 h, como exemplificado usando fibras PL, EDL, EHL e sóleo em Vídeo Suplementar S2, Vídeo Suplementar S3, Vídeo Suplementar S4 e Vídeo Suplementar S5.
4. Procedimentos experimentais
NOTA: Fibras isoladas foram usadas para estimativas da concentração de Ca2+ sarcoplasmático, medidas morfométricas e estudos de expressão da cadeia pesada de miosina (MHC).
- Dosagem do Ca sarcoplasmático2+ concentração durante uma contração
- Monte uma lâmina de vidro limpa na câmara de banho experimental. Cubra a lâmina com 2-3 μL de laminina e deixe secar por 30 s antes de despejar ~400 μL da suspensão de fibra sobre a lâmina. Deixe as fibras aderirem à laminina por 10-15 min à temperatura ambiente.
- Monte a câmara experimental no palco de um microscópio invertido equipado para epifluorescência (Figura 3A).
- Evocar contrações simples para verificar a viabilidade das fibras aplicando pulsos de corrente retangular (0,8-1,2 ms) através dos dois eletrodos de platina colocados ao longo de cada lado da câmara experimental. Mesmo quando aderida à laminina, a contração das fibras ainda é visível principalmente nos extremos.
- Carregar as fibras com 3,5-4,5 μM do corante rápido Ca2+ Mag-Fluo-4, AM por 4-5 min em solução de Tyrode. Após este tempo, lave suavemente com Tyrode para remover o corante extracelular. Deixe o corante intracelular ser desesterificado por ~15-20 min em condições escuras. Mantenha sempre a temperatura abaixo de 22 °C para evitar a compartimentação do corante.
NOTA: Preparar um estoque de Mag-Fluo-4, AM apenas em dimetilsulfóxido (DMSO), de modo que a concentração final de DMSO na solução de Tyrode de carga seja inferior a 0,5%. - Iluminar a fibra com um diodo emissor de luz branca (LED) e um conjunto de filtros com os seguintes comprimentos de onda para excitação/dicroico/emissão: 450-490/510/515 nm (Figura 3A).
NOTA: Fontes alternativas de excitação incluem lâmpadas de fluorescência de mercúrio e xenônio. Use a menor intensidade e tamanho possível do ponto de excitação para evitar o fotobranqueamento do corante e danos à célula. - Evocar a resposta de Ca2+ da fibra (transientes sarcoplasmáticos de Ca2+ ) aplicando pulsos de corrente retangular (0,8-1,2 ms) através dos dois eletrodos de platina colocados ao longo de cada lado da câmara experimental a 20-22 °C.
- Colete e salve os sinais luminosos com uma objetiva de longa distância de imersão em óleo de 40x adequada para fluorescência e um tubo fotomultiplicador (PMT) conectado a um digitalizador (Figura 3A e Vídeo Suplementar S6). Garantir uma escala no software de aquisição de 0-200 unidades arbitrárias (UA) e definir a fluorescência de repouso (Frest) do experimento para 10 UA nessa escala, modulando o tamanho do ponto de excitação e o ganho do PMT. Uma vez padronizado o procedimento, mantenha o ganho inalterado de um experimento para o outro e defina a escala apenas através de pequenos ajustes no tamanho do ponto.
NOTA: Se surgirem artefactos de movimento, utilize 20-30 μM de N-benzil-p-tolueno sulfonamida (BTS) na solução de Tyrode. - Analise e calibre os sinais da seguinte forma:
- Filtro passa-baixa todo o traço em 1 kHz.
- Calcular o repouso F em 1 s do traço, ajustar o repouso F para 0 e medir a amplitude dos transientes Ca2+ do pico sarcoplasmático (pico F). Apresente a amplitude como na equação (1):
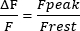 (1º)
(1º) - Calcular o pico de concentração de Ca2+ ([Ca2+], μM) usando a equação (2)26 e os seguintes parâmetros: constante de dissociação in situ (Kd) = 1,65 × 105 μM2, fluorescência máxima (Fmax) de 150,9 UA, fluorescência mínima (Fmin) de 0,14 UA, concentração de Mag-Fluo-4 [D]T de 229,1 μM26. Opico F já foi obtido na etapa 4.1.8.2.
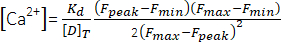 (2º)
(2º) - Meça o tempo de ascensão de 10% a 90% da amplitude (TR, ms), a duração na metade máxima (HW, ms) e o tempo de decaimento de 90% a 10% da amplitude (DT, ms). Em seguida, estime a cinética de decaimento de acordo com um ajuste com a função biexponencial (equação 3):
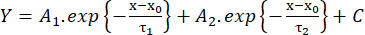 (3º)
(3º) - Salve os valores das constantes de tempo de decaimento τ1 e τ2 (ms) e amplitudes A1 e A226.
- Medidas morfométricas
- Monte uma lâmina de vidro limpa na câmara de banho experimental. Cubra a lâmina com 2-3 μL de laminina e deixe secar por 30 s antes de despejar ~400 μL da suspensão de fibra sobre a lâmina. Deixe as fibras aderirem à laminina por 10-15 min à temperatura ambiente.
- Evocar contrações simples para verificar a viabilidade das fibras aplicando pulsos de corrente retangular (0,8-1,2 ms) através dos dois eletrodos de platina colocados ao longo de cada lado da câmara experimental. Mesmo quando aderida à laminina, a contração das fibras ainda é visível principalmente nos extremos.
- Adquira imagens das fibras vivas usando objetivas de 10x e 20x e uma câmera de pelo menos 5 megapixels montada em um microscópio de fluorescência invertido. Armazene as imagens em . Formato TIFF para análises offline.
NOTA: Um conjunto de ~2-6 imagens pode ser necessário para capturar completamente uma fibra longa. - Imagem de uma régua de calibração micrométrica do microscópio sob a mesma ampliação. Armazene as imagens em . Formato TIFF para análises offline.
- Meça os comprimentos e diâmetros das fibras utilizando a ferramenta de calibração do software livre para análise de imagens da seguinte forma:
- Estabeleça uma relação entre os pixels e a distância conhecida (μm) nas imagens com a ajuda da régua de calibração do micrômetro do microscópio usando a ferramenta Analyze/Set scale como mostrado na Figura Suplementar S1.
- Meça comprimentos uma vez de uma ponta para a outra da fibra e diâmetros em 2-6 lugares diferentes ao longo da fibra (1-2 medidas por imagem, dependendo de seu comprimento), como na Figura Suplementar S1.
- Relate o valor do comprimento (μm ou mm) e a média de todos os diâmetros (μm) medidos por fibra.
- Estudos de expressão da cadeia pesada de miosina
NOTA: Para detalhes sobre a determinação de MHC por imunofluorescência43 e eletroforese em gel de poliacrilamida com dodecil sulfato de sódio (SDS-PAGE)33,44,45,46 em músculos inteiros, consulte Arquivo Suplementar 1. O protocolo para a determinação por imunofluorescência do MHC na suspensão de fibras isoladas de FDB é o seguinte:- Cubra cada uma das cinco lâminas de vidro limpas com 2-3 μL de laminina e deixe secar por 30 s antes de despejar ~300 μL da suspensão de fibra em cada lâmina. Deixe as fibras aderirem à laminina por 4 h à temperatura ambiente.
- Fixar as preparações com acetona refrigerada em congelador por 30 min à temperatura ambiente.
- Lave suavemente 3x com PBS.
- Permeabilizar as membranas celulares com PBS suplementado com Triton X-100 a 0,7% por 15 min à temperatura ambiente.
- Lavar suavemente 3x com PBS suplementado com 0,2% de albumina de soro bovino (BSA) e 0,04% de Triton X-100 e, em seguida, bloquear com PBS com 2% de BSA, 2% de soro de cabra e 0,4% de Triton X-100 por 30 min à temperatura ambiente.
- Lavar suavemente 3x com PBS suplementado com BSA a 0,2% e Triton X-100 a 0,04% e incubar com os anticorpos primários da seguinte forma:
- Diluir cada anticorpo primário anti-MHC em um frasco separado em PBS com BSA a 1% e Triton X-100 a 0,04%: anti-I (1:1.500), anti-II (1:600), anti-IIA (use meios condicionados inteiros do hibridoma) e anti-IIB (1:500).
- Incubar cada lâmina com um anticorpo e a lâmina restante com PBS como controle por 12-16 h a 4 °C.
OBS: Neste protocolo, as fibras do tipo IIX permaneceram não marcadas em todas as amostras.
- Lavar suavemente 3x com PBS e incubar todas as lâminas com o anticorpo secundário (1:800) acoplado a uma molécula verde fluorescente por 1-2 h à temperatura ambiente.
- Núcleos corados com 1 μg/mL Hoechst por 15 min.
- Lave suavemente 3x com PBS, adicione cuidadosamente 20-40 μL de meio de montagem e coloque uma lamínula.
NOTA: Trocas suaves de soluções e lavagem garantem que dezenas de fibras permaneçam presas à lâmina, tornando o experimento estatisticamente correto. - Visualize cada lâmina usando uma objetiva de 10x adequada para fluorescência e um conjunto de filtros com os seguintes comprimentos de onda para excitação/dicroico/emissão: 450-490/510/515 nm e conte todas as fibras positivas e negativas. Alternativamente, adquira imagens de fluorescência usando as mesmas condições técnicas e uma câmera de pelo menos 5 megapixels montada em um microscópio de fluorescência invertida e armazene-as em . Formato TIFF para análises offline.
- Registre as fibras positivas e negativas de cada lâmina em um banco de dados e calcule as porcentagens de fibras I, IIA, IIB e II total positivas com base no número total de fibras presentes na lâmina correspondente. Calcular a porcentagem de fibras IIX subtraindo a soma de IIA+IIB da porcentagem de fibras II totais. Estimar a porcentagem de fibras híbridas I/IIA subtraindo a soma de I+II de um valor de 100%. Finalmente, subtrair a porcentagem de células híbridas do total de I e II para ter as fibras puras do tipo I e II.
NOTA: Em estudos de composição MHC, os tipos de fibras são designados por uma letra maiúscula, enquanto as isoformas são designadas por uma letra minúscula46.
- Coloração para hematoxilina e eosina
- Cubra uma lâmina de vidro limpa com 2-3 μL de laminina e deixe secar por 30 s antes de despejar ~300 μL da suspensão de fibra sobre a lâmina. Deixe as fibras aderirem à laminina por 4 h à temperatura ambiente.
- Fixar a preparação com solução de Carnoy (etanol absoluto a 60%, clorofórmio a 30%, ácido acético a 10%) durante 5 minutos à temperatura ambiente.
- Incubar com hematoxilina por 90 s.
- Lave suavemente 3x com água da torneira.
- Incubar com 1% de eosina Y preparada em etanol 70% por 30 s.
- Lave suavemente 3x com água da torneira.
- Mergulhe 3x em etanol absoluto.
- Incubar em xilol por 60 s.
- Adicione 20-40 μL de meio de montagem e visualize com um microscópio convencional. Adquira imagens na ampliação desejada usando uma câmera colorida de pelo menos 5 megapixels.
5. Análise estatística e gráficos
NOTA: A unidade experimental é uma fibra muscular.
- Expresse os resultados como média ± desvio padrão e calcule intervalos de confiança de 95% (IC95%) para algumas análises.
- Para comparar comprimento, diâmetro e cinética de transientes de Ca2+ entre os grupos, realizar análise de variância (ANOVA) e testes post-hoc com correção de Bonferroni.
- Avaliar a normalidade e a igualdade de variância por meio dos testes de Shapiro-Wilk e Levene, respectivamente.
- Considere-se as diferenças significativas quando p < 0,05.
Access restricted. Please log in or start a trial to view this content.
Resultados
Concentração de Ca2+ sarcoplasmático durante uma contração
Para demonstrar a viabilidade de experimentos fisiológicos no conjunto de fibras dissociadas e estender nossos achados anteriores sobre acoplamento excitação-contração (CCE) e tipos de fibras, transientes de Ca2+ foram adquiridos em fibras de todos os músculos. Primeiro, FDB (n = 5) e EDL (n = 7) apresentaram cinética de Ca2+ conhecida como morfologia tipo II (MT-II). Estes são sinais rápidos, esp...
Access restricted. Please log in or start a trial to view this content.
Discussão
Para complementar os modelos disponíveis para o estudo da biologia muscular esquelética madura, demonstramos aqui a dissociação enzimática bem-sucedida de uma variedade de músculos de camundongos com fibras curtas, intermediárias e longas. Essas fibras permitem demonstrar a generalização da cinética MT-II dos transientes de Ca2+ no músculo esquelético. Além disso, os tipos de fibras nos músculos inteiros intactos foram classificados. Tendo em vista que o FDB é o músculo mais utilizado para expe...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Os autores expressam sua gratidão ao professor Robinson Ramírez, da UdeA, pela ajuda com os animais e algumas fotos e a Carolina Palacios pelo apoio técnico. Johan Pineda da Kaika nos ajudou a configurar as câmeras coloridas e de fluorescência. Shyuan Ngo, da Universidade de Queensland, gentilmente revisou o manuscrito. Este estudo foi financiado pelo CODI-UdeA (2020-34909 de 22 de fevereiro de 2021 e 2021-40170 de 31 de março de 2022, SIU), e pelo Escritório de Planejamento-UdeA (E01708-K e ES03180101), Medellín, Colômbia, ao JCC. Os financiadores não participaram da coleta e análise dos dados, redação ou submissão do manuscrito.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Absolute ethanol | Sigma Aldrich | 32221 | |
| Acetone | Merck | 179124 | |
| Acrylamide | Gibco BRL | 15512-015 | |
| Ammonium persulfate | Panreac | 141138.1610 | |
| Anti myosin I antibody | Sigma Aldrich | M4276 | Primary antibody |
| Anti myosin II antibody | Sigma Aldrich | M8421 | Primary antibody |
| Anti myosin IIA antibody | American Type Culture Collection | SC-71 | Primary antibody. Derived from HB-277 hybridoma |
| Anti myosin IIB antibody | Developmental Studies Hybridoma Bank | BF-F3-c | Primary antibody |
| Bis-acrylamide | AMRESCO | 0172 | |
| Bovine serum albumin | Thermo Scientific | B14 | |
| Bradford reagent | Merck | 1.10306.0500 | |
| Bromophenol blue | Carlo Erba | 428658 | |
| Calcium carbonate | Merck | 102066 | |
| Calcium dichloride (CaCl2) | Merck | 2389 | |
| Chloroform | Sigma Aldrich | 319988 | |
| Collagenase type 2 | Worthington | CLS-2/LS004176 | |
| Consul-Mount | Thermo Scientific | 9990440 | |
| Coomassie Brilliant blue R 250 | Merck | 112553 | |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Dithiothreitol (DTT) | AMRESCO | 0281 | |
| Edetic acid (EDTA | AMRESCO | 0322 | |
| Eosin Y | Sigma Aldrich | E4009 | |
| Glycerol | Panreac | 1423291211 | |
| Glycine | Panreac | 151340.1067 | |
| Goat serum | Sigma Aldrich | G9023 | |
| Hematoxylin | Thermo Scientific | 6765015 | |
| HEPES | AMRESCO | 0511 | |
| Hoechst 33258 | Sigma Aldrich | 861405 | |
| Imidazole | AMRESCO | M136 | |
| Isopentane | Sigma Aldrich | M32631 | |
| Laminin | Sigma Aldrich | L2020 | |
| Mag-Fluo-4, AM | Invitrogen | M14206 | Prepared only in DMSO. Pluronic acid is not required and should not be used to avoid fiber deterioration. |
| Mercaptoethanol | Applichem | A11080100 | |
| Methanol | Protokimica | MP10043 | |
| Mice | Several | Several | For this manuscript, we only used C57BL/6 mice. However, some preliminary results have shown that the protocol works well for Swiss Webster mice of the same age and weight. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | |
| N,N,N',N'-tetramethylethane-1,2-diamine (TEMED) | Promega | V3161 | |
| N-benzyl-p-toluene sulphonamide (BTS) | Tocris | 1870 | |
| Optimal cutting compound (OCT) | Thermo Scientific | 6769006 | |
| Secondary antibody | Thermo Scientific | A-11001 | Goat anti-mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 |
| Sodium dodecil sulfate | Panreac | 1323631209 | |
| TRIS 0.5 M, pH 6.8 | AMRESCO | J832 | |
| Tris(Hydroxymethyl)aminomethane | AMRESCO | M151 | |
| Triton X-100 | AMRESCO | M143 | |
| Materials | |||
| Dissection chamber | Custom-made | ||
| Charged slides | Erie Scientific | 5951PLUS | |
| Experimental bath chamber | Warner Instruments | RC-27NE2 | Narrow Bath Chamber with Field Stimulation, ensembled on a heated platform PH-6 |
| Fine forceps | World Precision Instruments | 500338, 500230 | |
| Fine scissors | World Precision Instruments | Vannas Scissors 501778 | |
| Glass Pasteur pipettes | Several | Fire-polished tips | |
| Glass vials with cap | Several | 2-3 mL volumen | |
| Operating scissors | World Precision Instruments | 501223-G | |
| Equipment | |||
| Centrifuge | Thermo Scientific | SL 8R | |
| Confocal microscope | Olympus | FV1000 | |
| Cryostat | Leica | CM1850 | |
| Digital camera | Zeiss | Erc 5s and Axio 305 | Axio 305, coupled to the Stemi 508 stereoscope, was used to take pictures during dissection; while Erc 5s or Axio 208, coupled to the Axio Observer A1 microscope, were used to take images of the isolated fibers and the immunofluorescence assays |
| Digitizer | Molecular Devices | 1550A Digidata | |
| Electrophoresis chamber | Bio Rad | Mini-Protean IV | |
| Inverted microscope coupled to fluorescence | Zeiss | Axio Observer A1 | Coupled to an appropriate light source, filters and objectives for fluorescence |
| Photomultiplier | Horiba | R928 tube, Hamamatsu, in a D104 photometer, Horiba | Coupled to the lateral port of the fluorescence microscope |
| Stereoscope | Zeiss | Stemi 508 | |
| Stimulator | Grass Instruments | S6 | |
| Water bath | Memmert | WNE-22 | |
| Xilol | Sigma Aldrich | 808691 | |
| Software | |||
| Free software for electrophoreses analyses | University of Kentucky | GelBandFitter v1.7 | http://www.gelbandfitter.org |
| Free software for image analysis and morphometry | National Institutes of Health | ImageJ v1.54 | https://imagej.nih.gov/ij/index.html |
| Licensed software for Ca2+ signals acquisition and analyses | Molecular Devices | pCLAMP v10.05 | https://www.moleculardevices.com |
| Licensed software for statistical analyses and graphing | OriginLab | OriginPro 2019 | https://www.originlab.com/ |
Referências
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int. 96 (3), 183-195 (2015).
- Barclay, C., Launikonis, B. Components of activation heat in skeletal muscle. J Muscle Res Cell Motil. 42 (1), 1-16 (2021).
- Gallo-Villegas, J. A., Calderón, J. C. Epidemiological, mechanistic, and practical bases for assessment of cardiorespiratory fitness and muscle status in adults in healthcare settings. Eur J Appl Physiol. 123 (5), 945-964 (2023).
- Cardamone, M., Darras, B. T., Ryan, M. M. Inherited myopathies and muscular dystrophies. Semin Neurol. 28 (2), 250-259 (2008).
- Sánchez-Aguilera, P., et al. Role of ABCA1 on membrane cholesterol content, insulin-dependent Akt phosphorylation and glucose uptake in adult skeletal muscle fibers from mice. Biochim Biophys Acta. 1863 (12), 1469-1477 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 48 (1), 16-31 (2019).
- Narvaez-Sanchez, R., Calderón, J. C., Vega, G., Trillos, M. C., Ospina, S. Skeletal muscle as a protagonist in the pregnancy metabolic syndrome. Med Hypotheses. 126, 26-37 (2019).
- Gallo-Villegas, J., et al. Efficacy of high-intensity interval- or continuous aerobic-training on insulin resistance and muscle function in adults with metabolic syndrome: a clinical trial. Eur J Appl Physiol. 122 (2), 331-344 (2022).
- Close, R. Properties of motor units in fast and slow skeletal muscles of the rat. J Physiol. 193 (1), 45-55 (1967).
- Barnard, R. J., Edgerton, V. R., Furukawa, T., Peter, J. B. Histochemical, biochemical, and contractile properties of red, white, and intermediate fibers. Am J Physiol. 220, 410-414 (1971).
- Bär, A., Pette, D. Three fast myosin heavy chains in adult rat skeletal muscle. FEBS letters. 235 (1-2), 153-155 (1988).
- Schiaffino, S., et al. Myosin heavy chain isoforms and velocity of shortening of type 2 skeletal muscle fibres. Acta Physiol Scand. 134 (4), 575-576 (1988).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. J Muscle Res Cell Motil. 10 (3), 197-205 (1989).
- Ranatunga, K., Thomas, P. Correlation between shortening velocity, force-velocity relation and histochemical fibre-type composition in rat muscles. J Muscle Res Cell Motil. 11 (3), 240-250 (1990).
- Hämäläinen, N., Pette, D. The histochemical profiles of fast fiber types IIB, IID, and IIA in skeletal muscles of mouse, rat, and rabbit. J Histochem Cytochem. 41 (5), 733-743 (1993).
- Agbulut, O., Li, Z., Mouly, V., Butler-Browne, G. S. Analysis of skeletal and cardiac muscle from desmin knock-out and normal mice by high resolution separation of myosin heavy-chain isoforms. Biol Cell. 88 (3), 131-135 (1996).
- Bekoff, A., Betz, W. Properties of isolated adult rat muscle fibres maintained in tissue culture. J Physiol. 271 (2), 537-547 (1977).
- Bekoff, A., Betz, W. Physiological properties of dissociated muscle fibres obtained from innervated and denervated adult rat muscle. J Physiol. 271 (1), 25-40 (1977).
- Schuetze, S. M. The acetylcholine channel open time in chick muscle is not decreased following innervation. J Physiol. 303, 111-124 (1980).
- Youhanna, S., Bruton, J., Jardemark, K., Westerblad, H., Lauschke, V. M. Calcium measurements in enzymatically dissociated or mechanically microdissected mouse primary skeletal muscle fibers. STAR Protoc. 4 (2), 102260(2023).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem Cell Biol. 83 (5), 674-676 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single muscle-fiber isolation and culture for cellular, molecular, pharmacological, and evolutionary studies. Methods Mol Biol. 798, 85-102 (2012).
- Bolaños, P., Guillen, A., Gámez, A., Caputo, C. Quantifying SOCE fluorescence measurements in mammalian muscle fibres. The effects of ryanodine and osmotic shocks. J Muscle Res Cell Motil. 34 (5-6), 379-393 (2013).
- Lopez, R., et al. Raptor ablation in skeletal muscle decreases Cav1.1 expression and affects the function of the excitation-contraction coupling supramolecular complex. Biochem J. 466 (1), 123-135 (2015).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skelet Muscle. 8 (1), 14(2018).
- Milán, A. F., et al. Calibration of mammalian skeletal muscle Ca2+ transients recorded with the fast Ca2+ dye Mag-Fluo-4. Biochim Biophys Acta. 1865 (9), 129939(2021).
- Park, K. H., et al. Assessment of calcium sparks in intact skeletal muscle fibers. J Vis Exp. (84), e50898(2014).
- Wei-LaPierre, L., Groom, L., Dirksen, R. T. Acute exposure to extracellular BTP2 does not inhibit Ca2+ release during EC coupling in intact skeletal muscle fibers. J Gen Physiol. 154 (9), 202112976(2022).
- Banks, Q., et al. Voltage sensor movements of Ca(V)1.1 during an action potential in skeletal muscle fibers. Proc Natl Acad Sci U S A. 118 (40), 2026116118(2021).
- Jaque-Fernandez, F., et al. Preserved Ca2+ handling and excitation-contraction coupling in muscle fibres from diet-induced obese mice. Diabetologia. 63 (11), 2471-2481 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--a more mature muscle culture system. Cell Motil Cytoskeleton. 64 (10), 727-738 (2007).
- Leduc-Gaudet, J. -P., et al. MYTHO is a novel regulator of skeletal muscle autophagy and integrity. Nat Commun. 14 (1), 1199(2023).
- Calderón, J. C., Bolaños, P., Caputo, C. Myosin heavy chain isoform composition and Ca2+ transients in fibres from enzymatically dissociated murine soleus and extensor digitorum longus muscles. J Physiol. 588 (1), 267-279 (2010).
- Calderón, J. C., Bolaños, P., Caputo, C. Kinetic changes in tetanic Ca2+ transients in enzymatically dissociated muscle fibres under repetitive stimulation. J Physiol. 589 (21), 5269-5283 (2011).
- Calderón, J. C., Bolaños, P., Caputo, C. Tetanic Ca2+ transient differences between slow- and fast-twitch mouse skeletal muscle fibres: a comprehensive experimental approach. J Muscle Res Cell Motil. 35 (5-6), 279-293 (2014).
- Li, R., et al. Development of a high-throughput method for real-time assessment of cellular metabolism in intact long skeletal muscle fibre bundles. J Physiol. 594 (24), 7197-7213 (2016).
- Chemello, F., et al. Microgenomic analysis in skeletal muscle: expression signatures of individual fast and slow myofibers. PloS One. 6 (2), 16807(2011).
- Williams, D. A., Head, S. I., Bakker, A. J., Stephenson, D. G. Resting calcium concentrations in isolated skeletal muscle fibres of dystrophic mice. J Physiol. 428 (1), 243-256 (1990).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. J Vis Exp. (73), e50074(2013).
- Brun, C. E., et al. GLI3 regulates muscle stem cell entry into G(Alert) and self-renewal. Nat Commun. 13 (1), 3961(2022).
- Percie du Sert, N., et al. The ARRIVE guidelines 2.0: updated guidelines for reporting animal research. J Physiol. 598 (18), 3793-3801 (2020).
- Charles, J. P., Cappellari, O., Spence, A. J., Hutchinson, J. R., Wells, D. J. Musculoskeletal geometry, muscle architecture and functional specialisations of the mouse hindlimb. PLoS One. 11 (4), 0147669(2016).
- Enríquez, V., Granados, S., Arias, M. P., Calderón, J. C. Muscle fiber types of gluteus medius in the Colombian creole horse. J Equine Vet Sci. 35 (6), 524-530 (2015).
- Sartorius, C. A., et al. Myosin heavy chains IIa and IId are functionally distinct in the mouse. J Cell Biol. 141 (4), 943-953 (1998).
- Talmadge, R. J., Roy, R. R. Electrophoretic separation of rat skeletal muscle myosin heavy-chain isoforms. J Appl Physiol. 75 (5), 2337-2340 (1993).
- Hämäläinen, N., Pette, D. Patterns of myosin isoforms in mammalian skeletal muscle fibres. Microsc Res Tech. 30 (5), 381-389 (1995).
- Bolaños, P., Calderón, J. C. Excitation-contraction coupling in mammalian skeletal muscle: Blending old and last-decade research. Front Physiol. 13, 989796(2022).
- Gineste, C., et al. Enzymatically dissociated muscle fibers display rapid dedifferentiation and impaired mitochondrial calcium control. iScience. 25 (12), 105654(2022).
- Calderón, J. C., Bolaños, P., Caputo, C. The excitation-contraction coupling mechanism in skeletal muscle. Biophys Rev. 6 (1), 133-160 (2014).
- Lainé, J., Skoglund, G., Fournier, E., Tabti, N. Development of the excitation-contraction coupling machinery and its relation to myofibrillogenesis in human iPSC-derived skeletal myocytes. Skelet Muscle. 8 (1), (2018).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nat Commun. 9 (1), 126(2018).
- Cea, L. A., et al. The absence of dysferlin induces the expression of functional connexin-based hemichannels in human myotubes. BMC Cell Biology. 17 (15), 127-136 (2016).
- Nakada, T., et al. Physical interaction of junctophilin and the Ca(V)1.1 C terminus is crucial for skeletal muscle contraction. Proc Natl Acad Sci U S A. 115 (17), 4507-4512 (2018).
- Cully, T. R., Edwards, J. N., Murphy, R. M., Launikonis, B. S. A quantitative description of tubular system Ca2+ handling in fast- and slow-twitch muscle fibres. J Physiol. 594 (11), 2795-2810 (2016).
- Lim, J. -Y., Frontera, W. R. Single skeletal muscle fiber mechanical properties: a muscle quality biomarker of human aging. Eur J Appl Physiol. 122 (6), 1383-1395 (2022).
- Gonzalez, E., Messi, M. L., Zheng, Z., Delbono, O. Insulin-like growth factor-1 prevents age-related decrease in specific force and intracellular Ca2+ in single intact muscle fibres from transgenic mice. J Physiol. 552, 833-844 (2003).
- Luedeke, J. D., McCall, R. D., Dillaman, R. M., Kinsey, S. T. Properties of slow- and fast-twitch skeletal muscle from mice with an inherited capacity for hypoxic exercise. Comp Biochem Physiol A Mol Integr Physiol. 138 (3), 373-382 (2004).
- Asmussen, G., Schmalbruch, I., Soukup, T., Pette, D. Contractile properties, fiber types, and myosin isoforms in fast and slow muscles of hyperactive Japanese waltzing mice. Exp Neurol. 184 (2), 758-766 (2003).
- Augusto, V., Padovani, C. R., Campos, G. E. R. Skeletal muscle fiber types in C57BL6J mice. Braz J Morphol Sci. 21 (2), 89-94 (2004).
- Wang, L. C., Kernell, D. Fibre type regionalisation in lower hindlimb muscles of rabbit, rat and mouse: a comparative study. J Anat. 199, 631-643 (2001).
- Abbassi-Daloii, T., et al. Quantitative analysis of myofiber type composition in human and mouse skeletal muscles. STAR Protoc. 4 (1), 102075(2023).
- Tulloch, L. K., Perkins, J. D., Piercy, R. J. Multiple immunofluorescence labelling enables simultaneous identification of all mature fibre types in a single equine skeletal muscle cryosection. Equine Vet J. 43 (4), 500-503 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados